DOI: https://doi.org/10.1007/s42773-024-00308-3
تاريخ النشر: 2024-03-01
إصلاح التربة الملوثة باليورانيوم باستخدام الفحم الحيوي: الأدلة والآليات والآفاق
الملخص
تلوث التربة باليورانيوم يمثل قلقًا بيئيًا عالميًا متزايدًا، مما يؤثر سلبًا على كل من الإنتاج الزراعي وصحة التربة. البيوكربون، وهو مادة كربونية مشتقة من التحلل الحراري للكتلة الحيوية، يظهر إمكانات كبيرة في إصلاح التربة الملوثة باليورانيوم. ومع ذلك، لا يزال هناك غياب ملحوظ لمراجعة شاملة لتأثيرات البيوكربون على مصير وتراكم اليورانيوم في أنظمة التربة والنبات. في هذه الورقة، يتم مراجعة مصادر اليورانيوم والتلوث، ويتم تحليل تأثير البيوكربون على تثبيت اليورانيوم وإزالة سميته في أنظمة التربة والنبات. قمنا بمراجعة حالة تلوث اليورانيوم في التربة على مستوى العالم ووجدنا أن أنشطة التعدين هي المصادر الرئيسية حاليًا. كشفت المزيد من التحليلات التراكمية أن إضافة البيوكربون قللت بشكل كبير من توافر اليورانيوم في التربة وتراكم اليورانيوم في الأجزاء الهوائية، وكانت قيمة تأثيرها هي
النقاط الرئيسية
- يقلل البيوكربون من حركة اليورانيوم من خلال مجموعة متنوعة من الآليات، بما في ذلك التعقيد السطحي، والاختزال، وتبادل الأيونات، والامتزاز الفيزيائي.
- يقلل البيوكربون بشكل كبير من توافر اليورانيوم في التربة ويحد من تراكمه في النباتات.
- لقد أظهر البيوكربون المعدل فعاليته في تثبيت اليورانيوم.
- تطبيق البيوكربون على التربة لا يعزز فقط إصلاح اليورانيوم ولكن أيضًا يحسن جودة التربة.
الملخص الرسومي
1 المقدمة
العمليات الجيولوجية، والأنشطة البشرية، والتجوية الطبيعية، وكلها تؤثر بشكل كبير على أنظمة التربة والنبات على مسافات كبيرة (بيريز-سانشيز وثورن 2014). نظرًا لسميته الكيميائية والإشعاعية، يشكل اليورانيوم مخاطر كبيرة على نمو النبات، وإنتاجية الزراعة، وسلامة الغذاء (سريفاستافا وآخرون 2020). علاوة على ذلك، يؤدي تراكم اليورانيوم بواسطة النباتات إلى نقله على طول سلسلة الغذاء، مما يؤثر في النهاية على صحة الإنسان، مع آثار محتملة على تطور السرطان عند مستويات تتجاوز
تكتسب النباتات اليورانيوم بشكل أساسي من خلال الانتشار السلبي، والنقل الميسر، أو آليات الامتصاص النشطة، والتي تحدث بشكل رئيسي من خلال نظام الجذور (تشين وآخرون 2021؛ لاي وآخرون 2021). بمجرد امتصاصه، يمكن نقل اليورانيوم إلى الأجزاء الهوائية من النبات، مما قد يؤدي إلى السمية وآثار سلبية على النمو والتطور (تسوي وآخرون 2023). يلعب البيوكربون دورًا حاسمًا في منع هجرة اليورانيوم في أنظمة التربة والنبات
الأنظمة، مما يساعد على إزالة سمية اليورانيوم وتقليل سميته للنباتات (Qi et al. 2021; Yin et al. 2022). تحمي إزالة السموم النباتات من الأضرار الناتجة عن اليورانيوم وتخفف من إمكانية انتقال اليورانيوم على طول سلسلة الغذاء. لقد أظهرت الأدلة الحديثة فعالية الفحم الحيوي في منع هجرة اليورانيوم وإزالة سمية أنظمة التربة والنبات (Qi et al. 2021; Liu et al. 2022c). على سبيل المثال، أدى تطبيق الفحم الحيوي على الأراضي الملوثة باليورانيوم إلى زيادة ملحوظة في إنتاج النباتات، مما يبرز قدرة الفحم الحيوي على تخفيف سمية اليورانيوم وتعزيز نمو النباتات (Qi et al. 2022). يوفر تطبيق الفحم الحيوي ميزة إضافية تتمثل في تحسين جودة التربة وخصوبتها من خلال تحسين خصائصها الفيزيائية والكيميائية والبيولوجية، مما يسهل نمو النباتات الصحية (Khan et al. 2022; Mousavi et al. 2023). يتم إنتاج الفحم الحيوي من مصادر الكتلة الحيوية المستدامة، مما يعزز فوائده البيئية. تؤكد هذه القوة المجمعة أن الفحم الحيوي هو حل واعد ومتعدد الاستخدامات لمعالجة التربة الملوثة باليورانيوم.
2 الحالة العالمية لتلوث اليورانيوم
2.1 الحدوث، الأشكال الموجودة، والمصادر
على مستوى العالم بسبب دوره المحوري في إنتاج الطاقة النووية (Cui et al. 2023). يتم توزيعه بشكل طبيعي وواسع في قشرة الأرض، متجاوزًا وفرة الفضة والزئبق والكادميوم (Peng and Cao 2021). تتجاوز احتياطيات اليورانيوم في المحيطات وحدها الكمية الموجودة في قشرة الأرض بأكثر من ألف مرة، حيث تبلغ حوالي 4.5 مليار طن (Endrizzi et al. 2016). يتكون اليورانيوم الطبيعي من ثلاثة نظائر: اليورانيوم-234، اليورانيوم-235، واليورانيوم-238. اليورانيوم-238 هو الأكثر وفرة، حيث يمثل حوالي
اليورانيوم الذي يرتبط بقوة وأقل وصولًا للنباتات أو الكائنات الحية الأخرى (Huang et al. 2022; Wang et al. 2023). تتكون الفئة المتبقية عادةً من مركبات غير قابلة للذوبان، مثل أكاسيد المعادن أو المعادن، حيث تكون أيونات اليورانيوم مرتبطة بقوة وأقل حركة. تبقى الفئة القابلة للاختزال من اليورانيوم، المرتبطة بأكاسيد الحديد والمنغنيز، عادةً مستقرة. ومع ذلك، يمكن أن تصبح متحركة إذا ذابت هذه الأكاسيد في البيئات المختزلة مثل المناطق المغمورة بالمياه أو اللاهوائية (Gao et al. 2021). بالمثل، فإن الفئة القابلة للأكسدة من اليورانيوم، المرتبطة بالمادة العضوية والمعادن الكبريتية، عادةً ما تكون غير متحركة. ومع ذلك، قد تزداد توافرها بسبب تحلل المادة العضوية أو أكسدة المعادن الكبريتية (Peña et al. 2020). الأشكال الموجودة من اليورانيوم في التربة بالقرب من منجم اليورانيوم في جنوب شرق الصين هي في الغالب في الفئة المتبقية، بينما تهيمن الترب في أوك ريدج على الفئات المرتبطة بالكربونات، وتكون الترب المحيطة بمناجم اليورانيوم المهجورة في البرازيل في الغالب في الفئة المؤكسدة (Zhou and Gu 2005; Ouyang et al. 2019; Galhardi et al. 2020). تؤدي التفاعلات المعقدة بين اليورانيوم والمصفوفة المحيطة إلى التحول المتبادل بين فئات اليورانيوم المختلفة من خلال تفاعلات متنوعة، بما في ذلك الامتزاز، وإزالة الامتزاز، والترسيب، وتفاعل الأكسدة والاختزال وتشكيل المعقدات (Florez-Vargas et al. 2023).
2.2 درجة التلوث وظاهرة التلوث المركب
علاوة على ذلك، يجب أخذ ظاهرة التلوث المركب في الاعتبار. غالبًا ما يتواجد اليورانيوم مع معادن ثقيلة أخرى. على سبيل المثال، أفاد سكيبرود وآخرون (2013) بوجود كميات كبيرة من المخلفات التي تحتوي على
أفاد أن المحتويات المتوسطة لـ
3 آثار تطبيق الفحم الحيوي على تثبيت اليورانيوم في التربة
| المصادر | الموقع | محتوى اليورانيوم
|
المراجع |
| المصادر الطبيعية | تشيلي | 0.79 | (كابral بينتو وآخرون 2014) |
| المصادر الطبيعية | ألمانيا | 1.9 | (أوتيرمان وفوخس 2008) |
| المصادر الطبيعية | سويسرا | ٢.٢٥ | (بيغالكي وآخرون 2017) |
| المصادر الطبيعية | إنجلترا | 2.6 | (فوديانيتسكي 2011) |
| المصادر الطبيعية | اليابان | 1.74 | (ساهو وآخرون 2011) |
| المصادر الطبيعية | الولايات المتحدة الأمريكية | 3.5 | (بيرن وآخرون 2019) |
| المصادر الطبيعية | بولندا | 0.79 | (فوديانيتسكي 2011) |
| المصادر الطبيعية | أوروبا | ٢.٤٦ | (بلانت وآخرون 2003) |
| المصادر الطبيعية | كندا | 1.2 | (فوديانيتسكي 2011) |
| المصادر الطبيعية | الصين | 3.13 | (Xu وآخرون 1993) |
| أنشطة التعدين | البرتغال | 92.1 | (نيفا وآخرون 2019) |
| أنشطة التعدين | رومانيا | 64.5 | (Pehoiu وآخرون 2019) |
| أنشطة التعدين | ألمانيا | ٢٩.٩ | (جرامس وفويت 2016) |
| أنشطة التعدين | بلغاريا | ٢٧.٢ | (بوتيفا وآخرون 2016) |
| أنشطة التعدين | أستراليا | ٥٩.٠ | (كوستيلو 2005) |
| أنشطة التعدين | الصين | ٣٤.٧ | (وانغ وآخرون 2019أ) |
| استخدام الأسمدة | فرع فوجيساكا (اليابان) | 2.0 | (تاكيدا وآخرون 2006) |
| استخدام الأسمدة | واتاواتا (نيوزيلندا) | 2.80 | (شيبير وآخرون 2011) |
| استخدام الأسمدة | قلعة جونستاون (أيرلندا) | 1.81 | (تونى وآخرون 2009) |
| تسرب نووي | هانفورد (الولايات المتحدة الأمريكية) | ٢٠٦ | (أوم وآخرون 2010) |
| التكنولوجيا النووية | أيجكا | 9.32 | (باب et al. 2002) |
| التكنولوجيا النووية | تايوان (الصين) | 2.81 | (تساي وآخرون 2008) |
| التكنولوجيا النووية | الأردن | 253 | (السبيغ وأبو قديحة 2017) |
أجزاء من النباتات. على سبيل المثال، أظهرت دراسة حديثة أن تطبيق
إزالة اليورانيوم. أظهر الفحم الحيوي المعدل قدرة أكبر على تقليل اليورانيوم القابل للتبادل في التربة.
توزيع الشحنات، مما يعزز قدرته على التفاعل مع اليورانيوم. علاوة على ذلك، قد تشمل الطرق البيولوجية استخدام الكائنات الدقيقة لتعديل خصائص سطح البيوكربون، مما يزيد من وظيفته وخصوصيته تجاه اليورانيوم (Qi et al. 2022). هذه التعديلات توسع من قدرة الامتصاص للبيوكربون، وقدرته على تبادل الأيونات، وتفاعله مع اليورانيوم، مما يساهم في التحسين الملحوظ في التنظيف (Yin et al. 2022). تم اكتشاف أن إضافة البيوكربون المعدل بالفوسفور (PBC) المرتبط بمركب هيدروكسيد الألمنيوم والمغنيسيوم المزدوج (LDH) (“PBC@LDH”) أدت إلى تقليل كفاءة تسرب اليورانيوم بنسبة 54% (Lyu et al. 2021a). أظهر مركب PBC@LDH ألفة قوية لليورانيوم، مما يقلل بشكل فعال من تسرب اليورانيوم ويحافظ على جودة المياه الجوفية. تُظهر صور المجهر الإلكتروني الماسح قبل وبعد تعديل البيوكربون في الشكل 3. لقد لاحظنا أن معظم الثغور على سطح البيوكربون غير المعدل (الشكل 3a) كانت مسدودة بسبب هيكله المتقشر.

بالإضافة إلى قدراتها المباشرة في تثبيت اليورانيوم، أظهرت البيوكاربون أنها تعزز صحة التربة وخصوبتها من خلال تحسين درجة حموضة التربة، ومحتوى المادة العضوية، وسعة تبادل الكاتيونات (سينغ وآخرون 2022؛ لي وآخرون 2023ب؛ يانغ وآخرون 2023ج). علاوة على ذلك، تؤثر البيوكاربون بشكل إيجابي على المجتمعات الميكروبية في التربة، مما يخلق ظروفًا ملائمة لنمو الكائنات الدقيقة المفيدة (يانغ وآخرون 2023ب). وهذا بدوره يعزز دورة المغذيات في التربة ويلعب دورًا حاسمًا في تثبيت اليورانيوم (داي وآخرون 2021ب). تحسن البيوكاربون درجة حموضة التربة بسبب طبيعتها القلوية، مما يقلل من توفر اليورانيوم في التربة (يانغ وآخرون 2023أ). تمتلك المادة العضوية في التربة قدرة عالية على امتصاص اليورانيوم بفضل وجود المجموعات الوظيفية. لذلك، فإن زيادة محتوى المادة العضوية في التربة مفيدة لتثبيت اليورانيوم. في دراسة حديثة، تم اكتشاف أن تطبيق البيوكاربون المحمّل بالبكتيريا المختلطة على التربة غيّر الميكروبيئة من خلال زيادة المادة العضوية في التربة، وسعة تبادل الكاتيونات، ونشاط تحلل الفلورسئين داي أستات، ونشاط الديهيدروجيناز (تشي وآخرون 2022). وقد أدى البيوكاربون المحمّل بالبكتيريا المختلطة إلى تقليل كبير في توفر اليورانيوم والكدميوم في التربة من خلال
قش الذرة، بقايا الأعشاب، روث الأبقار، حبوب التقطير، وبقايا قصب السكر – على توفر اليورانيوم في التربة. وقد وُجد أن الفحم الحيوي المستخرج من قش الذرة قلل بشكل كبير من توفر اليورانيوم، مع
4 الآليات الداخلية لتثبيت اليورانيوم بواسطة الفحم الحيوي
4.1 التكوين السطحي
تتميز التعقيدات الخارجية بتفاعلات كهربائية بين المادة الممتصة وسطح المعدن (Yi et al. 2023). تتضمن هذه الآلية الامتصاصية، المعروفة أيضًا باسم الامتصاص الفيزيائي، تشكيل أغشية ترطيب من جزيئات الماء التي تشكل حاجزًا بين المادة الممتصة والمادة الماصة. عادةً ما تكون التعقيدات الخارجية ضعيفة وقابلة للعكس. لذلك، تشير التعقيدات السطحية عادةً إلى التعقيدات الداخلية (Alam et al.
| ماص | المادة الخام | درجة حرارة التحلل الحراري
|
|
إيزوثيرم الامتزاز | آلية | المراجع |
| الكتلة الحيوية | قش الأرز | ٧٠٠ | 7.14 | لانغمور، فريندليش، تيمكين، ودي-آر | تعقيد السطح الداخلي | (دونغ وآخرون 2017) |
| قشرة براعم الخيزران | ٥٠٠ | ٣٤.٩ | لانغموير | التعقيد السطحي والكاتيون-
|
(هو وآخرون 2018أ) | |
| فروع السلفادورا بيرسيكا | ٤٠٠ | 85.7 | لانجموير وتمكين | الامتصاص الكيميائي | (البياياري وآخرون 2021) | |
| خشب الأوكالبتوس | ٤٠٠ | ٢٧.٢ | لانغموير | التعقيد السطحي | (ميشرا وآخرون 2017) | |
| باك تشوي الغني بالسليلوز | ٣٠٠ | ٤٦.٦ | – | التعقيد السطحي | (فينغ وآخرون 2022) | |
| كوب الذرة الغني باللجنين | ٣٥.٦ | |||||
| حمأة متبقية | ٢٥٠ | ٥٥.٣ | لانغموير | الجذب الكهروستاتيكي والتعقيد | (زوه وآخرون 2023) | |
| قش القمح | ٤٠٠ | ٣٩٩ | لانغموير، فريندليش | الجذب الكهروستاتيكي والتعقيد السطحي داخل الكرة | (تشاو وآخرون 2021) | |
| سماد الخنازير | ٥٠٠ | ٣٧٦ | لانغموير | الجذب الكهروستاتيكي والتعقيد | (لياو وآخرون 2022ج) | |
| نبات البردي | ٤٠٠ | 157 | لانغموير | التعقيد السطحي | (Xu وآخرون 2020) | |
| الكتلة الحيوية المعدلة بحمض الفيتيك | الألوة فيرا | ٥٠٠ | 272 | لانغموير فريندليش | التعقيد السطحي | (وانغ وآخرون 2022) |
| الكتلة الحيوية المعدلة بحمض الستريك | قش القصب | ٢٠٠ | ٣٧.١ | لانغموير | التعقيد السطحي | (ليو وآخرون 2022ب) |
| لوف رتان | ٢٠٠ | 434 | لانغموير | التفاعل الكهروستاتيكي، التعقيد والامتصاص الفيزيائي | (ي وآخرون 2020) | |
| الكتلة الحيوية | سماد الخنازير | ٥٠٠ | 369 | لانغموير | (لياو وآخرون 2022أ) | |
| الكتلة الحيوية المعدلة بحمض الهيدروكلوريك | 53.3 | التفاعل الكهروستاتيكي، التعقيد السطحي | ||||
| الكتلة الحيوية المعدلة بـ NaOH | 952 | |||||
|
|
لوفيا أسطوانية | ٦٥٠ | 92.0 | لانغموير | تعقيد السطح الداخلي | (ليتسوا وآخرون 2017) |
| الكتلة الحيوية | قش القمح | ٤٥٠ | 8.71 | لانغموير | (جين وآخرون 2018) | |
|
|
٣٥٥ | التفاعل الكهروستاتيكي، التعقيد | ||||
| الكتلة الحيوية | سماد البقر | 64.0 | ||||
|
|
73.3 | |||||
| الكتلة الحيوية المعدلة بحمض الأسيتيك | حمأة | 300-700 | 178 | لانغموير | تعقيد | (يو وآخرون 2022) |
| الكتلة الحيوية المعدلة بحمض الفيتيك | القصب الضيق الأوراق | ٥٠٠ | 128.5 | لانغموير | التفاعل الكهروستاتيكي، التعقيد | (تشو وآخرون 2020) |
| الكتلة الحيوية المعدلة بالفوسفات | بامبو | 170 | 781 | لانغموير | التفاعل الكهروستاتيكي، التعقيد | (تشن وآخرون 2023ب) |
| الفحم الحيوي المفعّل بالفوسفات | غبار الخيزران | ٤٥٠ | 229 | لانغموير | التفاعل الكهروستاتيكي، التعقيد | (هو وآخرون 2020) |
|
|
حمأة الصرف الصحي | ٦٠٠ | 149.1 | لانغموير | التعقيد، تبادل الأيونات، الاختزال والجذب الكهروستاتيكي | (مو وآخرون 2021) |
|
|
بذور “سيترولوس لاناتوس” | ٣٥٠ | ٢٧.٦ | لانغموير | التعقيد السطحي | (أحمد وآخرون 2021أ) |
| ماص | المادة الخام | درجة حرارة التحلل الحراري
|
|
إيزوثيرم الامتزاز | آلية | المراجع |
| البيوكربون المغناطيسي | تريبولوس تيرستريس | ٥٠٠ | 17.2 | ودود | التعقيد السطحي | (أحمد وآخرون 2021ب) |
| قش الأرز | ٥٥٠ | 52.6 | لانغموير | التعقيد السطحي، الاختزال | (لي وآخرون 2019أ) | |
| كتلة حيوية للنباتات المائية الطبيعية | ٧٠٠ | 54.3 | لانغموير | التنسيق الداخلي والتقليل | (هو وآخرون 2018ب) | |
| سماد البقر | ٥٠٠ | 662 | لانغموير | التعقيد السطحي، الاختزال والجذب الكهروستاتيكي | (لياو وآخرون 2022e) | |
| قشور البطيخ | ٥٠٠ | ٣٢٣ | لانغموير | التعقيد، تبادل الأيونات، والجذب الكهروستاتيكي | (لينغمدين و آخرون 2022) | |
| ميكروسيستيس أيروجينوزا | ٢٠٠ | ٥٢.١ | ودود | تعقيد | (وانغ وآخرون 2020) | |
| البيوكربون المؤكسد | قش الأرز | ٥٠٠ | 242 | لانغموير | تعقيد السطح الداخلي | (أحمد وآخرون 2021ج) |
| ألياف شجرة النخيل | ٦٥٠ | ١١٢ | لانغموير | تعقيد السطح الداخلي | (ستاسي وآخرون 2022) | |
| الكربون الحيوي الناتج عن الأكسدة الحرارية للهواء | كوز الذرة | ٥٠٠ | 96.7 | لانغموير | الامتصاص الفيزيائي، التعقيد السطحي، الجذب الكهروستاتيكي والترسيب | (داي وآخرون 2020) |
| حمأة | ٦٠٠ | ٤٩٠ | لانغموير | تقليل التعقيد | (سون وآخرون 2022) | |
| مركب ثنائي الكبريتيد/الفحم الحيوي | قش القمح | ٦٠٠ | ٤٥١ | لانغموير | الامتصاص الكيميائي، الجذب الكهروستاتيكي، التعقيد السطحي | (تشو وآخرون 2023ب) |
| الحديد الصفري النانوي المدعوم بالفحم الحيوي | نشا | ٩٠٠ | ٥٥.١ | لانغموير | تعقيد | (Zhang وآخرون 2019a) |
| الحديد الصفري النانوي المكلس المدعوم بالفحم الحيوي | ديكتيوفورا إندوسياتا | 180 | ٣٠٠ | لانغموير | التعقيد والتقليل | (بانغ وآخرون 2022) |
| مركب MgO/الفحم الحيوي | نشارة خشب الصنوبر | ٥٠٠ | 514 | لانغموير | التعقيد السطحي | (تشن وآخرون 2022ب) |
| قشر البرتقال | ٢٥٠ | 246 | سيبس وريدليش بيترسون | تعقيد السطح الداخلي | (ينغ وآخرون 2020) | |
| مركبات الكربون الحيوي من كبريتيد الحديد على النانو | قشرة الفول السوداني | ٢٥٠ | 76.3 | ودود | الجذب الكهروستاتيكي، التكوين السطحي، الترسيب، والتفاعل الاختزالي | (ليو وآخرون 2021ب) |
| مركب الفحم الحيوي Fe-Mn | نفايات الشاي | ٦٠٠ | 492 | لانغموير وريد ليش بيترسون | التعقيد السطحي
|
(ليو وآخرون 2021أ) |
| مركب البيوچار-سيليكات المغنيسيوم | نفايات البرتقال | ٦٥٠ | ٣٥٢ | لانغموير | التعقيد السطحي | (ناراسيمهاراو وآخرون 2023) |
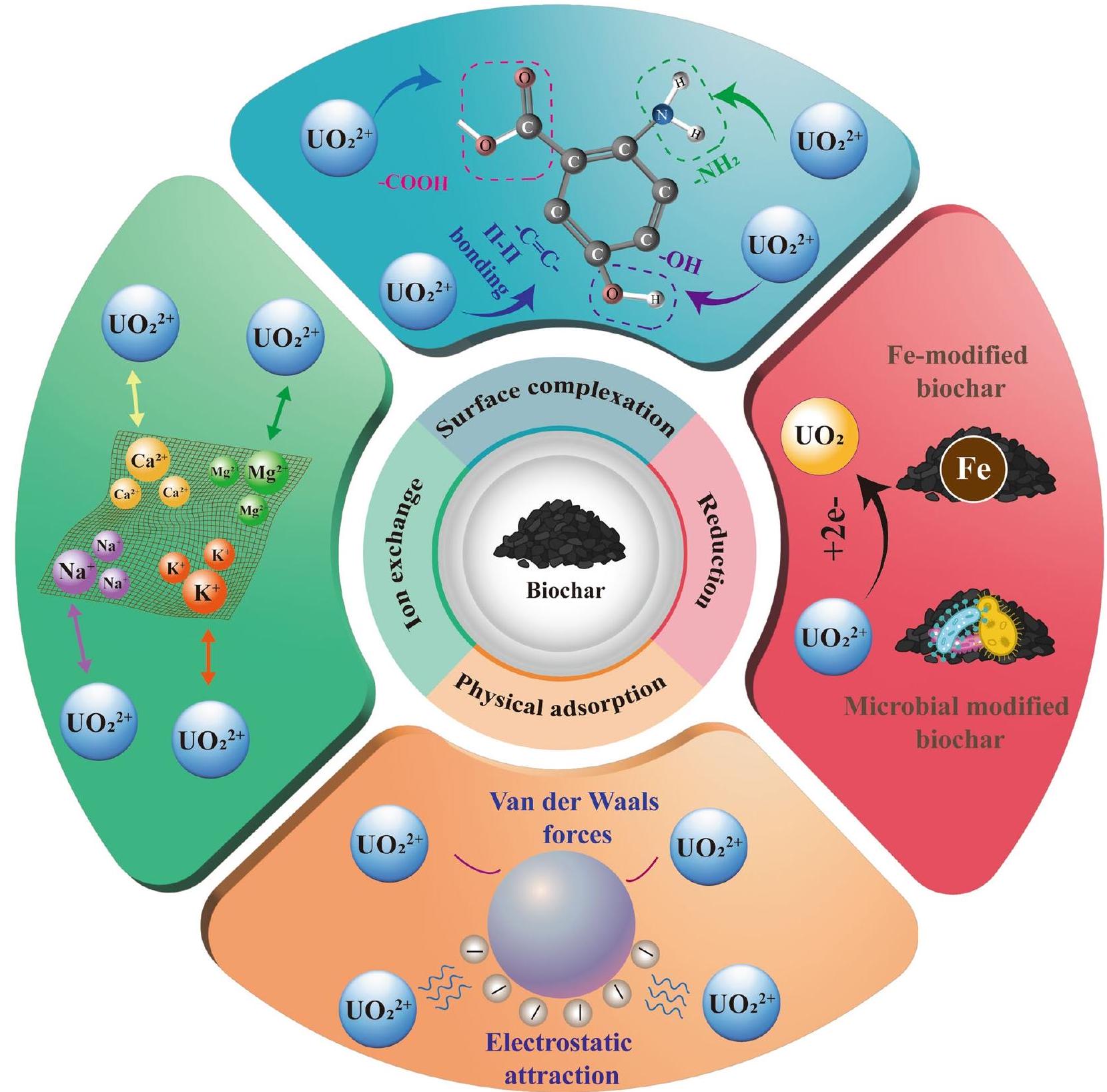
تشكيل معقدات قوية ومستقرة مع أيونات اليورانيوم (Dai et al. 2021a; Wu et al. 2022a; Gan et al. 2023; Li et al. 2023a). أظهر أحمد وآخرون (2021a) أهمية مجموعات -COOH و -OH في امتصاص أيونات اليورانيوم على سطح الفحم الحيوي، مما يشير إلى أن وجود هذه المجموعات يؤثر بشكل كبير على سعة الامتصاص. وبالمثل، أكد فو وآخرون (2022) الدور المهم لمجموعات -COOH و -OH في تشكيل روابط سطحية معقدة، مما يقلل بشكل فعال من حركة وتوافر اليورانيوم في التربة. بالإضافة إلى ذلك، على الرغم من أن الأدبيات محدودة، إلا أن بعض التقارير أشارت إلى مشاركة المجموعات العطرية في عملية التعقيد من خلال تشكيل
تعقيدات عند واجهة البيوكاربون واليورانيوم (ليو وآخرون 2023ب). أظهرت دراسة شاملة باستخدام هذه الطرق أن اليورانيوم يلتصق بشكل رئيسي بسطح البيوكاربون عبر مجموعات الكربوكسيل والهيدروكسيل الفينولي التي كانت تفاعلية مع البروتونات، مما يشير إلى وجود كل من التعقيد الداخلي والخارجي (علام وآخرون 2018). توفر هذه المنهجيات أدلة مهمة تبرز الدور الحاسم لمجموعات السطح الوظيفية في تثبيت اليورانيوم (هو وآخرون 2018ب).
4.2 تفاعلات الاختزال
يمكن أن يعزز تطبيق البيوكربون من قدرة التخفيض الميكروبي (راشيميشا وآخرون 2022؛ وو وآخرون 2022ب؛ دونغ وآخرون 2023). يتأثر التفاعل بين الميكروبات والبيوكربون لتقليل اليورانيوم بعدة عوامل: (i) البيوكربون كملجأ ميكروبي: يلعب البيوكربون دورًا حاسمًا في التربة المعقدة، حيث يعمل كملجأ للميكروبات، مما يساهم بشكل كبير في تقليل اليورانيوم (تشنغ وآخرون 2022). تسهل البنية المسامية للبيوكربون استعمار ونمو الميكروبات من خلال توفير مساحة سطحية واسعة وشبكة مسام مترابطة، مما يخلق بيئة مثالية لسكن الميكروبات (لي وآخرون 2022). أظهر فرانكل وآخرون (2016) أن تطبيق البيوكربون زاد بشكل كبير من الكتلة الحيوية والنشاط الميكروبي، مما يوفر دليلًا على دور البيوكربون كملجأ ميكروبي. لا يوفر هذا الملجأ موطنًا مناسبًا للميكروبات فحسب، بل يحفز أيضًا أنشطتها العلاجية، مما يؤدي في النهاية إلى تقليل وتثبيت اليورانيوم (أرشاد وآخرون 2017)؛ (ii) تحسين التربة بواسطة البيوكربون: يعزز تطبيق البيوكربون الخصائص الطبيعية للتربة، مما يبني بيئة ملائمة للنشاط الميكروبي (وي وآخرون 2023). تم تحقيق ذلك من خلال إثراء التربة بالعناصر الغذائية الأساسية، مثل البوتاسيوم والفوسفور، مما يحفز نمو الميكروبات (ليمويكران وآخرون 2018). علاوة على ذلك، حسّن البيوكربون من قدرة تبادل الكاتيونات في التربة واحتباس الماء، مما خلق بيئة ملائمة للميكروبات، وبالتالي ساهم بشكل كبير في تقليل وتثبيت اليورانيوم (تان وآخرون 2022). (iii) البيوكربون كوسيلة لنقل الإلكترونات: غني بالكربون، يظهر البيوكربون خصائص مشابهة لتلك الخاصة بوسائل نقل الإلكترونات. اقترحت دراسة سابقة مسارين فريدين لنقل الإلكترونات مرتبطين بالبيوكربون، وهما “البطارية الجيولوجية” و”الموصل الجيولوجي” (سون وآخرون 2017). يعتمد الأول على الوظائف السطحية للبيوكربون، التي يمكن أن تخزن وتحرر الإلكترونات، مما يسهل تفاعلات الأكسدة والاختزال في التربة (هو وآخرون 2022). يمكن لجرام واحد من البيوكربون تخزين واستخدام ما يصل إلى 2 مليمول من الإلكترونات لتفاعلات الأكسدة والاختزال في التربة (كلوبفل وآخرون 2014). يُعزى مسار الموصل الجيولوجي إلى الموصلية العالية للبيوكربون بسبب هيكله الكربوني، الذي يدعم نقل الإلكترونات المباشر (سون وآخرون 2017). تساهم هذه الخصائص الفريدة في دور البيوكربون كوسيلة لنقل الإلكترونات خلال مجموعة واسعة من العمليات البيوجيوكيميائية. يحدد تفاعل البيوكربون مع الميكروبات المقللة تبادل الإلكترونات المستمر بين الميكروبات وأيونات المعادن، مما يشجع تفاعلات الأكسدة والاختزال، وينتج في النهاية تثبيت اليورانيوم (يو وآخرون 2023). كشف رين وآخرون (2023) أن الجزء النشط أكسيد-اختزالي من البيوكربون، الذي يحتوي بشكل أساسي على مكون يحتوي على الأكسجين، يعمل كوسيلة قوية لنقل الإلكترونات في عمليات التخفيض الميكروبي، مما يسهل بشكل فعال
تقليل الكروم (Cr) في التربة. من الجدير بالذكر أن الكروم مشابه لأيونات المعادن متعددة التكافؤ في اليورانيوم، مما يشير إلى عمليات محتملة مماثلة. دعم دينغ وآخرون (2018) هذا المنظور من خلال إظهار أن الميكروبات المدعومة بالبيوكربون تسرع من تقليل اليورانيوم من U(VI) إلى U(IV)، مصحوبة بتراسب معدني مشترك. بشكل عام، يوفر تعديل البيوكربون بواسطة الميكروبات نهجًا فعالًا لتقليل اليورانيوم (VI)، مع آفاق واعدة لمعالجة البيئات الملوثة باليورانيوم.
4.3 تبادل الأيونات
4.4 الامتصاص الفيزيائي
4.5 آليات أخرى
تفاعل الترسيب (لياو وآخرون 2022d). في هذه المواد الحيوية، يمكن لأيونات الفوسفات أن تتفاعل كيميائيًا مع أيونات اليورانيوم الماصة على أسطحها (روان وآخرون 2022). تؤدي مثل هذه التفاعلات إلى تكوين معادن فوسفات اليورانيوم، ولا سيما الأوتونيت.
5 تأثير تطبيق الفحم الحيوي على تراكم اليورانيوم والسمية في النباتات
5.1 خفض الفحم الحيوي امتصاص اليورانيوم بواسطة النباتات
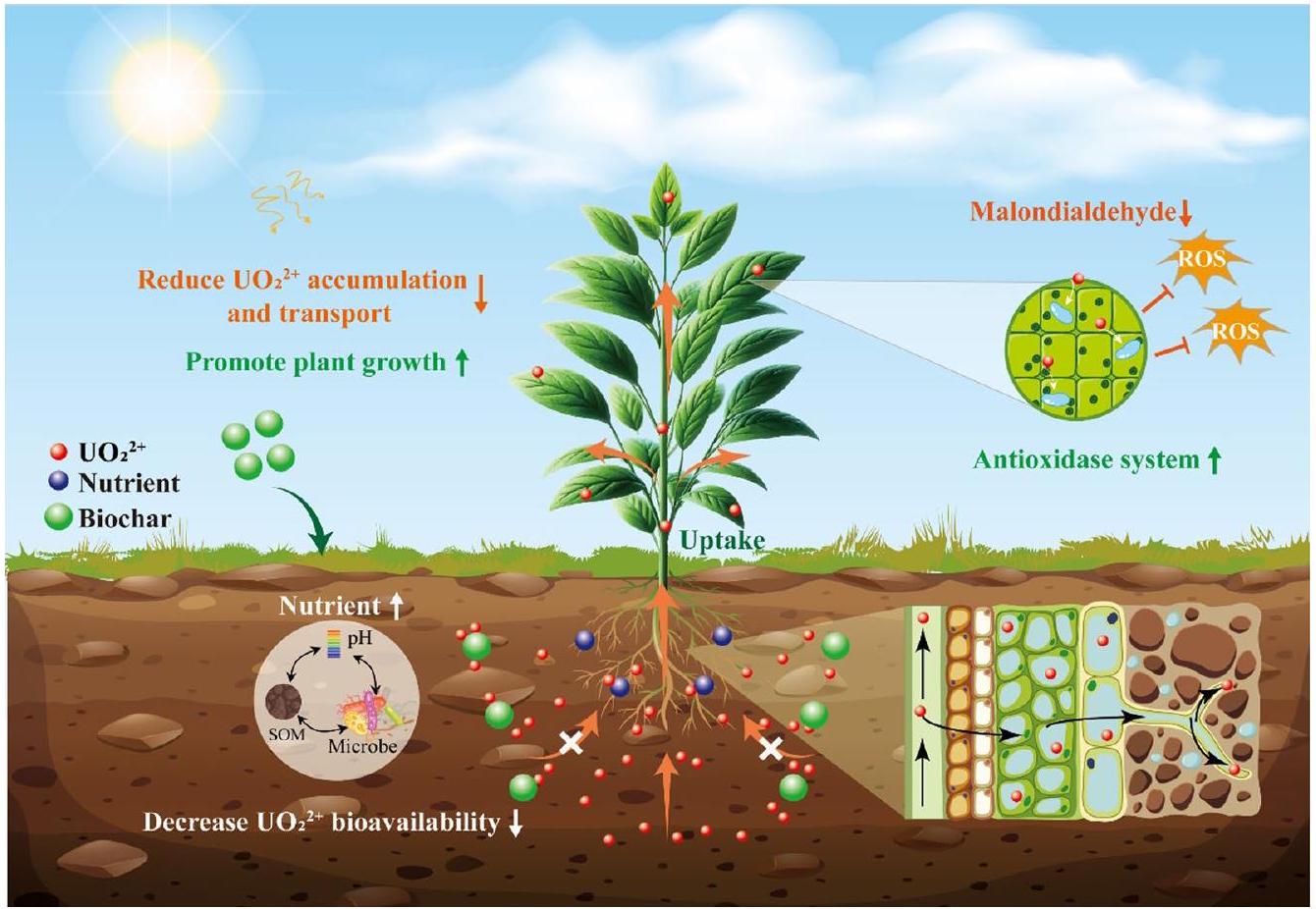
ومع ذلك، من المهم أن نلاحظ أن فعالية الفحم الحيوي في تقليل تراكم اليورانيوم في النباتات تختلف اعتمادًا على عوامل متعددة. كما ذُكر سابقًا، فإن العوامل الرئيسية التي تحدد فعالية الفحم الحيوي هي نوعه وخصائصه، بما في ذلك المواد الخام المستخدمة في إنتاجه، ودرجة حرارة التحلل الحراري، وطريقة التعديل. كما أن الخصائص الفطرية للتربة التي يُطبق عليها الفحم الحيوي تؤثر أيضًا على وظيفته (بوجي وآخرون 2018). وجد تاسكين وآخرون (2019) أن إضافة الفحم الحيوي إلى التربة الكلسية لم تقلل من محتوى اليورانيوم في فول الصويا. قد يُعزى هذا الملاحظة إلى تكوين معقدات أنيونية عالية الحركة بين
الاستجابات الفسيولوجية والتمثيلية لليورانيوم والبيوتشار. قد تستبعد الطماطم والكرنب اليورانيوم، بينما قد تتراكم الخيار والفجل اليورانيوم في أنسجتها، مما يشكل خطرًا على سلسلة الغذاء (Hou et al. 2018). استكشفت الأبحاث اللاحقة تأثير البيوتشار على تقليل تراكم اليورانيوم في الخضروات ووجدت أن فعاليته تعتمد على النوع (Qi et al. 2022). أظهرت النتائج أن ترتيب التراكم في الأجزاء فوق الأرض كان Brassica chinensis L. > Apium graveolens L. > Lycopersicon esculentum Mill في التربة الملوثة المعالجة بالبيوتشار. بشكل عام، يمكن اعتبار تطبيق البيوتشار نهجًا واعدًا وصديقًا للبيئة للتخفيف من تراكم اليورانيوم في النباتات وتعزيز الإنتاج الزراعي الآمن على الأراضي الملوثة باليورانيوم. ومع ذلك، هناك حاجة إلى تقييم أكثر شمولاً لإمكاناتهم وقيودهم لتحسين فهمنا لفعاليتهم في الترميم البيئي.
5.2 تم تثبيط نقل اليورانيوم من الجذور إلى الساق بواسطة الفحم الحيوي
مع بقايا الفوسفات الذاتية، مما يؤدي إلى الترسيب والثبات داخل أعضاء النبات، وبالتالي يمنع انتقالها من الجذور إلى الأوراق (لوريت وآخرون 2012). يمكن أن يقلل هذا التنظيم بشكل كبير من الآثار الفيتوكسينية المحتملة المرتبطة بتراكم اليورانيوم، مما يعزز بقاء ورفاهية النباتات في البيئات الملوثة باليورانيوم (وانغ وآخرون 2019ب). يتم تعديل هذه النقل بواسطة معلمات مختلفة، بما في ذلك تركيزات اليورانيوم القابلة للذوبان في التربة (فاندنهوف وآخرون 2007)، ومستويات التعبير عن جينات الناقلات في النباتات (جون وآخرون 2022)، والظروف البيئية الخارجية (ميرتينز وآخرون 2022). في وجود اليورانيوم، تم ملاحظة تأثير جينات الناقلات (IRT1، FRO2، وFIT1) وناقل الكالسيوم CAX7 في الأرابيدوبسيس ثاليانا، على سبيل المثال، وقد تم ملاحظة أن الكالسيوم الخارجي يمنع تراكم اليورانيوم في الجذور (دوستالي وآخرون 2014؛ ميرتينز وآخرون 2022؛ سارثو وآخرون 2022). كان لإضافة البيوكربون إلى التربة تأثير كبير على هذه العملية النقل. اكتشف ين وآخرون (2022)، على سبيل المثال، أن TF لليورانيوم لعلاجات البيوكربون المعدلة بالفوسفور انخفضت بمقدار
5.3 البيوكربون خفف من سمية اليورانيوم
الضغط، مما يشير إلى إمكاناته في تخفيف مثل هذه الأضرار الناتجة عن الضغط (تشانغ وآخرون 2019ب). تمتلك النباتات نظام دفاع للتعامل مع ROS، والذي يتضمن إنزيمات مضادة للأكسدة مختلفة تخفف من الآثار الضارة للضغط المؤكسد (هان وآخرون 2023). يحسن تطبيق البيوكربون من تحمل النبات للضغط غير الحيوي عن طريق زيادة النشاط المضاد للأكسدة (إرشاد وآخرون 2020). يعزز تطبيق البيوكربون الأنشطة المضادة للأكسدة في النباتات عن طريق زيادة محتوى إنزيمات مضادة للأكسدة مثل سوبر أكسيد ديسموتاز (SOD)، وبيروكسيداز (POD)، وكاتالاز (CAT)، وبيروكسيداز الأسكوربات (APX) (رضوان وآخرون 2018). يخفف SOD من الجذور الحرة، بينما يحفز POD وCAT تحلل بيروكسيد الهيدروجين، مما يقلل من الأضرار المؤكسدة المحتملة. يستخدم APX الأسكوربات لتسميم البيروكسيدات (تشو وآخرون 2023أ). من خلال زيادة النشاط المضاد للأكسدة بشكل كبير، يحسن البيوكربون من تحمل النبات للضغط غير الحيوي ويعزز الصحة العامة وإنتاجية النبات.
6 ملاحظات ختامية وآفاق مستقبلية
معلومات إضافية
الشكر والتقدير
مساهمات المؤلفين
التمويل
توفر البيانات والمواد
الإعلانات
المصالح المتنافسة
تفاصيل المؤلف
فبراير 2024
نُشر على الإنترنت: 01 مارس 2024
References
Ahmed W, Mehmood S, Núñez-Delgado A, Ali S, Qaswar M, Khan ZH, Ying H, Chen D-Y (2021a) Utilization of Citrullus lanatus L. seeds to synthesize a novel MnFe2O4-biochar adsorbent for the removal of U(VI) from wastewater: Insights and comparison between modified and raw biochar. Sci Total Environ 771:144955
Ahmed W, Mehmood S, Núñez-Delgado A, Qaswar M, Ali S, Ying H, Liu Z, Mahmood M, Chen D-Y (2021b) Fabrication, characterization and U(VI) sorption properties of a novel biochar derived from Tribulus terrestris via two different approaches. Sci Total Environ 780:146617
Ahmed W, Mehmood S, Qaswar M, Ali S, Khan ZH, Ying H, Chen D-Y, NúñezDelgado A (2021c) Oxidized biochar obtained from rice straw as adsorbent to remove uranium (VI) from aqueous solutions. J Environ Chem Eng 9:105104
Ahmed W, Núñez-Delgado A, Mehmood S, Ali S, Qaswar M, Shakoor A, Chen D-Y (2021d) Highly efficient uranium (VI) capture from aqueous solution by means of a hydroxyapatite-biochar nanocomposite: adsorption behavior and mechanism. Environ Res 201:111518
Akash S, Sivaprakash B, Raja VCV, Rajamohan N, Muthusamy G (2022) Remediation techniques for uranium removal from polluted environ-ment-review on methods, mechanism and toxicology. Environ Pollut 302:119068
Alam MS, Gorman-Lewis D, Chen N, Safari S, Baek K, Konhauser KO, Alessi DS (2018) Mechanisms of the removal of U(VI) from aqueous solution using biochar: a combined spectroscopic and modeling approach. Environ Sci Technol 52:13057-13067
Albayari M, Nazal MK, Khalili Fl, Nordin N, Adnan R (2021) Biochar derived from Salvadora persica branches biomass as low-cost adsorbent for removal of uranium(VI) and thorium(IV) from water. J Radioanal Nucl Chem 328:669-678
Alsabbagh AH, Abuqudaira TM (2017) Phytoremediation of Jordanian uranium-rich soil using sunflower. Water Air Soil Pollut 228:219
An K, Wang Z, Yang X, Qu Z, Sun F, Zhou W, Zhao H (2022) Reasons of low formaldehyde adsorption capacity on activated carbon: multi-scale simulation of dynamic interaction between pore size and functional groups. J Environ Chem Eng 10:108723
Antunes SC, Pereira R, Marques SM, Castro BB, Gonçalves F (2011) Impaired microbial activity caused by metal pollution: a field study in a deactivated uranium mining area. Sci Total Environ 410-411:87-95
Ao M, Chen X, Deng T, Sun S, Tang Y, Morel JL, Qiu R, Wang S (2022) Chromium biogeochemical behaviour in soil-plant systems and remediation strategies: a critical review. J Hazard Mater 424:127233
Arshad M, Khan AHA, Hussain I, Badar uz Z, Anees M, Iqbal M, Soja G, Linde C, Yousaf S (2017) The reduction of chromium (VI) phytotoxicity and phytoavailability to wheat (Triticum aestivum L.) using biochar and bacteria. Appl Soil Ecol 114:90-98
Ashry A, Bailey EH, Chenery SRN, Young SD (2016) Kinetic study of timedependent fixation of U(VI) on biochar. J Hazard Mater 320:55-66
Azeem M, Shaheen SM, Ali A, Jeyasundar PGSA, Latif A, Abdelrahman H, Li R, Almazroui M, Niazi NK, Sarmah AK, Li G, Rinklebe J, Zhu Y-G, Zhang Z (2022) Removal of potentially toxic elements from contaminated soil and water using bone char compared to plant- and bone-derived biochars: a review. J Hazard Mater 427:128131
Bern CR, Walton-Day K, Naftz DL (2019) Improved enrichment factor calculations through principal component analysis: examples from soils near breccia pipe uranium mines, Arizona, USA. Environ Pollut 248:90-100
Bigalke M, Ulrich A, Rehmus A, Keller A (2017) Accumulation of cadmium and uranium in arable soils in Switzerland. Environ Pollut 221:85-93
Boteva S, Radeva G, Traykov I, Kenarova A (2016) Effects of long-term radionuclide and heavy metal contamination on the activity of microbial communities, inhabiting uranium mining impacted soils. Environ Sci Pollut Res 23:5644-5653
Cabral Pinto MMS, Ferreira da Silva EA, Silva MMVG, Dinis PA (2014) Estimated background values maps of uranium in Santiago island topsoil and stream sediments. Procedia Earth Planet Sci 8:23-27
Chen L, Liu J, Zhang W, Zhou J, Luo D, Li Z (2021) Uranium (U) source, speciation, uptake, toxicity and bioremediation strategies in soil-plant system: a review. J Hazard Mater 413:125319
Chen L, Wang J, Beiyuan J, Guo X, Wu H, Fang L (2022a) Environmental and health risk assessment of potentially toxic trace elements in soils near uranium (U) mines: a global meta-analysis. Sci Total Environ 816:151556
Chen W, Feng J, Liu S, Zhang J, Cai Y, Lv Z, Fang M, Tan X (2022b) A green and economical MgO/biochar composite for the removal of U(VI) from aqueous solutions. Chem Eng Res Des 180:391-401
Chen L, Wang F, Zhang Z, Chao H, He H, Hu W, Zeng Y, Duan C, Liu J, Fang L (2023a) Influences of arbuscular mycorrhizal fungi on crop growth and potentially toxic element accumulation in contaminated soils: a metaanalysis. Crit Rev Environ Sci Technol 53:1795-1816
Chen X, Wang Y, Xia H, Ren Q, Li Y, Xu L, Xie C, Wang Y (2023b) “One-can” strategy for the synthesis of hydrothermal biochar modified with phosphate groups and efficient removal of uranium(VI). J Environ Radioact 263:107182
Costelloe BGLPMAMT. 2005. Contaminant dispersion at the rehabilitated Mary Kathleen uranium mine, Australia.
Cui Q, Zhang Z, Beiyuan J, Cui Y, Chen L, Chen H, Fang L (2023) A critical review of uranium in the soil-plant system: Distribution, bioavailability, toxicity, and bioremediation strategies. Crit Rev Environ Sci Technol 53:340-365
Dai L, Li L, Zhu W, Ma H, Huang H, Lu Q, Yang M, Ran Y (2020) Post-engineering of biochar via thermal air treatment for highly efficient promotion of uranium(VI) adsorption. Biores Technol 298:122576
Dai L, Lu Q, Zhou H, Shen F, Liu Z, Zhu W, Huang H (2021a) Tuning oxygenated functional groups on biochar for water pollution control: a critical review. J Hazard Mater 420:126547
Dai Z, Xiong X, Zhu H, Xu H, Leng P, Li J, Tang C, Xu J (2021b) Association of biochar properties with changes in soil bacterial, fungal and fauna communities and nutrient cycling processes. Biochar 3:239-254
Dhir B (2021) Effective removal of radioactive waste from environment using plants. In: Prasad R (ed) Phytoremediation for environmental sustainability. Springer Nature Singapore, Singapore, pp 71-82
Ding L, Tan W-f, Xie S-b, Mumford K, Lv J-w, Wang H-q, Fang Q, Zhang X-w, Wu X-y, Li M (2018) Uranium adsorption and subsequent re-oxidation under aerobic conditions by Leifsonia sp.-coated biochar as green trapping agent. Environ Pollut 242:778-787
Dong L, Yang J, Mou Y, Sheng G, Wang L, Linghu W, Asiri AM, Alamry KA (2017) Effect of various environmental factors on the adsorption of
Dong H, Coffin ES, Sheng Y, Duley ML, Khalifa YM (2023) Microbial reduction of
Doustaly F, Combes F, Fiévet JB, Berthet S, Hugouvieux V, Bastien O, Aranjuelo I, Leonhardt N, Rivasseau C, Carrière M, Vavasseur A, Renou J-P, Vandenbrouck Y, Bourguignon J (2014) Uranium perturbs signaling and iron uptake response in Arabidopsis thaliana roots. Metallomics 6:809-821
Duquène L, Vandenhove H, Tack F, Van Hees M, Wannijn J (2010) Diffusive gradient in thin FILMS (DGT) compared with soil solution and labile uranium fraction for predicting uranium bioavailability to ryegrass. J Environ Radioact 101:140-147
Endrizzi F, Leggett CJ, Rao L (2016) Scientific basis for efficient extraction of uranium from seawater. I: understanding the chemical speciation of uranium under seawater conditions. Ind Eng Chem Res 55:4249-4256
Fahad SA, Nawab MS, Shaida MA, Verma S, Khan MU, Siddiqui V, Naushad M, Saleem L, Farooqi IH (2023) Carbon based adsorbents for the removal of
Florez-Vargas O, Vilanova E, Alcaide C, Henao JA, Villarreal-Jaimes CA, MedinaPérez OM, Rodriguez-Villamizar LA, Idrovo AJ, Sánchez-Rodríguez LH (2023) Geological context and human exposures to element mixtures in mining and agricultural settings in Colombia. Sci Total Environ 898:165632
Frankel ML, Bhuiyan TI, Veksha A, Demeter MA, Layzell DB, Helleur RJ, Hill JM, Turner RJ (2016) Removal and biodegradation of naphthenic acids by biochar and attached environmental biofilms in the presence of cocontaminating metals. Biores Technol 216:352-361
Fu H, Wang S, Zhang H, Dai Z, He G, Li G, Ding D (2022) Remediation of uranium-contaminated acidic red soil by rice husk biochar. Environ Sci Pollut Res 29:77839-77850
Galhardi JA, de Mello JWV, Wilkinson KJ (2020) Bioaccumulation of potentially toxic elements from the soils surrounding a legacy uranium mine in Brazil. Chemosphere 261:127679
Gan J, Zhang L, Wang Q, Xin Q, Hu E, Lei Z, Wang H, Wang H (2023) Synergistic action of multiple functional groups enhanced uranium extraction from seawater of porous phosphorylated chitosan/coal-based activated carbon composite sponge. Desalination 545:116154
Ganguly S, Bhan U (2023) Occurrences and mobility of uranium in soil profile due to groundwater-soil interaction. Hydrogeochem Aqua Ecosyst. https://doi.org/10.1002/9781119870562.ch8
Gao N, Huang Z, Liu H, Hou J, Liu X (2019) Advances on the toxicity of uranium to different organisms. Chemosphere 237:124548
Gao L, Li R, Liang Z, Wu Q, Yang Z, Li M, Chen J, Hou L (2021) Mobilization mechanisms and toxicity risk of sediment trace metals (
Gramss G, Voigt K-D (2016) Gradual accumulation of heavy metals in an industrial wheat crop from uranium mine soil and the potential use of the herbage. Agriculture 6:51
Guilhen SN, Mašek O, Ortiz N, Izidoro JC, Fungaro DA (2019) Pyrolytic temperature evaluation of macauba biochar for uranium adsorption from aqueous solutions. Biomass Bioenerg 122:381-390
Guilhen SN, Rovani S, Araujo LGd, Tenório JAS, Mašek O (2021) Uranium removal from aqueous solution using macauba endocarp-derived biochar: effect of physical activation. Environ Pollut 272:116022
Guo L, Peng L, Li J, Zhang W, Shi B (2023) Superefficient separation of Th(IV) and
Han L, Gu H, Lu W, Li H, Peng W-x, Ling Ma N, Lam SS, Sonne C (2023) Progress in phytoremediation of chromium from the environment. Chemosphere 344:140307
Hilpmann S, Rossberg A, Steudtner R, Drobot B, Hübner R, Bok F, Prieur D, Bauters S, Kvashnina KO, StumpfT, Cherkouk A (2023) Presence of uranium(V) during uranium(VI) reduction by Desulfosporosinus hippei DSM 8344T. Sci Total Environ 875:162593
Hong EY, Wan Z, Kim Y, Yu J (2022) Submerged zone and vegetation drive distribution of heavy metal fractions and microbial community structure: Insights into stormwater biofiltration system. Sci Total Environ 853:158367
Hou J, Wang C, Zhou Y, Li S, Hayat T, Alsaedi A, Wang X (2018) Effects of uranium stress on physiological and biochemical characteristics in seedlings of six common edible vegetables. J Radioanal Nucl Chem 316:1001-1010
Hou N, Li X, Jiang X, Zhang N, Wang R, Li D (2022) The role of biochar in the photocatalytic treatment of a mixture of
Hu H, Zhang X, Wang T, Sun L, Wu H, Chen X (2018a) Bamboo (Acidosasa longiligula) shoot shell biochar: its potential application to isolation of uranium(VI) from aqueous solution. J Radioanal Nucl Chem 316:349-362
Hu Q, Zhu Y, Hu B, Lu S, Sheng G (2018b) Mechanistic insights into sequestration of
Hu R, Xiao J, Wang T, Chen G, Chen L, Tian X (2020) Engineering of phosphatefunctionalized biochars with highly developed surface area and
porosity for efficient and selective extraction of uranium. Chem Eng J 379:122388
Huang M, Zhou M, Li Z, Ding X, Wen J, Jin C, Wang L, Xiao L, Chen J (2022) How do drying-wetting cycles influence availability of heavy metals in sediment? A perspective from DOM molecular composition. Water Res 220:118671
Huang F, Hu J, Chen L, Wang Z, Sun S, Zhang W, Jiang H, Luo Y, Wang L, Zeng Y, Fang L (2023) Microplastics may increase the environmental risks of Cd via promoting Cd uptake by plants: a meta-analysis. J Hazard Mater 448:130887
Huang F, Li Z, Yang X, Liu H, Chen L, Chang N, He H, Zeng Y, Qiu T, Fang L (2024) Silicon reduces toxicity and accumulation of arsenic and cadmium in cereal crops: a meta-analysis, mechanism, and perspective study. Sci Total Environ 918:170663
Irshad MK, Noman A, Alhaithloul HAS, Adeel M, Rui Y, Shah T, Zhu S, Shang
Janu R, Mrlik V, Ribitsch D, Hofman J, Sedláček P, Bielská L, Soja G (2021) Biochar surface functional groups as affected by biomass feedstock, biochar composition and pyrolysis temperature. Carbon Resour Convers 4:36-46
Ji W, Parameswarappa Jayalakshmamma M, Abou Khalil C, Zhao L, Boufadel M (2020) Removal of hydrocarbon from soils possessing macroheterogeneities using electrokinetics and surfactants. Chem Eng J Adv 4:100030
Jin J, Li S, Peng X, Liu W, Zhang C, Yang Y, Han L, Du Z, Sun K, Wang X (2018)
John WA, Lückel B, Matschiavelli N, Hübner R, Matschi S, Hoehenwarter W, Sachs S (2022) Endocytosis is a significant contributor to uranium(VI) uptake in tobacco (Nicotiana tabacum) BY-2 cells in phosphate-deficient culture. Sci Total Environ 823:153700
Kanwar P, Mina U, Thakur IS, Srivastava S (2023) Heavy metal phytoremediation by the novel prospect of microbes, nanotechnology, and genetic engineering for recovery and rehabilitation of landfill site. Bioresour Technol Rep 23:101518
Kasera N, Kolar P, Hall SG (2022) Nitrogen-doped biochars as adsorbents for mitigation of heavy metals and organics from water: a review. Biochar 4:17
Khan Z, Fan X, Khan MN, Khan MA, Zhang K, Fu Y, Shen H (2022) The toxicity of heavy metals and plant signaling facilitated by biochar application: implications for stress mitigation and crop production. Chemosphere 308:136466
Klüpfel L, Keiluweit M, Kleber M, Sander M (2014) Redox properties of plant biomass-derived black carbon (biochar). Environ Sci Technol 48:5601-5611
Kumar S, Loganathan VA, Gupta RB, Barnett MO (2011) An Assessment of U(VI) removal from groundwater using biochar produced from hydrothermal carbonization. J Environ Manage 92:2504-2512
Kumar A, Kumar V, Saroop S, Arsenov D, Bali S, Radziemska M, Bhardwaj R (2023) A comprehensive review of Uranium in the terrestrial and aquatic environment: bioavailability, immobilization, tolerance and remediation approaches. Plant Soil 490:31-65
Lai J-I, Liu Z-w, Li C, Luo X-g (2021) Analysis of accumulation and phytotoxicity mechanism of uranium and cadmium in two sweet potato cultivars. J Hazard Mater 409:124997
Laurette J, Larue C, Llorens I, Jaillard D, Jouneau P-H, Bourguignon J, Carrière M (2012) Speciation of uranium in plants upon root accumulation and root-to-shoot translocation: A XAS and TEM study. Environ Exp Bot 77:87-95
Leng L, Xu S, Liu R, Yu T, Zhuo X, Leng S, Xiong Q, Huang H (2020) Nitrogen containing functional groups of biochar: an overview. Biores Technol 298:122286
Lepore GO, Schingaro E, Mesto E, Lacalamita M, Cristiani C, Stampino PG, Dotelli G, Finocchio E, d’Acapito F, Giuli G (2022) Lanthanum captured in montmorillonite: evidence of inner-sphere complexes from X-ray absorption spectroscopy investigations. Appl Clay Sci 230:106676
Li X, Pan H, Yu M, Wakeel M, Luo J, Alharbi NS, Liao Q, Liu J (2018) Macroscopic and molecular investigations of immobilization mechanism of uranium on biochar: EXAFS spectroscopy and static batch. J Mol Liq 269:64-71
Li M, Liu H, Chen T, Dong C, Sun Y (2019a) Synthesis of magnetic biochar composites for enhanced uranium(VI) adsorption. Sci Total Environ 651:1020-1028
Li N, Yin M, Tsang DCW, Yang S, Liu J, Li X, Song G, Wang J (2019b) Mechanisms of U(VI) removal by biochar derived from Ficus microcarpa aerial root: a comparison between raw and modified biochar. Sci Total Environ 697:134115
Li S, Harris S, Anandhi A, Chen G (2019c) Predicting biochar properties and functions based on feedstock and pyrolysis temperature: a review and data syntheses. J Clean Prod 215:890-902
Li R, Wang B, Niu A, Cheng N, Chen M, Zhang X, Yu Z, Wang S (2022) Application of biochar immobilized microorganisms for pollutants removal from wastewater: a review. Sci Total Environ 837:155563
Li A, Ye C, Jiang Y, Deng H (2023a) Enhanced removal performance of magnesium-modified biochar for cadmium in wastewaters: role of active functional groups, processes, and mechanisms. Biores Technol 386:129515
Li Y, Abdo Al, Shi Z, Merwad A-RMA, Zhang J (2023b) Biochar derived from invasive plants improved the pH , macronutrient availability and biological properties better than liming for acid rain-affected soil. Biochar 5:59
Li N, Wang Y, Zhou L, Fu D, Chen T, Chen X, Wang Q, Zhu W (2024) The joint action of biochar and plant roots on U-stressed soil remediation: insights from bacteriomics and metabolomics. J Hazard Mater 461:132635
Liao J, Chen H, Zhang Y, Zhu W (2022a) Pyrolysis of animal manure under nitrogen atmosphere: an environment protection way to obtain animal manure biochar for high-efficient adsorption of uranium(VI). J Anal Appl Pyrol 163:105493
Liao J, Ding L, Zhang Y, Zhu W (2022b) Efficient removal of uranium from wastewater using pig manure biochar: understanding adsorption and binding mechanisms. J Hazard Mater 423:127190
Liao J, He X, Zhang Y, Zhang L, He Z (2022c) Constructing a novel carbon material for efficient separation of uranium(VI) from solution. Biomass Convers Bioref. https://doi.org/10.1007/s13399-022-02856-9
Liao J, He X, Zhang Y, Zhu W, Zhang L, He Z (2022d) Bismuth impregnated biochar for efficient uranium removal from solution: adsorption behavior and interfacial mechanism. Sci Total Environ 819:153145
Liao J, Xiong T, Ding L, Zhang Y, Zhu W (2022e) Effective separation of uranium(VI) from wastewater using a magnetic carbon as a recyclable adsorbent. Sep Purif Technol 282:120140
Liao J, He X, Zhang Y, Zhang L, He Z (2023) The construction of magnetic hydroxyapatite-functionalized pig manure-derived biochar for the efficient uranium separation. Chem Eng J 457:141367
Liatsou I, Michail G, Demetriou M, Pashalidis I (2017) Uranium binding by biochar fibres derived from Luffa cylindrica after controlled surface oxidation. J Radioanal Nucl Chem 311:871-875
Limwikran T, Kheoruenromne I, Suddhiprakarn A, Prakongkep N, Gilkes RJ (2018) Dissolution of K, Ca, and P from biochar grains in tropical soils. Geoderma 312:139-150
Lingamdinne LP, Choi J-S, Angaru GKR, Karri RR, Yang J-K, Chang Y-Y, Koduru JR (2022) Magnetic-watermelon rinds biochar for uranium-contaminated water treatment using an electromagnetic semi-batch column with removal mechanistic investigations. Chemosphere 286:131776
Liu J, Wang J, Li H, Shen C-C, Chen Y, Wang C, Ye H, Long J, Song G, Wu Y (2015) Surface sediment contamination by uranium mining/milling activities in South China. Clean: Soil, Air, Water 43:414-420
Liu J, Ge Y, Wang G, Liu Y, Xu X (2021a) Highly efficient removal of U(VI) in aqueous solutions by tea waste-derived biochar-supported iron-manganese oxide composite. J Radioanal Nucl Chem 330:871-882
Liu R, Wang H, Han L, Hu B, Qiu M (2021b) Reductive and adsorptive elimination of U(VI) ions in aqueous solution by SFeS@Biochar composites. Environ Sci Pollut Res 28:55176-55185
Liu X, Tournassat C, Grangeon S, Kalinichev AG, Takahashi Y, Marques Fernandes M (2022a) Molecular-level understanding of metal ion retention in clay-rich materials. Nat Rev Earth Environ 3:461-476
Liu Y, Wu S, Nguyen TAH, Chan T-S, Lu Y-R, Huang L (2022c) Biochar mediated uranium immobilization in magnetite rich Cu tailings subject to organic matter amendment and native plant colonization. J Hazard Mater 427:127860
Liu Z, Xu Z, Xu L, Buyong F, Chay TC, Li Z, Cai Y, Hu B, Zhu Y, Wang X (2022d) Modified biochar: synthesis and mechanism for removal of environmental heavy metals. Carbon Res 1:8
Liu B, Jiang S, Guan D-X, Song X, Li Y, Zhou S, Wang B, Gao B (2023a) Geochemical fractionation, bioaccessibility and ecological risk of metallic elements in the weathering profiles of typical skarn-type copper tailings from Tongling, China. Sci Total Environ 894:164859
Liu Y, Yuan W, Lin W, Yu S, Zhou L, Zeng Q, Wang J, Tao L, Dai Q, Liu J (2023b) Efficacy and mechanisms of
Lovley DR, Phillips EJP, Gorby YA, Landa ER (1991) Microbial reduction of uranium. Nature 350:413-416
Lyu P, Wang G, Cao Y, Wang B, Deng N (2021a) Phosphorus-modified biochar cross-linked Mg-Al layered double-hydroxide composite for immobilizing uranium in mining contaminated soil. Chemosphere 276:130116
Lyu P, Wang G, Wang B, Yin Q, Li Y, Deng N (2021b) Adsorption and interaction mechanism of uranium (VI) from aqueous solutions on phosphateimpregnation biochar cross-linked MgAl layered double-hydroxide composite. Appl Clay Sci 209:106146
Ma M, Wang R, Xu L, Xu M, Liu S (2020) Emerging health risks and underlying toxicological mechanisms of uranium contamination: lessons from the past two decades. Environ Int 145:106107
Majeed A, Muhmood A, Niaz A, Ditta A, Rajpar MN (2022) Comparative efficacy of different biochars and traditional manures in the attenuation of cadmium toxicity in rice (Oryza sativa L.). Arab J Geosci 15:209
Malaviya P, Singh A (2012) Phytoremediation strategies for remediation of uranium-contaminated environments: a review. Crit Rev Environ Sci Technol 42:2575-2647
Mertens A, Horemans N, Saenen E, Nauts R, Cuypers A (2022) Calcium affects uranium responses in Arabidopsis thaliana: from distribution to toxicity. Plant Physiol Biochem 185:101-111
Mishra V, Sureshkumar MK, Gupta N, Kaushik CP (2017) Study on sorption characteristics of uranium onto biochar derived from eucalyptus wood. Water Air Soil Pollut 228:309
Mo G, Hu Q, Wang G, Xie S, Nong H, Zhang X, Zeng T (2021) Fe3O4-modified sewage sludge biochar for
Monreal MJ, Diaconescu PL (2010) The riches of uranium. Nat Chem 2:424-424
Morereau A, Jaegler H, Hain K, Steier P, Golser R, Beaumais A, Lepage H, Eyrolle F, Grosbois C, Cazala C, Gourgiotis A (2022) Deciphering sources of U contamination using isotope ratio signatures in the Loire River sediments: exploring the relevance of
Mousavi SM, Srivastava AK, Cheraghi M (2023) Soil health and crop response of biochar: an updated analysis. Arch Agron Soil Sci 69:1085-1110
Mukherjee A, Zimmerman AR, Harris W (2011) Surface chemistry variations among a series of laboratory-produced biochars. Geoderma 163:247-255
Narasimharao K, Angaru GKR, Momin ZH, Al-Thabaiti S, Mokhtar M, Alsheshri A, Alfaifi SY, Koduru JR, Chang Y-Y (2023) Orange waste Biochar-Magnesium Silicate (OBMS) composite for enhanced removal of U(VI) ions from aqueous solutions. J Water Process Eng 51:103359
Nduka JK, Umeh TC, Kelle HI, Ozoagu PC, Okafor PC (2022) Health risk assessment of radiation dose of background radionuclides in quarry soil and uptake by plants in Ezillo-Ishiagu in Ebonyi South-Eastern Nigeria. Case Stud Chem Environ Eng 6:100269
Neiva AMR, Albuquerque MTD, Antunes IMHR, Carvalho PCS, Santos ACT, Boente C, Cunha PP, Henriques SBA, Pato RL (2019) Assessment of metal and metalloid contamination in soils trough compositional data: the old Mortórios uranium mine area, central Portugal. Environ Geochem Health 41:2875-2892
Ouyang P, Narayanan M, Shi X, Chen X, Li Z, Luo Y, Ma Y (2023) Integrating biochar and bacteria for sustainable remediation of metal-contaminated soils. Biochar 5:63
Pang H, Zhang E, Zhang D, Wang X, Zhao B, Liu L, Ma X, Song G, Yu S (2022) Precursor impact and mechanism analysis of uranium elimination by biochar supported sulfurized nanoscale zero-valent iron. J Environ Chem Eng 10:107288
Papp Z, Dezső Z, Daróczy S (2002) Significant radioactive contamination of soil around a coal-fired thermal power plant. J Environ Radioact 59:191-205
Pehlivan N, Gedik K, Wang JJ (2023) Tea-based biochar-mediated changes in cation diffusion homeostasis in rice grown in heavy metal (loid) contaminated mining soil. Plant Physiol Biochem 201:107889
Pehoiu G, Radulescu C, Murarescu O, Dulama ID, Bucurica IA, Teodorescu S, Stirbescu RM (2019) Health risk assessment associated with abandoned copper and uranium mine tailings. Bull Environ Contam Toxicol 102:504-510
Peña J, Straub M, Flury V, Loup E, Corcho J, Steinmann P, Bochud F, Froidevaux P (2020) Origin and stability of uranium accumulation-layers in an Alpine histosol. Sci Total Environ 727:138368
Peng Z, Cao J (2021) Natural uranium-bearing nanoparticles in surface media. Environ Chem Lett 19:2713-2721
Pérez-Sánchez D, Thorne MC (2014) An investigation into the upward transport of uranium-series radionuclides in soils and uptake by plants. J Radiol Prot 34:545
Philippou M, Pashalidis I, Theocharis CR (2022) Uranium Isotope (U-232) removal from waters by biochar fibers: an adsorption study in the subpicomolar concentration range. Molecules 27:6765
Plant J, Reeder S, Salminen R, Smith D, Tarvainen T, De Vivo B, Petterson M (2003) The distribution of uranium over Europe: geological and environmental significance. Appl Earth Sci (transactions of the Institute of Mining and Metallurgy B) 112:B1-B17
Qi X, Gou J, Chen X, Xiao S, Ali I, Shang R, Wang D, Wu Y, Han M, Luo X (2021) Application of mixed bacteria-loaded biochar to enhance uranium and cadmium immobilization in a co-contaminated soil. J Hazard Mater 401:123823
Qi X, Xiao S, Chen X, Ali I, Gou J, Wang D, Zhu B, Zhu W, Shang R, Han M (2022) Biochar-based microbial agent reduces
Qiu B, Tao X, Wang H, Li W, Ding X, Chu H (2021) Biochar as a low-cost adsorbent for aqueous heavy metal removal: a review. J Anal Appl Pyrol 155:105081
Qiu M, Liu L, Ling Q, Cai Y, Yu S, Wang S, Fu D, Hu B, Wang X (2022) Biochar for the removal of contaminants from soil and water: a review. Biochar 4:19
Ramadan RS, Dawood YH, Yehia MM, Gad A (2022) Environmental and health impact of current uranium mining activities in southwestern Sinai, Egypt. Environ Earth Sci 81:213
Rani N, Singh P, Kumar S, Kumar P, Bhankar V, Kamra N, Kumar K (2023) Recent advancement in nanomaterials for the detection and removal of uranium: a review. Environ Res 234:116536
Ren J, Huang H, Zhang Z, Xu X, Zhao L, Qiu H, Cao X (2023) Enhanced microbial reduction of
Rizwan M, Ali S, Abbas T, Rehman MZu, Al-Wabel MI (2018) Residual impact of biochar on cadmium uptake by rice (Oryza sativa L.) grown in Cdcontaminated soil. Arab J Geosci 11:630
Ruan Y, Zhang H, Yu Z, Diao Z, Song G, Su M, La H, Chen D, Wang S, Kong L (2022) Phosphate enhanced uranium stable immobilization on biochar supported nano zero valent iron. J Hazard Mater 424:127119
Rushimisha IE, Li X, Han T, Chen X, Abdoul Magid ASI, Sun Y, Li Y (2022) Application of biochar on soil bioelectrochemical remediation: behind roles, progress, and potential. Crit Rev Biotechnol 44(1):120-138
Sahoo SK, Hosoda M, Kamagata S, Sorimachi A, Ishikawa T, Tokonami S, Uchida
Sapre S, Gontia-Mishra I, Tiwari S (2022) Plant growth-promoting Rhizobacteria ameliorates salinity stress in pea (Pisum sativum). J Plant Growth Regul 41:647-656
Satpathy A, Sharma N, Pan W, Catalano JG, Giammar DE (2023) Exchange between dissolved U(VI) and adsorbed and precipitated forms of solidassociated U. ACS Earth Space Chem 7:1528-1535
Schilz JR, Dashner-Titus EJ, Simmons KA, Erdei E, Bolt AM, MacKenzie DA, Hudson LG (2022) The immunotoxicity of natural and depleted uranium: from cells to people. Toxicol Appl Pharmacol 454:116252
Schipper LA, Sparling GP, Fisk LM, Dodd MB, Power IL, Littler RA (2011) Rates of accumulation of cadmium and uranium in a New Zealand hill farm soil as a result of long-term use of phosphate fertilizer. Agicr Ecosyst Environ 144:95-101
Shahandeh H, Hossner L (2002) Role of soil properties in phytoaccumulation of uranium. Water Air Soil Pollut 141:165-180
Sharma DA, Keesari T, Pant D, Rishi MS, Sangwan P, Thakur N, Sinha UK (2022) Appraising the factors favouring uranium mobilization and associated health risk assessment in groundwaters of north-western India. Ecotoxicol Environ Saf 229:113086
Shen C, Pan J, Chen M, Su M, Chen D, Song G (2023) Statistically and visually analyzing the latest advancements and future trends of uranium removal. Environ Res 239:117280
Singh H, Northup BK, Rice CW, Prasad PVV (2022) Biochar applications influence soil physical and chemical properties, microbial diversity, and crop productivity: a meta-analysis. Biochar 4:8
Skipperud L, Strømman G, Yunusov M, Stegnar P, Uralbekov B, Tilloboev H, Zjazjev G, Heier LS, Rosseland BO, Salbu B (2013) Environmental impact assessment of radionuclide and metal contamination at the former
Srivastava RR, Pathak P, Perween M (2020) Environmental and health impact due to uranium mining. In: Gupta DK, Walther C (eds) Uranium in plants and the environment. Springer International Publishing, Cham, pp 69-89
Stasi C, Georgiou E, loannidis I, Pashalidis I (2022) Uranium removal from laboratory and environmental waters by oxidised biochar prepared from palm tree fibres. J Radioanal Nucl Chem 331:375-381
Sun T, Levin BD, Guzman JJ, Enders A, Muller DA, Angenent LT, Lehmann J (2017) Rapid electron transfer by the carbon matrix in natural pyrogenic carbon. Nat Commun 8:14873
Sun Y, Zeng B, Dai Y, Liang X, Zhang L, Ahmad R, Su X (2022) Modification of sludge-based biochar using air roasting-oxidation and its performance in adsorption of uranium(VI) from aqueous solutions. J Colloid Interface Sci 614:547-555
Takeda A, Tsukada H, Takaku Y, Si H, Nanzyo M (2006) Accumulation of uranium derived from long-term fertilizer applications in a cultivated Andisol. Sci Total Environ 367:924-931
Tan X-F, Zhu S-S, Wang R-P, Chen Y-D, Show P-L, Zhang F-F, Ho S-H (2021) Role of biochar surface characteristics in the adsorption of aromatic compounds: pore structure and functional groups. Chin Chem Lett 32:2939-2946
Tan S, Narayanan M, Thu Huong DT, Ito N, Unpaprom Y, Pugazhendhi A, Lan Chi NT, Liu J (2022) A perspective on the interaction between biochar and soil microbes: a way to regain soil eminence. Environ Res 214:113832
Taskin MB, Kadioglu YK, Sahin O, Inal A, Gunes A (2019) Effect of acid modified biochar on the growth and essential and non- essential element content of bean, chickpea, soybean, and maize grown in calcareous soil. Commun Soil Sci Plant Anal 50:1604-1613
Thakur A, Kumar R, Sahoo PK (2022) Uranium and fluoride removal from aqueous solution using biochar: a critical review for understanding the role of feedstock types, mechanisms, and modification methods. Water 14:413
Thorgersen MP, Goff JL, Poole FL, Walker KF, Putt AD, Lui LM, Hazen TC, Arkin AP, Adams MWW (2023) Mixed nitrate and metal contamination influences operational speciation of toxic and essential elements. Environ Pollut. https://doi.org/10.1016/j.envpol.2023.122674
Tomczyk A, Sokołowska Z, Boguta P (2020) Biochar physicochemical properties: pyrolysis temperature and feedstock kind effects. Rev Environ Sci Bio/Technol 19:191-215
Tunney H, Stojanović M, MrdakovićPopić J, McGrath D, Zhang C (2009) Relationship of soil phosphorus with uranium in grassland mineral soils in Ireland using soils from a long-term phosphorus experiment and a National Soil Database. J Plant Nutr Soil Sci 172:346-352
Um W, Icenhower JP, Brown CF, Serne RJ, Wang Z, Dodge CJ, Francis AJ (2010) Characterization of uranium-contaminated sediments from beneath a nuclear waste storage tank from Hanford, Washington: implications for contaminant transport and fate. Geochim Cosmochim Acta 74:1363-1380
Utermann J, Fuchs M (2008) Uranium in German soils. Loads and fate of fertilizer-derived uranium. Backhuys Publishers, Leiden, pp 978-990
Vandenhove H, Van Hees M, Wannijn J, Wouters K, Wang L (2007) Can we predict uranium bioavailability based on soil parameters? Part 2: Soil solution uranium concentration is not a good bioavailability index. Environ Pollut 145:577-586
Vodyanitskii YN (2011) Chemical aspects of uranium behavior in soils: a review. Eurasian Soil Sci 44:862-873
Wang Z, Qin H, Liu X (2019a) Health risk assessment of heavy metals in the soil-water-rice system around the Xiazhuang uranium mine, China. Environ Sci Pollut Res 26:5904-5912
Wang Z, Qin H, Wang J (2019b) Accumulation of uranium and heavy metals in the soil-plant system in Xiazhuang uranium ore field, Guangdong Province, China. Environ Geochem Health 41:2413-2423
Wang B, Li Y, Zheng J, Hu Y, Wang X, Hu B (2020) Efficient removal of U(VI) from aqueous solutions using the magnetic biochar derived from the biomass of a bloom-forming cyanobacterium (Microcystis aeruginosa). Chemosphere 254:126898
Wang C, Wang G, Xie S, Wang J, Guo Y (2022) Removal behavior and mechanisms of
Wang C, Ma R, Wang J, Zhong C, Zhao Y, Browne P (2023) Fractionations of heavy metals and their correlations with magnetic susceptibility in soil from a typical alluvial island in the lower Yangtze river, China. J Clean Prod 418:138060
Wei B, Peng Y, Lin L, Zhang D, Ma L, Jiang L, Li Y, He T, Wang Z (2023) Drivers of biochar-mediated improvement of soil water retention capacity based on soil texture: a meta-analysis. Geoderma 437:116591
Wen J, Fang Y, Zeng G (2018) Progress and prospect of adsorptive removal of heavy metal ions from aqueous solution using metal-organic frameworks: a review of studies from the last decade. Chemosphere 201:627-643
Wu C, Zhi D, Yao B, Zhou Y, Yang Y, Zhou Y (2022a) Immobilization of microbes on biochar for water and soil remediation: a review. Environ Res 212:113226
Wu Z, Firmin KA, Cheng M, Wu H, Si Y (2022b) Biochar enhanced Cd and Pb immobilization by sulfate-reducing bacterium isolated from acid mine drainage environment. J Clean Prod 366:132823
Xia D, Liu Y, Cheng X, Gu P, Chen Q, Zhang Z (2022) Temperature-tuned fishscale biochar with two-dimensional homogeneous porous structure: a promising uranium extractant. Appl Surf Sci 591:153136
Xu N, Wei FS, Ten EJ, Chen LQ (1993) Evaluation of indigenous concentrations of uranium and thorium in soils of China. Commun Soil Sci Plant Anal 24:1795-1803
Xu Z, Xing Y, Ren A, Ma D, Li Y, Hu S (2020) Study on adsorption properties of water hyacinth-derived biochar for uranium (VI). J Radioanal Nucl Chem 324:1317-1327
Xue C, Yi X, Yang Y, Jiang F, Yin H, Dang Z (2023) Chemical speciation and distribution of adsorbed
Yang G (2023) Sorption and reduction of hexavalent uranium by natural and modified silicate minerals: a review. Environ Chem Lett 21:2441-2470
Yang X, Wan Y, Zheng Y, He F, Yu Z, Huang J, Wang H, Ok YS, Jiang Y, Gao B (2019) Surface functional groups of carbon-based adsorbents and their roles in the removal of heavy metals from aqueous solutions: a critical review. Chem Eng J 366:608-621
Yang X, Dai Z, Ge C, Yu H, Bolan N, Tsang DCW, Song H, Hou D, Shaheen SM, Wang H, Rinklebe J (2023a) Multiple-functionalized biochar affects rice yield and quality via regulating arsenic and lead redistribution and
bacterial community structure in soils under different hydrological conditions. J Hazard Mater 443:130308
Yang X, Wen E, Ge C, El-Naggar A, Yu H, Wang S, Kwon EE, Song H, Shaheen SM, Wang H, Rinklebe J (2023b) Iron-modified phosphorus- and siliconbased biochars exhibited various influences on arsenic, cadmium, and lead accumulation in rice and enzyme activities in a paddy soil. J Hazard Mater 443:130203
Yang Y, Zhong M, Bian X, You Y, Li F (2023c) Preparation of carbon-based material with high water absorption capacity and its effect on the water retention characteristics of sandy soil. Biochar 5:61
Ye T, Huang B, Wang Y, Zhou L, Liu Z (2020) Rapid removal of uranium(VI) using functionalized luffa rattan biochar from aqueous solution. Colloids Surf, A 606:125480
Yi P, Yan Y, Kong Y, Chen Q, Wu M, Liang N, Zhang L, Pan B (2023) The opposite influences of Cu and Cd cation bridges on sulfamethoxazole sorption on humic acids in wetting-drying cycles. Sci Total Environ 898:165547
Yin Q, Lyu P, Wang G, Wang B, Li Y, Zhou Z, Guo Y, Li L, Deng N (2022) Phos-phorus-modified biochar cross-linked Mg-Al layered double-hydroxide stabilizer reduced U and Pb uptake by Indian mustard (Brassica juncea L.) in uranium contaminated soil. Ecotoxicol Environ Saf 234:113363
Yu S, Wu X, Ye J, Li M, Zhang Q, Zhang X, Lv C, Xie W, Shi K, Liu Y (2022) Dual effect of acetic acid efficiently enhances sludge-based biochar to recover uranium from aqueous solution. Front Chem 10:835959
Yu C, Zhu X, Mohamed A, Dai K, Cai P, Liu S, Huang Q, Xing B (2023) Enhanced
Yuan Y, Bolan N, Prévoteau A, Vithanage M, Biswas JK, Ok YS, Wang H (2017) Applications of biochar in redox-mediated reactions. Biores Technol 246:271-281
Zeng T, Mo G, Zhang X, Liu J, Liu H, Xie S (2020) U(VI) removal efficiency and mechanism of biochars derived from sewage sludge at two pyrolysis temperatures. J Radioanal Nucl Chem 326:1413-1425
Zhang C, Yu Z-g, Zeng G-m, Jiang M, Yang Z-z, Cui F, Zhu M-y, Shen L-q, Hu
Zhang H, Ruan Y, Liang A, Shih K, Diao Z, Su M, La H, Chen D, Lu H, Kong L (2019a) Carbothermal reduction for preparing nZVI/BC to extract uranium: insight into the iron species dependent uranium adsorption behavior. J Clean Prod 239:117873
Zhang P, Qi X, Wen J, Liu J (2019b) Effect and mechanism of mixed biochar with rice straw and pig manure on remediation of uranium contaminated soil by Lolium Perenne. J Univ S China 33:90-96
Zhang S, Yang F, Cao X, Tang Y, Yin T, Bo T, Liu Y, Lisak G, Kano N, Na B, Chang M, Liu
Zhao L, Cao X, Zheng W, Wang Q, Yang F (2015) Endogenous minerals have influences on surface electrochemistry and ion exchange properties of biochar. Chemosphere 136:133-139
Zhao Q, Xu Z, Yu Z (2021) Straw-derived biochar as the potential adsorbent for U(VI) and Th(IV) removal in aqueous solutions. Biomass Convers Biorefinery 13:15707-15718
Zheng X, Xu W, Dong J, Yang T, Shangguan Z, Qu J, Li X, Tan X (2022) The effects of biochar and its applications in the microbial remediation of contaminated soil: a review. J Hazard Mater 438:129557
Zhou P, Gu B (2005) Extraction of oxidized and reduced forms of uranium from contaminated soils: effects of carbonate concentration and pH. Environ Sci Technol 39:4435-4440
Zhou Y, Xiao J, Hu R, Wang T, Shao X, Chen G, Chen L, Tian X (2020) Engineered phosphorous-functionalized biochar with enhanced porosity using phytic acid-assisted ball milling for efficient and selective uptake of aquatic uranium. J Mol Liq 303:112659
Zhu J, Wei R, Wang X, He D, Jiang X, Wang M, Yang Y, Yang L (2023a) Polyphosphate promotes oxidation resistance of ppk-expressing transgenic rice in low phosphorus culture. Plant Physiol Biochem 203:108006
Zhu K, Xian H, Peng L, Wang S, Chen C, Liu J (2023b) Adsorption performance and mechanism of
- Handling editor: Xing Yang
*Correspondence:
Li Chen
chenlixkd@163.com
Linchuan Fang
flinc629@hotmail.com
Full list of author information is available at the end of the article
DOI: https://doi.org/10.1007/s42773-024-00308-3
Publication Date: 2024-03-01
Biochar-mediated remediation of uranium-contaminated soils: evidence, mechanisms, and perspectives
Abstract
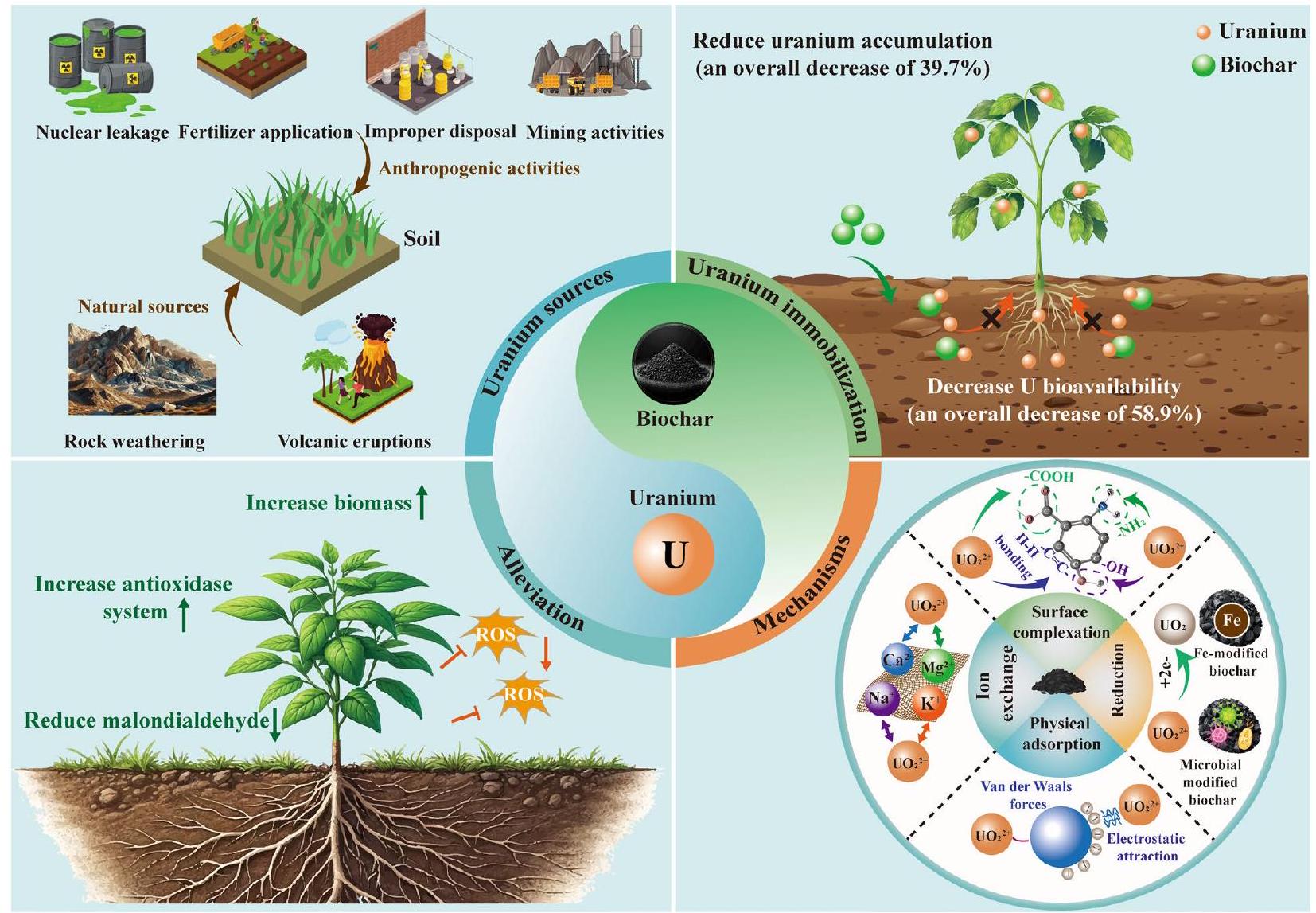
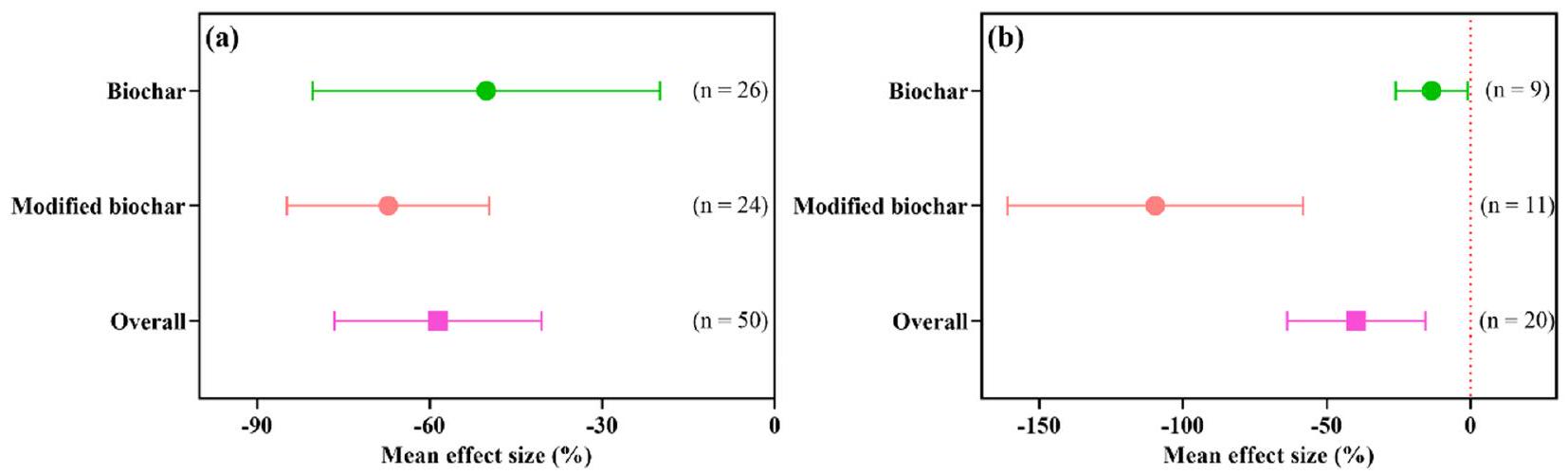
Soil contamination by uranium presents a burgeoning global environmental concern, exerting detrimental effects on both agricultural production and soil health. Biochar, a carbonaceous material derived from biomass pyrolysis, exhibits considerable potential for remediating uranium-contaminated soils. However, a comprehensive review of the effects of biochar on the fate and accumulation of uranium in soil-plant systems remains conspicuously absent. In this paper, uranium sources and contamination are reviewed, and the impact of biochar on uranium immobilization and detoxification in soil-plant systems is analyzed. We reviewed the status of uranium contamination in soils globally and found that mining activities are currently the main sources. Further meta-analysis revealed that biochar addition significantly reduced the soil uranium bioavailability and shoot uranium accumulation, and their effect value is
Highlights
- Biochar reduces uranium mobility through a variety of mechanisms, including surface complexation, reduction, ion exchange, and physical adsorption.
- Biochar significantly reduces uranium bioavailability in soil and limits its accumulation in plants.
- Modified biochar has been shown to enhance its effectiveness in immobilising uranium.
- Biochar application to soil not only promotes uranium remediation but also improves soil quality.
Graphical Abstract

1 Introduction
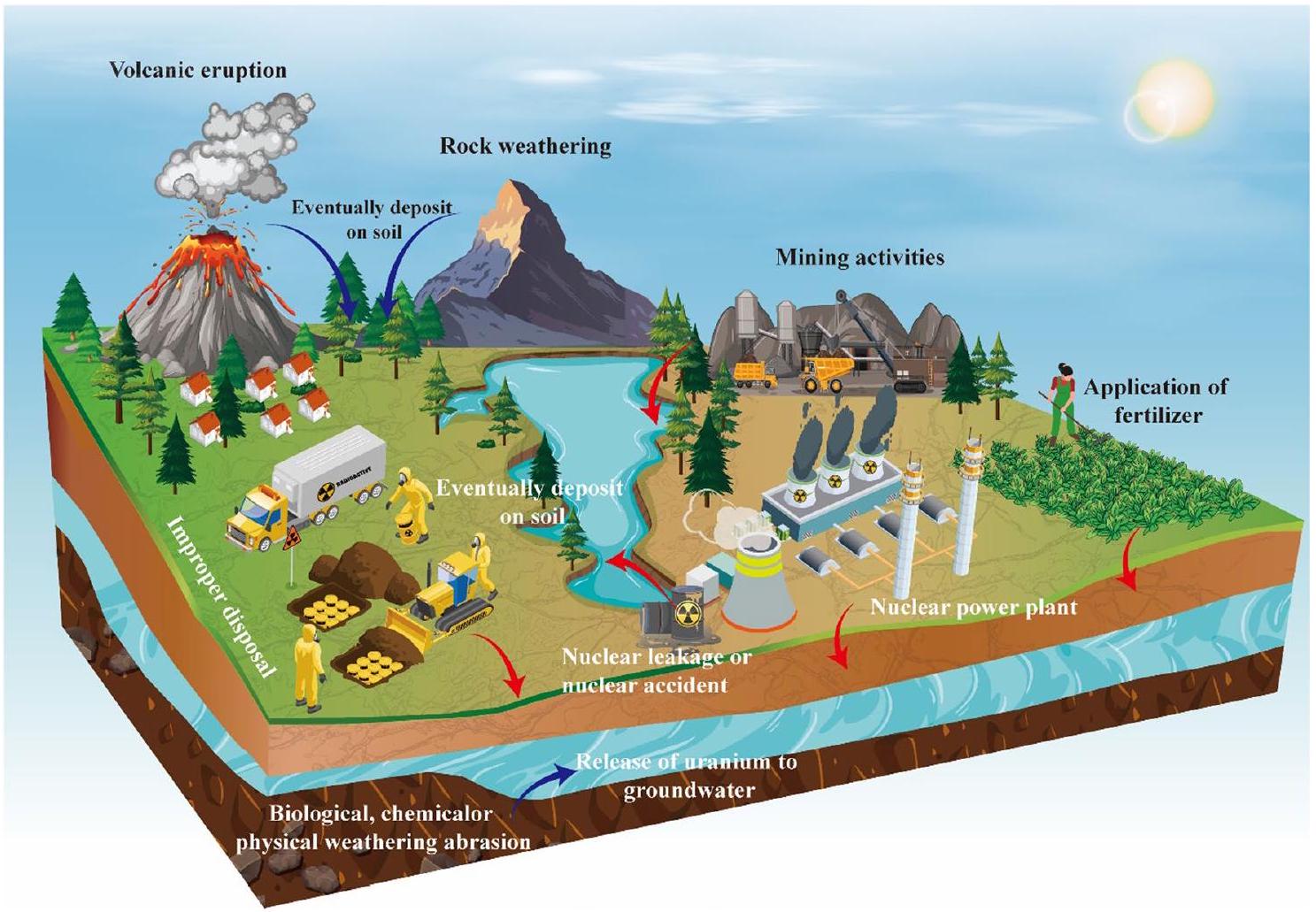
geochemical processes, anthropogenic activities, and natural weathering, all of which significantly impact soilplant systems over considerable distances (Pérez-Sánchez and Thorne 2014). Given its chemical and radiological toxicity, uranium poses significant risks to plant growth, agricultural productivity, and food safety (Srivastava et al. 2020). Furthermore, uranium accumulation by plants leads to its transfer along the food chain, ultimately affecting human health, with potential implications for cancer development at levels exceeding
Plants acquire uranium primarily through passive diffusion, facilitated transport, or active uptake mechanisms, which predominantly occur through the root system (Chen et al. 2021; Lai et al. 2021). Once absorbed, uranium can be transported to the aerial plant parts, potentially inducing toxicity and adverse effects on growth and development (Cui et al. 2023). Biochar plays a crucial role in preventing the migration of uranium in soil-plant
systems, thereby detoxifying uranium and mitigating its toxicity to plants (Qi et al. 2021; Yin et al. 2022). Detoxification protects plants from uranium-induced damage and mitigates the potential transfer of uranium along the food chain. Recent evidence has demonstrated the effectiveness of biochar in preventing uranium migration and detoxifying soil-plant systems (Qi et al. 2021; Liu et al. 2022c). For instance, biochar application to uraniumcontaminated land has led to a remarkable increase in plant production, highlighting the ability of biochar to alleviate uranium toxicity and enhance plant growth (Qi et al. 2022). The application of biochar provides the additional advantage of improving soil quality and fertility by improving its physical, chemical, and biological properties, thereby facilitating healthy plant growth (Khan et al. 2022; Mousavi et al. 2023). Biochar is produced from sustainable biomass sources, which enhances its environmental benefits. These combined strengths confirm that biochar is a promising and versatile solution for the remediation of uranium-contaminated soils.
2 Global status of uranium contaminations
2.1 Occurrence, existing forms, and sources
globally due to its pivotal role in nuclear power production (Cui et al. 2023). It is naturally and widely distributed in the Earth’s crust, surpassing the abundance of silver, mercury, and cadmium (Peng and Cao 2021). The reserves of uranium in oceans alone exceed the quantity found in the Earth’s crust by over a thousand times, amounting to approximately 4.5 billion tons (Endrizzi et al. 2016). Naturally occurring uranium comprises three isotopes: uranium-234, uranium-235, and ura-nium-238. Uranium-238 is the most abundant, accounting for approximately
uranium that is tightly bound and is less accessible to plants or other organisms (Huang et al. 2022; Wang et al. 2023). The residual fraction is typically composed of insoluble compounds, such as metal oxides or minerals, where uranium ions are strongly bound and less mobile. The reducible fraction of uranium, associated with iron and manganese oxides, typically remains stable. However, it can become mobile if these oxides dissolve in reducing environments such as waterlogged or anaerobic areas (Gao et al. 2021). Similarly, the oxidizable fraction of uranium, bound to organic matter and sulfide minerals, is ordinarily immobile. Nevertheless, its availability may increase due to the decomposition of organic matter or the oxidation of sulfide minerals (Peña et al. 2020). The uranium forms in the soil near a uranium mine in southeastern China are primarily in the residual fraction, whereas the soils in Oak Ridge are dominated by carbonate-bound fractions, and the soils surrounding abandoned uranium mines in Brazil are primarily in the oxidised fraction (Zhou and Gu 2005; Ouyang et al. 2019; Galhardi et al. 2020). The complex interactions between uranium and the surrounding matrix result in the mutual transformation of different uranium fractions through various reactions, including adsorption, desorption, precipitation, redox reaction and complex formation (Florez-Vargas et al. 2023).

2.2 Degree of pollution and the phenomenon of compound pollution
Moreover, the phenomenon of compound pollution should be taken into account. Uranium often coexists with other heavy metals. For example, Skipperud et al. (2013) reported that large quantities of tailings containing
reported that the average contents of
3 Effects of biochar application on uranium immobilisation in soils
| Sources | Location | Uranium content/
|
References |
| Natural sources | Chile | 0.79 | (Cabral Pinto et al. 2014) |
| Natural sources | Germany | 1.9 | (Utermann and Fuchs 2008) |
| Natural sources | Switzerland | 2.25 | (Bigalke et al. 2017) |
| Natural sources | England | 2.6 | (Vodyanitskii 2011) |
| Natural sources | Japan | 1.74 | (Sahoo et al. 2011) |
| Natural sources | USA | 3.5 | (Bern et al. 2019) |
| Natural sources | Poland | 0.79 | (Vodyanitskii 2011) |
| Natural sources | Europe | 2.46 | (Plant et al. 2003) |
| Natural sources | Canada | 1.2 | (Vodyanitskii 2011) |
| Natural sources | China | 3.13 | (Xu et al. 1993) |
| Mining activities | Portugal | 92.1 | (Neiva et al. 2019) |
| Mining activities | Romania | 64.5 | (Pehoiu et al. 2019) |
| Mining activities | Germany | 29.9 | (Gramss and Voigt 2016) |
| Mining activities | Bulgaria | 27.2 | (Boteva et al. 2016) |
| Mining activities | Australia | 59.0 | (Costelloe 2005) |
| Mining activities | China | 34.7 | (Wang et al. 2019a) |
| Fertilizer use | Fujisaka Branch (Japan) | 2.0 | (Takeda et al. 2006) |
| Fertilizer use | Whatawhata (New Zealand) | 2.80 | (Schipper et al. 2011) |
| Fertilizer use | Johnstown Castle (Ireland) | 1.81 | (Tunney et al. 2009) |
| Nuclear leakage | Hanford (USA) | 206 | (Um et al. 2010) |
| Nuclear technology | Ajka | 9.32 | (Papp et al. 2002) |
| Nuclear technology | Taiwan (China) | 2.81 | (Tsai et al. 2008) |
| Nuclear technology | Jordan | 253 | (Alsabbagh and Abuqudaira 2017) |

parts of plants. For instance, a recent study observed that the application of
uranium remediation. The modified biochar exhibited a greater capacity to reduce exchangeable uranium in soil (
charge distribution, enhancing its ability to interact with uranium. Moreover, biological methods may include the use of microorganisms to modify the biochar’s surface properties, further increasing its functionality and specificity towards uranium (Qi et al. 2022). These modifications expand the biochar’s adsorption capacity, ion exchange ability, and interaction with uranium, thus contributing to the observed improvement in remediation (Yin et al. 2022). It was discovered that the addition of phosphorus-modified bamboo biochar (PBC) crosslinked with magnesium-aluminium layered doublehydroxide (LDH) composite (“PBC@LDH”) resulted in a 54% reduction in the uranium leaching efficiency (Lyu et al. 2021a). The PBC@LDH composite exhibited strong affinity for uranium, effectively minimising uranium leaching and safeguarding groundwater quality. The scanning electron microscopy images before and after biochar modification are shown in Fig. 3. We have observed that most of the stomates on the surface of the unmodified (Fig. 3a) biochar were blocked by its flaky structure,

Besides its direct uranium immobilisation capabilities, biochar has been shown to enhance soil health and fertility by improving soil pH , organic matter content, and cation exchange capacity (Singh et al. 2022; Li et al. 2023b; Yang et al. 2023c). Moreover, biochar positively influences soil microbial communities, creating conditions conducive to the growth of beneficial microorganisms (Yang et al. 2023b). This, in turn, enhances soil nutrient cycling and plays a crucial role in uranium immobilisation (Dai et al. 2021b). Biochar improves soil pH because of its alkaline nature, which reduces uranium availability in soils (Yang et al. 2023a). Organic matter in the soil has a high capacity to adsorb uranium owing to the presence of functional groups. Therefore, an increased organic matter content in soil is beneficial for uranium immobilisation. In a recent study, it was discovered that the mixed bacteria-loaded biochar application to soil altered the microenvironment by increasing the soil organic matter, cation exchange capacity, fluorescein diacetate hydrolysis activity, and dehydrogenase activity (Qi et al. 2022). The mixed bacteria-loaded biochar significantly decreased the availability of uranium and Cd in soil by
stover, herbal residue, cow manure, distiller’s grains, and sugarcane bagasse-on uranium availability in soil. It was found that biochar derived from corn stover significantly reduced uranium availability, with a
4 Inner mechanisms of uranium immobilisation by biochar
4.1 Surface complexation

outer-sphere complexation is characterised by electrostatic interactions between the adsorbate and mineral surface (Yi et al. 2023). This adsorption mechanism, also known as physisorption, involves the hydration shells of water molecules forming a barrier between the adsorbate and adsorbent. Outer-sphere complexes are generally weak and reversible. Therefore, surface complexation typically refers to inner-sphere complexation (Alam et al.
| Adsorbent | Feedstock | Pyrolysis temperature/
|
|
Adsorption isotherms | Mechanism | References |
| Biochar | Rice straw | 700 | 7.14 | Langmuir, Freundlich, Temkin, and D-R | Inner-sphere surface complexation | (Dong et al. 2017) |
| Bamboo shoot shell | 500 | 34.9 | Langmuir | Surface complexation and the cation-
|
(Hu et al. 2018a) | |
| Salvadora persica branches | 400 | 85.7 | Langmuir and Temkin | Chemical adsorption | (Albayari et al. 2021) | |
| Eucalyptus Wood | 400 | 27.2 | Langmuir | Surface complexation | (Mishra et al. 2017) | |
| Cellulose-rich pakchoi | 300 | 46.6 | – | Surface complexation | (Feng et al. 2022) | |
| Lignin-rich corncob | 35.6 | |||||
| Residual sludge | 250 | 55.3 | Langmuir | Electrostatic attraction and the complexation | (Zou et al. 2023) | |
| Wheat straws | 400 | 399 | Langmuir, Freundlich | Electrostatic attraction and inner-sphere surface complexation | (Zhao et al. 2021) | |
| Pig manure | 500 | 376 | Langmuir | Electrostatic attraction and the complexation | (Liao et al. 2022c) | |
| Water hyacinth | 400 | 157 | Langmuir | Surface complexation | (Xu et al. 2020) | |
| Phytic acid-modified biochar | Aloe vera | 500 | 272 | Langmuir Freundlich | Surface complexation | (Wang et al. 2022) |
| Citric acid-modified biochar | Reed straw | 200 | 37.1 | Langmuir | Surface complexation | (Liu et al. 2022b) |
| luffa rattan | 200 | 434 | Langmuir | Electrostatic interaction, complexation and physical adsorption | (Ye et al. 2020) | |
| Biochar | Pig manure | 500 | 369 | Langmuir | (Liao et al. 2022a) | |
| HCl-modified biochar | 53.3 | Electrostatic interaction, Surface complexation | ||||
| NaOH-modified biochar | 952 | |||||
|
|
Luffa cylindrica | 650 | 92.0 | Langmuir | Inner-sphere surface complexation | (Liatsou et al. 2017) |
| Biochar | Wheat straw | 450 | 8.71 | Langmuir | (Jin et al. 2018) | |
|
|
355 | Electrostatic interaction, complexation | ||||
| Biochar | Cow manure | 64.0 | ||||
|
|
73.3 | |||||
| Acetic acid-modified biochar | Sludge | 300-700 | 178 | Langmuir | Complexation | (Yu et al. 2022) |
| Phytic acid-modified biochar | Typha angustifolia | 500 | 128.5 | Langmuir | Electrostatic interaction, complexation | (Zhou et al. 2020) |
| Phosphate-modified biochar | Bamboo | 170 | 781 | Langmuir | Electrostatic interaction, complexation | (Chen et al. 2023b) |
| Phosphate-functionalized biochars | Bamboo sawdust | 450 | 229 | Langmuir | Electrostatic interaction, complexation | (Hu et al. 2020) |
|
|
Sewage sludge | 600 | 149.1 | Langmuir | Complexation, ion exchange, reduction and electrostatic attraction | (Mo et al. 2021) |
|
|
Citrullus lanatus L. seeds | 350 | 27.6 | Langmuir | Surface complexation | (Ahmed et al. 2021a) |
| Adsorbent | Feedstock | Pyrolysis temperature/
|
|
Adsorption isotherms | Mechanism | References |
| Magnetic biochar | Tribulus terrestris | 500 | 17.2 | Freundlich | Surface complexation | (Ahmed et al. 2021b) |
| Rice husk | 550 | 52.6 | Langmuir | Surface complexation, reduction | (Li et al. 2019a) | |
| Natural hydrophyte biomass | 700 | 54.3 | Langmuir | Inner-sphere coordination and reduction | (Hu et al. 2018b) | |
| Cow manure | 500 | 662 | Langmuir | Surface complexation, reduction and electrostatic attraction | (Liao et al. 2022e) | |
| Watermelon rinds | 500 | 323 | Langmuir | Complexation, ion exchange, and electrostatic attraction | (Lingamdinne et al. 2022) | |
| Microcystis aeruginosa | 200 | 52.1 | Freundlich | Complexation | (Wang et al. 2020) | |
| Oxidized biochar | Rice straw | 500 | 242 | Langmuir | Inner-sphere surface complexation | (Ahmed et al. 2021c) |
| Palm tree fibres | 650 | 112 | Langmuir | Inner-sphere surface complexation | (Stasi et al. 2022) | |
| Thermal air oxidation biochar | Corn cob | 500 | 96.7 | Langmuir | Physical adsorption, surface complexation, electrostatic attraction and precipitation | (Dai et al. 2020) |
| Sludge | 600 | 490 | Langmuir | Complexation reduction | (Sun et al. 2022) | |
| Disulfide/biochar composite | Wheat husk | 600 | 451 | Langmuir | Chemical adsorption, electrostatic attraction, surface complexation | (Zhu et al. 2023b) |
| Biochar-supported nano zerovalent iron | Starch | 900 | 55.1 | Langmuir | Complexation | (Zhang et al. 2019a) |
| Biochar supported sulfurized nanoscale zero-valent iron | Dictyophora indusiata | 180 | 300 | Langmuir | Complexation and reduction | (Pang et al. 2022) |
| MgO/biochar composite | Pine sawdust | 500 | 514 | Langmuir | Surface complexation | (Chen et al. 2022b) |
| Orange peel | 250 | 246 | Sips and RedlichPeterson | Inner-sphere surface complexation | (Ying et al. 2020) | |
| Nanoscale iron sulfide biochar composites | Peanut shell | 250 | 76.3 | Freundlich | Electrostatic attraction, surface complexation, precipitation, and reductive reaction | (Liu et al. 2021b) |
| Fe-Mn biochar composite | Tea waste | 600 | 492 | Langmuir and Red lichPeterson | Surface complexation,
|
(Liu et al. 2021a) |
| Biochar-Magnesium Silicate composite | Orange waste | 650 | 352 | Langmuir | Surface complexation | (Narasimharao et al. 2023) |
the formation of strong and stabilising complexes with uranyl ions (Dai et al. 2021a; Wu et al. 2022a; Gan et al. 2023; Li et al. 2023a). Ahmed et al (2021a) demonstrated the importance of -COOH and -OH groups in the sorption of uranyl ions onto biochar surface, indicating the presence of these groups significantly influences the sorption capacity. Similarly, Fu et al (2022) confirmed the important role of -COOH and -OH groups in the formation of complex surface bonds, effectively which effectively reduces the mobility and bioavailability of uranium in the soil. Additionally, though the literature is limited, some reports indicated the involvement of aromatic groups in the complexation process through the formation of
intricacies at the biochar-uranyl interface (Liu et al. 2023b). A comprehensive investigation using these methods determined that uranium mainly adhered to the biochar surface via carboxyl and phenolic hydroxyl groups that were reactive to protons, suggesting the presence of both inner- and outer-sphere complexation (Alam et al. 2018). These methodologies provide important evidence that highlights the crucial role of surface functional groups in uranium immobilisation (Hu et al. 2018b).
4.2 Reduction reactions
that biochar application can enhance microbial reduction ability (Rushimisha et al. 2022; Wu et al. 2022b; Dong et al. 2023). The interaction between microorganisms and biochar for uranium reduction is influenced by various factors: (i) biochar as a microbial shelter: biochar plays a crucial role in complex soil, functioning as a shelter for microbes, thus considerably contributing to uranium reduction (Zheng et al. 2022). The porous structure of biochar facilitates both microbial colonisation and growth by providing an extensive surface area and an interconnected pore network, creating an optimal environment for microbial habitation (Li et al. 2022). Frankel et al. (2016) demonstrated that biochar application substantially increased microbial biomass and activity, providing evidence for the role of biochar as a microbial shelter. This shelter not only provides a suitable habitat for microbes but also catalyses their remediation activities, ultimately leading to the reduction and immobilisation of uranium (Arshad et al. 2017); (ii) Biochar-mediated soil improvement: biochar application enhances the inherent soil properties, building a favourable environment for microbial activity (Wei et al. 2023). This was accomplished by enriching the soil with essential nutrients, such as potassium and phosphorus, thus stimulating the growth of microorganisms (Limwikran et al. 2018). Furthermore, biochar improved soil cation exchange capacity and water retention, creating a favourable environment for microbes, thereby considerably contributing to uranium reduction and immobilisation (Tan et al. 2022). (iii) Biochar as an Electron Shuttle: Enriched with carbon, biochar exhibits characteristics similar to those of electron shuttles. A previous study suggested two unique electron shuttle pathways related to biochar, namely “geo-battery” and “geo-conductor” (Sun et al. 2017). The former relies on the surface functionality of the biochar, which can store and release electrons, thereby facilitating redox reactions in the soil (Hou et al. 2022). One gram of biochar can store and utilise as much as 2 mM of electrons for redox reactions in soil (Klüpfel et al. 2014). The geo-conductor pathway is attributed to the high conductivity of biochar due to its carbon structure, which supports direct electron transfer (Sun et al. 2017). These unique characteristics contribute to the role of biochar as an electron shuttle during a wide range of biogeochemical processes. The interaction of biochar with reducing microorganisms establishes an ongoing electron exchange between microorganisms and metal ions, encouraging redox reactions, and ultimately resulting in uranium immobilisation (Yu et al. 2023). Ren et al. (2023) revealed that the oxido-reductively active segment of biochar, predominantly the component containing oxygen, serves as a potent electron shuttle agent in microbial reduction processes, effectively facilitating
chromium ( Cr ) reduction in soil. Notably, chromium is similar to the polyvalent metal ions in uranium, which suggests potential analogous processes. Ding et al. (2018) supported this perspective by showing that biocharsupported microorganisms accelerate the reduction of uranium from U(VI) to U(IV), accompanied by mineral coprecipitation. Overall, microbial modification of biochar provides an effective approach for uranium(VI) reduction, with promising prospects for remediating U-contaminated environments.
4.3 Ion exchange
4.4 Physical adsorption
4.5 Other mechanisms
precipitation reaction (Liao et al. 2022d). In these biochar, phosphate ions can chemically react with uranyl ions adsorbed on their surfaces (Ruan et al. 2022). Such reactions lead to the formation of uranium phosphate minerals, notably autunite
5 Effect of biochar application on uranium accumulation and toxicity in plants
5.1 Biochar reduced uranium uptake by plants

However, it is important to note that the effectiveness of biochar in reducing uranium accumulation in plants varies depending on various factors. As previously stated, key determinants of biochar efficacy are its type and properties, including the feedstock used in its production, pyrolysis temperature, and modification method. The inherent properties of the soil in which biochar is applied also influence its functionality (Boghi et al. 2018). Taskin et al. (2019) found that the addition of biochar to calcareous soil did not reduce the uranium content in soybeans. This observation may be attributed to the formation of highly mobile anionic complexes between
physiological and metabolic responses to uranium and biochar. Tomatoes andkohlrabi may exclude uranium, whereas cucumbers and radishes may accumulate uranium in their tissues, thereby posing a risk to the food chain (Hou et al. 2018). Subsequent research explored the effect of biochar on reducing uranium accumulation in vegetables and found that its effectiveness was species-dependent (Qi et al. 2022). The finding indicated that the order of enrichment in the above-ground parts was Brassica chinensis L. >Apium graveolens L. > Lycopersicon esculentum Mill in biochar-treated contaminated soil. Overall, the application of biochar can be regarded as a promising and environmentally friendly approach for mitigating uranium accumulation in plants and promoting safe agricultural production on uranium-contaminated lands. However, a more comprehensive assessment of their potential and limitations is necessary to improve our understanding of their efficacy in environmental remediation.
5.2 Biochar inhibited root-shoot transport of uranium
with endogenous phosphate residues, resulting in precipitation and fixation within plant organs, thereby preventing their translocation from the roots to the leaves (Laurette et al. 2012). This regulation can significantly minimise the potential phytotoxic effects associated with uranium accumulation, thereby promoting the survival and well-being of plants in uranium-contaminated environments (Wang et al. 2019b). This transportation is modulated by various parameters, including soluble uranium concentrations in the soil (Vandenhove et al. 2007), expression levels of transporter genes in plants (John et al. 2022), and external environmental conditions (Mertens et al. 2022). In the presence of uranium, transporter genes (IRT1, FRO2, and FIT1) and calcium transporter CAX7 in Arabidopsis thaliana, for instance, have been observed to be affected, and external calcium inhibits uranium accumulation in roots (Doustaly et al. 2014; Mertens et al. 2022; Sarthou et al. 2022). The addition of biochar to the soil has a significant influence on this transport process. Yin et al. (2022), for instance, discovered that the TF of uranium for phosphorus-modified bamboo biochar treatments decreased by
5.3 Biochar alleviated uranium phytotoxicity
stress, thereby indicating its potential in alleviating such stress-induced damage (Zhang et al. 2019b). Plants have a defence system to cope with ROS, which includes various antioxidant enzymes that mitigate the deleterious effects of oxidative stress (Han et al. 2023). Biochar application improves plant tolerance to abiotic stress by increasing antioxidant activity (Irshad et al. 2020). Biochar application enhances antioxidant activities in plants by increasing the content of antioxidant enzymes such as superoxide dismutase (SOD), peroxidase (POD), catalase (CAT), and ascorbate peroxidase (APX) (Rizwan et al. 2018). SOD mitigates superoxide radicals, whereas POD and CAT catalyse the breakdown of hydrogen peroxide, thereby reducing potential oxidative damage. APX utilises ascorbate to detoxify peroxides (Zhu et al. 2023a). By significantly increasing antioxidant activity, biochar improves plant tolerance to abiotic stress and promotes overall plant health and productivity.
6 Concluding remarks and future perspectives
Supplementary Information
Acknowledgements
Author contributions
Funding
Availability of data and materials
Declarations
Competing interests
Author details
February 2024
Published online: 01 March 2024
References
Ahmed W, Mehmood S, Núñez-Delgado A, Ali S, Qaswar M, Khan ZH, Ying H, Chen D-Y (2021a) Utilization of Citrullus lanatus L. seeds to synthesize a novel MnFe2O4-biochar adsorbent for the removal of U(VI) from wastewater: Insights and comparison between modified and raw biochar. Sci Total Environ 771:144955
Ahmed W, Mehmood S, Núñez-Delgado A, Qaswar M, Ali S, Ying H, Liu Z, Mahmood M, Chen D-Y (2021b) Fabrication, characterization and U(VI) sorption properties of a novel biochar derived from Tribulus terrestris via two different approaches. Sci Total Environ 780:146617
Ahmed W, Mehmood S, Qaswar M, Ali S, Khan ZH, Ying H, Chen D-Y, NúñezDelgado A (2021c) Oxidized biochar obtained from rice straw as adsorbent to remove uranium (VI) from aqueous solutions. J Environ Chem Eng 9:105104
Ahmed W, Núñez-Delgado A, Mehmood S, Ali S, Qaswar M, Shakoor A, Chen D-Y (2021d) Highly efficient uranium (VI) capture from aqueous solution by means of a hydroxyapatite-biochar nanocomposite: adsorption behavior and mechanism. Environ Res 201:111518
Akash S, Sivaprakash B, Raja VCV, Rajamohan N, Muthusamy G (2022) Remediation techniques for uranium removal from polluted environ-ment-review on methods, mechanism and toxicology. Environ Pollut 302:119068
Alam MS, Gorman-Lewis D, Chen N, Safari S, Baek K, Konhauser KO, Alessi DS (2018) Mechanisms of the removal of U(VI) from aqueous solution using biochar: a combined spectroscopic and modeling approach. Environ Sci Technol 52:13057-13067
Albayari M, Nazal MK, Khalili Fl, Nordin N, Adnan R (2021) Biochar derived from Salvadora persica branches biomass as low-cost adsorbent for removal of uranium(VI) and thorium(IV) from water. J Radioanal Nucl Chem 328:669-678
Alsabbagh AH, Abuqudaira TM (2017) Phytoremediation of Jordanian uranium-rich soil using sunflower. Water Air Soil Pollut 228:219
An K, Wang Z, Yang X, Qu Z, Sun F, Zhou W, Zhao H (2022) Reasons of low formaldehyde adsorption capacity on activated carbon: multi-scale simulation of dynamic interaction between pore size and functional groups. J Environ Chem Eng 10:108723
Antunes SC, Pereira R, Marques SM, Castro BB, Gonçalves F (2011) Impaired microbial activity caused by metal pollution: a field study in a deactivated uranium mining area. Sci Total Environ 410-411:87-95
Ao M, Chen X, Deng T, Sun S, Tang Y, Morel JL, Qiu R, Wang S (2022) Chromium biogeochemical behaviour in soil-plant systems and remediation strategies: a critical review. J Hazard Mater 424:127233
Arshad M, Khan AHA, Hussain I, Badar uz Z, Anees M, Iqbal M, Soja G, Linde C, Yousaf S (2017) The reduction of chromium (VI) phytotoxicity and phytoavailability to wheat (Triticum aestivum L.) using biochar and bacteria. Appl Soil Ecol 114:90-98
Ashry A, Bailey EH, Chenery SRN, Young SD (2016) Kinetic study of timedependent fixation of U(VI) on biochar. J Hazard Mater 320:55-66
Azeem M, Shaheen SM, Ali A, Jeyasundar PGSA, Latif A, Abdelrahman H, Li R, Almazroui M, Niazi NK, Sarmah AK, Li G, Rinklebe J, Zhu Y-G, Zhang Z (2022) Removal of potentially toxic elements from contaminated soil and water using bone char compared to plant- and bone-derived biochars: a review. J Hazard Mater 427:128131
Bern CR, Walton-Day K, Naftz DL (2019) Improved enrichment factor calculations through principal component analysis: examples from soils near breccia pipe uranium mines, Arizona, USA. Environ Pollut 248:90-100
Bigalke M, Ulrich A, Rehmus A, Keller A (2017) Accumulation of cadmium and uranium in arable soils in Switzerland. Environ Pollut 221:85-93
Boteva S, Radeva G, Traykov I, Kenarova A (2016) Effects of long-term radionuclide and heavy metal contamination on the activity of microbial communities, inhabiting uranium mining impacted soils. Environ Sci Pollut Res 23:5644-5653
Cabral Pinto MMS, Ferreira da Silva EA, Silva MMVG, Dinis PA (2014) Estimated background values maps of uranium in Santiago island topsoil and stream sediments. Procedia Earth Planet Sci 8:23-27
Chen L, Liu J, Zhang W, Zhou J, Luo D, Li Z (2021) Uranium (U) source, speciation, uptake, toxicity and bioremediation strategies in soil-plant system: a review. J Hazard Mater 413:125319
Chen L, Wang J, Beiyuan J, Guo X, Wu H, Fang L (2022a) Environmental and health risk assessment of potentially toxic trace elements in soils near uranium (U) mines: a global meta-analysis. Sci Total Environ 816:151556
Chen W, Feng J, Liu S, Zhang J, Cai Y, Lv Z, Fang M, Tan X (2022b) A green and economical MgO/biochar composite for the removal of U(VI) from aqueous solutions. Chem Eng Res Des 180:391-401
Chen L, Wang F, Zhang Z, Chao H, He H, Hu W, Zeng Y, Duan C, Liu J, Fang L (2023a) Influences of arbuscular mycorrhizal fungi on crop growth and potentially toxic element accumulation in contaminated soils: a metaanalysis. Crit Rev Environ Sci Technol 53:1795-1816
Chen X, Wang Y, Xia H, Ren Q, Li Y, Xu L, Xie C, Wang Y (2023b) “One-can” strategy for the synthesis of hydrothermal biochar modified with phosphate groups and efficient removal of uranium(VI). J Environ Radioact 263:107182
Costelloe BGLPMAMT. 2005. Contaminant dispersion at the rehabilitated Mary Kathleen uranium mine, Australia.
Cui Q, Zhang Z, Beiyuan J, Cui Y, Chen L, Chen H, Fang L (2023) A critical review of uranium in the soil-plant system: Distribution, bioavailability, toxicity, and bioremediation strategies. Crit Rev Environ Sci Technol 53:340-365
Dai L, Li L, Zhu W, Ma H, Huang H, Lu Q, Yang M, Ran Y (2020) Post-engineering of biochar via thermal air treatment for highly efficient promotion of uranium(VI) adsorption. Biores Technol 298:122576
Dai L, Lu Q, Zhou H, Shen F, Liu Z, Zhu W, Huang H (2021a) Tuning oxygenated functional groups on biochar for water pollution control: a critical review. J Hazard Mater 420:126547
Dai Z, Xiong X, Zhu H, Xu H, Leng P, Li J, Tang C, Xu J (2021b) Association of biochar properties with changes in soil bacterial, fungal and fauna communities and nutrient cycling processes. Biochar 3:239-254
Dhir B (2021) Effective removal of radioactive waste from environment using plants. In: Prasad R (ed) Phytoremediation for environmental sustainability. Springer Nature Singapore, Singapore, pp 71-82
Ding L, Tan W-f, Xie S-b, Mumford K, Lv J-w, Wang H-q, Fang Q, Zhang X-w, Wu X-y, Li M (2018) Uranium adsorption and subsequent re-oxidation under aerobic conditions by Leifsonia sp.-coated biochar as green trapping agent. Environ Pollut 242:778-787
Dong L, Yang J, Mou Y, Sheng G, Wang L, Linghu W, Asiri AM, Alamry KA (2017) Effect of various environmental factors on the adsorption of
Dong H, Coffin ES, Sheng Y, Duley ML, Khalifa YM (2023) Microbial reduction of
Doustaly F, Combes F, Fiévet JB, Berthet S, Hugouvieux V, Bastien O, Aranjuelo I, Leonhardt N, Rivasseau C, Carrière M, Vavasseur A, Renou J-P, Vandenbrouck Y, Bourguignon J (2014) Uranium perturbs signaling and iron uptake response in Arabidopsis thaliana roots. Metallomics 6:809-821
Duquène L, Vandenhove H, Tack F, Van Hees M, Wannijn J (2010) Diffusive gradient in thin FILMS (DGT) compared with soil solution and labile uranium fraction for predicting uranium bioavailability to ryegrass. J Environ Radioact 101:140-147
Endrizzi F, Leggett CJ, Rao L (2016) Scientific basis for efficient extraction of uranium from seawater. I: understanding the chemical speciation of uranium under seawater conditions. Ind Eng Chem Res 55:4249-4256
Fahad SA, Nawab MS, Shaida MA, Verma S, Khan MU, Siddiqui V, Naushad M, Saleem L, Farooqi IH (2023) Carbon based adsorbents for the removal of
Florez-Vargas O, Vilanova E, Alcaide C, Henao JA, Villarreal-Jaimes CA, MedinaPérez OM, Rodriguez-Villamizar LA, Idrovo AJ, Sánchez-Rodríguez LH (2023) Geological context and human exposures to element mixtures in mining and agricultural settings in Colombia. Sci Total Environ 898:165632
Frankel ML, Bhuiyan TI, Veksha A, Demeter MA, Layzell DB, Helleur RJ, Hill JM, Turner RJ (2016) Removal and biodegradation of naphthenic acids by biochar and attached environmental biofilms in the presence of cocontaminating metals. Biores Technol 216:352-361
Fu H, Wang S, Zhang H, Dai Z, He G, Li G, Ding D (2022) Remediation of uranium-contaminated acidic red soil by rice husk biochar. Environ Sci Pollut Res 29:77839-77850
Galhardi JA, de Mello JWV, Wilkinson KJ (2020) Bioaccumulation of potentially toxic elements from the soils surrounding a legacy uranium mine in Brazil. Chemosphere 261:127679
Gan J, Zhang L, Wang Q, Xin Q, Hu E, Lei Z, Wang H, Wang H (2023) Synergistic action of multiple functional groups enhanced uranium extraction from seawater of porous phosphorylated chitosan/coal-based activated carbon composite sponge. Desalination 545:116154
Ganguly S, Bhan U (2023) Occurrences and mobility of uranium in soil profile due to groundwater-soil interaction. Hydrogeochem Aqua Ecosyst. https://doi.org/10.1002/9781119870562.ch8
Gao N, Huang Z, Liu H, Hou J, Liu X (2019) Advances on the toxicity of uranium to different organisms. Chemosphere 237:124548
Gao L, Li R, Liang Z, Wu Q, Yang Z, Li M, Chen J, Hou L (2021) Mobilization mechanisms and toxicity risk of sediment trace metals (
Gramss G, Voigt K-D (2016) Gradual accumulation of heavy metals in an industrial wheat crop from uranium mine soil and the potential use of the herbage. Agriculture 6:51
Guilhen SN, Mašek O, Ortiz N, Izidoro JC, Fungaro DA (2019) Pyrolytic temperature evaluation of macauba biochar for uranium adsorption from aqueous solutions. Biomass Bioenerg 122:381-390
Guilhen SN, Rovani S, Araujo LGd, Tenório JAS, Mašek O (2021) Uranium removal from aqueous solution using macauba endocarp-derived biochar: effect of physical activation. Environ Pollut 272:116022
Guo L, Peng L, Li J, Zhang W, Shi B (2023) Superefficient separation of Th(IV) and
Han L, Gu H, Lu W, Li H, Peng W-x, Ling Ma N, Lam SS, Sonne C (2023) Progress in phytoremediation of chromium from the environment. Chemosphere 344:140307
Hilpmann S, Rossberg A, Steudtner R, Drobot B, Hübner R, Bok F, Prieur D, Bauters S, Kvashnina KO, StumpfT, Cherkouk A (2023) Presence of uranium(V) during uranium(VI) reduction by Desulfosporosinus hippei DSM 8344T. Sci Total Environ 875:162593
Hong EY, Wan Z, Kim Y, Yu J (2022) Submerged zone and vegetation drive distribution of heavy metal fractions and microbial community structure: Insights into stormwater biofiltration system. Sci Total Environ 853:158367
Hou J, Wang C, Zhou Y, Li S, Hayat T, Alsaedi A, Wang X (2018) Effects of uranium stress on physiological and biochemical characteristics in seedlings of six common edible vegetables. J Radioanal Nucl Chem 316:1001-1010
Hou N, Li X, Jiang X, Zhang N, Wang R, Li D (2022) The role of biochar in the photocatalytic treatment of a mixture of
Hu H, Zhang X, Wang T, Sun L, Wu H, Chen X (2018a) Bamboo (Acidosasa longiligula) shoot shell biochar: its potential application to isolation of uranium(VI) from aqueous solution. J Radioanal Nucl Chem 316:349-362
Hu Q, Zhu Y, Hu B, Lu S, Sheng G (2018b) Mechanistic insights into sequestration of
Hu R, Xiao J, Wang T, Chen G, Chen L, Tian X (2020) Engineering of phosphatefunctionalized biochars with highly developed surface area and
porosity for efficient and selective extraction of uranium. Chem Eng J 379:122388
Huang M, Zhou M, Li Z, Ding X, Wen J, Jin C, Wang L, Xiao L, Chen J (2022) How do drying-wetting cycles influence availability of heavy metals in sediment? A perspective from DOM molecular composition. Water Res 220:118671
Huang F, Hu J, Chen L, Wang Z, Sun S, Zhang W, Jiang H, Luo Y, Wang L, Zeng Y, Fang L (2023) Microplastics may increase the environmental risks of Cd via promoting Cd uptake by plants: a meta-analysis. J Hazard Mater 448:130887
Huang F, Li Z, Yang X, Liu H, Chen L, Chang N, He H, Zeng Y, Qiu T, Fang L (2024) Silicon reduces toxicity and accumulation of arsenic and cadmium in cereal crops: a meta-analysis, mechanism, and perspective study. Sci Total Environ 918:170663
Irshad MK, Noman A, Alhaithloul HAS, Adeel M, Rui Y, Shah T, Zhu S, Shang
Janu R, Mrlik V, Ribitsch D, Hofman J, Sedláček P, Bielská L, Soja G (2021) Biochar surface functional groups as affected by biomass feedstock, biochar composition and pyrolysis temperature. Carbon Resour Convers 4:36-46
Ji W, Parameswarappa Jayalakshmamma M, Abou Khalil C, Zhao L, Boufadel M (2020) Removal of hydrocarbon from soils possessing macroheterogeneities using electrokinetics and surfactants. Chem Eng J Adv 4:100030
Jin J, Li S, Peng X, Liu W, Zhang C, Yang Y, Han L, Du Z, Sun K, Wang X (2018)
John WA, Lückel B, Matschiavelli N, Hübner R, Matschi S, Hoehenwarter W, Sachs S (2022) Endocytosis is a significant contributor to uranium(VI) uptake in tobacco (Nicotiana tabacum) BY-2 cells in phosphate-deficient culture. Sci Total Environ 823:153700
Kanwar P, Mina U, Thakur IS, Srivastava S (2023) Heavy metal phytoremediation by the novel prospect of microbes, nanotechnology, and genetic engineering for recovery and rehabilitation of landfill site. Bioresour Technol Rep 23:101518
Kasera N, Kolar P, Hall SG (2022) Nitrogen-doped biochars as adsorbents for mitigation of heavy metals and organics from water: a review. Biochar 4:17
Khan Z, Fan X, Khan MN, Khan MA, Zhang K, Fu Y, Shen H (2022) The toxicity of heavy metals and plant signaling facilitated by biochar application: implications for stress mitigation and crop production. Chemosphere 308:136466
Klüpfel L, Keiluweit M, Kleber M, Sander M (2014) Redox properties of plant biomass-derived black carbon (biochar). Environ Sci Technol 48:5601-5611
Kumar S, Loganathan VA, Gupta RB, Barnett MO (2011) An Assessment of U(VI) removal from groundwater using biochar produced from hydrothermal carbonization. J Environ Manage 92:2504-2512
Kumar A, Kumar V, Saroop S, Arsenov D, Bali S, Radziemska M, Bhardwaj R (2023) A comprehensive review of Uranium in the terrestrial and aquatic environment: bioavailability, immobilization, tolerance and remediation approaches. Plant Soil 490:31-65
Lai J-I, Liu Z-w, Li C, Luo X-g (2021) Analysis of accumulation and phytotoxicity mechanism of uranium and cadmium in two sweet potato cultivars. J Hazard Mater 409:124997
Laurette J, Larue C, Llorens I, Jaillard D, Jouneau P-H, Bourguignon J, Carrière M (2012) Speciation of uranium in plants upon root accumulation and root-to-shoot translocation: A XAS and TEM study. Environ Exp Bot 77:87-95
Leng L, Xu S, Liu R, Yu T, Zhuo X, Leng S, Xiong Q, Huang H (2020) Nitrogen containing functional groups of biochar: an overview. Biores Technol 298:122286
Lepore GO, Schingaro E, Mesto E, Lacalamita M, Cristiani C, Stampino PG, Dotelli G, Finocchio E, d’Acapito F, Giuli G (2022) Lanthanum captured in montmorillonite: evidence of inner-sphere complexes from X-ray absorption spectroscopy investigations. Appl Clay Sci 230:106676
Li X, Pan H, Yu M, Wakeel M, Luo J, Alharbi NS, Liao Q, Liu J (2018) Macroscopic and molecular investigations of immobilization mechanism of uranium on biochar: EXAFS spectroscopy and static batch. J Mol Liq 269:64-71
Li M, Liu H, Chen T, Dong C, Sun Y (2019a) Synthesis of magnetic biochar composites for enhanced uranium(VI) adsorption. Sci Total Environ 651:1020-1028
Li N, Yin M, Tsang DCW, Yang S, Liu J, Li X, Song G, Wang J (2019b) Mechanisms of U(VI) removal by biochar derived from Ficus microcarpa aerial root: a comparison between raw and modified biochar. Sci Total Environ 697:134115
Li S, Harris S, Anandhi A, Chen G (2019c) Predicting biochar properties and functions based on feedstock and pyrolysis temperature: a review and data syntheses. J Clean Prod 215:890-902
Li R, Wang B, Niu A, Cheng N, Chen M, Zhang X, Yu Z, Wang S (2022) Application of biochar immobilized microorganisms for pollutants removal from wastewater: a review. Sci Total Environ 837:155563
Li A, Ye C, Jiang Y, Deng H (2023a) Enhanced removal performance of magnesium-modified biochar for cadmium in wastewaters: role of active functional groups, processes, and mechanisms. Biores Technol 386:129515
Li Y, Abdo Al, Shi Z, Merwad A-RMA, Zhang J (2023b) Biochar derived from invasive plants improved the pH , macronutrient availability and biological properties better than liming for acid rain-affected soil. Biochar 5:59
Li N, Wang Y, Zhou L, Fu D, Chen T, Chen X, Wang Q, Zhu W (2024) The joint action of biochar and plant roots on U-stressed soil remediation: insights from bacteriomics and metabolomics. J Hazard Mater 461:132635
Liao J, Chen H, Zhang Y, Zhu W (2022a) Pyrolysis of animal manure under nitrogen atmosphere: an environment protection way to obtain animal manure biochar for high-efficient adsorption of uranium(VI). J Anal Appl Pyrol 163:105493
Liao J, Ding L, Zhang Y, Zhu W (2022b) Efficient removal of uranium from wastewater using pig manure biochar: understanding adsorption and binding mechanisms. J Hazard Mater 423:127190
Liao J, He X, Zhang Y, Zhang L, He Z (2022c) Constructing a novel carbon material for efficient separation of uranium(VI) from solution. Biomass Convers Bioref. https://doi.org/10.1007/s13399-022-02856-9
Liao J, He X, Zhang Y, Zhu W, Zhang L, He Z (2022d) Bismuth impregnated biochar for efficient uranium removal from solution: adsorption behavior and interfacial mechanism. Sci Total Environ 819:153145
Liao J, Xiong T, Ding L, Zhang Y, Zhu W (2022e) Effective separation of uranium(VI) from wastewater using a magnetic carbon as a recyclable adsorbent. Sep Purif Technol 282:120140
Liao J, He X, Zhang Y, Zhang L, He Z (2023) The construction of magnetic hydroxyapatite-functionalized pig manure-derived biochar for the efficient uranium separation. Chem Eng J 457:141367
Liatsou I, Michail G, Demetriou M, Pashalidis I (2017) Uranium binding by biochar fibres derived from Luffa cylindrica after controlled surface oxidation. J Radioanal Nucl Chem 311:871-875
Limwikran T, Kheoruenromne I, Suddhiprakarn A, Prakongkep N, Gilkes RJ (2018) Dissolution of K, Ca, and P from biochar grains in tropical soils. Geoderma 312:139-150
Lingamdinne LP, Choi J-S, Angaru GKR, Karri RR, Yang J-K, Chang Y-Y, Koduru JR (2022) Magnetic-watermelon rinds biochar for uranium-contaminated water treatment using an electromagnetic semi-batch column with removal mechanistic investigations. Chemosphere 286:131776
Liu J, Wang J, Li H, Shen C-C, Chen Y, Wang C, Ye H, Long J, Song G, Wu Y (2015) Surface sediment contamination by uranium mining/milling activities in South China. Clean: Soil, Air, Water 43:414-420
Liu J, Ge Y, Wang G, Liu Y, Xu X (2021a) Highly efficient removal of U(VI) in aqueous solutions by tea waste-derived biochar-supported iron-manganese oxide composite. J Radioanal Nucl Chem 330:871-882
Liu R, Wang H, Han L, Hu B, Qiu M (2021b) Reductive and adsorptive elimination of U(VI) ions in aqueous solution by SFeS@Biochar composites. Environ Sci Pollut Res 28:55176-55185
Liu X, Tournassat C, Grangeon S, Kalinichev AG, Takahashi Y, Marques Fernandes M (2022a) Molecular-level understanding of metal ion retention in clay-rich materials. Nat Rev Earth Environ 3:461-476
Liu Y, Wu S, Nguyen TAH, Chan T-S, Lu Y-R, Huang L (2022c) Biochar mediated uranium immobilization in magnetite rich Cu tailings subject to organic matter amendment and native plant colonization. J Hazard Mater 427:127860
Liu Z, Xu Z, Xu L, Buyong F, Chay TC, Li Z, Cai Y, Hu B, Zhu Y, Wang X (2022d) Modified biochar: synthesis and mechanism for removal of environmental heavy metals. Carbon Res 1:8
Liu B, Jiang S, Guan D-X, Song X, Li Y, Zhou S, Wang B, Gao B (2023a) Geochemical fractionation, bioaccessibility and ecological risk of metallic elements in the weathering profiles of typical skarn-type copper tailings from Tongling, China. Sci Total Environ 894:164859
Liu Y, Yuan W, Lin W, Yu S, Zhou L, Zeng Q, Wang J, Tao L, Dai Q, Liu J (2023b) Efficacy and mechanisms of
Lovley DR, Phillips EJP, Gorby YA, Landa ER (1991) Microbial reduction of uranium. Nature 350:413-416
Lyu P, Wang G, Cao Y, Wang B, Deng N (2021a) Phosphorus-modified biochar cross-linked Mg-Al layered double-hydroxide composite for immobilizing uranium in mining contaminated soil. Chemosphere 276:130116
Lyu P, Wang G, Wang B, Yin Q, Li Y, Deng N (2021b) Adsorption and interaction mechanism of uranium (VI) from aqueous solutions on phosphateimpregnation biochar cross-linked MgAl layered double-hydroxide composite. Appl Clay Sci 209:106146
Ma M, Wang R, Xu L, Xu M, Liu S (2020) Emerging health risks and underlying toxicological mechanisms of uranium contamination: lessons from the past two decades. Environ Int 145:106107
Majeed A, Muhmood A, Niaz A, Ditta A, Rajpar MN (2022) Comparative efficacy of different biochars and traditional manures in the attenuation of cadmium toxicity in rice (Oryza sativa L.). Arab J Geosci 15:209
Malaviya P, Singh A (2012) Phytoremediation strategies for remediation of uranium-contaminated environments: a review. Crit Rev Environ Sci Technol 42:2575-2647
Mertens A, Horemans N, Saenen E, Nauts R, Cuypers A (2022) Calcium affects uranium responses in Arabidopsis thaliana: from distribution to toxicity. Plant Physiol Biochem 185:101-111
Mishra V, Sureshkumar MK, Gupta N, Kaushik CP (2017) Study on sorption characteristics of uranium onto biochar derived from eucalyptus wood. Water Air Soil Pollut 228:309
Mo G, Hu Q, Wang G, Xie S, Nong H, Zhang X, Zeng T (2021) Fe3O4-modified sewage sludge biochar for
Monreal MJ, Diaconescu PL (2010) The riches of uranium. Nat Chem 2:424-424
Morereau A, Jaegler H, Hain K, Steier P, Golser R, Beaumais A, Lepage H, Eyrolle F, Grosbois C, Cazala C, Gourgiotis A (2022) Deciphering sources of U contamination using isotope ratio signatures in the Loire River sediments: exploring the relevance of
Mousavi SM, Srivastava AK, Cheraghi M (2023) Soil health and crop response of biochar: an updated analysis. Arch Agron Soil Sci 69:1085-1110
Mukherjee A, Zimmerman AR, Harris W (2011) Surface chemistry variations among a series of laboratory-produced biochars. Geoderma 163:247-255
Narasimharao K, Angaru GKR, Momin ZH, Al-Thabaiti S, Mokhtar M, Alsheshri A, Alfaifi SY, Koduru JR, Chang Y-Y (2023) Orange waste Biochar-Magnesium Silicate (OBMS) composite for enhanced removal of U(VI) ions from aqueous solutions. J Water Process Eng 51:103359
Nduka JK, Umeh TC, Kelle HI, Ozoagu PC, Okafor PC (2022) Health risk assessment of radiation dose of background radionuclides in quarry soil and uptake by plants in Ezillo-Ishiagu in Ebonyi South-Eastern Nigeria. Case Stud Chem Environ Eng 6:100269
Neiva AMR, Albuquerque MTD, Antunes IMHR, Carvalho PCS, Santos ACT, Boente C, Cunha PP, Henriques SBA, Pato RL (2019) Assessment of metal and metalloid contamination in soils trough compositional data: the old Mortórios uranium mine area, central Portugal. Environ Geochem Health 41:2875-2892
Ouyang P, Narayanan M, Shi X, Chen X, Li Z, Luo Y, Ma Y (2023) Integrating biochar and bacteria for sustainable remediation of metal-contaminated soils. Biochar 5:63
Pang H, Zhang E, Zhang D, Wang X, Zhao B, Liu L, Ma X, Song G, Yu S (2022) Precursor impact and mechanism analysis of uranium elimination by biochar supported sulfurized nanoscale zero-valent iron. J Environ Chem Eng 10:107288
Papp Z, Dezső Z, Daróczy S (2002) Significant radioactive contamination of soil around a coal-fired thermal power plant. J Environ Radioact 59:191-205
Pehlivan N, Gedik K, Wang JJ (2023) Tea-based biochar-mediated changes in cation diffusion homeostasis in rice grown in heavy metal (loid) contaminated mining soil. Plant Physiol Biochem 201:107889
Pehoiu G, Radulescu C, Murarescu O, Dulama ID, Bucurica IA, Teodorescu S, Stirbescu RM (2019) Health risk assessment associated with abandoned copper and uranium mine tailings. Bull Environ Contam Toxicol 102:504-510
Peña J, Straub M, Flury V, Loup E, Corcho J, Steinmann P, Bochud F, Froidevaux P (2020) Origin and stability of uranium accumulation-layers in an Alpine histosol. Sci Total Environ 727:138368
Peng Z, Cao J (2021) Natural uranium-bearing nanoparticles in surface media. Environ Chem Lett 19:2713-2721
Pérez-Sánchez D, Thorne MC (2014) An investigation into the upward transport of uranium-series radionuclides in soils and uptake by plants. J Radiol Prot 34:545
Philippou M, Pashalidis I, Theocharis CR (2022) Uranium Isotope (U-232) removal from waters by biochar fibers: an adsorption study in the subpicomolar concentration range. Molecules 27:6765
Plant J, Reeder S, Salminen R, Smith D, Tarvainen T, De Vivo B, Petterson M (2003) The distribution of uranium over Europe: geological and environmental significance. Appl Earth Sci (transactions of the Institute of Mining and Metallurgy B) 112:B1-B17
Qi X, Gou J, Chen X, Xiao S, Ali I, Shang R, Wang D, Wu Y, Han M, Luo X (2021) Application of mixed bacteria-loaded biochar to enhance uranium and cadmium immobilization in a co-contaminated soil. J Hazard Mater 401:123823
Qi X, Xiao S, Chen X, Ali I, Gou J, Wang D, Zhu B, Zhu W, Shang R, Han M (2022) Biochar-based microbial agent reduces
Qiu B, Tao X, Wang H, Li W, Ding X, Chu H (2021) Biochar as a low-cost adsorbent for aqueous heavy metal removal: a review. J Anal Appl Pyrol 155:105081
Qiu M, Liu L, Ling Q, Cai Y, Yu S, Wang S, Fu D, Hu B, Wang X (2022) Biochar for the removal of contaminants from soil and water: a review. Biochar 4:19
Ramadan RS, Dawood YH, Yehia MM, Gad A (2022) Environmental and health impact of current uranium mining activities in southwestern Sinai, Egypt. Environ Earth Sci 81:213
Rani N, Singh P, Kumar S, Kumar P, Bhankar V, Kamra N, Kumar K (2023) Recent advancement in nanomaterials for the detection and removal of uranium: a review. Environ Res 234:116536
Ren J, Huang H, Zhang Z, Xu X, Zhao L, Qiu H, Cao X (2023) Enhanced microbial reduction of
Rizwan M, Ali S, Abbas T, Rehman MZu, Al-Wabel MI (2018) Residual impact of biochar on cadmium uptake by rice (Oryza sativa L.) grown in Cdcontaminated soil. Arab J Geosci 11:630
Ruan Y, Zhang H, Yu Z, Diao Z, Song G, Su M, La H, Chen D, Wang S, Kong L (2022) Phosphate enhanced uranium stable immobilization on biochar supported nano zero valent iron. J Hazard Mater 424:127119
Rushimisha IE, Li X, Han T, Chen X, Abdoul Magid ASI, Sun Y, Li Y (2022) Application of biochar on soil bioelectrochemical remediation: behind roles, progress, and potential. Crit Rev Biotechnol 44(1):120-138
Sahoo SK, Hosoda M, Kamagata S, Sorimachi A, Ishikawa T, Tokonami S, Uchida
Sapre S, Gontia-Mishra I, Tiwari S (2022) Plant growth-promoting Rhizobacteria ameliorates salinity stress in pea (Pisum sativum). J Plant Growth Regul 41:647-656
Satpathy A, Sharma N, Pan W, Catalano JG, Giammar DE (2023) Exchange between dissolved U(VI) and adsorbed and precipitated forms of solidassociated U. ACS Earth Space Chem 7:1528-1535
Schilz JR, Dashner-Titus EJ, Simmons KA, Erdei E, Bolt AM, MacKenzie DA, Hudson LG (2022) The immunotoxicity of natural and depleted uranium: from cells to people. Toxicol Appl Pharmacol 454:116252
Schipper LA, Sparling GP, Fisk LM, Dodd MB, Power IL, Littler RA (2011) Rates of accumulation of cadmium and uranium in a New Zealand hill farm soil as a result of long-term use of phosphate fertilizer. Agicr Ecosyst Environ 144:95-101
Shahandeh H, Hossner L (2002) Role of soil properties in phytoaccumulation of uranium. Water Air Soil Pollut 141:165-180
Sharma DA, Keesari T, Pant D, Rishi MS, Sangwan P, Thakur N, Sinha UK (2022) Appraising the factors favouring uranium mobilization and associated health risk assessment in groundwaters of north-western India. Ecotoxicol Environ Saf 229:113086
Shen C, Pan J, Chen M, Su M, Chen D, Song G (2023) Statistically and visually analyzing the latest advancements and future trends of uranium removal. Environ Res 239:117280
Singh H, Northup BK, Rice CW, Prasad PVV (2022) Biochar applications influence soil physical and chemical properties, microbial diversity, and crop productivity: a meta-analysis. Biochar 4:8
Skipperud L, Strømman G, Yunusov M, Stegnar P, Uralbekov B, Tilloboev H, Zjazjev G, Heier LS, Rosseland BO, Salbu B (2013) Environmental impact assessment of radionuclide and metal contamination at the former
Srivastava RR, Pathak P, Perween M (2020) Environmental and health impact due to uranium mining. In: Gupta DK, Walther C (eds) Uranium in plants and the environment. Springer International Publishing, Cham, pp 69-89
Stasi C, Georgiou E, loannidis I, Pashalidis I (2022) Uranium removal from laboratory and environmental waters by oxidised biochar prepared from palm tree fibres. J Radioanal Nucl Chem 331:375-381
Sun T, Levin BD, Guzman JJ, Enders A, Muller DA, Angenent LT, Lehmann J (2017) Rapid electron transfer by the carbon matrix in natural pyrogenic carbon. Nat Commun 8:14873
Sun Y, Zeng B, Dai Y, Liang X, Zhang L, Ahmad R, Su X (2022) Modification of sludge-based biochar using air roasting-oxidation and its performance in adsorption of uranium(VI) from aqueous solutions. J Colloid Interface Sci 614:547-555
Takeda A, Tsukada H, Takaku Y, Si H, Nanzyo M (2006) Accumulation of uranium derived from long-term fertilizer applications in a cultivated Andisol. Sci Total Environ 367:924-931
Tan X-F, Zhu S-S, Wang R-P, Chen Y-D, Show P-L, Zhang F-F, Ho S-H (2021) Role of biochar surface characteristics in the adsorption of aromatic compounds: pore structure and functional groups. Chin Chem Lett 32:2939-2946
Tan S, Narayanan M, Thu Huong DT, Ito N, Unpaprom Y, Pugazhendhi A, Lan Chi NT, Liu J (2022) A perspective on the interaction between biochar and soil microbes: a way to regain soil eminence. Environ Res 214:113832
Taskin MB, Kadioglu YK, Sahin O, Inal A, Gunes A (2019) Effect of acid modified biochar on the growth and essential and non- essential element content of bean, chickpea, soybean, and maize grown in calcareous soil. Commun Soil Sci Plant Anal 50:1604-1613
Thakur A, Kumar R, Sahoo PK (2022) Uranium and fluoride removal from aqueous solution using biochar: a critical review for understanding the role of feedstock types, mechanisms, and modification methods. Water 14:413
Thorgersen MP, Goff JL, Poole FL, Walker KF, Putt AD, Lui LM, Hazen TC, Arkin AP, Adams MWW (2023) Mixed nitrate and metal contamination influences operational speciation of toxic and essential elements. Environ Pollut. https://doi.org/10.1016/j.envpol.2023.122674
Tomczyk A, Sokołowska Z, Boguta P (2020) Biochar physicochemical properties: pyrolysis temperature and feedstock kind effects. Rev Environ Sci Bio/Technol 19:191-215
Tunney H, Stojanović M, MrdakovićPopić J, McGrath D, Zhang C (2009) Relationship of soil phosphorus with uranium in grassland mineral soils in Ireland using soils from a long-term phosphorus experiment and a National Soil Database. J Plant Nutr Soil Sci 172:346-352
Um W, Icenhower JP, Brown CF, Serne RJ, Wang Z, Dodge CJ, Francis AJ (2010) Characterization of uranium-contaminated sediments from beneath a nuclear waste storage tank from Hanford, Washington: implications for contaminant transport and fate. Geochim Cosmochim Acta 74:1363-1380
Utermann J, Fuchs M (2008) Uranium in German soils. Loads and fate of fertilizer-derived uranium. Backhuys Publishers, Leiden, pp 978-990
Vandenhove H, Van Hees M, Wannijn J, Wouters K, Wang L (2007) Can we predict uranium bioavailability based on soil parameters? Part 2: Soil solution uranium concentration is not a good bioavailability index. Environ Pollut 145:577-586
Vodyanitskii YN (2011) Chemical aspects of uranium behavior in soils: a review. Eurasian Soil Sci 44:862-873
Wang Z, Qin H, Liu X (2019a) Health risk assessment of heavy metals in the soil-water-rice system around the Xiazhuang uranium mine, China. Environ Sci Pollut Res 26:5904-5912
Wang Z, Qin H, Wang J (2019b) Accumulation of uranium and heavy metals in the soil-plant system in Xiazhuang uranium ore field, Guangdong Province, China. Environ Geochem Health 41:2413-2423
Wang B, Li Y, Zheng J, Hu Y, Wang X, Hu B (2020) Efficient removal of U(VI) from aqueous solutions using the magnetic biochar derived from the biomass of a bloom-forming cyanobacterium (Microcystis aeruginosa). Chemosphere 254:126898
Wang C, Wang G, Xie S, Wang J, Guo Y (2022) Removal behavior and mechanisms of
Wang C, Ma R, Wang J, Zhong C, Zhao Y, Browne P (2023) Fractionations of heavy metals and their correlations with magnetic susceptibility in soil from a typical alluvial island in the lower Yangtze river, China. J Clean Prod 418:138060
Wei B, Peng Y, Lin L, Zhang D, Ma L, Jiang L, Li Y, He T, Wang Z (2023) Drivers of biochar-mediated improvement of soil water retention capacity based on soil texture: a meta-analysis. Geoderma 437:116591
Wen J, Fang Y, Zeng G (2018) Progress and prospect of adsorptive removal of heavy metal ions from aqueous solution using metal-organic frameworks: a review of studies from the last decade. Chemosphere 201:627-643
Wu C, Zhi D, Yao B, Zhou Y, Yang Y, Zhou Y (2022a) Immobilization of microbes on biochar for water and soil remediation: a review. Environ Res 212:113226
Wu Z, Firmin KA, Cheng M, Wu H, Si Y (2022b) Biochar enhanced Cd and Pb immobilization by sulfate-reducing bacterium isolated from acid mine drainage environment. J Clean Prod 366:132823
Xia D, Liu Y, Cheng X, Gu P, Chen Q, Zhang Z (2022) Temperature-tuned fishscale biochar with two-dimensional homogeneous porous structure: a promising uranium extractant. Appl Surf Sci 591:153136
Xu N, Wei FS, Ten EJ, Chen LQ (1993) Evaluation of indigenous concentrations of uranium and thorium in soils of China. Commun Soil Sci Plant Anal 24:1795-1803
Xu Z, Xing Y, Ren A, Ma D, Li Y, Hu S (2020) Study on adsorption properties of water hyacinth-derived biochar for uranium (VI). J Radioanal Nucl Chem 324:1317-1327
Xue C, Yi X, Yang Y, Jiang F, Yin H, Dang Z (2023) Chemical speciation and distribution of adsorbed
Yang G (2023) Sorption and reduction of hexavalent uranium by natural and modified silicate minerals: a review. Environ Chem Lett 21:2441-2470
Yang X, Wan Y, Zheng Y, He F, Yu Z, Huang J, Wang H, Ok YS, Jiang Y, Gao B (2019) Surface functional groups of carbon-based adsorbents and their roles in the removal of heavy metals from aqueous solutions: a critical review. Chem Eng J 366:608-621
Yang X, Dai Z, Ge C, Yu H, Bolan N, Tsang DCW, Song H, Hou D, Shaheen SM, Wang H, Rinklebe J (2023a) Multiple-functionalized biochar affects rice yield and quality via regulating arsenic and lead redistribution and
bacterial community structure in soils under different hydrological conditions. J Hazard Mater 443:130308
Yang X, Wen E, Ge C, El-Naggar A, Yu H, Wang S, Kwon EE, Song H, Shaheen SM, Wang H, Rinklebe J (2023b) Iron-modified phosphorus- and siliconbased biochars exhibited various influences on arsenic, cadmium, and lead accumulation in rice and enzyme activities in a paddy soil. J Hazard Mater 443:130203
Yang Y, Zhong M, Bian X, You Y, Li F (2023c) Preparation of carbon-based material with high water absorption capacity and its effect on the water retention characteristics of sandy soil. Biochar 5:61
Ye T, Huang B, Wang Y, Zhou L, Liu Z (2020) Rapid removal of uranium(VI) using functionalized luffa rattan biochar from aqueous solution. Colloids Surf, A 606:125480
Yi P, Yan Y, Kong Y, Chen Q, Wu M, Liang N, Zhang L, Pan B (2023) The opposite influences of Cu and Cd cation bridges on sulfamethoxazole sorption on humic acids in wetting-drying cycles. Sci Total Environ 898:165547
Yin Q, Lyu P, Wang G, Wang B, Li Y, Zhou Z, Guo Y, Li L, Deng N (2022) Phos-phorus-modified biochar cross-linked Mg-Al layered double-hydroxide stabilizer reduced U and Pb uptake by Indian mustard (Brassica juncea L.) in uranium contaminated soil. Ecotoxicol Environ Saf 234:113363
Yu S, Wu X, Ye J, Li M, Zhang Q, Zhang X, Lv C, Xie W, Shi K, Liu Y (2022) Dual effect of acetic acid efficiently enhances sludge-based biochar to recover uranium from aqueous solution. Front Chem 10:835959
Yu C, Zhu X, Mohamed A, Dai K, Cai P, Liu S, Huang Q, Xing B (2023) Enhanced
Yuan Y, Bolan N, Prévoteau A, Vithanage M, Biswas JK, Ok YS, Wang H (2017) Applications of biochar in redox-mediated reactions. Biores Technol 246:271-281
Zeng T, Mo G, Zhang X, Liu J, Liu H, Xie S (2020) U(VI) removal efficiency and mechanism of biochars derived from sewage sludge at two pyrolysis temperatures. J Radioanal Nucl Chem 326:1413-1425
Zhang C, Yu Z-g, Zeng G-m, Jiang M, Yang Z-z, Cui F, Zhu M-y, Shen L-q, Hu
Zhang H, Ruan Y, Liang A, Shih K, Diao Z, Su M, La H, Chen D, Lu H, Kong L (2019a) Carbothermal reduction for preparing nZVI/BC to extract uranium: insight into the iron species dependent uranium adsorption behavior. J Clean Prod 239:117873
Zhang P, Qi X, Wen J, Liu J (2019b) Effect and mechanism of mixed biochar with rice straw and pig manure on remediation of uranium contaminated soil by Lolium Perenne. J Univ S China 33:90-96
Zhang S, Yang F, Cao X, Tang Y, Yin T, Bo T, Liu Y, Lisak G, Kano N, Na B, Chang M, Liu
Zhao L, Cao X, Zheng W, Wang Q, Yang F (2015) Endogenous minerals have influences on surface electrochemistry and ion exchange properties of biochar. Chemosphere 136:133-139
Zhao Q, Xu Z, Yu Z (2021) Straw-derived biochar as the potential adsorbent for U(VI) and Th(IV) removal in aqueous solutions. Biomass Convers Biorefinery 13:15707-15718
Zheng X, Xu W, Dong J, Yang T, Shangguan Z, Qu J, Li X, Tan X (2022) The effects of biochar and its applications in the microbial remediation of contaminated soil: a review. J Hazard Mater 438:129557
Zhou P, Gu B (2005) Extraction of oxidized and reduced forms of uranium from contaminated soils: effects of carbonate concentration and pH. Environ Sci Technol 39:4435-4440
Zhou Y, Xiao J, Hu R, Wang T, Shao X, Chen G, Chen L, Tian X (2020) Engineered phosphorous-functionalized biochar with enhanced porosity using phytic acid-assisted ball milling for efficient and selective uptake of aquatic uranium. J Mol Liq 303:112659
Zhu J, Wei R, Wang X, He D, Jiang X, Wang M, Yang Y, Yang L (2023a) Polyphosphate promotes oxidation resistance of ppk-expressing transgenic rice in low phosphorus culture. Plant Physiol Biochem 203:108006
Zhu K, Xian H, Peng L, Wang S, Chen C, Liu J (2023b) Adsorption performance and mechanism of
- Handling editor: Xing Yang
*Correspondence:
Li Chen
chenlixkd@163.com
Linchuan Fang
flinc629@hotmail.com
Full list of author information is available at the end of the article
