DOI: https://doi.org/10.1038/s41420-024-01815-9
PMID: https://pubmed.ncbi.nlm.nih.gov/38245520
تاريخ النشر: 2024-01-20
اختراق في علاج الأورام الصلبة: العلاج المناعي CAR-NK
الملخص
كأحدث وأهم طريقة للعلاج المناعي للأورام، حصل علاج CAR-NK على اهتمام متزايد في السنوات الأخيرة، وتتمتع سلامته وكفاءته العالية بمزايا لا يمكن الاستغناء عنها مقارنةً بـ CAR-T. تركز الأبحاث الحالية على تطبيق CAR-NK في الأورام الدموية، بينما هناك دراسات أقل على الأورام الصلبة. تستعرض هذه المقالة عملية بناء CAR-NK، وتأثيرات نقص الأكسجة والعوامل الأيضية، ومستقبلات سطح خلايا NK، والسيتوكينات، والإكسوزومات على فعالية CAR-NK في الأورام الصلبة، ودور CAR-NK في مختلف الأورام الصلبة. كما تناقش آلية العمل وحالة البحث حول إمكانيات CAR-NK في علاج الأورام الصلبة في الممارسة السريرية، وتطرح المزايا والقيود والمشكلات المستقبلية لعلاج CAR-NK للأورام الصلبة.
الحقائق
- تقدم هذه المقالة مقدمة مفصلة للعوامل التي تقيد حاليًا فعالية CAR-NK في الأورام الصلبة، مما يوفر مرجعًا لتطوير وتصميم CAR-NK في المستقبل.
- في الوقت الحالي، تركز معظم التجارب على تأثير CAR-NK على الأورام الدموية. تركز هذه المقالة على أحدث جدوى لعلاج CAR-NK في مختلف الأورام الصلبة. توفر أساسًا نظريًا لتوسيع قابلية تطبيق علاج CAR-NK.
- جمع المؤلف التجارب السريرية الجارية لعلاج CAR-NK المطبق على الأورام الصلبة، مما يوفر أفكارًا لمبادري التجارب السريرية اللاحقة وتجنب العمل المكرر. في الوقت نفسه، يمكن أيضًا مراقبة أحدث التطورات في هذه التجارب.
أسئلة مفتوحة
لتحديد ما إذا كان يمكن تطبيق CAR-NK على نطاق واسع في علاج الأورام الصلبة في الممارسة السريرية في المستقبل.
المقدمة
العلاجات التقليدية، تقدم خلايا CAR-NK بلا شك الأمل. إن تعظيم دور CAR-NK في الأورام الصلبة هو تحدٍ حالي في مجال الأورام. يتطلب نجاح علاج CAR-NK في الأورام الصلبة معالجة صعوبات متنوعة، بما في ذلك تصميم الهيكل الأمثل لـ CAR وتعديل المسارات المثبطة والمنشطة الداخلية لخلايا NK وراثيًا [4]. تشير الأبحاث الحالية إلى أن البيئة المثبطة TME (نقص التغذية والحالة المناعية المثبطة) تشكل عقبة كبيرة أمام التطبيق الفعال لـ CAR-NK في الأورام الصلبة. ومع ذلك، لا تزال الحالة الوظيفية وآلية الضرر لخلايا NK داخل TME غير معروفة [5]. يمكن أن تؤدي TME إلى خلل شديد في خلايا المناعة السامة، ودرجة ضعف السمية في خلايا NK داخل TME لمرضى السرطان مرتبطة ارتباطًا وثيقًا بتوقعات مختلف أنواع السرطان. على الرغم من ذلك، لا تزال الآليات الأساسية لخلل خلايا NK في TME غير مفهومة تمامًا. تتناول هذه المقالة التحديات التي تطرحها TME على تطبيق CAR-NK في الأورام الصلبة. تتعمق في عملية بناء CAR-NK، مستكشفة تأثيرات نقص الأكسجة، والعوامل الأيضية، ومستقبلات سطح خلايا NK، والسيتوكينات، والإكسوزومات على فعالية CAR-NK في الأورام الصلبة. يتم مراجعة الآليات التي تحكم عمل CAR-NK في مختلف الأورام الصلبة وحالة البحث الحالية حول الإمكانيات السريرية لـ CAR-NK لعلاج الأورام الصلبة بشكل شامل.
العلاج المناعي للورم
الخلايا في الدم والأنسجة. تشمل ACT أساليب مختلفة، بما في ذلك علاج الخلايا اللمفاوية المتسللة إلى الورم (TIL)، وعلاج مستقبلات الخلايا التائية المهندسة (TCR)، وعلاج CAR-T، وعلاج CAR-NK.
علاج CAR-NK
حبيبات سيتوبلازمية تحتوي على البيرفورين والجرانزيمات. ثانياً، إطلاق السيتوكينات، مثل IFN-
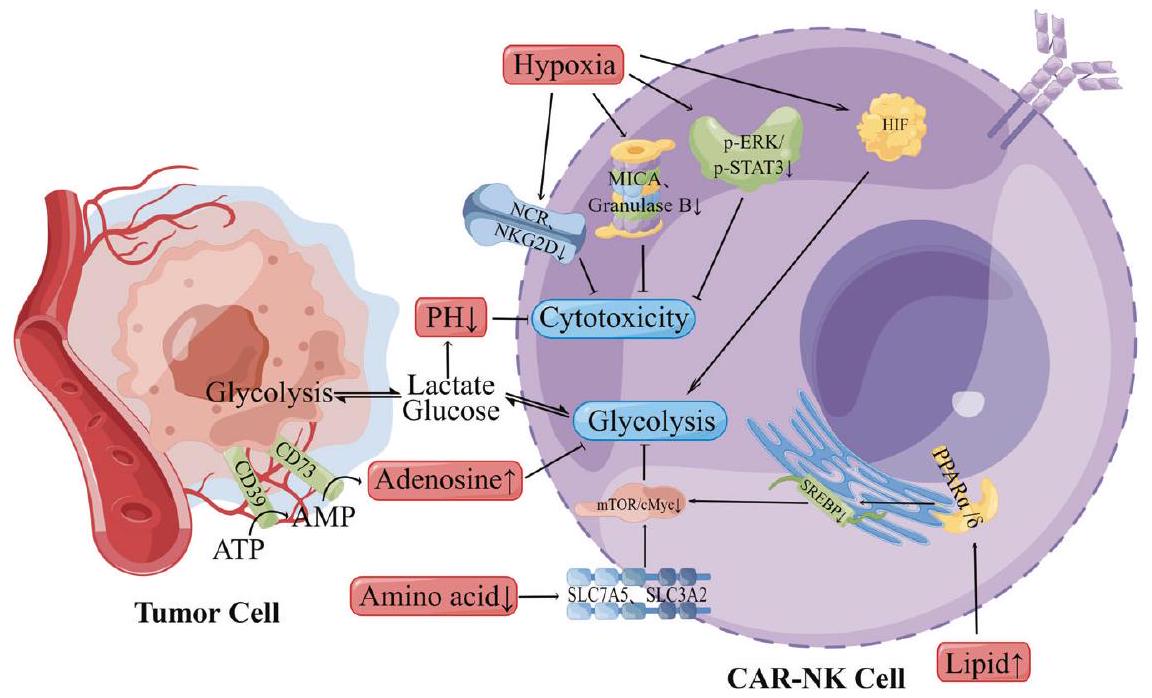
تأثير نقص الأكسجين والعوامل الأيضية على فعالية CAR-NK في الأورام الصلبة
عوامل نقص الأكسجين (HIFs) تتكون من وحدات ألفا الحساسة للأكسجين (HIF1a و HIF-2a و HIF-3a) ووحدات بيتا المعبر عنها بشكل دائم (HIF-1
أثر مستقبلات سطح خلايا NK على فعالية CAR-NK في الأورام الصلبة
NKG2D/NKG2DLs
مثل الميلانوما، الورم العصبي الجنيني، سرطان البروستاتا، وسرطان الكلى [56، 60-63]. بالإضافة إلى NKG2DLs القابلة للذوبان، فإن السيتوكينات في بيئة الورم المجاورة (TME) تشارك أيضًا في آليات هروب الورم المعتمدة على NKG2D. السيتوكينات المؤيدة للالتهاب IFN-
مستقبلات الأجسام المضادة الشبيهة بالخلايا القاتلة (KIR)
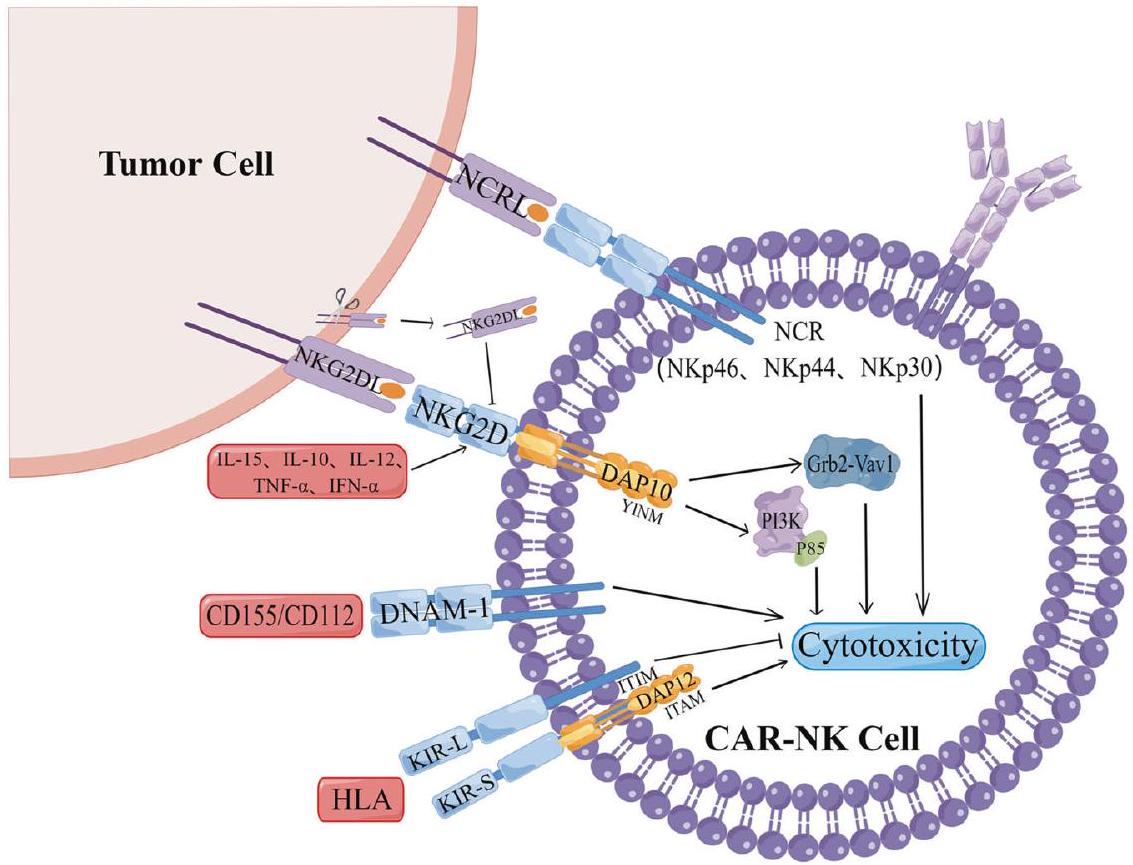
جزيء الملحق DNAX 1 (DNAM-1)
مستقبل السمية الطبيعية (NCR)
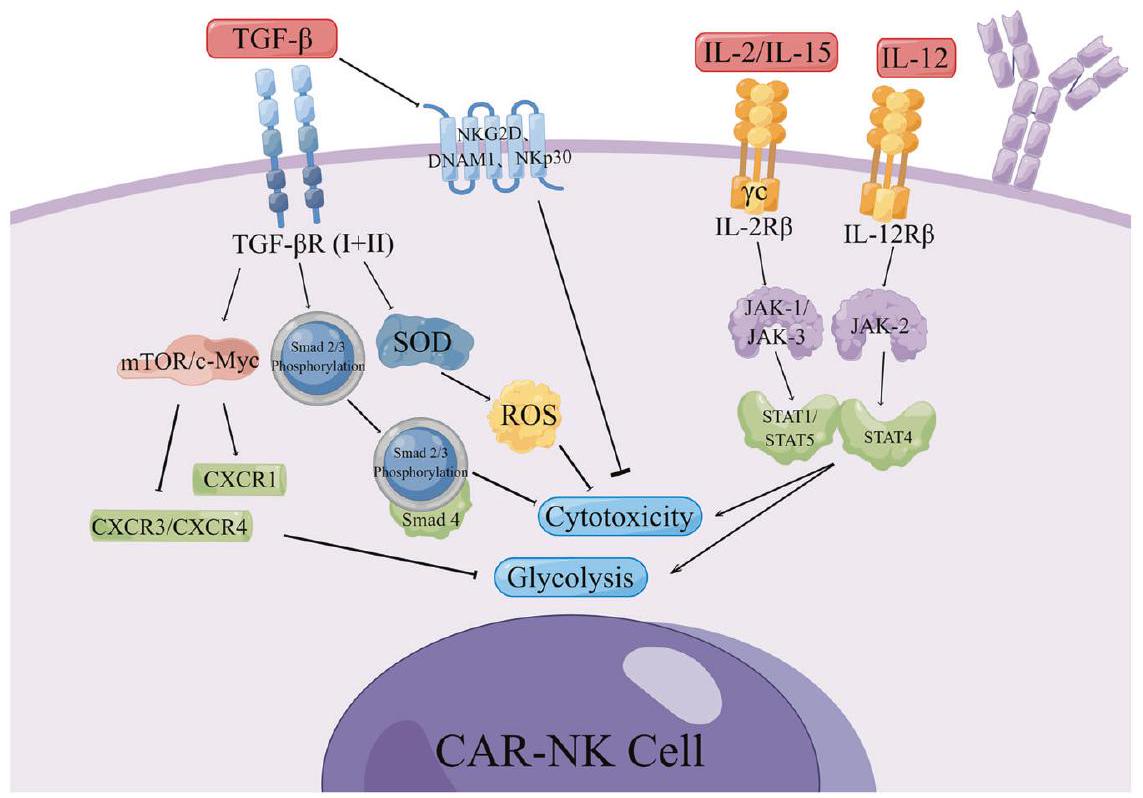
أثر السيتوكينات (CK) على فعالية CAR-NK في الأورام الصلبة
تGF-
إنترلوكين (IL)
من خلال غاما مشترك
أثر الإكسوزومات على فعالية CAR-NK في الأورام الصلبة
يمكن أن يؤدي سرطان القناة البنكرياسية إلى تقليل تعبير مستقبلات تنشيط خلايا NK، مما يؤدي إلى خلل في خلايا NK. ومن المثير للاهتمام أن عدة دراسات [111، 112] أظهرت أن IL-15 يمكن أن يعكس تثبيط تعبير NKG2D بواسطة الإكسوزومات الورمية ويحمي خلايا NK من التأثير المثبط المرتبط بالإكسوزومات TGF-
محاولات CAR-NK في أورام صلبة مختلفة
غليوبلاستوما
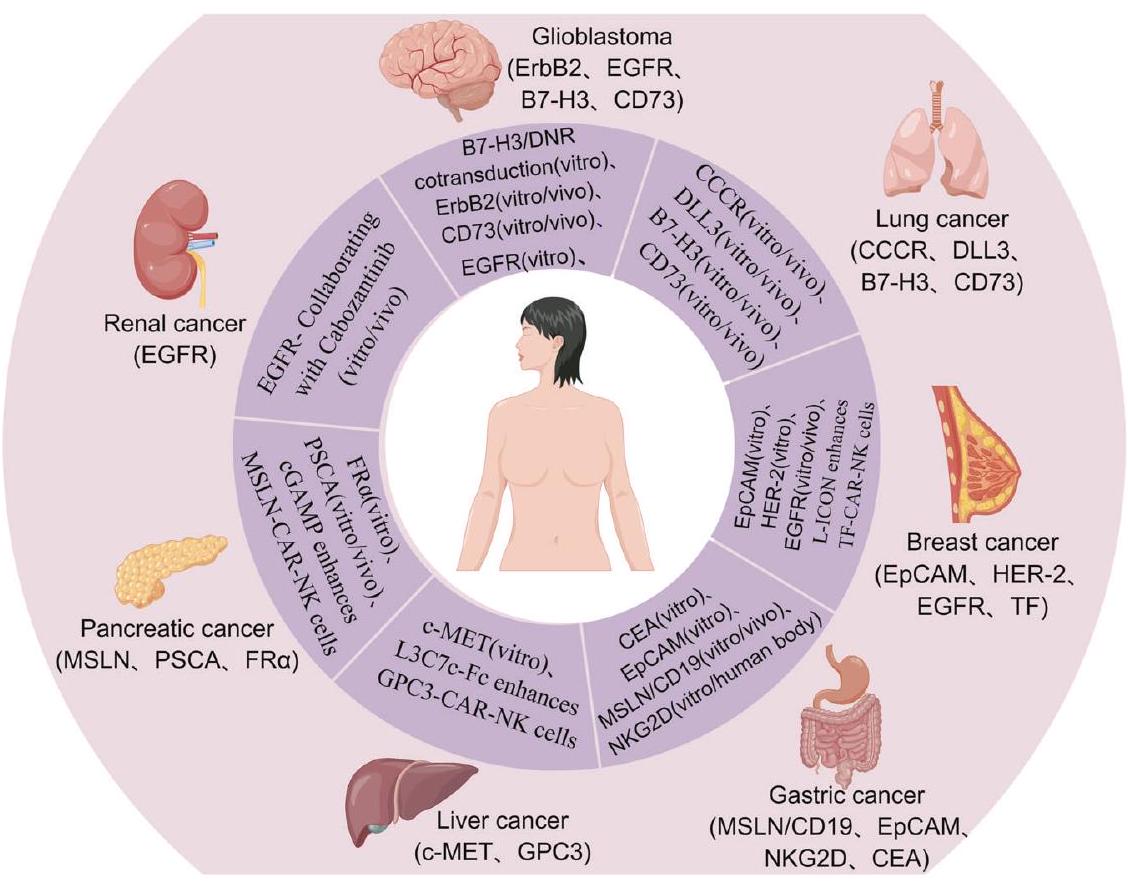
سرطان الرئة
سرطان الثدي
بالمقارنة مع التعبير عن MHC الفئة I، فإن ذلك غير ذي صلة. من المهم أن خلايا HER-2 CAR-NK تظهر سمية خلوية معززة تجاه أهداف الورم مقارنة بخلايا HER-2 CAR-T المتطابقة مع المتبرعين. ومن الجدير بالذكر أن خلايا HER-2 CAR-NK تحافظ على وظيفة سمية خلوية عالية في وجود عوامل مثبطة للمناعة المتواجدة بكثرة في الأورام الصلبة، مما يشير إلى كفاءتها وسلامتها للعلاج المناعي للأورام الصلبة [124-128].
سرطان المعدة (GC) وسرطان القولون (CRC)
سرطان الكبد وسرطان البنكرياس
خصوصية وفعالية العلاج المناعي لخلايا CAR-NK المستهدفة لـ c-MET في علاج سرطان الكبد البشري في المختبر. مؤخرًا، قام Chen130 بإنشاء خلايا GPC3-CAR-NK استنادًا إلى جسم مضاد معزز بال affinity يستهدف GPC3 لعلاج مرضى سرطان الكبد. تم استخدام L3C7c-Fc لعكس المستوى العالي من ligand 1 المبرمج القابل للذوبان (sPD-L1) في مرضى HCC، مما يعزز من تأثير هذه الخلايا CAR-NK ويوفر دليلًا تجريبيًا لتطوير استراتيجيات العلاج المناعي اللاحقة لسرطان الكبد.
سرطان الكلى
الإمكانات السريرية لتطبيق CAR-NK في الأورام الصلبة
يمكن لمستقبلات المستضدات قتل خلايا السرطان مباشرة عن طريق إفراز Perforin-1 و Granzyme أو عن طريق مستقبلات الموت، أو عن طريق إفراز السيتوكينات والكيموكينات لتنشيط خلايا المناعة مثل
الخاتمة
| صف | حالة | معرف الحكومة | عنوان الدراسة | الشروط | التدخلات | المرحلة/ن | عصور | جنس | تصميم الدراسة | جرعة الخلايا | مقاييس النتائج | المواقع |
| 1 | التوظيف | NCT05410717 | المرحلة الأولى/المرحلة الأولى لتقييم سلامة وفعالية أولية لـ CLDN6-CAR-NK في المرضى الذين يعانون من أورام صلبة متقدمة إيجابية لـ CLDN6 | سرطان المبيض المرحلة الرابعة؛ سرطان الخصية المقاوم؛ سرطان بطانة الرحم المتكرر؛ CAR NK | استهداف خلايا CARNK بواسطة Claudin6 | المرحلة 1، المرحلة 2/
|
من 18 سنة إلى 75 سنة | كل | مهمة جماعية فردية / مفتوحة | الأولوية: السلامة الثانوية: ORR، DCR، DOR | المستشفى الثاني التابع لجامعة غوانغتشو الطبية | |
| 2 | التوظيف | NCT05213195 | علاج خلايا NK باستخدام CAR-NKG2D في مرضى سرطان القولون والمستقيم النقيلي المقاوم للعلاج | سرطان القولون المستقيمي النقيلي المقاوم للعلاج | NKG2D CAR-NK | المرحلة 1/
|
من 18 سنة إلى 70 سنة | كل | التعيين المتسلسل/ مفتوح | الأولية: سمية محددة بالجرعة، الجرعة القصوى القابلة للتحمل الثانوية: مدة الاستجابة، معدل الاستجابة الكلي، البقاء على قيد الحياة | المستشفى الأول التابع لجامعة تشجيانغ | |
| ٣ | التوظيف | NCT05528341 | علاج المناعة باستخدام خلايا NKG2D-CAR-NK92 للأورام الصلبة | ورم صلب متكرر/مقاوم للعلاج | خلايا NKG2D-CAR-NK92 | المرحلة 1/
|
من 18 سنة إلى 75 سنة | كل | مهمة جماعية فردية / مفتوحة | سيتم إعطاء خلايا NKG2D-CAR-NK92 عن طريق الوريد على مدى ساعة واحدة. ستكون الجرعة الابتدائية من خلايا NKG2D-CAR-NK92 هي
|
الأولية: السلامة، ORR الثانوية: DCR، PFS، OS، درجة جودة الحياة | المستشفى الأول التابع لجامعة شينشيانغ الطبية |
| ٤ | التوظيف | NCT05776355 | NKG2D CAR-NK وسرطان المبيض | سرطان المبيض | NKG2D CAR-NK | غير قابل للتطبيق/
|
18 سنة وما فوق | أنثى | مهمة جماعية فردية / مفتوحة | الأولية: سمية محددة بالجرعة، الجرعة القصوى القابلة للتحمل | مستشفى تشجيانغ للسرطان | |
| ٥ | التوظيف | NCT05194709 | دراسة علاج خلايا NK CAR المضادة لـ ST4 في الأورام الصلبة المتقدمة | الأورام الصلبة المتقدمة | خلايا NK المضادة لـ CAR | المرحلة المبكرة
|
من 18 سنة إلى 80 سنة | كل | مهمة جماعية فردية / مفتوحة | سيتم إعطاء خلايا CAR-NK في اليوم الأول واليوم الثالث من كل دورة (21 يومًا). الجرعة الأولى في الدورة الأولى هي
|
الأولية: السلامة والتحمل لخلايا CAR-NK المضادة لـ 5T4 الثانوية: معدل الاستجابة الكلي، فترة البقاء بدون تقدم، البقاء على قيد الحياة، معدل الاستجابة المرضية، إفراز السيتوكينات، نوع الخلايا اللمفاوية | مستشفى الشعب في ووشي |
| ٦ | غير معروف | NCT03692637 | دراسة خلايا NK المضادة للميزوثيلين في سرطان المبيض الظهاري | سرطان المبيض الظهاري | خلايا NK المضادة للميسوثيلين | المرحلة المبكرة
|
من 18 سنة إلى 70 سنة | أنثى | مهمة جماعية فردية / مفتوحة | الجرعة الإجمالية من 0.5-3 مليون
|
الأولية: حدوث أحداث سلبية مرتبطة بالعلاج | لا توجد جهات اتصال أو مواقع مقدمة |
| ٧ | التوظيف | NCT05507593 | دراسة خلايا DLL3-CARNK في علاج سرطان الرئة صغير الخلايا في المرحلة المتقدمة | سرطان الرئة ذو الخلايا الصغيرة، المرحلة المتقدمة | خلايا DLL3-CAR-NK | المرحلة 1/
|
من 18 سنة إلى 75 سنة | كل | التعيين المتسلسل/ مفتوح | المجموعة أ:
|
أساسي: DLT، MTD | معهد ومستشفى تيانجين الطبي للسرطان |
| ٨ | غير معروف | NCT03415100 | دراسة تجريبية لخلايا CARNK المستهدفة بواسطة ligand NKG2D في مرضى الأورام الصلبة النقيليّة | ورم صلب | بيولوجي: خلايا CAR-NK تستهدف جزيئات NKG2D | المرحلة 1/
|
من 18 سنة إلى 70 سنة | كل | مهمة جماعية فردية / مفتوحة | الأولية: عدد الأحداث السلبية الثانوية: الاستجابة المضادة للورم نتيجة حقن خلايا CAR-NK | المستشفى الثالث التابع لجامعة غوانغتشو الطبية | |
| 9 | غير معروف | NCT03940820 | البحث السريري عن خلايا CARNK المحددة لـ ROBO1 لدى المرضى الذين يعانون من أورام صلبة | ورم صلب | خلايا CAR-NK ROBO1 | المرحلة 1، المرحلة 2/
|
من 18 سنة إلى 75 سنة | كل | مهمة جماعية فردية / مفتوحة | الأولية: حدوث الأحداث السلبية المرتبطة بالعلاج كما تم تقييمها بواسطة CTCAE v4.03 | قسم العلاج الإشعاعي، مركز سوتشو للسرطان، مستشفى سوتشو التابع لجامعة نانجينغ الطبية |
| صف | حالة | معرف الحكومة | عنوان الدراسة | الشروط | التدخلات | المرحلة/ن | عصور | جنس | تصميم الدراسة | جرعة الخلايا | مقاييس النتائج | المواقع |
| 10 | توظيف | NCT04847466 | تركيبة العلاج المناعي: خلايا CARNK المعالجة بالإشعاع PD-L1 بالإضافة إلى بيمبروليزوماب بالإضافة إلى N-803 للمرضى الذين يعانون من سرطان المعدة أو الرأس والعنق المتكرر/النقائل | سرطانات تقاطع المريء والمعدة المتقدمة (GEJ) سرطان الرأس والعنق المتقدم (HNSCC) | دواء: N-803 دواء: بيمبروليزوماب PD-L1 t-haNK | المرحلة 2/
|
18 سنة وما فوق | كل | مهمة جماعية فردية / مفتوحة | خلايا NK CAR المستهدفة لـ PD-L1
|
أساسي:
|
المركز السريري للمعاهد الوطنية للصحة بيثيسدا، ماريلاند، الولايات المتحدة |
| 11 | لم يتم التوظيف بعد | NCT05845502 | دراسة سريرية مفتوحة ذات ذراع واحدة لعقار SZ003 في علاج سرطان الكبد الخلوي المتقدم | سرطان الكبد الخلوي المتقدم | SZ003 سيارة-NK | غير قابل للتطبيق/
|
من 18 سنة إلى 80 سنة | كل | مهمة جماعية فردية / مفتوحة | SZ003 CAR-NK في دراسة التصعيد، كانت الجرعة الأولية الدنيا هي
|
الرئيسي: عدد الأحداث السلبية، معدل الاستجابة الكلي، البقاء على قيد الحياة | كلية الطب بجامعة شانتو؛ شركة قوانغدونغ بروكاب زوم للعلوم الحيوية المحدودة. |
| 12 | غير معروف | NCT03941457 | البحث السريري عن خلايا BiCAR-NK المحددة لـ ROBO1 لدى مرضى سرطان البنكرياس | سرطان البنكرياس | خلايا BiCAR-NK (خلايا ROBO1 CAR-NK) | المرحلة 1، المرحلة 2/
|
من 18 سنة إلى 75 سنة | كل | مهمة جماعية فردية / مفتوحة | الأولية: حدوث الأحداث السلبية المرتبطة بالعلاج كما تم تقييمها بواسطة CTCAE v4.03 | قسم الأشعة، مستشفى رويجين بشنغهاي | |
| ١٣ | غير معروف | NCT03931720 | البحث السريري عن خلايا NK/T ثنائية الخصوصية ROBO1 على مرضى الأورام الخبيثة | ورم خبيث | خلايا BiCAR-NK/T (خلايا ROBO1 CAR-NK/T) | المرحلة 1، المرحلة 2/
|
من 18 سنة إلى 75 سنة | كل | مهمة جماعية فردية / مفتوحة | الأولية: حدوث الأحداث السلبية المرتبطة بالعلاج كما تم تقييمها بواسطة CTCAE v4.04 | قسم الأورام، مستشفى سوتشو كولون، جامعة شنغهاي جياوتونغ كلية الطب | |
| 14 | لم يبدأ التوظيف بعد | NCT05686720 | دراسة سريرية مفتوحة ذات ذراع واحدة لعقار SZ011 في علاج سرطان الثدي الثلاثي السلبي المتقدم | سرطان الثدي الثلاثي السلبي المتقدم | سيارة SZ011-NK | المرحلة المبكرة
|
من 18 سنة إلى 80 سنة | أنثى | مهمة جماعية فردية / مفتوحة | الجرعة الأولية الدنيا كانت
|
الأولية: عدد الأحداث السلبية، معدل الاستجابة الكلي الثانوية: بقاء خالي من التقدم، مدة الاستجابة، معدل الاستجابة المرضية، البقاء على قيد الحياة | المستشفى الأول التابع لكلية الطب بجامعة شانتو، شركة قوانغدونغ بروكاب زوم للعلوم الحيوية المحدودة. |
| 15 | التوظيف | NCT03692663 | دراسة خلايا NK CAR المضادة لـ PSMA (TABP EIC) في سرطان البروستاتا المقاوم للإخصاء النقيلي | سرطان البروستاتا المقاوم للإخصاء النقيلي | تابب إي آي سي؛ سيكلوفوسفاميد 2023-6-5؛ فلودارابين | المرحلة المبكرة
|
18 سنة وما فوق | كل | مهمة جماعية فردية / مفتوحة | جرعة واحدة من
|
الأول: حدوث الأحداث السلبية المتعلقة بالعلاج كما تم تقييمه بواسطة CTCAE v5.0. الثانوي: التحليل الدوائي لـ TABP EIC، نسبة المرضى الذين شهدوا انخفاضًا في مستويات PSA من خط الأساس، فترة البقاء بدون تقدم سريري، الوقت حتى التقدم السريري. | مستشفى الشعب في تيانجين |
| 16 | لم يبدأ التوظيف بعد | NCT05856643 | دراسة سريرية مفتوحة ذات ذراع واحدة لعقار SZ011 في علاج سرطان المبيض الظهاري | سرطان الظهارة المبيضية | دواء: SZ011 CAR-NK | المرحلة المبكرة
|
من 18 سنة إلى 80 سنة | أنثى | مهمة جماعية فردية / مفتوحة | في دراسة التصعيد، كانت الجرعة الأولية الدنيا هي
|
الأولية: عدد الأحداث السلبية، معدل الاستجابة الكلي، البقاء على قيد الحياة، فترة البقاء بدون تقدم | كلية الطب بجامعة شانتو |
| 17 | التوظيف | NCT05248048 | خلايا CAR-T NKG2D لعلاج المرضى الذين تم علاجهم سابقًا من سرطان القولون المستقيمي النقيلي الكبدي | سرطان القولون المستقيمي النقيلي المقاوم للعلاج | بيولوجي: حقن CAR-T | المرحلة المبكرة
|
من 18 سنة إلى 75 سنة | كل | مهمة جماعية فردية / مفتوحة | أساسي: DLT، MTD ثانوي: ORR، OS | المستشفى الثالث التابع لجامعة غوانغتشو الطبية |
| صف | حالة | معرف الحكومة | عنوان الدراسة | الشروط | التدخلات | المرحلة/ن | عصور | جنس | تصميم الدراسة | جرعة الخلايا | مقاييس النتائج | المواقع |
| 18 | التوظيف | NCT03383978 | حقن داخل الجمجمة لخلايا NK-92/5.28.z بالاشتراك مع إيزابنليماب عن طريق الوريد في مرضى الورم الدبقي المتكرر الإيجابي HER2 | ورم دبقي متعدد الأشكال | NK-92/5.28.z; إزابنليماب | المرحلة 1،
|
18 سنة وما فوق | كل | مهمة جماعية فردية / مفتوحة | التطبيق داخل الجمجمة لـ NK-92/5.28.z
|
الأولية: عدد المشاركين الذين تعرضوا لآثار جانبية مرتبطة بالعلاج، الحد الأقصى للجرعة أو الحد الأقصى للجرعة المسموح بها لـ NK-92/5.28.z، فترة قابلية اكتشاف خلايا NK-92/5.28.z في الدم والسائل الدماغي الشوكي (CSF) خلال الأسابيع الأربعة والعشرين الأولى بعد تطبيق NK-92/5.28.z باستخدام qPCR، اكتشاف NK-92/5.28.z في الدم أو السائل الدماغي الشوكي باستخدام qPCR. ملف السيتوكينات في الدم والسائل الدماغي الشوكي. الثانوية: الاستجابة المناعية، معدل الاستجابة الكلي، البقاء بدون تقدم، البقاء على قيد الحياة. | عيادة جراحة الأعصاب، الطب الجامعي مانهايم؛ عيادة جراحة الأعصاب، الطب الجامعي ماينز؛ عيادة جراحة الأعصاب، الطب الجامعي ماينز؛ مستشفى جامعة يوهان و. غوتة، معهد سينكنبرغ للأورام العصبية |
| 19 | التوظيف | NCT05703854 | دراسة خلايا NK المشتقة من دم الحبل السري المعالجة بـ IL15 المهندسة CAR.70 بالتزامن مع العلاج الكيميائي المزيل للخلايا اللمفاوية لإدارة سرطان الخلايا الكلوية المتقدم، الميزوثليوما وساركوما العظام | سرطان الخلايا الكلوية المتقدم؛ الميزوثليوما المتقدمة؛ الساركوما العظمية المتقدمة | خلايا NK المشتقة من خلايا الدم الجذعية المعدلة بـ CAR.70/IL15؛ فلوDarabine فوسفات | المرحلة 1، المرحلة 2/
|
من 18 سنة إلى 80 سنة | كل | مهمة جماعية فردية / مفتوحة | حدوث الأحداث السلبية | مركز إم دي أندرسون للسرطان | |
| 20 | غير معروف | NCT02839954 | علاج المناعة بخلايا CAR-pNK في الأورام الصلبة الإيجابية لمستضد MUC1 المتكررة أو المقاومة للعلاج | سرطان الكبد الخلوي؛ سرطان الرئة غير صغير الخلايا؛ سرطان البنكرياس؛ سرطان الثدي الغازي الثلاثي السلبي؛ الورم الدبقي الخبيث في الدماغ؛ سرطان القولون والمستقيم؛ سرطان المعدة | خلايا CAR-pNK المضادة لـ MUC1 | المرحلة 1، المرحلة 2/
|
18 سنة وما فوق | كل | مهمة جماعية فردية / مفتوحة | الأول: الأحداث السلبية المنسوبة إلى إعطاء خلايا CAR-pNK المضادة لـ MUC1، تحديد ملف السمية لخلايا CAR-pNK المستهدفة لـ MUC1 باستخدام معايير السمية الشائعة للأحداث السلبية. الثانوي: معدل الاستجابة الكلي. | شركة بيرسون جين للعلاج الحيوي (سوتشو) المحدودة | |
| 21 | التوظيف | NCT05137275 | دراسة علاج خلايا CAR-raNK المضادة لـ 5T4 في الأورام الصلبة المتقدمة محليًا أو المنتشرة | الأورام الصلبة المتقدمة محليًا أو المنتشرة | خلايا CAR-raNK المضادة لـ ST4 | المرحلة المبكرة
|
من 18 سنة إلى 80 سنة | كل | مهمة جماعية فردية / مفتوحة | في الـ
|
الأولية: تقنيات دفتر الأستاذ الموزع، العوامل المعززة، معدل الاستجابة الكلي، معدل الاستجابة الجزئية، معدل البقاء على قيد الحياة الخالي من التقدم، البقاء على قيد الحياة الكلي. الثانوية: عدد خلايا CAR-raNK، إفراز السيتوكينات، نوع الخلايا اللمفاوية، الأجسام المضادة المضادة لـ CAR. | مستشفى شرق شنغهاي |
| ٢٢ | التوظيف | NCT05143151 | خلايا T المستهدفة بمستقبلات المستضدات الهجينة CD276 في علاج سرطان البنكرياس المتقدم | سرطان البنكرياس المتقدم | خلايا CAR-T CD276 | من 18 سنة إلى 75 سنة | كل | مهمة جماعية فردية / مفتوحة | الأولي: ORR الثانوي: OS |
| الجدول 1. مستمر | ||||||||||||
| صف | حالة | معرف الحكومة | عنوان الدراسة | الشروط | التدخلات | المرحلة/ن | عصور | جنس | تصميم الدراسة | جرعة الخلايا | مقاييس النتائج | المواقع |
| 23 | التوظيف | NCT03882840 | العلاج المناعي الخلوي الشبيه بخلايا T المحفزة لعلاج السرطان الذي يفتقر إلى MHC-I | العلاج المناعي للخلايا المضادة للسرطان: خلايا T وخلايا NK | علاج خلايا NK | المرحلة 1، المرحلة 2/
|
18 سنة وما فوق | كل | مهمة جماعية فردية / مفتوحة | الأول: سلامة وتحمل علاج المناعة بخلايا ITNK. الثاني: نسبة المرضى الذين حققوا أفضل استجابة إما بالشفاء التام أو الشفاء الجزئي. | المستشفى الثاني التابع لجامعة غوانغتشو الطبية | |
| ٢٤ | التسجيل عن طريق الدعوة | NCT03656705 | علاج المناعة بخلايا CCCR-NK92 لسرطان الرئة غير صغير الخلايا | سرطان الرئة غير صغير الخلايا | خلايا CCCR-NK92 | المرحلة 1،
|
من 18 سنة إلى 75 سنة | كل | مهمة جماعية فردية / مفتوحة | ستتم إدارة خلايا CCCR-NK92 عن طريق الوريد على مدى ساعة واحدة. ستكون الجرعة الابتدائية من خلايا CCCR-NK92 هي
|
الأولية: عدد المشاركين الذين تعرضوا لآثار جانبية، معدل الاستجابة الكلية. الثانوية: معدل الاستجابة المرضية، البقاء بدون تقدم، البقاء على قيد الحياة. | المستشفى الأول التابع لجامعة شينشيانغ الطبية |
| ٢٥ | جارٍ | ChiCTR2100048100 | دراسة سلامة خلايا NK CAR MESO الذاتية في علاج سرطان المبيض الظهاري المقاوم للعلاج | سرطان المبيض الظهاري | ميزو كار إن كيه | المرحلة 1 | من 18 سنة إلى 70 سنة | أنثى | ذراع واحدة / مفتوح | الأولوية: السلامة | مستشفى الشعب في تشوهاي | |
REFERENCES
- Vinay DS, Ryan EP, Pawelec G, Talib WH, Stagg J, Elkord E, et al. Immune evasion in cancer: mechanistic basis and therapeutic strategies. Semin Cancer Biol. 2015;35:S185-S98.
- Cozar B, Greppi M, Carpentier S, Narni-Mancinelli E, Chiossone L, Vivier E. Tumorinfiltrating natural killer cells. Cancer Discov. 2021;11:34-44.
- Shimasaki N, Jain A, Campana D. NK cells for cancer immunotherapy. Nat Rev Drug Discov. 2020;19:200-18.
- Wrona E, Borowiec M, Potemski P. CAR-NK cells in the treatment of solid tumors. Int J Mol Sci. 2021;22:5899.
- Poznanski SM, Singh K, Ritchie TM, Aguiar JA, Fan IY, Portillo AL, et al. Metabolic flexibility determines human NK cell functional fate in the tumor microenvironment. Cell Metab. 2021;33:1205-1220.e5.
- Matsushita H, Vesely MD, Koboldt DC, Rickert CG, Uppaluri R, Magrini VJ, et al. Cancer exome analysis reveals a T-cell-dependent mechanism of cancer immunoediting. Nature. 2012;482:400-U149.
- Demaria O, Cornen S, Daeron M, Morel Y, Medzhitov R, Vivier E. Harnessing innate immunity in cancer therapy. Nature. 2019;574:45-56.
- Yuen GJ, Demissie E, Pillai S. B lymphocytes and cancer: a love-hate relationship. Trends Cancer. 2016;2:747-57.
- Thomas A, Teicher BA, Hassan RT. Antibody-drug conjugates for cancer therapy. Lancet Oncol. 2016;17:E254-E62.
- Morgan RA, Dudley ME, Wunderlich JR, Hughes MS, Yang JC, Sherry RM, et al. Cancer regression in patients after transfer of genetically engineered lymphocytes. Science. 2006;314:126-9.
- Starnes CO. Coley’s toxins in perspective. Nature. 1992;357:11-2.
- Gaugler B, Van den Eynde B, van der Bruggen P, Romero P, Gaforio JJ, De Plaen E , et al. Human gene MAGE-3 codes for an antigen recognized on a melanoma by autologous cytolytic T lymphocytes. J Exp Med. 1994;179:921-30.
- Pardoll DM. The blockade of immune checkpoints in cancer immunotherapy. Nat Rev Cancer. 2012;12:252-64.
- Chaft JE, Shyr Y, Sepesi B, Forde PM. Preoperative and postoperative systemic therapy for operable non-small-cell lung cancer. J Clin Oncol. 2022;40:546-55.
- Uprety D, Mandrekar SJ, Wigle D, Roden AC, Adjei AA. Neoadjuvant immunotherapy for NSCLC: current concepts and future approaches. J Thorac Oncol. 2020;15:1281-97.
- Tang T, Huang X, Zhang G, Hong Z, Bai X, Liang T. Advantages of targeting the tumor immune microenvironment over blocking immune checkpoint in cancer immunotherapy. Signal Transduct Target Ther. 2021;6:72.
- Tan S, Li D, Zhu X. Cancer immunotherapy: pros, cons and beyond. Biomed Pharmacother. 2020;124:109821.
- Sadelain M, Riviere I, Riddell S. Therapeutic T cell engineering. Nature. 2017;545:423-31.
- Schmidt P, Raftery MJ, Pecher G. Engineering NK cells for CAR therapy-recent advances in gene transfer methodology. Front Immunol. 2020;11:611163.
- Khawar MB, Sun H, et al. CAR-NK cells: from natural basis to design for kill. Front Immunol. 2021;12:707542.
- Terren I, Orrantia A, Vitalle J. NK cell metabolism and tumor microenvironment. Front Immunol. 2019;10:2278.
- Berrien-Elliott MM, Becker-Hapak M, Cashen AF, Jacobs M, Wong P, Foster M, et al. Systemic IL-15 promotes allogeneic cell rejection in patients treated with natural killer cell adoptive therapy. Blood. 2022;139:1177-83.
- Albinger N, Hartmann J, Ullrich E. Current status and perspective of CAR-T and CAR-NK cell therapy trials in Germany. Gene Ther. 2021;28:513-27.
- Dermani FK, Samadi P, Rahmani G, Kohlan AK, Najafi R. PD-1/PD-L1 immune checkpoint: potential target for cancer therapy. J Cell Physiol. 2019;234:1313-25.
- Lecocq Q, Keyaerts M, Devoogdt N, Breckpot K. The next-generation immune checkpoint LAG-3 and its therapeutic potential in oncology: third time’s a charm. Int J Mol Sci. 2020;22,:75.
- Zhang Q, Bi J, Zheng X, Chen Y, Wang H, Wu W, et al. Blockade of the checkpoint receptor TIGIT prevents NK cell exhaustion and elicits potent anti-tumor immunity. Nat Immunol. 2018;19:723-32.
- Myers JA, Miller JS. Exploring the NK cell platform for cancer immunotherapy. Nat Rev Clin Oncol. 2021;18:85-100.
- Meng W, Hao Y, He C, Li L, Zhu G. Exosome-orchestrated hypoxic tumor microenvironment. Mol Cancer. 2019;18:57.
- Petrova V, Annicchiarico-Petruzzelli M, Melino G, Amelio I. The hypoxic tumour microenvironment. Oncogenesis. 2018;7:10.
- Teng R, Wang Y, Lv N, Zhang D, Williamson RA, Lei L, et al. Hypoxia impairs NK cell cytotoxicity through SHP-1-mediated attenuation of STAT3 and ERK signaling pathways. J Immunol Res. 2020;2020:4598476.
- Balsamo M, Manzini C, Pietra G, Raggi F, Blengio F, Mingari MC, et al. Hypoxia downregulates the expression of activating receptors involved in NK-cell-mediated target cell killing without affecting ADCC. Eur J Immunol. 2013;43:2756-64.
- Ou ZL, Luo Z, Wei W, Liang S, Gao TL, Lu YB. Hypoxia-induced shedding of MICA and HIF1A-mediated immune escape of pancreatic cancer cells from NK cells: role of circ_0000977/miR-153 axis. RNA Biol. 2019;16:1592-603.
- Baginska J, Viry E, Berchem G, Poli A, Noman MZ, van Moer K, et al. Granzyme B degradation by autophagy decreases tumor cell susceptibility to natural killermediated lysis under hypoxia. Proc Natl Acad Sci USA. 2013;110:17450-5.
- Synnestvedt K, Furuta GT, Comerford KM, Louis N, Karhausen J, Eltzschig HK, et al. Ecto-5′-nucleotidase (CD73) regulation by hypoxia-inducible factor-1 mediates permeability changes in intestinal epithelia. J Clin Invest. 2002;110:993-1002.
- Lim SA, Moon Y, Shin MH, Kim TJ, Chae S, Yee C, et al. Hypoxia-Driven HIF1alpha activation reprograms pre-activated NK cells towards highly potent effector phenotypes via ERK/STAT3 pathways. Cancers (Basel). 2021;13:1904.
- Lawson KV, Kalisiak J, Lindsey EA, Newcomb ET, Leleti MR, Debien L, et al. Discovery of AB680: a potent and selective inhibitor of CD73. J Med Chem. 2020;63:11448-68.
- Neo SY, Yang Y, Record J, Ma R, Chen XS, Chen ZQ, et al. CD73 immune checkpoint defines regulatory NK cells within the tumor microenvironment. J Clin Investig. 2020;130:1185-98.
- Brand A, Singer K, Koehl GE, Kolitzus M, Schoenhammer G, Thiel A, et al. LDHAassociated lactic acid production blunts tumor immunosurveillance by T and NK cells. Cell Metab. 2016;24:657-71.
- Husain Z, Huang Y, Seth P, Sukhatme VP. Tumor-derived lactate modifies antitumor immune response: effect on myeloid-derived suppressor cells and NK cells. J Immunol. 2013;191:1486-95.
- Harmon C, Robinson MW, Hand F, Almuaili D, Mentor K, Houlihan DD, et al. Lactate-mediated acidification of tumor microenvironment induces apoptosis of liver-resident NK cells in colorectal liver metastasis. Cancer Immunol Res. 2019;7:335-46.
- Donnelly RP, Loftus RM, Keating SE, Liou KT, Biron CA, Gardiner CM, et al. mTORC1-dependent metabolic reprogramming is a prerequisite for NK cell effector function. J Immunol. 2014;193:4477-84.
- Slattery K, Gardiner CM. NK cell metabolism and TGFbeta – implications for immunotherapy. Front Immunol. 2019;10:2915.
- Marcais A, Cherfils-Vicini J, Viant C, Degouve S, Viel S, Fenis A, et al. The metabolic checkpoint kinase mTOR is essential for IL-15 signaling during the development and activation of NK cells. Nat Immunol. 2014;15:749-57.
- Nachef M, Ali AK, Almutairi SM, Lee SH. Targeting SLC1A5 and SLC3A2/SLC7A5 as a potential strategy to strengthen anti-tumor immunity in the tumor microenvironment. Front Immunol. 2021;12:624324.
- Assmann N, O’Brien KL, Donnelly RP, Dyck L, Zaiatz-Bittencourt V, Loftus RM, et al. Srebp-controlled glucose metabolism is essential for NK cell functional responses. Nat Immunol. 2017;18:1197-206.
- Abd-Aziz N, Stanbridge EJ, Shafee N. Bortezomib attenuates HIF-1- but not HIF-2-mediated transcriptional activation. Oncol Lett. 2015;10:2192-6.
- Hudes GR, Berkenblit A, Feingold J, Atkins MB, Rini BI, Dutcher J. Clinical trial experience with temsirolimus in patients with advanced renal cell carcinoma. Semin Oncol. 2009;36:S26-36.
- Jain RK. Antiangiogenesis strategies revisited: from starving tumors to alleviating hypoxia. Cancer Cell. 2014;26:605-22.
- Michelet X, Dyck L, Hogan A, Loftus RM, Duquette D, Wei K, et al. Metabolic reprogramming of natural killer cells in obesity limits antitumor responses. Nat Immunol. 2018;19:1330-40.
- Graham DB, Cella M, Giurisato E, Fujikawa K, Miletic AV, Kloeppel T, et al. Vav1 controls DAP10-mediated natural cytotoxicity by regulating actin and microtubule dynamics. J Immunol. 2006;177:2349-55.
- Raulet DH, Gasser S, Gowen BG, Deng W, Jung H, et al. Regulation of ligands for the NKG2D activating receptor. Annu Rev Immunol. 2013;31:413-41.
- Ullrich E, Koch J, Cerwenka A, Steinle A. New prospects on the NKG2D/NKG2DL system for oncology. Oncoimmunology. 2013;2:e26097.
- Liu H, Wang S, Xin J, Wang J, Yao C, Zhang Z. Role of NKG2D and its ligands in cancer immunotherapy. Am J Cancer Res. 2019;9:2064-78.
- Lanier LL. NKG2D receptor and its ligands in host defense. Cancer Immunol Res. 2015;3:575-82.
- Wiencke K, Spurkland A, Schrumpf E, Boberg KM. Primary sclerosing cholangitis is associated to an extended B8-DR3 haplotype including particular MICA and MICB alleles. Hepatology. 2001;34:625-30.
- Zhang C, Roder J, Scherer A, Bodden M. Bispecific antibody-mediated redirection of NKG2D-CAR natural killer cells facilitates dual targeting and enhances antitumor activity. J Immunother Cancer. 2021;9:e002980.
- Watzl C. The NKG2D receptor and its ligands-recognition beyond the “missing self”? Microbes Infect. 2003;5:31-7.
- Voskoboinik I, Whisstock JC, Trapani JA, et al. Perforin and granzymes: function, dysfunction and human pathology. Nat Rev Immunol. 2015;15:388-400.
- Sutherland CL, Chalupny NJ, Schooley K, VandenBos T, Kubin M, Cosman D. UL16binding proteins, novel MHC class I-related proteins, bind to NKG2D and activate multiple signaling pathways in primary NK cells. J Immunol. 2002;168:671-9.
- Paschen A, Sucker A, Hill B, Moll I, Zapatka M, Nguyen XD, et al. Differential clinical significance of individual NKG2D ligands in melanoma: soluble ULBP2 as an indicator of poor prognosis superior to S100B. Clin Cancer Res. 2009;15:5208-15.
- Secchiari F, Nunez SY, Sierra JM, Ziblat A, Regge MV, Raffo Iraolagoitia XL, et al. The MICA-NKG2D axis in clear cell renal cell carcinoma bolsters MICA as target in immuno-oncology. Oncoimmunology. 2022;11:2104991.
- Sakellariou C, Elhage O, Papaevangelou E, Giustarini G, Esteves AM, Smolarek D, et al. Prostate cancer cells enhance interleukin-15-mediated expansion of NK cells. BJU Int. 2020;125:89-102.
- Neviani P, Wise PM, Murtadha M, Liu CW, Wu CH, Jong AY, et al. Natural killerderived exosomal miR-186 inhibits neuroblastoma growth and immune escape mechanisms. Cancer Res. 2019;79:1151-64.
- Jinushi M, Takehara T, Tatsumi T, Kanto T, Groh V, Spies T, et al. Expression and role of MICA and MICB in human hepatocellular carcinomas and their regulation by retinoic acid. Int J Cancer. 2003;104:354-61.
- Eisele G, Wischhusen J, Mittelbronn M, Meyermann R, Waldhauer I, Steinle A, et al. TGF-beta and metalloproteinases differentially suppress NKG2D ligand surface expression on malignant glioma cells. Brain. 2006;129:2416-25.
- Trinh TL, Kandell WM, Donatelli SS, Tu N, Tejera MM, Gilvary DL, et al. Immune evasion by TGFbeta-induced miR-183 repression of MICA/B expression in human lung tumor cells. Oncoimmunology. 2019;8:e1557372.
- Wang W, Erbe AK, Hank JA, Morris ZS, Sondel PM. NK cell-mediated antibodydependent cellular cytotoxicity in cancer immunotherapy. Front Immunol. 2015;6:368.
- Guo C, Wang X, Zhang H, Zhi L, Lv T, Li M, et al. Structure-based rational design of a novel chimeric PD1-NKG2D receptor for natural killer cells. Mol Immunol. 2019;114:108-13.
- Xiao L, Cen D, Gan H, Sun Y, Huang N, Xiong H, et al. Adoptive transfer of NKG2D CAR mRNA-engineered natural killer cells in colorectal cancer patients. Mol Ther. 2019;27:1114-25.
- Debska-Zielkowska J, Moszkowska G, Zielinski M, Zielinska H, Dukat-Mazurek A, Trzonkowski P, et al. KIR receptors as key regulators of NK cells activity in health and disease. Cells. 2021;10:1777.
- Joly E, Hudrisier D. What is trogocytosis and what is its purpose? Nat Immunol. 2003;4:815.
- Dance A. Core concept: cells nibble one another via the under-appreciated process of trogocytosis. Proc Natl Acad Sci USA. 2019;116:17608-10.
- Li Y, Basar R, Wang G, Liu E, Moyes JS, Li L, et al. KIR-based inhibitory CARs overcome CAR-NK cell trogocytosis-mediated fratricide and tumor escape. Nat Med. 2022;28:2133-44.
- Sanchez-Correa B, Valhondo I, Hassouneh F, Lopez-Sejas N, Pera A, Bergua JM, et al. DNAM-1 and the TIGIT/PVRIG/TACTILE Axis: novel immune checkpoints for natural killer cell-based cancer immunotherapy. Cancers (Basel). 2019;11:877.
- Huntington ND, Martinet L, Smyth MJ. DNAM-1: would the real natural killer cell please stand up! Oncotarget. 2015;6:28537-8.
- Gao J, Zheng Q, Xin N, Wang W, Zhao C. CD155, an onco-immunologic molecule in human tumors. Cancer Sci. 2017;108:1934-8.
- Casado JG, Pawelec G, Morgado S, Sanchez-Correa B, Delgado E, Gayoso I, et al. Expression of adhesion molecules and ligands for activating and costimulatory receptors involved in cell-mediated cytotoxicity in a large panel of human melanoma cell lines. Cancer Immunol Immunother. 2009;58:1517-26.
- Focaccetti C, Benvenuto M, Pighi C, Vitelli A, Napolitano F, Cotugno N, et al. DNAM-1-chimeric receptor-engineered NK cells, combined with Nutlin-3a, more effectively fight neuroblastoma cells in vitro: a proof-of-concept study. Front Immunol. 2022;13:886319.
- Melaiu O, Lucarini V, Cifaldi L, Fruci D. Influence of the tumor microenvironment on NK cell function in solid tumors. Front Immunol. 2019;10:3038.
- Duffy MJ, Synnott NC, O’Grady S, Crown J. Targeting p53 for the treatment of cancer. Semin Cancer Biol. 2022;79:58-67.
- Kruse PH, Matta J, Ugolini S, Vivier E. Natural cytotoxicity receptors and their ligands. Immunol Cell Biol. 2014;92:221-9.
- Semeraro M, Rusakiewicz S, Zitvogel L, Kroemer G. Natural killer cell mediated immunosurveillance of pediatric neuroblastoma. Oncoimmunology. 2015;4:e1042202.
- Li Y, Yan J, Chang HM, Chen ZJ, Leung PCK. Roles of TGF-beta superfamily proteins in extravillous trophoblast invasion. Trends Endocrinol Metab. 2021;32:170-89.
- Cruz-Bermudez A, Laza-Briviesca R, Vicente-Blanco RJ, Garcia-Grande A, Coronado MJ, Laine-Menendez S, et al. Cancer-associated fibroblasts modify lung cancer metabolism involving ROS and TGF-beta signaling. Free Radic Biol Med. 2019;130:163-73.
- Gough NR, Xiang X, Mishra L. TGF-beta signaling in liver, pancreas, and gastrointestinal diseases and cancer. Gastroenterology. 2021;161:434-452.e15.
- Zeng D, Li M, Zhou R, Zhang J, Sun H, Shi M, et al. Tumor microenvironment characterization in gastric cancer identifies prognostic and immunotherapeutically relevant gene signatures. Cancer Immunol Res. 2019;7:737-50.
- Tang X, Shi L, Xie N, Liu Z, Qian M, Meng F, et al. SIRT7 antagonizes TGF-beta signaling and inhibits breast cancer metastasis. Nat Commun. 2017;8:318.
- Paauwe M, Schoonderwoerd MJA, Helderman R, Harryvan TJ, Groenewoud A, van Pelt GW, et al. Endoglin expression on cancer-associated fibroblasts regulates invasion and stimulates colorectal cancer metastasis. Clin Cancer Res. 2018;24:6331-44.
- Caja L, Dituri F, Mancarella S, Caballero-Diaz D, Moustakas A, Giannelli G, et al. TGF-beta and the tissue microenvironment: relevance in fibrosis and cancer. Int J Mol Sci. 2018;19:1294.
- Grote S, Urena-Bailen G, Chan KC, Baden C, Mezger M, Handgretinger R, et al. In vitro evaluation of CD276-CAR NK-92 functionality, migration and invasion potential in the presence of immune inhibitory factors of the tumor microenvironment. Cells. 2021;10:1020.
- Viel S, Marcais A, Guimaraes FS, Loftus R, Rabilloud J, Grau M, et al. TGF-beta inhibits the activation and functions of NK cells by repressing the mTOR pathway. Sci Signal. 2016;9:ra19.
- Castriconi R, Dondero A, Bellora F, Moretta L, Castellano A, Locatelli F, et al. Neuroblastoma-derived TGF-beta1 modulates the chemokine receptor repertoire of human resting NK cells. J Immunol. 2013;190:5321-8.
- Slattery K, Woods E, Zaiatz-Bittencourt V, Marks S, Chew S, Conroy M, et al. TGFbeta drives NK cell metabolic dysfunction in human metastatic breast cancer. J Immunother Cancer. 2021;9:e002044.
- Chaudhry K, Geiger A, Dowlati E, Lang H, Sohai DK, Hwang El, et al. Cotransducing B7H3 CAR-NK cells with the DNR preserves their cytolytic function against GBM in the presence of exogenous TGF-beta. Mol Ther Methods Clin Dev. 2022;27:415-30.
- Rosmaraki EE, Douagi I, Roth C, Colucci F, Cumano A, Di Santo JP. Identification of committed NK cell progenitors in adult murine bone marrow. Eur J Immunol. 2001;31:1900-9.
- Boulanger MJ, Garcia KC. Shared cytokine signaling receptors: structural insights from the gp130 system. Adv Protein Chem. 2004;68:107-46.
- Smith GA, Uchida K, Weiss A, Taunton J. Essential biphasic role for JAK3 catalytic activity in IL-2 receptor signaling. Nat Chem Biol. 2016;12:373-9.
- Khalil M, Wang D, Hashemi E, Terhune SS, Malarkannan S. Implications of a ‘Third Signal’ in NK cells. Cells. 2021;10:1955.
- Ullrich KA, Schulze LL, Paap EM, Muller TM, Neurath MF, Zundler S. Immunology of IL-12: an update on functional activities and implications for disease. EXCLI J. 2020;19:1563-89.
- Li L, Mohanty V, Dou J, Huang Y, Banerjee PP, Miao Q, et al. Loss of metabolic fitness drives tumor resistance after CAR-NK cell therapy and can be overcome by cytokine engineering. Sci Adv. 2023;9:eadd6997.
- Silvestre RN, Eitler J, de Azevedo JTC, Tirapelle MC, Fantacini DMC, de Souza LEB, et al. Engineering NK-CAR. 19 cells with the IL-15/IL-15Ra complex improved proliferation and anti-tumor effect in vivo. Front Immunol. 2023;14:1226518.
- Perez-Martinez A, Fernandez L, Valentin J, Martinez-Romera I, Corral MD, Ramirez M, et al. A phase I/II trial of interleukin-15-stimulated natural killer cell infusion after haplo-identical stem cell transplantation for pediatric refractory solid tumors. Cytotherapy. 2015;17:1594-603.
- Ng YY, Tay JCK, Wang S. CXCR1 expression to improve anti-cancer efficacy of intravenously injected CAR-NK cells in mice with peritoneal xenografts. Mol Ther Oncolytics. 2020;16:75-85.
- Klopotowska M, Bajor M, Graczyk-Jarzynka A, Kraft A, Pilch Z, Zhylko A, et al. PRDX-1 supports the survival and antitumor activity of primary and CARmodified NK cells under oxidative stress. Cancer Immunol Res. 2022;10: 228-44.
- Johnstone RM, Adam M, Hammond JR, Orr L, Turbide C. Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes). J Biol Chem. 1987;262:9412-20.
- Liu J, Ren L, Li S, Li W, Zheng X, Yang Y, et al. The biology, function, and applications of exosomes in cancer. Acta Pharm Sin B. 2021;11:2783-97.
- Hosseini R, Asef-Kabiri L, Yousefi H, Sarvnaz H, Salehi M, Akbari ME, et al. The roles of tumor-derived exosomes in altered differentiation, maturation and function of dendritic cells. Mol Cancer. 2021;20:83.
- Hosseini R, Sarvnaz H, Arabpour M, Ramshe SM, Asef-Kabiri L, Yousefi H, et al. Cancer exosomes and natural killer cells dysfunction: biological roles, clinical significance and implications for immunotherapy. Mol Cancer. 2022;21:15.
- Xia Y, Zhang Q, Zhen Q, Zhao Y, Liu N, Li T, et al. Negative regulation of tumorinfiltrating NK cell in clear cell renal cell carcinoma patients through the exosomal pathway. Oncotarget. 2017;8:37783-95.
- Zhao J, Schlosser HA, Wang Z, Qin J, Li J, Popp F, et al. Tumor-derived extracellular vesicles inhibit natural killer cell function in pancreatic cancer. Cancers (Basel). 2019;11:874.
- Clayton A, Mitchell JP, Court J, Linnane S, Mason MD, Tabi Z. Human tumor-derived exosomes down-modulate NKG2D expression. J Immunol. 2008;180:7249-58.
- Szczepanski MJ, Szajnik M, Welsh A, Whiteside TL, Boyiadzis M. Blast-derived microvesicles in sera from patients with acute myeloid leukemia suppress natural killer cell function via membrane-associated transforming growth factorbeta1. Haematologica. 2011;96:1302-9.
- Kim K, Gwak HS, Han N, Hong EK, Choi BK, Lee S, et al. Chimeric antigen receptor T cells with modified interleukin-13 preferentially recognize IL13Ralpha2 and suppress malignant glioma: a preclinical study. Front Immunol. 2021;12:715000.
- Wang J, Toregrosa-Allen S, Elzey BD, Utturkar S, Lanman NA, Bernal-Crespo V, et al. Multispecific targeting of glioblastoma with tumor microenvironmentresponsive multifunctional engineered NK cells. Proc Natl Acad Sci USA. 2021;118:e2107507118.
- Zhang C, Burger MC, Jennewein L, Genssler S, Schonfeld K, Zeiner P et al. ErbB2/ HER2-specific NK cells for targeted therapy of glioblastoma. J Natl Cancer Inst. 2016;108.
- Murakami T, Nakazawa T, Natsume A, Nishimura F, Nakamura M, Matsuda R, et al. Novel human NK cell line carrying CAR targeting EGFRvIII induces antitumor effects in glioblastoma cells. Anticancer Res. 2018;38:5049-56.
- Jan CI, Huang SW, Canoll P, Bruce JN, Lin YC, Pan CM, et al. Targeting human leukocyte antigen
with chimeric antigen receptors of natural killer cells convert immunosuppression to ablate solid tumors. J Immunother Cancer. 2021;9:e003050. - Lu C, Guo C, Chen H, Zhang H, Zhi L, Lv T, et al. A novel chimeric PD1-NKG2D41BB receptor enhances antitumor activity of NK92 cells against human lung cancer H1299 cells by triggering pyroptosis. Mol Immunol. 2020;122:200-6.
- Zhang X, Guo Y, Ji Y, Gao Y, Zhang M, Liu Y, et al. Cytokine release syndrome after modified CAR-NK therapy in an advanced non-small cell lung cancer patient: a case report. Cell Transpl. 2022;31:9636897221094244.
- Liu M, Huang W, Guo Y, Zhou Y, Zhi C, Chen J, et al. CAR NK-92 cells targeting DLL3 kill effectively small cell lung cancer cells in vitro and in vivo. J Leukoc Biol. 2022;112:901-11.
- Yang S, Cao B, Zhou G, Zhu L, Wang L, Zhang L, et al. Targeting B7-H3 immune checkpoint with chimeric antigen receptor-engineered natural killer cells exhibits potent cytotoxicity against non-small cell lung cancer. Front Pharm. 2020;11:1089.
- Chambers AM, Lupo KB, Wang J, Cao J, Utturkar S, Lanman N, et al. Engineered natural killer cells impede the immunometabolic CD73-adenosine axis in solid tumors. Elife. 2022;11:e73699.
- Sahm C, Schonfeld K, Wels WS. Expression of IL-15 in NK cells results in rapid enrichment and selective cytotoxicity of gene-modified effectors that carry a tumor-specific antigen receptor. Cancer Immunol Immunother. 2012;61:1451-61.
- Daldrup-Link HE, Meier R, Rudelius M, Piontek G, Piert M, Metz S, et al. In vivo tracking of genetically engineered, anti-HER2/neu directed natural killer cells to HER2/neu positive mammary tumors with magnetic resonance imaging. Eur Radio. 2005;15:4-13.
- Schonfeld K, Sahm C, Zhang C, Naundorf S, Brendel C, Odendahl M, et al. Selective inhibition of tumor growth by clonal NK cells expressing an ErbB2/ HER2-specific chimeric antigen receptor. Mol Ther. 2015;23:330-8.
- Uherek C, Tonn T, Uherek B, Becker S, Schnierle B, Klingemann HG, et al. Retargeting of natural killer-cell cytolytic activity to ErbB2-expressing cancer cells results in efficient and selective tumor cell destruction. Blood. 2002;100:1265-73.
- Liu H, Yang B, Sun T, Lin L, Hu Y, Deng M, et al. Specific growth inhibition of ErbB2-expressing human breast cancer cells by genetically modified NK-92 cells. Oncol Rep. 2015;33:95-102.
- Alkins R, Burgess A, Ganguly M, Francia G, Kerbel R, Wels WS, et al. Focused ultrasound delivers targeted immune cells to metastatic brain tumors. Cancer Res. 2013;73:1892-9.
- Liu Y, Zhou Y, Huang KH, Fang X, Li Y, Wang F, et al. Targeting epidermal growth factor-overexpressing triple-negative breast cancer by natural killer cells expressing a specific chimeric antigen receptor. Cell Prolif. 2020;53:e12858.
- Chen X, Han J, Chu J, Zhang L, Zhang J, Chen C, et al. A combinational therapy of EGFR-CAR NK cells and oncolytic herpes simplex virus 1 for breast cancer brain metastases. Oncotarget. 2016;7:27764-77.
- Hu Z. Tissue factor as a new target for CAR-NK cell immunotherapy of triplenegative breast cancer. Sci Rep. 2020;10:2815.
- Cao B, Liu M, Huang J, Zhou J, Li J, Lian H, et al. Development of mesothelinspecific CAR NK-92 cells for the treatment of gastric cancer. Int J Biol Sci. 2021;17:3850-61.
- Zhang Q, Zhang H, Ding J, Liu H, Li H, Li H, et al. Corrigendum to “combination therapy with EpCAM-CAR-NK-92 cells and regorafenib against human colorectal cancer models. J Immunol Res. 2019;2019:2070562.
- Shiozawa M, Chang CH, Huang YC, Chen YC, Chi MS, Hao HC, et al. Pharmacologically upregulated carcinoembryonic antigen-expression enhances the cytolytic activity of genetically-modified chimeric antigen receptor NK-92MI against colorectal cancer cells. BMC Immunol. 2018;19:27.
- Liu B, Liu ZZ, Zhou ML, Lin JW, Chen XM, Li Z, et al. Development of c-MET-specific chimeric antigen receptor-engineered natural killer cells with cytotoxic effects on human liver cancer HepG2 cells. Mol Med Rep. 2019;20:2823-31.
- Lee YE, Ju A, Choi HW, Kim JC, Kim EE, Kim TS, et al. Rationally designed redirection of natural killer cells anchoring a cytotoxic ligand for pancreatic cancer treatment. J Control Release. 2020;326:310-23.
- Da Y, Liu Y, Hu Y, Liu W, Ma J, Lu N, et al. STING agonist cGAMP enhances antitumor activity of CAR-NK cells against pancreatic cancer. Oncoimmunology. 2022;11:2054105.
- Teng KY, Mansour AG, Zhu Z, Li Z, Tian L, Ma S, et al. Off-the-shelf prostate stem cell antigen-directed chimeric antigen receptor natural killer cell therapy to treat pancreatic cancer. Gastroenterology. 2022;162:1319-33.
- Bai KH, Zhang YY, Li XP, Tian XP, Pan MM, Wang DW, et al. Comprehensive analysis of tumor necrosis factor-alpha-inducible protein 8 -like 2 (TIPE2): a potential novel pan-cancer immune checkpoint. Comput Struct Biotechnol J. 2022;20:5226-34.
- Zhang Q, Tian K, Xu J, Zhang H, Li L, Fu Q, et al. Synergistic effects of cabozantinib and EGFR-specific CAR-NK-92 cells in renal cell carcinoma. J Immunol Res. 2017;2017:6915912.
- Liu E, Marin D, Banerjee P, Macapinlac HA, Thompson P, Basar R, et al. Use of CAR-transduced natural killer cells in CD19-positive lymphoid tumors. N. Engl J Med. 2020;382:545-53.
- Lo Nigro C, Macagno M, Sangiolo D, Bertolaccini L, Aglietta M, Merlano MC. NKmediated antibody-dependent cell-mediated cytotoxicity in solid tumors: biological evidence and clinical perspectives. Ann Transl Med. 2019;7:105.
- Vivier E, Tomasello E, Baratin M, Walzer T, Ugolini S. Functions of natural killer cells. Nat Immunol. 2008;9:503-10.
- Xie G, Dong H, Liang Y, Ham JD, Rizwan R, Chen J. CAR-NK cells: a promising cellular immunotherapy for cancer. EBioMedicine. 2020;59:102975.
- Chang YH, Connolly J, Shimasaki N, Mimura K, Kono K, Campana D. A chimeric receptor with NKG2D specificity enhances natural killer cell activation and killing of tumor cells. Cancer Res. 2013;73:1777-86.
- Yvon ES, Burga R, Powell A, Cruz CR, Fernandes R, Barese C, et al. Cord blood natural killer cells expressing a dominant negative TGF-beta receptor: implications for adoptive immunotherapy for glioblastoma. Cytotherapy. 2017;19:408-18.
مساهمات المؤلفين
تمويل
المصالح المتنافسة
معلومات إضافية
© المؤلف(ون) 2024
قسم جراحة الثدي، المستشفى الأول التابع لجامعة تشنغتشو، تشنغتشو، الصين. قسم العلاج الإشعاعي، مستشفى السرطان التابع لجامعة تشنغتشو، مستشفى هنان للسرطان، تشنغتشو، الصين. قسم الطب الباطني، مستشفى السرطان التابع لجامعة تشنغتشو، مستشفى هنان للسرطان، تشنغتشو، الصين. مركز العلاج البيولوجي، المستشفى الأول التابع لجامعة تشنغتشو، تشنغتشو، الصين. قسم جراحة القولون والمستقيم، المستشفى الأول التابع لجامعة تشنغتشو، تشنغتشو، الصين. البريد الإلكتروني:fccwangwk@zzu.edu.cn; fccsunzq@zzu.edu.cn; gexin1981@126.com - بما في ذلك الحالة، الشروط، التداخلات، المرحلة، العمر/الجنس، المواقع، ومعلومات أخرى عن التجربة.
DOI: https://doi.org/10.1038/s41420-024-01815-9
PMID: https://pubmed.ncbi.nlm.nih.gov/38245520
Publication Date: 2024-01-20
Breakthrough of solid tumor treatment: CAR-NK immunotherapy
Abstract
As the latest and most anticipated method of tumor immunotherapy, CAR-NK therapy has received increasing attention in recent years, and its safety and high efficiency have irreplaceable advantages over CAR-T. Current research focuses on the application of CAR-NK in hematological tumors, while there are fewer studies on solid tumor. This article reviews the process of constructing CARNK, the effects of hypoxia and metabolic factors, NK cell surface receptors, cytokines, and exosomes on the efficacy of CAR-NK in solid tumor, and the role of CAR-NK in various solid tumor. The mechanism of action and the research status of the potential of CAR-NK in the treatment of solid tumor in clinical practice, and put forward the advantages, limitations and future problems of CARNK in the treatment of solid tumor.
FACTS
- This article provides a detailed introduction to the factors that currently constrain the efficacy of CAR-NK in solid tumors, providing reference for the development and design of CARNK in the future.
- At present, most of the experiments are about the effect of CAR-NK on hematological tumors. This article focuses on the latest feasibility of CAR-NK therapy in different solid tumors. Provide theoretical basis for expanding the applicability of CAR-NK therapy.
- The author collected ongoing clinical trials of CAR-NK applied to solid tumors, providing ideas for subsequent clinical trial initiators and avoiding duplicate work. At the same time, the latest developments in these experiments can also be monitored.
OPEN QUESTIONS
is needed to determine whether CAR-NK can be widely applied in the treatment of solid tumors in clinical practice in the future.
INTRODUCTION
conventional treatments, CAR-NK cells undoubtedly offer hope. Maximizing the role of CAR-NK in solid tumor is a current challenge in the field of oncology. Successful CAR-NK therapy in solid tumor requires to addressing various difficulties, including designing the optimal CAR structure and genetically modifying the intrinsic inhibitory and activating pathways of NK cells [4]. Current research indicates that the suppressive TME (nutritional deprivation and immunosuppressive state) poses a significant obstacle to the effective application of CAR-NK in solid tumors. However, the functional state and damage mechanism of NK cells within the TME remain unknown [5]. The TME can induce severe dysfunction in cytotoxic immune cells, and the extent of impaired cytotoxicity in NK cells within the TME of cancer patients is closely linked to the prognosis of various cancers. Despite this, the underlying mechanisms of NK cell dysfunction in the TME are not yet fully understood. This article addresses the challenges posed by the TME to the application of CAR-NK in solid tumors. It delves into the construction process of CAR-NK, exploring the impacts of hypoxia, metabolic factors, NK cell surface receptors, cytokines, and exosomes on the efficacy of CAR-NK in solid tumors. The mechanisms governing the functioning of CAR-NK in various solid tumors and the current research status of CAR-NK’s clinical potential for treating solid tumors are comprehensively reviewed.
TUMOR IMMUNOTHERAPY
cells in the blood and tissues. ACT encompasses various approaches, including Tumor Infiltrating Lymphocyte (TIL) therapy, Engineered T Cell Receptor (TCR) therapy, CAR-T therapy, and CAR-NK therapy.”
CAR-NK THERAPY
cytoplasmic granules containing perforin and granzymes. Secondly, The release of cytokines, such as IFN-
INFLUENCE OF HYPOXIA AND METABOLIC FACTORS ON THE EFFICACY OF CAR-NK IN SOLID TUMOR
factors (HIFs) composed of oxygen-sensitive alpha subunits (HIF1a, HIF-2a, and HIF-3a) and constitutively expressed beta subunits (HIF-1

EFFECT OF NK CELL SURFACE RECEPTORS ON THE EFFICACY OF CAR-NK IN SOLID TUMOR
NKG2D/NKG2DLs
as melanoma, neuroblastoma, prostate cancer, and kidney cancer [56, 60-63]. In addition to soluble NKG2DLs, cytokines in the TME are also involved in NKG2D-mediated tumor escape mechanisms. The pro-inflammatory cytokines IFN-
Killer cell immunoglobulin-like receptor (KIR)

DNAX accessory molecule 1 (DNAM-1)
Natural cytotoxicity receptor (NCR)
EFFECT OF CYTOKINES (CK) ON THE EFFICACY OF CAR-NK IN SOLID TUMOR
TGF-
Interleukin (IL)
through a common gamma (
THE EFFECT OF EXOSOMES ON THE EFFICACY CAR-NK IN SOLID TUMOR

from pancreatic ductal carcinoma could downregulate the expression of NK cell activating receptors, leading to NK cell dysfunction. Interestingly, several studies [111, 112] demonstrated that IL-15 could reverse the suppression of NKG2D expression by tumor exosomes and protect NK cells from the inhibitory effect of exosome-associated TGF-
ATTEMPTS OF CAR-NK IN DIFFERENT SOLID TUMOR
Glioblastoma

Lung cancer
Breast cancer
compared with MHC class I expression is irrelevant. Importantly, HER-2 CAR-NK cells exhibit enhanced cytotoxicity to tumor targets compared to donor-matched HER-2 CAR-T cells. Notably, HER-2 CAR-NK cells maintain high cytotoxic function in the presence of immunosuppressive factors enriched in solid tumors, suggesting their efficiency and safety for solid tumor immunotherapy [124-128].
Gastric cancer (GC) and colon cancer (CRC)
Liver cancer and pancreatic cancer
specificity and effectiveness of c-MET targeting CAR-NK cell immunotherapy in the treatment of human liver cancer in vitro. Recently, Chen130 constructed GPC3-CAR-NK cells based on an affinity-enhanced antibody targeting GPC3 for the treatment of liver cancer patients. L3C7c-Fc was used to reverse the high level of soluble programmed death ligand 1 (sPD-L1) in HCC patients, enhancing the effect of this CAR-NK cell and providing experimental evidence for the development of subsequent liver cancer immunotherapy strategies.
Renal cancer
THE CLINICAL APPLICATION POTENTIAL OF CAR-NK IN SOLID TUMORS
antigen receptors can kill cancer cells directly by releasing Perforin-1 and Granzyme or by death receptors, or by secreting cytokines and chemokines to activate immune cells such as
CONCLUSION
| Row | Status | Gov Identifier | Study Title | Conditions | Interventions | Phase/N | Ages | Gender | Study Design | Cell Dosage | Outcome Measures | Locations |
| 1 | Recruiting | NCT05410717 | Phase I/Ila Trial to Evaluate Safety and Preliminary Efficacy of CLDN6-CAR-NK in Patients With CLDN6positive Advanced Solid Tumors | Stage IV Ovarian Cancer; Testis Cancer, Refractory; Endometrial Cancer Recurrent; CAR NK | Claudin6 targeting CARNK cells | Phase 1, Phase 2/
|
18 Years to 75 Years | All | Single Group Assignment/ Open | Primary: Safety Secondary: ORR, DCR, DOR | The Second Affiliated Hospital of Guangzhou Medical University | |
| 2 | Recruiting | NCT05213195 | NKG2D CAR-NK Cell Therapy in Patients With Refractory Metastatic Colorectal Cancer | Refractory Metastatic Colorectal Cancer | NKG2D CAR-NK | Phase 1/
|
18 Years to 70 Years | All | Sequential Assignment/ Open | Primary: Dose-Limiting Toxicity, Maximal Tolerable Dose Secondary: DOR, ORR, OS | The First Affiliated Hospital, Zhejiang University | |
| 3 | Recruiting | NCT05528341 | NKG2D-CAR-NK92 Cells Immunotherapy for Solid Tumors | Relapsed/Refractory Solid Tumor | NKG2D-CAR-NK92 cells | Phase 1/
|
18 Years to 75 Years | All | Single Group Assignment/ Open | NKG2D-CAR-NK92 cells will be administered intravenously over 1 h . The starting dose of NKG2D-CAR-NK92 cells will be
|
Primary: Safety, ORR Secondary: DCR, PFS, OS, Quality of Life Score | The first Affiliated Hospital of Xinxiang Medical University |
| 4 | Recruiting | NCT05776355 | NKG2D CAR-NK & Ovarian Cancer | Ovarian Cancer | NKG2D CAR-NK | Not Applicable/
|
18 Years and older | Female | Single Group Assignment/ Open | Primary: Dose-Limiting Toxicity, Maximal Tolerable Dose | Zhejiang Cancer Hospital | |
| 5 | Recruiting | NCT05194709 | Study of Anti-ST4 CAR-NK Cell Therapy in Advanced Solid Tumors | Advanced Solid Tumors | Anti-CAR-NK Cells | Early Phase
|
18 Years to 80 Years | All | Single Group Assignment/ Open | The administration of CAR-NK cell will be performed on day 1 and day 3 of each cycle ( 21 days). The first administration dose in the first cycle is
|
Primary: safety and tolerability of anti-5T4 CAR-NK cells Secondary: ORR, PFS, OS, DCR, Cytokine release, Lymphocyte subtype | Wuxi People’s Hospital |
| 6 | Unknown | NCT03692637 | Study of AntiMesothelin Car NK Cells in Epithelial Ovarian Cancer | Epithelial Ovarian Cancer | Anti-Mesothelin Car NK Cells | Early Phase
|
18 Years to 70 Years | Female | Single Group Assignment/ Open | Total dose of 0.5-3 million
|
Primary: Occurrence of treatment related adverse events | No Contacts or Locations Provided |
| 7 | Recruiting | NCT05507593 | Study of DLL3-CARNK Cells in the Treatment of Extensive Stage Small Cell Lung Cancer | SCLC, Extensive Stage | DLL3-CAR-NK cells | Phase 1/
|
18 Years to 75 Years | All | Sequential Assignment/ Open | group A:
|
Primary: DLT, MTD | Tianjin Medical University Cancer Institute and Hospital |
| 8 | Unknown | NCT03415100 | Pilot Study of NKG2DLigand Targeted CARNK Cells in Patients With Metastatic Solid Tumours | Solid Tumour | Biological: CAR-NK cells targeting NKG2D ligands | Phase 1/
|
18 Years to 70 Years | All | Single Group Assignment/ Open | Primary:Number of Adverse Events Secondary: Anti-tumour response due to CAR-NK cell infusions | Third Affiliated Hospital of Guangzhou Medical University | |
| 9 | Unknown | NCT03940820 | Clinical Research of ROBO1 Specific CARNK Cells on Patients With Solid Tumors | Solid Tumor | ROBO1 CAR-NK cells | Phase 1, Phase 2/
|
18 Years to 75 Years | All | Single Group Assignment/ Open | Primary:Occurrence of treatment related adverse events as assessed by CTCAE v4.03 | Radiation Therapy Department, Suzhou Cancer Center, Suzhou Hospital Affiliated to Nanjing Medical University |
| Row | Status | Gov Identifier | Study Title | Conditions | Interventions | Phase/N | Ages | Gender | Study Design | Cell Dosage | Outcome Measures | Locations |
| 10 | Recruiting | NCT04847466 | Immunotherapy Combination: Irradiated PD-L1 CARNK Cells Plus Pembrolizumab Plus N-803 for Subjects With Recurrent/ Metastatic Gastric or Head and Neck Cancer | Gastroesophageal Junction (GEJ) Cancers Advanced HNSCC | Drug: N-803 Drug: Pembrolizumab PD-L1 t-haNK | Phase 2/
|
18 Years and older | All | Single Group Assignment/ Open | PD-L1 CAR NK cells
|
Primary:
|
National Institutes of Health Clinical Center Bethesda, Maryland, United States |
| 11 | Not yet recruiting NEW | NCT05845502 | Single-arm, Openlabel Clinical Study of SZ003 in the Treatment of Advanced Hepatocellular Carcinoma | Advanced Hepatocellular Carcinoma | SZ003 CAR-NK | Not Applicable/
|
18 Years to 80 Years | All | Single Group Assignment/ Open | SZ003 CAR-NK In the escalation study, the minimum initial dose was
|
Primary: Number of Adverse Events, ORR, OS | Shantou University Medical College; Guangdong ProCapZoom Biosciences Co., Ltd. |
| 12 | Unknown | NCT03941457 | Clinical Research of ROBO1 Specific BiCAR-NK Cells on Patients With Pancreatic Cancer | Pancreatic Cancer | BiCAR-NK cells (ROBO1 CAR-NK cells) | Phase 1, Phase 2/
|
18 Years to 75 Years | All | Single Group Assignment/ Open | Primary: Occurrence of treatment related adverse events as assessed by CTCAE v4.03 | Department of Radiology, Shanghai Ruijin Hospital | |
| 13 | Unknown | NCT03931720 | Clinical Research of ROBO1 Specific BiCAR-NK/T Cells on Patients With Malignant Tumor | Malignant Tumor | BiCAR-NK/T cells (ROBO1 CAR-NK/T cells) | Phase 1, Phase 2/
|
18 Years to 75 Years | All | Single Group Assignment/ Open | Primary: Occurrence of treatment related adverse events as assessed by CTCAE v4.04 | Department of Oncology, Suzhou Kowloon Hospital, Shanghai Jiaotong University School of Medicine | |
| 14 | Not yet recruiting | NCT05686720 | Single-arm, Openlabel Clinical Study of SZ011 in the Treatment of Advanced Triple Negative Breast Cancer | Advanced Triple Negative Breast Cancer | SZ011 CAR-NK | Early Phase
|
18 Years to 80 Years | Female | Single Group Assignment/ Open | the minimum initial dose was
|
Primary: Number of Adverse Events, ORR Secondary: PFS, DOR, DCR,OS | First Affiliated Hospital of Shantou University Medical College Guangdong ProCapZoom Biosciences Co., Ltd. |
| 15 | Recruiting | NCT03692663 | Study of Anti-PSMA CAR NK Cell (TABP EIC) in Metastatic Castration-Resistant Prostate Cancer | Metastatic Castrationresistant Prostate Cancer | TABP EIC; Cyclophosphamide2023-6-5; fludarabine | Early Phase
|
18 Years and older | All | Single Group Assignment/ Open | A single dose of
|
Primary: Occurrence of treatment related adverse events as assessed by CTCAE v5.0 Secnodary:he pharmacokinetic analysis of TABP EIC, The proportion of patients with a decrease in PSA levels from baseline, PFS,Time to clinical progression | Tianjin pepole’s hosptial |
| 16 | Not yet recruiting | NCT05856643 | Single-arm, Openlabel Clinical Study of SZ011 in the Treatment of Ovarian Epithelial Carcinoma | Ovarian Epithelial Carcinoma | Drug: SZ011 CAR-NK | Early Phase
|
18 Years to 80 Years | Female | Single Group Assignment/ Open | In the escalation study, the minimum initial dose was
|
Primary: Number of Adverse Events, ORR, OS, PFS | Shantou University Medical College |
| 17 | Recruiting | NCT05248048 | NKG2D CAR-T Cells to Treat Patients With Previously Treated Liver Metastatic Colorectal Cancer | Refractory Metastatic Colorectal Cancer | Biological: CAR-T infusion | Early Phase
|
18 Years to 75 Years | All | Single Group Assignment/ Open | Primary: DLT, MTD Secondary: ORR, OS | The Third Affiliated Hospital of Guangzhou Medical University |
| Row | Status | Gov Identifier | Study Title | Conditions | Interventions | Phase/N | Ages | Gender | Study Design | Cell Dosage | Outcome Measures | Locations |
| 18 | Recruiting | NCT03383978 | Intracranial Injection of NK-92/5.28.z Cells in Combination With Intravenous Ezabenlimab in Patients With Recurrent HER2positive Glioblastoma | Glioblastoma | NK-92/5.28.z; Ezabenlimab | Phase 1,
|
18 Years and older | All | Single Group Assignment/ Open | Intracranial application of NK-92/5.28.z,
|
Primary: Number of participants with treatment-related adverse events, MTD or MFD for NK-92/5.28.z, Period of detectability of NK-92/ 5.28.z cells in blood and cerebrospinal fluid (CSF) during the first 24 weeks after NK-92/5.28.z application with qPCR, qPCR detection of NK-92/ 5.28.z in blood or CSF. Cytokine profile in the blood and the cerebrospinal fluid Secondary: immune response., ORR, PFS, OS | Neurochirurgische Klinik, Universitätsmedizin Mannheim; Neurochirurgische Klinik, Universitätsmedizin Mainz; Neurochirurgische Klinik, Universitätsmedizin Mainz; Johann W. Goethe University Hospital, Senckenberg Institute of Neurooncology |
| 19 | Recruiting | NCT05703854 | Study of CAR.70engineered IL15transduced Cord Blood-derived NK Cells in Conjunction With Lymphodepleting Chemotherapy for the Management of Advanced Renal Cell Carcinoma, Mesothelioma and Osteosarcoma | Advanced Renal Cell Carcinoma;Advanced Mesothelioma; Advanced Osteosarcoma | CAR.70/IL15-transduced CB-derived NK cells; Fludarabine phosphate | Phase 1, Phase 2/
|
18 Years to 80 Years | All | Single Group Assignment/ Open | Incidence of Adverse Events | M D Anderson Cancer Center | |
| 20 | Unknown | NCT02839954 | CAR-pNK Cell Immunotherapy in MUC1 Positive Relapsed or Refractory Solid Tumor | Hepatocellular Carcinoma; Non-small Cell; Lung Cancer; Pancreatic Carcinoma; Triple-Negative Invasive Breast Carcinoma; Malignant Glioma of Brain; Colorectal Carcinoma; Gastric Carcinoma | Anti-MUC1 CAR-pNK cells | Phase 1, Phase 2/
|
18 Years and older | All | Single Group Assignment/ Open | Primary: Adverse events attributed to the administration of the antiMUC1 CAR-pNK cells, Determine the toxicity profile of the MUC1 targeted CAR-pNK cells with Common Toxicity Criteria for Adverse Effects Secondary: ORR | PersonGen BioTherapeutics (Suzhou) Co., Ltd. | |
| 21 | Recruiting | NCT05137275 | Study of Anti-5T4 CAR-raNK Cell Therapy in Locally Advanced or Metastatic Solid Tumors | Locally Advanced or Metastatic Solid Tumors | Anti-ST4 CAR-raNK Cells | Early Phase
|
18 Years to 80 Years | All | Single Group Assignment/ Open | In the
|
Primary: DLTs, AEs, ORR, DCR, DOR, PFS, OS Secondary: The number of CAR-raNK cells, Cytokine release, Lymphocyte subtype, Anti-CAR antibodies | Shanghai East Hospital |
| 22 | Recruiting | NCT05143151 | CD276-targeted Chimeric Antigen Receptor T Cells in Treatment With Advanced Pancreatic Cancer | Advanced Pancreatic Carcinoma | CD276 CAR-T cells | 18 Years to 75 Years | All | Single Group Assignment/ Open | Primary: ORR Secondary: OS |
| Table 1. continued | ||||||||||||
| Row | Status | Gov Identifier | Study Title | Conditions | Interventions | Phase/N | Ages | Gender | Study Design | Cell Dosage | Outcome Measures | Locations |
| 23 | Recruiting | NCT03882840 | Induced-T Cell Like NK Cellular Immunotherapy for Cancer Lack of MHC-I | Anti-cancer Cell Immunotherapy T Cell and NK Cell | NK cell therapy | Phase 1, Phase 2/
|
18 Years and older | All | Single Group Assignment/ Open | Primary: The safety and tolerance of the ITNK cell immunotherapy Secondary: Percent of Patients with best response as either complete remission or partial remission. | The Second Affiliated Hospital of Guangzhou Medical University | |
| 24 | Enrolling by invitation | NCT03656705 | CCCR-NK92 Cells Immunotherapy for Non-small Cell Lung Carcinoma | Non-small Cell Lung Cancer | CCCR-NK92 cells | Phase 1,
|
18 Years to 75 Years | All | Single Group Assignment/ Open | CCCR-NK92 cells will be administered intravenously over 1 h . The starting dose of CCCR-NK92 cells will be
|
Primary: Number of participants with adverse events, ORR. Secondary: DCR, PFS, OS | The first Affiliated Hospital of Xinxiang Medical University |
| 25 | Ongoing | ChiCTR2100048100 | Safety Study of autologous MESO CAR NK cells in the treatment of refractory epithelial ovarian carcinoma | Epithelial ovarian carcinoma | MESO CAR NK | Phase 1 | 18 Years to 70 Years | Female | Single arm/ Open | Primary: safety | Zhuhai People’s Hospital | |
REFERENCES
- Vinay DS, Ryan EP, Pawelec G, Talib WH, Stagg J, Elkord E, et al. Immune evasion in cancer: mechanistic basis and therapeutic strategies. Semin Cancer Biol. 2015;35:S185-S98.
- Cozar B, Greppi M, Carpentier S, Narni-Mancinelli E, Chiossone L, Vivier E. Tumorinfiltrating natural killer cells. Cancer Discov. 2021;11:34-44.
- Shimasaki N, Jain A, Campana D. NK cells for cancer immunotherapy. Nat Rev Drug Discov. 2020;19:200-18.
- Wrona E, Borowiec M, Potemski P. CAR-NK cells in the treatment of solid tumors. Int J Mol Sci. 2021;22:5899.
- Poznanski SM, Singh K, Ritchie TM, Aguiar JA, Fan IY, Portillo AL, et al. Metabolic flexibility determines human NK cell functional fate in the tumor microenvironment. Cell Metab. 2021;33:1205-1220.e5.
- Matsushita H, Vesely MD, Koboldt DC, Rickert CG, Uppaluri R, Magrini VJ, et al. Cancer exome analysis reveals a T-cell-dependent mechanism of cancer immunoediting. Nature. 2012;482:400-U149.
- Demaria O, Cornen S, Daeron M, Morel Y, Medzhitov R, Vivier E. Harnessing innate immunity in cancer therapy. Nature. 2019;574:45-56.
- Yuen GJ, Demissie E, Pillai S. B lymphocytes and cancer: a love-hate relationship. Trends Cancer. 2016;2:747-57.
- Thomas A, Teicher BA, Hassan RT. Antibody-drug conjugates for cancer therapy. Lancet Oncol. 2016;17:E254-E62.
- Morgan RA, Dudley ME, Wunderlich JR, Hughes MS, Yang JC, Sherry RM, et al. Cancer regression in patients after transfer of genetically engineered lymphocytes. Science. 2006;314:126-9.
- Starnes CO. Coley’s toxins in perspective. Nature. 1992;357:11-2.
- Gaugler B, Van den Eynde B, van der Bruggen P, Romero P, Gaforio JJ, De Plaen E , et al. Human gene MAGE-3 codes for an antigen recognized on a melanoma by autologous cytolytic T lymphocytes. J Exp Med. 1994;179:921-30.
- Pardoll DM. The blockade of immune checkpoints in cancer immunotherapy. Nat Rev Cancer. 2012;12:252-64.
- Chaft JE, Shyr Y, Sepesi B, Forde PM. Preoperative and postoperative systemic therapy for operable non-small-cell lung cancer. J Clin Oncol. 2022;40:546-55.
- Uprety D, Mandrekar SJ, Wigle D, Roden AC, Adjei AA. Neoadjuvant immunotherapy for NSCLC: current concepts and future approaches. J Thorac Oncol. 2020;15:1281-97.
- Tang T, Huang X, Zhang G, Hong Z, Bai X, Liang T. Advantages of targeting the tumor immune microenvironment over blocking immune checkpoint in cancer immunotherapy. Signal Transduct Target Ther. 2021;6:72.
- Tan S, Li D, Zhu X. Cancer immunotherapy: pros, cons and beyond. Biomed Pharmacother. 2020;124:109821.
- Sadelain M, Riviere I, Riddell S. Therapeutic T cell engineering. Nature. 2017;545:423-31.
- Schmidt P, Raftery MJ, Pecher G. Engineering NK cells for CAR therapy-recent advances in gene transfer methodology. Front Immunol. 2020;11:611163.
- Khawar MB, Sun H, et al. CAR-NK cells: from natural basis to design for kill. Front Immunol. 2021;12:707542.
- Terren I, Orrantia A, Vitalle J. NK cell metabolism and tumor microenvironment. Front Immunol. 2019;10:2278.
- Berrien-Elliott MM, Becker-Hapak M, Cashen AF, Jacobs M, Wong P, Foster M, et al. Systemic IL-15 promotes allogeneic cell rejection in patients treated with natural killer cell adoptive therapy. Blood. 2022;139:1177-83.
- Albinger N, Hartmann J, Ullrich E. Current status and perspective of CAR-T and CAR-NK cell therapy trials in Germany. Gene Ther. 2021;28:513-27.
- Dermani FK, Samadi P, Rahmani G, Kohlan AK, Najafi R. PD-1/PD-L1 immune checkpoint: potential target for cancer therapy. J Cell Physiol. 2019;234:1313-25.
- Lecocq Q, Keyaerts M, Devoogdt N, Breckpot K. The next-generation immune checkpoint LAG-3 and its therapeutic potential in oncology: third time’s a charm. Int J Mol Sci. 2020;22,:75.
- Zhang Q, Bi J, Zheng X, Chen Y, Wang H, Wu W, et al. Blockade of the checkpoint receptor TIGIT prevents NK cell exhaustion and elicits potent anti-tumor immunity. Nat Immunol. 2018;19:723-32.
- Myers JA, Miller JS. Exploring the NK cell platform for cancer immunotherapy. Nat Rev Clin Oncol. 2021;18:85-100.
- Meng W, Hao Y, He C, Li L, Zhu G. Exosome-orchestrated hypoxic tumor microenvironment. Mol Cancer. 2019;18:57.
- Petrova V, Annicchiarico-Petruzzelli M, Melino G, Amelio I. The hypoxic tumour microenvironment. Oncogenesis. 2018;7:10.
- Teng R, Wang Y, Lv N, Zhang D, Williamson RA, Lei L, et al. Hypoxia impairs NK cell cytotoxicity through SHP-1-mediated attenuation of STAT3 and ERK signaling pathways. J Immunol Res. 2020;2020:4598476.
- Balsamo M, Manzini C, Pietra G, Raggi F, Blengio F, Mingari MC, et al. Hypoxia downregulates the expression of activating receptors involved in NK-cell-mediated target cell killing without affecting ADCC. Eur J Immunol. 2013;43:2756-64.
- Ou ZL, Luo Z, Wei W, Liang S, Gao TL, Lu YB. Hypoxia-induced shedding of MICA and HIF1A-mediated immune escape of pancreatic cancer cells from NK cells: role of circ_0000977/miR-153 axis. RNA Biol. 2019;16:1592-603.
- Baginska J, Viry E, Berchem G, Poli A, Noman MZ, van Moer K, et al. Granzyme B degradation by autophagy decreases tumor cell susceptibility to natural killermediated lysis under hypoxia. Proc Natl Acad Sci USA. 2013;110:17450-5.
- Synnestvedt K, Furuta GT, Comerford KM, Louis N, Karhausen J, Eltzschig HK, et al. Ecto-5′-nucleotidase (CD73) regulation by hypoxia-inducible factor-1 mediates permeability changes in intestinal epithelia. J Clin Invest. 2002;110:993-1002.
- Lim SA, Moon Y, Shin MH, Kim TJ, Chae S, Yee C, et al. Hypoxia-Driven HIF1alpha activation reprograms pre-activated NK cells towards highly potent effector phenotypes via ERK/STAT3 pathways. Cancers (Basel). 2021;13:1904.
- Lawson KV, Kalisiak J, Lindsey EA, Newcomb ET, Leleti MR, Debien L, et al. Discovery of AB680: a potent and selective inhibitor of CD73. J Med Chem. 2020;63:11448-68.
- Neo SY, Yang Y, Record J, Ma R, Chen XS, Chen ZQ, et al. CD73 immune checkpoint defines regulatory NK cells within the tumor microenvironment. J Clin Investig. 2020;130:1185-98.
- Brand A, Singer K, Koehl GE, Kolitzus M, Schoenhammer G, Thiel A, et al. LDHAassociated lactic acid production blunts tumor immunosurveillance by T and NK cells. Cell Metab. 2016;24:657-71.
- Husain Z, Huang Y, Seth P, Sukhatme VP. Tumor-derived lactate modifies antitumor immune response: effect on myeloid-derived suppressor cells and NK cells. J Immunol. 2013;191:1486-95.
- Harmon C, Robinson MW, Hand F, Almuaili D, Mentor K, Houlihan DD, et al. Lactate-mediated acidification of tumor microenvironment induces apoptosis of liver-resident NK cells in colorectal liver metastasis. Cancer Immunol Res. 2019;7:335-46.
- Donnelly RP, Loftus RM, Keating SE, Liou KT, Biron CA, Gardiner CM, et al. mTORC1-dependent metabolic reprogramming is a prerequisite for NK cell effector function. J Immunol. 2014;193:4477-84.
- Slattery K, Gardiner CM. NK cell metabolism and TGFbeta – implications for immunotherapy. Front Immunol. 2019;10:2915.
- Marcais A, Cherfils-Vicini J, Viant C, Degouve S, Viel S, Fenis A, et al. The metabolic checkpoint kinase mTOR is essential for IL-15 signaling during the development and activation of NK cells. Nat Immunol. 2014;15:749-57.
- Nachef M, Ali AK, Almutairi SM, Lee SH. Targeting SLC1A5 and SLC3A2/SLC7A5 as a potential strategy to strengthen anti-tumor immunity in the tumor microenvironment. Front Immunol. 2021;12:624324.
- Assmann N, O’Brien KL, Donnelly RP, Dyck L, Zaiatz-Bittencourt V, Loftus RM, et al. Srebp-controlled glucose metabolism is essential for NK cell functional responses. Nat Immunol. 2017;18:1197-206.
- Abd-Aziz N, Stanbridge EJ, Shafee N. Bortezomib attenuates HIF-1- but not HIF-2-mediated transcriptional activation. Oncol Lett. 2015;10:2192-6.
- Hudes GR, Berkenblit A, Feingold J, Atkins MB, Rini BI, Dutcher J. Clinical trial experience with temsirolimus in patients with advanced renal cell carcinoma. Semin Oncol. 2009;36:S26-36.
- Jain RK. Antiangiogenesis strategies revisited: from starving tumors to alleviating hypoxia. Cancer Cell. 2014;26:605-22.
- Michelet X, Dyck L, Hogan A, Loftus RM, Duquette D, Wei K, et al. Metabolic reprogramming of natural killer cells in obesity limits antitumor responses. Nat Immunol. 2018;19:1330-40.
- Graham DB, Cella M, Giurisato E, Fujikawa K, Miletic AV, Kloeppel T, et al. Vav1 controls DAP10-mediated natural cytotoxicity by regulating actin and microtubule dynamics. J Immunol. 2006;177:2349-55.
- Raulet DH, Gasser S, Gowen BG, Deng W, Jung H, et al. Regulation of ligands for the NKG2D activating receptor. Annu Rev Immunol. 2013;31:413-41.
- Ullrich E, Koch J, Cerwenka A, Steinle A. New prospects on the NKG2D/NKG2DL system for oncology. Oncoimmunology. 2013;2:e26097.
- Liu H, Wang S, Xin J, Wang J, Yao C, Zhang Z. Role of NKG2D and its ligands in cancer immunotherapy. Am J Cancer Res. 2019;9:2064-78.
- Lanier LL. NKG2D receptor and its ligands in host defense. Cancer Immunol Res. 2015;3:575-82.
- Wiencke K, Spurkland A, Schrumpf E, Boberg KM. Primary sclerosing cholangitis is associated to an extended B8-DR3 haplotype including particular MICA and MICB alleles. Hepatology. 2001;34:625-30.
- Zhang C, Roder J, Scherer A, Bodden M. Bispecific antibody-mediated redirection of NKG2D-CAR natural killer cells facilitates dual targeting and enhances antitumor activity. J Immunother Cancer. 2021;9:e002980.
- Watzl C. The NKG2D receptor and its ligands-recognition beyond the “missing self”? Microbes Infect. 2003;5:31-7.
- Voskoboinik I, Whisstock JC, Trapani JA, et al. Perforin and granzymes: function, dysfunction and human pathology. Nat Rev Immunol. 2015;15:388-400.
- Sutherland CL, Chalupny NJ, Schooley K, VandenBos T, Kubin M, Cosman D. UL16binding proteins, novel MHC class I-related proteins, bind to NKG2D and activate multiple signaling pathways in primary NK cells. J Immunol. 2002;168:671-9.
- Paschen A, Sucker A, Hill B, Moll I, Zapatka M, Nguyen XD, et al. Differential clinical significance of individual NKG2D ligands in melanoma: soluble ULBP2 as an indicator of poor prognosis superior to S100B. Clin Cancer Res. 2009;15:5208-15.
- Secchiari F, Nunez SY, Sierra JM, Ziblat A, Regge MV, Raffo Iraolagoitia XL, et al. The MICA-NKG2D axis in clear cell renal cell carcinoma bolsters MICA as target in immuno-oncology. Oncoimmunology. 2022;11:2104991.
- Sakellariou C, Elhage O, Papaevangelou E, Giustarini G, Esteves AM, Smolarek D, et al. Prostate cancer cells enhance interleukin-15-mediated expansion of NK cells. BJU Int. 2020;125:89-102.
- Neviani P, Wise PM, Murtadha M, Liu CW, Wu CH, Jong AY, et al. Natural killerderived exosomal miR-186 inhibits neuroblastoma growth and immune escape mechanisms. Cancer Res. 2019;79:1151-64.
- Jinushi M, Takehara T, Tatsumi T, Kanto T, Groh V, Spies T, et al. Expression and role of MICA and MICB in human hepatocellular carcinomas and their regulation by retinoic acid. Int J Cancer. 2003;104:354-61.
- Eisele G, Wischhusen J, Mittelbronn M, Meyermann R, Waldhauer I, Steinle A, et al. TGF-beta and metalloproteinases differentially suppress NKG2D ligand surface expression on malignant glioma cells. Brain. 2006;129:2416-25.
- Trinh TL, Kandell WM, Donatelli SS, Tu N, Tejera MM, Gilvary DL, et al. Immune evasion by TGFbeta-induced miR-183 repression of MICA/B expression in human lung tumor cells. Oncoimmunology. 2019;8:e1557372.
- Wang W, Erbe AK, Hank JA, Morris ZS, Sondel PM. NK cell-mediated antibodydependent cellular cytotoxicity in cancer immunotherapy. Front Immunol. 2015;6:368.
- Guo C, Wang X, Zhang H, Zhi L, Lv T, Li M, et al. Structure-based rational design of a novel chimeric PD1-NKG2D receptor for natural killer cells. Mol Immunol. 2019;114:108-13.
- Xiao L, Cen D, Gan H, Sun Y, Huang N, Xiong H, et al. Adoptive transfer of NKG2D CAR mRNA-engineered natural killer cells in colorectal cancer patients. Mol Ther. 2019;27:1114-25.
- Debska-Zielkowska J, Moszkowska G, Zielinski M, Zielinska H, Dukat-Mazurek A, Trzonkowski P, et al. KIR receptors as key regulators of NK cells activity in health and disease. Cells. 2021;10:1777.
- Joly E, Hudrisier D. What is trogocytosis and what is its purpose? Nat Immunol. 2003;4:815.
- Dance A. Core concept: cells nibble one another via the under-appreciated process of trogocytosis. Proc Natl Acad Sci USA. 2019;116:17608-10.
- Li Y, Basar R, Wang G, Liu E, Moyes JS, Li L, et al. KIR-based inhibitory CARs overcome CAR-NK cell trogocytosis-mediated fratricide and tumor escape. Nat Med. 2022;28:2133-44.
- Sanchez-Correa B, Valhondo I, Hassouneh F, Lopez-Sejas N, Pera A, Bergua JM, et al. DNAM-1 and the TIGIT/PVRIG/TACTILE Axis: novel immune checkpoints for natural killer cell-based cancer immunotherapy. Cancers (Basel). 2019;11:877.
- Huntington ND, Martinet L, Smyth MJ. DNAM-1: would the real natural killer cell please stand up! Oncotarget. 2015;6:28537-8.
- Gao J, Zheng Q, Xin N, Wang W, Zhao C. CD155, an onco-immunologic molecule in human tumors. Cancer Sci. 2017;108:1934-8.
- Casado JG, Pawelec G, Morgado S, Sanchez-Correa B, Delgado E, Gayoso I, et al. Expression of adhesion molecules and ligands for activating and costimulatory receptors involved in cell-mediated cytotoxicity in a large panel of human melanoma cell lines. Cancer Immunol Immunother. 2009;58:1517-26.
- Focaccetti C, Benvenuto M, Pighi C, Vitelli A, Napolitano F, Cotugno N, et al. DNAM-1-chimeric receptor-engineered NK cells, combined with Nutlin-3a, more effectively fight neuroblastoma cells in vitro: a proof-of-concept study. Front Immunol. 2022;13:886319.
- Melaiu O, Lucarini V, Cifaldi L, Fruci D. Influence of the tumor microenvironment on NK cell function in solid tumors. Front Immunol. 2019;10:3038.
- Duffy MJ, Synnott NC, O’Grady S, Crown J. Targeting p53 for the treatment of cancer. Semin Cancer Biol. 2022;79:58-67.
- Kruse PH, Matta J, Ugolini S, Vivier E. Natural cytotoxicity receptors and their ligands. Immunol Cell Biol. 2014;92:221-9.
- Semeraro M, Rusakiewicz S, Zitvogel L, Kroemer G. Natural killer cell mediated immunosurveillance of pediatric neuroblastoma. Oncoimmunology. 2015;4:e1042202.
- Li Y, Yan J, Chang HM, Chen ZJ, Leung PCK. Roles of TGF-beta superfamily proteins in extravillous trophoblast invasion. Trends Endocrinol Metab. 2021;32:170-89.
- Cruz-Bermudez A, Laza-Briviesca R, Vicente-Blanco RJ, Garcia-Grande A, Coronado MJ, Laine-Menendez S, et al. Cancer-associated fibroblasts modify lung cancer metabolism involving ROS and TGF-beta signaling. Free Radic Biol Med. 2019;130:163-73.
- Gough NR, Xiang X, Mishra L. TGF-beta signaling in liver, pancreas, and gastrointestinal diseases and cancer. Gastroenterology. 2021;161:434-452.e15.
- Zeng D, Li M, Zhou R, Zhang J, Sun H, Shi M, et al. Tumor microenvironment characterization in gastric cancer identifies prognostic and immunotherapeutically relevant gene signatures. Cancer Immunol Res. 2019;7:737-50.
- Tang X, Shi L, Xie N, Liu Z, Qian M, Meng F, et al. SIRT7 antagonizes TGF-beta signaling and inhibits breast cancer metastasis. Nat Commun. 2017;8:318.
- Paauwe M, Schoonderwoerd MJA, Helderman R, Harryvan TJ, Groenewoud A, van Pelt GW, et al. Endoglin expression on cancer-associated fibroblasts regulates invasion and stimulates colorectal cancer metastasis. Clin Cancer Res. 2018;24:6331-44.
- Caja L, Dituri F, Mancarella S, Caballero-Diaz D, Moustakas A, Giannelli G, et al. TGF-beta and the tissue microenvironment: relevance in fibrosis and cancer. Int J Mol Sci. 2018;19:1294.
- Grote S, Urena-Bailen G, Chan KC, Baden C, Mezger M, Handgretinger R, et al. In vitro evaluation of CD276-CAR NK-92 functionality, migration and invasion potential in the presence of immune inhibitory factors of the tumor microenvironment. Cells. 2021;10:1020.
- Viel S, Marcais A, Guimaraes FS, Loftus R, Rabilloud J, Grau M, et al. TGF-beta inhibits the activation and functions of NK cells by repressing the mTOR pathway. Sci Signal. 2016;9:ra19.
- Castriconi R, Dondero A, Bellora F, Moretta L, Castellano A, Locatelli F, et al. Neuroblastoma-derived TGF-beta1 modulates the chemokine receptor repertoire of human resting NK cells. J Immunol. 2013;190:5321-8.
- Slattery K, Woods E, Zaiatz-Bittencourt V, Marks S, Chew S, Conroy M, et al. TGFbeta drives NK cell metabolic dysfunction in human metastatic breast cancer. J Immunother Cancer. 2021;9:e002044.
- Chaudhry K, Geiger A, Dowlati E, Lang H, Sohai DK, Hwang El, et al. Cotransducing B7H3 CAR-NK cells with the DNR preserves their cytolytic function against GBM in the presence of exogenous TGF-beta. Mol Ther Methods Clin Dev. 2022;27:415-30.
- Rosmaraki EE, Douagi I, Roth C, Colucci F, Cumano A, Di Santo JP. Identification of committed NK cell progenitors in adult murine bone marrow. Eur J Immunol. 2001;31:1900-9.
- Boulanger MJ, Garcia KC. Shared cytokine signaling receptors: structural insights from the gp130 system. Adv Protein Chem. 2004;68:107-46.
- Smith GA, Uchida K, Weiss A, Taunton J. Essential biphasic role for JAK3 catalytic activity in IL-2 receptor signaling. Nat Chem Biol. 2016;12:373-9.
- Khalil M, Wang D, Hashemi E, Terhune SS, Malarkannan S. Implications of a ‘Third Signal’ in NK cells. Cells. 2021;10:1955.
- Ullrich KA, Schulze LL, Paap EM, Muller TM, Neurath MF, Zundler S. Immunology of IL-12: an update on functional activities and implications for disease. EXCLI J. 2020;19:1563-89.
- Li L, Mohanty V, Dou J, Huang Y, Banerjee PP, Miao Q, et al. Loss of metabolic fitness drives tumor resistance after CAR-NK cell therapy and can be overcome by cytokine engineering. Sci Adv. 2023;9:eadd6997.
- Silvestre RN, Eitler J, de Azevedo JTC, Tirapelle MC, Fantacini DMC, de Souza LEB, et al. Engineering NK-CAR. 19 cells with the IL-15/IL-15Ra complex improved proliferation and anti-tumor effect in vivo. Front Immunol. 2023;14:1226518.
- Perez-Martinez A, Fernandez L, Valentin J, Martinez-Romera I, Corral MD, Ramirez M, et al. A phase I/II trial of interleukin-15-stimulated natural killer cell infusion after haplo-identical stem cell transplantation for pediatric refractory solid tumors. Cytotherapy. 2015;17:1594-603.
- Ng YY, Tay JCK, Wang S. CXCR1 expression to improve anti-cancer efficacy of intravenously injected CAR-NK cells in mice with peritoneal xenografts. Mol Ther Oncolytics. 2020;16:75-85.
- Klopotowska M, Bajor M, Graczyk-Jarzynka A, Kraft A, Pilch Z, Zhylko A, et al. PRDX-1 supports the survival and antitumor activity of primary and CARmodified NK cells under oxidative stress. Cancer Immunol Res. 2022;10: 228-44.
- Johnstone RM, Adam M, Hammond JR, Orr L, Turbide C. Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes). J Biol Chem. 1987;262:9412-20.
- Liu J, Ren L, Li S, Li W, Zheng X, Yang Y, et al. The biology, function, and applications of exosomes in cancer. Acta Pharm Sin B. 2021;11:2783-97.
- Hosseini R, Asef-Kabiri L, Yousefi H, Sarvnaz H, Salehi M, Akbari ME, et al. The roles of tumor-derived exosomes in altered differentiation, maturation and function of dendritic cells. Mol Cancer. 2021;20:83.
- Hosseini R, Sarvnaz H, Arabpour M, Ramshe SM, Asef-Kabiri L, Yousefi H, et al. Cancer exosomes and natural killer cells dysfunction: biological roles, clinical significance and implications for immunotherapy. Mol Cancer. 2022;21:15.
- Xia Y, Zhang Q, Zhen Q, Zhao Y, Liu N, Li T, et al. Negative regulation of tumorinfiltrating NK cell in clear cell renal cell carcinoma patients through the exosomal pathway. Oncotarget. 2017;8:37783-95.
- Zhao J, Schlosser HA, Wang Z, Qin J, Li J, Popp F, et al. Tumor-derived extracellular vesicles inhibit natural killer cell function in pancreatic cancer. Cancers (Basel). 2019;11:874.
- Clayton A, Mitchell JP, Court J, Linnane S, Mason MD, Tabi Z. Human tumor-derived exosomes down-modulate NKG2D expression. J Immunol. 2008;180:7249-58.
- Szczepanski MJ, Szajnik M, Welsh A, Whiteside TL, Boyiadzis M. Blast-derived microvesicles in sera from patients with acute myeloid leukemia suppress natural killer cell function via membrane-associated transforming growth factorbeta1. Haematologica. 2011;96:1302-9.
- Kim K, Gwak HS, Han N, Hong EK, Choi BK, Lee S, et al. Chimeric antigen receptor T cells with modified interleukin-13 preferentially recognize IL13Ralpha2 and suppress malignant glioma: a preclinical study. Front Immunol. 2021;12:715000.
- Wang J, Toregrosa-Allen S, Elzey BD, Utturkar S, Lanman NA, Bernal-Crespo V, et al. Multispecific targeting of glioblastoma with tumor microenvironmentresponsive multifunctional engineered NK cells. Proc Natl Acad Sci USA. 2021;118:e2107507118.
- Zhang C, Burger MC, Jennewein L, Genssler S, Schonfeld K, Zeiner P et al. ErbB2/ HER2-specific NK cells for targeted therapy of glioblastoma. J Natl Cancer Inst. 2016;108.
- Murakami T, Nakazawa T, Natsume A, Nishimura F, Nakamura M, Matsuda R, et al. Novel human NK cell line carrying CAR targeting EGFRvIII induces antitumor effects in glioblastoma cells. Anticancer Res. 2018;38:5049-56.
- Jan CI, Huang SW, Canoll P, Bruce JN, Lin YC, Pan CM, et al. Targeting human leukocyte antigen
with chimeric antigen receptors of natural killer cells convert immunosuppression to ablate solid tumors. J Immunother Cancer. 2021;9:e003050. - Lu C, Guo C, Chen H, Zhang H, Zhi L, Lv T, et al. A novel chimeric PD1-NKG2D41BB receptor enhances antitumor activity of NK92 cells against human lung cancer H1299 cells by triggering pyroptosis. Mol Immunol. 2020;122:200-6.
- Zhang X, Guo Y, Ji Y, Gao Y, Zhang M, Liu Y, et al. Cytokine release syndrome after modified CAR-NK therapy in an advanced non-small cell lung cancer patient: a case report. Cell Transpl. 2022;31:9636897221094244.
- Liu M, Huang W, Guo Y, Zhou Y, Zhi C, Chen J, et al. CAR NK-92 cells targeting DLL3 kill effectively small cell lung cancer cells in vitro and in vivo. J Leukoc Biol. 2022;112:901-11.
- Yang S, Cao B, Zhou G, Zhu L, Wang L, Zhang L, et al. Targeting B7-H3 immune checkpoint with chimeric antigen receptor-engineered natural killer cells exhibits potent cytotoxicity against non-small cell lung cancer. Front Pharm. 2020;11:1089.
- Chambers AM, Lupo KB, Wang J, Cao J, Utturkar S, Lanman N, et al. Engineered natural killer cells impede the immunometabolic CD73-adenosine axis in solid tumors. Elife. 2022;11:e73699.
- Sahm C, Schonfeld K, Wels WS. Expression of IL-15 in NK cells results in rapid enrichment and selective cytotoxicity of gene-modified effectors that carry a tumor-specific antigen receptor. Cancer Immunol Immunother. 2012;61:1451-61.
- Daldrup-Link HE, Meier R, Rudelius M, Piontek G, Piert M, Metz S, et al. In vivo tracking of genetically engineered, anti-HER2/neu directed natural killer cells to HER2/neu positive mammary tumors with magnetic resonance imaging. Eur Radio. 2005;15:4-13.
- Schonfeld K, Sahm C, Zhang C, Naundorf S, Brendel C, Odendahl M, et al. Selective inhibition of tumor growth by clonal NK cells expressing an ErbB2/ HER2-specific chimeric antigen receptor. Mol Ther. 2015;23:330-8.
- Uherek C, Tonn T, Uherek B, Becker S, Schnierle B, Klingemann HG, et al. Retargeting of natural killer-cell cytolytic activity to ErbB2-expressing cancer cells results in efficient and selective tumor cell destruction. Blood. 2002;100:1265-73.
- Liu H, Yang B, Sun T, Lin L, Hu Y, Deng M, et al. Specific growth inhibition of ErbB2-expressing human breast cancer cells by genetically modified NK-92 cells. Oncol Rep. 2015;33:95-102.
- Alkins R, Burgess A, Ganguly M, Francia G, Kerbel R, Wels WS, et al. Focused ultrasound delivers targeted immune cells to metastatic brain tumors. Cancer Res. 2013;73:1892-9.
- Liu Y, Zhou Y, Huang KH, Fang X, Li Y, Wang F, et al. Targeting epidermal growth factor-overexpressing triple-negative breast cancer by natural killer cells expressing a specific chimeric antigen receptor. Cell Prolif. 2020;53:e12858.
- Chen X, Han J, Chu J, Zhang L, Zhang J, Chen C, et al. A combinational therapy of EGFR-CAR NK cells and oncolytic herpes simplex virus 1 for breast cancer brain metastases. Oncotarget. 2016;7:27764-77.
- Hu Z. Tissue factor as a new target for CAR-NK cell immunotherapy of triplenegative breast cancer. Sci Rep. 2020;10:2815.
- Cao B, Liu M, Huang J, Zhou J, Li J, Lian H, et al. Development of mesothelinspecific CAR NK-92 cells for the treatment of gastric cancer. Int J Biol Sci. 2021;17:3850-61.
- Zhang Q, Zhang H, Ding J, Liu H, Li H, Li H, et al. Corrigendum to “combination therapy with EpCAM-CAR-NK-92 cells and regorafenib against human colorectal cancer models. J Immunol Res. 2019;2019:2070562.
- Shiozawa M, Chang CH, Huang YC, Chen YC, Chi MS, Hao HC, et al. Pharmacologically upregulated carcinoembryonic antigen-expression enhances the cytolytic activity of genetically-modified chimeric antigen receptor NK-92MI against colorectal cancer cells. BMC Immunol. 2018;19:27.
- Liu B, Liu ZZ, Zhou ML, Lin JW, Chen XM, Li Z, et al. Development of c-MET-specific chimeric antigen receptor-engineered natural killer cells with cytotoxic effects on human liver cancer HepG2 cells. Mol Med Rep. 2019;20:2823-31.
- Lee YE, Ju A, Choi HW, Kim JC, Kim EE, Kim TS, et al. Rationally designed redirection of natural killer cells anchoring a cytotoxic ligand for pancreatic cancer treatment. J Control Release. 2020;326:310-23.
- Da Y, Liu Y, Hu Y, Liu W, Ma J, Lu N, et al. STING agonist cGAMP enhances antitumor activity of CAR-NK cells against pancreatic cancer. Oncoimmunology. 2022;11:2054105.
- Teng KY, Mansour AG, Zhu Z, Li Z, Tian L, Ma S, et al. Off-the-shelf prostate stem cell antigen-directed chimeric antigen receptor natural killer cell therapy to treat pancreatic cancer. Gastroenterology. 2022;162:1319-33.
- Bai KH, Zhang YY, Li XP, Tian XP, Pan MM, Wang DW, et al. Comprehensive analysis of tumor necrosis factor-alpha-inducible protein 8 -like 2 (TIPE2): a potential novel pan-cancer immune checkpoint. Comput Struct Biotechnol J. 2022;20:5226-34.
- Zhang Q, Tian K, Xu J, Zhang H, Li L, Fu Q, et al. Synergistic effects of cabozantinib and EGFR-specific CAR-NK-92 cells in renal cell carcinoma. J Immunol Res. 2017;2017:6915912.
- Liu E, Marin D, Banerjee P, Macapinlac HA, Thompson P, Basar R, et al. Use of CAR-transduced natural killer cells in CD19-positive lymphoid tumors. N. Engl J Med. 2020;382:545-53.
- Lo Nigro C, Macagno M, Sangiolo D, Bertolaccini L, Aglietta M, Merlano MC. NKmediated antibody-dependent cell-mediated cytotoxicity in solid tumors: biological evidence and clinical perspectives. Ann Transl Med. 2019;7:105.
- Vivier E, Tomasello E, Baratin M, Walzer T, Ugolini S. Functions of natural killer cells. Nat Immunol. 2008;9:503-10.
- Xie G, Dong H, Liang Y, Ham JD, Rizwan R, Chen J. CAR-NK cells: a promising cellular immunotherapy for cancer. EBioMedicine. 2020;59:102975.
- Chang YH, Connolly J, Shimasaki N, Mimura K, Kono K, Campana D. A chimeric receptor with NKG2D specificity enhances natural killer cell activation and killing of tumor cells. Cancer Res. 2013;73:1777-86.
- Yvon ES, Burga R, Powell A, Cruz CR, Fernandes R, Barese C, et al. Cord blood natural killer cells expressing a dominant negative TGF-beta receptor: implications for adoptive immunotherapy for glioblastoma. Cytotherapy. 2017;19:408-18.
AUTHOR CONTRIBUTIONS
FUNDING
COMPETING INTERESTS
ADDITIONAL INFORMATION
© The Author(s) 2024
Department of Breast Surgery, The First Affiliated Hospital of Zhengzhou University, Zhengzhou, China. Department of Radiotherapy, Affiliated Cancer Hospital of Zhengzhou University, Henan Cancer Hospital, Zhengzhou, China. Department of Internal Medicine, Affiliated Cancer Hospital of Zhengzhou University, Henan Cancer Hospital, Zhengzhou, China. Biotherapy Center, The First Affiliated Hospital of Zhengzhou University, Zhengzhou, China. Department of Colorectal Surgery, The First Affiliated Hospital of Zhengzhou University, Zhengzhou, China. email: fccwangwk@zzu.edu.cn; fccsunzq@zzu.edu.cn; gexin1981@126.com - Including the status, conditions, interferences, phase, age/gender, locations, and other information of the experiment.
