DOI: https://doi.org/10.14218/fim.2023.00086
تاريخ النشر: 2024-03-25
استكشاف السلامة والفعالية والنشاط البيولوجي للأدوية العشبية: ربط الحكمة التقليدية بالعلم الحديث في الرعاية الصحية
الملخص
تستكشف هذه المراجعة تقارب الحكمة التقليدية والعلم الحديث في مجال الأدوية العشبية، مع التركيز على السلامة والفعالية والنشاط البيولوجي لهذه العلاجات الطبيعية في الرعاية الصحية المعاصرة. التاريخ الغني للأدوية العشبية، المتجذر بعمق في التقاليد الثقافية، يشهد انتعاشًا مع تزايد البحث عن الرعاية الصحية الشاملة والشخصية. تعتبر الأدوية العشبية، ممارسة قديمة تم تمريرها عبر الأجيال، تحظى باهتمام متجدد في ظل الاعتراف المتزايد بفوائدها المحتملة. تتناول هذه المراجعة ملفات السلامة للعلاجات العشبية، خاضعة لتمحيص علمي صارم. بالإضافة إلى ذلك، تحقق في فعالية التدخلات العشبية، بهدف سد الفجوة بين الحكايات التاريخية والبحث التجريبي. النشاط البيولوجي المعقد للمركبات العشبية، التي تحتوي غالبًا على العديد من المكونات النشطة، هو نقطة محورية، تكشف عن الآليات التي تتفاعل من خلالها هذه المواد الطبيعية مع جسم الإنسان. في عالم حيث يحمل دمج الحكمة التقليدية والعلم الحديث وعدًا لتقدم الرعاية الصحية، تسهم هذه المراجعة في الحوار المستمر. من خلال فحص السلامة والفعالية والنشاط البيولوجي للعلاجات العشبية بشكل نقدي، تهدف إلى إلقاء الضوء على المشهد المتطور للأدوية العشبية. الهدف هو دمج أفضل ما في العالمين لتعزيز الرفاهية العالمية، مع الاعتراف بإمكانات الأدوية العشبية كملحق قيم لممارسات الرعاية الصحية الحديثة.
المقدمة
النمو.
ومع ذلك، شهد هذا الطلب المتزايد أيضًا زيادة في الممارسات الاحتيالية، بما في ذلك استبدال المواد العشبية وإضافة المركبات الاصطناعية.
تقييم السلامة للأدوية العشبية
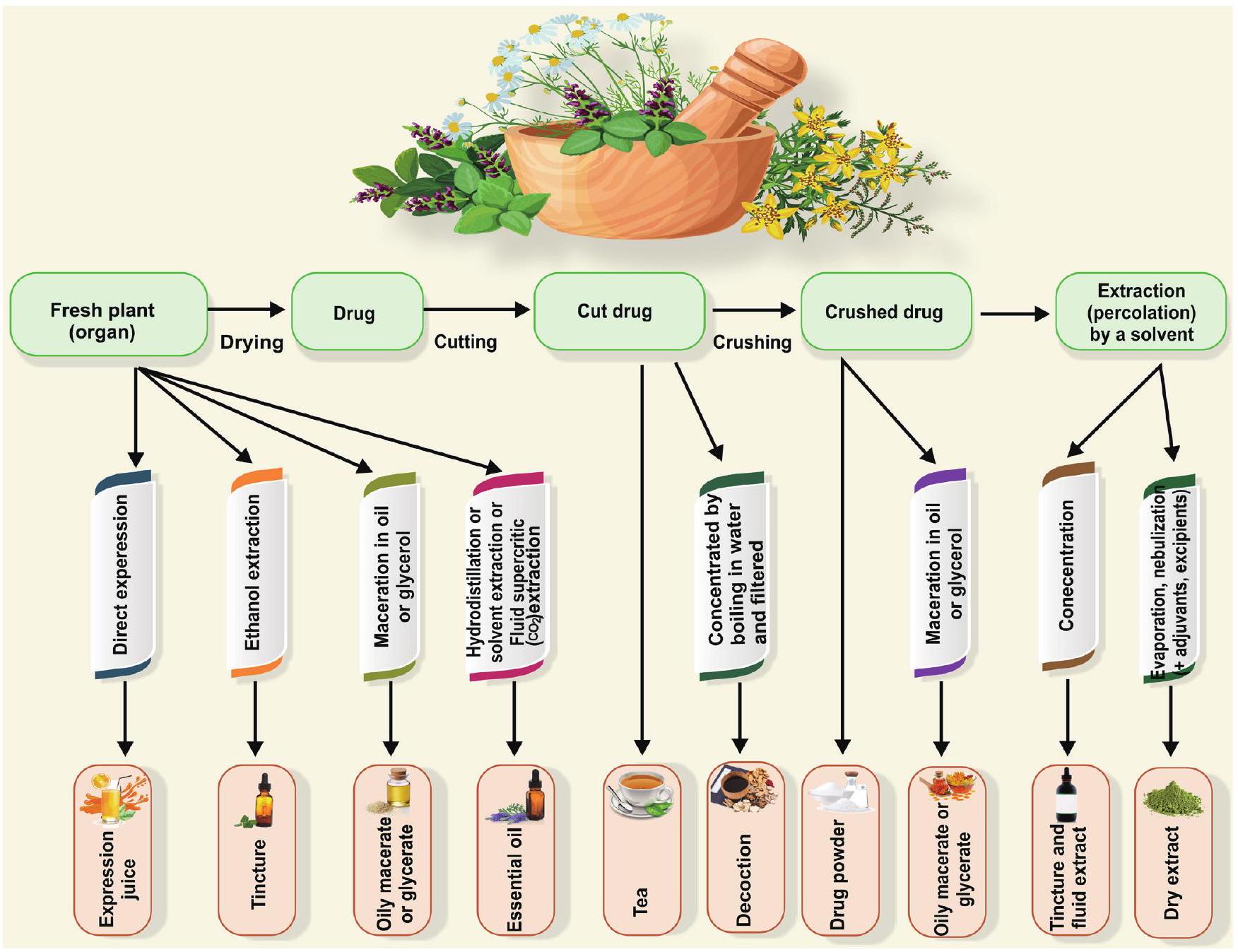
الأدوية العشبية وتحضيراتها
السلامة والسمية المحتملة للعلاجات العشبية
توقع الآثار السلبية والسمية: فهم استخدام الطب العشبي
بما في ذلك الاستخدام غير المناسب للأعشاب والمكملات، تحضيرها بشكل غير صحيح، الجرعات المفرطة، أو الاستخدام المطول.
| الأدوية الصيدلانية | الأدوية العشبية | |
| نظام التقارير | يوجد نظام قوي للإبلاغ عن وتتبع التفاعلات السلبية للأدوية الصيدلانية. يجب على مقدمي الرعاية الصحية والشركات الصيدلانية الإبلاغ عن هذه الأحداث، مما يؤدي إلى إنشاء قواعد بيانات شاملة للأحداث السلبية المتعلقة بالأدوية. | تُسجل التفاعلات السلبية المرتبطة بالأدوية العشبية بشكل أقل انتظامًا مقارنة بالأدوية الصيدلانية، مما يؤدي غالبًا إلى نقص في الإبلاغ بسبب قلة الوعي بين المستهلكين ومقدمي الرعاية الصحية. |
| بيانات عن التفاعلات السلبية | في عام 2020، سجل نظام الإبلاغ عن الأحداث السلبية التابع لإدارة الغذاء والدواء الأمريكية (FAERS) 5.8 مليون تقرير عن أحداث سلبية مرتبطة بالأدوية الصيدلانية، تشمل طيفًا من الآثار الجانبية الخفيفة إلى ردود الفعل الشديدة والمهددة للحياة. | مراقبة ردود الفعل السلبية للأدوية العشبية أقل قوة مقارنة بالأدوية الصيدلانية. على الرغم من احتمال التقليل من الإبلاغ، تظل الحالات الموثقة من ردود الفعل السلبية الخطيرة أو المهددة للحياة تجاه الأدوية العشبية نادرة بشكل استثنائي. |
| ردود الفعل السلبية الشائعة | تشمل التفاعلات السلبية الشائعة للأدوية الصيدلانية الغثيان، القيء، الصداع، الدوار، وطفح الجلد. في الحالات الشديدة، يمكن أن تسبب تلف الأعضاء أو حتى الوفاة. | إن نقص أنظمة التقارير الشاملة يجعل من الصعب تجميع بيانات دقيقة حول التفاعلات السلبية للأدوية العشبية. |
مع الأدوية. وبالمثل، أظهرت دراسة تفحص 243 منتجًا مملوكًا في كاليفورنيا أن
خلال التعرف وجمع النباتات الطبية المستخدمة في العلاجات العشبية. لمعالجة الارتباك الناجم عن الأسماء الشائعة، من الضروري اعتماد أسماء ثنائية مقبولة على نطاق واسع، بما في ذلك مرادفاتها، للنباتات الطبية. على سبيل المثال، الأرتيميسيا أبسنتيوم L.، المعروفة بمشتقها النشط المخدر وإمكانية التسبب في اضطرابات في الجهاز العصبي المركزي وتدهور عقلي عام، ليس لديها أقل من 11 اسمًا شائعًا مميزًا، مع سبعة منها لا تشبه اسمها النباتي. نظرًا لانتشار الأسماء الشائعة، فإن الهيليوتروبيوم يوروبايوم (هيليوتروب) الذي يحتوي على قلويدات بيروليدين السامة، يتم الخلط بينه بشكل متكرر مع فاليريان أوفيشيناليس (هيليوتروب الحديقة)، الذي يحتوي على فالبوتريئات المهدئة والمريحة للعضلات، مما يبرز ضرورة تقديم الاسم العلمي الدقيق للنبات. وبالتالي، فإن الإشراف الكفء على سلامة الأدوية العشبية يتطلب تعاونًا قويًا بين علماء النبات، وعلماء الكيمياء النباتية، وعلماء الأدوية، وغيرهم من المساهمين البارزين.
التنظيم ومراقبة الجودة
وفعالية هذه المنتجات للخطر. تشمل التحديات الرئيسية في الحصول على أدوية عشبية أصلية التلاعب، والاستبدال، ونقص الكوادر المدربة. إن تنفيذ تقنيات ومعايير مراقبة الجودة المتقدمة أمر حاسم لضمان جودة المنتجات العشبية الطبية.
تقييم المعلمات الفيزيائية الكيميائية (مثل محتوى الرطوبة، الرماد غير القابل للذوبان في الحمض، والرماد القابل للذوبان في الماء)، ودمج معلمات جديدة.
تفاعلات الأدوية والأعشاب
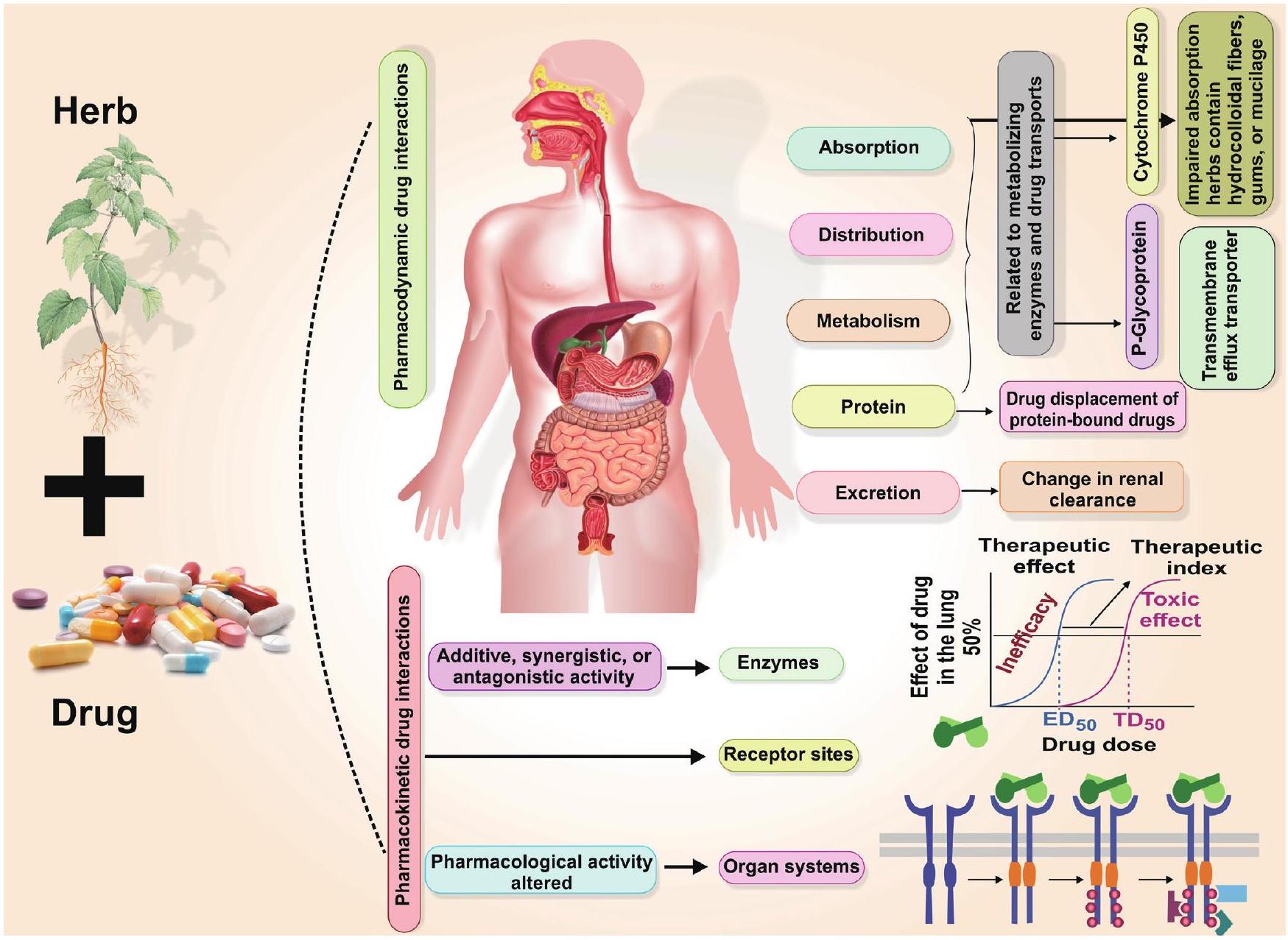
وقت عبور الجهاز الهضمي وزيادة حركة الأمعاء. قد تكون هذه النباتات ضارة بظهارة الأمعاء (تثبط
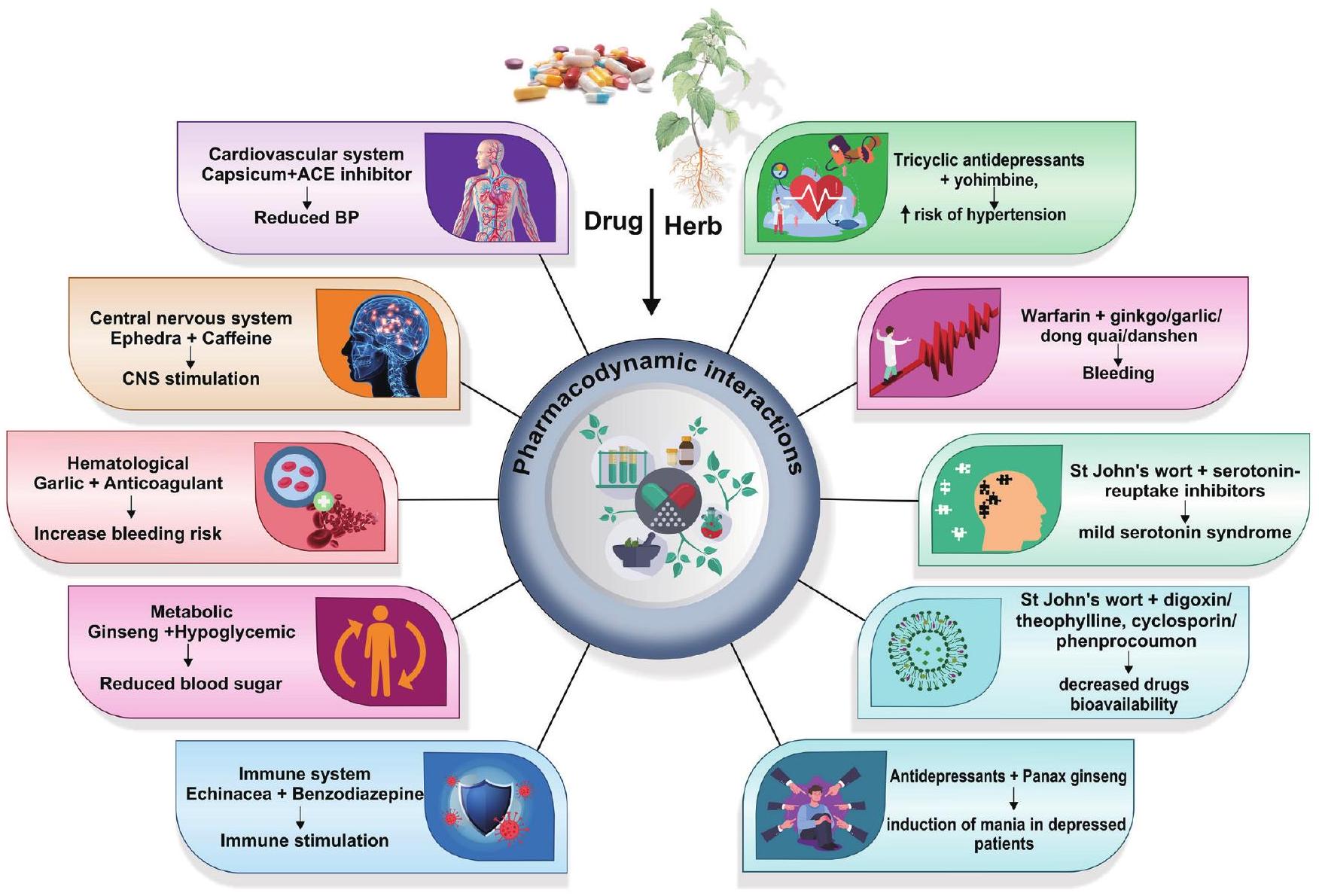
فعالية الأدوية العشبية
تاريخ الطب العشبي التقليدي الغني
أهمية التحقق من صحة المعرفة التقليدية من خلال البحث العلمي الحديث
والاضطرابات التنفسية،
أمثلة لبعض الأعشاب الشائعة التي ثبت علميًا فعاليتها
إمكاناته لتعزيز مؤشرات الدهون لدى النساء اللواتي يعانين من متلازمة المبيض المتعدد الكيسات، مما يشير إلى إمكانيته كعلاج تكميلي بجانب الرعاية القياسية.
الأنشطة الحيوية للأدوية العشبية
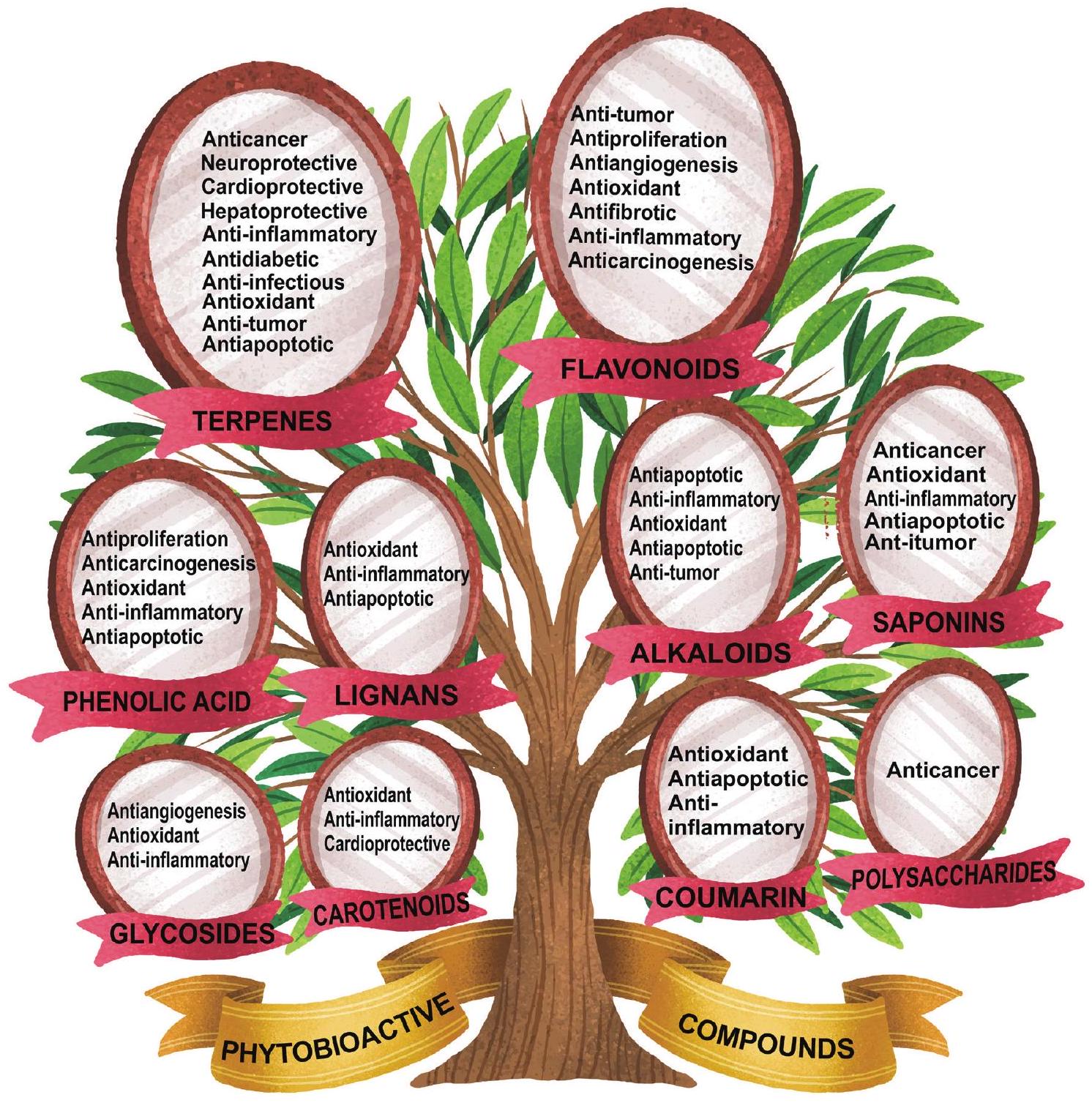
مجموعة متنوعة من المركبات النشطة بيولوجياً
ممارسات الشفاء التقليدية بسبب خصائصها الطبية. هذه المركبات النشطة بيولوجيًا هي جوهر ما يمنح الأعشاب اللون والنكهة والرائحة، بينما تقدم أيضًا تأثيرًا عميقًا على صحة الإنسان عند استهلاكها. تساهم في مجموعة من الأنشطة البيولوجية، مثل الخصائص المضادة للالتهابات، والمنشطة للمناعة، ومكافحة السرطان، ومضادات الأكسدة، ومضادات التكاثر، والاستماتة، ومضادات التليف، والخصائص المضادة للميكروبات (الشكل 4). بالإضافة إلى ذلك، قد تدعم صحة الجهاز الهضمي، وتعزز الجهاز المناعي، أو تساعد في إدارة الحالات المزمنة.
الآليات المعقدة للمركبات النشطة بيولوجيًا
طرق، معالجة، وعملية الهضم، جميعها تؤثر على امتصاصها واستخدامها داخل الجسم. غالبًا ما يصف المعالجون بالأعشاب والمعالجون التقليديون الأعشاب بناءً على المركبات النشطة حيويًا التي تحتويها لمعالجة حالات صحية محددة. كما أن البحث العلمي الحديث قد استكشف أيضًا الإمكانيات العلاجية للمركبات النشطة حيويًا في الأعشاب، موضحًا آليات عملها والتطبيقات المحتملة في الرعاية الصحية.
فهم آلي للمركبات النشطة بيولوجيًا
تدفق التوبوفاجي، يقلل من ROS، وموت الخلايا، بينما تمنع اللجنات فسفرة p38 وموت JNK.
الخاتمة
الشكر والتقدير
تمويل
تضارب المصالح
مساهمات المؤلفين
References
[2] Islam SU, Dar TUH, Khuroo AA, Bhat BA, Mangral ZA, Tariq L, et al. DNA barcoding aids in identification of adulterants of Trillium govanianum Wall. ex D. Don. J Appl Res Med Aromat Plants 2021;23:100305. doi:10.1016/j.jarmap.2021.100305.
[3] Jităreanu A, Trifan A, Vieriu M, Caba IC, Mârțu I, Agoroaei L. Current trends in toxicity assessment of herbal medicines: A narrative review. Processes 2022;11(1):83. doi:10.3390/pr11010083.
[4] Tulunay M, Aypak C, Yikilkan H, Gorpelioglu S. Herbal medicine use among patients with chronic diseases. J Intercult Ethnopharmacol 2015;4(3):217-220. doi:10.5455/jice.20150623090040, PMID:2640 1410.
[5] Peltzer K, Pengpid S. The use of herbal medicines among chronic disease patients in Thailand: a cross-sectional survey. J Multidiscip Healthc 2019;12:573-582. doi:10.2147/JMDH.S212953, PMID: 31413584.
[6] Tnah LH, Lee SL, Tan AL, Lee CT, Ng KK, Ng CH, et al. DNA barcode database of common herbal plants in the tropics: a resource for herbal product authentication. Food control 2019;95:318-326. doi:10.1016/j.foodcont.2018.08.022.
[7] Jordan SA, Cunningham DG, Marles RJ. Assessment of herbal medicinal products: challenges, and opportunities to increase the knowledge base for safety assessment. Toxicol Appl Pharmacol 2010;243(2):198216. doi:10.1016/j.taap.2009.12.005, PMID:20018204.
[8] Brantley SJ, Argikar AA, Lin YS, Nagar S, Paine MF. Herb-drug interactions: challenges and opportunities for improved predictions. Drug Metab Dispos 2014;42(3):301-317. doi:10.1124/dmd.113.055236, PMID:24335390.
[9] Singh S, Bansal A, Singh V, Chopra T, Poddar J. Flavonoids, alkaloids and terpenoids: a new hope for the treatment of diabetes mellitus. J Diabetes Metab Disord 2022;21(1):941-950. doi:10.1007/s40200-
[10] Roy A, Khan A, Ahmad I, Alghamdi S, Rajab BS, Babalghith AO, et al. Flavonoids a Bioactive Compound from Medicinal Plants and Its Therapeutic Applications. Biomed Res Int 2022;2022:5445291. doi:10.1155/2022/5445291, PMID:35707379.
[11] Riaz M, Khalid R, Afzal M, Anjum F, Fatima H, Zia S, et al. Phytobioactive compounds as therapeutic agents for human diseases: A review. Food Sci Nutr 2023;11(6):2500-2529. doi:10.1002/fsn3.3308, PMID:37324906.
[12] Fernández-Ochoa Á, Leyva-Jiménez FJ, De la Luz Cádiz-Gurrea M, Pi-mentel-Moral S, Segura-Carretero A. The Role of High-Resolution Analytical Techniques in the Development of Functional Foods. Int J Mol Sci 2021;22(6):3220. doi:10.3390/ijms22063220, PMID:33809986.
[13] Rinschen MM, Ivanisevic J, Giera M, Siuzdak G. Identification of bioactive metabolites using activity metabolomics. Nat Rev Mol Cell Biol 2019;20(6):353-367. doi:10.1038/s41580-019-0108-4, PMID:30814649.
[14] Fu Y, Yang JC, Cunningham AB, Towns AM, Zhang Y, Yang HY, et al. A billion cups: The diversity, traditional uses, safety issues and potential of Chinese herbal teas. J Ethnopharmacol 2018;222:217-228. doi:10.1016/j.jep.2018.04.026, PMID:29730132.
[15] Zhao J, Deng JW, Chen YW, Li SP. Advanced phytochemical analysis of herbal tea in China. J Chromatogr A 2013;1313:2-23. doi:10.1016/j. chroma.2013.07.039, PMID:23906802.
[16] Dori D, Méda N, Gbaguidi FA, Quetin-Leclercq J, Semdé R. [Wholesale distribution and delivery of plant-based medicinal products through the pharmaceutical system of Burkina Fasol. Ann Pharm Fr 2020;78(2):179188. doi:10.1016/j.pharma.2019.12.003, PMID:32037029.
[17] Petitet F. Interactions pharmacocinétiques entre préparation à base de plantes et médicament: une revue de l’importance Clinique. Phytothérapie 2012;10(3):170-182. doi:10.1007/s10298-012-0705-2.
[18] Sahoo N, Manchikanti P, Dey S. Herbal drugs: standards and regulation. Fitoterapia 2010;81(6):462-471. doi:10.1016/j.fitote.2010. 02.001, PMID:20156530.
[19] Muyumba NW, Mutombo SC, Sheridan H, Nachtergael A, Duez P. Quality control of herbal drugs and preparations: The methods of analysis, their relevance and applications. Talanta Open 2021;4:100070. doi:10.1016/j.talo.2021.100070.
[20] George P. Concerns regarding the safety and toxicity of medicinal plants-An overview. J Appl Pharm Sci 2011;1(6):40-44.
[21] Boullata JI, Nace AM. Safety issues with herbal medicine. Pharmacotherapy 2000;20(3):257-269. doi:10.1592/phco.20.4.257.34886, PMID:10730682.
[22] Ernst E. Herbal medicines: balancing benefits and risks. Novartis Found Symp 2007;282:154-167. doi:10.1002/9780470319444.ch11, PMID:17913230.
[23] Mardani S, Nasri H, Rafieian-Kopaei M, Hajian S. Herbal medicine and diabetic kidney disease. J Nephropharmacol 2013;2(1):1-2. PMID:28197432.
[24] Karimi A, Majlesi M, Rafieian-Kopaei M. Herbal versus synthetic drugs; beliefs and facts. J Nephropharmacol 2015;4(1):27-30. PMID:28197471.
[25] Ekor M. The growing use of herbal medicines: issues relating to adverse reactions and challenges in monitoring safety. Front Pharmacol 2014;4:177. doi:10.3389/fphar.2013.00177, PMID:24454289.
[26] Ifeoma O, Oluwakanyinsola S. Screening of herbal medicines for potential toxicities. In: Gowder S (ed). New insights into toxicity and drug testing. Rijeka: IntechOpen; 2013:63-88. doi:10.5772/54493.
[27] Jagan S, Ramakrishnan G, Anandakumar P, Kamaraj S, Devaki T. Antiproliferative potential of gallic acid against diethylnitrosamineinduced rat hepatocellular carcinoma. Mol Cell Biochem 2008;319(1-2):51-59. doi:10.1007/s11010-008-9876-4, PMID:18629614.
[28] Msomi NZ, Simelane MB. Herbal medicine. In: Builders PF (ed). Herbal Medicine. Rijeka: IntechOpen; 2019:215-227. doi:10.5772/ intechopen. 72816.
[29] Mirzaeian R, Sadoughi F, Tahmasebian S, Mojahedi M. Progresses and challenges in the traditional medicine information system: A systematic review. J Pharm Pharmacogn Res 2019;7(4):246-259. doi:10.56499/jppres19.662_7.4.246.
[30] Ahmad Khan MS, Ahmad I. Chapter 1-Herbal medicine: current trends and future prospects. In: Ahmad Khan MS, Ahmad I, Chat-
topadhyay D (eds). New Look to Phytomedicine: Advancements in Herbal Products as Novel Drug Leads. Cambridge: Academic Press; 2019:3-13. doi:10.1016/B978-0-12-814619-4.00001-X.
[31] Wake GE, Fitie GW. Magnitude and Determinant Factors of Herbal Medicine Utilization Among Mothers Attending Their Antenatal Care at Public Health Institutions in Debre Berhan Town, Ethiopia. Front Public Health 2022;10:883053. doi:10.3389/fpubh.2022.883053, PMID:35570953.
[32] Nasri H. Cisplatin therapy and the problem of gender-related nephrotoxicity. J Nephropharmacol 2013;2(2):13-14. PMID:28197436.
[33] Rafieian-Kopaei M. Medicinal plants for renal injury prevention. J Renal Inj Prev 2013;2(2):63-65. doi:10.12861/jrip.2013.21, PMID:25340130.
[34] Chang YJ, Hsu SL, Liu YT, Lin YH, Lin MH, Huang SJ, et al. Gallic acid induces necroptosis via TNF-
[35] Welz AN, Emberger-Klein A, Menrad K. Why people use herbal medicine: insights from a focus-group study in Germany. BMC Complement Altern Med 2018;18(1):92. doi:10.1186/s12906-018-2160-6, PMID:29544493.
[36] Mulholland CA, Benford DJ. What is known about the safety of multi-vitamin-multimineral supplements for the generally healthy population? Theoretical basis for harm. Am J Clin Nutr 2007;85(1):318S322S. doi:10.1093/ajcn/85.1.318S, PMID:17209218.
[37] Jacobus CH, Holick MF, Shao Q, Chen TC, Holm IA, Kolodny JM, et al. Hypervitaminosis D associated with drinking milk. N Engl J Med 1992;326(18):1173-1177. doi:10.1056/NEJM199204303261 801, PMID:1313547.
[38] Phua DH, Zosel A, Heard K. Dietary supplements and herbal medicine toxicities-when to anticipate them and how to manage them. Int J Emerg Med 2009;2(2):69-76. doi:10.1007/s12245-009-0105-z, PMID:20157447.
[39] Huang WF, Wen KC, Hsiao ML. Adulteration by synthetic therapeutic substances of traditional Chinese medicines in Taiwan. J Clin Pharmacol 1997;37(4):344-350. doi:10.1002/j.1552-4604.1997.tb04312.x, PMID:9115061.
[40] Ernst E. Adulteration of Chinese herbal medicines with synthetic drugs: a systematic review. J Intern Med 2002;252(2):107-113. doi:10.1046/j.1365-2796.2002.00999.x, PMID:12190885.
[41] Yee SK, Chu SS, Xu YM, Choo PL. Regulatory control of Chinese Proprietary Medicines in Singapore. Health Policy 2005;71(2):133-149. doi:10.1016/j.healthpol.2003.09.013, PMID:15607377.
[42] Ariffin SH, A Wahab I, Hassan Y, Abd Wahab MS. Adulterated Tra-ditional-Herbal Medicinal Products and Its Safety Signals in Malaysia. Drug Healthc Patient Saf 2021;13:133-140. doi:10.2147/DHPS. S305953, PMID:34135639.
[43] Al Lawati HA, Al Busaidi I, Kadavilpparampu AM, Suliman FO. Determination of Common Adulterants in Herbal Medicine and Food Samples using Core-shell Column Coupled to Tandem Mass Spectrometry. J Chromatogr Sci 2017;55(3):232-242. doi:10.1093/chromsci/ bmw175, PMID:27881492.
[44] Raviraja Shetty G, Harsha R. Adulteration in medicinal plants and herbal drugs. Int J Agric Sci 2021;12(1):12-17. doi:10.53390/ijas. v12i1.4.
[45] Krapf R. Development of Cushing’s syndrome after use of a herbal remedy. Lancet 2002;360(9348):1884. doi:10.1016/S0140-6736(02) 11747-8, PMID:12480390.
[46] Guimarães AC, Malachias MV, Coelho OR, Zilli EC, Luna RL. Use of sildenafil in patients with cardiovascular disease. Arq Bras Cardiol 1999;73(6):515-526. PMID:10904272.
[47] Chamsi-Pasha H. Sildenafil (viagra) and the heart. J Family Community Med 2001;8(2):63-66. PMID:23008645.
[48] Newmaster SG, Grguric M, Shanmughanandhan D, Ramalingam S, Ragupathy S. DNA barcoding detects contamination and substitution in North American herbal products. BMC Med 2013;11:222. doi:10.1186/1741-7015-11-222, PMID:24120035.
[49] Kerchner A, Farkas Á. Worldwide poisoning potential of Brugmansia and Datura. Forensic Toxicol 2020;38:30-41. doi:10.1007/s11419-019-00500-2.
[50] Han JP, Li MN, Luo K, Liu MZ, Chen XC, Chen SL. Identification of Da-
turae flos and its adulterants based on DNA barcoding technique. Yao Xue Xue Bao 2011;46(11):1408-1412. PMID:22260038.
[51] Pandey R, Tiwari RK, Shukla SS. Omics: A newer technique in herbal drug standardization & quantification. J Young Pharm 2016;8(2):7681. doi:10.5530/jyp.2016.2.4.
[52] World Health Organization. WHO guidelines for assessing quality of herbal medicines with reference to contaminants and residues. Geneva: World Health Organization; 2007.
[53] World Health Organization. WHO guidelines on good agricultural and collection practices (GACP) for medicinal plants. Geneva: World Health Organization; 2003.
[54] Liang YZ, Xie P, Chan K. Quality control of herbal medicines. J Chromatogr B Analyt Technol Biomed Life Sci 2004;812(1-2):53-70. doi:10.1016/j.jchromb.2004.08.041, PMID:15556488.
[55] Kamble MA, Mane MR, Ingole AR, Dhabarde DM. Standardization of some marketed herbal formulation used in diabetes. Journal of Advanced Research in Pharmaceutical Sciences and Pharmacology Interventions 2019;2(1):22-26.
[56] Nazim MD, Aslam M, Khatoon R, Asif M, Chaudhary SS. Physico-chemical standardization of Hansraj (Adiantum capillus-Veneris). J Drug Deliv Ther 2018;8(6-s):195-203. doi:10.22270/jddt.v8i6-s.2229.
[57] Marchese A, Barbieri R, Coppo E, Orhan IE, Daglia M, Nabavi SF, et al. Antimicrobial activity of eugenol and essential oils containing eugenol: A mechanistic viewpoint. Crit Rev Microbiol 2017;43(6):668-689. doi:10.1080/1040841X.2017.1295225, PMID:28346030.
[58] Deogade MS, Prasad KS. Standardization of wild Krushnatulasi (Ocimum tenuiflorum Linn) leaf. Int J Ayurveda Res 2019;10(1):52-61. doi:10.47552/ijam.v10i1.1172.
[59] Shaheen N, Imam S, Abidi S, Sultan RA, Azhar I, Mahmood ZA. Comparative pharmacognostic evaluation and standardization of Capsicum annuum L.(red chili). Int J Pharm Sci Res 2018;9(7):2807-2817. doi:10.13040/IJPSR.0975-8232.9(7).2807-17.
[60] Liu C, Guo DA, Liu L. Quality transitivity and traceability system of herbal medicine products based on quality markers. Phytomedicine 2018; 44:247-257. doi:10.1016/j.phymed.2018.03.006, PMID:29631807.
[61] Steinhoff B. Review: Quality of herbal medicinal products: State of the art of purity assessment. Phytomedicine 2019;60:153003. doi:10.1016/j.phymed.2019.153003, PMID:31327654.
[62] Zhang J, Wider B, Shang H, Li X, Ernst E. Quality of herbal medicines: challenges and solutions. Complement Ther Med 2012;20(1-2):100106. doi:10.1016/j.ctim.2011.09.004, PMID:22305255.
[63] Fernandes FH, Salgado HR. Gallic Acid: Review of the Methods of Determination and Quantification. Crit Rev Anal Chem 2016;46(3):257265. doi:10.1080/10408347.2015.1095064, PMID:26440222.
[64] Rashid S, Zafar M, Ahmad M, Lone FA, Shaheen S, Sultana S, et al. Microscopic investigations and pharmacognostic techniques used for the standardization of herbal drug Nigella sativa L. Microsc Res Tech. 2018;81(12):1443-1450. doi:10.1002/jemt.23110, PMID:30351462.
[65] Klepser TB, Doucette WR, Horton MR, Buys LM, Ernst ME, Ford JK, et al. Assessment of patients’ perceptions and beliefs regarding herbal therapies. Pharmacotherapy 2000;20(1):83-87. doi:10.1592/ phco.20.1.83.34658, PMID:10641978.
[66] Fugh-Berman A. Herb-drug interactions. Lancet 2000;355(9198):134138. doi:10.1016/S0140-6736(99)06457-0, PMID:10675182.
[67] Neergheen-Bhujun VS. Underestimating the toxicological challenges associated with the use of herbal medicinal products in developing countries. Biomed Res Int 2013;2013:804086. doi:10.1155/2013/804086, PMID:24163821.
[68] Meijerman I, Beijnen JH, Schellens JH. Herb-drug interactions in oncology: focus on mechanisms of induction. Oncologist 2006;11(7):742752. doi:10.1634/theoncologist.11-7-742, PMID:16880233.
[69] Farkas D, Shader RI, von Moltke LL, Greenblatt DJ. Mechanisms and consequences of drug-drug interactions. In: Gad SC (ed). Preclinical development handbook: ADME and biopharmaceutical properties. New York: John Wiley & Sons, Inc; 2008:879-917. doi:10.1002/9780470249031.ch25.
[70] Fasinu PS, Bouic PJ, Rosenkranz B. An overview of the evidence and mechanisms of herb-drug interactions. Front Pharmacol 2012;3:69. doi:10.3389/fphar.2012.00069, PMID:22557968.
[71] Brown L, Heyneke O, Brown D, van Wyk JP, Hamman JH. Impact of traditional medicinal plant extracts on antiretroviral drug ab-
sorption. J Ethnopharmacol 2008;119(3):588-592. doi:10.1016/j. jep.2008.06.028, PMID:18640255.
[72] Patsalos PN, Perucca E. Clinically important drug interactions in epilepsy: interactions between antiepileptic drugs and other drugs. Lancet Neurol 2003;2(8):473-481. doi:10.1016/s1474-4422(03)004836, PMID:12878435.
[73] Coppola M, Mondola R. Potential action of betel alkaloids on positive and negative symptoms of schizophrenia: a review. Nord J Psychiatry 2012;66(2):73-78. doi:10.3109/08039488.2011.605172, PMID: 21859398.
[74] Engelberg D, McCutcheon A, Wiseman S. A case of ginsenginduced mania. J Clin Psychopharmacol 2001;21(5):535-537. doi:10.1097/00004714-200110000-00015, PMID:11593083.
[75] Borrelli F, Izzo AA. Herb-drug interactions with St John’s wort (Hypericum perforatum): an update on clinical observations. AAPS J 2009;11(4):710-727. doi:10.1208/s12248-009-9146-8, PMID:1985 9815.
[76] Nicolussi S, Drewe J, Butterweck V, Meyer Zu Schwabedissen HE. Clinical relevance of St. John’s wort drug interactions revisited. Br J Pharmacol 2020;177(6):1212-1226. doi:10.1111/bph.14936, PMID:31742659.
[77] Yin OQ, Tomlinson B, Waye MM, Chow AH, Chow MS. Pharmacogenetics and herb-drug interactions: experience with Ginkgo biloba and omeprazole. Pharmacogenetics 2004;14(12):841-850. doi:10.1097/00008571-200412000-00007, PMID:15608563.
[78] Taki Y, Yokotani K, Yamada S, Shinozuka K, Kubota Y, Watanabe Y, et al. Ginkgo biloba extract attenuates warfarin-mediated anticoagulation through induction of hepatic cytochrome P450 enzymes by bilobalide in mice. Phytomedicine 2012;19(2):177-182. doi:10.1016/j. phymed.2011.06.020, PMID:21802929.
[79] Alvarez AI, Real R, Pérez M, Mendoza G, Prieto JG, Merino G. Modulation of the activity of ABC transporters (P-glycoprotein, MRP2, BCRP) by flavonoids and drug response. J Pharm Sci 2010;99(2):598-617. doi:10.1002/jps.21851, PMID:19544374.
[80] Paine MF, Widmer WW, Pusek SN, Beavers KL, Criss AB, Snyder J, et al. Further characterization of a furanocoumarin-free grapefruit juice on drug disposition: studies with cyclosporine. Am J Clin Nutr 2008;87(4):863-871. doi:10.1093/ajcn/87.4.863, PMID:18400708.
[81] Sanderson JT, Hordijk J, Denison MS, Springsteel MF, Nantz MH, van den Berg M. Induction and inhibition of aromatase (CYP19) activity by natural and synthetic flavonoid compounds in H295R human adrenocortical carcinoma cells. Toxicol Sci 2004;82(1):70-79. doi:10.1093/toxsci/kfh257, PMID:15319488.
[82] Lundahl J, Regårdh CG, Edgar B, Johnsson G. Relationship between time of intake of grapefruit juice and its effect on pharmacokinetics and pharmacodynamics of felodipine in healthy subjects. Eur J Clin Pharmacol 1995;49(1-2):61-67. doi:10.1007/BF00192360, PMID:8751023.
[83] Pasi AK. Herb-drug interaction: an overview. Int J Pharm Sci Res 2013;4(10):3770-3774.doi:10.13040/IJPSR.0975-8232.4(10).3770-74.
[84] Suroowan S, Abdallah HH, Mahomoodally MF. Herb-drug interactions and toxicity: Underscoring potential mechanisms and forecasting clinically relevant interactions induced by common phytoconstituents via data mining and computational approaches. Food Chem Toxicol 2021;156:112432. doi:10.1016/j.fct.2021.112432, PMID:34293424.
[85] Petrovska BB. Historical review of medicinal plants’ usage. Pharmacogn Rev 2012;6(11):1-5. doi:10.4103/0973-7847.95849, PMID:2265 4398.
[86] Šantić Ž, Pravdić N, Bevanda M, Galić K. The historical use of medicinal plants in traditional and scientific medicine. Psychiatr Danub 2017;29(Suppl 4):787-792. PMID:29278625.
[87] Yuan H, Ma Q, Ye L, Piao G. The Traditional Medicine and Modern Medicine from Natural Products. Molecules 2016;21(5):559. doi:10.3390/molecules21050559, PMID:27136524.
[88] Patwardhan B, Warude D, Pushpangadan P, Bhatt N. Ayurveda and traditional Chinese medicine: a comparative overview. Evid Based Complement Alternat Med 2005;2(4):465-473. doi:10.1093/ecam/ neh140, PMID:16322803.
[89] Balkrishna A, Sharma S, Maity M, Tomer M, Singh R, Gohel V, et al. Di-vya-WeightGo combined with moderate aerobic exercise remediates
adiposopathy, insulin resistance, serum biomarkers, and hepatic lipid accumulation in high-fat diet-induced obese mice. Biomed Pharmacother 2023;163:114785. doi:10.1016/j.biopha.2023.114785, PMID: 37137183.
[90] Balkrishna A, Gohel V, Pathak N, Tomer M, Rawat M, Dev R, et al. Anti-hyperglycemic contours of Madhugrit are robustly translated in the Caenorhabditis elegans model of lipid accumulation by regulating oxidative stress and inflammatory response. Front Endocrinol (Lausanne) 2022;13:1064532. doi:10.3389/fendo.2022.1064532, PMID: 36545334.
[91] Balkrishna A, Gohel V, Pathak N, Singh R, Tomer M, Rawat M, et al. An-ti-oxidant response of lipidom modulates lipid metabolism in Caenorhabditis elegans and in OxLDL-induced human macrophages by tuning inflammatory mediators. Biomed Pharmacother 2023;160:114309. doi:10.1016/j.biopha.2023.114309, PMID:36709598.
[92] Sekhar AV, Gandhi DN, Rao NM, Rawal UD. An experimental and clinical evaluation of anti-asthmatic potentialities of Devadaru compound (DC). Indian J Physiol Pharmacol 2003;47(1):101-107. PMID:12708131.
[93] Balkrishna A, Goswami S, Singh H, Gohel V, Dev R, Haldar S, et al. Herbo-mineral formulation, Divya-Swasari-Vati averts SARS-CoV-2 pseudovirus entry into human alveolar epithelial cells by interfering with spike protein-ACE 2 interaction and IL-
[94] Chopra A, Lavin P, Patwardhan B, Chitre D. Randomized double blind trial of an ayurvedic plant derived formulation for treatment of rheumatoid arthritis. J Rheumatol 2000;27(6):1365-1372. PMID:10852255.
[95] Balkrishna A, Sakat SS, Joshi K, Paudel S, Joshi D, Joshi K, et al. AntiInflammatory and Anti-Arthritic Efficacies of an Indian Traditional Herbo-Mineral Medicine “Divya Amvatari Ras” in Collagen Anti-body-Induced Arthritis (CAIA) Mouse Model Through Modulation of IL-6/IL-13/TNF-
[96] Xiong H, Ding X, Wang H, Jiang H, Wu X, Tu C, et al. Tibetan medicine Kuan-Jin-Teng exerts anti-arthritic effects on collagen-induced arthritis rats via inhibition the production of pro-inflammatory cytokines and down-regulation of MAPK signaling pathway. Phytomedicine 2019;57:271-281. doi:10.1016/j.phymed.2018.12.023, PMID:30802713.
[97] Gupta R, Singhal S, Goyle A, Sharma VN. Antioxidant and hypocholesterolaemic effects of Terminalia arjuna tree-bark powder: a randomised placebo-controlled trial. J Assoc Physicians India 2001;49:231-235. PMID:11225136.
[98] Kumar PU, Adhikari P, Pereira P, Bhat P. Safety and efficacy of Hartone in stable angina pectoris-an open comparative trial. J Assoc Physicians India 1999;47(7):685-689. PMID:10778587.
[99] Srivastava S, Saksena AK, Khattri S, Kumar S, Dagur RS. Curcuma Ionga extract reduces inflammatory and oxidative stress biomarkers in osteoarthritis of knee: a four-month, double-blind, randomized, pla-cebo-controlled trial. Inflammopharmacology 2016;24(6):377-388. doi:10.1007/s10787-016-0289-9, PMID:27761693.
[100] Rahmani S, Asgary S, Askari G, Keshvari M, Hatamipour M, Feizi A, et al. Treatment of Non-alcoholic Fatty Liver Disease with Curcumin: A Randomized Placebo-controlled Trial. Phytother Res 2016;30(9):1540-1548. doi:10.1002/ptr.5659, PMID:27270872.
[101] Arabnezhad L, Mohammadifard M, Rahmani L, Majidi Z, Ferns GA, Bahrami A. Effects of curcumin supplementation on vitamin D levels in women with premenstrual syndrome and dysmenorrhea: a randomized controlled study. BMC Complement Med Ther 2022;22(1):19. doi:10.1186/s12906-022-03515-2, PMID:35065636.
[102] Shah S, Rath H, Sharma G, Senapati SN, Mishra E. Effectiveness of curcumin mouthwash on radiation-induced oral mucositis among head and neck cancer patients: A triple-blind, pilot randomised controlled trial. Indian J Dent Res 2020;31(5):718-727. doi:10.4103/ijdr. IJDR_822_18, PMID:33433509.
[103] Uchio R, Kawasaki K, Okuda-Hanafusa C, Saji R, Muroyama K, Murosaki S , et al. Curcuma longa extract improves serum inflammatory markers and mental health in healthy participants who are overweight: a randomized, double-blind, placebo-controlled trial. Nutr J
[104] Radunz CL, Okuyama CE, Branco-Barreiro FCA, Pereira RMS, Diniz SN. Clinical randomized trial study of hearing aids effectiveness in association with Ginkgo biloba extract (EGb 761) on tinnitus improvement. Braz J Otorhinolaryngol 2020;86(6):734-742. doi:10.1016/j. bjorl.2019.05.003, PMID:31300303.
[105] Nazarinasab M, Behrouzian F, Negahban S, Sadegh AM, Zeynali E. Investigating the efficacy of Ginkgo biloba on the cognitive function of patients undergoing treatment with electric shock: a double-blind clinical trial. J Med Life 2022;15(12):1540-1547. doi:10.25122/jml-2021-0262, PMID:36762332.
[106] Sha RN, Tang L, Du YW, Wu SX, Shi HW, Zou HX, et al. Effectiveness and safety of Ginkgo biloba extract (GBE50) in the treatment of dizziness caused by cerebral arteriosclerosis: a multi-center, doubleblind, randomized controlled trial. J Tradit Chin Med 2022;42(1):8389. doi:10.19852/j.cnki.jtcm.20211214.001, PMID:35294126.
[107] Pingali U, Nutalapati C, Koilagundla N, Taduri G. A randomized, dou-ble-blind, positive-controlled, prospective, dose-response clinical study to evaluate the efficacy and tolerability of an aqueous extract of Terminalia bellerica in lowering uric acid and creatinine levels in chronic kidney disease subjects with hyperuricemia. BMC Complement Med Ther 2020;20(1):281. doi:10.1186/s12906-020-03071-7, PMID:32933504.
[108] Pingali U, Sukumaran D, Nutalapati C. Effect of an aqueous extract of Terminalia chebula on endothelial dysfunction, systemic inflammation, and lipid profile in type 2 diabetes mellitus: A randomized double-blind, placebo-controlled clinical study. Phytother Res 2020;34(12):3226-3235. doi:10.1002/ptr.6771, PMID:32618037.
[109] Zadhoush R, Alavi-Naeini A, Feizi A, Naghshineh E, Ghazvini MR. The effect of garlic (Allium sativum) supplementation on the lipid parameters and blood pressure levels in women with polycystic ovary syndrome: A randomized controlled trial. Phytother Res 2021;35(11):6335-6342. doi:10.1002/ptr.7282, PMID:34496450.
[110] Alhashim M, Lombardo J. Effect of Topical Garlic on Wound Healing and Scarring: A Clinical Trial. Dermatol Surg 2020;46(5):618-627. doi:10.1097/DSS. 0000000000002123 , PMID:31490311.
[111] Choudhary PR, Jani RD, Sharma MS. Effect of Raw Crushed Garlic (Allium sativum L.) on Components of Metabolic Syndrome. J Diet Suppl 2018;15(4):499-506. doi:10.1080/19390211.2017.1358233, PMID:28956671.
[112] Xu C, Mathews AE, Rodrigues C, Eudy BJ, Rowe CA, O’Donoughue A, et al. Aged garlic extract supplementation modifies inflammation and immunity of adults with obesity: A randomized, double-blind, placebo-controlled clinical trial. Clin Nutr ESPEN 2018;24:148-155. doi:10.1016/j.clnesp.2017.11.010, PMID:29576354.
[113] Ried K, Frank OR, Stocks NP. Aged garlic extract reduces blood pressure in hypertensives: a dose-response trial. Eur J Clin Nutr 2013;67(1):64-70. doi:10.1038/ejcn.2012.178, PMID:23169470.
[114] Kim HG, Cho JH, Yoo SR, Lee JS, Han JM, Lee NH, et al. Antifatigue effects of Panax ginseng C.A. Meyer: a randomised, double-blind, placebo-controlled trial. PLoS One 2013;8(4):e61271. doi:10.1371/ journal.pone.0061271, PMID:23613825.
[115] Jovanovski E, Lea-Duvnjak-Smircic, Komishon A, Au-Yeung F, Zurbau A, Jenkins AL, et al. Vascular effects of combined enriched Korean Red ginseng (Panax Ginseng) and American ginseng (Panax Quinquefolius) administration in individuals with hypertension and type 2 diabetes: A randomized controlled trial. Complement Ther Med 2020;49:102338. doi:10.1016/j.ctim.2020.102338, PMID:32147072.
[116] Lin CH, Lin YA, Chen SL, Hsu MC, Hsu CC. American Ginseng Attenuates Eccentric Exercise-Induced Muscle Damage via the Modulation of Lipid Peroxidation and Inflammatory Adaptation in Males. Nutrients 2021;14(1):78. doi:10.3390/nu14010078, PMID:35010953.
[117] Ghorbani Z, Mirghafourvand M, Farshbaf Khalili A, Javadzadeh Y, Shakouri SK, Dastranj Tabrizi A. The Effect of Panax ginseng on Genitourinary Syndrome in Postmenopausal Women: A Randomized, Double-Blind, Placebo-Controlled Clinical Trial. Complement Med Res 2021;28(5):419-426. doi:10.1159/000514944, PMID:33730722.
[118] Jung JH, Kang TK, Oh JH, Jeong JU, Ko KP, Kim ST. The Effect of Korean Red Ginseng on Symptoms and Inflammation in Patients With Allergic Rhinitis. Ear Nose Throat J 2021;100(suppl 5):712S-719S. doi:10.1177/0145561320907172, PMID:32070136.
[119] Guiné RP, Gonçalves FJ. Bioactive Compounds in Some Culinary Aromatic Herbs and Their Effects on Human Health. Mini Rev Med Chem 2016;16(11):855-866. doi:10.2174/1389557516666160211120540, PMID:26864553.
[120] Stéphane FF, Jules BK, Batiha GE, Ali I, Bruno LN. El-Shemy HA. Extraction of bioactive compounds from medicinal plants and herbs. Natural Medicinal Plants 2021;RijekaIntechOpen1-39. doi:10.5772/ intechopen. 98602.
[121] Yan Y, Liu N, Hou N, Dong L, Li J. Chlorogenic acid inhibits hepatocellular carcinoma in vitro and in vivo. J Nutr Biochem 2017;46:68-73. doi:10.1016/j.jnutbio.2017.04.007, PMID:28458139.
[122] Sultana S, Munir N, Mahmood Z, Riaz M, Akram M, Rebezov M, et al. Molecular targets for the management of cancer using Curcuma longa Linn. phytoconstituents: A Review. Biomed Pharmacother 2021;135:111078. doi:10.1016/j.biopha.2020.111078, PMID:33433 356.
[123] Zhang F, Thakur K, Hu F, Zhang JG, Wei ZJ. 10-Gingerol, a Phytochemical Derivative from “Tongling White Ginger”, Inhibits Cervical Cancer: Insights into the Molecular Mechanism and Inhibitory Targets. J Agric Food Chem 2017;65(10):2089-2099. doi:10.1021/acs. jafc.7b00095, PMID:28230361.
[124] Pal HC, Sharma S, Strickland LR, Agarwal J, Athar M, Elmets CA, et al. Delphinidin reduces cell proliferation and induces apoptosis of non-small-cell lung cancer cells by targeting EGFR/VEGFR2 signaling pathways. PLoS One 2013;8(10):e77270. doi:10.1371/journal. pone.0077270, PMID:24124611.
[125] Wang X, Zhang ZF, Zheng GH, Wang AM, Sun CH, Qin SP, et al. The Inhibitory Effects of Purple Sweet Potato Color on Hepatic Inflammation Is Associated with Restoration of NAD
[126] Zapf MA, Kothari AN, Weber CE, Arffa ML, Wai PY, Driver J, et al. Green tea component epigallocatechin-3-gallate decreases expression of osteopontin via a decrease in mRNA half-life in cell lines of metastatic hepatocellular carcinoma. Surgery 2015;158(4):10391047. doi:10.1016/j.surg.2015.06.011, PMID:26189955.
[127] Sur S, Pal D, Roy R, Barua A, Roy A, Saha P, et al. Tea polyphenols EGCG and TF restrict tongue and liver carcinogenesis simultaneously induced by N-nitrosodiethylamine in mice. Toxicol Appl Pharmacol 2016;300:34-46. doi:10.1016/j.taap.2016.03.016, PMID:27058323.
[128] Shimizu M, Shirakami Y, Sakai H, Tatebe H, Nakagawa T, Hara Y, et al. EGCG inhibits activation of the insulin-like growth factor (IGF)/ IGF-1 receptor axis in human hepatocellular carcinoma cells. Cancer Lett 2008;262(1):10-18. doi:10.1016/j.canlet.2007.11.026, PMID: 18164805.
[129] Banjerdpongchai R, Wudtiwai B, Khaw-On P, Rachakhom W, Duangnil N, Kongtawelert P. Hesperidin from Citrus seed induces human hepatocellular carcinoma HepG2 cell apoptosis via both mitochondrial and death receptor pathways. Tumour Biol 2016;37(1):227237. doi:10.1007/s13277-015-3774-7, PMID:26194866.
[130] Zhang J, Song J, Wu D, Wang J, Dong W. Hesperetin induces the apoptosis of hepatocellular carcinoma cells via mitochondrial pathway mediated by the increased intracellular reactive oxygen species, ATP and calcium. Med Oncol 2015;32(4):101. doi:10.1007/s12032-015-0516-z, PMID:25737432.
[131] Yen HR, Liu CJ, Yeh CC. Naringenin suppresses TPA-induced tumor invasion by suppressing multiple signal transduction pathways in human hepatocellular carcinoma cells. Chem Biol Interact 2015;235:19. doi:10.1016/j.cbi.2015.04.003, PMID:25866363.
[132] Akram M, Riaz M, Wadood AWC, Hazrat A, Mukhtiar M, Ahmad Zakki S, et al. Medicinal plants with anti-mutagenic potential. Biotechnol Biotechnol Equip 34(1):309-318. doi:10.1080/13102818.2020.1749 527.
[133] García ER, Gutierrez EA, de Melo FCSA, Novaes RD, Gonçalves RV. Flavonoids Effects on Hepatocellular Carcinoma in Murine Models: A Systematic Review. Evid Based Complement Alternat Med 2018;2018:6328970. doi:10.1155/2018/6328970, PMID:29681978.
[134] Iyer SC, Gopal A, Halagowder D. Myricetin induces apoptosis by inhibiting P21 activated kinase 1 (PAK1) signaling cascade in hepatocellular carcinoma. Mol Cell Biochem 2015;407(1-2):223-237.
doi:10.1007/s11010-015-2471-6, PMID:26104578.
[135] Kim SJ, Jeong CW, Bae HB, Kwak SH, Son JK, Seo CS, et al. Protective effect of sauchinone against regional myocardial ischemia/ reperfusion injury: inhibition of p38 MAPK and JNK death signaling pathways. J Korean Med Sci 2012;27(5):572-575. doi:10.3346/ jkms.2012.27.5.572, PMID:22563228.
[136]Zuo YH, Liu YB, Cheng CS, Yang YP, Xie Y, Luo P, et al. Isovaleroylbinankadsurin A ameliorates cardiac ischemia/reperfusion injury through activating GR dependent RISK signaling. Pharmacol Res 2020;158:104897. doi:10.1016/j.phrs.2020.104897, PMID:32422343.
[137] Zhang H, Sun Q, Xu T, Hong L, Fu R, Wu J, et al. Resveratrol attenuates the progress of liver fibrosis via the Akt/nuclear factor-kB pathways. Mol Med Rep 2016;13(1):224-230. doi:10.3892/mmr.2015.4497, PMID:26530037.
[138] Li J, Liu P, Zhang R, Cao L, Qian H, Liao J, et al. Icaritin induces cell death in activated hepatic stellate cells through mitochondrial activated apoptosis and ameliorates the development of liver fibrosis in rats. J Ethnopharmacol 2011;137(1):714-723. doi:10.1016/j. jep.2011.06.030, PMID:21726622.
[139] Ling Y, Chen G, Deng Y, Tang H, Ling L, Zhou X, et al. Polydatin posttreatment alleviates myocardial ischaemia/reperfusion injury by promoting autophagic flux. Clin Sci (Lond) 2016;130(18):1641-1653. doi:10.1042/CS20160082, PMID:27340138.
[140] Mioc M, Milan A, Malița D, Mioc A, Prodea A, Racoviceanu R, et al. Recent Advances Regarding the Molecular Mechanisms of Triterpenic Acids: A Review (Part I). Int J Mol Sci 2022;23(14):7740. doi:10.3390/ijms23147740, PMID:35887090.
[141] Yi C, Song M, Sun L, Si L, Yu D, Li B, et al. Asiatic Acid Alleviates Myocardial Ischemia-Reperfusion Injury by Inhibiting the ROS-Mediated Mitochondria-Dependent Apoptosis Pathway. Oxid Med Cell Longev 2022;2022:3267450. doi:10.1155/2022/3267450, PMID:35198095.
[142] Wang F, Gao Q, Yang J, Wang C, Cao J, Sun J, et al. Artemisinin suppresses myocardial ischemia-reperfusion injury via NLRP3 inflammasome mechanism. Mol Cell Biochem 2020;474(1-2):171-180. doi:10.1007/s11010-020-03842-3, PMID:32729005.
[143] Chang L, Shi R, Wang X, Bao Y. Gypenoside A protects ischemia/ reperfusion injuries by suppressing miR-143-3p level via the activation of AMPK/Foxo1 pathway. Biofactors 2020;46(3):432-440. doi:10.1002/biof.1601, PMID:31889343.
[144] Wang Y, Che J, Zhao H, Tang J, Shi G. Platycodin D inhibits oxidative stress and apoptosis in H9c2 cardiomyocytes following hypoxia/reoxygenation injury. Biochem Biophys Res Commun 2018;503(4):32193224. doi:10.1016/j.bbrc.2018.08.129, PMID:30146261.
[145] Omata M, Matsui N, Inomata N, Ohno T. Protective effects of polysaccharide fucoidin on myocardial ischemia-reperfusion injury in rats. J Cardiovasc Pharmacol 1997;30(6):717-724. doi:10.1097/00005344-199712000-00003, PMID:9436808.
[146] Przybylska S, Tokarczyk G. Lycopene in the Prevention of Cardiovascular Diseases. Int J Mol Sci 2022;23(4):1957. doi:10.3390/ ijms23041957, PMID:35216071.
[147] Wang XY, Dong WP, Bi SH, Pan ZG, Yu H, Wang XW, et al. Protective effects of osthole against myocardial ischemia/reperfusion injury in rats. Int J Mol Med 2013;32(2):365-372. doi:10.3892/ ijmm.2013.1386, PMID:23695269.
- Keywords: Herbal medicine; Safety; Efficacy; Bioactivity; Natural remedies; Traditional medicine; Botanical supplements.
Abbreviations: ACE, angiotensin-converting enzyme; Akt, protein kinase B; BP, blood pressure; CNS, central nervous system; CYP, cytochrome P450; ED, effective dose for of the population; ERK, extracellular-signal regulated kinase; FAERS, FDA’s Adverse Event Reporting System; FDA, The Food and Drug Administration; GACP, Guidelines on Good Agricultural and Collection Practices; HDIs, herb-drug interactions; IL, interleukin; JNK, c-Jun N-terminal kinase; MMP, matrix metalloproteinase; NFkB, nuclear factor kappa B; PI3K, phosphoinositide 3-kinase; ROS, reactive oxygen species; TCM, traditional Chinese medicine; TD , median toxic dose of a drug at which toxicity occurs in of cases.
*Correspondence to: Nidhi Sharma, Patanjali Herbal Research Department, Patanjali Research Foundation, Maharishi Dayanand Gram, Delhi-Haridwar National Highway, Near Bahadrabad, Haridwar 249405, India. ORCID: https://orcid.org/0000-0001-6123-5194. Tel: +91-9999880322, E-mail: nidhi.sharma@prft.co.in
How to cite this article: Balkrishna A, Sharma N, Srivastava D, Kukreti A, Srivastava S, Arya V. Exploring the Safety, Efficacy, and Bioactivity of Herbal Medicines: Bridging Traditional Wisdom and Modern Science in Healthcare. Future Integr Med 2024;3(1):35-49. doi: 10.14218/FIM.2023.00086.
DOI: https://doi.org/10.14218/fim.2023.00086
Publication Date: 2024-03-25
Exploring the Safety, Efficacy, and Bioactivity of Herbal Medicines: Bridging Traditional Wisdom and Modern Science in Healthcare
Abstract
This review explores the convergence of traditional wisdom and modern science in the realm of herbal medicines, focusing on the safety, efficacy, and bioactivity of these natural remedies in contemporary healthcare. The rich history of herbal medicines, deeply embedded in cultural traditions, is witnessing a resurgence as the quest for holistic and personalized healthcare gains momentum. Herbal medicine, a time-honored practice passed down through generations, is experiencing renewed interest amid the growing acknowledgment of its potential benefits. This review delves into the safety profiles of herbal remedies, subjecting them to rigorous scientific scrutiny. Additionally, it investigates the efficacy of herbal interventions, aiming to bridge the gap between historical anecdotes and empirical research. The complex bioactivity of herbal compounds, often containing numerous active ingredients, is a focal point, unraveling the mechanisms through which these natural substances interact with the human body. In a world where the synthesis of traditional wisdom and modern science holds promise for advancing healthcare, this review contributes to the ongoing dialogue. By critically examining the safety, efficacy, and bioactivity of herbal remedies, it aims to illuminate the evolving landscape of herbal medicine. The goal is to integrate the best of both worlds to enhance global well-being, acknowledging the potential of herbal medicine as a valuable complement to modern healthcare practices.
Introduction
growth.
However, this increasing demand has also witnessed a rise in fraudulent practices, including the substitution of herbal material and the addition of synthetic compounds.
Safety assessment of herbal medicines
Herbal drugs and their preparations
Safety and potential toxicity of herbal remedies

Anticipating adverse effects and toxicities: understanding herbal medicine usage
including the inappropriate application of herbs and supplements, their incorrect preparation, excessive dosages, or prolonged utilization.
| Pharmaceutical drugs | Herbal drugs | |
| Reporting System | A robust system exists for reporting and tracking adverse reactions to pharmaceutical drugs. Healthcare providers and pharmaceutical companies must report such events, resulting in comprehensive databases of drug-related adverse events. | Adverse reactions linked to herbal drugs are less systematically reported compared to pharmaceuticals, often leading to underreporting due to a lack of awareness among consumers and healthcare providers. |
| Data on adverse reactions | In 2020, the FDA’s Adverse Event Reporting System (FAERS) recorded 5.8 million adverse event reports associated with pharmaceutical drugs, encompassing a spectrum from mild side effects to severe and life-threatening reactions. | Monitoring herbal drug adverse reactions is less robust than for pharmaceuticals. Despite potential underreporting, the documented instances of serious or life-threatening adverse reactions to herbal medicines remain exceptionally rare. |
| Common adverse reactions | Common adverse reactions to pharmaceutical drugs include nausea, vomiting, headache, dizziness, and skin rashes. In severe cases, they can cause organ damage or even death | The lack of comprehensive reporting systems makes it challenging to compile accurate data on adverse reactions to herbal drugs. |
with pharmaceuticals. Similarly, a study examining 243 proprietary products in California showed that
challenges during the identification and collection of medicinal plants used in herbal remedies. To address confusion stemming from common names, it is essential to adopt widely accepted binomial names, including their synonyms, for medicinal plants. For instance, Artemisia absinthium L., known for its active narcotic derivative and potential to induce central nervous system disorders and generalized mental deterioration, has no fewer than 11 distinct common names, with seven bearing no resemblance to its botanical name. Given the prevalence of common names, Heliotropium europaeum (heliotrope), containing potent hepatotoxic pyrrolidine alkaloids, is frequently mistaken for Valerian officinalis (garden heliotrope), which contains sedative and muscle relaxant valepotriates, emphasizing the necessity of providing the precise scientific name of the plant. Hence, the proficient oversight of herbal medicine safety necessitates robust cooperation among botanists, phytochemists, pharmacologists, and other prominent contributors.
Regulation and quality control
and efficacy of these products. Key challenges in obtaining genuine herbal drugs include adulteration, substitution, and a shortage of skilled personnel. Implementing advanced quality control techniques and standards is crucial to ensure the quality of medicinal herbal products.
cal parameter assessments (e.g., moisture content, acid-insoluble ash, and water-soluble ash), and the incorporation of novel parameters.
Drug-herb interactions

ing the gastrointestinal transit time and increasing gastrointestinal motility. These plants might be detrimental to the gut epithelium (inhibits

Efficacy of herbal medicines
The rich history of traditional herbal medicine practices
The importance of validating traditional knowledge with modern scientific research
ma and respiratory disorders,
Examples of some common herbs scientifically proven to be effective
potential to enhance lipid markers in women suffering from polycystic ovary syndrome, suggesting its potential as a complementary therapy alongside standard care.
Bioactivity of herbal medicines

Diverse array of bioactive compounds
digenous healing practices due to their medicinal properties. These bioactive compounds are the very essence that imparts color, flavor, and aroma to herbs, while also offering a profound impact on human health when consumed. They contribute to a spectrum of bioactivities, such as anti-inflammatory, immunostimulatory, anticancer, antioxidant, antiproliferation, apoptosis, antifibrotic, and antimicrobial properties (Fig. 4). Additionally, they may support digestive health, bolster the immune system, or aid in the management of chronic conditions.
The complex mechanisms of bioactive compounds
methods, processing, and the digestive process, all of which affect their absorption and utilization within the body. Herbalists and traditional healers often prescribe herbs based on the bioactive compounds they contain to address specific health conditions. Modern scientific research also has delved into the therapeutic potential of bioactive compounds in herbs, shedding light on their mechanisms of action and potential applications in healthcare.
Mechanistic insight of bioactive compounds
tophagic flux, reduces ROS, and cell death, while lignans inhibit p38 phosphorylation and JNK death.
Conclusion
Acknowledgments
Funding
Conflict of interest
Author contributions
References
[2] Islam SU, Dar TUH, Khuroo AA, Bhat BA, Mangral ZA, Tariq L, et al. DNA barcoding aids in identification of adulterants of Trillium govanianum Wall. ex D. Don. J Appl Res Med Aromat Plants 2021;23:100305. doi:10.1016/j.jarmap.2021.100305.
[3] Jităreanu A, Trifan A, Vieriu M, Caba IC, Mârțu I, Agoroaei L. Current trends in toxicity assessment of herbal medicines: A narrative review. Processes 2022;11(1):83. doi:10.3390/pr11010083.
[4] Tulunay M, Aypak C, Yikilkan H, Gorpelioglu S. Herbal medicine use among patients with chronic diseases. J Intercult Ethnopharmacol 2015;4(3):217-220. doi:10.5455/jice.20150623090040, PMID:2640 1410.
[5] Peltzer K, Pengpid S. The use of herbal medicines among chronic disease patients in Thailand: a cross-sectional survey. J Multidiscip Healthc 2019;12:573-582. doi:10.2147/JMDH.S212953, PMID: 31413584.
[6] Tnah LH, Lee SL, Tan AL, Lee CT, Ng KK, Ng CH, et al. DNA barcode database of common herbal plants in the tropics: a resource for herbal product authentication. Food control 2019;95:318-326. doi:10.1016/j.foodcont.2018.08.022.
[7] Jordan SA, Cunningham DG, Marles RJ. Assessment of herbal medicinal products: challenges, and opportunities to increase the knowledge base for safety assessment. Toxicol Appl Pharmacol 2010;243(2):198216. doi:10.1016/j.taap.2009.12.005, PMID:20018204.
[8] Brantley SJ, Argikar AA, Lin YS, Nagar S, Paine MF. Herb-drug interactions: challenges and opportunities for improved predictions. Drug Metab Dispos 2014;42(3):301-317. doi:10.1124/dmd.113.055236, PMID:24335390.
[9] Singh S, Bansal A, Singh V, Chopra T, Poddar J. Flavonoids, alkaloids and terpenoids: a new hope for the treatment of diabetes mellitus. J Diabetes Metab Disord 2022;21(1):941-950. doi:10.1007/s40200-
[10] Roy A, Khan A, Ahmad I, Alghamdi S, Rajab BS, Babalghith AO, et al. Flavonoids a Bioactive Compound from Medicinal Plants and Its Therapeutic Applications. Biomed Res Int 2022;2022:5445291. doi:10.1155/2022/5445291, PMID:35707379.
[11] Riaz M, Khalid R, Afzal M, Anjum F, Fatima H, Zia S, et al. Phytobioactive compounds as therapeutic agents for human diseases: A review. Food Sci Nutr 2023;11(6):2500-2529. doi:10.1002/fsn3.3308, PMID:37324906.
[12] Fernández-Ochoa Á, Leyva-Jiménez FJ, De la Luz Cádiz-Gurrea M, Pi-mentel-Moral S, Segura-Carretero A. The Role of High-Resolution Analytical Techniques in the Development of Functional Foods. Int J Mol Sci 2021;22(6):3220. doi:10.3390/ijms22063220, PMID:33809986.
[13] Rinschen MM, Ivanisevic J, Giera M, Siuzdak G. Identification of bioactive metabolites using activity metabolomics. Nat Rev Mol Cell Biol 2019;20(6):353-367. doi:10.1038/s41580-019-0108-4, PMID:30814649.
[14] Fu Y, Yang JC, Cunningham AB, Towns AM, Zhang Y, Yang HY, et al. A billion cups: The diversity, traditional uses, safety issues and potential of Chinese herbal teas. J Ethnopharmacol 2018;222:217-228. doi:10.1016/j.jep.2018.04.026, PMID:29730132.
[15] Zhao J, Deng JW, Chen YW, Li SP. Advanced phytochemical analysis of herbal tea in China. J Chromatogr A 2013;1313:2-23. doi:10.1016/j. chroma.2013.07.039, PMID:23906802.
[16] Dori D, Méda N, Gbaguidi FA, Quetin-Leclercq J, Semdé R. [Wholesale distribution and delivery of plant-based medicinal products through the pharmaceutical system of Burkina Fasol. Ann Pharm Fr 2020;78(2):179188. doi:10.1016/j.pharma.2019.12.003, PMID:32037029.
[17] Petitet F. Interactions pharmacocinétiques entre préparation à base de plantes et médicament: une revue de l’importance Clinique. Phytothérapie 2012;10(3):170-182. doi:10.1007/s10298-012-0705-2.
[18] Sahoo N, Manchikanti P, Dey S. Herbal drugs: standards and regulation. Fitoterapia 2010;81(6):462-471. doi:10.1016/j.fitote.2010. 02.001, PMID:20156530.
[19] Muyumba NW, Mutombo SC, Sheridan H, Nachtergael A, Duez P. Quality control of herbal drugs and preparations: The methods of analysis, their relevance and applications. Talanta Open 2021;4:100070. doi:10.1016/j.talo.2021.100070.
[20] George P. Concerns regarding the safety and toxicity of medicinal plants-An overview. J Appl Pharm Sci 2011;1(6):40-44.
[21] Boullata JI, Nace AM. Safety issues with herbal medicine. Pharmacotherapy 2000;20(3):257-269. doi:10.1592/phco.20.4.257.34886, PMID:10730682.
[22] Ernst E. Herbal medicines: balancing benefits and risks. Novartis Found Symp 2007;282:154-167. doi:10.1002/9780470319444.ch11, PMID:17913230.
[23] Mardani S, Nasri H, Rafieian-Kopaei M, Hajian S. Herbal medicine and diabetic kidney disease. J Nephropharmacol 2013;2(1):1-2. PMID:28197432.
[24] Karimi A, Majlesi M, Rafieian-Kopaei M. Herbal versus synthetic drugs; beliefs and facts. J Nephropharmacol 2015;4(1):27-30. PMID:28197471.
[25] Ekor M. The growing use of herbal medicines: issues relating to adverse reactions and challenges in monitoring safety. Front Pharmacol 2014;4:177. doi:10.3389/fphar.2013.00177, PMID:24454289.
[26] Ifeoma O, Oluwakanyinsola S. Screening of herbal medicines for potential toxicities. In: Gowder S (ed). New insights into toxicity and drug testing. Rijeka: IntechOpen; 2013:63-88. doi:10.5772/54493.
[27] Jagan S, Ramakrishnan G, Anandakumar P, Kamaraj S, Devaki T. Antiproliferative potential of gallic acid against diethylnitrosamineinduced rat hepatocellular carcinoma. Mol Cell Biochem 2008;319(1-2):51-59. doi:10.1007/s11010-008-9876-4, PMID:18629614.
[28] Msomi NZ, Simelane MB. Herbal medicine. In: Builders PF (ed). Herbal Medicine. Rijeka: IntechOpen; 2019:215-227. doi:10.5772/ intechopen. 72816.
[29] Mirzaeian R, Sadoughi F, Tahmasebian S, Mojahedi M. Progresses and challenges in the traditional medicine information system: A systematic review. J Pharm Pharmacogn Res 2019;7(4):246-259. doi:10.56499/jppres19.662_7.4.246.
[30] Ahmad Khan MS, Ahmad I. Chapter 1-Herbal medicine: current trends and future prospects. In: Ahmad Khan MS, Ahmad I, Chat-
topadhyay D (eds). New Look to Phytomedicine: Advancements in Herbal Products as Novel Drug Leads. Cambridge: Academic Press; 2019:3-13. doi:10.1016/B978-0-12-814619-4.00001-X.
[31] Wake GE, Fitie GW. Magnitude and Determinant Factors of Herbal Medicine Utilization Among Mothers Attending Their Antenatal Care at Public Health Institutions in Debre Berhan Town, Ethiopia. Front Public Health 2022;10:883053. doi:10.3389/fpubh.2022.883053, PMID:35570953.
[32] Nasri H. Cisplatin therapy and the problem of gender-related nephrotoxicity. J Nephropharmacol 2013;2(2):13-14. PMID:28197436.
[33] Rafieian-Kopaei M. Medicinal plants for renal injury prevention. J Renal Inj Prev 2013;2(2):63-65. doi:10.12861/jrip.2013.21, PMID:25340130.
[34] Chang YJ, Hsu SL, Liu YT, Lin YH, Lin MH, Huang SJ, et al. Gallic acid induces necroptosis via TNF-
[35] Welz AN, Emberger-Klein A, Menrad K. Why people use herbal medicine: insights from a focus-group study in Germany. BMC Complement Altern Med 2018;18(1):92. doi:10.1186/s12906-018-2160-6, PMID:29544493.
[36] Mulholland CA, Benford DJ. What is known about the safety of multi-vitamin-multimineral supplements for the generally healthy population? Theoretical basis for harm. Am J Clin Nutr 2007;85(1):318S322S. doi:10.1093/ajcn/85.1.318S, PMID:17209218.
[37] Jacobus CH, Holick MF, Shao Q, Chen TC, Holm IA, Kolodny JM, et al. Hypervitaminosis D associated with drinking milk. N Engl J Med 1992;326(18):1173-1177. doi:10.1056/NEJM199204303261 801, PMID:1313547.
[38] Phua DH, Zosel A, Heard K. Dietary supplements and herbal medicine toxicities-when to anticipate them and how to manage them. Int J Emerg Med 2009;2(2):69-76. doi:10.1007/s12245-009-0105-z, PMID:20157447.
[39] Huang WF, Wen KC, Hsiao ML. Adulteration by synthetic therapeutic substances of traditional Chinese medicines in Taiwan. J Clin Pharmacol 1997;37(4):344-350. doi:10.1002/j.1552-4604.1997.tb04312.x, PMID:9115061.
[40] Ernst E. Adulteration of Chinese herbal medicines with synthetic drugs: a systematic review. J Intern Med 2002;252(2):107-113. doi:10.1046/j.1365-2796.2002.00999.x, PMID:12190885.
[41] Yee SK, Chu SS, Xu YM, Choo PL. Regulatory control of Chinese Proprietary Medicines in Singapore. Health Policy 2005;71(2):133-149. doi:10.1016/j.healthpol.2003.09.013, PMID:15607377.
[42] Ariffin SH, A Wahab I, Hassan Y, Abd Wahab MS. Adulterated Tra-ditional-Herbal Medicinal Products and Its Safety Signals in Malaysia. Drug Healthc Patient Saf 2021;13:133-140. doi:10.2147/DHPS. S305953, PMID:34135639.
[43] Al Lawati HA, Al Busaidi I, Kadavilpparampu AM, Suliman FO. Determination of Common Adulterants in Herbal Medicine and Food Samples using Core-shell Column Coupled to Tandem Mass Spectrometry. J Chromatogr Sci 2017;55(3):232-242. doi:10.1093/chromsci/ bmw175, PMID:27881492.
[44] Raviraja Shetty G, Harsha R. Adulteration in medicinal plants and herbal drugs. Int J Agric Sci 2021;12(1):12-17. doi:10.53390/ijas. v12i1.4.
[45] Krapf R. Development of Cushing’s syndrome after use of a herbal remedy. Lancet 2002;360(9348):1884. doi:10.1016/S0140-6736(02) 11747-8, PMID:12480390.
[46] Guimarães AC, Malachias MV, Coelho OR, Zilli EC, Luna RL. Use of sildenafil in patients with cardiovascular disease. Arq Bras Cardiol 1999;73(6):515-526. PMID:10904272.
[47] Chamsi-Pasha H. Sildenafil (viagra) and the heart. J Family Community Med 2001;8(2):63-66. PMID:23008645.
[48] Newmaster SG, Grguric M, Shanmughanandhan D, Ramalingam S, Ragupathy S. DNA barcoding detects contamination and substitution in North American herbal products. BMC Med 2013;11:222. doi:10.1186/1741-7015-11-222, PMID:24120035.
[49] Kerchner A, Farkas Á. Worldwide poisoning potential of Brugmansia and Datura. Forensic Toxicol 2020;38:30-41. doi:10.1007/s11419-019-00500-2.
[50] Han JP, Li MN, Luo K, Liu MZ, Chen XC, Chen SL. Identification of Da-
turae flos and its adulterants based on DNA barcoding technique. Yao Xue Xue Bao 2011;46(11):1408-1412. PMID:22260038.
[51] Pandey R, Tiwari RK, Shukla SS. Omics: A newer technique in herbal drug standardization & quantification. J Young Pharm 2016;8(2):7681. doi:10.5530/jyp.2016.2.4.
[52] World Health Organization. WHO guidelines for assessing quality of herbal medicines with reference to contaminants and residues. Geneva: World Health Organization; 2007.
[53] World Health Organization. WHO guidelines on good agricultural and collection practices (GACP) for medicinal plants. Geneva: World Health Organization; 2003.
[54] Liang YZ, Xie P, Chan K. Quality control of herbal medicines. J Chromatogr B Analyt Technol Biomed Life Sci 2004;812(1-2):53-70. doi:10.1016/j.jchromb.2004.08.041, PMID:15556488.
[55] Kamble MA, Mane MR, Ingole AR, Dhabarde DM. Standardization of some marketed herbal formulation used in diabetes. Journal of Advanced Research in Pharmaceutical Sciences and Pharmacology Interventions 2019;2(1):22-26.
[56] Nazim MD, Aslam M, Khatoon R, Asif M, Chaudhary SS. Physico-chemical standardization of Hansraj (Adiantum capillus-Veneris). J Drug Deliv Ther 2018;8(6-s):195-203. doi:10.22270/jddt.v8i6-s.2229.
[57] Marchese A, Barbieri R, Coppo E, Orhan IE, Daglia M, Nabavi SF, et al. Antimicrobial activity of eugenol and essential oils containing eugenol: A mechanistic viewpoint. Crit Rev Microbiol 2017;43(6):668-689. doi:10.1080/1040841X.2017.1295225, PMID:28346030.
[58] Deogade MS, Prasad KS. Standardization of wild Krushnatulasi (Ocimum tenuiflorum Linn) leaf. Int J Ayurveda Res 2019;10(1):52-61. doi:10.47552/ijam.v10i1.1172.
[59] Shaheen N, Imam S, Abidi S, Sultan RA, Azhar I, Mahmood ZA. Comparative pharmacognostic evaluation and standardization of Capsicum annuum L.(red chili). Int J Pharm Sci Res 2018;9(7):2807-2817. doi:10.13040/IJPSR.0975-8232.9(7).2807-17.
[60] Liu C, Guo DA, Liu L. Quality transitivity and traceability system of herbal medicine products based on quality markers. Phytomedicine 2018; 44:247-257. doi:10.1016/j.phymed.2018.03.006, PMID:29631807.
[61] Steinhoff B. Review: Quality of herbal medicinal products: State of the art of purity assessment. Phytomedicine 2019;60:153003. doi:10.1016/j.phymed.2019.153003, PMID:31327654.
[62] Zhang J, Wider B, Shang H, Li X, Ernst E. Quality of herbal medicines: challenges and solutions. Complement Ther Med 2012;20(1-2):100106. doi:10.1016/j.ctim.2011.09.004, PMID:22305255.
[63] Fernandes FH, Salgado HR. Gallic Acid: Review of the Methods of Determination and Quantification. Crit Rev Anal Chem 2016;46(3):257265. doi:10.1080/10408347.2015.1095064, PMID:26440222.
[64] Rashid S, Zafar M, Ahmad M, Lone FA, Shaheen S, Sultana S, et al. Microscopic investigations and pharmacognostic techniques used for the standardization of herbal drug Nigella sativa L. Microsc Res Tech. 2018;81(12):1443-1450. doi:10.1002/jemt.23110, PMID:30351462.
[65] Klepser TB, Doucette WR, Horton MR, Buys LM, Ernst ME, Ford JK, et al. Assessment of patients’ perceptions and beliefs regarding herbal therapies. Pharmacotherapy 2000;20(1):83-87. doi:10.1592/ phco.20.1.83.34658, PMID:10641978.
[66] Fugh-Berman A. Herb-drug interactions. Lancet 2000;355(9198):134138. doi:10.1016/S0140-6736(99)06457-0, PMID:10675182.
[67] Neergheen-Bhujun VS. Underestimating the toxicological challenges associated with the use of herbal medicinal products in developing countries. Biomed Res Int 2013;2013:804086. doi:10.1155/2013/804086, PMID:24163821.
[68] Meijerman I, Beijnen JH, Schellens JH. Herb-drug interactions in oncology: focus on mechanisms of induction. Oncologist 2006;11(7):742752. doi:10.1634/theoncologist.11-7-742, PMID:16880233.
[69] Farkas D, Shader RI, von Moltke LL, Greenblatt DJ. Mechanisms and consequences of drug-drug interactions. In: Gad SC (ed). Preclinical development handbook: ADME and biopharmaceutical properties. New York: John Wiley & Sons, Inc; 2008:879-917. doi:10.1002/9780470249031.ch25.
[70] Fasinu PS, Bouic PJ, Rosenkranz B. An overview of the evidence and mechanisms of herb-drug interactions. Front Pharmacol 2012;3:69. doi:10.3389/fphar.2012.00069, PMID:22557968.
[71] Brown L, Heyneke O, Brown D, van Wyk JP, Hamman JH. Impact of traditional medicinal plant extracts on antiretroviral drug ab-
sorption. J Ethnopharmacol 2008;119(3):588-592. doi:10.1016/j. jep.2008.06.028, PMID:18640255.
[72] Patsalos PN, Perucca E. Clinically important drug interactions in epilepsy: interactions between antiepileptic drugs and other drugs. Lancet Neurol 2003;2(8):473-481. doi:10.1016/s1474-4422(03)004836, PMID:12878435.
[73] Coppola M, Mondola R. Potential action of betel alkaloids on positive and negative symptoms of schizophrenia: a review. Nord J Psychiatry 2012;66(2):73-78. doi:10.3109/08039488.2011.605172, PMID: 21859398.
[74] Engelberg D, McCutcheon A, Wiseman S. A case of ginsenginduced mania. J Clin Psychopharmacol 2001;21(5):535-537. doi:10.1097/00004714-200110000-00015, PMID:11593083.
[75] Borrelli F, Izzo AA. Herb-drug interactions with St John’s wort (Hypericum perforatum): an update on clinical observations. AAPS J 2009;11(4):710-727. doi:10.1208/s12248-009-9146-8, PMID:1985 9815.
[76] Nicolussi S, Drewe J, Butterweck V, Meyer Zu Schwabedissen HE. Clinical relevance of St. John’s wort drug interactions revisited. Br J Pharmacol 2020;177(6):1212-1226. doi:10.1111/bph.14936, PMID:31742659.
[77] Yin OQ, Tomlinson B, Waye MM, Chow AH, Chow MS. Pharmacogenetics and herb-drug interactions: experience with Ginkgo biloba and omeprazole. Pharmacogenetics 2004;14(12):841-850. doi:10.1097/00008571-200412000-00007, PMID:15608563.
[78] Taki Y, Yokotani K, Yamada S, Shinozuka K, Kubota Y, Watanabe Y, et al. Ginkgo biloba extract attenuates warfarin-mediated anticoagulation through induction of hepatic cytochrome P450 enzymes by bilobalide in mice. Phytomedicine 2012;19(2):177-182. doi:10.1016/j. phymed.2011.06.020, PMID:21802929.
[79] Alvarez AI, Real R, Pérez M, Mendoza G, Prieto JG, Merino G. Modulation of the activity of ABC transporters (P-glycoprotein, MRP2, BCRP) by flavonoids and drug response. J Pharm Sci 2010;99(2):598-617. doi:10.1002/jps.21851, PMID:19544374.
[80] Paine MF, Widmer WW, Pusek SN, Beavers KL, Criss AB, Snyder J, et al. Further characterization of a furanocoumarin-free grapefruit juice on drug disposition: studies with cyclosporine. Am J Clin Nutr 2008;87(4):863-871. doi:10.1093/ajcn/87.4.863, PMID:18400708.
[81] Sanderson JT, Hordijk J, Denison MS, Springsteel MF, Nantz MH, van den Berg M. Induction and inhibition of aromatase (CYP19) activity by natural and synthetic flavonoid compounds in H295R human adrenocortical carcinoma cells. Toxicol Sci 2004;82(1):70-79. doi:10.1093/toxsci/kfh257, PMID:15319488.
[82] Lundahl J, Regårdh CG, Edgar B, Johnsson G. Relationship between time of intake of grapefruit juice and its effect on pharmacokinetics and pharmacodynamics of felodipine in healthy subjects. Eur J Clin Pharmacol 1995;49(1-2):61-67. doi:10.1007/BF00192360, PMID:8751023.
[83] Pasi AK. Herb-drug interaction: an overview. Int J Pharm Sci Res 2013;4(10):3770-3774.doi:10.13040/IJPSR.0975-8232.4(10).3770-74.
[84] Suroowan S, Abdallah HH, Mahomoodally MF. Herb-drug interactions and toxicity: Underscoring potential mechanisms and forecasting clinically relevant interactions induced by common phytoconstituents via data mining and computational approaches. Food Chem Toxicol 2021;156:112432. doi:10.1016/j.fct.2021.112432, PMID:34293424.
[85] Petrovska BB. Historical review of medicinal plants’ usage. Pharmacogn Rev 2012;6(11):1-5. doi:10.4103/0973-7847.95849, PMID:2265 4398.
[86] Šantić Ž, Pravdić N, Bevanda M, Galić K. The historical use of medicinal plants in traditional and scientific medicine. Psychiatr Danub 2017;29(Suppl 4):787-792. PMID:29278625.
[87] Yuan H, Ma Q, Ye L, Piao G. The Traditional Medicine and Modern Medicine from Natural Products. Molecules 2016;21(5):559. doi:10.3390/molecules21050559, PMID:27136524.
[88] Patwardhan B, Warude D, Pushpangadan P, Bhatt N. Ayurveda and traditional Chinese medicine: a comparative overview. Evid Based Complement Alternat Med 2005;2(4):465-473. doi:10.1093/ecam/ neh140, PMID:16322803.
[89] Balkrishna A, Sharma S, Maity M, Tomer M, Singh R, Gohel V, et al. Di-vya-WeightGo combined with moderate aerobic exercise remediates
adiposopathy, insulin resistance, serum biomarkers, and hepatic lipid accumulation in high-fat diet-induced obese mice. Biomed Pharmacother 2023;163:114785. doi:10.1016/j.biopha.2023.114785, PMID: 37137183.
[90] Balkrishna A, Gohel V, Pathak N, Tomer M, Rawat M, Dev R, et al. Anti-hyperglycemic contours of Madhugrit are robustly translated in the Caenorhabditis elegans model of lipid accumulation by regulating oxidative stress and inflammatory response. Front Endocrinol (Lausanne) 2022;13:1064532. doi:10.3389/fendo.2022.1064532, PMID: 36545334.
[91] Balkrishna A, Gohel V, Pathak N, Singh R, Tomer M, Rawat M, et al. An-ti-oxidant response of lipidom modulates lipid metabolism in Caenorhabditis elegans and in OxLDL-induced human macrophages by tuning inflammatory mediators. Biomed Pharmacother 2023;160:114309. doi:10.1016/j.biopha.2023.114309, PMID:36709598.
[92] Sekhar AV, Gandhi DN, Rao NM, Rawal UD. An experimental and clinical evaluation of anti-asthmatic potentialities of Devadaru compound (DC). Indian J Physiol Pharmacol 2003;47(1):101-107. PMID:12708131.
[93] Balkrishna A, Goswami S, Singh H, Gohel V, Dev R, Haldar S, et al. Herbo-mineral formulation, Divya-Swasari-Vati averts SARS-CoV-2 pseudovirus entry into human alveolar epithelial cells by interfering with spike protein-ACE 2 interaction and IL-
[94] Chopra A, Lavin P, Patwardhan B, Chitre D. Randomized double blind trial of an ayurvedic plant derived formulation for treatment of rheumatoid arthritis. J Rheumatol 2000;27(6):1365-1372. PMID:10852255.
[95] Balkrishna A, Sakat SS, Joshi K, Paudel S, Joshi D, Joshi K, et al. AntiInflammatory and Anti-Arthritic Efficacies of an Indian Traditional Herbo-Mineral Medicine “Divya Amvatari Ras” in Collagen Anti-body-Induced Arthritis (CAIA) Mouse Model Through Modulation of IL-6/IL-13/TNF-
[96] Xiong H, Ding X, Wang H, Jiang H, Wu X, Tu C, et al. Tibetan medicine Kuan-Jin-Teng exerts anti-arthritic effects on collagen-induced arthritis rats via inhibition the production of pro-inflammatory cytokines and down-regulation of MAPK signaling pathway. Phytomedicine 2019;57:271-281. doi:10.1016/j.phymed.2018.12.023, PMID:30802713.
[97] Gupta R, Singhal S, Goyle A, Sharma VN. Antioxidant and hypocholesterolaemic effects of Terminalia arjuna tree-bark powder: a randomised placebo-controlled trial. J Assoc Physicians India 2001;49:231-235. PMID:11225136.
[98] Kumar PU, Adhikari P, Pereira P, Bhat P. Safety and efficacy of Hartone in stable angina pectoris-an open comparative trial. J Assoc Physicians India 1999;47(7):685-689. PMID:10778587.
[99] Srivastava S, Saksena AK, Khattri S, Kumar S, Dagur RS. Curcuma Ionga extract reduces inflammatory and oxidative stress biomarkers in osteoarthritis of knee: a four-month, double-blind, randomized, pla-cebo-controlled trial. Inflammopharmacology 2016;24(6):377-388. doi:10.1007/s10787-016-0289-9, PMID:27761693.
[100] Rahmani S, Asgary S, Askari G, Keshvari M, Hatamipour M, Feizi A, et al. Treatment of Non-alcoholic Fatty Liver Disease with Curcumin: A Randomized Placebo-controlled Trial. Phytother Res 2016;30(9):1540-1548. doi:10.1002/ptr.5659, PMID:27270872.
[101] Arabnezhad L, Mohammadifard M, Rahmani L, Majidi Z, Ferns GA, Bahrami A. Effects of curcumin supplementation on vitamin D levels in women with premenstrual syndrome and dysmenorrhea: a randomized controlled study. BMC Complement Med Ther 2022;22(1):19. doi:10.1186/s12906-022-03515-2, PMID:35065636.
[102] Shah S, Rath H, Sharma G, Senapati SN, Mishra E. Effectiveness of curcumin mouthwash on radiation-induced oral mucositis among head and neck cancer patients: A triple-blind, pilot randomised controlled trial. Indian J Dent Res 2020;31(5):718-727. doi:10.4103/ijdr. IJDR_822_18, PMID:33433509.
[103] Uchio R, Kawasaki K, Okuda-Hanafusa C, Saji R, Muroyama K, Murosaki S , et al. Curcuma longa extract improves serum inflammatory markers and mental health in healthy participants who are overweight: a randomized, double-blind, placebo-controlled trial. Nutr J
[104] Radunz CL, Okuyama CE, Branco-Barreiro FCA, Pereira RMS, Diniz SN. Clinical randomized trial study of hearing aids effectiveness in association with Ginkgo biloba extract (EGb 761) on tinnitus improvement. Braz J Otorhinolaryngol 2020;86(6):734-742. doi:10.1016/j. bjorl.2019.05.003, PMID:31300303.
[105] Nazarinasab M, Behrouzian F, Negahban S, Sadegh AM, Zeynali E. Investigating the efficacy of Ginkgo biloba on the cognitive function of patients undergoing treatment with electric shock: a double-blind clinical trial. J Med Life 2022;15(12):1540-1547. doi:10.25122/jml-2021-0262, PMID:36762332.
[106] Sha RN, Tang L, Du YW, Wu SX, Shi HW, Zou HX, et al. Effectiveness and safety of Ginkgo biloba extract (GBE50) in the treatment of dizziness caused by cerebral arteriosclerosis: a multi-center, doubleblind, randomized controlled trial. J Tradit Chin Med 2022;42(1):8389. doi:10.19852/j.cnki.jtcm.20211214.001, PMID:35294126.
[107] Pingali U, Nutalapati C, Koilagundla N, Taduri G. A randomized, dou-ble-blind, positive-controlled, prospective, dose-response clinical study to evaluate the efficacy and tolerability of an aqueous extract of Terminalia bellerica in lowering uric acid and creatinine levels in chronic kidney disease subjects with hyperuricemia. BMC Complement Med Ther 2020;20(1):281. doi:10.1186/s12906-020-03071-7, PMID:32933504.
[108] Pingali U, Sukumaran D, Nutalapati C. Effect of an aqueous extract of Terminalia chebula on endothelial dysfunction, systemic inflammation, and lipid profile in type 2 diabetes mellitus: A randomized double-blind, placebo-controlled clinical study. Phytother Res 2020;34(12):3226-3235. doi:10.1002/ptr.6771, PMID:32618037.
[109] Zadhoush R, Alavi-Naeini A, Feizi A, Naghshineh E, Ghazvini MR. The effect of garlic (Allium sativum) supplementation on the lipid parameters and blood pressure levels in women with polycystic ovary syndrome: A randomized controlled trial. Phytother Res 2021;35(11):6335-6342. doi:10.1002/ptr.7282, PMID:34496450.
[110] Alhashim M, Lombardo J. Effect of Topical Garlic on Wound Healing and Scarring: A Clinical Trial. Dermatol Surg 2020;46(5):618-627. doi:10.1097/DSS. 0000000000002123 , PMID:31490311.
[111] Choudhary PR, Jani RD, Sharma MS. Effect of Raw Crushed Garlic (Allium sativum L.) on Components of Metabolic Syndrome. J Diet Suppl 2018;15(4):499-506. doi:10.1080/19390211.2017.1358233, PMID:28956671.
[112] Xu C, Mathews AE, Rodrigues C, Eudy BJ, Rowe CA, O’Donoughue A, et al. Aged garlic extract supplementation modifies inflammation and immunity of adults with obesity: A randomized, double-blind, placebo-controlled clinical trial. Clin Nutr ESPEN 2018;24:148-155. doi:10.1016/j.clnesp.2017.11.010, PMID:29576354.
[113] Ried K, Frank OR, Stocks NP. Aged garlic extract reduces blood pressure in hypertensives: a dose-response trial. Eur J Clin Nutr 2013;67(1):64-70. doi:10.1038/ejcn.2012.178, PMID:23169470.
[114] Kim HG, Cho JH, Yoo SR, Lee JS, Han JM, Lee NH, et al. Antifatigue effects of Panax ginseng C.A. Meyer: a randomised, double-blind, placebo-controlled trial. PLoS One 2013;8(4):e61271. doi:10.1371/ journal.pone.0061271, PMID:23613825.
[115] Jovanovski E, Lea-Duvnjak-Smircic, Komishon A, Au-Yeung F, Zurbau A, Jenkins AL, et al. Vascular effects of combined enriched Korean Red ginseng (Panax Ginseng) and American ginseng (Panax Quinquefolius) administration in individuals with hypertension and type 2 diabetes: A randomized controlled trial. Complement Ther Med 2020;49:102338. doi:10.1016/j.ctim.2020.102338, PMID:32147072.
[116] Lin CH, Lin YA, Chen SL, Hsu MC, Hsu CC. American Ginseng Attenuates Eccentric Exercise-Induced Muscle Damage via the Modulation of Lipid Peroxidation and Inflammatory Adaptation in Males. Nutrients 2021;14(1):78. doi:10.3390/nu14010078, PMID:35010953.
[117] Ghorbani Z, Mirghafourvand M, Farshbaf Khalili A, Javadzadeh Y, Shakouri SK, Dastranj Tabrizi A. The Effect of Panax ginseng on Genitourinary Syndrome in Postmenopausal Women: A Randomized, Double-Blind, Placebo-Controlled Clinical Trial. Complement Med Res 2021;28(5):419-426. doi:10.1159/000514944, PMID:33730722.
[118] Jung JH, Kang TK, Oh JH, Jeong JU, Ko KP, Kim ST. The Effect of Korean Red Ginseng on Symptoms and Inflammation in Patients With Allergic Rhinitis. Ear Nose Throat J 2021;100(suppl 5):712S-719S. doi:10.1177/0145561320907172, PMID:32070136.
[119] Guiné RP, Gonçalves FJ. Bioactive Compounds in Some Culinary Aromatic Herbs and Their Effects on Human Health. Mini Rev Med Chem 2016;16(11):855-866. doi:10.2174/1389557516666160211120540, PMID:26864553.
[120] Stéphane FF, Jules BK, Batiha GE, Ali I, Bruno LN. El-Shemy HA. Extraction of bioactive compounds from medicinal plants and herbs. Natural Medicinal Plants 2021;RijekaIntechOpen1-39. doi:10.5772/ intechopen. 98602.
[121] Yan Y, Liu N, Hou N, Dong L, Li J. Chlorogenic acid inhibits hepatocellular carcinoma in vitro and in vivo. J Nutr Biochem 2017;46:68-73. doi:10.1016/j.jnutbio.2017.04.007, PMID:28458139.
[122] Sultana S, Munir N, Mahmood Z, Riaz M, Akram M, Rebezov M, et al. Molecular targets for the management of cancer using Curcuma longa Linn. phytoconstituents: A Review. Biomed Pharmacother 2021;135:111078. doi:10.1016/j.biopha.2020.111078, PMID:33433 356.
[123] Zhang F, Thakur K, Hu F, Zhang JG, Wei ZJ. 10-Gingerol, a Phytochemical Derivative from “Tongling White Ginger”, Inhibits Cervical Cancer: Insights into the Molecular Mechanism and Inhibitory Targets. J Agric Food Chem 2017;65(10):2089-2099. doi:10.1021/acs. jafc.7b00095, PMID:28230361.
[124] Pal HC, Sharma S, Strickland LR, Agarwal J, Athar M, Elmets CA, et al. Delphinidin reduces cell proliferation and induces apoptosis of non-small-cell lung cancer cells by targeting EGFR/VEGFR2 signaling pathways. PLoS One 2013;8(10):e77270. doi:10.1371/journal. pone.0077270, PMID:24124611.
[125] Wang X, Zhang ZF, Zheng GH, Wang AM, Sun CH, Qin SP, et al. The Inhibitory Effects of Purple Sweet Potato Color on Hepatic Inflammation Is Associated with Restoration of NAD
[126] Zapf MA, Kothari AN, Weber CE, Arffa ML, Wai PY, Driver J, et al. Green tea component epigallocatechin-3-gallate decreases expression of osteopontin via a decrease in mRNA half-life in cell lines of metastatic hepatocellular carcinoma. Surgery 2015;158(4):10391047. doi:10.1016/j.surg.2015.06.011, PMID:26189955.
[127] Sur S, Pal D, Roy R, Barua A, Roy A, Saha P, et al. Tea polyphenols EGCG and TF restrict tongue and liver carcinogenesis simultaneously induced by N-nitrosodiethylamine in mice. Toxicol Appl Pharmacol 2016;300:34-46. doi:10.1016/j.taap.2016.03.016, PMID:27058323.
[128] Shimizu M, Shirakami Y, Sakai H, Tatebe H, Nakagawa T, Hara Y, et al. EGCG inhibits activation of the insulin-like growth factor (IGF)/ IGF-1 receptor axis in human hepatocellular carcinoma cells. Cancer Lett 2008;262(1):10-18. doi:10.1016/j.canlet.2007.11.026, PMID: 18164805.
[129] Banjerdpongchai R, Wudtiwai B, Khaw-On P, Rachakhom W, Duangnil N, Kongtawelert P. Hesperidin from Citrus seed induces human hepatocellular carcinoma HepG2 cell apoptosis via both mitochondrial and death receptor pathways. Tumour Biol 2016;37(1):227237. doi:10.1007/s13277-015-3774-7, PMID:26194866.
[130] Zhang J, Song J, Wu D, Wang J, Dong W. Hesperetin induces the apoptosis of hepatocellular carcinoma cells via mitochondrial pathway mediated by the increased intracellular reactive oxygen species, ATP and calcium. Med Oncol 2015;32(4):101. doi:10.1007/s12032-015-0516-z, PMID:25737432.
[131] Yen HR, Liu CJ, Yeh CC. Naringenin suppresses TPA-induced tumor invasion by suppressing multiple signal transduction pathways in human hepatocellular carcinoma cells. Chem Biol Interact 2015;235:19. doi:10.1016/j.cbi.2015.04.003, PMID:25866363.
[132] Akram M, Riaz M, Wadood AWC, Hazrat A, Mukhtiar M, Ahmad Zakki S, et al. Medicinal plants with anti-mutagenic potential. Biotechnol Biotechnol Equip 34(1):309-318. doi:10.1080/13102818.2020.1749 527.
[133] García ER, Gutierrez EA, de Melo FCSA, Novaes RD, Gonçalves RV. Flavonoids Effects on Hepatocellular Carcinoma in Murine Models: A Systematic Review. Evid Based Complement Alternat Med 2018;2018:6328970. doi:10.1155/2018/6328970, PMID:29681978.
[134] Iyer SC, Gopal A, Halagowder D. Myricetin induces apoptosis by inhibiting P21 activated kinase 1 (PAK1) signaling cascade in hepatocellular carcinoma. Mol Cell Biochem 2015;407(1-2):223-237.
doi:10.1007/s11010-015-2471-6, PMID:26104578.
[135] Kim SJ, Jeong CW, Bae HB, Kwak SH, Son JK, Seo CS, et al. Protective effect of sauchinone against regional myocardial ischemia/ reperfusion injury: inhibition of p38 MAPK and JNK death signaling pathways. J Korean Med Sci 2012;27(5):572-575. doi:10.3346/ jkms.2012.27.5.572, PMID:22563228.
[136]Zuo YH, Liu YB, Cheng CS, Yang YP, Xie Y, Luo P, et al. Isovaleroylbinankadsurin A ameliorates cardiac ischemia/reperfusion injury through activating GR dependent RISK signaling. Pharmacol Res 2020;158:104897. doi:10.1016/j.phrs.2020.104897, PMID:32422343.
[137] Zhang H, Sun Q, Xu T, Hong L, Fu R, Wu J, et al. Resveratrol attenuates the progress of liver fibrosis via the Akt/nuclear factor-kB pathways. Mol Med Rep 2016;13(1):224-230. doi:10.3892/mmr.2015.4497, PMID:26530037.
[138] Li J, Liu P, Zhang R, Cao L, Qian H, Liao J, et al. Icaritin induces cell death in activated hepatic stellate cells through mitochondrial activated apoptosis and ameliorates the development of liver fibrosis in rats. J Ethnopharmacol 2011;137(1):714-723. doi:10.1016/j. jep.2011.06.030, PMID:21726622.
[139] Ling Y, Chen G, Deng Y, Tang H, Ling L, Zhou X, et al. Polydatin posttreatment alleviates myocardial ischaemia/reperfusion injury by promoting autophagic flux. Clin Sci (Lond) 2016;130(18):1641-1653. doi:10.1042/CS20160082, PMID:27340138.
[140] Mioc M, Milan A, Malița D, Mioc A, Prodea A, Racoviceanu R, et al. Recent Advances Regarding the Molecular Mechanisms of Triterpenic Acids: A Review (Part I). Int J Mol Sci 2022;23(14):7740. doi:10.3390/ijms23147740, PMID:35887090.
[141] Yi C, Song M, Sun L, Si L, Yu D, Li B, et al. Asiatic Acid Alleviates Myocardial Ischemia-Reperfusion Injury by Inhibiting the ROS-Mediated Mitochondria-Dependent Apoptosis Pathway. Oxid Med Cell Longev 2022;2022:3267450. doi:10.1155/2022/3267450, PMID:35198095.
[142] Wang F, Gao Q, Yang J, Wang C, Cao J, Sun J, et al. Artemisinin suppresses myocardial ischemia-reperfusion injury via NLRP3 inflammasome mechanism. Mol Cell Biochem 2020;474(1-2):171-180. doi:10.1007/s11010-020-03842-3, PMID:32729005.
[143] Chang L, Shi R, Wang X, Bao Y. Gypenoside A protects ischemia/ reperfusion injuries by suppressing miR-143-3p level via the activation of AMPK/Foxo1 pathway. Biofactors 2020;46(3):432-440. doi:10.1002/biof.1601, PMID:31889343.
[144] Wang Y, Che J, Zhao H, Tang J, Shi G. Platycodin D inhibits oxidative stress and apoptosis in H9c2 cardiomyocytes following hypoxia/reoxygenation injury. Biochem Biophys Res Commun 2018;503(4):32193224. doi:10.1016/j.bbrc.2018.08.129, PMID:30146261.
[145] Omata M, Matsui N, Inomata N, Ohno T. Protective effects of polysaccharide fucoidin on myocardial ischemia-reperfusion injury in rats. J Cardiovasc Pharmacol 1997;30(6):717-724. doi:10.1097/00005344-199712000-00003, PMID:9436808.
[146] Przybylska S, Tokarczyk G. Lycopene in the Prevention of Cardiovascular Diseases. Int J Mol Sci 2022;23(4):1957. doi:10.3390/ ijms23041957, PMID:35216071.
[147] Wang XY, Dong WP, Bi SH, Pan ZG, Yu H, Wang XW, et al. Protective effects of osthole against myocardial ischemia/reperfusion injury in rats. Int J Mol Med 2013;32(2):365-372. doi:10.3892/ ijmm.2013.1386, PMID:23695269.
- Keywords: Herbal medicine; Safety; Efficacy; Bioactivity; Natural remedies; Traditional medicine; Botanical supplements.
Abbreviations: ACE, angiotensin-converting enzyme; Akt, protein kinase B; BP, blood pressure; CNS, central nervous system; CYP, cytochrome P450; ED, effective dose for of the population; ERK, extracellular-signal regulated kinase; FAERS, FDA’s Adverse Event Reporting System; FDA, The Food and Drug Administration; GACP, Guidelines on Good Agricultural and Collection Practices; HDIs, herb-drug interactions; IL, interleukin; JNK, c-Jun N-terminal kinase; MMP, matrix metalloproteinase; NFkB, nuclear factor kappa B; PI3K, phosphoinositide 3-kinase; ROS, reactive oxygen species; TCM, traditional Chinese medicine; TD , median toxic dose of a drug at which toxicity occurs in of cases.
*Correspondence to: Nidhi Sharma, Patanjali Herbal Research Department, Patanjali Research Foundation, Maharishi Dayanand Gram, Delhi-Haridwar National Highway, Near Bahadrabad, Haridwar 249405, India. ORCID: https://orcid.org/0000-0001-6123-5194. Tel: +91-9999880322, E-mail: nidhi.sharma@prft.co.in
How to cite this article: Balkrishna A, Sharma N, Srivastava D, Kukreti A, Srivastava S, Arya V. Exploring the Safety, Efficacy, and Bioactivity of Herbal Medicines: Bridging Traditional Wisdom and Modern Science in Healthcare. Future Integr Med 2024;3(1):35-49. doi: 10.14218/FIM.2023.00086.
