DOI: https://doi.org/10.1208/s12249-024-02749-2
PMID: https://pubmed.ncbi.nlm.nih.gov/38355916
تاريخ النشر: 2024-02-14
البثق بالحرارة المنصهرة: من النظرية إلى التطبيق في صياغة الأدوية – أين نحن الآن؟
© المؤلفون 2024
الملخص
البثق بالحرارة (HME) هو تقنية معترف بها عالميًا، قوية وفعالة تعزز التوافر البيولوجي للمكونات الفعالة الصيدلانية ذات الذوبانية الضعيفة وتقدم عملية تصنيع مستمرة فعالة. يوفر البثق المزدوج اللولب (TSE) خلاطًا قابلًا للتخصيص بشكل كبير يُستخدم في التركيب المستمر والتكوير باستخدام تركيبات مختلفة من عناصر النقل، وعناصر العجن (التكوين الأمامي والعكسي)، وعناصر الخلط التوزيعي. وبالتالي، يتم استخدام TSE بكفاءة في التكوير الجاف أو الرطب أو المنصهر ليس فقط لتصنيع أشكال الجرعات مثل الأقراص، والكبسولات، أو الأكياس المملوءة بالحبوب، ولكن أيضًا لتصميم تركيبات جديدة مثل أجهزة استنشاق المساحيق الجافة، وحدات التجفيف للحبيبات، النانو-بثق، الطباعة ثلاثية الأبعاد، التكوين، والتشتت الصلب غير المتبلور. على مدى العقود الماضية، أدت التعاونات بين الأكاديميين وصناعة الأدوية إلى دفع الابتكارات الجديدة لتقنية HME، مما أدى إلى زيادة كبيرة في المقالات المنشورة وبراءات الاختراع. تلخص هذه المقالة التحديات والنماذج لتنفيذ توسيع نطاق HME. بالإضافة إلى ذلك، تغطي فوائد التصنيع المستمر، واعتبارات تكنولوجيا التحليل العملياتي (PAT)، والمتطلبات التنظيمية. باختصار، تستند هذه المراجعة المصممة جيدًا إلى منشورنا السابق، وتستكشف بعمق إمكانيات البثق المزدوج اللولب (TSE) لتطبيقات جديدة متنوعة.
المقدمة
إلى التطبيق في صياغة الأدوية في AAPS PharmSciTech، 2016″ [6].
الأدوات المستخدمة لإعداد المراجعة
التطبيقات الصيدلانية لآلات البثق المزدوج اللولب
TSE كخلاط للمساحيق الجافة للاستنشاق
تميل المساحيق إلى الالتصاق معًا في كتل، ويكون من الضروري وجود وقت خلط محدد لتفكيكها من أجل تحقيق أفضل النتائج. تسلط هذه المعلومات الضوء على أهمية فهم خصائص أنواع المساحيق المختلفة وتكييف عملية الخلط وفقًا لذلك.

المخارج المزدوجة اللولبية كأجهزة تجفيف
رطوبة
النانوإكستروشن
تم الاحتفاظ به في
Granulation بمسمارين مزدوجين
العوامل المؤثرة على خصائص الحبيبات
| التطبيقات | HME | TSMG | TSDG | TSWG |
| عملية مستمرة | نعم | نعم | نعم | نعم |
| كفاءة خلط عالية | نعم | نعم | نعم | نعم |
| تعزيز الذوبانية | نعم | نعم | لا | لا |
| تغطية الطعم | نعم | نعم | نعم | نعم |
| تركيبة جرعة ثابتة | نعم | نعم | نعم | نعم |
| تركيبة مثبطة للإساءة | نعم | نعم | لا | لا |
| استقرار واجهة برمجة التطبيقات | نعم | نعم | لا | لا |
| تحسين قابلية معالجة واجهة برمجة التطبيقات | نعم | نعم | نعم | نعم |
| مادة فعالة حساسة للرطوبة | نعم | نعم | نعم | لا |
| مادة فعالة حساسة للحرارة | لا | لا | نعم | نعم |
| إصدار معدل | نعم | نعم | نعم | نعم |

نظام الرباط، الذي يكون عادةً إما قائمًا على الدهون أو قائمًا على البوليمر، يحدد خصائص الحبيبات النهائية. يعتمد اختيار نظام الرباط على عوامل مثل توافق الدواء مع الرباط، ونقطة الانصهار، واللزوجة، وخصائص الإفراج المرغوبة [24]. الرباطات ذات Tg منخفضة ولزوجة منخفضة مناسبة للتحبيبات الجافة والرطبة، على التوالي. بالنسبة لـ TSMG، من المرغوب أن يكون هناك نقطة انصهار منخفضة، وحجم جزيئات صغير، ورباط ذو لزوجة منخفضة لتحقيق حبيبات جيدة مع نسبة أقل من الغرامات. وذلك بسبب آلية توزيع الرباط داخل الطارد. تشمل الرباطات المستخدمة بشكل شائع هيدروكسي بروبيل
درجة الحرارة تلعب درجة الحرارة دورًا حيويًا في عملية التحبيب بالانصهار. تؤثر على الانصهار، والخلط، والتصلب للدواء والبوليمر. من الضروري التأكد من أن درجة حرارة المعالجة لا تتجاوز درجة حرارة تحلل الدواء عند استخدام التحبيب بالانصهار، خاصةً عندما تكون Tg البوليمر أكبر من درجة حرارة تحلل الدواء. في مثل هذه الحالات، يمكن أن يساعد استخدام بوليمر ذو Tg أقل أو دمج مُلدن في تقليل درجة حرارة المعالجة. ومع ذلك، يمكن إجراء البثق في TSDG تحت درجة حرارة الانتقال الزجاجي أو نقطة انصهار مكونات التركيبة للحفاظ على حالة جافة، حيث تدعم العملية الطاقة الحرارية و
أو كجم/ساعة)، وتصميم فوهة الرش، وكفاءة توزيع الرباط، وعملية التجفيف [36].
تمتلك TSG إمكانات كبيرة كتصنيع مستمر وتكنولوجيا خضراء في صناعة الأدوية. ومع ذلك، لا تزال هناك بعض الفجوات والتحديات التي تواجهها في تجاريتها. قد تختلف هذه الفجوات بناءً على التطبيق المحدد ومتطلبات الصناعة. على الرغم من التقدم في TSG، لا يزال هناك حاجة لفهم أعمق لآليات العملية الأساسية وتأثير المتغيرات العملية على خصائص الحبيبات. يعد تطوير نماذج قوية واستراتيجيات تحكم لـ TSG أمرًا حاسمًا لضمان جودة المنتج وأدائه المتسق. هناك حاجة إلى مزيد من البحث لتأسيس علاقات أداء العملية، وتحسين معلمات العملية، وتمكين المراقبة والتحكم في الوقت الحقيقي لعملية TSG. فيما يلي بعض الفجوات الشائعة في تجارية TSG، بما في ذلك فهم العملية والتحكم، والاعتبارات التنظيمية، واعتبارات التوسع والتصنيع (حجم دفعة أصغر مقارنة بالطرق التقليدية)، وتوافر المعدات وتكلفتها، وتعقيد التركيبة، والتدريب التعليمي [25].
نتائج متسقة وقابلة للتكرار على النطاق التجاري. نظرًا لأن TSG هي تقنية جديدة نسبيًا، هناك حاجة إلى برامج تعليمية وتدريبية لتعزيز المعرفة والمهارات لدى علماء الأدوية وموظفي التصنيع. سيساعد التدريب الكافي على مبادئ TSG، وتحسين العمليات، وحل المشكلات في سد الفجوة المعرفية وتعزيز الاعتماد الأوسع لـ TSG في الصناعة. يتطلب معالجة هذه الفجوات جهودًا تعاونية بين الأوساط الأكاديمية والصناعة والهيئات التنظيمية. ستساهم الأبحاث الإضافية، والتقدم التكنولوجي، ونشر المعرفة في تسويق TSG من خلال معالجة التحديات وتقديم حلول شاملة للتنفيذ الناجح على نطاق أوسع.
البثق بالحرارة وطباعه النماذج المدمجة ثلاثية الأبعاد لأشكال الجرعات الصيدلانية
عادةً ما يُفضل أن تكون درجة حرارة الانتقال الزجاجي (Tg) أعلى من نقطة الانصهار (Tm) للدواء لتجنب التحلل الحراري للدواء أثناء المعالجة. بعض من أكثر البوليمرات الحرارية البلاستيكية المستخدمة في صناعة الخيوط لطباعة FDM هي Eudragits، بولي فينيل بيروليدون (PVP)، HPC، بولي إيثيلين جلايكول (PEG)، إلخ.
المجمعات الدوائية / التشتتات الصلبة من خلال البثق بالحرارة
معقدات السيكلودكسترين
تمت دراسة أساليب مثل إضافة المذيب إلى HME لتشكيل المركب (البثق السائل الساخن (HLE)) أو إضافة بوليمر. في HLE، يساعد السائل في تشكيل مركب بين المادة الفعالة وCD. قد يكون المبدأ وراء هذه التقنية مشابهًا لتقنية العجن، حيث يتم خلط المزيج الفيزيائي بشكل مكثف بمساعدة السائل. ومع ذلك، فإن شدة وملاءمة وتجانس الخلط في HLE تفوق بكثير تقنية العجن، مما يؤدي إلى كفاءة أكبر في التكوين بين جزيئات المضيف والضيف. تم استخدام هذه التقنية من قبل مان ورفاقه لتشكيل مركبات كاربامازيبين-CD، وقد درسوا تأثير المذيب (الماء والعازل المائي)، وسرعة اللولب، ودرجة الحرارة، ونسبة المولارية للتكوين بين المتفاعلين. أنظمة المذيبات التي حافظت على المادة الفعالة في حالة غير مؤينة (عالية الكارهية للماء) أدت إلى كفاءات تكوين عالية مما أدى إلى تحسين أفضل للذوبان. تأثير درجة الحرارة على التكوين ضئيل لأن التفاعل بين جزيئات المضيف والضيف يتضمن استبدال جزيئات الماء من تجويف المضيف بجزيئات الضيف. ومع ذلك، كانت كفاءة التكوين عند درجة حرارة قريبة من درجة حرارة الغرفة أعلى من تلك عند درجات حرارة مرتفعة. سرعة اللولب تتناسب عكسيًا مع زمن الإقامة؛ لذلك، يجب اختيار السرعة المثلى من خلال القضاء المحتمل على سرعات اللولب الضارة، التي تختلف اعتمادًا على نظام المذيب ودرجة الحرارة وطبيعة المادة الفعالة وCD المختارين.
| شكل الجرعة | نموذج طابعة ثلاثية الأبعاد | دواء | بوليمر/حامل/مُلدن | معلمات الطباعة | غرض | مرجع | ||||
| شكل جرعة فموية سريعة الذوبان | إيجلد | – | بي في إيه، مالتيتول، تي إي سي | سرعة الطباعة:
|
شكل جرعة يذوب بسرعة | [95] | ||||
| شكل جرعة فموية ذات نواة وقشرة | ألتيمكر 3 | ثيوفيلين | HPMC 35 (ذوبان بطيء، نواة القرص)، PEO15-P (ذوبان سريع، غلاف القرص) |
|
ديناميكية الإفراز المزدوج | [96] | ||||
| زرع | غاونوو-أ001 | إيبوبروفين | بي سي إل، كيتوزان | سرعة الطباعة:
|
إطلاق دواء مخصص ومراقب | [97] | ||||
| حلقة مهبلية | ألتيمكر 3 | كلوتريمازول | البولي يوريثين الحراري القابل للتشكيل (TPU) |
|
توصيل الدواء المستمر | [98] | ||||
| زرعة عينية | بروسا آي 3 | هيدروكلوريد سيبروفلوكساسين | HPC، PEO، PEG 4000، سوربيتول | درجة حرارة الطباعة:
|
توصيل الأدوية العينية لفترة طويلة | [99] | ||||
| فيلم باكالي | بروسا آي 3 | حمض الأدبيك وزيليتول | PEO 200 ك | درجة حرارة الفوهة:
|
توصيل فموي لاصق للمخاط | [100] |
معقدات المخدرات والراتنج
للمادة المنصهرة أثناء البثق، مما يسهل انتشار الأيونات وتشكيل المعقدات. أظهر سرعة اللولب تأثيرًا محدودًا على صياغة DRC، مما استلزم تحسينًا لضمان عملية بثق سلسة دون عوائق. كانت ألفة الدواء للراتنج عاملًا حاسمًا في اختيار الراتنج واحتاجت إلى فحص. في هذه الدراسة، أظهر IRP88 أداءً متفوقًا على IRP64 في تشكيل DRCs من هيدروكلوريد الكينين، حيث فشل IRP64 في تقليل شدة القمم عند
التشتتات الصلبة
التشتتات الصلبة غير المتبلورة
تؤدي درجة الحرارة، جنبًا إلى جنب مع الخلط العنيف داخل البرميل، إلى ذوبان الدواء أو تقليل حجم الجسيمات للدواء وتسمح له بالامتزاج أو الذوبان داخل البوليمر المنصهر، مما يحسن من تجانس المحتوى واستقرار الطبيعة غير المتبلورة للدواء [59]. لذلك، فإن الاختيار المناسب لحوامل البوليمر هو أمر بالغ الأهمية في تطوير ASD الناجح، حيث تمثل حوالي 50 إلى
التشتتات الصلبة البلورية
في دراسة أجراها براساد وآخرون، تم تطوير CSDs من حمض الميفيناميك. حيث كانت درجات الحرارة المستخدمة أقل من Tm للدواء، وتم استخدام مادة مضافة لتقليل درجات حرارة المعالجة في HME. تشير نتائج DSC وXRD إلى الحفاظ على الطبيعة البلورية لـ API بعد البثق، خاصة عندما كان تحميل الدواء أعلى من
الكريستالات المشتركة
وتغطية الطعم المر لمواد الأدوية دون التأثير بشكل كبير على نشاطها الصيدلاني. الكريستالات المشتركة هي أنظمة متعددة المكونات حيث يتم ربط المادة الفعالة (API) والمساعد المساعد/مادة فعالة أخرى بنسبة ستوكيومترية محددة عبر إما روابط هيدروجينية أو قوى فان دير فالس، أو
التكوين
نقاء
حجم الجسيمات وتوزيعها
الخصائص الحرارية
معلمات عملية HME
تحديات وتفكير ونماذج توسيع نطاق HME
أحجام معدات HME/TSE وتحديات التوسع
نحتاج إلى مزيد من الإنتاجية. لتحقيق مقاييس أكبر، يجب زيادة حجم المعدات لتلبية الطلب التجاري. يمكن أن يكون توسيع عملية التصنيع تحديًا. إن زيادة الإنتاجية أو معدل التغذية ببساطة يمكن أن تؤثر على جودة المنتج. تغيير سرعة اللولب أو معدل التغذية يمكن أن يسبب تحميلًا زائدًا على الآلة ويؤثر على جودة المنتج. وبالمثل، فإن زيادة حجم الأسطوانة دون تعديل معدل التغذية يمكن أن تؤثر على جودة المنتج. في التصنيع المستمر، فإن الانتقال من المختبر إلى مستوى الإنتاج معقد بسبب عدة عمليات وحدات مجمعة ضمن جهاز واحد.
| براغي مزدوجة من ليستريتز | |||||||
| نوع | قطر البراغي (مم) | عزم براغي (نيوتن متر) | أقصى سرعة لبرغي (دورة في الدقيقة) | قدرة المحرك (كيلووات) | متوسط الإنتاج* كجم/ساعة | ||
| نانو 16 | 16 | 42 | ٥٠٠ | ٢.٢٤ | 0.02-0.1 | ||
| ZSE 12 HP-PH | 12 | 20 | 1000 | 2 | 0.05-1 | ||
| ZSE 18 HP-PH | ١٨ | 71 | ١٢٠٠ | 9.4 | 0.2-5 | ||
| ZSE 27 HP-PH | 27 | ٢٦٨ | ٥٠٠ و ١٢٠٠ | 15 | 1-25 | ||
| ZSE 40 HP-PH | 40 | ٨٣٠ | ٤٠٠ | 37 | حتى 100 | ||
| ZSE 50 HP-PH | 50 | 1570 | ٤٠٠ | 70 | حتى 200 | ||
| المخارج المزدوجة اللولبية من ثيرمو فيشر | |||||||
| نوع | قطر البراغي (مم) | أقصى سرعة لبرغي (دورة في الدقيقة) | متوسط الإنتاج* كجم/ساعة | ||||
| هاكي
|
مخروطي | ٣٦٠ | 0.01 إلى 0.1 | ||||
| فارما ميني HME | مخروطي | ٣٦٠ | 0.01 إلى 0.1 | ||||
| هاكي
|
مخروطي | ٣٦٠ | 0.01 إلى 0.1 | ||||
| فارما 11 | 11 | 1000 | 0.01 إلى 2.5 | ||||
| العملية 11 | 11 | 1000 | 0.01 إلى 2.5 | ||||
| يورو لاب XL | 16 | 500 (1000) | 0.2 إلى 10 | ||||
| هاكي
|
16 | ١١٠٠ | 0.2 إلى 10 | ||||
| هاكي
|
٢٤ | ١١٠٠ (٥٦٠) | 0.5 إلى 50 | ||||
| هاكي
|
مخروطي | ٢٥٠ | 0.2 إلى 5 | ||||
| تي إس إي 24 إم سي | ٢٤ | ٥٠٠ (١٠٠٠) | 0.5 إلى 50 | ||||
| فارما 16 | 16 | 1000 | 0.2 إلى 5 | ||||
| فارما 24 | ٢٤ | 1000 | 0.5 إلى 20 | ||||
نماذج وصيغ التوسع في HME
- عملية البثق الذاتي المولد المشتقة من القانون التكعيبي: بناءً على هذه الاعتبارات، يمكن توسيع عمليات البثق الذاتي المولد باستخدام المعادلة (1)، في حالة أن
يتم توفير طاقة كافية من خلال التشتت اللزج مع عدم وجود فقدان أو اكتساب للحرارة من البيئة المحيطة. ستتغير النتيجة حسب نسبة القطر إلى القوة الثالثة.) للآلات الطاردة مع تشابه هندسي والعمليات التي تعمل بنفس سرعة الدوران. وبالمثل، قانون مربع ( يمكن أيضًا اقتراح ذلك بناءً على انتقال الحرارة عند النظر في نجاح عملية التوسع. ومع ذلك، يمكن أن ينحرف التوازن بناءً على التشابه الهندسي ودرجة حرارة الانصهار لأنها قد لا تكون ثابتة طوال عملية التوسع. - زيادة الحجم الحجمي: في التصنيع المستمر (CM) للمنتجات الصيدلانية باستخدام عمليات HME، يتم تطبيقها للحفاظ على نفس درجة التعبئة ونفس زمن الإقامة (RTD). بالنسبة للآلات الطاردة المماثلة هندسياً ذات الأقطار المختلفة، يتم تقييم معدل التغذية النهائي في آلة الطرد المزدوجة باستخدام المعادلة (2). في ظروف مبسطة، إذا تم إجراء زيادة الحجم الحجمي باستخدام آلات طرد هندسية مماثلة (على سبيل المثال،
أو المكبس اللولبي المزدوج من ثيرمو فيشر، ألمانيا) وسرعة اللولب تُحافظ على ثباتها، من المتوقع أن يتبع معدل الإنتاج في العملية القانون التكعيبي. - معدل نقل الحرارة: يمكن تقييم توسيع عملية تصنيع الأدوية باستخدام عمليات HME من خلال تحسين نقل الحرارة في الأسطوانة، حيث سيكون توسيع التصنيع معتمدًا بالكامل على نقل الحرارة. في هذه الطريقة، يتم اعتبار المساحة السطحية لنقل الحرارة معادلة لمساحة سطح الأسطوانة.
| نموذج | صيغة | وصف المعلمات |
| نموذج العملية الأديباتية (المعادلة 1) |
|
معادلة التوسع للحصول على التشابه الحراري، حيث Q هو الإنتاج عند النطاق المستهدف،
|
| زيادة الحجم الحجمي (المعادلة 2) |
|
أين
|
| معدل انتقال الحرارة (المعادلة 3) |
|
أين
|
| الطاقة المحددة (المعادلة 4) | الطاقة المحددة
|
حيث Emax و Nmax و
|
| استهلاك الطاقة الميكانيكية المحددة (المعادلة 5) | SMEC
|
أين
|
| معدل القص (المعادلة 6) | معدل القص
|
حيث D هو قطر اللولب، n هو سرعة اللولب بالدورات في الدقيقة، و h هو ارتفاع الطيران |
| إجهاد القص (المعادلة 7) | إجهاد القص –
|
حيث Ec هو لزوجة المادة |
| توزيع زمن الإقامة (المعادلة 8) |
|
حيث RT هو زمن الإقامة (ثانية)، SV هو الحجم النوعي، SG هو الوزن النوعي للمادة، النسبة المئوية للتعبئة بالكسور و Q هو معدل التدفق (كجم/ساعة) |
- يعتبر العزم المحدد والطاقة المحددة (SE) المدخلة من المعلمات الحرجة في إنتاج التركيبات عالية الطاقة، بما في ذلك الأنظمة غير المتبلورة. لذلك، يعتمد النجاح في توسيع عملية CM عبر HME بشكل كبير على المستوى الثابت المستمر من مدخلات SE. بشكل عام، يتم حساب وتحديد مدخلات الطاقة الميكانيكية في عملية HME خلال تحسين طرق التوسع باستخدام المعادلة (4).
- تُقاس الطاقة الميكانيكية المحددة (SME) إجمالي الطاقة الميكانيكية (كشكل من أشكال الحرارة) المدخلة في المنتج أثناء الخلط عالي القص. تمثل استهلاك الطاقة الميكانيكية المحددة (SMEC) الطاقة الداخلة إلى نظام البثق لكل وحدة كتلة من خلال التبدد اللزج. كما هو موضح في المعادلة (5)، يعتمد SMEC على العزم، دوران اللولب، ومعدل التغذية أو الإنتاجية، ويتم قياسه في
. - معدل القص: في نظام TSE، تؤدي قوى القص إلى الخلط، وبالتالي، يحدد معدل القص تدرج السرعة بين سطحين يتحركان بسرعات مختلفة. في TSE النموذجي، يتم حساب معدل القص كدالة لقطر اللولب الخارجي، وفجوة الطيران، وسرعة اللولب، كما هو موضح في المعادلة (6).
- يشار إلى إجهاد القص على أنه مقدار الإجهاد المطبق داخل الأسطوانة الذي تتعرض له المواد الناقلة، ويعبر عنه بالمعادلة (7) كدالة لمعدل القص واللزوجة. تلعب درجات حرارة الأسطوانة دورًا رئيسيًا في التحكم في لزوجة المصهور داخل الأسطوانة. تؤثر اللزوجة المنخفضة أو العالية على الخلط-
جودة الخلط (على سبيل المثال، اللزوجة العالية تسهل الخلط التشتتي). - توزيع زمن الإقامة يعتمد بشكل كبير على درجة ملء اللولب. يتم استخدام المعادلة (8) لتحديد زمن الإقامة.
عملية التصنيع المستمرة لـ HME
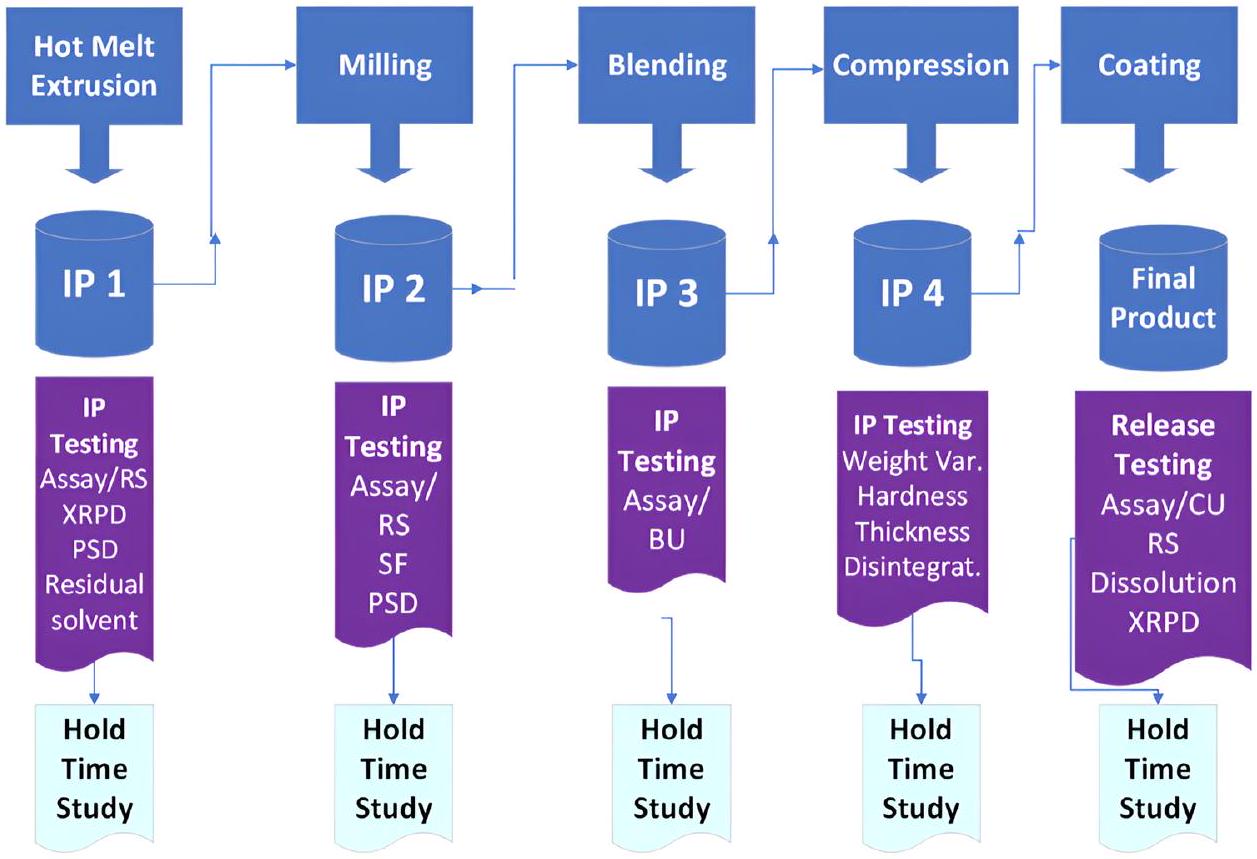
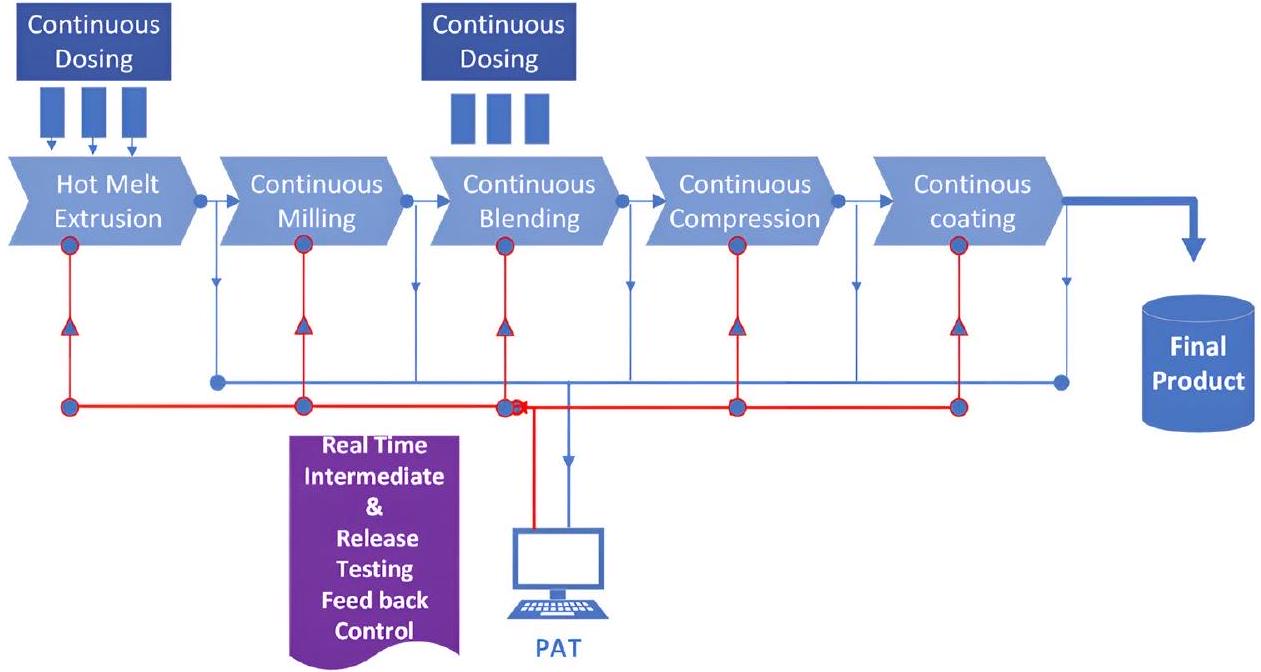
يتم نقلها إلى وحدة التشغيل التالية لمزيد من المعالجة. يمكن أن يختلف وقت الانتظار للوسطاء اعتمادًا على الحجم، مما يتطلب دراسات لوقت الانتظار. عادةً ما تتكرر هذه الخطوات عبر عدة وحدات تشغيل، على سبيل المثال، الخلط، والبثق بالحرارة، والطحن، والضغط، والتغطية (الشكل 7). من ناحية أخرى، يمكن دمج نفس وحدات التشغيل عبر التصنيع المستمر (CM). في هذه العملية، يتم نقل المادة تلقائيًا، ومراقبتها، والتحكم فيها بشكل متواصل على طول مسار التصنيع. يتم شحن المادة الأولية باستمرار إلى وحدة العملية الأولى في بداية الخط، بينما يتم تفريغ المنتج النهائي في نهاية وحدة العملية. يمكن دمج البثق المزدوج اللولب مع وحدات تصنيع الأقراص في الأسفل بشكل مستمر لإعداد عملية تصنيع شكل جرعة صلبة فموية مستمرة حقيقية (الشكل 8). يمكن لتقنية التحليل العملية (PAT) أن تؤسس استراتيجية تحكم (تغذية راجعة أو تغذية أمامية). في مثل هذه العملية المستمرة، يستغرق صنع المنتج النهائي وقتًا أقل دون الحاجة إلى اختبارات وسيطة ودراسات لوقت الانتظار [84].
اعتبارات PAT
نوع حساسات PAT
منتجات الأدوية المعتمدة المصنعة بواسطة CM
تمت الموافقة على المنتجات الدوائية التي يتم تصنيعها بواسطة عملية مستمرة [89]. العديد من منتجات التصنيع المستمر في مرحلة التطوير، ومن المتوقع أن يتم الموافقة على المزيد منها في السنوات القليلة القادمة.
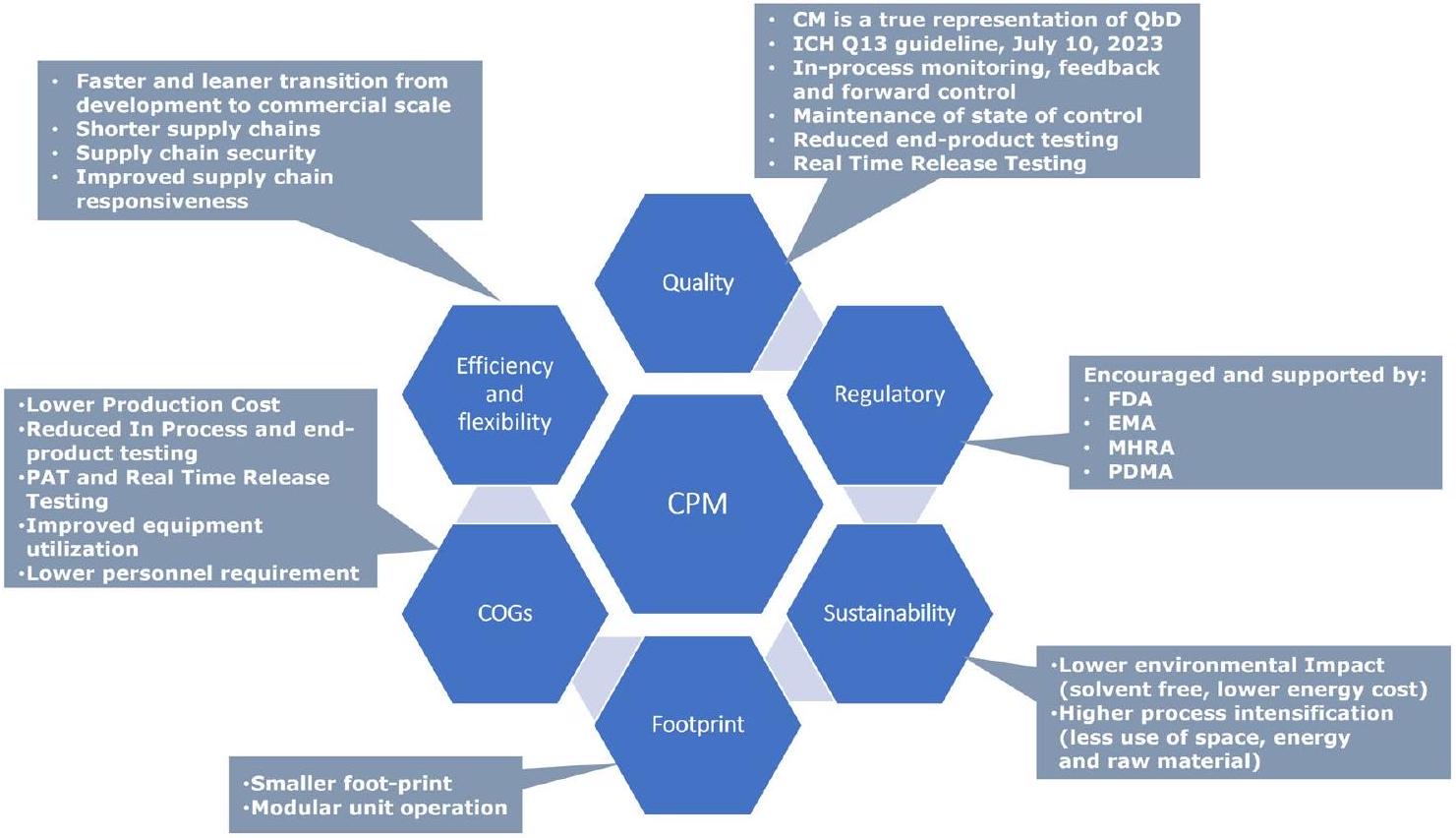
مزايا التصنيع المستمر في صناعة الأدوية
| منتج دوائي | إشارة | شركة | سنة الموافقة الأولى | الهيئة التنظيمية |
| أوركامبي
|
التليف الكيسي | رأس | 2015 | إدارة الغذاء والدواء، الوكالة الأوروبية للأدوية |
| بريزستا® | فيروس نقص المناعة البشرية | ج&ج | 2016 | إدارة الغذاء والدواء، الوكالة الأوروبية للأدوية |
| فيريزينو
|
سرطان الثدي | إيلي ليلي | 2017 | إدارة الغذاء والدواء الأمريكية، الوكالة الأوروبية للأدوية، وكالة المنتجات الطبية والأجهزة الطبية اليابانية |
| داوريسمو
|
لوكيميا النخاع | فايزر | 2018 | إدارة الغذاء والدواء |
| لوبريانا
|
سرطان الرئة | فايزر | 2018 | إدارة الغذاء والدواء |
| سيمديكو®/سيمكيفي
|
التليف الكيسي | رأس | 2018 | إدارة الغذاء والدواء، الوكالة الأوروبية للأدوية |
| تراماسيت
|
ألم | ج&ج | 2017 | PDMA |
| تريكاfta®/كافتريو® | التليف الكيسي | رأس | 2019 | إدارة الغذاء والدواء |
| دوفرق
|
فقر الدم الكلوي | جي إس كي | ٢٠٢٠ | إدارة الغذاء والدواء، وكالة المنتجات الطبية والتكنولوجيا |
| زوفلوزا® | إنفلونزا | جينينتيك إنك | ٢٠٢١ | إدارة الغذاء والدواء، الوكالة الأوروبية للأدوية، وكالة المنتجات الطبية والتكنولوجيا الطبية |
| تازفيرك® | لمفوما جريبية | إبيزيم إنك | ٢٠٢٠ | إدارة الغذاء والدواء، وكالة المنتجات الطبية والتجهيزات |
| سيبينقو
|
التهاب الجلد التأتبي | فايزر | 2022 | إدارة الغذاء والدواء |
تحديات التصنيع المستمر للأشكال الصلبة الفموية
تكلفة الفعالية، التي تفوق التحديات المعنية. ومع ذلك، من الضروري التعاون مع أصحاب المصلحة في الصناعة، وإجراء أبحاث وتطوير مستمرة، والالتزام بتنفيذ أفضل الممارسات للتغلب على هذه التحديات بفعالية.
الاعتبارات التنظيمية
المنتجات المروجة
| اسم تجاري | المصنع | سنة الموافقة | حالة التسويق | شكل الجرعة | واجهة برمجة التطبيقات | مصفوفة البوليمر | المؤشرات العلاجية |
| برافطوفي
|
مصفوفة | 2018 | وصفة طبية | كبسولة؛ عن طريق الفم | إنكورافينيب | PVP/VA64 | الميلانوما النقيلي |
| أنوفيرا
|
ثيرابيوتيكس إم دي إنك | 2018 | وصفة طبية | حلقة؛ مهبلية | إيثينيل ستراديول | الإيلاستومرات السيليكونية | وسيلة منع الحمل |
| لينبارزا
|
أسترازينيكا | 2017 | وصفة طبية | قرص؛ عن طريق الفم | أولاباريب | كوبوفيدون | سرطان المبيض |
| مافيريت
|
أبفي | 2017 | يتيم | قرص؛ عن طريق الفم | جليكابريفير؛ بيبرنتاسفير | كوبوفيدون، سكسينات بولي إيثيلين جلايكول فيتامين E | التهاب الكبد الوبائي C |
| فينكلكتا
|
أبفي | 2016 | يتيم | قرص؛ عن طريق الفم | فينيتوكلوكس | كوبوفيدون | سرطان الدم اللمفاوي المزمن |
| فيكيرا إكس آر® | أبفي | 2016 | وصفة طبية | قرص؛ إطلاق ممتد | أومبيتاسفير، باريتابريفير، ريتونافير، داسابوفير | كوبوفيدون | التهاب الكبد الوبائي سي |
| تكنيفي
|
أبفي | 2015 | مُتَوَقَّف | قرص؛ عن طريق الفم | أومبيتاسفير، باريتابريفير، ريتونافير | كوبوفيدون، فيتامين E بولي إيثيلين جلايكول سوكسينات | التهاب الكبد الوبائي C |
| فيكيرا باك® | أبفي | 2014 | مُتَوَقَّف | قرص؛ عن طريق الفم | أومبيتاسفير، باريتابريفير، ريتونافير، داسابوفير | كوبوفيدون | التهاب الكبد الوبائي C |
| بيلسومرا
|
ميرك | 2014 | وصفة طبية | قرص؛ عن طريق الفم | سوفوركسنت | كوبوفيدون | الأرق |
| نوكسافيل
|
ميرك | 2013 | وصفة طبية | قرص؛ إطلاق مؤجل | بوساكونازول | HPMCAS، PVA | العدوى الفطرية |
| نيوسينتا® | كوليجيم للأدوية | 2011 | وصفة طبية | قرص؛ إطلاق ممتد | هيدروكلوريد تابينتادول | بوفيدون | ألم حاد |
| أوبانا ER® | أندو للأدوية | 2011 | مُتَوَقَّف | قرص؛ إطلاق ممتد | هيدروكلوريد الأوكسي مورفون | HPMC | ألم شديد |
| نورفير
|
أبفي | 2010 | وصفة طبية | قرص؛ عن طريق الفم | ريتونافير | كوبوفيدون | HIV-1 |
| أونميل® | سيبيلا أيرلندا | 2010 | مُتَوَقَّف | قرص؛ عن طريق الفم | إيتراكونازول | HPMC | فطار الأظافر |
| فينوجلايد
|
ساليكس للأدوية | 2007 | وصفة طبية | قرص؛ عن طريق الفم | فينوفيبرات | PEG 6000 | خلل شحميات الدم |
| بالادون
|
شركة بوردو فارما | ٢٠٠٤ | مُتَوَقَّف | كبسولة؛ إطلاق ممتد | هيدروكودون هيدروكلوريد | مركب كوباوليمر ميثاكريلات الأمين | الألم في المرضى المتسامحين مع الأفيونات |
| كاليترا
|
أبفي | ٢٠٠٠ | وصفة طبية | قرص؛ عن طريق الفم | لوبينافير، ريتونافير | كوبوفيدون | عدوى فيروس نقص المناعة البشرية 1 |
| ريزولين
|
فايزر | 1997 | مُتَوَقَّف | قرص؛ عن طريق الفم | تروغليتازون | HPMC، PEG 400، بوفيدون | داء السكري من النوع 2 |
| كوفيرا-إتش إس® | فايزر | 1996 | مُتَوَقَّف | قرص؛ إطلاق ممتد | هيدروكلوريد فيراباميل | HPMC، PEG | ارتفاع ضغط الدم والذبحة الصدرية |
| عدالة CC® | نورويتش للأدوية | 1993 | مُتَوَقَّف | قرص؛ إطلاق ممتد | نيفيديبين | كروس بوفيدون | ارتفاع ضغط الدم |
| سيزاميت
|
باوش | 1985 | وصفة طبية | كبسولة؛ عن طريق الفم | نابيلون | بوفيدون | التقيؤ |
| لاكرسيرت
|
باوش | 1982 | وصفة طبية | إدراج؛ عيني | – | HPC | متلازمات جفاف العين |
الخاتمة
الإعلانات
الوصول المفتوح: هذه المقالة مرخصة بموجب رخصة المشاع الإبداعي للاستخدام والمشاركة والتكيف والتوزيع وإعادة الإنتاج في أي وسيلة أو صيغة، طالما أنك تعطي الائتمان المناسب للمؤلفين الأصليين والمصدر، وتوفر رابطًا لرخصة المشاع الإبداعي، وتوضح ما إذا كانت هناك تغييرات قد تم إجراؤها. الصور أو المواد الأخرى من طرف ثالث في هذه المقالة مشمولة في رخصة المشاع الإبداعي للمقالة، ما لم يُشار إلى خلاف ذلك في سطر الائتمان للمادة. إذا لم تكن المادة مشمولة في رخصة المشاع الإبداعي للمقالة واستخدامك المقصود غير مسموح به بموجب اللوائح القانونية أو يتجاوز الاستخدام المسموح به، ستحتاج إلى الحصول على إذن مباشرة من صاحب حقوق الطبع والنشر. لعرض نسخة من هذه الرخصة، قم بزيارة http://creativecommons.org/licenses/by/4.0/.
References
- Koutsamanis I, Roblegg E, Spoerk M. Controlled delivery via hot-melt extrusion: a focus on non-biodegradable carriers for non-oral applications. Journal of Drug Delivery Science and Technology. 2023;81:104289.
- Crowley MM, Zhang F, Repka MA, Thumma S, Upadhye SB, Battu SK, et al. Pharmaceutical applications of hot-melt extrusion: part I. Drug Dev Ind Pharm. 2007;33:909-26.
- Repka MA, Battu SK, Upadhye SB, Thumma S, Crowley MM, Zhang F, et al. Pharmaceutical applications of hot-melt extrusion: Part II. Drug Dev Ind Pharm. 2007;33:1043-57.
- Kallakunta VR, Sarabu S, Bandari S, Tiwari R, Patil H, Repka MA. An update on the contribution of hot-melt extrusion
technology to novel drug delivery in the twenty-first century: part I. Expert Opin Drug Deliv. 2019;16:539-50. - Sarabu S, Bandari S, Kallakunta VR, Tiwari R, Patil H, Repka MA. An update on the contribution of hot-melt extrusion technology to novel drug delivery in the twenty-first century: part II. Expert Opin Drug Deliv. 2019;16:567-82.
- Patil H, Tiwari RV, Repka MA. Hot-melt extrusion: from theory to application in pharmaceutical formulation. AAPS PharmSciTech. 2016;17:20-42.
- Smyth HDC, Hickey AJ. Carriers in drug powder delivery. Am J Drug Deliv. 2005;3:117-32.
- Spahn JE, Hefnawy A, Smyth HDC, Zhang F. Development of a novel method for the continuous blending of carrier-based dry powders for inhalation using a co-rotating twin-screw extruder. Int J Pharm. 2022;623:121914.
- Ren A, Koleng JJ, Costello M, Spahn JE, Smyth HDC, Zhang F. Twin-screw continuous mixing can produce dry powder inhalation mixtures for pulmonary delivery. J Pharm Sci. 2023;112:272-81.
- Ren A, Spahn JE, Smyth HDC, Zhang F. Twin-screw continuous mixing: Effect of mixing elements and processing parameters on properties of aerosol powders. Powder Technol. 2023;424:118519.
- Martin C. Twin screw extruders as continuous mixers for thermal processing: a technical and historical perspective. AAPS PharmSciTech. 2016;17:3-19.
- Pilcer G, Wauthoz N, Amighi K. Lactose characteristics and the generation of the aerosol. Adv Drug Deliv Rev. 2012;64:233-56.
- Schmidt A, de Waard H, Moll K-P, Kleinebudde P, Krumme M. Simplified end-to-end continuous manufacturing by feeding API suspensions in twin-screw wet granulation. Eur J Pharm Biopharm. 2018;133:224-31.
- Hare C, Ghadiri M, Dennehy R. Prediction of attrition in agitated particle beds. Chem Eng Sci. 2011;66:4757-70.
- Meena AK, Desai D, Serajuddin ATM. Development and optimization of a wet granulation process at elevated temperature for a poorly compactible drug using twin screw extruder for continuous manufacturing. J Pharm Sci. 2017;106:589-600.
- Schmidt A, de Waard H, Kleinebudde P, Krumme M. Continuous single-step wet granulation with integrated in-barrel-drying. Pharm Res. 2018;35:167.
- Kreimer M, Aigner I, Lepek D, Khinast J. Continuous drying of pharmaceutical powders using a twin-screw extruder. Org process Res Dev. 2018;22:813-23.
- Haser A, Kittikunakorn N, Dippold E, DiNunzio JC, Blincoe W. Continuous twin-screw wet granulation process with in-barrel drying and NIR setup for real-time moisture monitoring. Int J Pharm. 2023;630: 122377.
19 Li M, Ioannidis N, Gogos C, Bilgili E. A comparative assessment of nanocomposites vs. amorphous solid dispersions prepared via nanoextrusion for drug dissolution enhancement. Eur J Pharm Biopharm. 2017;119:68-80. - Khinast J, Baumgartner R, Roblegg E. Nano-extrusion: a onestep process for manufacturing of solid nanoparticle formulations directly from the liquid phase. AAPS PharmSciTech. 2013;14:601-4.
- Ye X, Patil H, Feng X, Tiwari RV, Lu J, Gryczke A, et al. Conjugation of hot-melt extrusion with high-pressure homogenization: a novel method of continuously preparing nanocrystal solid dispersions. AAPS PharmSciTech. 2016;17:78-88.
- Baumgartner R, Eitzlmayr A, Matsko N, Tetyczka C, Khinast J, Roblegg E. Nano-extrusion: a promising tool for continuous manufacturing of solid nano-formulations. Int J Pharm. 2014;477:1-11.
- Li M, Furey C, Skros J, Xu O, Rahman M, Azad M, et al. Impact of matrix surface area on Griseofulvin release from extrudates prepared via nanoextrusion. Pharmaceutics. 2021;13:1036.
- Nyavanandi D, Mandati P, Narala S, Alzahrani A, Kolimi P, Vemula SK, et al. Twin screw melt granulation: a single step approach for developing self-emulsifying drug delivery system for lipophilic drugs. Pharmaceutics. 2023;15:2267.
- Bandari S, Nyavanandi D, Kallakunta VR, Janga KY, Sarabu S, Butreddy A, et al. Continuous twin screw granulation-an advanced alternative granulation technology for use in the pharmaceutical industry. Int J Pharm. 2020;580: 119215.
- Vercruysse J, Burggraeve A, Fonteyne M, Cappuyns P, Delaet U, Van Assche I, et al. Impact of screw configuration on the particle size distribution of granules produced by twin screw granulation. Int J Pharm. 2015;479:171-80.
- Forster SP, Dippold E, Chiang T. Twin-screw melt granulation for oral solid pharmaceutical products. Pharmaceutics. 2021;13:665.
- Portier C, Vervaet C, Vanhoorne V. Continuous twin screw granulation: a review of recent Progress and opportunities in formulation and equipment design. Pharmaceutics. 2021;13:668.
- Zhao Y, Xie X, Zhao Y, Gao Y, Cai C, Zhang Q, et al. Effect of plasticizers on manufacturing ritonavir/copovidone solid dispersions via hot-melt extrusion: Preformulation, physicochemical characterization, and pharmacokinetics in rats. Eur J Pharm Sci. 2019;127:60-70.
- Ghosh I, Vippagunta R, Li S, Vippagunta S. Key considerations for optimization of formulation and melt-extrusion process parameters for developing thermosensitive compound. Pharm Dev Technol. 2012;17:502-10.
- Van Melkebeke B, Vermeulen B, Vervaet C, Remon JP. Melt granulation using a twin-screw extruder: A case study. Int J Pharm. 2006;326:89-93.
- Srinivasan P, Almutairi M, Youssef AAA, Almotairy A, Bandari S, Repka MA. Numerical simulation of five different screw configurations used during the preparation of hot-melt extruded Kollidon® and Soluplus® based amorphous solid dispersions containing indomethacin. Journal of Drug Delivery Science and Technology. 2023;85: 104561.
- Kumar A, Vercruysse J, Toiviainen M, Panouillot P-E, Juuti M, Vanhoorne V, et al. Mixing and transport during pharmaceutical twin-screw wet granulation: experimental analysis via chemical imaging. Eur J Pharm Biopharm. 2014;87:279-89.
- Nandi U, Trivedi V, Ross SA, Douroumis D. Advances in twinscrew granulation processing Pharmaceutics. 2021;13:624.
- Kallakunta VR, Tiwari R, Sarabu S, Bandari S, Repka MA. Effect of formulation and process variables on lipid based sustained release tablets via continuous twin screw granulation: a comparative study. Eur J Pharm Sci. 2018;121:126-38.
- Seem TC, Rowson NA, Ingram A, Huang Z, Yu S, de Matas M, et al. Twin screw granulation-a literature review. Powder Technol. 2015;276:89-102.
- Jakob B, Geilen T. Relevant process parameters for twin-screw compounding. 2018. https://www.thermofisher.com/document-connect/document-connect.html?url=https
Fassets. thermofisher.com%2FTFS-Assets%2FCAD%2FApplication-Notes%2FLR70-relevant-process-parameters-twin-screw-compo unding.pdf&title=UmVsZXZhbnQgUHJvY2VzcyBQYXJhbW V0ZXJzIGZvciBUd2luIFNjcmV3IENvbXBvdW5kaW5n. - Wang H, Vemula SK, Bandari S, Repka MA. Preparation of coreshell controlled release tablets using direct powder extrusion 3D printing techniques. Journal of Drug Delivery Science and Technology. 2023;88: 104896.
- Okafor-Muo OL, Hassanin H, Kayyali R, ElShaer A. 3D printing of solid oral dosage forms: numerous challenges with unique opportunities. J Pharm Sci. 2020;109:3535-50.
- Wang J, Zhang Y, Aghda NH, Pillai AR, Thakkar R, Nokhodchi A, et al. Emerging 3D printing technologies for drug delivery devices: current status and future perspective. Adv Drug Deliv Rev. 2021;174:294-316.
41 Solanki NG, Gumaste SG, Shah AV, Serajuddin ATM. Effects of surfactants on Itraconazole-Hydroxypropyl Methylcellulose Acetate Succinate solid dispersion prepared by hot melt extrusion. II: rheological analysis and extrudability testing. Journal of Pharmaceutical Sciences. 2019;108:3063-73. - Alhijjaj M, Nasereddin J, Belton P, Qi S. Impact of processing parameters on the quality of pharmaceutical solid dosage forms produced by fused deposition modeling (FDM). Pharmaceutics. 2019;11:633.
- Bandari S, Nyavanandi D, Dumpa N, Repka MA. Coupling hot melt extrusion and fused deposition modeling: Critical properties for successful performance. Adv Drug Deliv Rev. 2021;172:52-63.
- Lakkala P, Munnangi SR, Bandari S, Repka M. Additive manufacturing technologies with emphasis on stereolithography 3D printing in pharmaceutical and medical applications: A review. International Journal of Pharmaceutics: X. 2023;5: 100159.
- Ding B, Yu Y, Geng S, Liu B, Hao Y, Liang G. Computational methods for the interaction between Cyclodextrins and natural compounds: technology, benefits, limitations, and trends. J Agric Food Chem. 2022;70:2466-82.
- Manne ASN, Hegde AR, Raut SY, Rao RR, Kulkarni VI, Mutalik S. Hot liquid extrusion assisted drug-cyclodextrin complexation: a novel continuous manufacturing method for solubility and bioavailability enhancement of drugs. Drug Deliv and Transl Res. 2021;11:1273-87.
- Donthi MR, Munnangi SR, Krishna KV, Marathe SA, Saha RN, Singhvi G, et al. Formulating ternary inclusion complex of sorafenib Tosylate using
-Cyclodextrin and hydrophilic polymers: physicochemical characterization and in vitro assessment. AAPS PharmSciTech. 2022;23:254. - Munnangi SR, Youssef AAA, Narala N, Lakkala P, Vemula SK, Alluri R, et al. Continuous manufacturing of solvent-free cyclodextrin inclusion complexes for enhanced drug solubility via hot-melt extrusion: a quality by design approach. Pharmaceutics. 2023;15:2203.
- Thiry J, Krier F, Ratwatte S, Thomassin J-M, Jerome C, Evrard B. Hot-melt extrusion as a continuous manufacturing process to form ternary cyclodextrin inclusion complexes. Eur J Pharm Sci. 2017;96:590-7.
- Malaquias LFB, Sá-Barreto LCL, Freire DO, Silva ICR, Karan K, Durig T, et al. Taste masking and rheology improvement of drug complexed with beta-cyclodextrin and hydroxypropyl-
-cyclodextrin by hot-melt extrusion. Carbohyd Polym. 2018;185:19-26. - Granados PA, Pinho LAG, Sa-Barreto LL, Gratieri T, Gelfuso GM, Cunha-Filho M. Application of hot-melt extrusion in the complexation of naringenin with cyclodextrin using hydrophilic polymers. Adv Powder Technol. 2022;33: 103380.
- Zhang T-Y, Du R-F, Wang Y-J, Hu J-L, Wu F, Feng Y. Research progress of preparation technology of ion-exchange resin complexes. AAPS PharmSciTech. 2022;23:105.
- Munnangi SR, Youssef AAA, Narala N, Lakkala P, Narala S, Vemula SK, et al. Drug complexes: perspective from Academic Research and Pharmaceutical Market. Pharm Res. 2023;40:1519-40.
- Tan DCT, Ong JJ, Gokhale R, Heng PWS. Hot melt extrusion of ion-exchange resin for taste masking. Int J Pharm. 2018;547:385-94.
- Ghebre-Sellassie I, Terefe H, inventors; ExxPharma Therapeutics LLC, assignee. Tamper-resistant pharmaceutical dosage forms. United States patent US 9,770,514. 2017.
- Wang X, Zhang L, Ma D, Tang X, Zhang Y, Yin T, et al. Characterizing and exploring the differences in dissolution and stability between crystalline solid dispersion and amorphous solid dispersion. AAPS PharmSciTech. 2020;21:262.
- Agrawal AM, Dudhedia MS, Zimny E. Hot melt extrusion: development of an amorphous solid dispersion for an insoluble drug from mini-scale to clinical scale. AAPS PharmSciTech. 2016;17:133-47.
- Darji M, Pradhan A, Vemula SK, Kolter K, Langley N, Repka MA. Development of delayed-release pellets of Ibuprofen using Kollicoat® MAE 100P via hot-melt extrusion technology. J Pharm Innov. 2023;18:1827-37.
- Agrawal A, Dudhedia M, Deng W, Shepard K, Zhong L, Povilaitis E, et al. Development of tablet formulation of amorphous solid dispersions prepared by hot melt extrusion using quality by design approach. AAPS PharmSciTech. 2016;17:214-32.
- Iyer R, Petrovska Jovanovska V, Berginc K, Jaklič M, Fabiani F, Harlacher C, et al. Amorphous solid dispersions (ASDs): the influence of material properties, manufacturing processes and analytical technologies in drug product development. Pharmaceutics. 2021;13:1682.
- Auch C, Harms M, Mäder K. How changes in molecular weight and PDI of a polymer in amorphous solid dispersions impact dissolution performance. Int J Pharm. 2019;556:372-82.
- Mohapatra S, Samanta S, Kothari K, Mistry P, Suryanarayanan R. Effect of polymer molecular weight on the crystallization behavior of indomethacin amorphous solid dispersions. Cryst Growth Des. 2017;17:3142-50.
- Kyeremateng SO, Voges K, Dohrn S, Sobich E, Lander U, Weber S, et al. A hot-melt extrusion risk assessment classification system for amorphous solid dispersion formulation development. Pharmaceutics. 2022;14:1044.
- Prasad E, Robertson J, Halbert GW. Mefenamic acid solid dispersions: impact of formulation composition on processing parameters, product properties and performance. Int J Pharm. 2022;616: 121505.
- Pawar JN, Fule RA, Maniruzzaman M, Amin PD. Solid crystal suspension of Efavirenz using hot melt extrusion: exploring the role of crystalline polyols in improving solubility and dissolution rate. Mater Sci Eng, C. 2017;78:1023-34.
- Reitz E, Vervaet C, Neubert RHH, Thommes M. Solid crystal suspensions containing griseofulvin – Preparation and bioavailability testing. Eur J Pharm Biopharm. 2013;83:193-202.
- Zaworotko MJ. Molecules to crystals, crystals to molecules … and back again? Cryst Growth Des. 2007;7:4-9.
- Yarava JR, Potnuru LR, Pahari B, Tothadi S, Ramanathan KV. Supramolecular synthon identification in azelaic acid-isonicotinamide. Journal of Magnetic Resonance Open. 2022;10-11: 100056.
- Guo M, Sun X, Chen J, Cai T. Pharmaceutical cocrystals: a review of preparations, physicochemical properties and applications. Acta Pharmaceutica Sinica B. 2021;11:2537-64.
- Panzade PS, Shendarkar GR, Kulkarni DA. Hot melt extrusion: an emerging green technique for the synthesis of high-quality pharmaceutical cocrystals. J Pharm Innov. 2022;17:283-93.
- Narala S, Nyavanandi D, Srinivasan P, Mandati P, Bandari S, Repka MA. Pharmaceutical co-crystals, salts, and co-amorphous systems: a novel opportunity of hot-melt extrusion. Journal of Drug Delivery Science and Technology. 2021;61: 102209.
- Narala S, Nyavanandi D, Alzahrani A, Bandari S, Zhang F, Repka MA. Creation of hydrochlorothiazide pharmaceutical cocrystals via hot-melt extrusion for enhanced solubility and permeability. AAPS PharmSciTech. 2022;23:1-11.
- Thakkar R, Thakkar R, Pillai A, Ashour EA, Repka MA. Systematic screening of pharmaceutical polymers for hot melt extrusion processing: a comprehensive review. Int J Pharm. 2020;576: 118989.
- Mandati P, Nyavanandi D, Narala S, Alzahrani A, Vemula SK, Repka MA. A comparative assessment of cocrystal and amorphous solid dispersion printlets developed by hot melt extrusion paired fused deposition modeling for dissolution enhancement and stability of Ibuprofen. AAPS PharmSciTech. 2023;24:203.
- Chabalenge B, Korde S, Kelly AL, Neagu D, Paradkar A. Understanding matrix-assisted continuous co-crystallization using a data mining approach in quality by design (QbD). Cryst Growth Des. 2020;20:4540-9.
- Shaikh R, Walker GM, Croker DM. Continuous, simultaneous cocrystallization and formulation of Theophylline and 4-Aminobenzoic acid pharmaceutical cocrystals using twin screw melt granulation. Eur J Pharm Sci. 2019;137: 104981.
- Soliman II, Kandil SM, Abdou EM. Gabapentin-saccharin cocrystals with enhanced physicochemical properties and in vivo absorption formulated as oro-dispersible tablets. Pharm Dev Technol. 2020;25:227-36.
- Gajda M, Nartowski KP, Pluta J, Karolewicz B. Continuous, onestep synthesis of pharmaceutical cocrystals via hot melt extrusion from neat to matrix-assisted processing-State of the art. Int J Pharm. 2019;558:426-40.
- Maniruzzaman M, Nokhodchi A. Continuous manufacturing via hot-melt extrusion and scale up: regulatory matters. Drug Discovery Today. 2017;22:340-51.
- Zecevic DE, Evans RC, Paulsen K, Wagner KG. From benchtop to pilot scale-experimental study and computational assessment of a hot-melt extrusion scale-up of a solid dispersion of dipyridamole and copovidone. Int J Pharm. 2018;537:132-9.
- Matić J, Witschnigg A, Zagler M, Eder S, Khinast J. A novel in silico scale-up approach for hot melt extrusion processes. Chem Eng Sci. 2019;204:257-69.
- Wesholowski J, Hoppe K, Nickel K, Muehlenfeld C, Thommes M. Scale-up of pharmaceutical hot-melt-extrusion: process optimization and transfer. Eur J Pharm Biopharm. 2019;142:396-404.
- Roggo Y, Pauli V, Jelsch M, Pellegatti L, Elbaz F, Ensslin S, et al. Continuous manufacturing process monitoring of pharmaceutical solid dosage form: A case study. J Pharm Biomed Anal. 2020;179: 112971.
- Khinast J, Bresciani M. Continuous manufacturing: definitions and engineering principles. In: Kleinebudde P, Khinast J, Rantanen J, Eds. John Wiley & Sons, Ltd; 2017. p. 1-31.
- Panikar S, Li J, Rane V, Gillam S, Callegari G, Kurtyka B, et al. Integrating sensors for monitoring blend content in a pharmaceutical continuous manufacturing plant. Int J Pharm. 2021;606: 120085.
- Liu P, Jin H, Chen Y, Wang D, Yan H, Wu M, et al. Process analytical technologies and self-optimization algorithms in automated pharmaceutical continuous manufacturing. Chin Chem Lett. 2024;35:108877.
- Kurouski D, Dazzi A, Zenobi R, Centrone A. Infrared and Raman chemical imaging and spectroscopy at the nanoscale. Chem Soc Rev. 2020;49:3315-47.
- Laske S, Paudel A, Scheibelhofer O, Sacher S, Hörmann T, Khinast J. A review of PAT strategies in secondary solid oral dosage manufacturing of small molecules. J Pharm Sci. 2017;106:667-712.
- Wahlich J. Review: continuous manufacturing of small molecule solid oral dosage forms. Pharmaceutics. 2021;13:1311.
- Su Q, Ganesh S, Moreno M, Bommireddy Y, Gonzalez M, Reklaitis GV, et al. A perspective on Quality-by-Control (QbC) in pharmaceutical continuous manufacturing. Comput Chem Eng. 2019;125:216-31.
- Rossi CV. A comparative investment analysis of batch versus continuous pharmaceutical manufacturing technologies. J Pharm Innov. 2022;17:1373-91.
- Emerging Technology Program. U.S. Food and Drug Administration. 2023. https://www.fda.gov/about-fda/center-drug-evalu ation-and-research-cder/emerging-technology-program.
- Fisher AC, Liu W, Schick A, Ramanadham M, Chatterjee S, Brykman R, et al. An audit of pharmaceutical continuous manufacturing regulatory submissions and outcomes in the US. Int J Pharm. 2022;622: 121778.
- Guideline IC. Q13 on Continuous Manufacturing of Drug Substances and Drug Products. European Medicine Agency. 2023. https://www.ema.europa.eu/en/ich-guideline-q13-continuous-manufacturing-drug-substances-and-drug-products-scientificguideline.
- Ikeda S, Kobayashi M, Aoki S, Terukina T, Kanazawa T, Kojima H, et al. 3D-printed fast-dissolving oral dosage forms via fused deposition modeling based on sugar alcohol and poly(vinyl alco-hol)-preparation, drug release studies and in vivo oral absorption. Pharmaceutics. 2023;15:395.
- Tidau M, Finke JH. Modified release kinetics in dual filament 3D printed individualized oral dosage forms. Eur J Pharm Sci. 2022;175: 106221.
- Yang Y, Wu H, Fu Q, Xie X, Song Y, Xu M, et al. 3D-printed polycaprolactone-chitosan based drug delivery implants for personalized administration. Mater Des. 2022;214: 110394.
- Tiboni M, Campana R, Frangipani E, Casettari L. 3D printed clotrimazole intravaginal ring for the treatment of recurrent vaginal candidiasis. Int J Pharm. 2021;596: 120290.
- Alzahrani A, Youssef AAA, Nyavanandi D, Tripathi S, Bandari S, Majumdar S, et al. Design and optimization of ciprofloxacin hydrochloride biodegradable 3D printed ocular inserts: Full factorial design and in-vitro and ex-vivo evaluations: Part II. Int J Pharm. 2023;631: 122533.
- Elkanayati RM, Chambliss WG, Omari S, Almutairi M, Repka MA, Ashour EA. Mucoadhesive buccal films for treatment of xerostomia prepared by coupling HME and 3D printing technologies. Journal of Drug Delivery Science and Technology. 2022;75: 103660.
- Michael A. Repka
marepka@olemiss.edu
1 Department of Product Development, Catalent Pharma Solutions, 14 Schoolhouse Road, Somerset, New Jersey 08873, USA
Department of Pharmaceutics and Drug Delivery, School of Pharmacy, The University of Mississippi, University, Oxford, Mississippi 38677, USA
3 Department of Pharmaceutics, School of Pharmaceutical Sciences, Lovely Professional University, Phagwara, Punjab 144001, India
4 Molecular Pharmaceutics and Drug Delivery Division, College of Pharmacy, The University of Texas at Austin, 2409 University Avenue, Austin, Texas 78712, USA5 Pii Center for Pharmaceutical Technology, The University of Mississippi, University, Oxford, Mississippi 38677, USA
atos
DOI: https://doi.org/10.1208/s12249-024-02749-2
PMID: https://pubmed.ncbi.nlm.nih.gov/38355916
Publication Date: 2024-02-14
Hot-Melt Extrusion: from Theory to Application in Pharmaceutical Formulation-Where Are We Now?
© The Author(s) 2024
Abstract
Hot-melt extrusion (HME) is a globally recognized, robust, effective technology that enhances the bioavailability of poorly soluble active pharmaceutical ingredients and offers an efficient continuous manufacturing process. The twin-screw extruder (TSE) offers an extremely resourceful customizable mixer that is used for continuous compounding and granulation by using different combinations of conveying elements, kneading elements (forward and reverse configuration), and distributive mixing elements. TSE is thus efficiently utilized for dry, wet, or melt granulation not only to manufacture dosage forms such as tablets, capsules, or granule-filled sachets, but also for designing novel formulations such as dry powder inhalers, drying units for granules, nanoextrusion, 3D printing, complexation, and amorphous solid dispersions. Over the past decades, combined academic and pharmaceutical industry collaborations have driven novel innovations for HME technology, which has resulted in a substantial increase in published articles and patents. This article summarizes the challenges and models for executing HME scale-up. Additionally, it covers the benefits of continuous manufacturing, process analytical technology (PAT) considerations, and regulatory requirements. In summary, this well-designed review builds upon our earlier publication, probing deeper into the potential of twin-screw extruders (TSE) for various new applications.
Introduction
to Application in Pharmaceutical Formulation in AAPS PharmSciTech, 2016″ [6].
Tools Used to Prepare the Review
Pharmaceutical Applications of Twin-Screw Extruders
TSE as a Mixer for Dry Powders for Inhalation

powders tends to stick together in clumps, and a specific mixing time is necessary to break them apart for optimal results [12]. This information highlights the importance of understanding the properties of different types of powders and tailoring the mixing process accordingly.

Twin Screw Extruders as Drying Equipment
moisture of

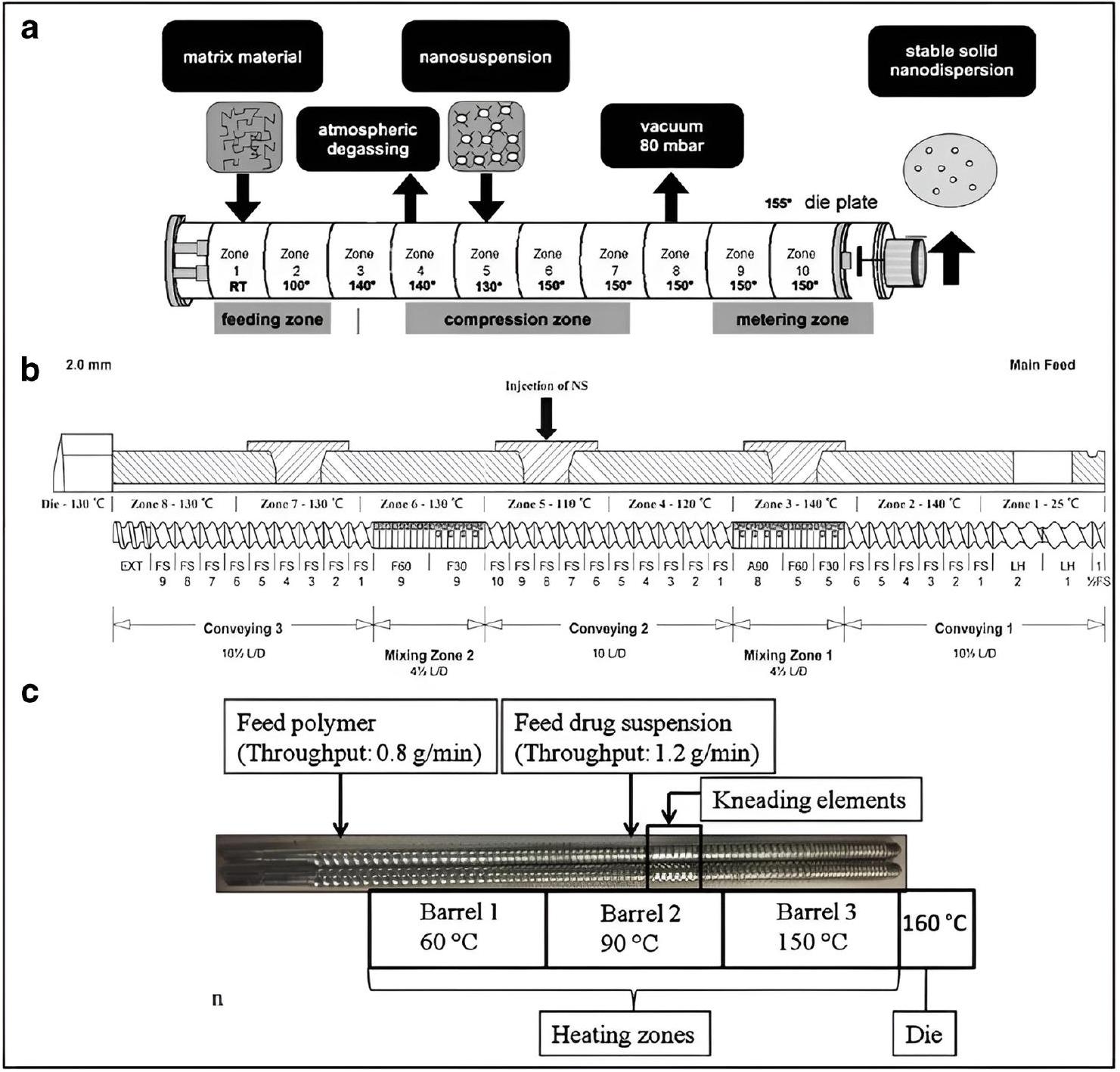
Nanoextrusion
was kept at
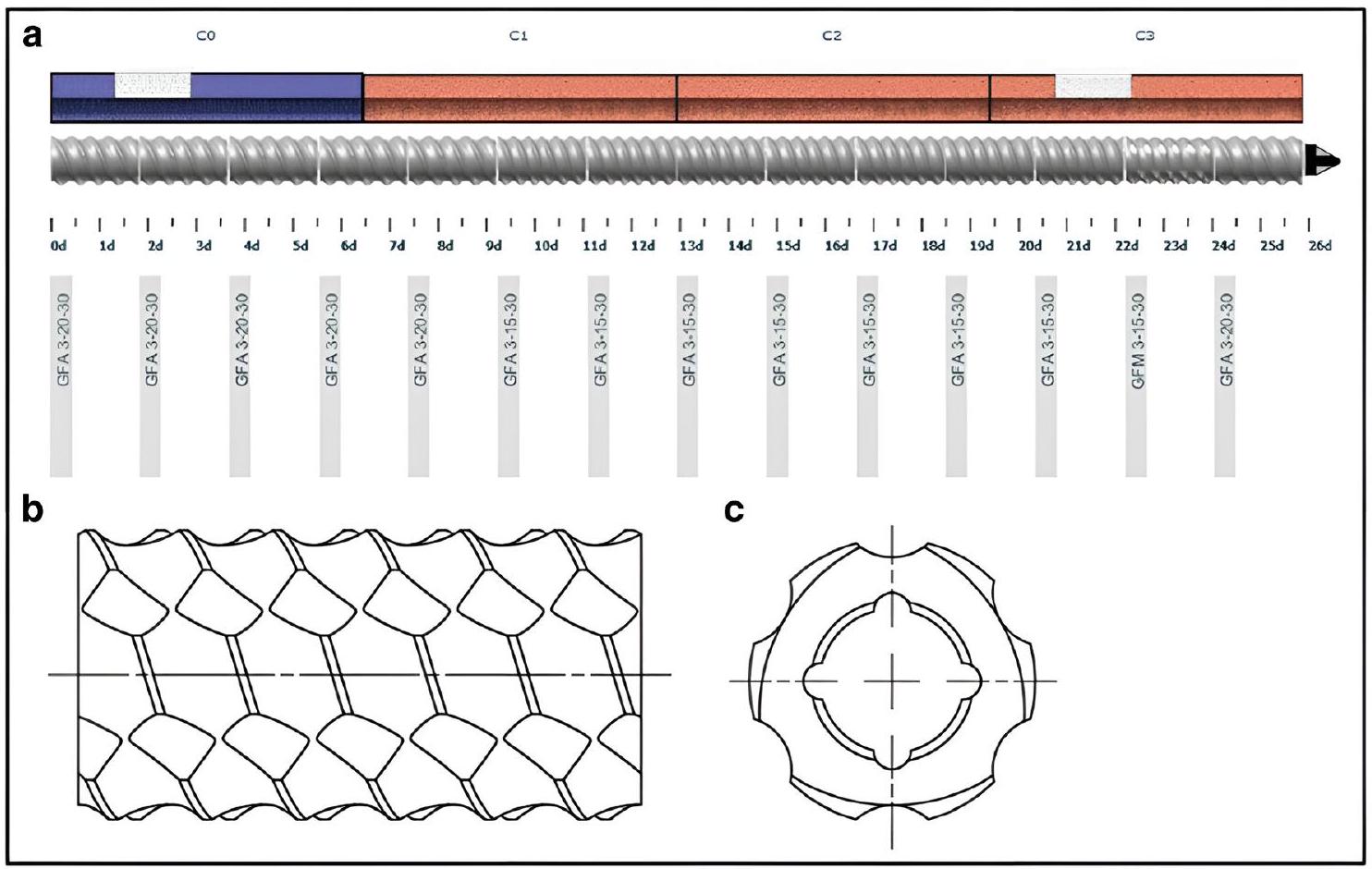
Twin Screw Granulation

Factors Influencing Granular Properties
| Applications | HME | TSMG | TSDG | TSWG |
| Continuous process | Yes | Yes | Yes | Yes |
| High mixing efficiency | Yes | Yes | Yes | Yes |
| Solubility enhancement | Yes | Yes | No | No |
| Taste masking | Yes | Yes | Yes | Yes |
| Fixed dose combination | Yes | Yes | Yes | Yes |
| Abuse deterrent formulation | Yes | Yes | No | No |
| API stabilization | Yes | Yes | No | No |
| Improve API processibility | Yes | Yes | Yes | Yes |
| Moisture sensitive API | Yes | Yes | Yes | No |
| Heat sensitive API | No | No | Yes | Yes |
| Modified release | Yes | Yes | Yes | Yes |

methylcellulose (HPMC) and hydroxypropyl cellulose (HPC), as well as synthetic polymers such as polyvinylpyrrolidone (PVP) [27].
shear applied during mixing [2,25,29]. Lower temperatures help maintain the crystallinity of the API during TSMG, and low melting point binders can help achieve this [30]. The temperature at which HME processing is carried out has a crucial role in the granulation process. When extrusion is performed at the melting temperature of the binder, it forms stronger and denser granules. This occurs because the amount of molten material increases, and the binding properties between particles are enhanced after cooling [31].
The Gap Between Lab Scale and Commercial Scale Processing
application and industry requirements. Despite the advancements in TSG, there still needs to be a deeper understanding of the underlying process mechanisms and the impact of process variables on granule properties. Developing robust models and control strategies for TSG is crucial to ensure consistent product quality and performance. Further research is needed to establish process-performance relationships, optimize process parameters, and enable real-time monitoring and control of the TSG process. Here are some common gaps in the commercialization of TSG, including process understanding and control, regulatory considerations, scale-up and manufacturing considerations (smaller batch size compared to conventional methods), equipment availability and cost, formulation complexity, and educational training [25].
consistent and reproducible results at the commercial scale. As TSG is a relatively new technology, there is a need for education and training programs to enhance the knowledge and skills of pharmaceutical scientists and manufacturing personnel. Adequate training on TSG principles, process optimization, and troubleshooting would help bridge the knowledge gap and promote the broader adoption of TSG in the industry. Addressing these gaps requires collaborative efforts between academia, industry, and regulatory bodies. Further research, technological advancements, and knowledge dissemination will contribute to the commercialization of TSG by addressing the challenges and providing comprehensive solutions for successful implementation at a larger scale [37].
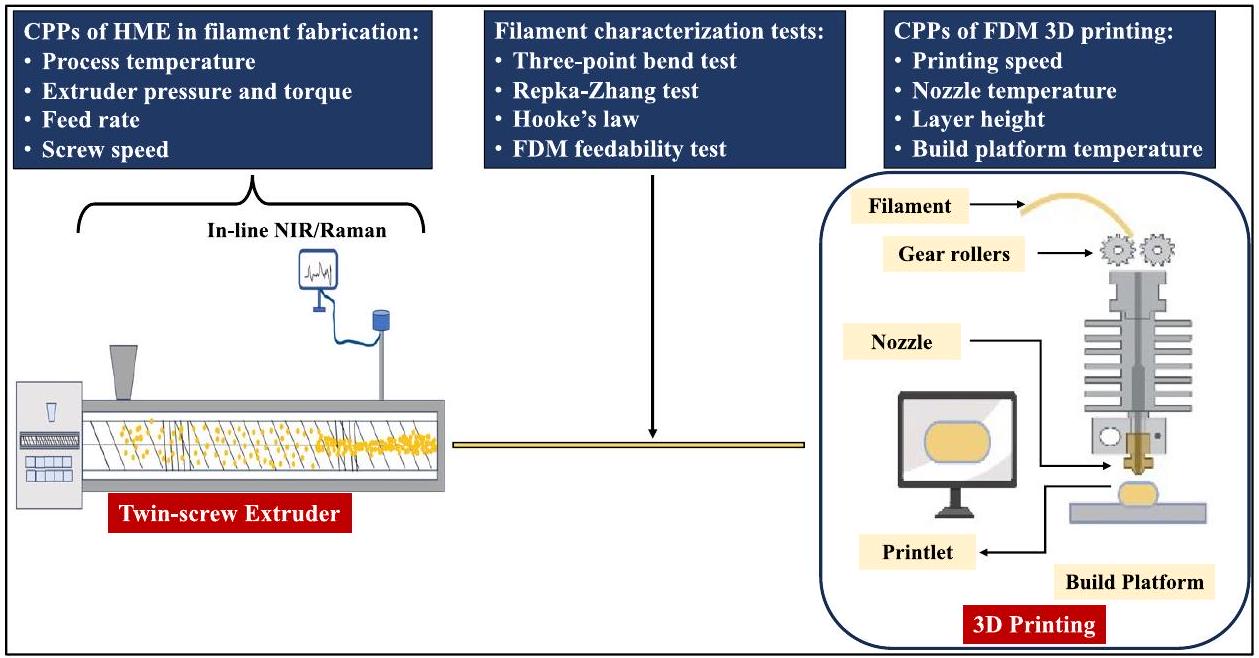
Hot-Melt Extrusion and Fused Deposition Modeling 3D Printing for Pharmaceutical Dosage Forms
glass transition temperature ( Tg ) than the melting point ( Tm ) of the drug are usually preferred to avoid thermal degradation of the drug during the processing. Some of the most commonly used pharmaceutical-grade thermoplastic polymers for producing filaments for FDM are Eudragits, Polyvinyl pyrrolidone (PVP), HPC, Polyethylene glycol (PEG), etc. [40].

Drug Complexes/Solid Dispersions via Hot-Melt Extrusion
Cyclodextrin Complexes
approaches have been investigated, such as adding solvent to HME to form the complex (hot-liquid extrusion (HLE)) or adding a polymer. In HLE, the liquid aids in the formation of a complex between API and CD. The principle behind this technique may be like that of the kneading technique, in which the physical mixture is intensively mixed with the help of liquid. However, the intensity, consistency, and uniformity of mixing in HLE are far superior to the kneading technique, resulting in a greater efficiency of complexation between the host and guest molecules. This technique was utilized by Manne et al. to form Carbamazepine-CD complexes, and they studied the effect of solvent (water and aqueous buffer), screw speed, temperature, and molar ratio of complexation between the two reactants. The solvent systems that kept the API in a unionized state (high hydrophobicity) resulted in high complexation efficiencies resulting in better improvement of solubility. The temperature has little effect on complexation because the interaction between the host and guest molecules involves the guest molecules’ replacement of water molecules from the host cavity. However, the complexation efficiency at near room temperature was higher than at elevated temperatures. The screw speed is indirectly proportional to residence time; therefore, the optimum speed should be chosen by potentially eliminating the detrimental screw speeds, which vary depending on the solvent system, temperature, and nature of the selected API and CD [46].
| Dosage Form | 3D printer model | Drug | Polymer/carrier/plasticizer | Printing parameters | Purpose | Reference | ||||
| Fast dissolving oral dosage form | Eagleed | – | PVA, Maltitol, TEC | Printing speed:
|
Rapidly dissolving dosage form | [95] | ||||
| Core-shell oral dosage form | Ultimaker 3 | Theophylline | HPMC 35 (slow dissolving, core of tablet), PEO15-P (Fast dissolving, shell of tablet) |
|
Dual release kinetics | [96] | ||||
| Implant | Gaonuo-a001 | Ibuprofen | PCL, Chitosan | Printing speed:
|
Personalized and controlled drug release | [97] | ||||
| Vaginal ring | Ultimaker 3 | Clotrimazole | Thermoplastic polyurethane (TPU) |
|
Sustained drug delivery | [98] | ||||
| Ocular insert | Prusa i3 | Ciprofloxacin hydrochloride | HPC, PEO, PEG 4000, Sorbitol | Printing temp:
|
Prolonged ocular drug delivery | [99] | ||||
| Buccal film | Prusa i3 | Adipic acid and Xylitol | PEO 200 K | Nozzle temperature:
|
Mucoadhesive buccal delivery | [100] |
Drug-Resin Complexes
of the molten material during extrusion, facilitating ion diffusion and complex formation. The screw speed exhibited limited impact on the DRC formulation, necessitating optimization to ensure a smooth extrusion process without hindrances. The drug’s affinity for the resin was a critical factor in resin selection and required screening. In this study, IRP88 demonstrated superior performance over IRP64 in forming DRCs of quinine hydrochloride, as IRP64 failed to diminish the peak intensities at
Solid Dispersions
Amorphous Solid Dispersions
temperature, along with vigorous mixing inside the barrel, melts the drug or reduces the particle size of the drug and allows it to be miscible or dissolve within the molten polymer, thereby improving the content uniformity and stability of the drug’s amorphous nature [59]. Therefore, proper selection of polymer carriers is of utmost importance in the successful development of ASD since they account for a large portion comprising about 50 to
Crystalline Solid Dispersions
are utilized. In a study conducted by Prasad et al., CSDs of mefenamic acid were developed. Wherein, the temperatures utilized are lower than the Tm of the drug, and a plasticizer was used to further reduce the processing temperatures in HME. The DSC and XRD results indicate the retaining of the crystalline nature of API after extrusion especially when the drug loading was above the
Cocrystals
and masking the bitter taste of drug substances without significantly affecting their pharmacological activity. Cocrystals are multi-component systems in which the active pharmaceutical ingredient (API) and coformer excipient/another API in a definite stoichiometric ratio are bonded together via either hydrogen bonds, van der Waals forces, or
Composition
Purity
Particle Size and Distribution
Thermal Properties
HME Process Parameters
HME Scale-up Challenges, Considerations, and Models
HME/TSE Equipment Sizes and Scale-up Challenges
need more throughput. To achieve larger scales, increase equipment size to meet commercial demand. Scaling up a manufacturing process can be challenging. Simply increasing the throughput or feed rate can affect the product quality. Changing the screw speed or feed rate can cause machine overload and affect the product quality. Similarly, increasing the barrel size without adjusting the feeding rate can impact product quality. In continuous manufacturing, transferring from a laboratory to a production level is complex due to several unit operations combined within a single apparatus.
| Leistritz Twin Screw Extruders | |||||||
| Type | Screws diameter (mm) | Screws torque (Nm) | Max screw speed (rpm) | Drive power (kW) | Average throughput* kg/h | ||
| NANO 16 | 16 | 42 | 500 | 2.24 | 0.02-0.1 | ||
| ZSE 12 HP-PH | 12 | 20 | 1000 | 2 | 0.05-1 | ||
| ZSE 18 HP-PH | 18 | 71 | 1200 | 9.4 | 0.2-5 | ||
| ZSE 27 HP-PH | 27 | 268 | 500 and 1200 | 15 | 1-25 | ||
| ZSE 40 HP-PH | 40 | 830 | 400 | 37 | Up to 100 | ||
| ZSE 50 HP-PH | 50 | 1570 | 400 | 70 | Up to 200 | ||
| ThermoFischer twin screw extruders | |||||||
| Type | Screws diameter (mm) | Max screw speed (rpm) | Average throughput* kg/h | ||||
| HAAKE
|
Conical | 360 | 0.01 to 0.1 | ||||
| Pharma mini HME | Conical | 360 | 0.01 to 0.1 | ||||
| HAAKE
|
Conical | 360 | 0.01 to 0.1 | ||||
| Pharma 11 | 11 | 1000 | 0.01 to 2.5 | ||||
| Process 11 | 11 | 1000 | 0.01 to 2.5 | ||||
| EuroLab XL | 16 | 500 (1000) | 0.2 to 10 | ||||
| HAAKE
|
16 | 1100 | 0.2 to 10 | ||||
| HAAKE
|
24 | 1100 (560) | 0.5 to 50 | ||||
| HAAKE
|
Conical | 250 | 0.2 to 5 | ||||
| TSE 24 MC | 24 | 500 (1000) | 0.5 to 50 | ||||
| Pharma 16 | 16 | 1000 | 0.2 to 5 | ||||
| Pharma 24 | 24 | 1000 | 0.5 to 20 | ||||
Scale-up Models and Formulas in HME
- Adiabatic melt extrusion process derived from the cubic law: Based on these considerations, adiabatic extrusion processes can be scaled up with Eq. (1), in the case that
sufficient energy is provided by viscous dissipation at ideally no heat loss or gain from the surrounding environment. The output will scale by the diameter ratio to the power of three () for extruders with geometrical similarity and processes running at the same rotation speed. Similarly, a square law ( ) can also be suggested based on the heat transfer when considering a successful scale-up. Nevertheless, the balance can deviate based on the geometric similarity and the melt temperature because they might not be constant throughout the scale-up. - Volumetric scale-up: In the continuous manufacturing (CM) of pharmaceutical products using HME processes is applied to maintain the same degree of fill and the same RTD. For geometrically similar extruders with different diameters, the final feed rate in a twin-screw extruder is assessed using Eq. (2). In simplified conditions, if volumetric scale-up is conducted using similar geometric extruders (e.g.,
or twin-screw extruder from Thermo Fisher, Germany) and the screw speed is kept constant, the process throughput is expected to obey the cubic law. - Heat Transfer Rate: Scale-up of the CM of pharmaceuticals using HME processes can be assessed by optimizing the heat transfer of the barrel, where the scale-up of the manufacturing will entirely be dependent on the heat transfer. In this method, the surface area for heat transfer is taken to be equivalent to the barrel surface area. Based
| Model | Formula | Parameters description |
| Adiabatic process model (Eq. 1) |
|
Scale-Up equation to obtain thermal similarity, where Q is throughput at target scale,
|
| Volumetric scale-up (Eq. 2) |
|
Where
|
| Heat transfer rate (Eq. 3) |
|
where
|
| Specific energy (Eq. 4) | Specific Energy
|
where Emax, Nmax, and
|
| Specific Mechanical Energy consumption (Eq. 5) | SMEC
|
Where
|
| Shear rate (Eq. 6) | Shear rate
|
Where, D is the screw diameter, n is the screw speed in rpm , and h is the overflight clearance |
| Shear stress (Eq. 7) | Shear stress –
|
Where Ec is viscosity of the material |
| Resident time distribution (Eq. 8) |
|
Where RT is the resident time (s), SV is specific volume, SG is specific gravity of material, percentage fill in decimal and Q is throughput (kg/h) |

- Specific torque and specific energy (SE) input is considered a critical parameter in the production of highenergy compositions, including amorphous systems. Therefore, successful scale-up of a CM process via HME depends largely on the steady constant level of SE input. Generally, the mechanical energy input in an HME process during the optimization of scale-up methods is calculated and determined by using Eq. (4).
- Specific mechanical energy (SME) measures the total mechanical energy (as a form of heat) put into the extrudate during high shear mixing. Specific mechanical energy consumption (SMEC) represents the energy entering the extrusion system per unit mass through viscous dissipation. As shown by Eq. (5), the SMEC depends on the torque, rotation of the screw, and the feed rate or throughput, and is measured in
. - Shear rate: In a TSE system, shear forces result in mixing and, thus, the shear rate determines the velocity gradient between two surfaces moving at different speeds. In a typical TSE, the shear rate is calculated as a function of screw outside diameter, overflight gap, and the screw speed, as shown by Eq. (6).
- Shear stress is referred to as the magnitude of the applied stress inside the barrel that the conveying materials experience and is expressed by Eq. (7) as a function of the shear rate and viscosity. Barrel temperatures have a key role in controlling the viscosity of the melt inside a barrel. Low or high viscosity impacts the mix-
ing quality (e.g., high viscosity facilitates dispersive mixing). - Residence time distribution is highly dependent upon the degree of screw fill. Equation (8) is used to determine the residence time.
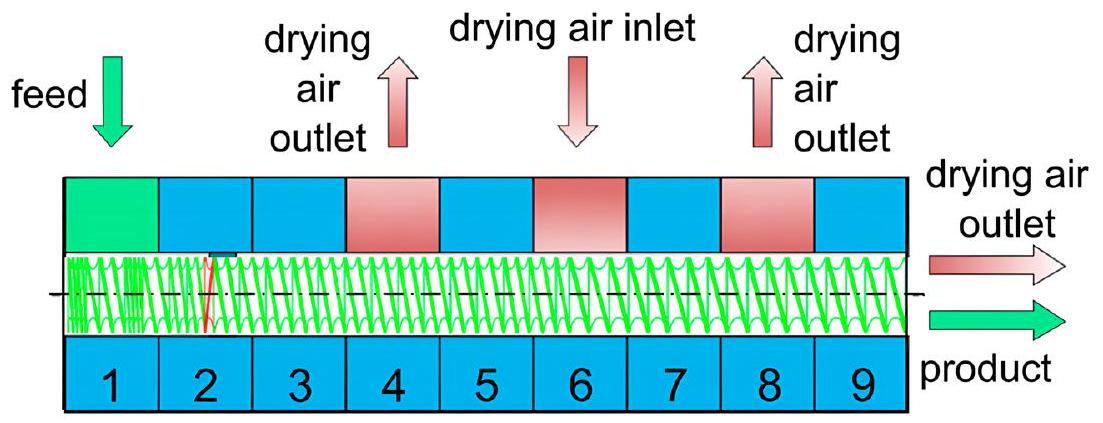
HME as a Continuous Manufacturing Process
transported to the next unit operation for further processing. The holding time for intermediates can vary depending on the scale, which requires hold time studies. These steps are usually repeated over multiple unit operations, for instance, blending, hot melt extrusion, milling, compression, and coating (Fig. 7). On the other hand, the same unit operations can be integrated via continuous manufacturing (CM). In this process, the material is automatically transferred, monitored, and controlled in-line along the manufacturing path. The starting material is continuously charged into the first process unit at the beginning of the line, while the final product is discharged at the end of the process unit. The twinscrew extruder can be integrated with downstream tablet manufacturing unit operations continuously to set up a true end-to-end continuous solid oral dosage form manufacturing process (Fig. 8). Process analytical technology (PAT) can establish a control strategy (feed-back or feed-forward). In such a continuous process, the time to make a final product takes less without needing intermediate testing and hold time studies [84].
PAT Considerations
Type of PAT Sensors

Approved Drug Products Manufactured by CM
approved drug products that are manufactured by continuous process [89]. Many CM products are in the pipeline, and more of them are expected to be approved in the next few years.
Advantages of Pharmaceutical Continuous Manufacturing
| Drug product | Indication | Company | Year of first approval | Regulatory body |
| Orkambi
|
Cystic fibrosis | Vertex | 2015 | FDA, EMA |
| Prezista® | HIV | J&J | 2016 | FDA, EMA |
| Verezino
|
Breast Cancer | Eli Lilly | 2017 | FDA, EMA, PMDA |
| Daurismo
|
Myeloid Leukemia | Pfizer | 2018 | FDA |
| Lobrena
|
Lung Cancer | Pfizer | 2018 | FDA |
| Symdeko®/Symkevi
|
Cystic fibrosis | Vertex | 2018 | FDA, EMA |
| Tramacet
|
Pain | J&J | 2017 | PDMA |
| Trikafta®/Kaftrio® | Cystic fibrosis | Vertex | 2019 | FDA |
| Duvroq
|
Renal Anemia | GSK | 2020 | FDA, PMDA |
| Xofluza® | Influenza | Genentech Inc | 2021 | FDA, EMA, PMDA |
| Tazverik® | Follicular Lymphoma | Epizyme Inc | 2020 | FDA, PMDA |
| Cibinqo
|
Atopic Dermatitis | Pfizer | 2022 | FDA |

Oral Solid Dosage Continuous Manufacturing Challenges
cost-effectiveness, which outweigh the challenges involved. However, it is essential to collaborate with industry stakeholders, conduct ongoing research and development, and commit to implementing best practices to overcome these challenges effectively.
Regulatory Considerations
Marketed Products
| Proprietary name | Manufacturer | Year approved | Marketing status | Dosage form | API | Polymer matrix | Therapeutic indications |
| Braftovi
|
Array | 2018 | Prescription | Capsule; Oral | Encorafenib | PVP/VA64 | Metastatic Melanoma |
| Annovera
|
Therapeutics MD Inc | 2018 | Prescription | Ring; Vaginal | Ethinylestradiol | Silicone Elastomers | Contraceptive |
| Lynparza
|
Astrazeneca | 2017 | Prescription | Tablet; Oral | Olaparib | Copovidone | Ovarian Cancer |
| Mavyret
|
AbbVie | 2017 | Orphan | Tablet; Oral | Glecaprevir; Pibrentasvir | Copovidone, Vitamin E Polyethylene Glycol Succinate | Hepatitis C |
| Venclexta
|
AbbVie | 2016 | Orphan | Tablet; Oral | Venetoclax | Copovidone | Chronic Lymphocytic Leukemia |
| Viekira XR® | AbbVie | 2016 | Prescription | Tablet; Extended Release | Ombitasvir, Paritaprevir, Ritonavir, Dasabuvir | Copovidone | Hepatitis C |
| Technivie
|
AbbVie | 2015 | Discontinued | Tablet; Oral | Ombitasvir, Paritaprevir, Ritonavir | Copovidone, Vitamin E Polyethylene Glycol Succinate | Hepatitis C |
| Viekira pak® | AbbVie | 2014 | Discontinued | Tablet; Oral | Ombitasvir, Paritaprevir, Ritonavir, Dasabuvir | Copovidone | Hepatitis C |
| Belsomra
|
Merck | 2014 | Prescription | Tablet; Oral | Suvorexant | Copovidone | Insomnia |
| Noxafil
|
Merck | 2013 | Prescription | Tablet; Delayed Release | Posaconazole | HPMCAS, PVA | Fungal Infections |
| Nucynta® | Collegium Pharmaceuticals | 2011 | Prescription | Tablet; Extended Release | Tapentadol hydrochloride | Povidone | Acute Pain |
| Opana ER® | Endo Pharmaceuticals | 2011 | Discontinued | Tablet; Extended Release | Oxymorphone hydrochloride | HPMC | Severe Pain |
| Norvir
|
AbbVie | 2010 | Prescription | Tablet; Oral | Ritonavir | Copovidone | HIV-1 |
| Onmel® | Sebela Ireland | 2010 | Discontinued | Tablet; Oral | Itraconazole | HPMC | Onychomycosis |
| Fenoglide
|
Salix Pharmaceuticals | 2007 | Prescription | Tablet; Oral | Fenofibrate | PEG 6000 | Dyslipidaemia |
| Palladone
|
Purdue Pharma LP | 2004 | Discontinued | Capsule; Extended Release | Hydromorphone hydrochloride | Amino Methacrylate Copolymer | Pain in Opioid Tolerant Patients |
| Kaletra
|
AbbVie | 2000 | Prescription | Tablet; Oral | Lopinavir, Ritonavir | Copovidone | HIV-1 Infection |
| Rezulin
|
Pfizer | 1997 | Discontinued | Tablet; Oral | Troglitazone | HPMC, PEG 400, Povidone | Type 2 Diabetes |
| Covera-HS® | Pfizer | 1996 | Discontinued | Tablet; Extended Release | Verapamil hydrochloride | HPMC, PEG | Hypertension and Angina |
| Adalat CC® | Norwich Pharmaceuticals | 1993 | Discontinued | Tablet; Extended Release | Nifedipine | Crospovidone | Hypertension |
| Cesamet
|
Bausch | 1985 | Prescription | Capsule; Oral | Nabilone | Povidone | Emesis |
| Lacrisert
|
Bausch | 1982 | Prescription | Insert; Ophthalmic | – | HPC | Dry Eye Syndromes |
Conclusion
Declarations
Open Access This article is licensed under a Creative Commons Attribution 4.0 International License, which permits use, sharing, adaptation, distribution and reproduction in any medium or format, as long as you give appropriate credit to the original author(s) and the source, provide a link to the Creative Commons licence, and indicate if changes were made. The images or other third party material in this article are included in the article’s Creative Commons licence, unless indicated otherwise in a credit line to the material. If material is not included in the article’s Creative Commons licence and your intended use is not permitted by statutory regulation or exceeds the permitted use, you will need to obtain permission directly from the copyright holder. To view a copy of this licence, visit http://creativecommons.org/licenses/by/4.0/.
References
- Koutsamanis I, Roblegg E, Spoerk M. Controlled delivery via hot-melt extrusion: a focus on non-biodegradable carriers for non-oral applications. Journal of Drug Delivery Science and Technology. 2023;81:104289.
- Crowley MM, Zhang F, Repka MA, Thumma S, Upadhye SB, Battu SK, et al. Pharmaceutical applications of hot-melt extrusion: part I. Drug Dev Ind Pharm. 2007;33:909-26.
- Repka MA, Battu SK, Upadhye SB, Thumma S, Crowley MM, Zhang F, et al. Pharmaceutical applications of hot-melt extrusion: Part II. Drug Dev Ind Pharm. 2007;33:1043-57.
- Kallakunta VR, Sarabu S, Bandari S, Tiwari R, Patil H, Repka MA. An update on the contribution of hot-melt extrusion
technology to novel drug delivery in the twenty-first century: part I. Expert Opin Drug Deliv. 2019;16:539-50. - Sarabu S, Bandari S, Kallakunta VR, Tiwari R, Patil H, Repka MA. An update on the contribution of hot-melt extrusion technology to novel drug delivery in the twenty-first century: part II. Expert Opin Drug Deliv. 2019;16:567-82.
- Patil H, Tiwari RV, Repka MA. Hot-melt extrusion: from theory to application in pharmaceutical formulation. AAPS PharmSciTech. 2016;17:20-42.
- Smyth HDC, Hickey AJ. Carriers in drug powder delivery. Am J Drug Deliv. 2005;3:117-32.
- Spahn JE, Hefnawy A, Smyth HDC, Zhang F. Development of a novel method for the continuous blending of carrier-based dry powders for inhalation using a co-rotating twin-screw extruder. Int J Pharm. 2022;623:121914.
- Ren A, Koleng JJ, Costello M, Spahn JE, Smyth HDC, Zhang F. Twin-screw continuous mixing can produce dry powder inhalation mixtures for pulmonary delivery. J Pharm Sci. 2023;112:272-81.
- Ren A, Spahn JE, Smyth HDC, Zhang F. Twin-screw continuous mixing: Effect of mixing elements and processing parameters on properties of aerosol powders. Powder Technol. 2023;424:118519.
- Martin C. Twin screw extruders as continuous mixers for thermal processing: a technical and historical perspective. AAPS PharmSciTech. 2016;17:3-19.
- Pilcer G, Wauthoz N, Amighi K. Lactose characteristics and the generation of the aerosol. Adv Drug Deliv Rev. 2012;64:233-56.
- Schmidt A, de Waard H, Moll K-P, Kleinebudde P, Krumme M. Simplified end-to-end continuous manufacturing by feeding API suspensions in twin-screw wet granulation. Eur J Pharm Biopharm. 2018;133:224-31.
- Hare C, Ghadiri M, Dennehy R. Prediction of attrition in agitated particle beds. Chem Eng Sci. 2011;66:4757-70.
- Meena AK, Desai D, Serajuddin ATM. Development and optimization of a wet granulation process at elevated temperature for a poorly compactible drug using twin screw extruder for continuous manufacturing. J Pharm Sci. 2017;106:589-600.
- Schmidt A, de Waard H, Kleinebudde P, Krumme M. Continuous single-step wet granulation with integrated in-barrel-drying. Pharm Res. 2018;35:167.
- Kreimer M, Aigner I, Lepek D, Khinast J. Continuous drying of pharmaceutical powders using a twin-screw extruder. Org process Res Dev. 2018;22:813-23.
- Haser A, Kittikunakorn N, Dippold E, DiNunzio JC, Blincoe W. Continuous twin-screw wet granulation process with in-barrel drying and NIR setup for real-time moisture monitoring. Int J Pharm. 2023;630: 122377.
19 Li M, Ioannidis N, Gogos C, Bilgili E. A comparative assessment of nanocomposites vs. amorphous solid dispersions prepared via nanoextrusion for drug dissolution enhancement. Eur J Pharm Biopharm. 2017;119:68-80. - Khinast J, Baumgartner R, Roblegg E. Nano-extrusion: a onestep process for manufacturing of solid nanoparticle formulations directly from the liquid phase. AAPS PharmSciTech. 2013;14:601-4.
- Ye X, Patil H, Feng X, Tiwari RV, Lu J, Gryczke A, et al. Conjugation of hot-melt extrusion with high-pressure homogenization: a novel method of continuously preparing nanocrystal solid dispersions. AAPS PharmSciTech. 2016;17:78-88.
- Baumgartner R, Eitzlmayr A, Matsko N, Tetyczka C, Khinast J, Roblegg E. Nano-extrusion: a promising tool for continuous manufacturing of solid nano-formulations. Int J Pharm. 2014;477:1-11.
- Li M, Furey C, Skros J, Xu O, Rahman M, Azad M, et al. Impact of matrix surface area on Griseofulvin release from extrudates prepared via nanoextrusion. Pharmaceutics. 2021;13:1036.
- Nyavanandi D, Mandati P, Narala S, Alzahrani A, Kolimi P, Vemula SK, et al. Twin screw melt granulation: a single step approach for developing self-emulsifying drug delivery system for lipophilic drugs. Pharmaceutics. 2023;15:2267.
- Bandari S, Nyavanandi D, Kallakunta VR, Janga KY, Sarabu S, Butreddy A, et al. Continuous twin screw granulation-an advanced alternative granulation technology for use in the pharmaceutical industry. Int J Pharm. 2020;580: 119215.
- Vercruysse J, Burggraeve A, Fonteyne M, Cappuyns P, Delaet U, Van Assche I, et al. Impact of screw configuration on the particle size distribution of granules produced by twin screw granulation. Int J Pharm. 2015;479:171-80.
- Forster SP, Dippold E, Chiang T. Twin-screw melt granulation for oral solid pharmaceutical products. Pharmaceutics. 2021;13:665.
- Portier C, Vervaet C, Vanhoorne V. Continuous twin screw granulation: a review of recent Progress and opportunities in formulation and equipment design. Pharmaceutics. 2021;13:668.
- Zhao Y, Xie X, Zhao Y, Gao Y, Cai C, Zhang Q, et al. Effect of plasticizers on manufacturing ritonavir/copovidone solid dispersions via hot-melt extrusion: Preformulation, physicochemical characterization, and pharmacokinetics in rats. Eur J Pharm Sci. 2019;127:60-70.
- Ghosh I, Vippagunta R, Li S, Vippagunta S. Key considerations for optimization of formulation and melt-extrusion process parameters for developing thermosensitive compound. Pharm Dev Technol. 2012;17:502-10.
- Van Melkebeke B, Vermeulen B, Vervaet C, Remon JP. Melt granulation using a twin-screw extruder: A case study. Int J Pharm. 2006;326:89-93.
- Srinivasan P, Almutairi M, Youssef AAA, Almotairy A, Bandari S, Repka MA. Numerical simulation of five different screw configurations used during the preparation of hot-melt extruded Kollidon® and Soluplus® based amorphous solid dispersions containing indomethacin. Journal of Drug Delivery Science and Technology. 2023;85: 104561.
- Kumar A, Vercruysse J, Toiviainen M, Panouillot P-E, Juuti M, Vanhoorne V, et al. Mixing and transport during pharmaceutical twin-screw wet granulation: experimental analysis via chemical imaging. Eur J Pharm Biopharm. 2014;87:279-89.
- Nandi U, Trivedi V, Ross SA, Douroumis D. Advances in twinscrew granulation processing Pharmaceutics. 2021;13:624.
- Kallakunta VR, Tiwari R, Sarabu S, Bandari S, Repka MA. Effect of formulation and process variables on lipid based sustained release tablets via continuous twin screw granulation: a comparative study. Eur J Pharm Sci. 2018;121:126-38.
- Seem TC, Rowson NA, Ingram A, Huang Z, Yu S, de Matas M, et al. Twin screw granulation-a literature review. Powder Technol. 2015;276:89-102.
- Jakob B, Geilen T. Relevant process parameters for twin-screw compounding. 2018. https://www.thermofisher.com/document-connect/document-connect.html?url=https
Fassets. thermofisher.com%2FTFS-Assets%2FCAD%2FApplication-Notes%2FLR70-relevant-process-parameters-twin-screw-compo unding.pdf&title=UmVsZXZhbnQgUHJvY2VzcyBQYXJhbW V0ZXJzIGZvciBUd2luIFNjcmV3IENvbXBvdW5kaW5n. - Wang H, Vemula SK, Bandari S, Repka MA. Preparation of coreshell controlled release tablets using direct powder extrusion 3D printing techniques. Journal of Drug Delivery Science and Technology. 2023;88: 104896.
- Okafor-Muo OL, Hassanin H, Kayyali R, ElShaer A. 3D printing of solid oral dosage forms: numerous challenges with unique opportunities. J Pharm Sci. 2020;109:3535-50.
- Wang J, Zhang Y, Aghda NH, Pillai AR, Thakkar R, Nokhodchi A, et al. Emerging 3D printing technologies for drug delivery devices: current status and future perspective. Adv Drug Deliv Rev. 2021;174:294-316.
41 Solanki NG, Gumaste SG, Shah AV, Serajuddin ATM. Effects of surfactants on Itraconazole-Hydroxypropyl Methylcellulose Acetate Succinate solid dispersion prepared by hot melt extrusion. II: rheological analysis and extrudability testing. Journal of Pharmaceutical Sciences. 2019;108:3063-73. - Alhijjaj M, Nasereddin J, Belton P, Qi S. Impact of processing parameters on the quality of pharmaceutical solid dosage forms produced by fused deposition modeling (FDM). Pharmaceutics. 2019;11:633.
- Bandari S, Nyavanandi D, Dumpa N, Repka MA. Coupling hot melt extrusion and fused deposition modeling: Critical properties for successful performance. Adv Drug Deliv Rev. 2021;172:52-63.
- Lakkala P, Munnangi SR, Bandari S, Repka M. Additive manufacturing technologies with emphasis on stereolithography 3D printing in pharmaceutical and medical applications: A review. International Journal of Pharmaceutics: X. 2023;5: 100159.
- Ding B, Yu Y, Geng S, Liu B, Hao Y, Liang G. Computational methods for the interaction between Cyclodextrins and natural compounds: technology, benefits, limitations, and trends. J Agric Food Chem. 2022;70:2466-82.
- Manne ASN, Hegde AR, Raut SY, Rao RR, Kulkarni VI, Mutalik S. Hot liquid extrusion assisted drug-cyclodextrin complexation: a novel continuous manufacturing method for solubility and bioavailability enhancement of drugs. Drug Deliv and Transl Res. 2021;11:1273-87.
- Donthi MR, Munnangi SR, Krishna KV, Marathe SA, Saha RN, Singhvi G, et al. Formulating ternary inclusion complex of sorafenib Tosylate using
-Cyclodextrin and hydrophilic polymers: physicochemical characterization and in vitro assessment. AAPS PharmSciTech. 2022;23:254. - Munnangi SR, Youssef AAA, Narala N, Lakkala P, Vemula SK, Alluri R, et al. Continuous manufacturing of solvent-free cyclodextrin inclusion complexes for enhanced drug solubility via hot-melt extrusion: a quality by design approach. Pharmaceutics. 2023;15:2203.
- Thiry J, Krier F, Ratwatte S, Thomassin J-M, Jerome C, Evrard B. Hot-melt extrusion as a continuous manufacturing process to form ternary cyclodextrin inclusion complexes. Eur J Pharm Sci. 2017;96:590-7.
- Malaquias LFB, Sá-Barreto LCL, Freire DO, Silva ICR, Karan K, Durig T, et al. Taste masking and rheology improvement of drug complexed with beta-cyclodextrin and hydroxypropyl-
-cyclodextrin by hot-melt extrusion. Carbohyd Polym. 2018;185:19-26. - Granados PA, Pinho LAG, Sa-Barreto LL, Gratieri T, Gelfuso GM, Cunha-Filho M. Application of hot-melt extrusion in the complexation of naringenin with cyclodextrin using hydrophilic polymers. Adv Powder Technol. 2022;33: 103380.
- Zhang T-Y, Du R-F, Wang Y-J, Hu J-L, Wu F, Feng Y. Research progress of preparation technology of ion-exchange resin complexes. AAPS PharmSciTech. 2022;23:105.
- Munnangi SR, Youssef AAA, Narala N, Lakkala P, Narala S, Vemula SK, et al. Drug complexes: perspective from Academic Research and Pharmaceutical Market. Pharm Res. 2023;40:1519-40.
- Tan DCT, Ong JJ, Gokhale R, Heng PWS. Hot melt extrusion of ion-exchange resin for taste masking. Int J Pharm. 2018;547:385-94.
- Ghebre-Sellassie I, Terefe H, inventors; ExxPharma Therapeutics LLC, assignee. Tamper-resistant pharmaceutical dosage forms. United States patent US 9,770,514. 2017.
- Wang X, Zhang L, Ma D, Tang X, Zhang Y, Yin T, et al. Characterizing and exploring the differences in dissolution and stability between crystalline solid dispersion and amorphous solid dispersion. AAPS PharmSciTech. 2020;21:262.
- Agrawal AM, Dudhedia MS, Zimny E. Hot melt extrusion: development of an amorphous solid dispersion for an insoluble drug from mini-scale to clinical scale. AAPS PharmSciTech. 2016;17:133-47.
- Darji M, Pradhan A, Vemula SK, Kolter K, Langley N, Repka MA. Development of delayed-release pellets of Ibuprofen using Kollicoat® MAE 100P via hot-melt extrusion technology. J Pharm Innov. 2023;18:1827-37.
- Agrawal A, Dudhedia M, Deng W, Shepard K, Zhong L, Povilaitis E, et al. Development of tablet formulation of amorphous solid dispersions prepared by hot melt extrusion using quality by design approach. AAPS PharmSciTech. 2016;17:214-32.
- Iyer R, Petrovska Jovanovska V, Berginc K, Jaklič M, Fabiani F, Harlacher C, et al. Amorphous solid dispersions (ASDs): the influence of material properties, manufacturing processes and analytical technologies in drug product development. Pharmaceutics. 2021;13:1682.
- Auch C, Harms M, Mäder K. How changes in molecular weight and PDI of a polymer in amorphous solid dispersions impact dissolution performance. Int J Pharm. 2019;556:372-82.
- Mohapatra S, Samanta S, Kothari K, Mistry P, Suryanarayanan R. Effect of polymer molecular weight on the crystallization behavior of indomethacin amorphous solid dispersions. Cryst Growth Des. 2017;17:3142-50.
- Kyeremateng SO, Voges K, Dohrn S, Sobich E, Lander U, Weber S, et al. A hot-melt extrusion risk assessment classification system for amorphous solid dispersion formulation development. Pharmaceutics. 2022;14:1044.
- Prasad E, Robertson J, Halbert GW. Mefenamic acid solid dispersions: impact of formulation composition on processing parameters, product properties and performance. Int J Pharm. 2022;616: 121505.
- Pawar JN, Fule RA, Maniruzzaman M, Amin PD. Solid crystal suspension of Efavirenz using hot melt extrusion: exploring the role of crystalline polyols in improving solubility and dissolution rate. Mater Sci Eng, C. 2017;78:1023-34.
- Reitz E, Vervaet C, Neubert RHH, Thommes M. Solid crystal suspensions containing griseofulvin – Preparation and bioavailability testing. Eur J Pharm Biopharm. 2013;83:193-202.
- Zaworotko MJ. Molecules to crystals, crystals to molecules … and back again? Cryst Growth Des. 2007;7:4-9.
- Yarava JR, Potnuru LR, Pahari B, Tothadi S, Ramanathan KV. Supramolecular synthon identification in azelaic acid-isonicotinamide. Journal of Magnetic Resonance Open. 2022;10-11: 100056.
- Guo M, Sun X, Chen J, Cai T. Pharmaceutical cocrystals: a review of preparations, physicochemical properties and applications. Acta Pharmaceutica Sinica B. 2021;11:2537-64.
- Panzade PS, Shendarkar GR, Kulkarni DA. Hot melt extrusion: an emerging green technique for the synthesis of high-quality pharmaceutical cocrystals. J Pharm Innov. 2022;17:283-93.
- Narala S, Nyavanandi D, Srinivasan P, Mandati P, Bandari S, Repka MA. Pharmaceutical co-crystals, salts, and co-amorphous systems: a novel opportunity of hot-melt extrusion. Journal of Drug Delivery Science and Technology. 2021;61: 102209.
- Narala S, Nyavanandi D, Alzahrani A, Bandari S, Zhang F, Repka MA. Creation of hydrochlorothiazide pharmaceutical cocrystals via hot-melt extrusion for enhanced solubility and permeability. AAPS PharmSciTech. 2022;23:1-11.
- Thakkar R, Thakkar R, Pillai A, Ashour EA, Repka MA. Systematic screening of pharmaceutical polymers for hot melt extrusion processing: a comprehensive review. Int J Pharm. 2020;576: 118989.
- Mandati P, Nyavanandi D, Narala S, Alzahrani A, Vemula SK, Repka MA. A comparative assessment of cocrystal and amorphous solid dispersion printlets developed by hot melt extrusion paired fused deposition modeling for dissolution enhancement and stability of Ibuprofen. AAPS PharmSciTech. 2023;24:203.
- Chabalenge B, Korde S, Kelly AL, Neagu D, Paradkar A. Understanding matrix-assisted continuous co-crystallization using a data mining approach in quality by design (QbD). Cryst Growth Des. 2020;20:4540-9.
- Shaikh R, Walker GM, Croker DM. Continuous, simultaneous cocrystallization and formulation of Theophylline and 4-Aminobenzoic acid pharmaceutical cocrystals using twin screw melt granulation. Eur J Pharm Sci. 2019;137: 104981.
- Soliman II, Kandil SM, Abdou EM. Gabapentin-saccharin cocrystals with enhanced physicochemical properties and in vivo absorption formulated as oro-dispersible tablets. Pharm Dev Technol. 2020;25:227-36.
- Gajda M, Nartowski KP, Pluta J, Karolewicz B. Continuous, onestep synthesis of pharmaceutical cocrystals via hot melt extrusion from neat to matrix-assisted processing-State of the art. Int J Pharm. 2019;558:426-40.
- Maniruzzaman M, Nokhodchi A. Continuous manufacturing via hot-melt extrusion and scale up: regulatory matters. Drug Discovery Today. 2017;22:340-51.
- Zecevic DE, Evans RC, Paulsen K, Wagner KG. From benchtop to pilot scale-experimental study and computational assessment of a hot-melt extrusion scale-up of a solid dispersion of dipyridamole and copovidone. Int J Pharm. 2018;537:132-9.
- Matić J, Witschnigg A, Zagler M, Eder S, Khinast J. A novel in silico scale-up approach for hot melt extrusion processes. Chem Eng Sci. 2019;204:257-69.
- Wesholowski J, Hoppe K, Nickel K, Muehlenfeld C, Thommes M. Scale-up of pharmaceutical hot-melt-extrusion: process optimization and transfer. Eur J Pharm Biopharm. 2019;142:396-404.
- Roggo Y, Pauli V, Jelsch M, Pellegatti L, Elbaz F, Ensslin S, et al. Continuous manufacturing process monitoring of pharmaceutical solid dosage form: A case study. J Pharm Biomed Anal. 2020;179: 112971.
- Khinast J, Bresciani M. Continuous manufacturing: definitions and engineering principles. In: Kleinebudde P, Khinast J, Rantanen J, Eds. John Wiley & Sons, Ltd; 2017. p. 1-31.
- Panikar S, Li J, Rane V, Gillam S, Callegari G, Kurtyka B, et al. Integrating sensors for monitoring blend content in a pharmaceutical continuous manufacturing plant. Int J Pharm. 2021;606: 120085.
- Liu P, Jin H, Chen Y, Wang D, Yan H, Wu M, et al. Process analytical technologies and self-optimization algorithms in automated pharmaceutical continuous manufacturing. Chin Chem Lett. 2024;35:108877.
- Kurouski D, Dazzi A, Zenobi R, Centrone A. Infrared and Raman chemical imaging and spectroscopy at the nanoscale. Chem Soc Rev. 2020;49:3315-47.
- Laske S, Paudel A, Scheibelhofer O, Sacher S, Hörmann T, Khinast J. A review of PAT strategies in secondary solid oral dosage manufacturing of small molecules. J Pharm Sci. 2017;106:667-712.
- Wahlich J. Review: continuous manufacturing of small molecule solid oral dosage forms. Pharmaceutics. 2021;13:1311.
- Su Q, Ganesh S, Moreno M, Bommireddy Y, Gonzalez M, Reklaitis GV, et al. A perspective on Quality-by-Control (QbC) in pharmaceutical continuous manufacturing. Comput Chem Eng. 2019;125:216-31.
- Rossi CV. A comparative investment analysis of batch versus continuous pharmaceutical manufacturing technologies. J Pharm Innov. 2022;17:1373-91.
- Emerging Technology Program. U.S. Food and Drug Administration. 2023. https://www.fda.gov/about-fda/center-drug-evalu ation-and-research-cder/emerging-technology-program.
- Fisher AC, Liu W, Schick A, Ramanadham M, Chatterjee S, Brykman R, et al. An audit of pharmaceutical continuous manufacturing regulatory submissions and outcomes in the US. Int J Pharm. 2022;622: 121778.
- Guideline IC. Q13 on Continuous Manufacturing of Drug Substances and Drug Products. European Medicine Agency. 2023. https://www.ema.europa.eu/en/ich-guideline-q13-continuous-manufacturing-drug-substances-and-drug-products-scientificguideline.
- Ikeda S, Kobayashi M, Aoki S, Terukina T, Kanazawa T, Kojima H, et al. 3D-printed fast-dissolving oral dosage forms via fused deposition modeling based on sugar alcohol and poly(vinyl alco-hol)-preparation, drug release studies and in vivo oral absorption. Pharmaceutics. 2023;15:395.
- Tidau M, Finke JH. Modified release kinetics in dual filament 3D printed individualized oral dosage forms. Eur J Pharm Sci. 2022;175: 106221.
- Yang Y, Wu H, Fu Q, Xie X, Song Y, Xu M, et al. 3D-printed polycaprolactone-chitosan based drug delivery implants for personalized administration. Mater Des. 2022;214: 110394.
- Tiboni M, Campana R, Frangipani E, Casettari L. 3D printed clotrimazole intravaginal ring for the treatment of recurrent vaginal candidiasis. Int J Pharm. 2021;596: 120290.
- Alzahrani A, Youssef AAA, Nyavanandi D, Tripathi S, Bandari S, Majumdar S, et al. Design and optimization of ciprofloxacin hydrochloride biodegradable 3D printed ocular inserts: Full factorial design and in-vitro and ex-vivo evaluations: Part II. Int J Pharm. 2023;631: 122533.
- Elkanayati RM, Chambliss WG, Omari S, Almutairi M, Repka MA, Ashour EA. Mucoadhesive buccal films for treatment of xerostomia prepared by coupling HME and 3D printing technologies. Journal of Drug Delivery Science and Technology. 2022;75: 103660.
- Michael A. Repka
marepka@olemiss.edu
1 Department of Product Development, Catalent Pharma Solutions, 14 Schoolhouse Road, Somerset, New Jersey 08873, USA
Department of Pharmaceutics and Drug Delivery, School of Pharmacy, The University of Mississippi, University, Oxford, Mississippi 38677, USA
3 Department of Pharmaceutics, School of Pharmaceutical Sciences, Lovely Professional University, Phagwara, Punjab 144001, India
4 Molecular Pharmaceutics and Drug Delivery Division, College of Pharmacy, The University of Texas at Austin, 2409 University Avenue, Austin, Texas 78712, USA5 Pii Center for Pharmaceutical Technology, The University of Mississippi, University, Oxford, Mississippi 38677, USA
atos
