DOI: https://doi.org/10.1038/s41586-023-06968-8
PMID: https://pubmed.ncbi.nlm.nih.gov/38355791
تاريخ النشر: 2024-02-14
التدخين يغير المناعة التكيفية مع آثار مستمرة
تاريخ الاستلام: 1 نوفمبر 2022
تم القبول: 13 ديسمبر 2023
نُشر على الإنترنت: 14 فبراير 2024
الوصول المفتوح
الملخص
يختلف الأفراد بشكل كبير في استجاباتهم المناعية، حيث تلعب العوامل العمرية والجنسية والوراثية أدوارًا رئيسية في هذه التباينات الفطرية.
علاقات التدخين، فيروس CMV ومؤشر كتلة الجسم
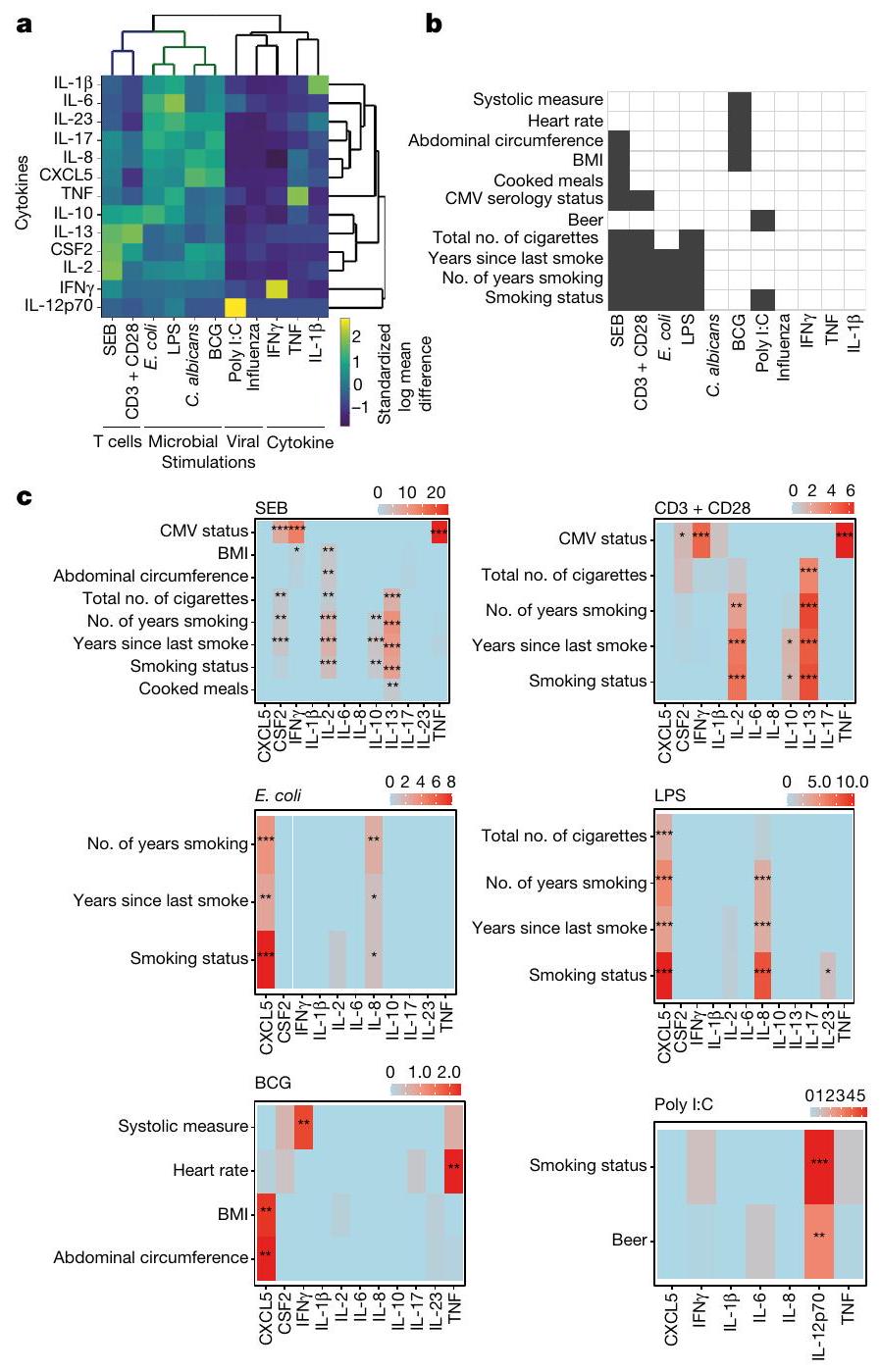
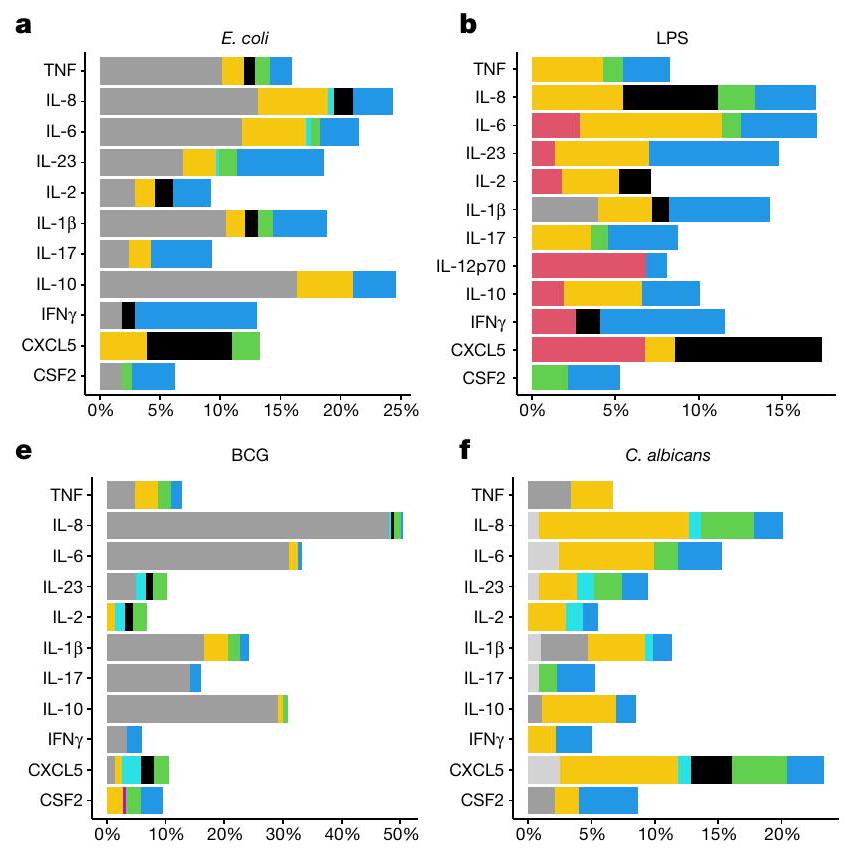
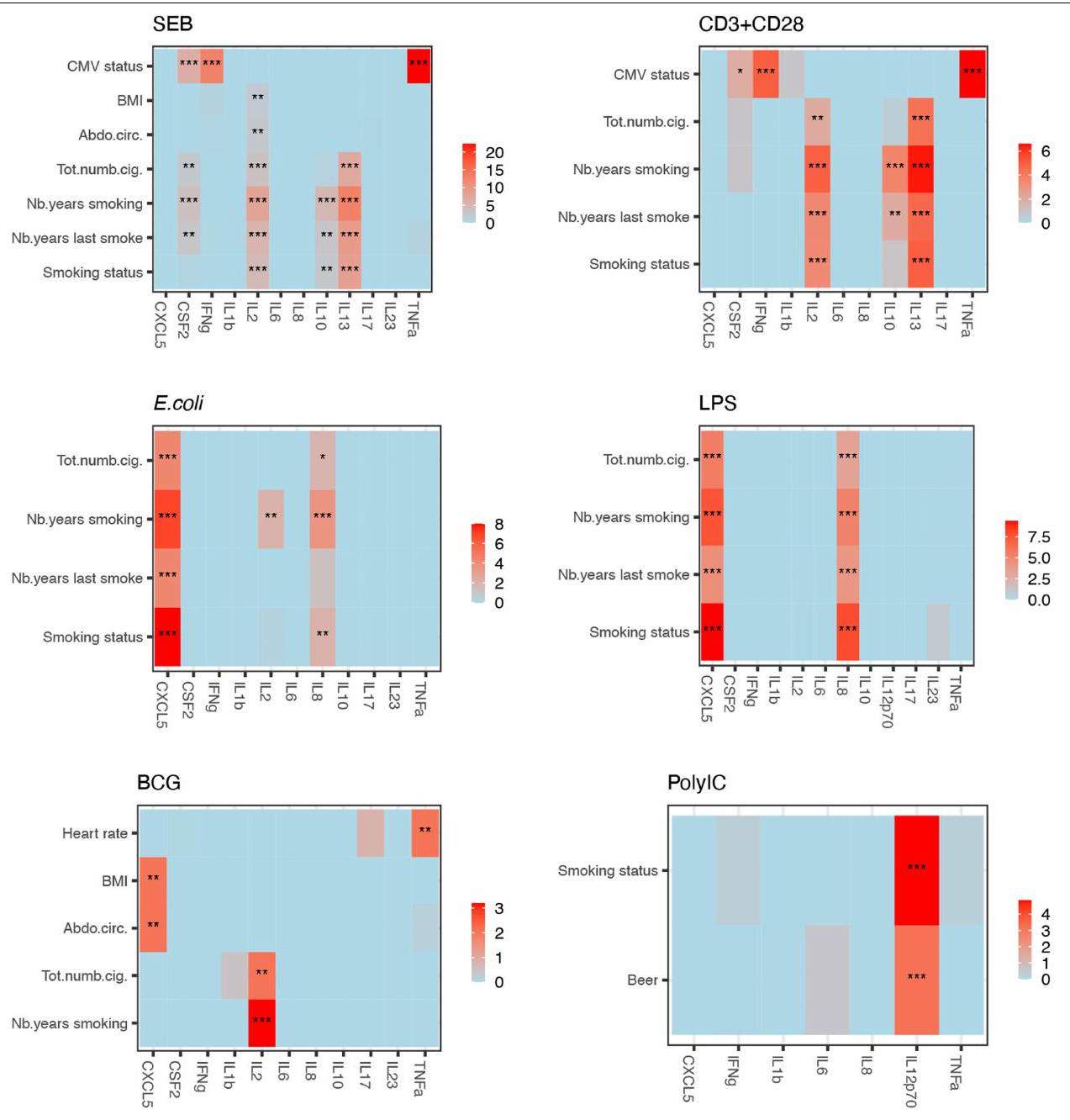
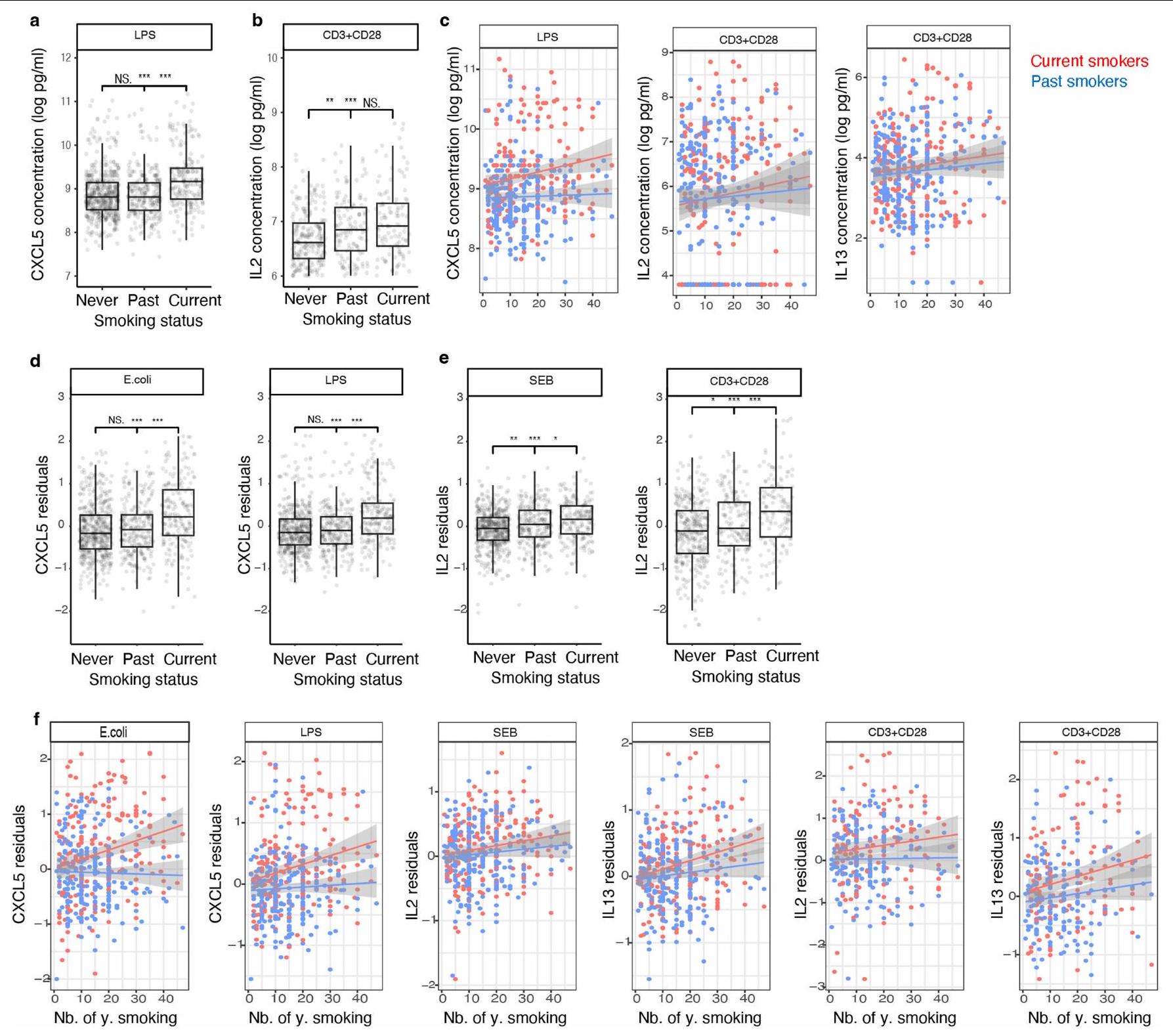
ترتبط المتغيرات المتعلقة بالتدخين بـ IL-2 و IL-13 في تحفيز SEB و anti-CD3 + CD28، وترتبط بـ CXCL5 في تحفيز المناعة الفطرية (الشكل 1c). تدعم هذه الملاحظات النتائج السابقة التي تظهر أن التدخين يعزز الالتهاب ويضعف المناعة ضد العدوى البكتيرية.
العدوى الكامنة مرتبطة بـ CSF2 و IFN
تأثير التدخين مستمر
خلايا المناعة وبروتينات البلازما
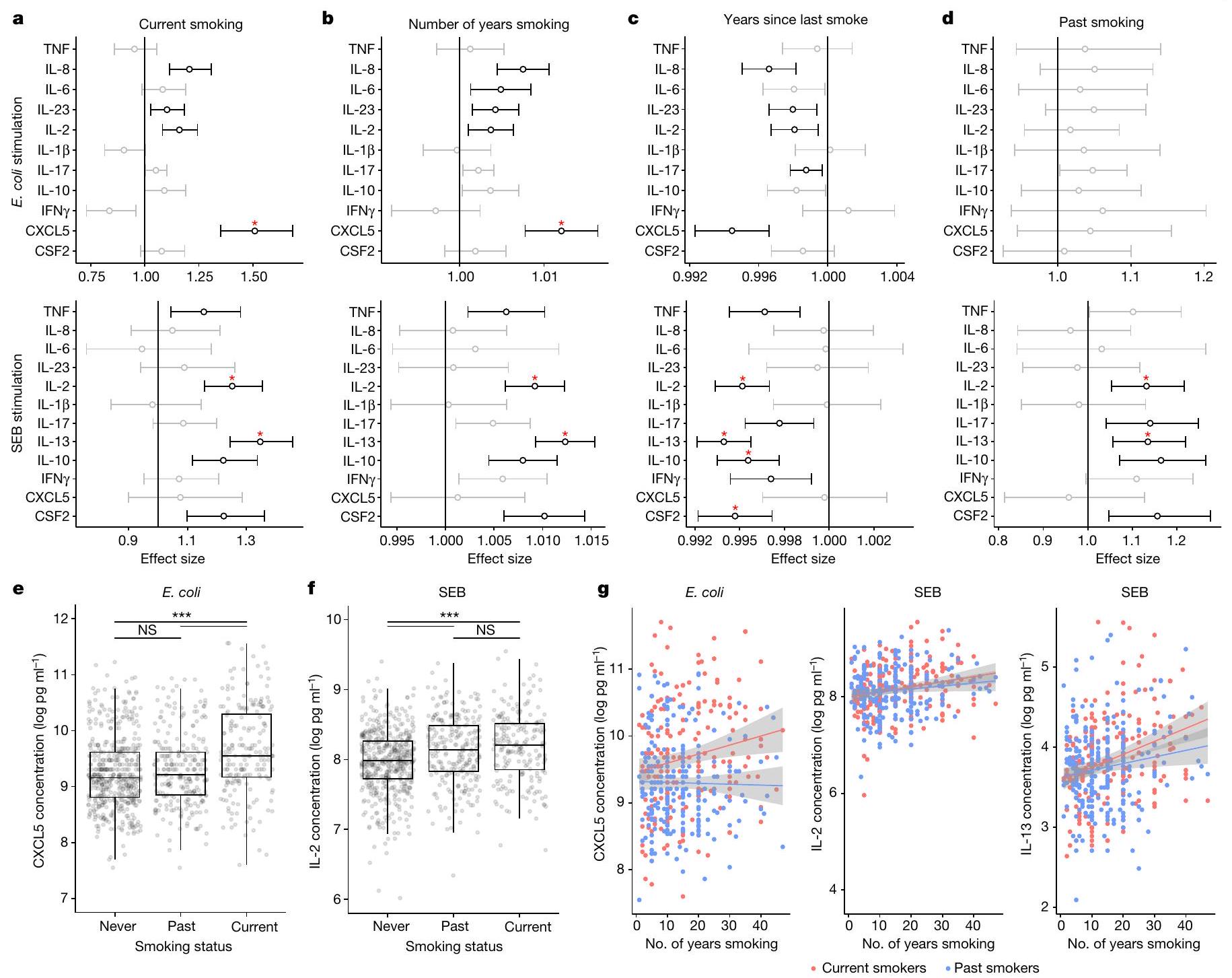
حالة السيروم مع مستويات CSF2 و IFN
عند تضمين جزيء التصاق الخلايا المرتبط بمستضد 6 (CEACAM6) في النماذج، يتم القضاء على العلاقة بين التدخين وCXCL5 بعد التحفيزات المناعية الفطرية، مما يشير إلى أن CEACAM6 متورط في تنظيم CXCL5 لدى المدخنين (الشكل 3ب). نحن نفسر هذا التأثير على أنه تفاعل بيولوجي بدلاً من تحول في تجمعات خلايا المناعة، وذلك بسبب فترة التحفيز القصيرة التي تبلغ 22 ساعة، ولأن تحليل الانحدار الذي يتضمن أعداد الخلايا كمتغيرات مصاحبة (الشكل 3أ) لم يحدد أي ارتباطات خلوية مع العلاقة بين التدخين وCXCL5 الناتجة عن البكتيريا.
تغيرات ميثلة الحمض النووي
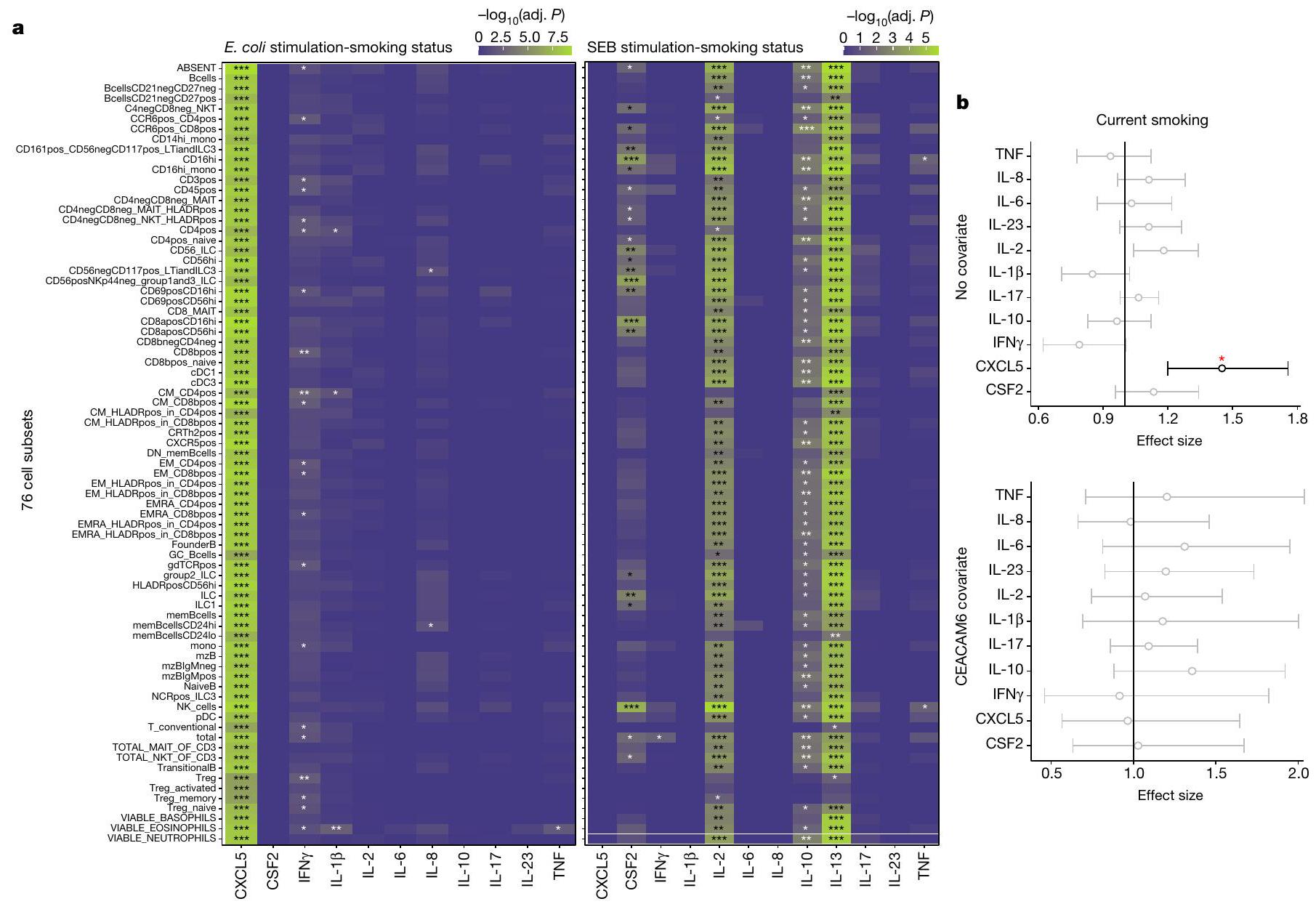
حددنا ما إذا كان التدخين يؤثر على مستويات السيتوكينات من خلال تغييرات في ميثلة الحمض النووي. قمنا بقياس ميثلة الحمض النووي الأساسية في أكثر من
توقف المدخنون عن التدخين يرتبط بشكل إيجابي عام بمستوى ميثيل الحمض النووي لديهم (الشكل 4d). توفر هذه النتائج دليلاً على أن التأثير المستمر للتدخين على الاستجابات المناعية التكيفية مرتبط بميثيل الحمض النووي عند المحفزات التفاعلية وعوامل تنظيم الأيض.
الارتباطات الجينومية
موقع إكسون TLR3، في حين أن pQTLs التي أبلغت عنها دراسة 500FG لهذه السيتوكينات (rs28393318 لـ IL-1
التحفيز ويقع في موقع CR1. تم ملاحظة الثالث في بولي I:C، IL-1
مقالة
| محفز | السيتوكين | معرف rs | معدل
|
سيس أو ترانس | موضع |
| E. كولاي | إنفاي | rs4833095 |
|
ترانز | موضع TLR1/6/10 |
| IL-2 | rs9306967 |
|
ترانز | موضع TLR1/6/10 | |
| IL-6 | rs5743614 |
|
ترانس | موضع TLR1/6/10 | |
| IL-8 | rs4833095 |
|
ترانس | موضع TLR1/6/10 | |
| IL-17a | rs9306967 |
|
ترانس | موضع TLR1/6/10 | |
| IL-23a | rs6815814 |
|
ترانس | موضع TLR1/6/10 | |
| LPS | CXCL5 | rs352045 |
|
سيس | محفز CXCL5 |
| IL-1
|
rs3764613 |
|
ترانس | معزز PPP5C | |
| IL-6 | rs62449491 |
|
سيس | معزز IL6 | |
| IL-10 | rs1518110 |
|
سيس | معزز داخل الجين IL10 | |
| IL-12a/b | rs143060887 |
|
سيز/ترانس | المناطق التنظيمية المحتملة لجين IL12A | |
| SEB | IL-6 | rs11936050 |
|
ترانس | موضع TLR1/6/10 |
| مضاد CD3+CD28 (المستجيبين) | CXCL5 | rs352045 |
|
سيس | محفز CXCL5 |
| IL-2 | rs1801274 |
|
ترانس | قريب من FCGR2A | |
| بي سي جي | CXCL5 | rs10013453 |
|
ترانس | موضع TLR1/6/10 |
| IL-2 | rs4833095 |
|
ترانس | موضع TLR1/6/10 | |
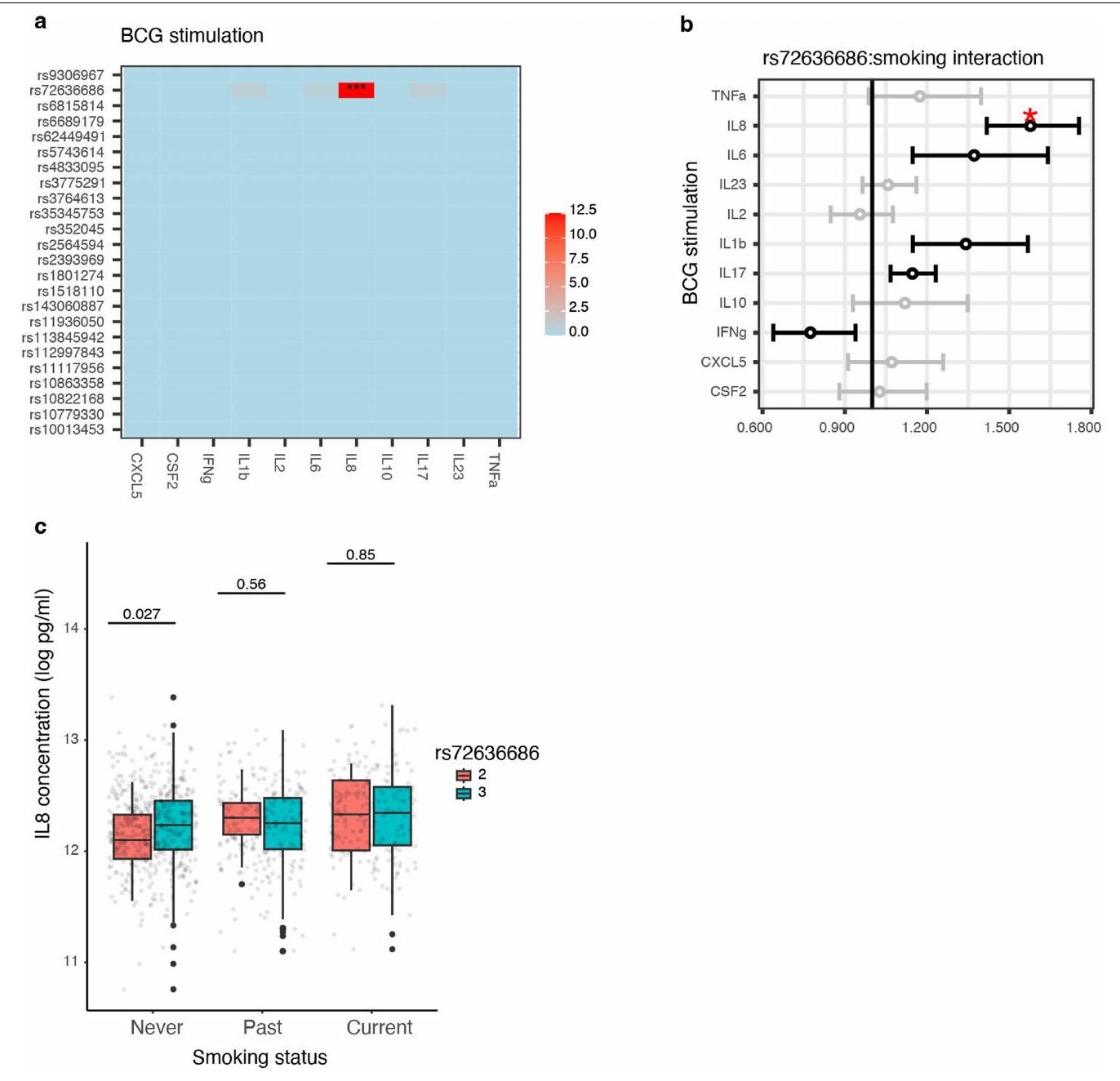
| IL-6 | rs72636686 |
|
ترانس | إنترون كازن | |
| IL-8 | rs4833095 |
|
ترانس | موضع TLR1/6/10 | |
| المبيضات البيض | CXCL5 | rs10779330 |
|
ترانس | موضع CR1 |
| IL-1
|
rs10863358 |
|
ترانس | موضع CR1 | |
| IL-23a | rs10779330 |
|
ترانس | موضع CR1 | |
| TNF | rs11117956 |
|
ترانز | موضع CR1 | |
| إنفلونزا | CXCL5 | rs352045 |
|
سيس | محفز CXCL5 |
| CXCL5 | rs10822168 |
|
ترانس | إنترون JMJD1C | |
| IL-6 | rs35345753 |
|
سيس | معزز IL6 | |
| بولي I:C | CXCL5 | rs352045 |
|
سيس | محفز CXCL5 |
| CXCL5 | rs10822168 |
|
ترانس | إنترون JMJD1C | |
| IFNy | rs3775291 |
|
ترانس | إكسون TLR3 | |
| IL-1
|
rs3775291 |
|
ترانس | إكسون TLR3 | |
| IL-6 | rs62449491 |
|
سيس | معزز IL6 | |
| IL-6 | rs3775291 |
|
ترانز | إكسون TLR3 | |
| IL-12a/b | rs3775291 |
|
ترانس | إكسون TLR3 | |
| TNF | rs113845942 |
|
سيس | منطقة بين الجينات HLA-DRB | |
| TNF | rs3775291 |
|
ترانس | إكسون TLR3 | |
| TNF | CSF2 | rs112997843 |
|
ترانس | المنطقة بين الجينات |
| CXCL5 | rs352045 |
|
سيس | محفز CXCL5 | |
| إنفاي | rs352045 |
|
ترانس | محفز CXCL5 | |
| IL-10 | rs6689179 |
|
سيس | معزز IL10 | |
| IL-1
|
CXCL5 | rs352045 |
|
سيس | محفز CXCL5 |
| CXCL5 | rs2393969 |
|
ترانس | إنترون JMJD1C | |
| IFNy | rs2564594 |
|
ترانس | محفز CXCL5 | |
| IFNy | CXCL5 | rs352045 |
|
سيس | محفز CXCL5 |
| CXCL5 | rs10822168 |
|
ترانس | إنترون JMJD1C |

ومقاومة العدوى الفيروسية
التحفيزات، لكن تحفيز BCG أظهر تفاعلًا جينيًا مع التدخين بشكل ملحوظ (حجم التأثير

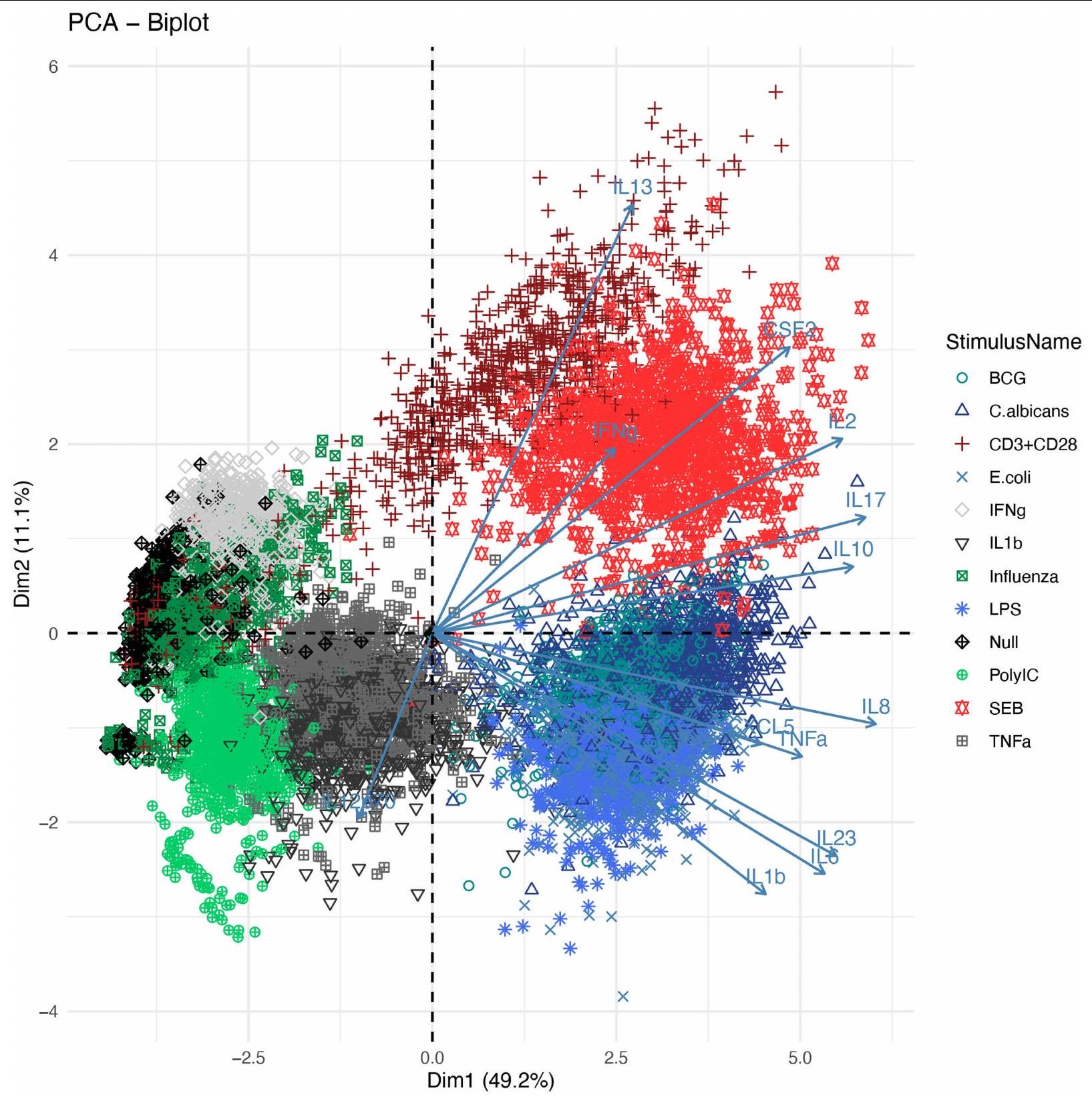
تفسير تباين السيتوكينات
نقاش
يرتبط تأثير التدخين بمجموعات خلايا
يرتبط بزيادة خطر الإصابة بمرض الانسداد الرئوي المزمن وسرطان الرئة
تحديد الشبكات التنظيمية النسخية
المحتوى عبر الإنترنت
- بروتين، ب. وآخرون. التباين في نظام المناعة البشري مدفوع إلى حد كبير بتأثيرات غير وراثية. خلية 160، 37-47 (2015).
- كواش، هـ. وآخرون. التكيف الجيني والاختلاط بالنيندرتال شكل نظام المناعة في السكان البشريين. خلية 167، 643-656.e17 (2016).
- باتين، إ. وآخرون. التباين الطبيعي في معلمات خلايا المناعة الفطرية مدفوع بشكل تفضيلي بالعوامل الجينية. نات. إيمونول. 19، 302-314 (2018).
- بياسيكا، ب. وآخرون. الأدوار المميزة للعمر والجنس والوراثة في تشكيل التباين النسخي للاستجابات المناعية البشرية للتحديات الميكروبية. بروك. ناتل أكاد. ساي. الولايات المتحدة الأمريكية 115، E488-E497 (2018).
- باكر، أ. ب. وآخرون. دمج بيانات متعددة الأوميات والتوصيف العميق يمكّن من التنبؤ باستجابات السيتوكين. نات. إيمونول. 19، 776-786 (2018).
- سالجي، هـ. وآخرون. تقدير عبء SARS-CoV-2 في فرنسا. العلوم 369، 208-211 (2020).
- نيدليك، ي. وآخرون. السلالة الجينية والانتقاء الطبيعي يدفعان الفروق السكانية في الاستجابات المناعية للعوامل الممرضة. خلية 167، 657-669.e21 (2016).
- هادجادج، ج. وآخرون. ضعف نشاط الإنترفيرون من النوع الأول والاستجابات الالتهابية في مرضى COVID-19 الشديد. العلوم 369، 718-724 (2020).
- بروتين، ب. محددات المناعة لتقديم مرض COVID-19 وشدته. نات. ميد. 27، 28-33 (2021).
- لي، ي. وآخرون. التباين بين الأفراد والتأثيرات الجينية على استجابات السيتوكين للبكتيريا والفطريات. نات. ميد. 22، 952-960 (2016).
- ليستون، أ.، كار، إ. ج. ولينترمان، م. أ. تشكيل التباين في نظام المناعة البشري. اتجاهات إيمونول. 37، 637-646 (2016).
- توماس، س. وآخرون. دراسة Milieu Intérieur – نهج تكاملي لدراسة التباين المناعي البشري. كلين. إيمونول. 157، 277-293 (2015).
- لوغادي، أ. أ. وآخرون. تعرض دخان السجائر يزيد من التهاب الرئة ويقوض المناعة ضد العدوى البكتيرية. ج. إيمونول. 192، 5226-5235 (2014).
- ميرتينز، ت. ج. وآخرون. يؤثر دخان السجائر بشكل مختلف على التعبير الجيني المستحث بواسطة IL-13 في خلايا الظهارة الهوائية البشرية. فيزيول. ريب. 5، e13347 (2017).
- بوتوف، د.، كوزهو، م.، ميكاييفا، ن. وبوتوفا، ت. التدخين كعامل خطر ينشط تعدد أشكال جين IL-2 في مرضى MDR-TB. يور. ريسبير. ج. 46، PA4535 (2015).
- شافي، س. وآخرون. CXC ligand 5 هو عامل مشتق من الأنسجة الدهنية يربط السمنة بمقاومة الأنسولين. خلية ميتاب. 9، 339-349 (2009).
- فارغاس، ر. وآخرون. زيادة بروتين C-reactive وانخفاض محتوى إنترلوكين-2 في مصل الأفراد البدينين مع أو بدون مقاومة الأنسولين: ارتباطات مع عدد الكريات البيضاء ومحتوى الأنسولين والأديبونيكتين. داء السكري ميتاب. سندر. كلينيك. ريس. ريف. 10، S34-S41 (2016).
- كارون، ب. وآخرون. تحليل جيني وتكاملي لخلايا المناعة لبروتينات البلازما في المتبرعين الأصحاء يحدد ارتباطات جديدة تتضمن جينات نقص المناعة الأولية. جينوم ميد. 14، 28 (2022).
- بيرغستيدت، ج. وآخرون. العوامل المناعية التي تدفع تباين ميثيل دنا في الدم البشري. نات. كوم. 13، 5895 (2022).
- سون، ب. ب. وآخرون. الأطلس الجينومي للبروتينات البلازمية البشرية. نات. 558، 73-79 (2018).
- فيركينغستاد، إ. وآخرون. الدمج على نطاق واسع للبروتينات البلازمية مع الجينات والأمراض. نات. جينت. 53، 1712-1721 (2021).
- بييتزنر، م. وآخرون. رسم خريطة التقارب البروتيني الجيني للأمراض البشرية. العلوم 374، eabj1541 (2021).
- غودجونسون، أ. وآخرون. دراسة ارتباطات جينية على مستوى الجينوم لبروتينات المصل تكشف عن مواقع مشتركة مع الأمراض الشائعة. نات. كوم. 13، 480 (2022).
- كوبروغلو، م. وآخرون. الروابط البروتينية الجينية بالأمراض الأيضية البشرية. نات. ميتاب. 5، 516-528 (2023).
- لي، ي. وآخرون. نهج الجينوم الوظيفي لفهم التباين في إنتاج السيتوكينات لدى البشر. خلية 167، 1099-1110.e14 (2016).
- أردلي، ك. ج. وآخرون. الجينوم البشري. تحليل الطيار للتعبير الجيني في الأنسجة (GTEx): تنظيم الجينات المتعددة الأنسجة في البشر. ساينس 348، 648-660 (2015).
- تشانغ، سي.، وانغ، و.، تشانغ، إتش.، وي، ل. وغو، إس. ارتباط تعدد أشكال FCGR2A rs1801274 بالاستعداد للأمراض المناعية الذاتية: تحليل تلوي. أونكوتارجت 7، 39436-39443 (2016).
- شتاين، م. م.، هروسش، س. ل.، سبيرلينغ، أ. آي. وأوبر، س. تأثيرات تعدد الأشكال الجينية لفئة FcyRIIA على تعبير الجينات في الكريات البيضاء واستجابات السيتوكين للأجسام المضادة المضادة لـ CD3 و CD28. جينات المناعة. 20، 462-472 (2019).
- ما، ل. وآخرون. ارتباط تعدد أشكال مستقبلات المناعة من النوع 3 rs3775291 مع التنكس البقعي المرتبط بالعمر: مراجعة منهجية وتحليل تلوي. ساي. ريب. 6، 19718 (2016).
- سيروني، م. وآخرون. تعدد أشكال شائع في TLR3 يمنح مقاومة طبيعية لعدوى فيروس نقص المناعة البشرية-1. مجلة المناعة. 188، 818-823 (2012).
- سو، د. وآخرون. تأثيرات مميزة على الإبيجينوم لتدخين التبغ في الدم الكامل وبين أنواع الكريات البيضاء. PLoS ONE 11، e0166486 (2016).
- كريستيانسن، سي. وآخرون. توقيعات جديدة لميثيل الحمض النووي الناتجة عن تدخين التبغ مع تأثيرات عبر عرقية. علم الأوبئة السريرية 13، 36 (2021).
- فيليبورت، ر. وآخرون. عكس إزالة الميثيل من AHRR هو علامة حيوية كمية للإقلاع عن التدخين. فرونت. الطب النفسيhttps://doi.org/10.3389/fpsyt.2016.00055 (2016).
- بوجيسن، س. إ.، تيمبسن، ن.، ريلتون، س.، ديفي سميث، ج. و نوردستغارد، ب. ج. يشير نقص الميثلة في AHRR (cg05575921) إلى سلوك التدخين، والمراضة، والوفيات. ثوراكس 72، 646-653 (2017).
- هارمان-ستمان، ت. وأبل، ج. مثبط مستقبل الأريل هيدروكربون (AhRR): التركيب، التعبير، والوظيفة. الكيمياء الحيوية. 387، 1195-1199 (2006).
- سوكلسكي، ل. أ. وآخرون. دور حاسم لمحور الكيمياء الجذعية CXCL3/CXCL5/CXCR2 في تنظيم الاستجابات من النوع 2 في نموذج تفاقم الربو الناتج عن الفيروسات الأنفية. مجلة المناعة 205، 2468-2478 (2020).
- رو، ج. ك. وآخرون. CEACAM6 هو علامة تنبؤية وعلاجية محتملة لسرطان المعدة. أونكوتارجت 8، 83673-83683 (2017).
- تشن، ج. وآخرون. المستويات المرتفعة من CXCL5 في الدورة الدموية مرتبطة بتدهور وظيفة الرئة لدى مرضى COPD ونموذج الفأر المستحث بالتدخين لمرض COPD. آن. ميد. 51، 314-329 (2019).
- وو، سي.-واي. وآخرون. CEACAM6 كهدف علاجي جديد لتعزيز الدفاع المضاد للأكسدة المعتمد على HO-1 في مرض الانسداد الرئوي المزمن. المجلة الأمريكية للطب التنفسي والعناية الحرجة 207، 1576-1590 (2023).
- سانت-أندريه، ف. أساليب البيولوجيا الحاسوبية لرسم خرائط الشبكات التنظيمية النسخية. مجلة الحوسبة والهياكل الحيوية. 19، 4884-4895 (2021).
(ج) المؤلفون 2024
طرق
عينات بشرية
تحفيز الدم الكامل باستخدام TruCulture
لفصل الخلايا المترسبة عن السائل الفائق ولإيقاف تفاعل التحفيز. تم تقسيم السائل الفائق إلى أجزاء وتم تجميده على الفور عند
تحليل متعدد التحليلات باستخدام Luminex
تحليل المكونات الرئيسية
تصوير تحفيز السيتوكين
تحديد غير المستجيبين لـ CD3 + CD28
اختبارات ارتباط معايير eCRF مع السيتوكينات المحفزة
إلى خرائط الحرارة الكاملة، مع الأخذ في الاعتبار الاختبارات التي أجريت على 136 متغيرًا من CRF مع جميع السيتوكينات المستحثة في تحفيز محدد. بالنسبة للبيانات الموسعة الأشكال 4 و 5، كانت النماذج المقارنة هي Im(sitokine ~ العمر + الجنس + batchID) مع Im(sitokine ~ الجنس + batchID) للعمر و
رسوم بيانية لحجم التأثير
اختبارات ارتباط مجموعة الخلايا
اختبارات ارتباط ميثلة الحمض النووي
خرائط الحرارة توضح تأثيرات المتغيرات المشتركة
كانت كل مجموعة خلوية فرعية، لذا قمنا بمقارنة
تحليلات pQTL
حساب التباين المفسر
ملخص التقرير
توفر البيانات
تُقدم البيانات التكميلية 1 وبيانات eCRF في البيانات التكميلية 2. تُقدم البيانات المصدرية مع هذه الورقة.
توفر الشيفرة
41. باترسون، ن.، برايس، أ. ل. ورايش، د. هيكل السكان والتحليل الذاتي. PLoS Genet. 2، e190 (2006).
42. بهار، د. م. وآخرون. الهيكل الجينومي للشعب اليهودي. نيتشر 466، 238-242 (2010).
43. دافي، د. وآخرون. التحليل الوظيفي من خلال أنظمة تحفيز الدم الكاملة القياسية يحدد حدود الاستجابة المناعية الصحية للمؤثرات المعقدة. المناعة 40، 436-450 (2014).
44. شابالين، أ. أ. مصفوفة eQTL: تحليل eQTL فائق السرعة عبر عمليات المصفوفات الكبيرة. المعلوماتية الحيوية 28، 1353-1358 (2012).
معلومات إضافية
يجب توجيه المراسلات والطلبات للحصول على المواد إلى فيولاين سانت أندري أو داراغ دافي.
معلومات مراجعة الأقران تشكر Nature سام جانس والمراجعين الآخرين المجهولين على مساهمتهم في مراجعة هذا العمل. تقارير مراجعة الأقران متاحة. معلومات إعادة الطبع والتصاريح متاحة علىhttp://www.nature.com/reprints.
مقالة
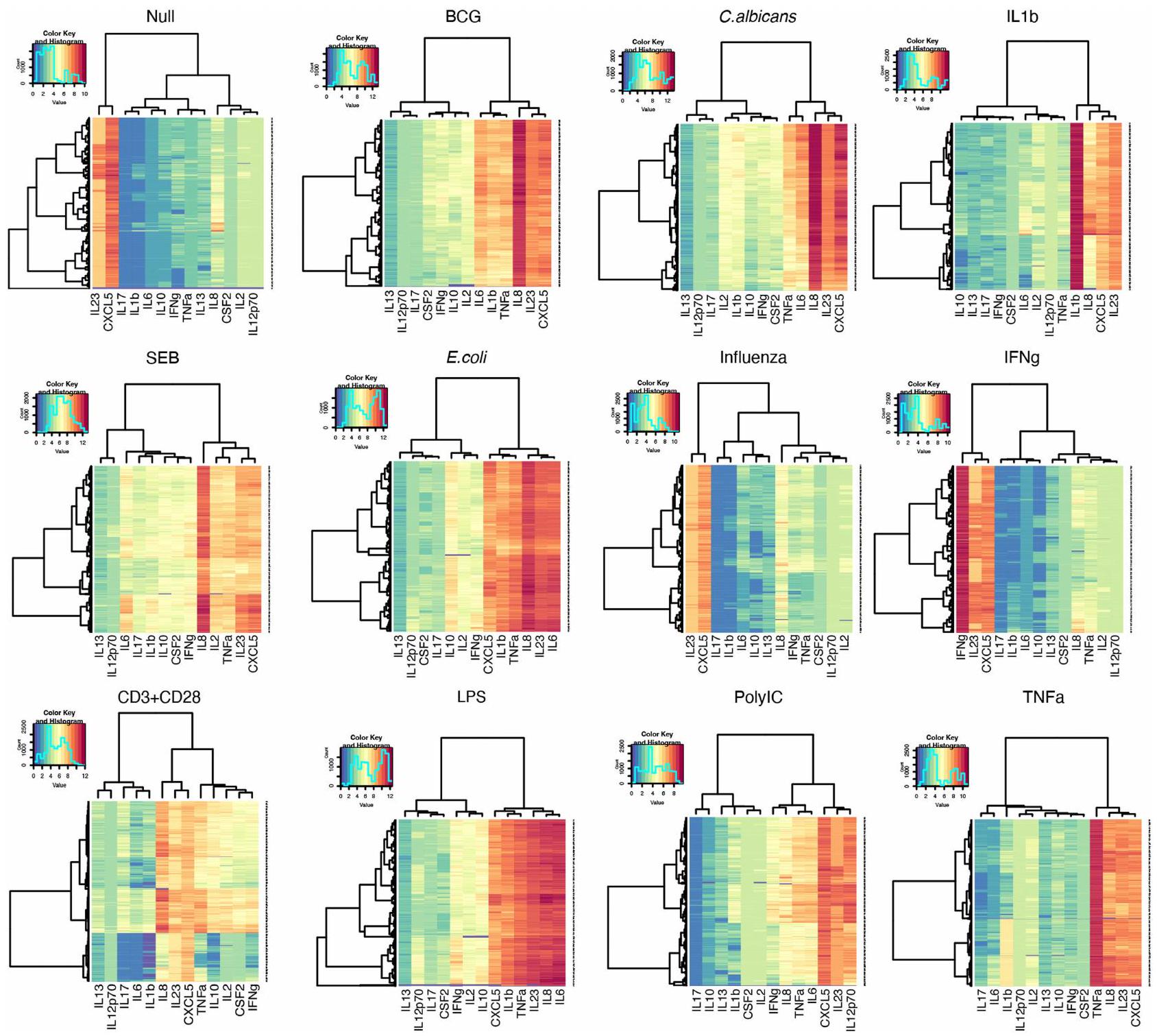
مقالة
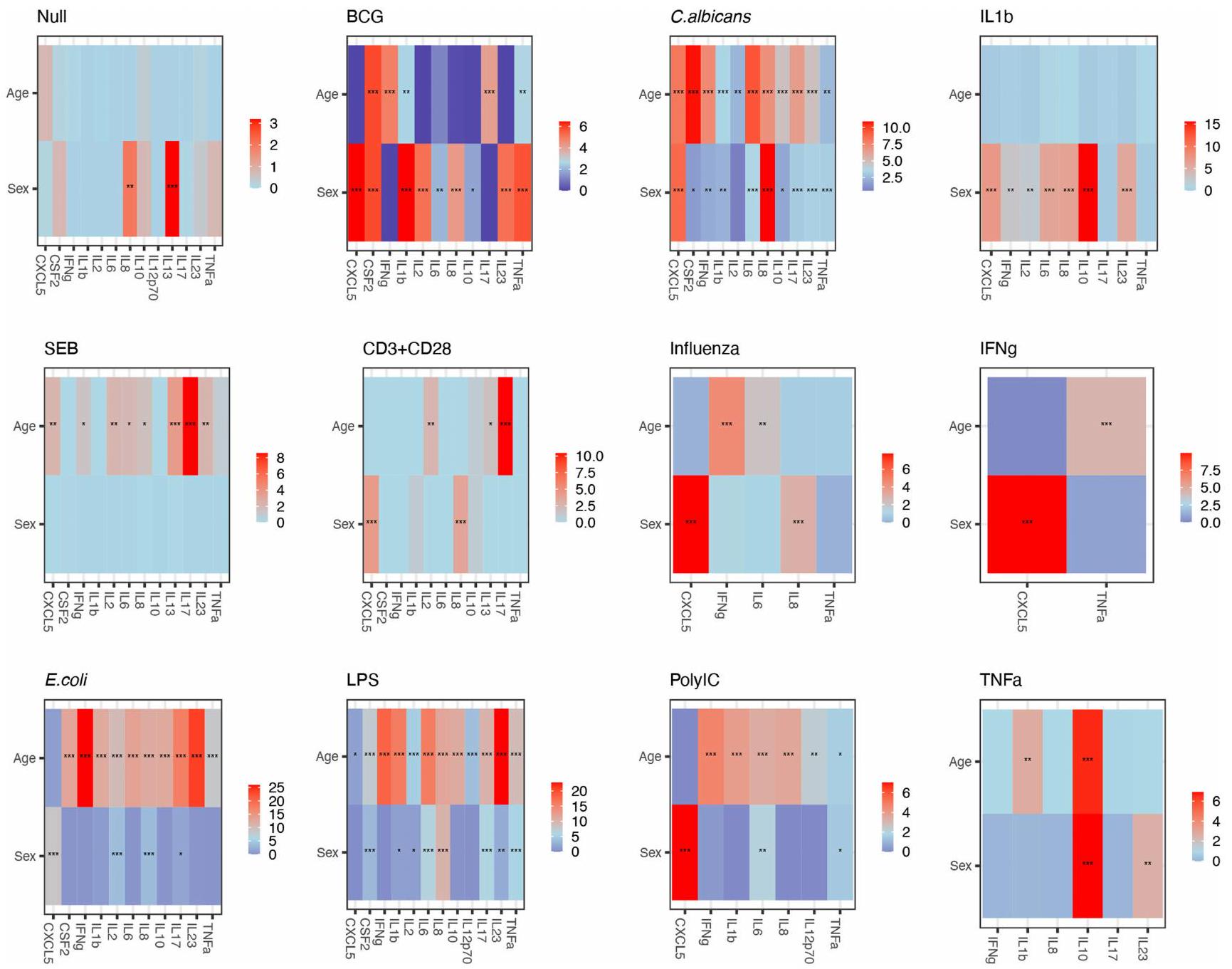

رسوم بيانية لحجم التأثير ذو الجانبين مصنوعة من
لـ 1,000 فرد من مجموعة Milieu Interieur. أحجام التأثير الكبيرة باللون الأسود، والأخرى باللون الرمادي. دلالة اختبار نسبة الاحتمالات المعدلة BY موضحة بالنجوم (*P<0.05؛ **P<0.01؛ ***P<0.001).
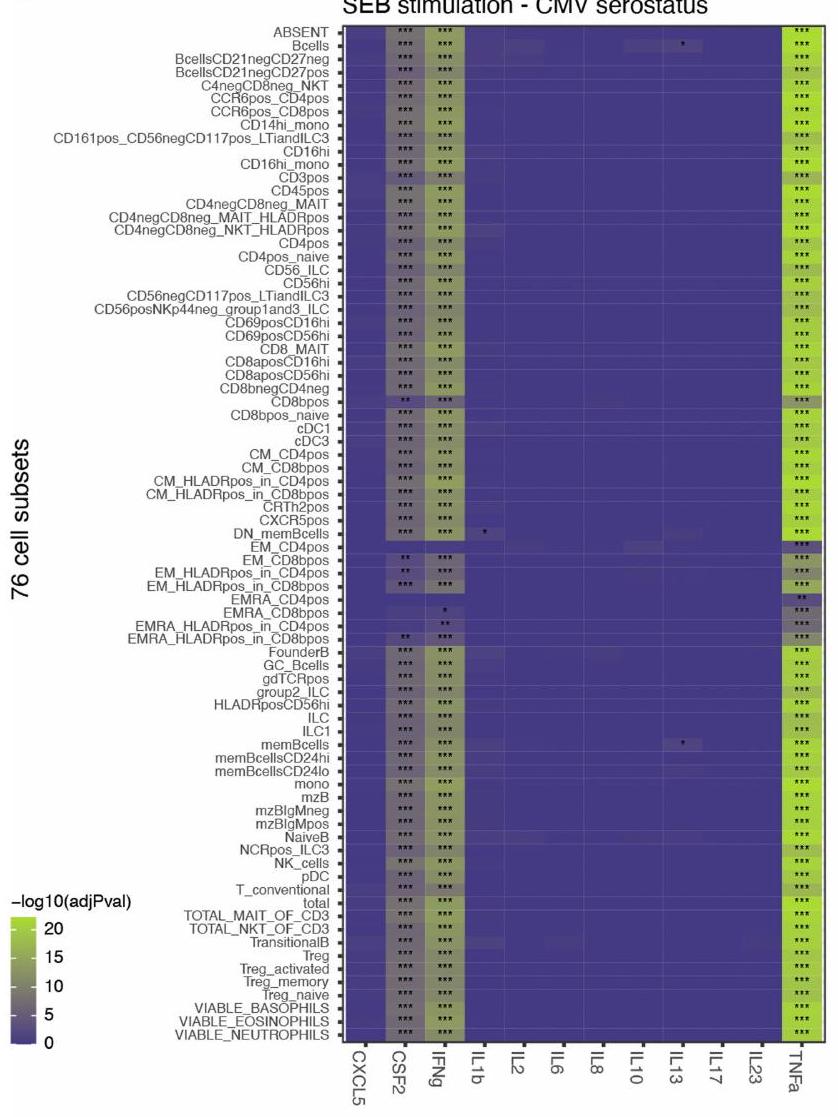
تحفيز SEB. أ، خريطة حرارية تظهر ارتباطات حالة فيروس السيتوميجالي (CMV) مع كل سيتوكين مستحث بعد تحفيز SEB، مع عدم وجود متغير خلوى (الخط العلوي) أو كل من 76 مجموعة خلوية تم تمريرها كمتغيرات في النماذج. دلالة اختبار نسبة الاحتمالات BY adj-pval

المقال
| التحفيز | mepQTL |
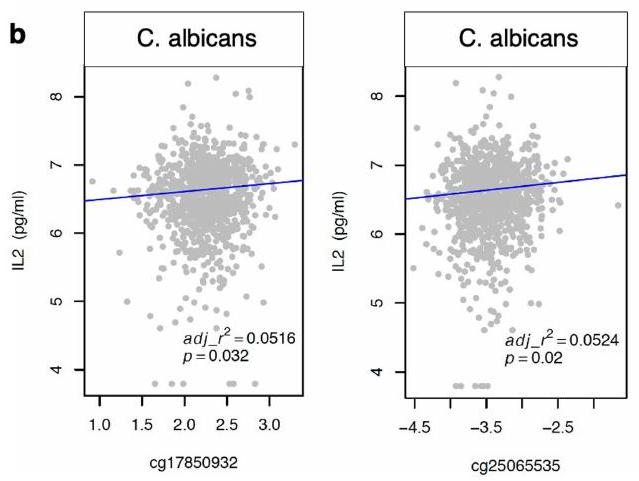
| LPS | IL17(cg09582880*) |
| C.albicans | IL2(cg17850932*, cg25065535*) |
| إنفلونزا | IL8(cg16468729*) |

natureportfolio
آخر تحديث من قبل المؤلف(المؤلفين): 19 أكتوبر 2023
ملخص التقرير
الإحصائيات
X حجم العينة الدقيق (
X
اختبار(اختبارات) الإحصائية المستخدمة وما إذا كانت ذات جانب واحد أو جانبين
يجب وصف الاختبارات الشائعة فقط بالاسم؛ وصف تقنيات أكثر تعقيدًا في قسم الطرق.
X وصف لجميع المتغيرات التي تم اختبارها
وصف لأي افتراضات أو تصحيحات، مثل اختبارات الطبيعية والتعديل للمقارنات المتعددة
X
وصف كامل للمعلمات الإحصائية بما في ذلك الاتجاه المركزي (مثل المتوسطات) أو تقديرات أساسية أخرى (مثل معامل الانحدار) وAND التباين (مثل الانحراف المعياري) أو تقديرات عدم اليقين المرتبطة (مثل فترات الثقة)
X
لاختبار فرضية العدم، إحصائية الاختبار (مثل
لتحليل بايزي، معلومات حول اختيار الأولويات وإعدادات سلسلة ماركوف مونت كارلو
X تقديرات أحجام التأثير (مثل حجم كوهين،
تحتوي مجموعتنا على الإنترنت حول الإحصائيات لعلماء الأحياء على مقالات حول العديد من النقاط أعلاه.
البرمجيات والرمز
جمع البيانات
FlowJo (Treestar)
Illumina Infinium MethylationEPIC BeadChip
Illumina HumanOmniExpress-24 و HumanExome-12 BeadChips
تحليل البيانات
حزمة R ggplot2 3.2.1 (R 3.6.0)
حزمة MatrixEQTL 2.2 R
heatmaply 1.0.0 و dendextend 1.13.12 مع طريقة التجميع “الكاملة” و”المسافة الإقليدية” في (R 3.6.0)
R 4.2.1 باستخدام FactoMineR 2.8
البيانات
معلومات السياسة حول توفر البيانات
- رموز الوصول، معرفات فريدة، أو روابط ويب لمجموعات البيانات المتاحة للجمهور
- وصف لأي قيود على توفر البيانات
- بالنسبة لمجموعات البيانات السريرية أو بيانات الطرف الثالث، يرجى التأكد من أن البيان يتماشى مع سياستنا
المشاركون في الأبحاث البشرية
| التقارير عن الجنس والنوع | تم تصميم المجموعة بشكل خاص لتكون متوازنة بالتساوي من حيث الجنس، 500 رجل و500 امرأة تم تصنيفهم أيضًا حسب العمر (20-69 عامًا). تم تأكيد الجنس (على عكس النوع) من خلال تحليل الكروموسومات الجينية. لتحديد تأثيرات البيئة على استجابات السيتوكين، قمنا بتصحيح كل من العمر والجنس. كما نبلغ عن تأثيرات الجنس المحددة على استجابات السيتوكين. |
| خصائص السكان | تم تجنيد 1000 متبرع من مجموعة Milieu Interieur بواسطة BioTrial (رين، فرنسا) لتكون مكونة من “أفراد أصحاء” من نفس الخلفية الجينية (الغرب الأوروبي) ولتكون هناك 100 امرأة و100 رجل من كل عقد من الحياة، بين 20 و69 عامًا. تم اختيار المتبرعين بناءً على معايير شمول واستبعاد مختلفة تم وصفها سابقًا (توماس وآخرون، 2015). باختصار، كان مطلوبًا من المتبرعين ألا يكون لديهم تاريخ أو دليل على حالات مرضية شديدة/مزمنة/متكررة، أو اضطرابات عصبية أو نفسية، أو إساءة استخدام الكحول، أو استخدام حديث للمخدرات، أو إعطاء لقاح حديث، أو استخدام حديث لوكلاء تعديل المناعة. لتجنب تأثير تقلبات الهرمونات في النساء، لم يتم تضمين النساء الحوامل والنساء في فترة ما قبل انقطاع الطمث. لتجنب التصنيف الجيني في مجموعة الدراسة، تم تقييد تجنيد المتبرعين للأفراد الذين وُلِدَ آباؤهم وأجدادهم في فرنسا الحضرية. |
| التجنيد | جاءت العينات البشرية من مجموعة Milieur Intérieur، وتم تجنيدها بواسطة BioTrial (رين، فرنسا) خلال سبتمبر 2011 – يوليو 2012. الدراسة برعاية معهد باستور (رقم ID-RCB: 2012-A00238-35) وتمت كدراسة تدخلية في مركز واحد دون منتج تجريبي. تم تسجيل البروتوكول الأصلي تحت ClinicalTrials.gov (رقم الدراسة NCT01699893). تم تأسيس العينات والبيانات المستخدمة في هذه الدراسة رسميًا كمجموعة بيانات Milieu Intérieur (NCT03905993)، مع موافقات من لجنة حماية الأشخاص – جنوب البحر الأبيض المتوسط ولجنة المعلومات الوطنية والحريات (CNIL) في 11 أبريل 2018. تم تعريف المتبرعين على أنهم أصحاء بناءً على معايير الشمول/الاستبعاد التي تم وصفها سابقًا في توماس وآخرون، علم المناعة السريرية 2015. |
| الإشراف الأخلاقي | تمت الموافقة على الدراسة من قبل لجنة حماية الأشخاص – غرب 6 في 13 يونيو 2012، ومن قبل الوكالة الفرنسية للأدوية (ANSM) في 22 يونيو 2012. |
التقارير الخاصة بالمجالات
علوم الحياة العلوم السلوكية والاجتماعية العلوم البيئية والتطورية والبيئية
لنسخة مرجعية من الوثيقة مع جميع الأقسام، انظر nature.com/documents/nr-reporting-summary-flat.pdf
تصميم دراسة علوم الحياة
| حجم العينة | تم حساب حجم العينة الأصلي لمجموعة Milieu Interieur
|
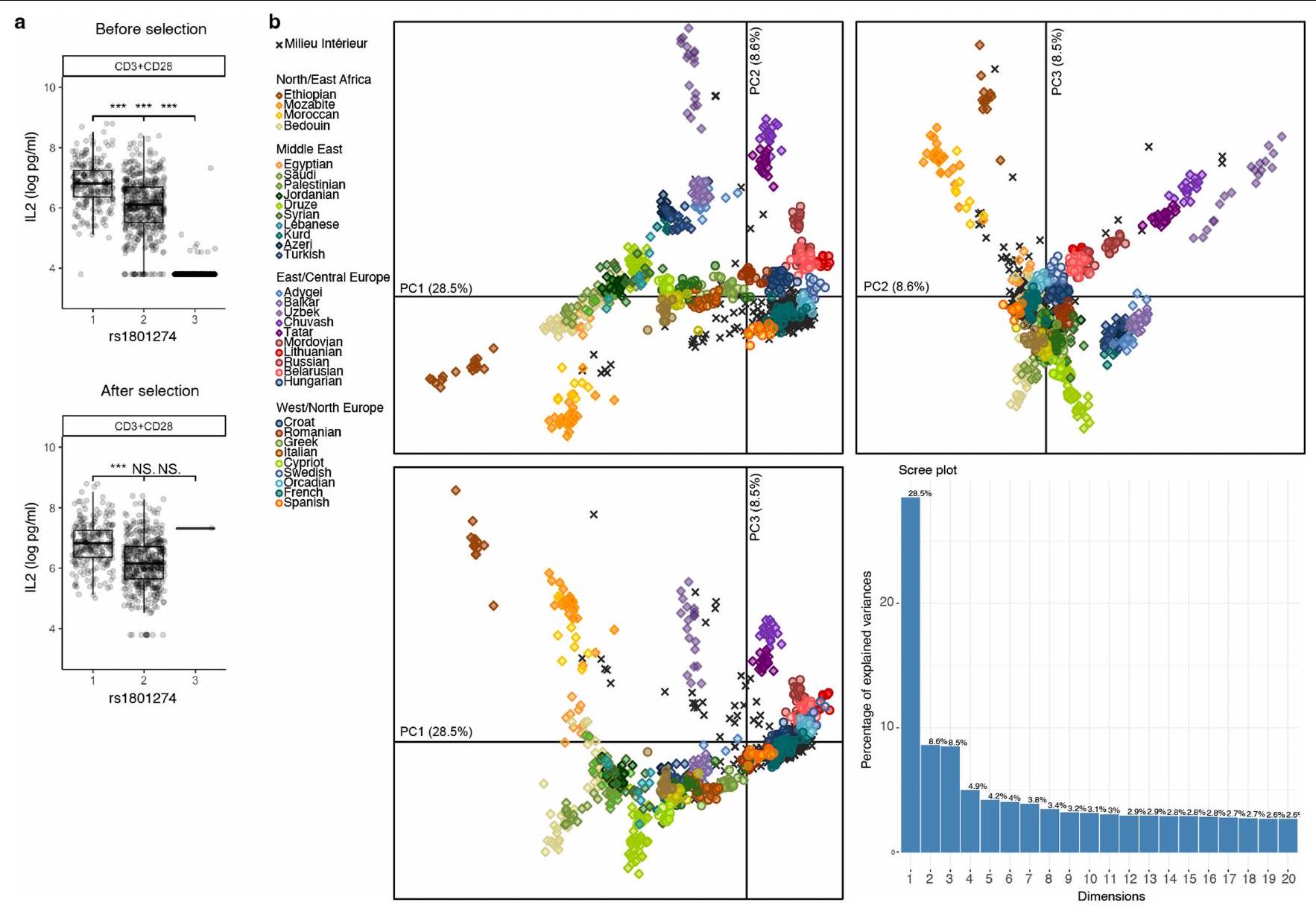
| استبعاد البيانات | بالنسبة لتحفيز CD3+CD28، حددنا من خلال التجميع باستخدام k -means مجموعة من 705 أفراد استجابوا للتحفيز ومجموعة من 295 فردًا لم يستجيبوا. يتم تفسير عدم استجابة 295 فردًا من خلال تعدد أشكال FcγRIIA (rs1801274) الذي تم وصفه سابقًا بأنه يمنع الاستجابة لهذا التحفيز CD3+CD28 (شتاين وآخرون، الجينات والمناعة، 2018) (الشكل التمديدي 9). وبالتالي، تم إجراء جميع التحليلات الإحصائية على تحفيزات CD3+CD28 في هذه الدراسة على 705 مستجيبين فقط. |
| التكرار | نظرًا للطبيعة المحددة للمجموعة ومجموعات البيانات المرتبطة، لم يتم إجراء التكرار. |
التقارير عن المواد والأنظمة والأساليب المحددة
| المواد والأنظمة التجريبية | الطرق | ||
| غير متاح | مشارك في الدراسة | غير متاح | مشارك في الدراسة |
 |
X الأجسام المضادة | X |  |
 |
خطوط الخلايا حقيقية النواة |  |
 |
 |
علم الحفريات وعلم الآثار |  |
التصوير العصبي القائم على الرنين المغناطيسي |
 |
|||
 |
|||
 |
 |
||
الأجسام المضادة
|
تم تحليل السوبرناتانت من أنابيب TruCulture بواسطة Rules Based Medicine (أوستن، تكساس، الولايات المتحدة) باستخدام تقنية Luminex xMAP. تم تحليل العينات وفقًا لإرشادات تحسين مختبرات السريرية (CLIA). تم تحديد الحد الأدنى من كمية القياس (LLOQ) كما تم وصفه سابقًا (دافي وآخرون، المناعة 2014)، وهو أقل تركيز لمحلل في عينة يمكن اكتشافه بشكل موثوق وعندها يلبي الخطأ الكلي متطلبات CLIA لدقة المختبر. معلومات حول سلالات الأجسام المضادة المستخدمة في الاختبار هي ملكية Rules Based Medicine. | ||
| تم إجراء التحقق من كل زوج من الأجسام المضادة المستخدمة في اختبار Luminex بواسطة Rules Based Medicine وفقًا لإرشادات CLIA واختبار الخصوصية والحساسية والتفاعل المتبادل. | |||
| البيانات السريرية | |||
| معلومات السياسة حول الدراسات السريرية | |||
| يجب أن تمتثل جميع المخطوطات لإرشادات ICMJE لنشر الأبحاث السريرية ويجب تضمين قائمة مراجعة CONSORT المكتملة مع جميع التقديمات. | |||
| تسجيل التجارب السريرية | NCT01699893، NCT03905993 | ||
| بروتوكول الدراسة | Clinical trials.gov : NCT01699893، NCT03905993 | ||
| جمع البيانات | تم تجنيد المتبرعين بواسطة BioTrial (رين، فرنسا) خلال سبتمبر 2011 – يوليو 2012. تم توليد البيانات من هذه العينات منذ عام 2012. | ||
| النتائج |
|
||
وحدة المناعة الانتقالية، قسم المناعة، معهد باستور، جامعة باريس سيت، باريس، فرنسا. معهد باستور، جامعة باريس سيت، مركز المعلوماتية الحيوية والإحصاء الحيوي، باريس، فرنسا. تقنيات القياس الخلوي والبيوماركر، مركز الأبحاث الانتقالية، معهد باستور، جامعة باريس سيت، باريس، فرنسا. DATACTIX، باريس، فرنسا. آفاق الابتكار في
 فرنسا.
فرنسا.
معهد الطب البيئي، معهد كارولينسكا، ستوكهولم، السويد. قسم الوبائيات الطبية والإحصاء الحيوي، معهد كارولينسكا، ستوكهولم، السويد. Octant Biosciences، سان فرانسيسكو، كاليفورنيا، الولايات المتحدة. كرسي الجينوم البشري والتطور، كلية فرنسا، باريس، فرنسا. *تظهر قائمة المؤلفين وانتماءاتهم في نهاية الورقة. البريد الإلكتروني: violaine.saint-andre@pasteur.fr; darragh.duffy@pasteur.fr
DOI: https://doi.org/10.1038/s41586-023-06968-8
PMID: https://pubmed.ncbi.nlm.nih.gov/38355791
Publication Date: 2024-02-14
Smoking changes adaptive immunity with persistent effects
Received: 1 November 2022
Accepted: 13 December 2023
Published online: 14 February 2024
Open access
Abstract
Individuals differ widely in their immune responses, with age, sex and genetic factors having major roles in this inherent variability
Smoking, CMV and BMI associations

Smoking-related variables are associated with IL-2 and IL-13 in SEB and anti-CD3 + CD28 stimulations, and they are associated with CXCL5 in innate immune stimulations (Fig.1c). These observations are supported by previous findings showing that smoking favours inflammation and compromises immunity to bacterial infection
latent infection is associated with CSF2, IFN
The smoking effect is persistent
Immune cells and plasma proteins

serostatus with the levels of CSF2, IFN
antigen-related cell adhesion molecule 6 (CEACAM6), when included in the models, eliminates the association of smoking with CXCL5 after innate immune stimulations, suggesting that CEACAM6 is involved in CXCL5 regulation in smokers (Fig. 3b). We interpret this effect as a biological interaction rather than a shift in immune cell populations, owing to the short stimulation period of 22 h and because the regression analysis including cell numbers as covariates (Fig. 3a) did not identify any cellular associations with the bacteria-induced CXCL5-smoking association.
DNA methylation changes

we determined whether smoking affected cytokine levels through DNA methylation changes. We measured baseline DNA methylation at more than
stopped smoking generally positively correlate with their level of DNA methylation (Fig. 4d). These results provide evidence that a persistent effect of smoking on adaptive immune responses is associated with DNA methylation at signal trans-activators and metabolism regulators.
Genomic associations

the TLR3 exon locus, whereas the pQTLs reported by the 500FG study for these cytokines (rs28393318 for IL-1
stimulation and is located in the CR1 locus. The third was observed in poly I:C, IL-1
Article
| Stimulus | Cytokine | rsID | Adjusted
|
cis or trans | Locus |
| E. coli | IFNy | rs4833095 |
|
trans | TLR1/6/10 locus |
| IL-2 | rs9306967 |
|
trans | TLR1/6/10 locus | |
| IL-6 | rs5743614 |
|
trans | TLR1/6/10 locus | |
| IL-8 | rs4833095 |
|
trans | TLR1/6/10 locus | |
| IL-17a | rs9306967 |
|
trans | TLR1/6/10 locus | |
| IL-23a | rs6815814 |
|
trans | TLR1/6/10 locus | |
| LPS | CXCL5 | rs352045 |
|
cis | CXCL5 promoter |
| IL-1
|
rs3764613 |
|
trans | PPP5C enhancer | |
| IL-6 | rs62449491 |
|
cis | IL6 enhancer | |
| IL-10 | rs1518110 |
|
cis | IL10 intronic enhancer | |
| IL-12a/b | rs143060887 |
|
cis/trans | IL12A putative regulatory regions | |
| SEB | IL-6 | rs11936050 |
|
trans | TLR1/6/10 locus |
| Anti-CD3+CD28 (responders) | CXCL5 | rs352045 |
|
cis | CXCL5 promoter |
| IL-2 | rs1801274 |
|
trans | Close to FCGR2A | |
| BCG | CXCL5 | rs10013453 |
|
trans | TLR1/6/10 locus |
| IL-2 | rs4833095 |
|
trans | TLR1/6/10 locus | |
| IL-6 | rs72636686 |
|
trans | KAZN intron | |
| IL-8 | rs4833095 |
|
trans | TLR1/6/10 locus | |
| C. albicans | CXCL5 | rs10779330 |
|
trans | CR1 locus |
| IL-1
|
rs10863358 |
|
trans | CR1 locus | |
| IL-23a | rs10779330 |
|
trans | CR1 locus | |
| TNF | rs11117956 |
|
trans | CR1 locus | |
| Influenza | CXCL5 | rs352045 |
|
cis | CXCL5 promoter |
| CXCL5 | rs10822168 |
|
trans | JMJD1C intron | |
| IL-6 | rs35345753 |
|
cis | IL6 enhancer | |
| Poly I:C | CXCL5 | rs352045 |
|
cis | CXCL5 promoter |
| CXCL5 | rs10822168 |
|
trans | JMJD1C intron | |
| IFNy | rs3775291 |
|
trans | TLR3 exon | |
| IL-1
|
rs3775291 |
|
trans | TLR3 exon | |
| IL-6 | rs62449491 |
|
cis | IL6 enhancer | |
| IL-6 | rs3775291 |
|
trans | TLR3 exon | |
| IL-12a/b | rs3775291 |
|
trans | TLR3 exon | |
| TNF | rs113845942 |
|
cis | HLA-DRB intergenic region | |
| TNF | rs3775291 |
|
trans | TLR3 exon | |
| TNF | CSF2 | rs112997843 |
|
trans | Intergenic region |
| CXCL5 | rs352045 |
|
cis | CXCL5 promoter | |
| IFNy | rs352045 |
|
trans | CXCL5 promoter | |
| IL-10 | rs6689179 |
|
cis | IL10 enhancer | |
| IL-1
|
CXCL5 | rs352045 |
|
cis | CXCL5 promoter |
| CXCL5 | rs2393969 |
|
trans | JMJD1C intron | |
| IFNy | rs2564594 |
|
trans | CXCL5 promoter | |
| IFNy | CXCL5 | rs352045 |
|
cis | CXCL5 promoter |
| CXCL5 | rs10822168 |
|
trans | JMJD1C intron |

and resistance to viral infections
stimulations, but BCG stimulation showed significant genetic-smoking interaction (effect size


Cytokine variance explained
Discussion
The association of the smoking effect with long-lived
is associated with increased risk for chronic obstructive pulmonary disease and lung cancer
identify the transcriptional regulatory networks
Online content
- Brodin, P. et al. Variation in the human immune system is largely driven by non-heritable influences. Cell 160, 37-47 (2015).
- Quach, H. et al. Genetic adaptation and neandertal admixture shaped the immune system of human populations. Cell 167, 643-656.e17 (2016).
- Patin, E. et al. Natural variation in the parameters of innate immune cells is preferentially driven by genetic factors. Nat. Immunol. 19, 302-314 (2018).
- Piasecka, B. et al. Distinctive roles of age, sex, and genetics in shaping transcriptional variation of human immune responses to microbial challenges. Proc. Natl Acad. Sci. USA 115, E488-E497 (2018).
- Bakker, O. B. et al. Integration of multi-omics data and deep phenotyping enables prediction of cytokine responses. Nat. Immunol. 19, 776-786 (2018).
- Salje, H. et al. Estimating the burden of SARS-CoV-2 in France. Science 369, 208-211 (2020).
- Nédélec, Y. et al. Genetic ancestry and natural selection drive population differences in immune responses to pathogens. Cell 167, 657-669.e21 (2016).
- Hadjadj, J. et al. Impaired type I interferon activity and inflammatory responses in severe COVID-19 patients. Science 369, 718-724 (2020).
- Brodin, P. Immune determinants of COVID-19 disease presentation and severity. Nat. Med. 27, 28-33 (2021).
- Li, Y. et al. Inter-individual variability and genetic influences on cytokine responses to bacteria and fungi. Nat. Med. 22, 952-960 (2016).
- Liston, A., Carr, E. J. & Linterman, M. A. Shaping variation in the human immune system. Trends Immunol. 37, 637-646 (2016).
- Thomas, S. et al. The Milieu Intérieur study-an integrative approach for study of human immunological variance. Clin. Immunol. 157, 277-293 (2015).
- Lugade, A. A. et al. Cigarette smoke exposure exacerbates lung inflammation and compromises immunity to bacterial infection. J. Immunol. 192, 5226-5235 (2014).
- Mertens, T. C. J. et al. Cigarette smoke differentially affects IL-13-induced gene expression in human airway epithelial cells. Physiol. Rep. 5, e13347 (2017).
- Butov, D., Kuzhko, M., Makeeva, N. & Butova, T. Smoking as a risk factor which activates IL-2 gene polymorphism in patients with MDR-TB. Eur. Respir. J. 46, PA4535 (2015).
- Chavey, C. et al. CXC ligand 5 is an adipose-tissue derived factor that links obesity to insulin resistance. Cell Metab. 9, 339-349 (2009).
- Vargas, R. et al. Increased C-reactive protein and decreased Interleukin-2 content in serum from obese individuals with or without insulin resistance: associations with leukocyte count and insulin and adiponectin content. Diabetes Metab. Syndr. Clin. Res. Rev. 10, S34-S41 (2016).
- Caron, B. et al. Integrative genetic and immune cell analysis of plasma proteins in healthy donors identifies novel associations involving primary immune deficiency genes. Genome Med. 14, 28 (2022).
- Bergstedt, J. et al. The immune factors driving DNA methylation variation in human blood. Nat. Commun. 13, 5895 (2022).
- Sun, B. B. et al. Genomic atlas of the human plasma proteome. Nature 558, 73-79 (2018).
- Ferkingstad, E. et al. Large-scale integration of the plasma proteome with genetics and disease. Nat. Genet. 53, 1712-1721 (2021).
- Pietzner, M. et al. Mapping the proteo-genomic convergence of human diseases. Science 374, eabj1541 (2021).
- Gudjonsson, A. et al. A genome-wide association study of serum proteins reveals shared loci with common diseases. Nat. Commun. 13, 480 (2022).
- Koprulu, M. et al. Proteogenomic links to human metabolic diseases. Nat. Metab. 5, 516-528 (2023).
- Li, Y. et al. A functional genomics approach to understand variation in cytokine production in humans. Cell 167, 1099-1110.e14 (2016).
- Ardlie, K. G. et al. Human genomics. The genotype-tissue expression (GTEx) pilot analysis: multitissue gene regulation in humans. Science 348, 648-660 (2015).
- Zhang, C., Wang, W., Zhang, H., Wei, L. & Guo, S. Association of FCGR2A rs1801274 polymorphism with susceptibility to autoimmune diseases: a meta-analysis. Oncotarget 7, 39436-39443 (2016).
- Stein, M. M., Hrusch, C. L., Sperling, A. I. & Ober, C. Effects of an FcyRIIA polymorphism on leukocyte gene expression and cytokine responses to anti-CD3 and anti-CD28 antibodies. Genes Immun. 20, 462-472 (2019).
- Ma, L. et al. Association of toll-like receptor 3 polymorphism rs3775291 with agerelated macular degeneration: a systematic review and meta-analysis. Sci. Rep. 6, 19718 (2016).
- Sironi, M. et al. A common polymorphism in TLR3 confers natural resistance to HIV-1 infection. J. Immunol. 188, 818-823 (2012).
- Su, D. et al. Distinct epigenetic effects of tobacco smoking in whole blood and among leukocyte subtypes. PLoS ONE 11, e0166486 (2016).
- Christiansen, C. et al. Novel DNA methylation signatures of tobacco smoking with trans-ethnic effects. Clin. Epigenetics 13, 36 (2021).
- Philibert, R. et al. Reversion of AHRR demethylation is a quantitative biomarker of smoking cessation. Front. Psychiatry https://doi.org/10.3389/fpsyt.2016.00055 (2016).
- Bojesen, S. E., Timpson, N., Relton, C., Davey Smith, G. & Nordestgaard, B. G. AHRR (cg05575921) hypomethylation marks smoking behaviour, morbidity and mortality. Thorax 72, 646-653 (2017).
- Haarmann-Stemmann, T. & Abel, J. The arylhydrocarbon receptor repressor (AhRR): structure, expression, and function. Biol. Chem. 387, 1195-1199 (2006).
- Sokulsky, L. A. et al. A critical role for the CXCL3/CXCL5/CXCR2 neutrophilic chemotactic axis in the regulation of type 2 responses in a model of rhinoviral-induced asthma exacerbation. J. Immunol. 205, 2468-2478 (2020).
- Ru, G. Q. et al. CEACAM6 is a prognostic biomarker and potential therapeutic target for gastric carcinoma. Oncotarget 8, 83673-83683 (2017).
- Chen, J. et al. The elevated CXCL5 levels in circulation are associated with lung function decline in COPD patients and cigarette smoking-induced mouse model of COPD. Ann. Med. 51, 314-329 (2019).
- Wu, C.-Y. et al. CEACAM6 as a novel therapeutic target to boost HO-1-mediated antioxidant defense in COPD. Am. J. Respir. Crit. Care Med. 207, 1576-1590 (2023).
- Saint-André, V. Computational biology approaches for mapping transcriptional regulatory networks. Comput. Struct. Biotechnol. J. 19, 4884-4895 (2021).
(c) The Author(s) 2024
Methods
Human samples
TruCulture whole-blood stimulations
in order to separate the sedimented cells from the supernatant and to stop the stimulation reaction. Liquid supernatants were aliquoted and immediately frozen at
Luminex multi-analyte profiling
Principal components analysis
Cytokine induction visualization
Identification of CD3 + CD28 non-responders
eCRF criteria association tests with induced cytokines
to the whole heat maps, so taking into account the tests made for the 136 CRF variables with all the induced cytokines in a specific stimulation. For Extended Data Figs. 4 and 5, the models compared were Im(cytokine ~ age + sex + batchID) with Im(cytokine ~ sex + batchID) for age and
Effect size plots
Cell subset association tests
DNA methylation association tests
Heat maps showing effects of covariates
was each cell subset, so we compared
pQTL analyses
Computation of variance explained
Reporting summary
Data availability
in Supplementary Data 1 and eCRF data are provided in Supplementary Data 2. Source data are provided with this paper.
Code availability
41. Patterson, N., Price, A. L. & Reich, D. Population structure and eigenanalysis. PLoS Genet. 2, e190 (2006).
42. Behar, D. M. et al. The genome-wide structure of the Jewish people. Nature 466, 238-242 (2010).
43. Duffy, D. et al. Functional analysis via standardized whole-blood stimulation systems defines the boundaries of a healthy immune response to complex stimuli. Immunity 40, 436-450 (2014).
44. Shabalin, A. A. Matrix eQTL: ultra fast eQTL analysis via large matrix operations. Bioinformatics 28, 1353-1358 (2012).
Additional information
Correspondence and requests for materials should be addressed to Violaine Saint-André or Darragh Duffy.
Peer review information Nature thanks Sam Janes and the other, anonymous, reviewer(s) for their contribution to the peer review of this work. Peer review reports are available. Reprints and permissions information is available at http://www.nature.com/reprints.

Article


Article


Two-sided effect size plots made from
for the 1,000 individuals of the Milieu Interieur cohort. Significant effect sizes are in black, others are in grey. Significance of the BY adj-pval likelihood ratio test is marked with stars (*P<0.05;**P<0.01;***P<0.001).


SEB stimulation. a, Heatmap showing associations of the cytomegalovirus (CMV) serostatus with each induced cytokine following SEB stimulation, with either no cellular covariate (top line) or each of 76 cell subsets passed as covariates in the models. Significance of the BY adj-pval likelihood ratio test



Article
| Stimulus | mepQTL |
| LPS | IL17(cg09582880*) |
| C.albicans | IL2(cg17850932*, cg25065535*) |
| Influenza | IL8(cg16468729*) |


natureportfolio
Last updated by author(s): Oct 19, 2023
Reporting Summary
Statistics
X The exact sample size (
X
The statistical test(s) used AND whether they are one- or two-sided
Only common tests should be described solely by name; describe more complex techniques in the Methods section.
X A description of all covariates tested
A description of any assumptions or corrections, such as tests of normality and adjustment for multiple comparisons
X
A full description of the statistical parameters including central tendency (e.g. means) or other basic estimates (e.g. regression coefficient) AND variation (e.g. standard deviation) or associated estimates of uncertainty (e.g. confidence intervals)
X
For null hypothesis testing, the test statistic (e.g.
For Bayesian analysis, information on the choice of priors and Markov chain Monte Carlo settings
X Estimates of effect sizes (e.g. Cohen’s
Our web collection on statistics for biologists contains articles on many of the points above.
Software and code
Data collection
FlowJo (Treestar)
Illumina Infinium MethylationEPIC BeadChip
Illumina HumanOmniExpress-24 and the HumanExome-12 BeadChips
Data analysis
R package ggplot2 3.2.1 (R 3.6.0)
MatrixEQTL 2.2 R package
heatmaply 1.0.0 and dendextend 1.13.12 with “complete” clustering method and “euclidien” distance in (R 3.6.0)
R 4.2.1 using FactoMineR 2.8
Data
Policy information about availability of data
- Accession codes, unique identifiers, or web links for publicly available datasets
- A description of any restrictions on data availability
- For clinical datasets or third party data, please ensure that the statement adheres to our policy
Human research participants
| Reporting on sex and gender | The cohort was specifically designed to be equally balanced in terms of sex, 500 men and 500 women who were also stratified by age (20-69 years old). Sex (as opposed to gender) was confirmed by genetic chromosome analysis. For identification of environmental effects on cytokine responses we corrected for both age and sex. We also report specific sex effects on cytokine responses. |
| Population characteristics | The 1,000 donors of the Milieu Interieur cohort were recruited by BioTrial (Rennes, France) to be composed of “healthy” individuals of the same genetic background (Western European) and to have 100 women and 100 men from each decade of life, between 20 and 69 years of age. Donors were selected based on various inclusion and exclusion criteria that were previously described (Thomas et al., 2015). Briefly, donors were required to have no history or evidence of severe/chronic/ recurrent pathological conditions, neurological or psychiatric disorders, alcohol abuse, recent use of drugs, recent vaccine administration, and recent use of immune modulatory agents. To avoid the influence of hormonal fluctuations in women, pregnant and peri-menopausal women were not included. To avoid genetic stratification in the study population, the recruitment of donors was restricted to individuals whose parents and grandparents were born in Metropolitan France. |
| Recruitment | Human samples came from the Milieur Intérieur cohort, and were recruited by BioTrial (Rennes, France) during September 2011-July 2012. The study is sponsored by Institut Pasteur (Pasteur ID-RCB Number: 2012-A00238-35) and was conducted as a single center interventional study without an investigational product. The original protocol was registered under ClinicalTrials.gov (study# NCT01699893). The samples and data used in this study were formally established as the Milieu Intérieur biocollection (NCT03905993), with approvals by the Comité de Protection des Personnes – Sud Méditerranée and the Commission Nationale de I’Informatique et des Libertés (CNIL) on April 11, 2018. Donors were defined as healthy based on inclusion/exlcusion criteria previously described in Thomas et al, Clinical Immunology 2015. |
| Ethics oversight | The study was approved by Comité de Protection des Personnes – Ouest 6 on June 13th, 2012, and by the French Agence Nationale de Sécurité du Médicament (ANSM) on June 22nd, 2012. |
Field-specific reporting
Life sciences Behavioural & social sciences Ecological, evolutionary & environmental sciences
For a reference copy of the document with all sections, see nature.com/documents/nr-reporting-summary-flat.pdf
Life sciences study design
| Sample size | The original sample size of the Milieu Interieur cohort
|
| Data exclusions | For the CD3+CD28 stimulation, we identified through k -means clustering a group of 705 individuals that responded to the stimulation and a group of 295 individual did not. This lack of response of 295 individuals is explained by a FcүRIIA polymorphism (rs1801274) that was previously described as preventing response to this CD3+CD28 stimulation (Stein et al., Genes and Immunity, 2018) (Extended Data Fig. 9). All statistical analyses on CD3+CD28 stimulations in this study were thus performed on the 705 responders only. |
| Replication | Due to the specific nature of the cohort and associated data sets replication has not been performed. |
Reporting for specific materials, systems and methods
| Materials & experimental systems | Methods | ||
| n/a | Involved in the study | n/a | Involved in the study |
 |
X Antibodies | X |  |
 |
Eukaryotic cell lines |  |
 |
 |
Palaeontology and archaeology |  |
MRI-based neuroimaging |
 |
|||
 |
|||
 |
 |
||
Antibodies
|
Supernatants from TruCulture tubes were analyzed by Rules Based Medicine (Austin, Texas, US) using the Luminex xMAP technology. Samples were analyzed according to the Clinical Laboratory Improvement Amendments (CLIA) guidelines. The lower limit of quantification (LLOQ) was determined as previously described (Duffy et al., Immunity 2014), and is the lowest concentration of an analyte in a sample that can be reliably detected and at which the total error meets CLIA requirements for laboratory accuracy. Information on the antibody clones used in the assay is the propriety of Rules Based Medicine. | ||
| Validation of each antibody pair used in the Luminex assay has been performed by Rules Based Medicine in respect of CLIA guidlines and testing for specificity, sensitivity and cross-reactivity. | |||
| Clinical data | |||
| Policy information about clinical studies | |||
| All manuscripts should comply with the ICMJE guidelines for publication of clinical research and a completed CONSORT checklist must be included with all submissions. | |||
| Clinical trial registration | NCT01699893, NCT03905993 | ||
| Study protocol | Clinical trials.gov : NCT01699893, NCT03905993 | ||
| Data collection | Donors were recruited by BioTrial (Rennes, France) during September 2011-July 2012. Data has been generated from these samples since 2012. | ||
| Outcomes |
|
||
Translational Immunology Unit, Department of Immunology, Institut Pasteur, Université Paris Cité, Paris, France. Institut Pasteur, Université Paris Cité, Bioinformatics and Biostatistics Hub, Paris, France. Cytometry and Biomarkers UTechS, Center for Translational Research, Institut Pasteur, Université Paris Cité, Paris, France. DATACTIX, Paris, France. Frontiers of Innovation in
 France.
France.
Institute of Environmental Medicine, Karolinska Institutet, Stockholm, Sweden. Department of Medical Epidemiology and Biostatistics, Karolinska Institutet, Stockholm, Sweden. Octant Biosciences, San Francisco, CA, USA. Chair Human Genomics and Evolution, Collège de France, Paris, France. *A list of authors and their affiliations appears at the end of the paper. e-mail: violaine.saint-andre@pasteur.fr; darragh.duffy@pasteur.fr
