DOI: https://doi.org/10.1136/bmj-2023-076743
PMID: https://pubmed.ncbi.nlm.nih.gov/38346808
تاريخ النشر: 2024-02-12
التطورات في تشخيص وعلاج سرطان المثانة
المراسلة إلى:
أ. لوبيز-بلتران
em1lobea@gmail.com أو ل. تشينغliang_cheng@yahoo.com
استشهد بهذا كـ: BMJ2024;384:e076743http://dx.doi.org/10.1136/bmj-2023-076743
مقدمة
هي
ترتبط البقاء العام للمرضى بعد استئصال المثانة بالمرحلة المرضية، وحوالي
بينما تظل العلاج الكيميائي القائم على البلاتين مكونًا مهمًا من العلاج للمرضى الذين لديهم مرض نقيل، فإن العلاجات الجديدة الناشئة، بما في ذلك الأجسام المضادة المعتمدة والعلاجات المستهدفة، قد مثلت تحولًا في إدارة سرطان المثانة النقيل.
الملخص
يظل سرطان المثانة سببًا رئيسيًا للوفاة بسبب السرطان في جميع أنحاء العالم ويرتبط بتأثيرات كبيرة على جودة حياة المرضى، والمراضة، والوفيات، وتكلفة نظام الرعاية الصحية. غالبًا ما تسبق البيلة الدموية الخشنة تشخيص سرطان المثانة. يتم إدارة سرطان المثانة غير الغازي للعضلات (NMIBC) في البداية من خلال الاستئصال عبر الإحليل لورم المثانة (TURBT)، يليه نهج مصنف حسب المخاطر للعلاج داخل المثانة المساعد (IVe)، ويرتبط بمعدل بقاء عام قدره 90%. ومع ذلك، تظل معدلات الشفاء أقل لسرطان المثانة الغازي للعضلات (MIBC) بسبب مجموعة متنوعة من العوامل. تعتبر مجموعات NMIBC وMIBC غير متجانسة ولها خصائص مرضية وجزيئية فريدة. في الواقع، حدد مشروع أطلس جينوم السرطان المحركات الجينية وأنماط الجزيئات اللمعية والقاعدية لـ MIBC مع استجابات علاجية مميزة. بالنسبة لـ NMIBC، فإن العلاج المناعي داخل المثانة (بشكل أساسي BCG) هو العلاج القياسي الذهبي لسرطان NMIBC عالي الدرجة وعالي المخاطر لتقليل أو منع كل من التكرار والتقدم بعد TURBT الأولي؛ تشمل التجارب الجديدة مثبطات نقاط التفتيش المناعية. تم مؤخرًا الانتهاء من العلاج الجيني داخل المثانة والعلاج الكيميائي المركب داخل المثانة، مع نتائج واعدة. بالنسبة لـ MIBC الموضعي، فإن الأهداف الأساسية هي تحسين الرعاية وتقليل المراضة بعد استئصال المثانة أو استراتيجيات الحفاظ على المثانة. في المرض النقيل، أدت التقدم في فهم المشهد الجينومي وبيئة الورم الدقيقة إلى تنفيذ مثبطات نقاط التفتيش المناعية، والعلاجات المستهدفة، والأجسام المضادة المعتمدة. إن تحديد معايير اختيار أفضل لتحديد المرضى الأكثر احتمالاً للاستفادة من علاج معين هو حاجة ملحة.
المصادر ومعايير الاختيار
وبائيات
يمكن أن ترتبط التدخلات مثل الإقلاع عن التدخين (بما في ذلك استهلاك التبغ)، وتقليل التعرض السام المهني، وتحسين جودة المياه، مع زيادة استهلاك الفواكه والخضروات، والترطيب الجيد، وتقليل استهلاك اللحوم المعالجة واللحوم الحمراء، بتقليل خطر الإصابة بسرطان المثانة، ولكن يمكن أيضًا أن تحسن الصحة العامة ونتائج الأورام أثناء علاج سرطان المثانة.
الفيزيولوجيا المرضية والخطوات الجزيئية
سرطان المثانة غير الغازي للعضلات
كابح ينظم إشارة الهدف الثديي للماكروبيوتين (mTOR).
سرطان المثانة الغازي للعضلات
على الرغم من أن طفرات FGFR3 أقل شيوعًا في MIBC مقارنة بـ NMIBC، إلا أن ما يصل إلى
تلعب التغيرات الوراثية أيضًا دورًا كبيرًا في تطور MIBC؛ أظهرت التحليلات على مستوى الجينوم أهمية كل من الميثيلين الحمضي للحمض النووي وميثيلين الهيستون في كتم الجينات. توجد اختلافات مميزة
أنواع سرطان المثانة
يعتبر سرطان الظهارة البولية البلازمي نوعًا فرعيًا عدوانيًا يظهر عادة في مرحلة متقدمة. يشترك هذا النوع الفرعي في الكيمياء المناعية والتغيرات الجزيئية مع سرطان الظهارة البولية التقليدي، مثل التلوين لـ KRT7 وp63 وGATA3 وuroplakins، جنبًا إلى جنب مع الطفرات الجينية في TP53 وRB1 وKMT2D وARID1A. ومع ذلك، فإن تطور هذه الأورام مدفوع أيضًا بفقدان الطفرات الوظيفية في CDH1 وارتفاع الميثيلين في المحفز لـ CDH1. من الجدير بالذكر، على النقيض من طفرات CDH1 الجينية التي تُرى في سرطانات المعدة الوراثية المنتشرة ومجموعة فرعية من سرطان الثدي اللوبولي، لم يتم تحديد أي طفرات CDH1 جينية في النوع الفرعي البلازمي.
يمثل سرطان الظهارة البولية الميكروبابيلي نوعًا فرعيًا نادرًا ولكنه عدواني آخر من سرطان المثانة. ينصح العديد من الأطباء بإجراء استئصال المثانة مبكرًا في هذه الأورام، حتى في غياب الغزو في طبقة العضلات. يرتبط هذا الورم عادةً بمعدلات أعلى من التغيرات في ERBB2، وغالبًا ما تكون تضخيمًا أكثر من الطفرات.
سرطان الخلايا الصغيرة/السرطان العصبي الصماوي في المثانة هو نوع نادر من سرطان المثانة متطابق شكليًا مع نظيره في الرئة، وبالمثل فإنه يحمل عادةً تغييرات مشتركة في كل من TP53 و RB1. علاوة على ذلك، تم اكتشاف تغييرات أخرى، بما في ذلك طفرات في محفز TERT وتغييرات تقصيرية.
العرض السريري، التشخيص، وتصنيف المخاطر
سرطان في الموقع بواسطة تنظير المثانة بالفلوريسcence أو التصوير الضيق النطاق، وكلاهما يمكن أن يتم باستخدام معدات تنظير مرنة في العيادة.
العوامل المحددة لبيولوجيا الورم لإبلاغ الإدارة.
تعتبر الدراسات التصويرية للمسالك البولية العليا (لتقييم نظام جمع الكلى) والحالب ضرورية لتقييم المرضى الذين يعانون من الدم في البول ولتقييم أورام الظهارة البولية في المسالك العليا. بينما يمكن تصور الأورام المثانية المتوسطة إلى الكبيرة على التصوير المتباين، فإنها تلعب دورًا ثانويًا في الكشف عن سرطان المثانة. تعتبر الأشعة المقطعية (CT) والتصوير بالرنين المغناطيسي (MRI) من الدراسات التصويرية المفضلة وترتبط بدقة تشخيصية محسنة مقارنةً بالموجات فوق الصوتية. يُطلب إجراء CT أو MRI في المرضى الذين تم تأكيد إصابتهم بـ MIBC لإكمال التصنيف وتقييم إمكانية الانتشار البعيد.
معتبرًا في الأمراض غير الغازية عالية الدرجة (باستثناء سرطان في الموقع فقط) لتحسين دقة التصنيف وزيادة البقاء بدون تكرار. وبالتالي، فإن تكرار TURBT بعد تشخيص سرطان المثانة T1 الجديد يحسن البقاء بدون تكرار والبقاء بدون تقدم خلال خمس سنوات بنسبة
العلاج
علاج سرطان المثانة غير الغازي
يعتبر المرضى الذين يعانون من مرض مستمر أو متفاقم بعد دورة علاج مناسبة مع BCG والذين يعانون من انتكاسة المرض أثناء العلاج بالصيانة غير مستجيبين لـ BCG.
| الجدول 1 | تصنيف المخاطر للجمعية الأمريكية لطب المسالك البولية / جمعية الأورام المسالك البولية لـ NMIBC
|
||||
| منخفض الخطورة | متوسط الخطورة | عالي الخطورة | ||
| PUNLMP | سرطان الظهارة البولية منخفض الدرجة | سرطان الظهارة البولية عالي الدرجة | ||
| سرطان الظهارة البولية منخفض الدرجة | – تكرار خلال عام واحد، LGTa | – T1 | ||
| – Ta و
|
– LGTa الوحيد >3 سم | – أي تكرار، HGTa | ||
| – LGTa، متعدد البؤر | – HGTa >3 سم (أو متعدد البؤر) | |||
| – LGT1 | – أي CIS | |||
| سرطان الظهارة البولية عالي الدرجة | – فشل BCG في مريض عالي الخطورة* | |||
| – Ta
|
– أي نوع نسيجي متغير* | |||
| – أي غزو وعائي لمفاوي* | ||||
| – *أي مشاركة في الإحليل البروستاتي عالي الخطورة | ||||
|
||||
| الجدول 2 | الإدارة الأولية حسب مجموعات خطر NMIBC
|
|
| مجموعة الخطر | الإدارة الأولية |
| منخفض | المراقبة |
| – يجب أن ينظر في حقن واحدة داخل المثانة للعلاج الكيميائي في وقت TURBT | |
| متوسط | العلاج داخل المثانة (المفضل) أو المراقبة |
| – تشمل خيارات العلاج داخل المثانة لمرض الخطورة المتوسطة BCG والعلاج الكيميائي داخل المثانة | |
| عالي | غير مستجيب لـ BCG |
| – ميزات عالية الخطورة جدًا: استئصال المثانة (المفضل) أو BCG | |
| – لا ميزات عالية الخطورة جدًا: BCG (المفضل، الفئة 1) أو استئصال المثانة | |
| غير مستجيب لـ BCG أو غير متحمل لـ BCG | |
| – استئصال المثانة (المفضل) أو العلاج الكيميائي داخل المثانة أو بيمبروليزوماب (المرضى المختارين) أو نادوفاراجين فيرادينوف | |
| BCG = بكتيريا كالميت-غرين؛ NMIBC = سرطان المثانة غير الغازي؛ TURBT = الاستئصال عبر الإحليل لورم المثانة. | |
| الجدول 3 | مجموعات المخاطر للجمعية الأوروبية لطب المسالك البولية لـ NMIBC والعلاج الموصى به
|
|||
| منخفض الخطورة | |||
| – ورم أولي، وحيد، Ta LG/G1 <3 سم في القطر بدون CIS في مريض <70 عامًا | |||
| – ورم أولي LG/G1 مع واحد فقط من عوامل الخطر السريرية الإضافية التالية (العمر >70 عامًا، أورام متعددة، وقطر الورم
|
|||
| – العلاج الموصى به: عرض حقنة واحدة فورية من العلاج الكيميائي داخل المثانة بعد TURBT | |||
| متوسط الخطورة | |||
| – المرضى بدون CIS الذين لا يتم تضمينهم في أي من مجموعات الخطورة المنخفضة أو العالية أو العالية جدًا | |||
| – العلاج الموصى به: لجميع المرضى، إما علاج BCG بجرعة كاملة لمدة عام واحد (التحريض بالإضافة إلى ثلاث حقن أسبوعية في 3، 6، و12 شهرًا) أو حقن العلاج الكيميائي (الجدول الأمثل غير معروف) لمدة أقصاها عام واحد. يجب أن تعكس الاختيار النهائي خطر تكرار المرض وتقدمه لكل مريض بالإضافة إلى فعالية وآثار كل وسيلة علاج. عرض حقنة واحدة فورية من العلاج الكيميائي للمرضى الذين لديهم تكرارات حليمية صغيرة تم اكتشافها بعد أكثر من عام من TURBT السابقة. | |||
| عالي الخطورة | |||
| – جميع T1 HG/G3 بدون CIS، باستثناء أولئك الذين تم تضمينهم في مجموعة الخطر العالية جدًا | |||
| – جميع مرضى متلازمة الالتهاب الحاد، باستثناء أولئك الذين تم تضمينهم في مجموعة المخاطر العالية جداً. | |||
|
|||
| – تا HG/G3 أو T1 LG، بدون CIS مع وجود عاملين خطر على الأقل (اثنان من: العمر >70 سنة، أورام متعددة، وقطر الورم)
|
|||
|
|||
| – العلاج الموصى به: تقديم جرعات كاملة من BCG داخل المثانة لمدة 1-3 سنوات أو استئصال المثانة. | |||
| خطر مرتفع جداً | |||
| – تا HG/G3 و CIS مع جميع عوامل الخطر الثلاثة (العمر >70 سنة، أورام متعددة، وقطر الورم)
|
|||
| – T1 G2 وCIS مع وجود عاملين خطر على الأقل (اثنان من: العمر >70 سنة، أورام متعددة، وقطر الورم)
|
|||
|
|||
| – T1 HG/G3 بدون CIS مع جميع عوامل الخطر الثلاثة (العمر > 70 سنة، أورام متعددة، وقطر الورم)
|
|||
| – العلاج الموصى به: النظر في استئصال المثانة وعرض حقن BCG بجرعة كاملة داخل المثانة لمدة 1-3 سنوات لأولئك الذين يرفضون أو غير مؤهلين لاستئصال المثانة. | |||
|
|||
| الجدول 4 | *احتمالية تقدم المرض عند 1 و 5 و 10 سنوات لمجموعات خطر NMIBC التابعة للرابطة الأوروبية لجراحة المسالك البولية
|
|||||
| جمعية المسالك البولية الأوروبية – مجموعات مخاطر NMIBC | احتمالية التقدم، % (95% فترة الثقة) | ||||
| سنة واحدة | 5 سنوات | 10 سنوات | |||
| دمج الدرجات المنخفضة مقابل العالية (منظمة الصحة العالمية 2004) | |||||
| منخفض | 0.06 (0.01 إلى 0.43) | 0.93 (0.49 إلى 1.7) | 3.7 (2.3 إلى 5.9) | ||
| متوسط | 1.0 (0.50 إلى 2.0) | 4.9 (3.4 إلى 7.0) | 8.5 (5.6 إلى 13) | ||
| عالي | 3.5 (2.4 إلى 5.2) | 9.6 (7.4 إلى 12) | 14 (11 إلى 18) | ||
| مرتفع جداً | 16 (10 إلى 26) | 40 (29 إلى 54) | 53 (36 إلى 73) | ||
| التعاون مع منظمة الصحة العالمية 1973 | |||||
| منخفض | 0.12 (0.02 إلى 0.82) | 0.57 (0.21 إلى 1.5) | 3.0 (1.5 إلى 6.3) | ||
| متوسط | 0.65 (0.36 إلى 1.2) | 3.6 (2.7 إلى 4.9) | 7.4 (5.5 إلى 10) | ||
| عالي | 3.8 (2.6 إلى 5.7) | 11 (8.1 إلى 14) | 14 (10 إلى 19) | ||
| مرتفع جداً | 20 (12 إلى 32) | 44 (30 إلى 61) | ٥٩ (٣٩ إلى ٧٩) | ||
|
|||||
وتصنيف العلاج الرائد الذي يهدف إلى تسريع الطريق لتقديم الطلب إلى إدارة الغذاء والدواء.
لقد أظهرت الكيمياء العلاجية المركبة مع الجيمسيتابين والدوتاكسل أيضًا فعاليتها في حالات عدم الاستجابة لعلاج BCG. تسلط الدراسات الأولية الضوء على إمكانياتها في تعزيز الفعالية العلاجية والتخفيف من آليات المقاومة في كل من الأمراض عالية الخطورة التي لم تتعرض لعلاج BCG والأمراض غير المستجيبة لعلاج BCG.
| الجدول 5 | العلاج الجهازي الأولي للأمراض المتقدمة محليًا أو المنتشرة (المرحلة الرابعة)
|
||||
| مؤهل للسيكلوفسفاميد | الأنظمة المفضلة* | |||
| – جيمسيتابين وسيسبلاتين* (الفئة 1) يتبعه علاج صيانة أفيلوماب (الفئة 1) فقط إذا لم يحدث تقدم في العلاج الكيميائي المحتوي على البلاتين من الخط الأول | ||||
| – ddMVAC* مع دعم عامل النمو (الفئة 1) يتبعه علاج صيانة بالأفيلوماب (الفئة 1) فقط إذا لم يحدث تقدم في العلاج الكيميائي المحتوي على البلاتين في الخط الأول | ||||
| مؤهل للسيكلوبلاتين | الأنظمة المفضلة | |||
|
||||
| أنظمة أخرى موصى بها | ||||
|
||||
| مفيد في ظروف معينة | ||||
|
||||
|
||||
| الجدول 6 | العلاج الجهازي من الخط الثاني للمرض المتقدم محليًا أو المرض النقيلي (المرحلة الرابعة) (بعد العلاج الكيميائي بالبلاتين أو غيره)
|
||||||
| النظام المفضل | بمبروليزوماب (الفئة 1 بعد البلاتين) | |||||
| أنظمة بديلة مفضلة |
|
|||||
| أنظمة أخرى موصى بها |
|
|||||
| مفيد في ظروف معينة بناءً على العلاج الطبي السابق |
|
|||||
علاج سرطان المثانة الغازي للعضلات
بعض المرضى الذين لديهم عقد لمفاوية إيجابية منخفضة الحجم، إلى تحسين النتائج من خلال تصنيف أكثر دقة، وبالتالي قد لا يكون مرتبطًا بتحسين السيطرة على السرطان. أظهرت التجربة المرحلة 3 SWOG S1011، التي عشوائية 592 مريضًا مصابًا بسرطان المثانة الغازي العضلي (cT2-4a N0-2) بنسبة 1:1 لاستئصال العقد اللمفاوية الموسعة أو القياسية، عدم وجود تحسين في البقاء خاليًا من المرض أو البقاء العام مع استئصال العقد اللمفاوية الموسعة مقابل القياسية، وكان استئصال العقد اللمفاوية الموسعة مرتبطًا بمراضة أكبر ووفيات حول العملية.
بعد استئصال المثانة الجذري واستئصال العقد اللمفاوية، يتطلب الأمر تحويل البول. تستخدم جميع أشكال تحويل البول تقريبًا قطعة قصيرة (15 سم) من الأمعاء الدقيقة أو القولون.
يتضمن تحويل البول القاري الاتصال الأورثوتوبي بالإحليل الطبيعي مثل المثانة الجديدة، التي تخلق خزانًا كرويًا، بحجم كافٍ وضغط منخفض مصنوع من الأمعاء المفرغة والمطوية إلى الإحليل؛ وبالتالي، فإن لها ميزة استخدام خزان موجود بشكل طبيعي.
هي خزانات أمعاء مفرغة منخفضة الضغط متصلة بالجلد للتقطير الذاتي، الأكثر شيوعًا منها هو كيس إنديانا. يمكن إجراء كيس إنديانا على المرضى الذين يرغبون في تجنب الفغرة ولكنهم ليسوا مرشحين أو غير راغبين في المثانة الجديدة الأورثوتوبية. يعد اختيار المرضى بناءً على العوامل السريرية والسرطانية مفتاحًا لنجاح تحويل البول وجودة الحياة المتعلقة بالصحة.
العلاج الكيميائي المساعد
العلاج الكيميائي المساعد
مثبطات نقاط التفتيش المناعية المساعدة
تم تعريف المخاطر على أنها
استراتيجية الحفاظ على المثانة مع العلاج الثلاثي الأبعاد
يجمع علاج الثلاثية الوسائط بين استئصال الورم الخبيث عبر المثانة (TURBT) مع العلاج الكيميائي المساعد الحساس للإشعاع والعلاج الإشعاعي الخارجي. يمكن أن تؤدي هذه الاستراتيجية إلى معدلات بقاء محددة للسرطان لمدة خمس سنوات تصل إلى 50%
علاج سرطان المثانة النقيلي
علاجات جديدة.
مؤخراً، أظهر إضافة مثبط نقطة التفتيش المضاد لـ PD1 نيفولوماب إلى العلاج الكيميائي الأولي المكون من جيمسيتابين وسيسبلاتين ميزة في البقاء العام مقارنةً بجيمسيتابين وسيسبلاتين وحده.
اختبار PDL1، الذي يتم قياسه باستخدام اختبارات المناعة النسيجية، هو حاليًا العلامة الحيوية الأكثر تحققًا واستخدامًا وقبولًا لتوجيه اختيار المرضى الذين سيتلقون العلاج بالأجسام المضادة المضادة لـ PD1 أو PDL1. ومع ذلك، لا تزال هناك العديد من التحديات في الاستخدام السريري لهذه الاختبارات، بما في ذلك ضرورة استخدام أنواع مختلفة من
اختبارات التشخيص المرافقة لوكلاء محددين، مستويات عالية من التباين بين الاختبارات من حيث الأداء ونقاط القطع، ونقص في المقارنات المستقبلية حول كيفية PDL1
مثبطات كيناز التيروزين المستهدفة
على التوالي، مع نسبة خطر تبلغ 1.18 (
الأجسام المضادة المرتبطة بالأدوية
خط أو ما بعده.
العلامات الحيوية التنبؤية والتشخيصية
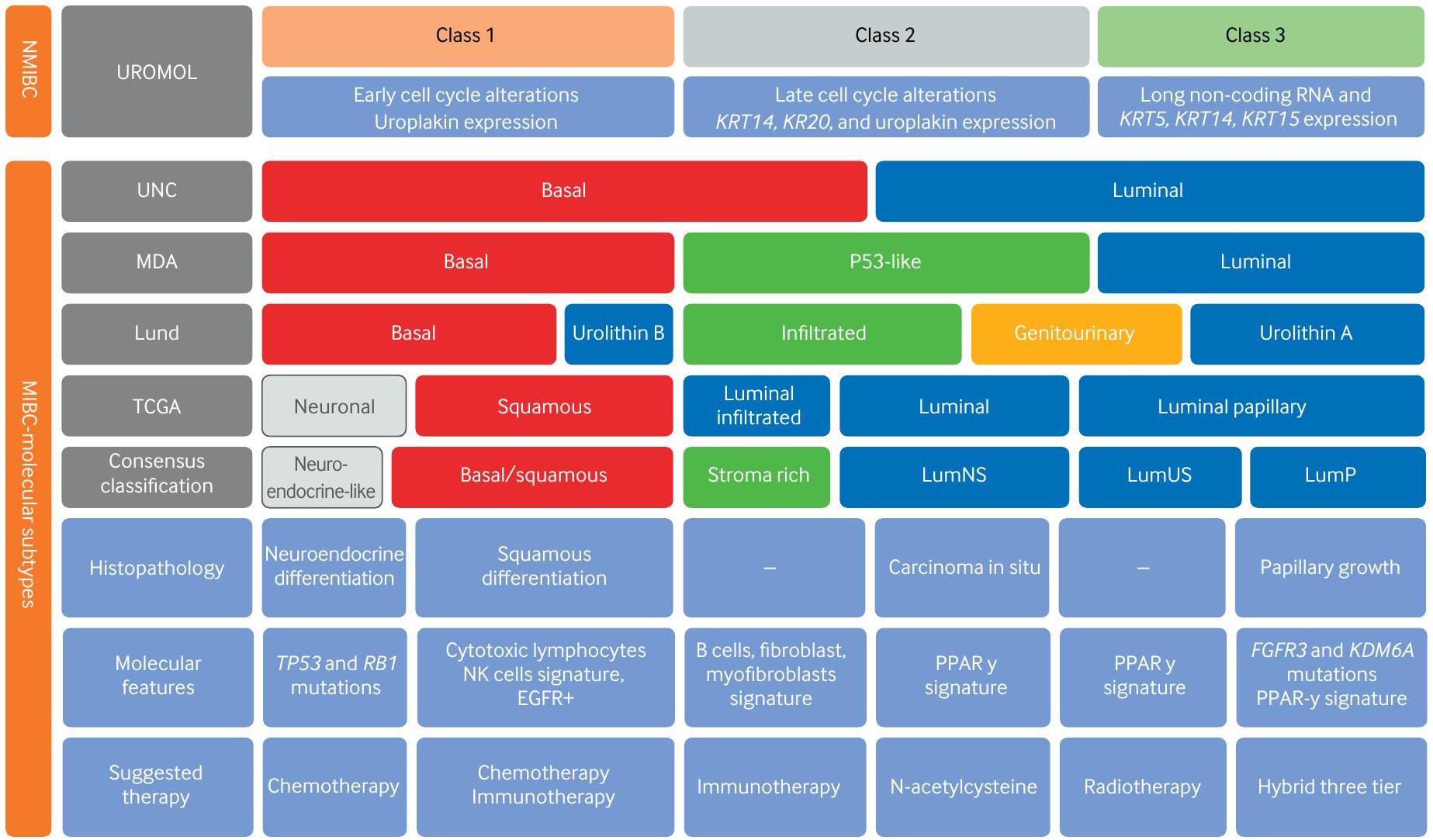
حالياً، كشفت التصنيف الجزيئي التوافقي لسرطان المثانة عن اتفاق على ست فئات جزيئية: اللمعية الحليمية، اللمعية غير المحددة، اللمعية غير المستقرة، الغنية بالستروما، القاعدية الحرشفية، والشبيهة بالعصبية الصماء.
علاوة على ذلك، فإن استخدام العلامات الحيوية للتنبؤ بالاستجابة للعلاج الكيميائي القائم على السيسبلاتين لا يزال قيد البحث، دون تطبيق سريري في الوقت الحالي. ومع ذلك، تؤكد بعض الدراسات على الكشف عن بروتين ERCC1 (مجموعة تكامل إصلاح الإزالة 1) الذي يتفاعل مع ERCC4 لتشكيل مركب إنزيم نووي.
| الجدول 7 | الخصائص المبلغ عنها لأنماط الجزيئات الفرعية لسرطان المثانة العضلي الغزير وآثارها على العلاج | ||||||
| الحليمي اللمعي (24%) | غير محدد لمينال (8%) | غير مستقر لومن (15%) | غني بالستروما (15%) | حرشفي قاعدي (35%) | شبيه الغدد الصماء العصبية (3%) | |
| علم المناعة النسيجية | جاتا 3، فوكسا 1، FGFR3، CK20، يوروبلاكين 2 | جاتا 3، فوكسا 1، FGFR3، CK20، يوروبلاكين 2 | جاتا 3، فوكسا 1، FGFR3، CK20، يوروبلاكين 2 | فيمنتين، ديسمين، SMA | CK5/6، CK14، ديسموجلين 3، STAT3 | INSM1، سينابتوفيزين، كروموجرانين، CD56 |
| علاج مستهدف محتمل | مخاطر منخفضة، مثبطات FGFR3، حساسية منخفضة لـ NAC | الرد على ICI، حساسية منخفضة لـ NAC | استجابة حساسية ICl لـ NAC | غير محدد | استجابة لمثبطات EGFR من ICl، نازع الأكتين سيزبلاتين | استجابة للعلاج الكيميائي المشترك |
| مصطلحات إضافية* | لوند يورو أ مدا لومنال TCGA لومنال بابيلاري UNC لومنال | لوند يورو سي إم دي إيه p53 مثل ولامينال TCGA لامينال UNC لامينال | لوند غير مستقر جينومياً MDA لومنال TCGA لومنال UNC لومنال | لوند ميسينشيمال لايك MDA p53 لايك TCGA بيسال سكواموس UNC بيسال | لوند القاعدي الحرشفي والقائم على infiltrated/ يوروليثين ب MDA القاعدي TCGA القاعدي الحرشفي UNC القاعدي | خلايا لوند الصغيرة / TCGA العصبية الشبيهة بـ NE، UNC القاعدية |
ICI=مثبطات نقاط التفتيش المناعية؛ MDA=مركز ميموريال سلون كيترينغ للسرطان؛ MIBC=سرطان المثانة الغازي للعضلات؛ NAC=العلاج الكيميائي المساعد؛ NE=غدد صماء عصبية؛ TCGA=أطلس جينوم السرطان؛ TMB=عبء الطفرات الورمية؛ UNC=جامعة نورث كارولينا.
- بعض الفئات المقترحة في تصنيفات أخرى تظهر ميزات متداخلة مع ارتباط محدود بينها.
سرطان المثانة النقيلي، مع نتائج محسّنة في هؤلاء المرضى. على العكس من ذلك، يرتبط الإفراط في التعبير عن ERCC1 بأسوأ بقاء عام في سرطان المثانة النقيلي. علاوة على ذلك، ترتبط طفرات ERCC2 بالاستجابة الكاملة المرضية، وتحسين البقاء العام مع العلاج الكيميائي القائم على السيسبلاتين قبل الجراحة في سرطان المثانة العضلي، وتحسين الاستجابات في سرطان المثانة النقيلي.
قد لا تكون استجابة مثبطات نقاط التفتيش كافية.
في السنوات الأخيرة، تم إعطاء الكثير من الاهتمام لحمل الطفرات الورمية، وهو علامة بديلة لإنتاج النيوأنتيجين والقدرة المناعية في TMB.
عدم استقرار الميكروساتلايت مرتبط بحساسية أعلى للعلاج القائم على مثبطات نقاط التفتيش المناعية. عدم استقرار الميكروساتلايت والطفرات في إصلاح تطابق الحمض النووي تعيق نشاط الجينات، مما يؤدي إلى زيادة عبء الطفرات الورمية وزيادة الحساسية لمثبطات نقاط التفتيش المناعية. يمكن أن تحدد عيوب إصلاح التطابق المستجيبين لمثبطات نقاط التفتيش المناعية، وهذا مستقل عن نسيج المنشأ. للأسف، فإن انخفاض انتشار التغيرات في إصلاح التطابق/عدم استقرار الميكروساتلايت في سرطان المثانة يحد من قابلية تطبيق عدم استقرار الميكروساتلايت وإصلاح التطابق في الممارسة العملية.
سرطان المثانة غني بكل من نكتين-4 وTROP2، وهما هدفان سطحيان للخلايا لعلاج ساكيتوزوماب جوفيتيكان وإنفورتوماب فيدوتين، على التوالي. ومن الجدير بالذكر أن البيانات الناشئة تشير إلى أن تعبير نكتين-4 قد يثبت في النهاية أنه مفيد في التنبؤ بالحساسية لـ
| الجدول 8 | العلاج المستهدف المعتمد | |||||||
| الهدف الجزيئي | علاج مستهدف | تجربة سريرية | أهلية المريض | ذراع الدراسة والنتائج | |||
| FGFR3 | إردافيتينيب | BLC2001 | سرطان المثانة المتقدم والعلاج الكيميائي السابق القائم على البلاتين، مع أو بدون العلاج المناعي السابق ومع تغييرات في FGFR (طفرات/اندماجات) |
|
|||
| نيكتين-4 | إنفورتوماب فيدوتين (أجسام مضادة تستهدف نكتين-4 مرتبطة بمركب مثبط للميكروتوبول) | EV-201 | مرض متقدم محليًا أو مرض نقيل غير مؤهل للعلاج بالسيستين، ولم يتلقَ علاجًا كيميائيًا قائمًا على البلاتين سابقًا، وتمت معالجته سابقًا إما بمثبط PD1 أو مثبط PDL1؛ لا حاجة لاختبار العلامات البيولوجية. |
|
|||
| EV-301 | سرطان المثانة المتقدم محليًا غير القابل للجراحة أو النقيلي (بما في ذلك الحالات ذات التمايز الحرشفي أو الأنواع الخلوية المختلطة) التي تم علاجها سابقًا بالعلاج الكيميائي القائم على البلاتين ومثبطات PD1/PDL1؛ لا حاجة لاختبار العلامات البيولوجية |
|
|||||
| تروب2 | سايتوزوماب جوفيتيكان (مركب مضاد للأجسام يستهدف TROP2، ومقترن بـ SN-38، وهو مستقلب نشط للإيرينوتيكان) | تروفي-يو-01 | سرطان المثانة المتقدم الذي تم علاجه سابقًا بالعلاج الكيميائي القائم على البلاتين أو العلاج المناعي؛ لا حاجة لاختبار العلامات البيولوجية |
|
|||
إنفورتوماب فيدوتين.
العلاجات الناشئة والجديدة
NMIBC غير المستجيب، بينما الفيسينيوم (أوبورتوزوماب مونا توكس-كيو كيو آر إس) والعلاج الكيميائي الحراري أيضًا في مراحل مختلفة من عملية الموافقة.
ديستيماب فيدوتين هو مركب مضاد للأجسام المضادة موجه نحو HER2 مع نفس حمولة مثبط الأنابيب الدقيقة مثل إنفورتوماب فيدوتين. في تحليل مشترك لاثنين من التجارب المرحلة الثانية ذات الذراع الواحدة (RC48-C005 و RC48-C009) لـ 107 مرضى إجمالاً مصابين بسرطان الظهارة البولية المتقدم محليًا أو النقيلي الإيجابي لـ HER2، حقق ديستيماب فيدوتين معدل استجابة موضوعية قدره
بالإضافة إلى مثبط نقطة التفتيش المضاد لـ PD1 توريباليماب. حققت هذه التركيبة معدل استجابة موضوعية مؤكد قدره
إرشادات
الخاتمة
أسئلة للبحث المستقبلي
- ما هي العلامات الحيوية لتحسين الكشف عن NMIBC العدواني الذي يتقدم تحت العلاجات القياسية (BCG)؟
- كيف يمكن تحسين الكشف غير الجراحي عن تكرار سرطان المثانة باستخدام المؤشرات الحيوية الجزيئية في البول؟
- ما هي العلامات الحيوية التي تتنبأ بتحسين استجابة العلاج في سرطان المثانة المتقدم محليًا والمنتشر (مثل PDL1، PD1، CTLA4، FGFR3، نكتين-4، TROP2، الأنماط الجزيئية)؟
- هل يمكن تعديل البيئة الدقيقة المناعية لتعزيز العلاجات لسرطان المثانة بشكل أفضل؟
كيف تم إشراك المرضى في إنشاء هذه المقالة
قائمة الاختصارات
- بي سي جي: بكتيريا كالميت-غيران
- CT: التصوير المقطعي المحوسب
- ctDNA: الحمض النووي الورمي المتداول
- ddMVAC: ميثوتريكسات بجرعة كثيفة، فينبلاستين، أدرياميسين، سيسبلاتين
- مجموعة التعاون الشرقي لعلم الأورام
- eLND: استئصال العقد اللمفية الموسع
- ERAS: التعافي المحسن بعد الجراحة
- ERCC: مجموعة تكامل تقاطع إصلاح الاستئصال
- إدارة الغذاء والدواء
- IVe: العلاج داخل المثانة
- سرطان المثانة الغازي للعضلات
- الرنين المغناطيسي: التصوير بالرنين المغناطيسي
- mTOR: الهدف الثديي للراباميسين
- ناي: نوجابندكين ألفا إنباكيسبت
- NCCN: الشبكة الوطنية الشاملة للسرطان
- NMIBC: سرطان المثانة غير الغازي في العضلات
- PD1: بروتين موت الخلايا المبرمج 1
- PDL1: ligand الموت المبرمج 1
- تي جي إف
عامل النمو المحول - عبء الطفرات الورمية
- TNM: ورم، عقدة، نقائل
- TROP2: مستضد سطح الخلايا المشيمية 2
- استئصال ورم المثانة عبر الإحليل
لقد تم دمج مثبطات نقاط التفتيش المناعية، وعلاج الجينات عن طريق الوريد، والعلاج الكيميائي المركب عن طريق الوريد، مع نتائج واعدة في تقليل التكرار والتقدم إلى MIBC.
بالنسبة لسرطان المثانة العضلي الغازي المحلي، فإن تحسين الرعاية وتقليل المراضة بعد استئصال المثانة أو استراتيجيات الحفاظ على المثانة هي أهداف أساسية. في حالة المرض النقيلي، أدت التقدمات في فهم المشهد الجيني وبيئة الورم إلى تنفيذ مثبطات نقاط التفتيش المناعية، والعلاجات المستهدفة، وموصلات الأجسام المضادة والعقاقير، مما يعزز المشهد السريري في حالة متقدمة من المرض. تتلقى العلاج الكيميائي القائم على سيسبلاتين الكثير من الاهتمام في الوقت الحاضر، سواء بمفرده أو بالاشتراك مع العلاج المناعي الجهازي وعلاجات مستهدفة أخرى تم تقديمها مؤخرًا. تمثل هذه الاستراتيجيات الجديدة، التي تقف وراء تحسين جودة حياة المرضى، تحولًا في إدارة كل من المرض المحلي والنقيلي. دور الأساليب التشخيصية المحسنة بما في ذلك تنظير المثانة بالضوء الأزرق والنطاق الضيق لتمييز أفضل بين الأورام الخبيثة و
تمت مراجعة الأنسجة الطبيعية، والبيانات الجزيئية المرتبطة بالبول، وطرق التصوير، والتطبيق المحتمل للذكاء الاصطناعي. هناك حاجة ملحة لتطوير معايير اختيار أفضل لتحديد المرضى الأكثر احتمالاً للاستفادة من علاج معين.
المصالح المتنافسة: لقد قرأنا وفهمنا سياسة BMJ بشأن إعلان المصالح ونعلن عن المصالح التالية: لا شيء.
المساهمون: ساهم جميع المؤلفين بشكل كبير في تصور وتحليل المخطوطة؛ قاموا بصياغة المخطوطة ومراجعتها بشكل نقدي للمحتوى الفكري المهم؛ وافقوا على النسخة النهائية للنشر؛ ويتحملون المسؤولية عن دقة وسلامة المخطوطة.
الأصل ومراجعة الأقران: مُفَوَّض؛ تمت مراجعتها من قبل أقران خارجيين.
2 سيجل RL، جياكوينتو AN، جيمال A. إحصائيات السرطان، 2024. CA Cancer J Clin 2024;74:12-49. doi:10.3322/caac.21820
3 موهنتي إس كيه، لوبيو أ، ميشرا إس كيه، تشينغ ل. الطب الدقيق في سرطان المثانة: التحديات الحالية والاتجاهات المستقبلية. ج. بيرس ميد 2023؛ 13:756. doi:10.3390/jpm13050756
4 فليغ تي دبليو، سبايس بي إي، أبرن م، وآخرون. رؤى إرشادات NCCN: سرطان المثانة، النسخة 2.2022. مجلة الشبكة الوطنية الشاملة للسرطان 2022؛20:866-78. doi:10.6004/jnccn.2022.0041
5 ديرسكيه ل، هانسل دي إي، إيفستاثيو جا، وآخرون. سرطان المثانة. مراجعات الطبيعة للأمراض الأولية 2023؛9:58. doi:10.1038/s41572-023-00468-9
6 كامات إيه إم، هان NM، إيفستاثيو JA، وآخرون. سرطان المثانة. لانسيت 2016؛388:2796-810. doi:10.1016/S0140-6736(16)30512-8
7 كونيتشكوفسكي دي جي، إيفستاثيو جا، موو كيه. الأساليب المعاصرة والناشئة للعلاج الثلاثي الأبعاد للحفاظ على المثانة في حالات سرطان المثانة الغازي للعضلات. هيماتول أونكول كلين نورث أم 2021؛ 35: 567-84. doi:10.1016/j.hoc.2021.02.006
8 لوبيو ن، أفيري ل، موشيني م، وآخرون. علم الأوبئة، الفحص، والوقاية من سرطان المثانة. يور يورول أونكول 2022؛5:628-39. doi:10.1016/j.euo.2022.10.003
9 Pfail JL، Small AC، Cumarasamy S، Galsky MD. النتائج الواقعية للمرضى الذين يعانون من سرطان المثانة: الفعالية مقابل الكفاءة لنماذج العلاج الحديثة. Hematol Oncol Clin North Am 2021؛ 35: 597612. doi:10.1016/j.hoc.2021.01.005
11 فينكاتراماني V، بارك DJ. الجراحة لسرطان المثانة وسرطان الظهارة البولية في المسالك العليا. هيماتول أونكول كلين نورث أم 2021؛ 35: 543-66. doi:10.1016/j.hoc.2021.02.005
12 تران ل، شياو جي إف، أجر وال ن، ديوكس جي إي، ثيودوريسكو د. تقدمات في بيولوجيا وعلاج سرطان المثانة. نات ريف كانسر 2021؛21:10421. doi:10.1038/s41568-020-00313-1
14 Sonpavde GP، Mouw KW، Mossanen M. العلاج لسرطان الخلايا الانتقالية الغازي للعضلات: الجدل والمآزق. J Clin Oncol 2022؛ 40: 1275-80. doi:10.1200/JC0.21.02928
15 نادال ر، كلارا ج. أ، فالدراما ب. ب، بيلمونت ج. العلاج الحالي لسرطان المثانة الانتشاري. هيماتول أونكول كلين نورث أم 2021؛ 35:469-93. doi:10.1016/j.hoc.2021.02.010
16 لوبيز-بلتران أ، سيمادامور أ، مونتيروني ر، تشينغ ل. علم الأمراض الجزيئي لسرطان الظهارة البولية. علم الأمراض البشري 2021؛113:67-83. doi:10.1016/j.humpath.2021.04.001
17 هودجز ك.ب، لوبيز-بلتران أ، دافيدسون د.د، مونتيروني ر، تشينغ ل. خلل التنسج الظهاري والآفات المسطحة الأخرى في المثانة البولية: الميزات السريرية والمرضية والجزيئية. علم الأمراض البشري 2010؛41:15562. doi:10.1016/j.humpath.2009.07.002
19 بري KK، بروكس NA، كامات AM. العلاج الحالي والعوامل الداخلية الناشئة لعلاج سرطان المثانة غير الغازي للعضلات. هيماتول أونكول كلين نورث أم 2021؛ 35: 513-29. doi:10.1016/j.hoc.2021.02.003
20 تشينغ ل، زانغ س، وانغ م، لوبيز-بلتران أ. الآفاق البيولوجية والسريرية لاكتشاف طفرات محفز TERT في تشخيص وإدارة سرطان المثانة. علم الأمراض البشري 2023؛133:56-75. doi:10.1016/j.humpath.2022.06.005
21 دامراور جي إس، رول ك آر، سميث م أ، وآخرون. تحديد علامة جديدة لبيئة الورم الملتهبة كعلامة حيوية تنبؤية للعلاج المناعي باستخدام بكتيريا كالميت-غرين في حالات غير…
سرطان المثانة الغازي للعضلات. أبحاث السرطان السريرية 2021؛27:4599-609. doi:10.1158/1078-0432.CCR-21-0205
22 هيرست سي دي، تشينغ جي، بلات إف إم، وآخرون. تحليل الجزيئات المصنفة حسب المرحلة لسرطان المثانة غير الغازي في العضلات يعزز الفهم البيولوجي والسريري والعلاجي. تقرير الخلايا الطبية 2021؛ 2:100472. doi:10.1016/j.xcrm.2021.100472
23 لوبيز-بلتران أ، بلانكا أ، سيمادامور أ، جوجنا ر، مونتيروني ر، تشينغ ل. التصنيف الجزيئي لسرطان المثانة الانتقائي باستخدام تحليل التعبير الجيني القائم على نانوسترينغ. السرطانات (بازل) 2021؛ 13:5500. doi:10.3390/cancers13215500
24 لوتان ي، دي يونغ ج.ج، ليو ف.ي.ت، وآخرون. المرضى الذين يعانون من سرطان المثانة الغازي للعضلات من النوع غير اللمعي يستفيدون بشكل أكبر من العلاج الكيميائي المساعد القائم على البلاتين. ج. يورول 2022؛207:541-50. doi:10.1097/JU.0000000000002261
25 شياو جي إف، كالييري إيه دبليو، ديوكس جي إي، ثيودوريسكو دي. المسارات القابلة للاستهداف في سرطان المثانة المتقدم: إشارة FGFR. السرطانات (بازل) 2021؛ 13:4891. doi:10.3390/cancers13194891
26 يو إي، بيترلا ك دي بي، أودونيل بي إتش، وآخرون. إنفورتوماب فيدوتين بعد مثبطات PD-1 أو PD-L1 في المرضى غير المؤهلين لسيكلوفسفاميد الذين يعانون من سرطان الظهارة البولية المتقدم (EV201): تجربة متعددة المراكز، ذات ذراع واحدة، من المرحلة الثانية. لانسيت أونكول 2021؛ 22: 872-82. doi:10.1016/S1470-2045(21)00094-2
27 ثيبولت سي، لوريو Y. العلاج المستهدف الناشئ لسرطان المثانة. عيادات الدم والأورام في أمريكا الشمالية 2021؛ 35: 585-96. doi:10.1016/j.hoc.2021.02.011
28 توماس ج، سونبافدي ج. العلاج المستهدف جزيئيًا تجاه التغيرات الجينية في سرطان المثانة المتقدم. السرطانات (بازل) 2022؛ 14:1795. doi:10.3390/cancers14071795
29 بنغ ج، سريدhar س، سيفكر-رادتيك AO، سيلفاراجه س، جيانغ DM. استهداف مسار FGFR في سرطان الظهارة البولية: المستقبل هو الآن. خيارات العلاج الحالية في الأورام 2022؛23:1269-87. doi:10.1007/s11864-022-01009-4
30 بيتريلاك دي بي، دي ويت ر، تشي كين، وآخرون، محققو دراسة RANGE. راموسيروماب بالإضافة إلى دوكسيتاكسل مقابل دواء وهمي بالإضافة إلى دوكسيتاكسل في المرضى الذين يعانون من سرطان الظهارة البولية المتقدم محليًا أو النقيلي بعد العلاج القائم على البلاتين (RANGE): البقاء العام والنتائج المحدثة من تجربة عشوائية مزدوجة التعمية من المرحلة 3. لانسيت أونكول 2020؛21:105-20. doi:10.1016/S1470-2045(19)30668-0
31 Siefker-Radtke AO، Cho DC، Diab A، وآخرون. بيمبيغالديزليوكين بالإضافة إلى نيفولوماب في سرطان الخلايا الانتقالية النقيلي في الخط الأول: نتائج من PIVOT-02. يور يورول 2022؛82:365-73. doi:10.1016/j.eururo.2022.05.002
32 سيفكر-رادتيك AO، نكّي A، بارك SH، وآخرون، مجموعة دراسة BLC2001. فعالية وسلامة إردافيتينيب في المرضى الذين يعانون من سرطان الظهارة البولية المتقدم محليًا أو النقيلي: متابعة طويلة الأمد لدراسة المرحلة الثانية. لانسيت أونكول 2022؛23:248-58. doi:10.1016/S1470-2045(21)00660-4
33 بيل-سيلفا أ، لوبيز-بلتران أ، بلانكا أ، وآخرون. الفائدة السريرية لمثبطات نقاط التفتيش ضد سرطان المثانة النقيلي: التغلب على التحديات لإيجاد طريق للمضي قدمًا. آراء الخبراء في العلاج البيولوجي 2023؛23:40718. doi:10.1080/14712598.2023.2201371
35 وولدو إس إل، شانلي أوز، لوتان واي. معالجة سرطان المثانة غير الغازي في العيادة. مراجعة الخبراء للعلاج المضاد للسرطان 2017؛ 17: 467-80. doi: 10.1080/14737140.2017.1313119
37 سونغ إتش، فيرلاي ج، سيغيل آر إل، وآخرون. إحصائيات السرطان العالمية 2020: تقديرات GLOBOCAN لحدوث ووفيات السرطان في جميع أنحاء العالم لـ 36 نوعًا من السرطان في 185 دولة. CA Cancer J Clin 2021؛ 71: 209-49. doi:10.3322/caac.21660
38 جوبير I، أونغ S، بوكافينا L، وآخرون. وبائيات سرطان المثانة في عام 2023: مراجعة منهجية لعوامل الخطر. يور يورول 2023؛ 84: 176-90. doi:10.1016/j.eururo.2023.03.029
39 تشينغ ل، لوبيز-بيلتران أ، وانغ م، وآخرون. الطفرات المتكررة في محفز إنزيم التيلوميراز العكسي ومُستقبل عامل نمو الألياف 3 تدعم الطبيعة السابقة لفرط تنسج الظهارة البولية الحليمية في المثانة البولية. مود باثول 2023؛ 36: 100151. doi:10.1016/j.modpat.2023.100151
40 غويرسيو بي جي، إير غ، روزنبرغ جي إي. تطوير الطب الدقيق لسرطان المثانة. مجلة أمراض الدم والأورام السريرية في أمريكا الشمالية 2021؛ 35: 633-53. doi:10.1016/j.hoc.2021.02.008
41 هونغ م، هي ج، جوه س، وآخرون. المؤشرات الحيوية لتشخيص سرطان الظهارة البولية الدقيق: الأساليب الحالية وتطبيق تقنيات الخلايا المفردة. السرطانات (بازل) 2021؛ 13:260. doi:10.3390/cancers13020260
42 مككونكي دي جي. البيولوجيا الجزيئية لسرطان المثانة: الآثار المحتملة للعلاج. هيماتول أونكول كلين نورث أم 2021؛ 35:45768. doi:10.1016/j.hoc.2021.02.009
44 سانلي أ، دوبروتش ج، نولز م أ، وآخرون. سرطان المثانة. نات ريف ديس برايمرز 2017؛3:17022. doi:10.1038/nrdp.2017.22
45 Sjödahl G، Eriksson P، Patschan O، وآخرون. التغيرات الجزيئية خلال التقدم من سرطان الظهارة البولية غير الغازي إلى سرطان الظهارة البولية المتقدم. المجلة الدولية للسرطان 2020؛ 146:2636-47. doi:10.1002/ijc.32737
46 دي يونغ FC، لايالا TD، هوديمكير RF، وآخرون. الأنماط الجزيئية لسرطان المثانة غير الغازي تتنبأ بالاستجابة المختلفة لبكتيريا باسيلوس كالميت-غيرين داخل المثانة. ساي ترانسل ميد 2023؛15:eabn4118. doi:10.1126/scitranslmed.abn4118
47 Ma J، بلاك بي سي. العلاج الحالي المحيط بالعمليات لجراحة سرطان المثانة الغازي للعضلات. هيماتول أونكول كلين نورث أم 2021؛ 35: 495-511. doi:10.1016/j.hoc.2021.02.002
48 كاردوست بارزي م، شاريت س ف، مارغوليس ف، موري ك، لوتان ي. قيمة خلايا المناعة المتسللة إلى الورم في التنبؤ بالاستجابة للعلاج بالـ BCG داخل المثانة لدى المرضى الذين يعانون من سرطان المثانة غير الغازي للعضلات: مراجعة منهجية وتحليل تلوي. BJU Int 2021؛ 127: 617-25. doi:10.1111/bju.15276
49 تشانغ إس إس، بوريجان إس إيه، تشو ر، وآخرون. تشخيص وعلاج سرطان المثانة غير الغازي للعضلات: إرشادات AUA/SUO. مجلة المسالك البولية 2016؛ 196: 1021-9. doi:10.1016/j.juro.2016.06.049
50 الشبكة الوطنية الشاملة لمكافحة السرطان. إرشادات NCCN لسرطان المثانة V.3.2023.https://www.nccn.org/professionals/الطبيب_gls/pdf/المثانة.pdf
51 بابيوك م، بورجر م، كابون أ، وآخرون. إرشادات الجمعية الأوروبية لطب المسالك البولية حول سرطان المثانة غير الغازي للعضلات (Ta، T1، وسرطان في الموقع). يور يورول 2022؛ 81: 75-94. doi:10.1016/j.eururo.2021.08.010
52 ليرنر إس بي، تانجن سي، سفاك آر إس، وآخرون. SWOG S1011: تجربة جراحية من المرحلة الثالثة لتقييم فائدة استئصال العقد اللمفاوية القياسي مقابل الاستئصال الموسع الذي يتم إجراؤه في وقت استئصال المثانة الجذري لسرطان الظهارة البولية الغازي في العضلات. ج Clin Oncol 2023؛ 41:4508. doi:10.1200/JCO.2023.41.16_suppl. 4508
53 كاتو جي دبليو إف، خيترا بال بي، ريتشياردي إف، وآخرون، فريق دراسة iROC. تأثير استئصال المثانة الجذري بمساعدة الروبوت مع تحويل البول داخل الجسم مقابل استئصال المثانة الجذري المفتوح على المراضة والوفيات خلال 90 يومًا بين مرضى سرطان المثانة: تجربة سريرية عشوائية. جاما 2022؛327:2092-103. doi:10.1001/jama.2022.7393
54 الحسين العواملة ب، تشانغ إس إس. علاجات جديدة لسرطان المثانة غير الغازي عالي المخاطر. تقارير الأورام الحالية 2023؛ 25: 83-91. doi:10.1007/s11912-022-01350-9
55 تعاون تحليل البيانات الشاملة لسرطان المثانة المتقدم (ABC). العلاج الكيميائي المساعد في سرطان المثانة الغازي: تحديث لمراجعة منهجية وتحليل شامل لبيانات المرضى الفردية في سرطان المثانة المتقدم (ABC) تعاون تحليل البيانات الشاملة. يور يورول 2005؛ 48: 202-5، مناقشة 205-6. doi:10.1016/j.eururo.2005.04.006
56 من مااس ه، هانسن س و، روبرتس ج ت، وآخرون. جيمسيتابين وسيسبلاتين مقابل ميثوتريكسات، فينبلاستين، دوكسوروبيسين، وسيسبلاتين في سرطان المثانة المتقدم أو النقيلي: نتائج دراسة كبيرة، عشوائية، متعددة الجنسيات، متعددة المراكز، من المرحلة الثالثة. ج كلين أونكول 2000؛ 18: 3068-77. doi:10.1200/JCO.2000.18.17.3068
57 فيستار سي، غرافيس جي، فليتشون أ، وآخرون، محققو تجربة فيسبير. العلاج الكيميائي المحيطي باستخدام الميثوتريكسات، الفينبلاستين، الدوكسوروبيسين، والسيكلوفسفاميد أو الجيمسيتابين والسيكلوفسفاميد للمرضى الذين يعانون من سرطان المثانة الغازي العضلي غير النقيلي: نتائج تجربة GETUG-AFU V05 فيسبير. ج Clin Oncol 2022؛40:2013-22. doi:10.1200/JCO.21.02051
58 جالسكي MD، هان NM، روزنبرغ J، وآخرون. تعريف متفق عليه للمرضى الذين يعانون من سرطان الظهارة البولية النقيلي والذين لا يصلحون للعلاج الكيميائي القائم على السيسبلاتين. لانسيت أونكول 2011؛12:211-4. doi:10.1016/S1470-2045(10)70275-8
59 جيانغ دي إم، غوبتا إس، كيتشلو أ، وآخرون. تحديد أهلية السيكلوفسفاميد في المرضى الذين يعانون من سرطان المثانة الغازي للعضلات. مراجعة طبيعية لأمراض المسالك البولية 2021؛ 18: 104-14. doi:10.1038/s41585-020-00404-6
60 حسين SA، بالمر DH، لويد B، وآخرون. دراسة حول العلاج الكيميائي المساعد القائم على السيكلوفسفاميد بجرعات مقسمة في سرطان المثانة الغازي للعضلات. أونكول ليت 2012؛3:855-9. doi:10.3892/ol.2012.563
61 مجموعة متعاونين في التحليل التلوي لسرطان المثانة المتقدم (ABC). العلاج الكيميائي المساعد لسرطان المثانة الغازي للعضلات: مراجعة منهجية وتحليل تلوي لبيانات المشاركين الفرديين من التجارب السريرية العشوائية. يور يورول 2022؛ 81: 50-61. doi:10.1016/j.eururo.2021.09.028
62 باجورين DF، ويتجس JA، غشويند JE، وآخرون. نيفولوماب المساعد مقابل الدواء الوهمي في سرطان الظهارة البولية الغازي للعضلات. نيو إنجلاند/ ميد 2021؛384:2102-14. doi:10.1056/NEJMoa2034442
63 جالسكي MD، ويتجس AA، غشويند JE، وآخرون. نتائج المتابعة الممتدة من تجربة CheckMate 274. J Clin Oncol 2023;41:LBA443-43. doi:10.1200/JCO.2023.41.6_suppl.LBA443
64 ميرك. KEYTRUDA حسنت بشكل كبير من فترة البقاء خالية من المرض كعلاج مساعد مقارنة بالمراقبة للمرضى الذين يعانون من سرطان المثانة الانتقالي الموضعي وسرطان الظهارة البولية المتقدم محليًا. 2023.https://www.merck.com/
أخبار/حقق دواء ميرك كيترودا (بمبرووليزوماب) الهدف الأساسي من البقاء خالياً من المرض (DFS) في بعض المرضى الذين يعانون من سرطان الخلايا الانتقالية الغازي للعضلات (MIUC) بعد الجراحة/
65 جونسون بي سي، غاينور جي إف، سوليفان آر جي، لونغو دي إل، شابنر بي. مثبطات نقاط التفتيش المناعية – الحاجة إلى الابتكار. نيو إنجلاند/ ميد 2023؛388:1529-32. doi:10.1056/NEJMsb2300232
66 ماك آر إتش، هانت دي، شيبلي وو، وآخرون. النتائج طويلة الأمد في المرضى الذين يعانون من سرطان المثانة الغازي للعضلات بعد العلاج المشترك الانتقائي للحفاظ على المثانة: تحليل مجمع لبروتوكولات مجموعة علاج الأورام بالإشعاع 8802، 8903، 9506، 9706، 9906، و0233. ج Clin Oncol 2014؛ 32: 3801-9. doi:10.1200/JCO.2014.57.5548
67 جيمس ND، حسين SA، هول E، وآخرون، محققو BC2001. العلاج الإشعاعي مع أو بدون العلاج الكيميائي في سرطان المثانة الغازي في العضلات. نيو إنجلاند / ميد 2012؛ 366: 1477-88. doi:10.1056/ NEJMoa1106106
68 إيفستاثيو JA، سبايجل DY، شيبلي WU، وآخرون. النتائج طويلة الأمد للحفاظ الانتقائي على المثانة من خلال العلاج المشترك لعلاج سرطان المثانة الغازي: تجربة MGH. يور يورول 2012؛61:70511. doi:10.1016/j.eururo.2011.11.010
70 زلوتي AR، بالاس LK، نيميركو A، وآخرون. استئصال المثانة الجذري مقابل العلاج الثلاثي للسرطان الغازي في المثانة: تحليل متعدد المؤسسات متطابق وموزون بناءً على درجة الميل. لانسيت أونكول 2023؛ 24: 669-81. doi:10.1016/S1470-2045(23)00170-5
71 جالسكي MD، دانشماند S، تشان KG، وآخرون. تجربة المرحلة الثانية من الجيمسيتابين، السيسبلاتين، بالإضافة إلى نيفولوماب مع الحفاظ الانتقائي على المثانة في المرضى الذين يعانون من سرطان المثانة الغازي في العضلات (MIBC): HCRN GU 16-257. J Clin Oncol 2021؛ 39:4503. doi:10.1200/JCO.2021.39.15_ suppl. 4503
72 جينيسمان دي إم، أبوش بي، روس إي إيه، وآخرون. تجربة المرحلة الثانية للعلاج المعتمد على المخاطر بعد بدء العلاج الكيميائي المساعد لسرطان المثانة (RETAIN BLADDER): تحليل مؤقت. مجلة السرطان السريرية 2021؛39:397. doi:10.1200/JCO.2021.39.6_suppl. 397
73 فليغ تي دبليو، تانجن سي إم، دانشماند إس، وآخرون. دراسة عشوائية من المرحلة الثانية لتقدير التعايش (COXEN) مع العلاج الكيميائي المساعد لسرطان المثانة (SWOG S1314؛ NCT02177695). أبحاث السرطان السريرية 2021؛27:2435-41. doi:10.1158/1078-0432.CCR-20-2409
74 إدارة الغذاء والدواء الأمريكية. إدارة الغذاء والدواء توافق على إنفورتوماب فيدوتين-إي جي إف مع بيمبروليزوماب لعلاج سرطان الخلايا الانتقالية المتقدم محليًا أو النقيلي. 2023.https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-enfortumab-vedotin-ejfv-pembrolizumab-locally-advanced-or-metastatic-urothelial-cancer
75 بيلمنت جي، دي ويت آر، فاون دي جي، وآخرون، محققو KEYNOTE-045. بيمبروليزوماب كعلاج خط ثانٍ لسرطان الخلايا الانتقالية المتقدم. نيو إنجلاند جورنال أوف ميديسن 2017؛376:1015-26. doi:10.1056/NEJMoa1613683
76 باولز تي، تشوسزي تي، أوزغور أوغلو م، وآخرون، محققو KEYNOTE-361. بيمبروليزوماب بمفرده أو بالاشتراك مع العلاج الكيميائي مقابل العلاج الكيميائي كعلاج خط أول لسرطان الخلايا الانتقالية المتقدم (KEYNOTE-361): تجربة عشوائية، مفتوحة، من المرحلة 3. لانسيت أونكول 2021؛ 22: 931-45. doi:10.1016/S1470-2045(21)00152-2
77 باولز تي، بارك ش، فوك إي، وآخرون. علاج الصيانة بأفيلوماب لسرطان الخلايا الانتقالية المتقدم أو النقيلي. نيو إنجلند جورنال أوف ميديسين 2020؛ 383: 1218-30. doi:10.1056/NEJMoa2002788
78 باولز تي، بارك ش، كاسيرتا سي، وآخرون. أفيليماب كعلاج صيانة في الخط الأول لسرطان الخلايا الانتقالية المتقدم: نتائج من تجربة جافلين المثانة 100 بعد أكثر من سنتين من المتابعة. ج Clin Oncol 2023؛ 41:348692. doi:10.1200/JCO.22.01792
80 إدارة الغذاء والدواء. تمنح إدارة الغذاء والدواء الموافقة المعجلة على إردافيتينيب لسرطان الخلايا الانتقالية النقيلي. 2019.https://www. fda.gov/drugs/resources-information-approved-drugs/fda-grants-accelerated-approval-erdafitinib-metastatic-urothelial-carcinoma
81 لوريو Y، ماتسوبارا N، بارك SH، وآخرون، محققو مجموعة THOR 1. إردافيتينيب أو العلاج الكيميائي في سرطان الخلايا الانتقالية المتقدم أو النقيلي. نيو إنجلاند جورنال أوف ميديسين 2023؛389:1961-71. doi:10.1056/NEJMoa2308849
82 لوريو Y، نيتشي A، بارك SH، وآخرون، مجموعة دراسة BLC2001. إردافيتينيب في سرطان الخلايا الانتقالية المتقدم محليًا أو النقيلي. نيو إنجلاند جورنال أوف ميديسين 2019؛ 381: 338-48. doi:10.1056/NEJMoa1817323
83 العبيدي ك. إ، تشينغ ل. جين مستقبلات عامل نمو الألياف (FGFR): الآلية المرضية وآثار العلاج في سرطان الظهارة البولية للمثانة. مجلة علم الأمراض السريرية 2021؛74:491-5. doi:10.1136/jclinpath-2020-207115
84 Siefker-Radtke AO، ماتسوبارا ن، بارك ش، وآخرون، محققو مجموعة THOR 2. إردافيتينيب مقابل بيمبروليزوماب في المرضى الذين تم علاجهم مسبقًا والذين يعانون من سرطان الظهارة البولية المتقدم أو النقيلي مع اختيار محدد
85 باولز تي، روزنبرغ جي إي، سونبافدي جي بي، وآخرون. إنفورتوماب فيدوتين في سرطان الظهارة البولية المتقدم الذي تم علاجه سابقًا.
86 روزنبرغ جي إي، باولز تي، سونبافدي جي بي، وآخرون. النتائج طويلة الأمد لدراسة EV-301: نتائج 24 شهرًا من التجربة السريرية المرحلة الثالثة لعقار إنفورتوماب فيدوتين مقابل العلاج الكيميائي في المرضى الذين تم علاجهم سابقًا من سرطان الخلايا الانتقالية المتقدم. آن أونكول 2023؛ 34: 1047-54. doi:10.1016/j.annonc.2023.08.016
87 إدارة الغذاء والدواء. تمنح إدارة الغذاء والدواء الموافقة المعجلة على إنفورتوماب فيدوتين-إي جي إف في مع بيمبروليزوماب لعلاج سرطان الخلايا الانتقالية المتقدم محليًا أو النقيلي. 2023.https://www.fda.gov/drugs/الموارد-المعلومات-الأدوية المعتمدة/إدارة الغذاء والدواء تمنح الموافقة المتسارعة لإنفورتوماب فيدوتين وإيجف-بمبروليزوماب للحالات المتقدمة محليًا أو النقيلي
88 هويمس سي جي، فليغ تي دبليو، ميلوفسكي إم آي، وآخرون. إنفورتوماب فيدوتين بالإضافة إلى بيمبروليزوماب في سرطان الخلايا الانتقالية المتقدم غير المعالج سابقًا. / كلين أونكول 2023؛ 41: 22-31. doi:10.1200/JC0.22.01643
89 غوبتا س، روزنبرغ جي إي، مكاي آر آر، وآخرون. دراسة EV-103 زيادة الجرعة/ المجموعة أ: النتائج طويلة الأمد للإنفورتوماب فيدوتين + بيمبروليزوماب في الخط الأول (1L) من سرطان الخلايا الانتقالية المتقدم محليًا أو النقيلي (la/mUC) غير المؤهل لسيستين، مع متابعة تقارب 4 سنوات. ج Clin Oncol 2023;41:4505. doi:10.1200/JCO.2023.41.16_suppl.4505
90 باولز تي بي، بيريز فالدراما بي، غوبتا إس، وآخرون. LBA6 EV-302/ KEYNOTE-A39: دراسة مفتوحة، عشوائية من المرحلة الثالثة لعقار إنفورتوماب فيدوتين بالاشتراك مع بيمبروليزوماب (EV+P) مقابل العلاج الكيميائي (Chemo) في سرطان الخلايا الانتقالية المتقدم محليًا النقيلي (la/mUC) غير المعالج سابقًا. آن أونكول 2023؛ 34: S1340 doi:10.1016/j.annonc.2023.10.106
91 شارع تاجاوا، أفينيو بالار، بيترلاك دي بي، وآخرون. دراسة مفتوحة المرحلة الثانية TROPHY-U-01: دراسة عن ساكيتوزوماب غوفيتيكان في المرضى الذين يعانون من سرطان الظهارة البولية النقيلي المتقدم بعد العلاج الكيميائي القائم على البلاتين ومثبطات نقاط التفتيش. مجلة السرطان السريرية 2021؛39:2474-85. doi:10.1200/JCO.20.03489
92 مارياثاسان س، تورلي إس ج، نيكليس د، وآخرون. TGF
93 تاغاوا ST، بالار AV، بيترلاك DP، وآخرون. نتائج محدثة في مجموعة TROPHY-U-01 المجموعة 1، دراسة المرحلة 2 لساقيتوزوماب غوفيتيكان (SG) في المرضى (pts) الذين يعانون من سرطان الظهارة البولية النقيلي (mUC) الذي تقدم بعد العلاج الكيميائي القائم على البلاتين (PT) ومثبط نقطة التفتيش (CPI). J Clin Oncol 2023؛ 41:526. doi:10.1200/JCO.2023.41.6_suppl.526
94 إدارة الغذاء والدواء. تمنح إدارة الغذاء والدواء الموافقة المعجلة على ساكيتوزوماب جوفيتيكان لسرطان الظهارة البولية المتقدم. 2021.https://www.fda.gov/drugs/resources-information-approved-drugs/إدارة الغذاء والدواء تمنح الموافقة المعجلة على ساكيتوزوماب غوفيتكان لسرطان الظهارة البولية المتقدم
95 كولبرغ ب، شبل غ، إريكسون ب، سيو دال غ، ليدبرغ ف. الأنماط الجزيئية المطبقة على سلسلة حديثة من استئصال المثانة القائم على السكان لا تتنبأ بالبقاء على قيد الحياة المحدد بالسرطان. أورول أونكول 2019؛37:791-9. doi:10.1016/j.urolonc.2019.04.010
96 موهنتي إس كيه، لوبيو أ، ميشرا إس كيه، تشينغ ل. الطب الدقيق في سرطان المثانة: التحديات الحالية والاتجاهات المستقبلية. ج برس ميد 2023؛13:756. doi:10.3390/jpm13050756
97 أودونيل بي إتش، ميلوفسكي إم آي، بيترلاك دي بي، وآخرون. إنفورتوماب فيدوتين مع أو بدون بيمبروليزوماب في المرضى غير المؤهلين لسيكلوفسفاميد الذين لم يتلقوا علاجًا سابقًا لسرطان الخلايا الانتقالية المتقدم محليًا أو النقيلي. مجلة علم الأورام السريرية 2023؛ 41: 4107-17. doi:10.1200/JC0.22.02887
98 سيلر ر، أشاب HAD، إرهون ن، وآخرون. تأثير الأنماط الجزيئية في سرطان المثانة الغازي للعضلات على التنبؤ بالاستجابة والبقاء بعد العلاج الكيميائي المساعد. يور يورول 2017؛72:544-54. doi:10.1016/j.eururo.2017.03.030
99 نيكّي أ، دي يونغ جي جي، راجي دي، وآخرون. التوصيف الجزيئي لسرطان المثانة المتبقي بعد العلاج المساعد ببمبروليزوماب. يور يورول 2021؛80:149-59. doi:10.1016/j.eururo.2021.03.014
100 موريرا دي إس، حسن علي إس إل، بيلو دي، وآخرون. المعايير السريرية تتفوق على الأنماط الجزيئية في التنبؤ بالنتائج في سرطان المثانة: نتائج من عدة مجموعات، بما في ذلك TCGA. مجلة المسالك البولية 2020؛203:62-72. doi:10.1097/JU.0000000000000351
102 أوروين واي، ليو JJ، فاي AP، ألبجيز L، شوايري TK، بيلمونت J. ERCC1 كعامل تنبؤي للبقاء على قيد الحياة في المرضى الذين يعانون من سرطان الظهارة البولية المتقدم المعالج بالعلاج الكيميائي القائم على البلاتين: مراجعة منهجية وتحليل تلوي. مراجعة نقدية في علم الأورام وعلم الدم 2017؛120:120-6. doi:10.1016/j.critrevonc.2017.10.012
103 الجمعية الأوروبية لعلم الأورام الطبية. وكالة الأدوية الأوروبية توصي بتمديد المؤشرات العلاجية لنيوفولوماب. 2022.https://www.esmo.org/أخبار-الأورام/الهيئة-الأوروبية-للأدوية-توصي-بتمديد-المؤشرات-العلاجية-للنيوفولوماب3
104 إير غ، أودينيت ف، ميده س، وآخرون. الكشف عن إصلاح عدم التطابق (MMR) في سرطان الظهارة البولية (UC) والارتباط باستجابة حجب نقاط التفتيش المناعية (ICB). مجلة علم الأورام السريرية 2017؛35:4511. doi:10.1200/JCO.2017.35.15_suppl.4511
105 إير جي، بالار إيه في، ميلوفسكي إم آي، وآخرون. تجربة متعددة المراكز المرحلة الثانية الاستباقية للعلاج المساعد باستخدام جيمسيتابين بجرعات مكثفة بالإضافة إلى سيسبلاتين في المرضى الذين يعانون من سرطان المثانة الغازي للعضلات. مجلة علم الأورام السريرية 2018؛ 36: 1949-56. doi:10.1200/JC0.2017.75.0158
106 كلومبر ن، رالسير دي جي، إلينجر ج، وآخرون. تعبير NECTIN-4 الغشائي ينخفض بشكل متكرر خلال الانتشار النقيلي لسرطان الخلايا الانتقالية ويرتبط بمقاومة إنفورتوماب فيدوتين. أبحاث السرطان السريرية 2023؛29:1496-505. doi:10.1158/1078-0432.CCR-22-1764
108 بورhani س، بورhani ر، كاجداكسي-بالا أ. الذكاء الاصطناعي: جبهة واعدة في تشخيص سرطان المثانة وتوقع النتائج. مراجعة نقدية في علم الأورام وعلم الدم 2022؛171:103601. doi:10.1016/j.critrevonc.2022.103601
109 هارمون SA، سانفورد TH، براون GT، وآخرون. تطبيق متعدد الدقة للذكاء الاصطناعي في علم الأمراض الرقمي لتوقع العقد اللمفاوية الإيجابية من الأورام الأولية في سرطان المثانة. JCO Clin Cancer Inform 2020؛ 4: 367-82. doi:10.1200/CCl.19.00155
110 تشامي ك، تشانغ إس إس، كرامولوسكي إي، وآخرون. السوبر أغونست IL-15 NAI في سرطان المثانة غير الغازي غير المستجيب للعلاج بـ BCG. NEJM Evid 2023;2:EVIDoa2200167. doi:10.1056/EVIDoa2200167
111 مودي إس، جاكوت و، ياماشيتا ت، وآخرون، محققو تجربة DESTINY-Breast04. تراستوزوماب ديروكستكان في سرطان الثدي المتقدم HER2 المنخفض المعالج سابقًا. نيو إنجلاند جورنال أوف ميديسن 2022؛387:9-20. doi:10.1056/NEJMoa2203690
112 ميريك-برنستام ف، ماكر V، أوكنين A، وآخرون. فعالية وسلامة تراستوزوماب ديروكستكان في المرضى الذين يعانون من أورام صلبة تعبر عن HER2: النتائج الأولية من تجربة DESTINY-PanTumor02 المرحلة الثانية. / كلين أونكول 2024؛42:47-58. doi:10.1200/JC0.23.02005
113 شينغ إكس، وانغ إل، هي ز، وآخرون. فعالية وسلامة ديسيتاماب فيدوتين لدى المرضى الذين يعانون من سرطان الخلايا الانتقالية المتقدم محليًا أو النقيلي الإيجابي لمستقبل عامل نمو البشرة البشري 2: تحليل مشترك لاثنين من التجارب السريرية من المرحلة الثانية. ج Clin Oncol 2023؛ 21 نوفمبر: JCO2202912. doi:10.1200/JC0.22.02912
114 شينغ إكس، تشو ل، يانغ ك، وآخرون. ديسيتاماب فيدوتين، وهو جسم مضاد مُعَدل بشري جديد مضاد لـ HER2، مُدمج مع توريباليما في مرضى سرطان الظهارة البولية المتقدم محليًا أو النقيلي: دراسة مفتوحة المرحلة 1ب/2. جورنال كلينيكال أونكولوجي 2023؛ 41:4566 doi:10.1200/JC0.2023.41.16_suppl. 4566
115 سادغي س، كوين د، دورف ت، وآخرون. تثبيط إيفرين B2 وبيمبروليزوماب في سرطان الخلايا الانتقالية النقيلي. مجلة علم الأورام السريرية 2023؛ 41:640-50. doi:10.1200/JC0.21.02923
116 بالديني سي، غولدشميت في، بران آي، وآخرون. BT8009-100: دراسة المرحلة الأولى/ الثانية لعقار الببتيد الثنائي الحلقي الجديد ومرتبط MMAE BT8009 في المرضى (pts) الذين يعانون من أورام خبيثة متقدمة مرتبطة بتعبير نكتين-4، بما في ذلك سرطان الظهارة البولية (UC). جورنال كلينيكال أونكولوجي 2023؛ 41:498 doi:10.1200/JCO.2023.41.6_suppl. 498
117 بالارد JA، كيرشر T، أبراهام D، وآخرون. الملخص P141: التوصيف قبل السريري لـ LOX-24350، مثبط FGFR3 شديد القوة واختياري لنوع معين. علاج السرطان الجزيئي 2021؛20:141doi:10.1158/1535-7163.TARG-21-P141
DOI: https://doi.org/10.1136/bmj-2023-076743
PMID: https://pubmed.ncbi.nlm.nih.gov/38346808
Publication Date: 2024-02-12
Advances in diagnosis and treatment of bladder cancer
Correspondence to:
A Lopez-Beltran
em1lobea@gmail.com or L Cheng liang_cheng@yahoo.com
Cite this as: BMJ2024;384:e076743 http://dx.doi.org/10.1136/ bmj-2023-076743
Introduction
survival are
Overall survival in patients after cystectomy correlates with pathologic stage, and about
While platinum based chemotherapy remains an important component of treatment for patients with metastatic disease, emerging novel treatments, including approved antibody-drug conjugates and targeted treatments, have represented a paradigm shift in managing metastatic bladder cancer.
Abstract
Bladder cancer remains a leading cause of cancer death worldwide and is associated with substantial impacts on patient quality of life, morbidity, mortality, and cost to the healthcare system. Gross hematuria frequently precedes the diagnosis of bladder cancer. Non-muscle-invasive bladder cancer (NMIBC) is managed initially with transurethral resection of a bladder tumor (TURBT), followed by a risk stratified approach to adjuvant intravesical therapy (IVe), and is associated with an overall survival of 90%. However, cure rates remain lower for muscle invasive bladder cancer (MIBC) owing to a variety of factors. NMIBC and MIBC groupings are heterogeneous and have unique pathological and molecular characteristics. Indeed, The Cancer Genome Atlas project identified genetic drivers and luminal and basal molecular subtypes of MIBC with distinct treatment responses. For NMIBC, IVe immunotherapy (primarily BCG) is the gold standard treatment for high grade and high risk NMIBC to reduce or prevent both recurrence and progression after initial TURBT; novel trials incorporate immune checkpoint inhibitors. IVe gene therapy and combination IVe chemotherapy have recently been completed, with promising results. For localized MIBC, essential goals are improving care and reducing morbidity following cystectomy or bladder preserving strategies. In metastatic disease, advances in understanding of the genomic landscape and tumor microenvironment have led to the implementation of immune checkpoint inhibitors, targeted treatments, and antibody-drug conjugates. Defining better selection criteria to identify the patients most likely to benefit from a specific treatment is an urgent need.
Sources and selection criteria
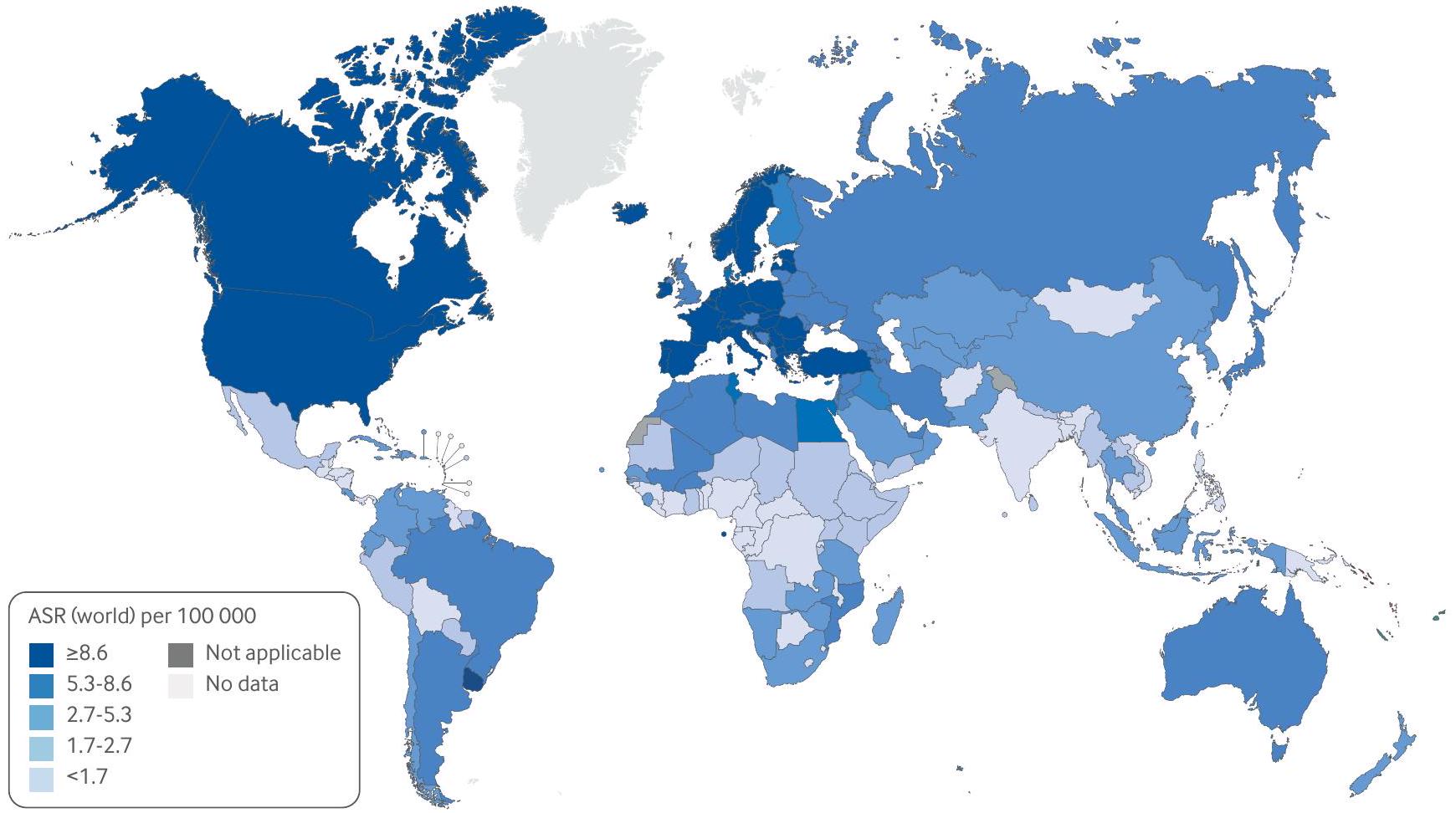
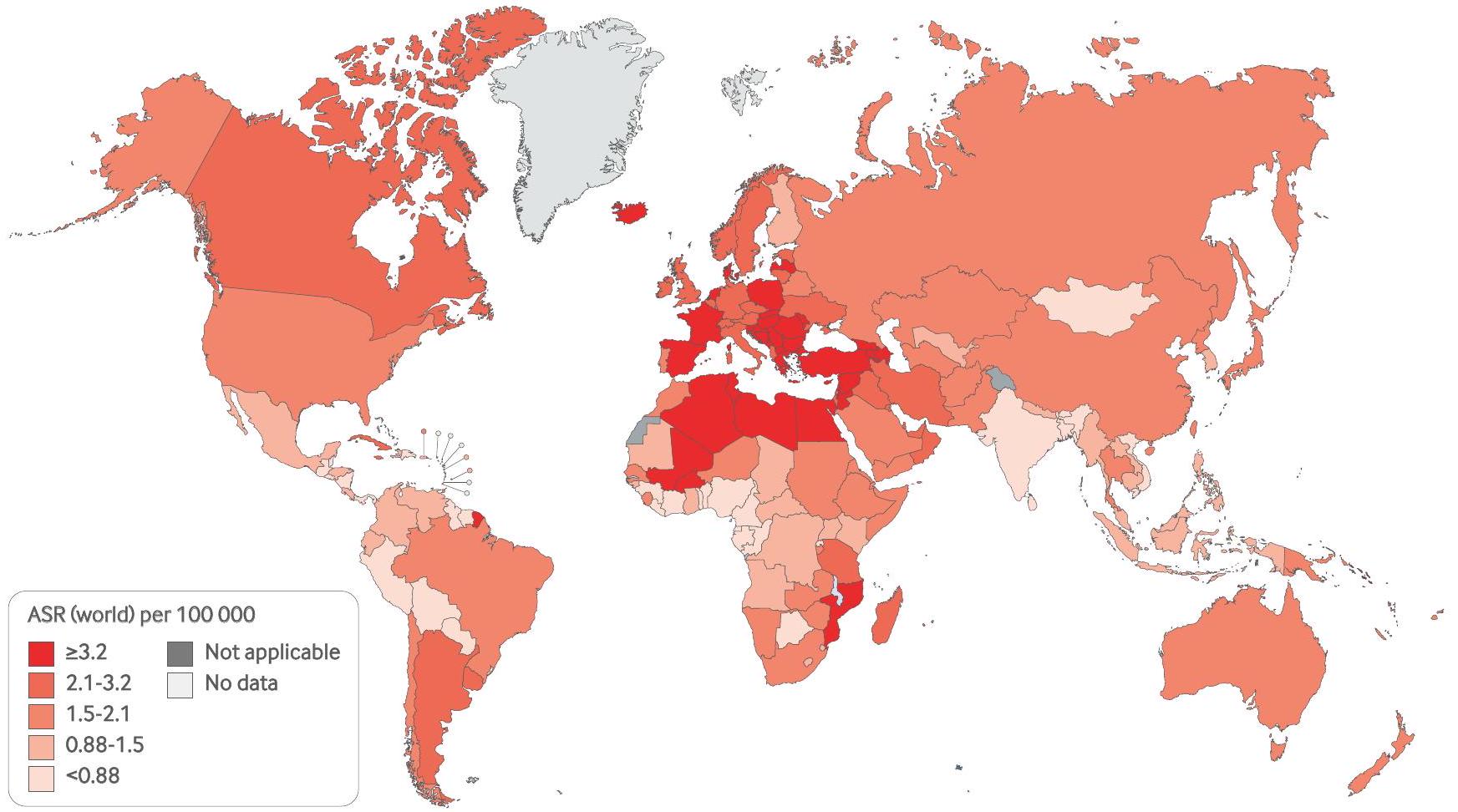
Epidemiology
Interventions such as cessation of smoking (including tobacco consumption), reducing occupational toxic exposure, and improving the quality of water, together with increasing fruit and vegetable consumption, good hydration, and reduced consumption of processed meat and red meat, could be associated with a reduced risk of bladder cancer, but also can improve overall health and oncologic outcomes during bladder cancer treatment.
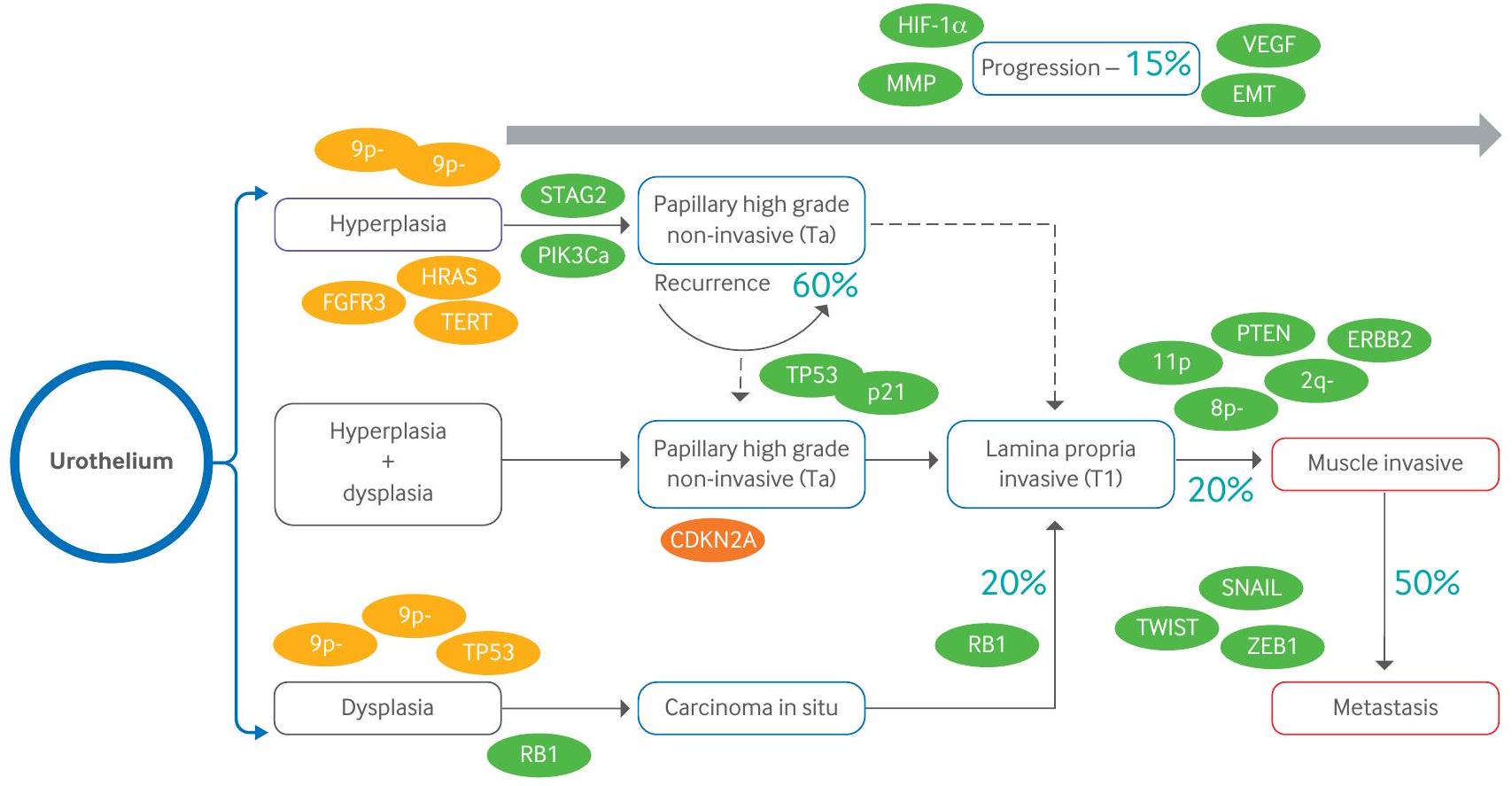
Pathophysiology and molecular steps
Non-muscle-invasive bladder cancer

suppressor that regulates mammalian target of rapamycin (mTOR) signaling.
Muscle invasive bladder cancer
Although FGFR3 mutations are less frequent in MIBC than in NMIBC, up to
Epigenetic changes also play a significant role in MIBC development; genome wide analysis has indicated the importance of both DNA methylation and histone methylation in gene silencing. Distinct

Subtypes of bladder cancer
plasmacytoid urothelial carcinoma is an aggressive subtype typically presenting at an advanced stage. This subtype shares immunohistochemistry and molecular alterations with conventional urothelial carcinoma, such as staining for KRT7, p63, GATA3, and uroplakins, along with genetic mutations in TP53, RB1, KMT2D, and ARID1A. However, the development of these tumors is additionally driven by loss of function mutations in CDH1 and promoter hypermethylation of CDH 1 . Of note, by contrast to the germline CDH1 mutations seen in diffuse hereditary gastric cancers and a subset of lobular breast cancer, no germline CDH1 mutations were identified in plasmacytoid subtype.
Micropapillary urothelial carcinoma represents another rare but aggressive subtype of bladder carcinoma. Many clinicians advise an early cystectomy in these tumors, even in the absence of invasion into the muscularis propria layer. This tumor is commonly associated with higher rates of ERBB2 alterations, more commonly amplifications than mutations.
Small cell/neuroendocrine carcinoma of the bladder is a rare subtype of bladder cancer morphologically identical to its counterpart in the lung, and similarly it commonly harbors combined alterations in both TP53 and RB1. Furthermore, other alterations have also been detected, including TERT promoter mutations and truncating alterations

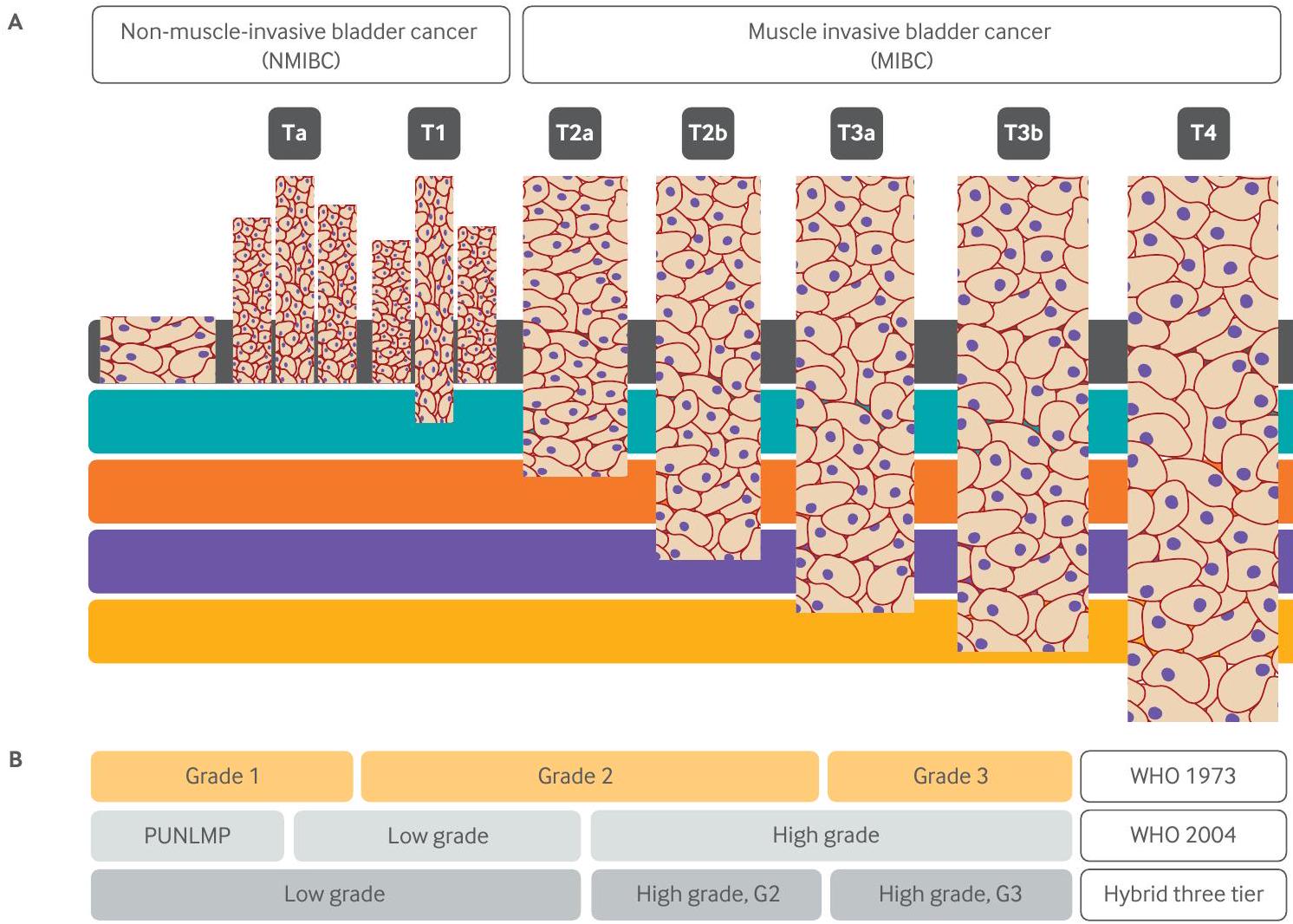
Clinical presentation, diagnosis, and risk stratification
carcinoma in situ can be enhanced by fluorescence cystoscopy or narrow band imaging, both of which can be performed with flexible endoscopic equipment in the office.
determining factors of tumor biology to inform management.
Imaging studies of the upper urinary tract (to evaluate the renal collecting system) and the ureter are essential to evaluate patients with hematuria and to assess for upper tract urothelial tumors. While moderate to large bladder tumors can be visualized on contrast imaging, it plays a minor part of role in the detection of bladder cancer. CT (computed tomography) and MRI (magnetic resonance imaging) urography are the imaging studies of choice and are associated with improved diagnostic accuracy over ultrasonography. CT or MRI is mandated in patients with confirmed MIBC to complete staging and to assess potential for distant spread.

considered in high grade non-invasive disease (except carcinoma in situ alone) to improve staging accuracy and increase recurrence free survival. Thus, repeating TURBT after newly diagnosed T1 bladder cancer improves recurrence free and progression free survival at five years by
Treatment
Treatment of non-muscle-invasive bladder cancer
Patients with persistent or worsening disease after an appropriate treatment course with BCG and those who experience disease relapse while on maintenance treatment are deemed BCG unresponsive.
| Table 1 | American Urological Association/Society of Urologic Oncology risk stratification for NMIBC
|
||||
| Low risk | Intermediate risk | High risk | ||
| PUNLMP | Low grade urothelial carcinoma | High grade urothelial carcinoma | ||
| Low grade urothelial carcinoma | – Recurrence within one year, LGTa | – T1 | ||
| – Ta and
|
– Solitary LGTa >3 cm | – Any recurrent, HGTa | ||
| – LGTa, multifocal | – HGTa >3 cm (or multifocal) | |||
| – LGT1 | – Any CIS | |||
| High grade urothelial carcinoma | – BCG failure in HG patient* | |||
| – Ta
|
– Any variant histology* | |||
| – Any lymphovascular invasion* | ||||
| – *Any HG prostatic urethral involvement | ||||
|
||||
| Table 2 | Initial management per NMIBC risk groups
|
|
| Risk group | Initial management |
| Low | Surveillance |
| – Should consider single perioperative instillation of intravesical chemotherapy at time of TURBT | |
| Intermediate | Intravesical treatment (preferred) or surveillance |
| – Options for intravesical treatment for intermediate risk disease include BCG and intravesical chemotherapy | |
| High | BCG naive |
| – Very high risk features: cystectomy (preferred) or BCG | |
| – No very high risk features: BCG (preferred, category 1) or cystectomy | |
| BCG unresponsive or BCG intolerant | |
| – Cystectomy (preferred) or intravesical chemotherapy or pembrolizumab (selected patients) or nadofaragene firadenovec | |
| BCG=Bacillus Calmette-Guérin; NMIBC=non-muscle invasive bladder cancer; TURBT=transurethral resection of bladder tumor. | |
| Table 3 | European Association of Urology risk groups for NMIBC and recommended treatment
|
|||
| Low risk | |||
| – A primary, single, Ta LG/G1 tumor <3 cm in diameter without CIS in a patient <70 yr | |||
| – A primary LG/G1 tumor with at most one of the following additional clinical risk factors (age >70 years, multiple tumors, and tumor diameter
|
|||
| – Recommended treatment: Offer one immediate instillation of intravesical chemotherapy after TURBT | |||
| Intermediate risk | |||
| – Patients without CIS who are not included in either the low risk, high risk, or very high risk groups | |||
| – Recommended treatment: For all patients, either one year full dose BCG treatment (induction plus three weekly instillations at 3,6 , and 12 months) or instillations of chemotherapy (the optimal schedule is not known) for a maximum of one year is recommended. The final choice should reflect the individual patient’s risk of recurrence and progression as well as the efficacy and side effects of each treatment modality. Offer one immediate chemotherapy instillation to patients with small papillary recurrences detected more than one year after previous TURBT. | |||
| High risk | |||
| – All T1 HG/G3 without CIS, except those included in the very high risk group | |||
| – All CIS patients, except those included in the very high risk group. | |||
|
|||
| – Ta HG/G3 or T1 LG, no CIS with at least two risk factors (two of: age >70 yr, multiple tumors, and tumor diameter
|
|||
|
|||
| – Recommended treatment: Offer intravesical full dose BCG instillations for 1-3 years or RC. | |||
| Very high risk | |||
| – Ta HG/G3 and CIS with all three risk factors (age >70 yr, multiple tumors, and tumor diameter
|
|||
| – T1 G2 and CIS with at least two risk factors (two of: age >70 yr, multiple tumors, and tumor diameter
|
|||
|
|||
| – T1 HG/G3 no CIS with all 3 risk factors (age > 70 yr , multiple tumors, and tumor diameter
|
|||
| – Recommended treatment: Consider RC and offer intravesical full dose BCG instillations for 1-3 years to those who refuse or are unfit for RC. | |||
|
|||
| Table 4 | *Disease progression probability at 1,5, and 10 years for the European Association of Urology NMIBC risk groups
|
|||||
| European Association of Urology NMIBC risk groups | Probability of progression, % (95% CI) | ||||
| 1 year | 5 years | 10 years | |||
| Incorporating low versus high grade (WHO 2004) | |||||
| Low | 0.06 (0.01 to 0.43) | 0.93 ( 0.49 to 1.7) | 3.7 (2.3 to 5.9) | ||
| Intermediate | 1.0 (0.50 to 2.0) | 4.9 (3.4 to 7.0) | 8.5 (5.6 to 13) | ||
| High | 3.5 (2.4 to 5.2) | 9.6 (7.4 to 12) | 14 (11 to 18) | ||
| Very high | 16 (10 to 26) | 40 (29 to 54) | 53 (36 to 73) | ||
| Incorporating with WHO 1973 | |||||
| Low | 0.12 (0.02 to 0.82) | 0.57 (0.21 to 1.5) | 3.0 (1.5 to 6.3) | ||
| Intermediate | 0.65 (0.36 to 1.2) | 3.6 (2.7 to 4.9) | 7.4 (5.5 to 10) | ||
| High | 3.8 (2.6 to 5.7) | 11 (8.1 to 14) | 14 (10 to 19) | ||
| Very high | 20 (12 to 32) | 44 (30 to 61) | 59 (39 to 79) | ||
|
|||||
and breakthrough therapy designation intended to accelerate path to FDA submission.
Combination chemotherapy with gemcitabine and docetaxel has also been shown to be effective in the BCG unresponsive space. Preliminary studies highlight its potential in enhancing therapeutic efficacy and mitigating resistance mechanisms in both high risk BCG naive and BCG unresponsive disease.
| Table 5 | First line systemic treatment for locally advanced or metastatic disease (stage IV)
|
||||
| Cisplatin eligible | Preferred regimens* | |||
| – Gemcitabine and cisplatin* (category 1) followed by avelumab maintenance treatment (category 1) only if no progression on first line platinum containing chemotherapy | ||||
| – ddMVAC* with growth factor support (category 1) followed by avelumab maintenance treatment (category 1) only if no progression on first line platinum containing chemotherapy | ||||
| Cisplatin eligible | Preferred regimens | |||
|
||||
| Other recommended regimes | ||||
|
||||
| Useful under certain circumstances | ||||
|
||||
|
||||
| Table 6 | Second line systemic treatment for locally advanced or metastatic disease (stage IV) (after platinum or other chemotherapy)
|
||||||
| Preferred regimen | Pembrolizumab (category 1 post platinum) | |||||
| Alternative preferred regimens |
|
|||||
| Other recommended regimens |
|
|||||
| Useful in certain circumstances based on previous medical treatment |
|
|||||
Treatment of muscle invasive bladder cancer
of some low volume lymph node positive patients, could result in improved outcomes through more accurate staging, and therefore not be related to improved cancer control. The phase 3 trial SWOG S1011, which randomized 592 patients with muscle invasive bladder cancer (cT2-4a N0-2) in a 1:1 ratio to extended or standard lymph node dissection, showed no improvement in disease free or overall survival with extended versus standard lymphadenectomy and extended lymphadenectomy was associated with greater morbidity and perioperative mortality.
Following radical cystectomy and lymph node dissection, a urinary diversion is required. Almost all forms of urinary diversion use a short segment ( 15 cm ) of the ileum or colon.
Continent urinary diversion involves orthotopic connection to the naive urethra such as a neobladder, which creates a spherical, adequate volume and low pressure reservoir made from detubularized and folded bowel to the urethra; therefore, it has the advantaged of using a naturally situated reservoir.
are low pressure detubularized bowel reservoirs connected to skin for self-catheterization, the most commonly performed of which is the Indiana pouch. The Indiana pouch can be performed on patients who wish to avoid a stoma but are not candidates or are unwilling for orthotopic neobladder. Patient selection based on clinical and oncologic factors is the key to successful urinary diversion and health related quality of life.
Neoadjuvant chemotherapy
Adjuvant chemotherapy
Adjuvant immune checkpoint inhibitors
risk was defined as
Bladder preservation strategy with trimodality treatment
Trimodality treatment combines radical TURBT with concomitant radio sensitizing chemotherapy and external beam radiotherapy. This strategy can result in five year cancer specific survival rates of 50
Treatment of metastatic bladder cancer
new treatments.
More recently, the addition of the anti-PD1 checkpoint inhibitor nivolumab to first line gemcitabine cisplatin chemotherapy was shown to confer an overall survival advantage compared with gemcitabine cisplatin alone.
PDL1 testing, quantified using immunohistochemistry assays, is currently the most widely validated, used, and accepted biomarker to guide the selection of patients to receive treatment with anti-PD1 or anti-PDL1 antibodies. However, many challenges remain in the clinical use of these assays, including the necessity of using different
companion diagnostic assays for specific agents, high levels of inter-assay variability in terms of both performance and cut-off points, and a lack of prospective comparisons of how PDL1
Targeted tyrosine kinase inhibitors
respectively, with a hazard ratio of 1.18 (
Antibody-drug conjugates
line or beyond.
Prognostic and predictive biomarkers
Currently, the consensus molecular classification of bladder cancer revealed an agreement on six molecular categories: luminal papillary, luminal non-specified, luminal unstable, stroma rich, basalsquamous, and neuroendocrine-like.
Moreover, the use of biomarkers to predict the response to cisplatin based chemotherapy remains investigational, withnoclinicalapplicationat present. However, some studies emphasize the detection of ERCC1 (excision repair cross complementation group 1) protein that heterodimerizes with ERCC4 to form an endonuclease complex.
| Table 7 | Reported characteristics of the molecular subtypes of MIBC cancer and their treatment implications | ||||||
| Luminal papillary (24%) | Luminal nonspecified (8%) | Luminal unstable (15%) | Stroma rich (15%) | Basal squamous (35%) | Neuroendocrinelike (3%) | |
| Immunohistochemistry | GATA3, FOXA1 FGFR3, CK20, Uroplakin 2 | GATA3, FOXA1 FGFR3, CK20, Uroplakin 2 | GATA3, FOXA1 FGFR3, CK20, Uroplakin 2 | Vimentin, desmin, SMA | CK5/6, CK14, Desmoglein 3, STAT3 | INSM1, Synaptophysin, Chromogranin, CD56 |
| Potential targeting therapy | Low risk, FGFR3 inhibitors, low sensitivity to NAC | Response to ICI, low sensitivity to NAC | Response to ICl Sensitivity to NAC | Not specified | Response to ICl EGFR inhibitors, Cisplatin NAC | Response to ICI, combined chemotherapy |
| Additional terminology* | Lund Uro A MDA luminal TCGA luminal papillary UNC luminal | Lund Uro C MDA p53-like and luminal TCGA luminal UNC luminal | Lund genomically unstable MDA luminal TCGA luminal UNC luminal | Lund mesenchymallike MDA p53-like TCGA basalsquamous UNC basal | Lund basalsquamous and basal-squamous infiltrated/ Urolithin B MDA basal TCGA basalsquamous UNC basal | Lund small cell/ NE-like TCGA neuronal, UNC basal |
ICI=immune checkpoint inhibitors; MDA=MD Anderson Cancer Center; MIBC=muscle invasive bladder cancer; NAC=neoadjuvant chemotherapy; NE=neuroendocrine; TCGA=The Cancer Genome Atlas; TMB=tumor mutation burden; UNC=University of North Carolina.
- Some of the proposed categories in other classifications present overlapping features with limited correspondence between them.
metastatic bladder cancer, with improved outcomes in these patients. Conversely, ERCC1 overexpression is associated with worse overall survival in metastatic bladder cancer. Furthermore, ERCC2 mutations are associated with pathologic complete response, improved overall survival to neoadjuvant cisplatin based chemotherapy in MIBC, and improved responses in metastatic bladder cancer.

checkpoint inhibitor response might not be sufficient.
In recent years, much attention has been given to tumor mutation burden, a surrogate marker of neoantigen production and immunogenicity in TMB
Microsatellite instability is associated with higher sensitivity to immune checkpoint inhibitor based treatment. Microsatellite instability and DNA mismatch repair mutations impair the activity of genes, leading to a higher tumor mutation burden and a higher sensitivity to immune checkpoint inhibitor. Mismatch repair defects can identify responders to immune checkpoint inhibitor, and this is independent of their tissue of origin. Unfortunately, the low prevalence of mismatch repair/microsatellite instability alterations in bladder cancer limits microsatellite instability and mismatch repair applicability in practice. 1633346572104105
Bladder cancer is enriched for both nectin-4 and TROP2, surface cell targets of sacituzumab govitecan and enfortumab vedotin, respectively. Notably, emerging data suggest that nectin-4 expression could ultimately prove helpful in predicting sensitivity to
| Table 8 | Approved targeted treatment | |||||||
| Molecular target | Targeted treatment | Clinical trial | Patient eligibility | Study arm and results | |||
| FGFR3 | Erdafitinib | BLC2001 | Advanced UC and progression on previous platinum based chemotherapy, with or without previous immunotherapy and with FGFR alterations (mutations/fusions) |
|
|||
| Nectin-4 | Enfortumab vedotin (an antibody targeting nectin-4 linked to a microtubule inhibitor conjugate | EV-201 | Locally advanced or metastatic disease ineligible for cisplatin, not having received previous platinum based chemotherapy, and previously treated with either a PD1 or a PDL1 inhibitor; no biomarker assay needed |
|
|||
| EV-301 | Locally advanced unresectable or metastatic UC (including those with squamous differentiation or mixed cell types) previously treated with platinum based chemotherapy and PD1/PDL1 inhibitor; no biomarker assay needed |
|
|||||
| TROP2 | Sacituzumab govitecan (antibodydrug conjugate that targets TROP2, and is coupled with SN-38, an active metabolite ofirinotecan) | TROPHY-U-01 | Advanced UC previously treated with platinum based chemotherapy or immunotherapy; no biomarker assay needed |
|
|||
enfortumab vedotin.
Emerging and novel treatments
unresponsive NMIBC, while vicinium (oportuzumab monatox-qqrs), and hyperthermic chemotherapy are also in various phases of the approval process.
Disitamab vedotin is a HER2 directed antibodydrug conjugate with the same microtubule inhibitor payload as enfortumab vedotin. In a combined analysis of two single arm phase 2 trials (RC48-C005 and RC48-C009) of 107 total patients with HER2 positive locally advanced or metastatic urothelial cancer, disitamab vedotin achieved an objective response rate of
plus the anti-PD1 checkpoint inhibitor toripalimab. This combination achieved a confirmed objective response rate of
Guidelines
Conclusion
QUESTIONS FOR FUTURE RESEARCH
- What are the biomarkers to improve the detection of aggressive NMIBC progressing under standard treatments (BCG)?
- How can the non-invasive detection of bladder cancer recurrences using molecular urine biomarkers be improved?
- What are the biomarkers that predict improved treatment responses in locally advanced and metastatic bladder cancer (eg, PDL1, PD1, CTLA4, FGFR3, nectin-4, TROP2, molecular subtypes)?
- Can the immune microenvironment be modulated to better potentiate treatments for bladder cancer?
HOW PATIENTS WERE INVOLVED IN THE CREATION OF THIS ARTICLE
GLOSSARY OF ABBREVIATIONS
- BCG: Bacillus Calmette-Guérin
- CT: computed tomography
- ctDNA: circulating tumor DNA
- ddMVAC: dose dense methotrexate, vinblastine, adriamycin, cisplatin
- ECOG: Eastern Cooperative Oncology Group
- eLND: extended lymphadenectomy
- ERAS: enhanced recovery after surgery
- ERCC: excision repair cross complementation group
- FDA: Food and Drug Administration
- IVe: intravesical therapy
- MIBC: muscle invasive bladder cancer
- MRI: magnetic resonance imaging
- mTOR: mammalian target of rapamycin
- NAI: nogapendekin alfa inbakicept
- NCCN: National Comprehensive Cancer Network
- NMIBC: non-muscle-invasive bladder cancer
- PD1: programmed cell death protein 1
- PDL1: programmed death ligand 1
- TGF
: transforming growth factor - TMB: tumor mutational burden
- TNM: tumor, node, metastases
- TROP2: trophoblast cell surface antigen 2
- TURBT: transurethral resection of a bladder tumor
have incorporated immune checkpoint inhibitors, IVe gene treatment, and combination IVe chemotherapy, with promising results in reducing recurrence and progression to MIBC.
For localized MIBC, improving care and reducing morbidity following cystectomy or bladder preserving strategies are essential goals. In metastatic disease, advances in understanding of the genomic landscape and tumor microenvironment have led to the implementation of immune checkpoint inhibitors, targeted treatments, and antibody-drug conjugates, thus enhancing the clinical landscape at an aggressive state of the disease. Cisplatin based chemotherapy is receiving much attention nowadays, alone or in combination with systemic immunotherapy and other recently introduced targeted treatments. These novel strategies, which are behind the improved quality of life of the patients, represent a paradigm shift in the management of both localized and metastatic disease. The role of enhanced diagnostic methods including narrow band and blue light cystoscopy to better differentiate neoplastic from
normal tissues, urine related molecular biomarkers, imaging methods and potential application of AI are also revisited. Developing better selection criteria to identify the patients most likely to benefit from a specific treatment is an urgent need.
Competing interests: We have read and understood the BMJ policy on declaration of interests and declare the following interests: None.
Contributors: All authors substantially contributed to conception and analysis of the manuscript; drafted the manuscript and revised it critically for important intellectual content; approved the final version to be published; and take responsibility for the accuracy and integrity of the manuscript.
Provenance and peer review: Commissioned; externally peer reviewed.
2 Siegel RL, Giaquinto AN, Jemal A. Cancer statistics, 2024. CA Cancer J Clin 2024;74:12-49. doi:10.3322/caac. 21820
3 Mohanty SK, Lobo A, Mishra SK, Cheng L. Precision medicine in bladder cancer: present challenges and future directions. J Pers Med 2023;13:756. doi:10.3390/jpm13050756
4 Flaig TW, Spiess PE, Abern M, et al. NCCN Guidelines® Insights: Bladder Cancer, Version 2.2022. J Natl Compr Canc Netw 2022;20:866-78. doi:10.6004/jnccn.2022.0041
5 Dyrskjøt L, Hansel DE, Efstathiou JA, et al. Bladder cancer. Nat Rev Dis Primers 2023;9:58. doi:10.1038/s41572-023-00468-9
6 Kamat AM, Hahn NM, Efstathiou JA, et al. Bladder cancer. Lancet 2016;388:2796-810. doi:10.1016/S0140-6736(16)30512-8
7 Konieczkowski DJ, Efstathiou JA, Mouw KW. Contemporary and emerging approaches to bladder-preserving trimodality therapy for muscle-invasive bladder cancer. Hematol Oncol Clin North Am 2021;35:567-84. doi:10.1016/j.hoc.2021.02.006
8 Lobo N, Afferi L, Moschini M, et al. Epidemiology, screening, and prevention of bladder cancer. Eur Urol Oncol 2022;5:628-39. doi:10.1016/j.euo.2022.10.003
9 Pfail JL, Small AC, Cumarasamy S, Galsky MD. Real world outcomes of patients with bladder cancer: effectiveness versus efficacy of modern treatment paradigms. Hematol Oncol Clin North Am 2021;35:597612. doi:10.1016/j.hoc.2021.01.005
11 Venkatramani V, Parekh DJ. Surgery for bladder and upper tract urothelial cancer. Hematol Oncol Clin North Am 2021;35:543-66. doi:10.1016/j.hoc.2021.02.005
12 Tran L, Xiao JF, Agarwal N, Duex JE, Theodorescu D. Advances in bladder cancer biology and therapy. Nat Rev Cancer 2021;21:10421. doi:10.1038/s41568-020-00313-1
14 Sonpavde GP, Mouw KW, Mossanen M. Therapy for muscleinvasive urothelial carcinoma: Controversies and dilemmas. J Clin Oncol 2022;40:1275-80. doi:10.1200/JC0.21.02928
15 Nadal R, Clara JA, Valderrama BP, Bellmunt J. Current therapy for metastatic urothelial carcinoma. Hematol Oncol Clin North Am 2021;35:469-93. doi:10.1016/j.hoc.2021.02.010
16 Lopez-Beltran A, Cimadamore A, Montironi R, Cheng L. Molecular pathology of urothelial carcinoma. Hum Pathol 2021;113:67-83. doi:10.1016/j.humpath.2021.04.001
17 Hodges KB, Lopez-Beltran A, Davidson DD, Montironi R, Cheng L. Urothelial dysplasia and other flat lesions of the urinary bladder: clinicopathologic and molecular features. Hum Pathol 2010;41:15562. doi:10.1016/j.humpath.2009.07.002
19 Bree KK, Brooks NA, Kamat AM. Current therapy and emerging intravesical agents to treat non-muscle invasive bladder cancer. Hematol Oncol Clin North Am 2021;35:513-29. doi:10.1016/j. hoc.2021.02.003
20 Cheng L, Zhang S, Wang M, Lopez-Beltran A. Biological and clinical perspectives of TERT promoter mutation detection on bladder cancer diagnosis and management. Hum Pathol 2023;133:56-75. doi:10.1016/j.humpath.2022.06.005
21 Damrauer JS, Roell KR, Smith MA, et al. Identification of a novel inflamed tumor microenvironment signature as a predictive biomarker of Bacillus Calmette-Guerin immunotherapy in non-
muscle-invasive bladder cancer. Clin Cancer Res 2021;27:4599-609. doi:10.1158/1078-0432.CCR-21-0205
22 Hurst CD, Cheng G, Platt FM, et al. Stage-stratified molecular profiling of non-muscle-invasive bladder cancer enhances biological, clinical, and therapeutic insight. Cell Rep Med 2021;2:100472. doi:10.1016/j.xcrm.2021.100472
23 Lopez-Beltran A, Blanca A, Cimadamore A, Gogna R, Montironi R, Cheng L. Molecular classification of bladder urothelial carcinoma using nanostring-based gene expression analysis. Cancers (Basel) 2021;13:5500. doi:10.3390/cancers13215500
24 Lotan Y, de Jong JJ, Liu VYT, et al. Patients with muscle-invasive bladder cancer with nonluminal subtype derive greatest benefit from platinum based neoadjuvant chemotherapy. J Urol 2022;207:541-50. doi:10.1097/JU.0000000 000002261
25 Xiao JF, Caliri AW, Duex JE, Theodorescu D. Targetable pathways in advanced bladder cancer: FGFR signaling. Cancers (Basel) 2021;13:4891. doi:10.3390/cancers13194891
26 Yu EY, Petrylak DP, O’Donnell PH, et al. Enfortumab vedotin after PD-1 or PD-L1 inhibitors in cisplatin-ineligible patients with advanced urothelial carcinoma (EV201): a multicentre, single-arm, phase 2 trial. Lancet Oncol 2021;22:872-82. doi:10.1016/S1470-2045(21)00094-2
27 Thibault C, Loriot Y. Emerging targeted therapy for bladder cancer. Hematol Oncol Clin North Am 2021;35:585-96. doi:10.1016/j. hoc.2021.02.011
28 Thomas J, Sonpavde G. Molecularly targeted therapy towards genetic alterations in advanced bladder cancer. Cancers (Basel) 2022;14:1795. doi:10.3390/cancers14071795
29 Peng J, Sridhar S, Siefker-Radtke AO, Selvarajah S, Jiang DM. Targeting the FGFR pathway in urothelial carcinoma: the future is now. Curr Treat Options Oncol 2022;23:1269-87. doi:10.1007/s11864-022-01009-4
30 Petrylak DP, de Wit R, Chi KN, et al, RANGE study investigators. Ramucirumab plus docetaxel versus placebo plus docetaxel in patients with locally advanced or metastatic urothelial carcinoma after platinum-based therapy (RANGE): overall survival and updated results of a randomised, double-blind, phase 3 trial. Lancet Oncol 2020;21:105-20. doi:10.1016/S1470-2045(19)30668-0
31 Siefker-Radtke AO, Cho DC, Diab A, et al. Bempegaldesleukin plus nivolumab in first-line metastatic urothelial carcinoma: results from PIVOT-02. Eur Urol 2022;82:365-73. doi:10.1016/j. eururo.2022.05.002
32 Siefker-Radtke AO, Necchi A, Park SH, et al, BLC2001 Study Group. Efficacy and safety of erdafitinib in patients with locally advanced or metastatic urothelial carcinoma: long-term follow-up of a phase 2 study. Lancet Oncol 2022;23:248-58. doi:10.1016/S1470-2045(21)00660-4
33 Bilé-Silva A, Lopez-Beltran A, Blanca A, et al. Clinical utility of checkpoint inhibitors against metastatic bladder cancer: overcoming challenges to find a way forward. Expert Opin Biol Ther 2023;23:40718. doi:10.1080/14712598.2023.2201371
35 Woldu SL, Şanli Ö, Lotan Y. Tackling non-muscle invasive bladder cancer in the clinic. Expert Rev Anticancer Ther 2017;17:467-80. doi: 10.1080/14737140.2017.1313119
37 Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2021;71:209-49. doi:10.3322/caac. 21660
38 Jubber I, Ong S, Bukavina L, et al. Epidemiology of bladder cancer in 2023: a systematic review of risk factors. Eur Urol 2023;84:176-90. doi:10.1016/j.eururo.2023.03.029
39 Cheng L, Lopez-Beltran A, Wang M, et al. Frequent telomerase reverse transcriptase promoter and fibroblast growth factor receptor 3 mutations support the precursor nature of papillary urothelial hyperplasia of the urinary bladder. Mod Pathol 2023;36:100151. doi:10.1016/j.modpat.2023.100151
40 Guercio BJ, Iyer G, Rosenberg JE. Developing precision medicine for bladder cancer. Hematol Oncol Clin North Am 2021;35:633-53. doi:10.1016/j.hoc.2021.02.008
41 Hong M, He G, Goh S, et al. Biomarkers for precision urothelial carcinoma diagnosis: Current approaches and the application of single-cell technologies. Cancers (Basel) 2021;13:260. doi:10.3390/cancers13020260
42 McConkey DJ. Molecular biology of bladder cancer: Potential implications for therapy. Hematol Oncol Clin North Am 2021;35:45768. doi:10.1016/j.hoc.2021.02.009
44 Sanli O, Dobruch J, Knowles MA, et al. Bladder cancer. Nat Rev Dis Primers 2017;3:17022. doi:10.1038/nrdp.2017.22
45 Sjödahl G, Eriksson P, Patschan O, et al. Molecular changes during progression from nonmuscle invasive to advanced urothelial carcinoma. Int J Cancer 2020;146:2636-47. doi:10.1002/ijc. 32737
46 de Jong FC, Laajala TD, Hoedemaeker RF, et al. Non-muscleinvasive bladder cancer molecular subtypes predict differential response to intravesical Bacillus Calmette-Guérin. Sci Transl Med 2023;15:eabn4118. doi:10.1126/scitranslmed.abn4118
47 Ma J, Black PC. Current perioperative therapy for muscle invasive bladder cancer. Hematol Oncol Clin North Am 2021;35:495-511. doi:10.1016/j.hoc.2021.02.002
48 Kardoust Parizi M, Shariat SF, Margulis V, Mori K, Lotan Y. Value of tumour-infiltrating immune cells in predicting response to intravesical BCG in patients with non-muscle-invasive bladder cancer: a systematic review and meta-analysis. BJU Int 2021;127:617-25. doi:10.1111/bju. 15276
49 Chang SS, Boorjian SA, Chou R, et al. Diagnosis and treatment of non-muscle invasive bladder cancer: AUA/SUO guideline. J Urol 2016;196:1021-9. doi:10.1016/j.juro.2016.06.049
50 National Comprehensive Cancer Network. NCCN Guidelines for Bladder Cancer V.3.2023. https://www.nccn.org/professionals/ physician_gls/pdf/bladder.pdf
51 Babjuk M, Burger M, Capoun O, et al. European Association of Urology guidelines on non-muscle-invasive bladder cancer (Ta, T1, and carcinoma in situ). Eur Urol 2022;81:75-94. doi:10.1016/j. eururo.2021.08.010
52 Lerner SP, Tangen C, Svatek RS, et al. SWOG S1011: A phase III surgical trial to evaluate the benefit of a standard versus an extended lymphadenectomy performed at time of radical cystectomy for muscle invasive urothelial cancer. J Clin Oncol 2023;41:4508. doi:10.1200/JCO.2023.41.16_suppl. 4508
53 Catto JWF, Khetrapal P, Ricciardi F, et al, iROC Study Team. Effect of robot-assisted radical cystectomy with intracorporeal urinary diversion vs open radical cystectomy on 90-day morbidity and mortality among patients with bladder cancer: a randomized clinical trial. JAMA 2022;327:2092-103. doi:10.1001/jama.2022.7393
54 Al Hussein Al Awamlh B, Chang SS. Novel therapies for high-risk non-muscle invasive bladder cancer. Curr Oncol Rep 2023;25:83-91. doi:10.1007/s11912-022-01350-9
55 Advanced Bladder Cancer (ABC) Meta-analysis Collaboration. Neoadjuvant chemotherapy in invasive bladder cancer: update of a systematic review and meta-analysis of individual patient data advanced bladder cancer (ABC) meta-analysis collaboration. Eur Urol 2005;48:202-5, discussion 205-6. doi:10.1016/j. eururo.2005.04.006
56 von der Maase H, Hansen SW, Roberts JT, et al. Gemcitabine and cisplatin versus methotrexate, vinblastine, doxorubicin, and cisplatin in advanced or metastatic bladder cancer: results of a large, randomized, multinational, multicenter, phase III study. J Clin Oncol 2000;18:3068-77. doi:10.1200/JCO.2000.18.17.3068
57 Pfister C, Gravis G, Fléchon A, et al, VESPER Trial Investigators. Dose-dense methotrexate, vinblastine, doxorubicin, and cisplatin or gemcitabine and cisplatin as perioperative chemotherapy for patients with nonmetastatic muscle-invasive bladder cancer: Results of the GETUG-AFU V05 VESPER trial. J Clin Oncol 2022;40:2013-22. doi:10.1200/JCO.21.02051
58 Galsky MD, Hahn NM, Rosenberg J, et al. A consensus definition of patients with metastatic urothelial carcinoma who are unfit for cisplatin-based chemotherapy. Lancet Oncol 2011;12:211-4. doi:10.1016/S1470-2045(10)70275-8
59 Jiang DM, Gupta S, Kitchlu A, et al. Defining cisplatin eligibility in patients with muscle-invasive bladder cancer. Nat Rev Urol 2021;18:104-14. doi:10.1038/s41585-020-00404-6
60 Hussain SA, Palmer DH, Lloyd B, et al. A study of split-dose cisplatinbased neo-adjuvant chemotherapy in muscle-invasive bladder cancer. Oncol Lett 2012;3:855-9. doi:10.3892/ol.2012.563
61 Advanced Bladder Cancer (ABC) Meta-analysis Collaborators Group. Adjuvant chemotherapy for muscle-invasive bladder cancer: a systematic review and meta-analysis of individual participant data from randomised controlled trials. Eur Urol 2022;81:50-61. doi:10.1016/j.eururo.2021.09.028
62 Bajorin DF, Witjes JA, Gschwend JE, et al. Adjuvant nivolumab versus placebo in muscle-invasive urothelial carcinoma. N Engl/ Med 2021;384:2102-14. doi:10.1056/NEJMoa2034442
63 Galsky MD, Witjes AA, Gschwend JE, et al. Extended follow-up results from the CheckMate 274 trial. J Clin Oncol 2023;41:LBA443-43. doi:10.1200/JCO.2023.41.6_suppl.LBA443
64 Merck. KEYTRUDA significantly improved DFS as adjuvant therapy versus observation for patients with localized MIUC and locally advanced urothelial carcinoma. 2023. https://www.merck.com/
news/mercks-keytruda-pembrolizumab-met-primary-endpoint-of-disease-free-survival-dfs-in-certain-patients-with-muscle-invasive-urothelial-carcinoma-miuc-after-surgery/
65 Johnson PC, Gainor JF, Sullivan RJ, Longo DL, Chabner B. Immune checkpoint inhibitors – the need for innovation. N Engl/ Med 2023;388:1529-32. doi:10.1056/NEJMsb2300232
66 Mak RH, Hunt D, Shipley WU, et al. Long-term outcomes in patients with muscle-invasive bladder cancer after selective bladderpreserving combined-modality therapy: a pooled analysis of Radiation Therapy Oncology Group protocols 8802, 8903, 9506, 9706, 9906, and 0233. J Clin Oncol 2014;32:3801-9. doi:10.1200/ JCO.2014.57.5548
67 James ND, Hussain SA, Hall E, et al, BC2001 Investigators. Radiotherapy with or without chemotherapy in muscle-invasive bladder cancer. N Engl / Med 2012;366:1477-88. doi:10.1056/ NEJMoa1106106
68 Efstathiou JA, Spiegel DY, Shipley WU, et al. Long-term outcomes of selective bladder preservation by combined-modality therapy for invasive bladder cancer: the MGH experience. Eur Urol 2012;61:70511. doi:10.1016/j.eururo.2011.11.010
70 Zlotta AR, Ballas LK, Niemierko A, et al. Radical cystectomy versus trimodality therapy for muscle-invasive bladder cancer: a multiinstitutional propensity score matched and weighted analysis. Lancet Oncol 2023;24:669-81. doi:10.1016/S1470-2045(23)00170-5
71 Galsky MD, Daneshmand S, Chan KG, et al. Phase 2 trial of gemcitabine, cisplatin, plus nivolumab with selective bladder sparing in patients with muscle- invasive bladder cancer (MIBC): HCRN GU 16-257. J Clin Oncol 2021;39:4503. doi:10.1200/JCO.2021.39.15_ suppl. 4503
72 Geynisman DM, Abbosh P, Ross EA, et al. A phase II trial of risk enabled therapy after initiating neoadjuvant chemotherapy for bladder cancer (RETAIN BLADDER): interim analysis. J Clin Oncol 2021;39:397. doi:10.1200/JCO.2021.39.6_suppl. 397
73 Flaig TW, Tangen CM, Daneshmand S, et al. A randomized phase II study of coexpression extrapolation (COXEN) with neoadjuvant chemotherapy for bladder cancer (SWOG S1314; NCT02177695). Clin Cancer Res 2021;27:2435-41. doi:10.1158/1078-0432.CCR-20-2409
74 US Food & Drug Administration. FDA approves enfortumab vedotin-ejfv with pembrolizumab for locally advanced or metastatic urothelial cancer. 2023. https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-enfortumab-vedotin-ejfv-pembrolizumab-locally-advanced-or-metastatic-urothelial-cancer
75 Bellmunt J, de Wit R, Vaughn DJ, et al, KEYNOTE-045 Investigators. Pembrolizumab as second-line therapy for advanced urothelial carcinoma. N Engl J Med 2017;376:1015-26. doi:10.1056/ NEJMoa1613683
76 Powles T, Csőszi T, Özgüroğlu M, et al, KEYNOTE-361 Investigators. Pembrolizumab alone or combined with chemotherapy versus chemotherapy as first-line therapy for advanced urothelial carcinoma (KEYNOTE-361): a randomised, open-label, phase 3 trial. Lancet Oncol 2021;22:931-45. doi:10.1016/S1470-2045(21)00152-2
77 Powles T, Park SH, Voog E, et al. Avelumab maintenance therapy for advanced or metastatic urothelial carcinoma. N Engl) Med 2020;383:1218-30. doi:10.1056/NEJMoa2002788
78 Powles T, Park SH, Caserta C, et al. Avelumab first-line maintenance for advanced urothelial carcinoma: results from the JAVELIN bladder 100 trial after >/=2 years of follow-up. J Clin Oncol 2023;41:348692. doi:10.1200/JCO.22.01792
80 Food and Drug Administration. FDA grants accelerated approval to erdafitinib for metastatic urothelial carcinoma. 2019. https://www. fda.gov/drugs/resources-information-approved-drugs/fda-grants-accelerated-approval-erdafitinib-metastatic-urothelial-carcinoma
81 Loriot Y, Matsubara N, Park SH, et al, THOR Cohort 1 Investigators. Erdafitinib or chemotherapy in advanced or metastatic urothelial carcinoma. N Engl J Med 2023;389:1961-71. doi:10.1056/ NEJMoa2308849
82 Loriot Y, Necchi A, Park SH, et al, BLC2001 Study Group. Erdafitinib in locally advanced or metastatic urothelial carcinoma. N Engl) Med 2019;381:338-48. doi:10.1056/NEJMoa1817323
83 Al-Obaidy KI, Cheng L. Fibroblast growth factor receptor (FGFR) gene: pathogenesis and treatment implications in urothelial carcinoma of the bladder. J Clin Pathol 2021;74:491-5. doi:10.1136/ jclinpath-2020-207115
84 Siefker-Radtke AO, Matsubara N, Park SH, et al, THOR cohort 2 investigators. Erdafitinib versus pembrolizumab in pretreated patients with advanced or metastatic urothelial cancer with select
85 Powles T, Rosenberg JE, Sonpavde GP, et al. Enfortumab vedotin in previously treated advanced urothelial carcinoma.
86 Rosenberg JE, Powles T, Sonpavde GP, et al. EV-301 long-term outcomes: 24-month findings from the phase III trial of enfortumab vedotin versus chemotherapy in patients with previously treated advanced urothelial carcinoma. Ann Oncol 2023;34:1047-54. doi:10.1016/j.annonc.2023.08.016
87 Food and Drug Administration. FDA grants accelerated approval to enfortumab vedotin-ejfv with pembrolizumab for locally advanced or metastatic urothelial carcinoma. 2023. https://www.fda.gov/drugs/ resources-information-approved-drugs/fda-grants-accelerated-approval-enfortumab-vedotin-ejfv-pembrolizumab-locally-advanced-or-metastatic
88 Hoimes CJ, Flaig TW, Milowsky MI, et al. Enfortumab vedotin plus pembrolizumab in previously untreated advanced urothelial cancer. / Clin Oncol 2023;41:22-31. doi:10.1200/JC0.22.01643
89 Gupta S, Rosenberg JE, McKay RR, et al. Study EV-103 dose escalation/cohort A: Long-term outcome of enfortumab vedotin + pembrolizumab in first-line (1L) cisplatin-ineligible locally advanced or metastatic urothelial carcinoma (la/mUC) with nearly 4 years of follow-up. J Clin Oncol 2023;41:4505. doi:10.1200/ JCO.2023.41.16_suppl. 4505
90 Powles TB, Perez Valderrama B, Gupta S, et al. LBA6 EV-302/ KEYNOTE-A39: Open-label, randomized phase III study of enfortumab vedotin in combination with pembrolizumab (EV+P) vs chemotherapy (Chemo) in previously untreated locally advanced metastatic urothelial carcinoma (la/mUC). Ann Oncol 2023;34:S1340doi:10.1016/j.annonc.2023.10.106
91 Tagawa ST, Balar AV, Petrylak DP, et al. TROPHY-U-01: A phase II openlabel study of sacituzumab govitecan in patients with metastatic urothelial carcinoma progressing after platinum-based chemotherapy and checkpoint inhibitors. J Clin Oncol 2021;39:2474-85. doi:10.1200/JCO.20.03489
92 Mariathasan S, Turley SJ, Nickles D, et al. TGF
93 Tagawa ST, Balar AV, Petrylak DP, et al. Updated outcomes in TROPHY-U-01 cohort 1, a phase 2 study of sacituzumab govitecan (SG) in patients (pts) with metastatic urothelial cancer (mUC) that progressed after platinum (PT)-based chemotherapy and a checkpoint inhibitor (CPI). J Clin Oncol 2023;41:526. doi:10.1200/ JCO.2023.41.6_suppl. 526
94 Food and Drug Administration. FDA grants accelerated approval to sacituzumab govitecan for advanced urothelial cancer. 2021. https://www.fda.gov/drugs/resources-information-approved-drugs/ fda-grants-accelerated-approval-sacituzumab-govitecan-advanced-urothelial-cancer
95 Kollberg P, Chebil G, Eriksson P, Sjödahl G, Liedberg F. Molecular subtypes applied to a population-based modern cystectomy series do not predict cancer-specific survival. Urol Oncol 2019;37:791-9. doi:10.1016/j.urolonc.2019.04.010
96 Mohanty SK, Lobo A, Mishra SK, Cheng L. Precision medicine in bladder cancer: Present challenges and future directions. J Pers Med 2023;13:756. doi:10.3390/jpm13050756
97 O’Donnell PH, Milowsky MI, Petrylak DP, et al. Enfortumab vedotin with or without pembrolizumab in cisplatin-ineligible patients with previously untreated locally advanced or metastatic urothelial cancer. J Clin Oncol 2023;41:4107-17. doi:10.1200/JC0.22.02887
98 Seiler R, Ashab HAD, Erho N, et al. Impact of molecular subtypes in muscle-invasive bladder cancer on predicting response and survival after neoadjuvant chemotherapy. Eur Urol 2017;72:544-54. doi:10.1016/j.eururo.2017.03.030
99 Necchi A, de Jong JJ, Raggi D, et al. Molecular characterization of residual bladder cancer after neoadjuvant pembrolizumab. Eur Urol 2021;80:149-59. doi:10.1016/j.eururo.2021.03.014
100 Morera DS, Hasanali SL, Belew D, et al. Clinical parameters outperform molecular subtypes for predicting outcome in bladder cancer: Results from multiple cohorts, including TCGA. J Urol 2020;203:62-72. doi:10.1097/JU.0000000000000351
102 Urun Y, Leow JJ, Fay AP, Albiges L, Choueiri TK, Bellmunt J. ERCC1 as a prognostic factor for survival in patients with advanced urothelial cancer treated with platinum based chemotherapy: A systematic review and meta-analysis. Crit Rev Oncol Hematol 2017;120:120-6. doi:10.1016/j.critrevonc.2017.10.012
103 European Society For Medical Oncology. EMA recommends extension of therapeutic indications for nivolumab. 2022. https://www.esmo. org/oncology-news/ema-recommends-extension-of-therapeutic-indications-for-nivolumab3
104 Iyer G, Audenet F, Middha S, et al. Mismatch repair (MMR) detection in urothelial carcinoma (UC) and correlation with immune checkpoint blockade (ICB) response. J Clin Oncol 2017;35:4511. doi:10.1200/ JCO.2017.35.15_suppl. 4511
105 Iyer G, Balar AV, Milowsky MI, et al. Multicenter prospective phase II trial of neoadjuvant dose-dense gemcitabine plus cisplatin in patients with muscle-invasive bladder cancer. J Clin Oncol 2018;36:1949-56. doi:10.1200/JC0.2017.75.0158
106 Klümper N, Ralser DJ, Ellinger J, et al. Membranous NECTIN-4 expression frequently decreases during metastatic spread of urothelial carcinoma and is associated with enfortumab vedotin resistance. Clin Cancer Res 2023;29:1496-505. doi:10.1158/1078-0432.CCR-22-1764
108 Borhani S, Borhani R, Kajdacsy-Balla A. Artificial intelligence: A promising frontier in bladder cancer diagnosis and outcome prediction. Crit Rev Oncol Hematol 2022;171:103601. doi:10.1016/j.critrevonc.2022.103601
109 Harmon SA, Sanford TH, Brown GT, et al. Multiresolution application of artificial intelligence in digital pathology for prediction of positive lymph nodes from primary tumors in bladder cancer. JCO Clin Cancer Inform 2020;4:367-82. doi:10.1200/CCl.19.00155
110 Chamie K, Chang SS, Kramolowsky E, et al. IL-15 Superagonist NAI in BCG-unresponsive non-muscle-invasive bladder cancer. NEJM Evid 2023;2:EVIDoa2200167. doi:10.1056/EVIDoa2200167
111 Modi S, Jacot W, Yamashita T, et al, DESTINY-Breast04 Trial Investigators. Trastuzumab deruxtecan in previously treated HER2-low advanced breast cancer. N Engl J Med 2022;387:9-20. doi:10.1056/NEJMoa2203690
112 Meric-Bernstam F, Makker V, Oaknin A, et al. Efficacy and safety of trastuzumab deruxtecan in patients with HER2-expressing solid tumors: primary results from the DESTINY-PanTumor02 phase II trial. / Clin Oncol 2024;42:47-58. doi:10.1200/JC0.23.02005
113 Sheng X, Wang L, He Z, et al. Efficacy and safety of disitamab vedotin in patients with human epidermal growth factor receptor 2-positive locally advanced or metastatic urothelial carcinoma: a combined analysis of two phase II clinical trials. J Clin Oncol 2023;Nov 21:JCO2202912. doi:10.1200/JC0.22.02912
114 Sheng X, Zhou L, Yang K, et al. Disitamab vedotin, a novel humanized anti-HER2 antibody-drug conjugate (ADC), combined with toripalimab in patients with locally advanced or metastatic urothelial carcinoma: An open-label phase 1b/2 study. J Clin Oncol 2023;41:4566doi:10.1200/JC0.2023.41.16_suppl. 4566
115 Sadeghi S, Quinn D, Dorff T, et al. EphrinB2 inhibition and pembrolizumab in metastatic urothelial carcinoma. J Clin Oncol 2023;41:640-50. doi:10.1200/JC0.21.02923
116 Baldini C, Goldschmidt V, Bran I, et al. BT8009-100: A phase I/ II study of novel bicyclic peptide and MMAE conjugate BT8009 in patients (pts) with advanced malignancies associated with nectin-4 expression, including urothelial cancer (UC). J Clin Oncol 2023;41:498doi:10.1200/JCO.2023.41.6_suppl. 498
117 Ballard JA, Kercher T, Abraham D, et al. Abstract P141: Preclinical characterization of LOX-24350, a highly potent and isoform-selective FGFR3 inhibitor. Mol Cancer Ther 2021;20:141doi:10.1158/1535-7163.TARG-21-P141
