DOI: https://doi.org/10.1038/s41591-024-03355-2
PMID: https://pubmed.ncbi.nlm.nih.gov/39753963
تاريخ النشر: 2025-01-01
التغيرات البروتينية عند العلاج بالسيماغلوتيد لدى الأفراد الذين يعانون من السمنة
تاريخ القبول: 14 أكتوبر 2024
تاريخ النشر على الإنترنت: 3 يناير 2025
تحقق من التحديثات
الملخص
تعتبر السمنة ومرض السكري من النوع 2 من الأمراض المزمنة الشائعة التي يتم إدارتها بفعالية بواسطة السيماغلوتيد. هنا درسنا تأثيرات السيماغلوتيد على البروتينات الدائرة باستخدام عينات مصل الدم من بداية العلاج ونهايته من تجربتين من المرحلة 3 لمشاركين يعانون من زيادة الوزن أو السمنة، مع أو بدون سكري: STEP
ويحسن جودة الحياة للأفراد المتأثرين
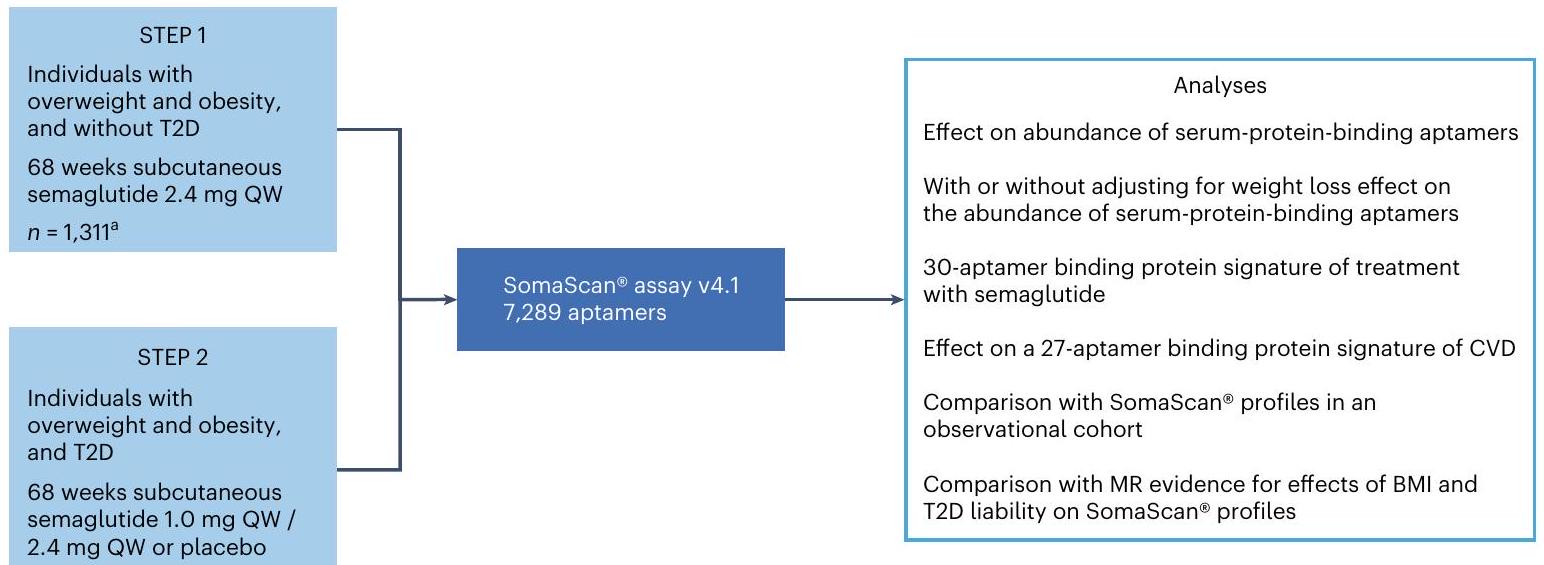
في الدراسة الذين كانت لديهم عينة حيوية متاحة لتوصيف البروتينات. تم استبعاد ذراع السيماغلوتيد 1.0 ملغ من معظم التحليلات اللاحقة، باستثناء تحليل مخاطر الأمراض القلبية الوعائية. MR، التوزيع العشوائي المندلي؛ QW، كل أسبوع.
استجابة وتقدم المرض، وتحديد أهداف علاجية جديدة
طوال التجربة لدى أولئك الذين يعانون من T2D والذين لا يعانون منها، ومن خلال مقارنة ملفات البروتينات مع تلك الخاصة بالمجموعات الملاحظة، هدفنا إلى دراسة شاملة لتأثيرات السيماغلوتيد على البروتينات وتوضيح آلية العمل التي تدفع فوائده على الوزن ومضاعفات السمنة، وتحديد إمكانياته للاستخدام في مؤشرات جديدة.
النتائج
خصائص المشاركين في الدراسة
تأثيرات السيماغلوتيد على البروتينات الدائرة
| خصائص | الخطوة 1،
|
الخطوة 2،
|
| العمر، المتوسط ± الانحراف المعياري (سنوات) |
|
|
| الجنس الأنثوي
|
955 (72.8) | 321 (49.8) |
| العرق أو المجموعة العرقية،
|
||
| أبيض | 984 (75.1) | ٣٨٨ (٦٠.٢) |
| آسيوي | 162 (12.4) | 183 (28.4) |
| أسود أو أمريكي من أصل أفريقي | 65 (5.0) | 55 (8.5) |
| آخر | 100 (7.6) | 19 (2.9) |
| مجموعة عرقية من أصل إسباني أو لاتيني،
|
135 (10.3) | 77 (11.9) |
| وزن الجسم، المتوسط ± الانحراف المعياري (كجم) |
|
|
| مؤشر كتلة الجسم (BMI)
|
||
| المتوسط ± الانحراف المعياري (
|
|
|
| توزيع
|
||
| <30 | 80 (6.1) | ١٢٢ (١٨.٩) |
|
|
433 (33.0) | 231 (35.8) |
|
|
401 (30.6) | 149 (23.1) |
|
|
397 (30.3) | 143 (22.2) |
| محيط الخصر، المتوسط ± الانحراف المعياري (سم) |
|
|
|
|
|
|
| ما قبل السكري
|
570 (43.5) |
|
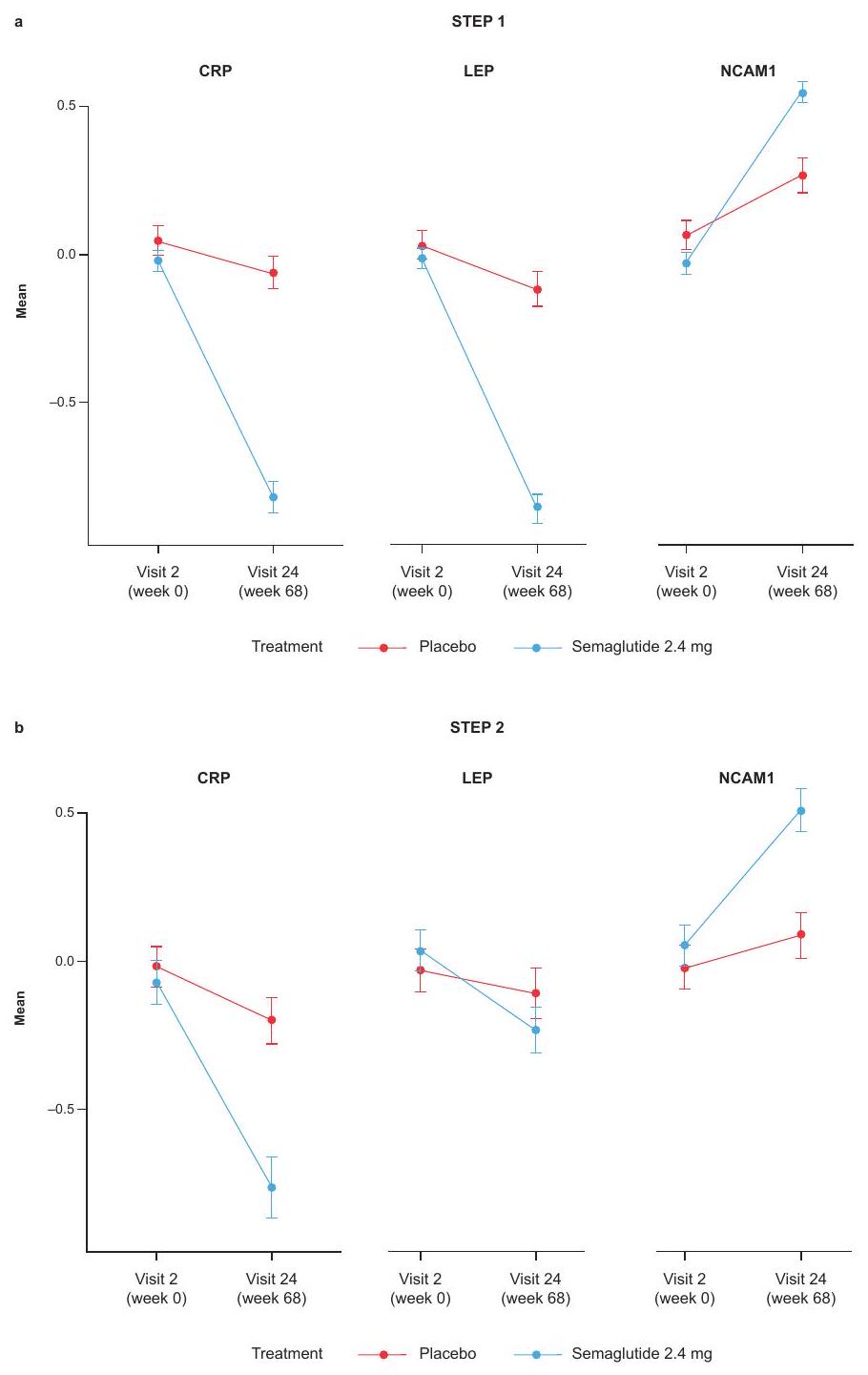
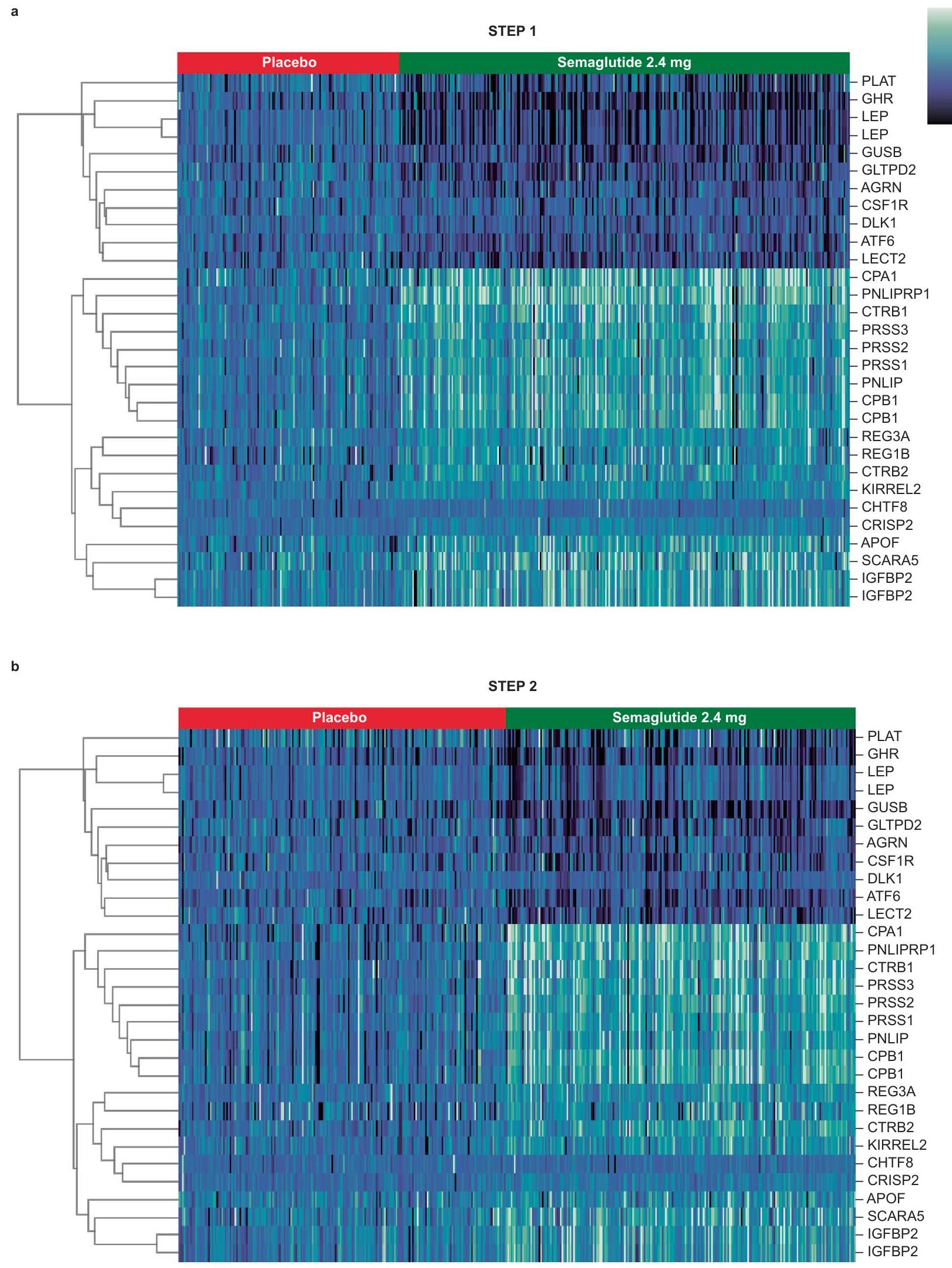
تم عرض STEP 1 و STEP 2 في الشكل البياني الموسع 1. لم يتم الكشف عن أي تأثير للجنس في الاستجابة البروتينية لعلاج السيماغلوتيد في كل من STEP 1 و STEP 2 (الجداول التكميلية 4 و 5).
فقدان الوزن و
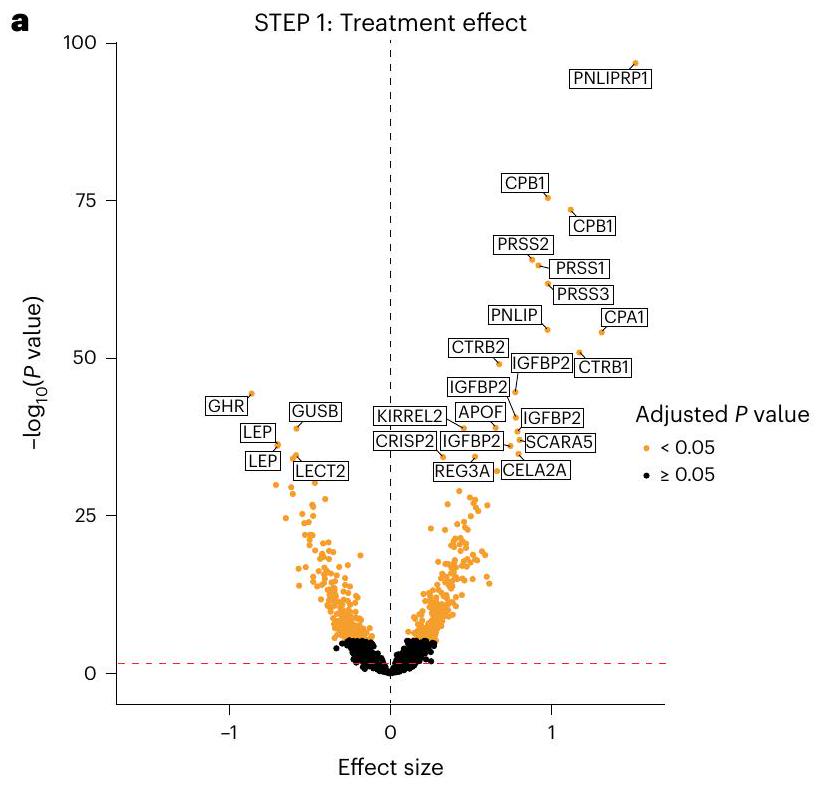
والبروتينات التي تم تنظيمها بشكل كبير في هذا التحليل مرتبطة بتأثيرات بيولوجية متنوعة (على سبيل المثال، الإجهاد القلبي، الالتهاب وعمليات الأيض الدهني) وقد وُجد سابقًا أنها مرتفعة في أمراض القلب والأوعية الدموية أو مرتبطة بزيادة خطر الإصابة بها. البروتينات التي تم تنظيمها بشكل كبير عند التعديل لتأثيرات وزن الجسم في الخطوة 1 والمعروفة بأنها مرتبطة بخطر الإصابة بأمراض القلب والأوعية الدموية تضمنت تيناسين C (TNC)، NT-proBNP، ثرومبوسبوندين 2 (THBS2)، مستقبل مكون المكمل C1q (مجموعة التمايز 93 (CD93))، مستقبل الماكروفاج 1-النطاق الخارجي (MSR1) وأنجيوبيوتين-2 (ANGPT2). بينما تضمنت البروتينات الأخرى التي تم تنظيمها بشكل كبير وغير المرتبطة بأمراض القلب والأوعية الدموية البروتين السري المتعلق بفريزل-4 (sFRP4) وبروتين ربط الأحماض الدهنية في الكبد (LFABP)، في حين تم تنظيم الجرونولين (GRN) بشكل كبير. مشابهًا للتحليل السابق الذي تم فيه أخذ وزن الجسم في الاعتبار و
التوقيع البروتيني لعلاج السيماغلوتيد
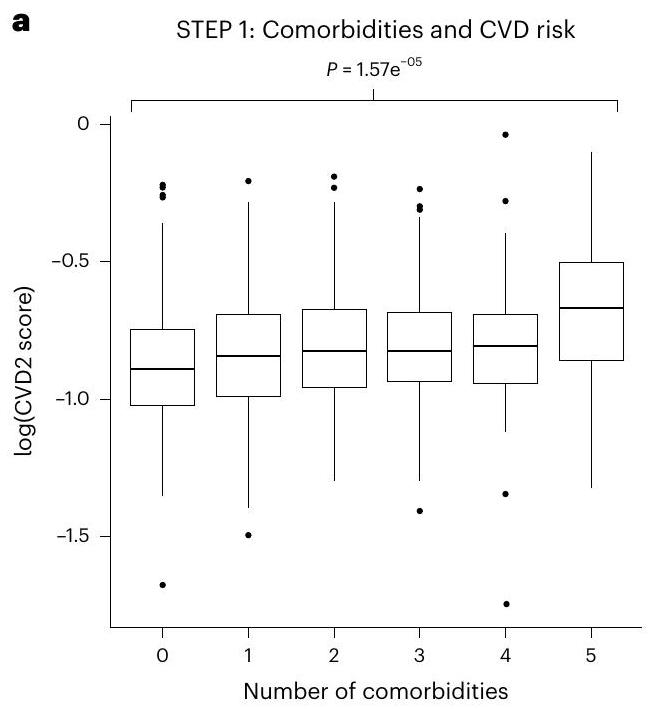
أثر علاج السيماغلوتيد على بصمة بروتينية لمخاطر أمراض القلب والأوعية الدموية
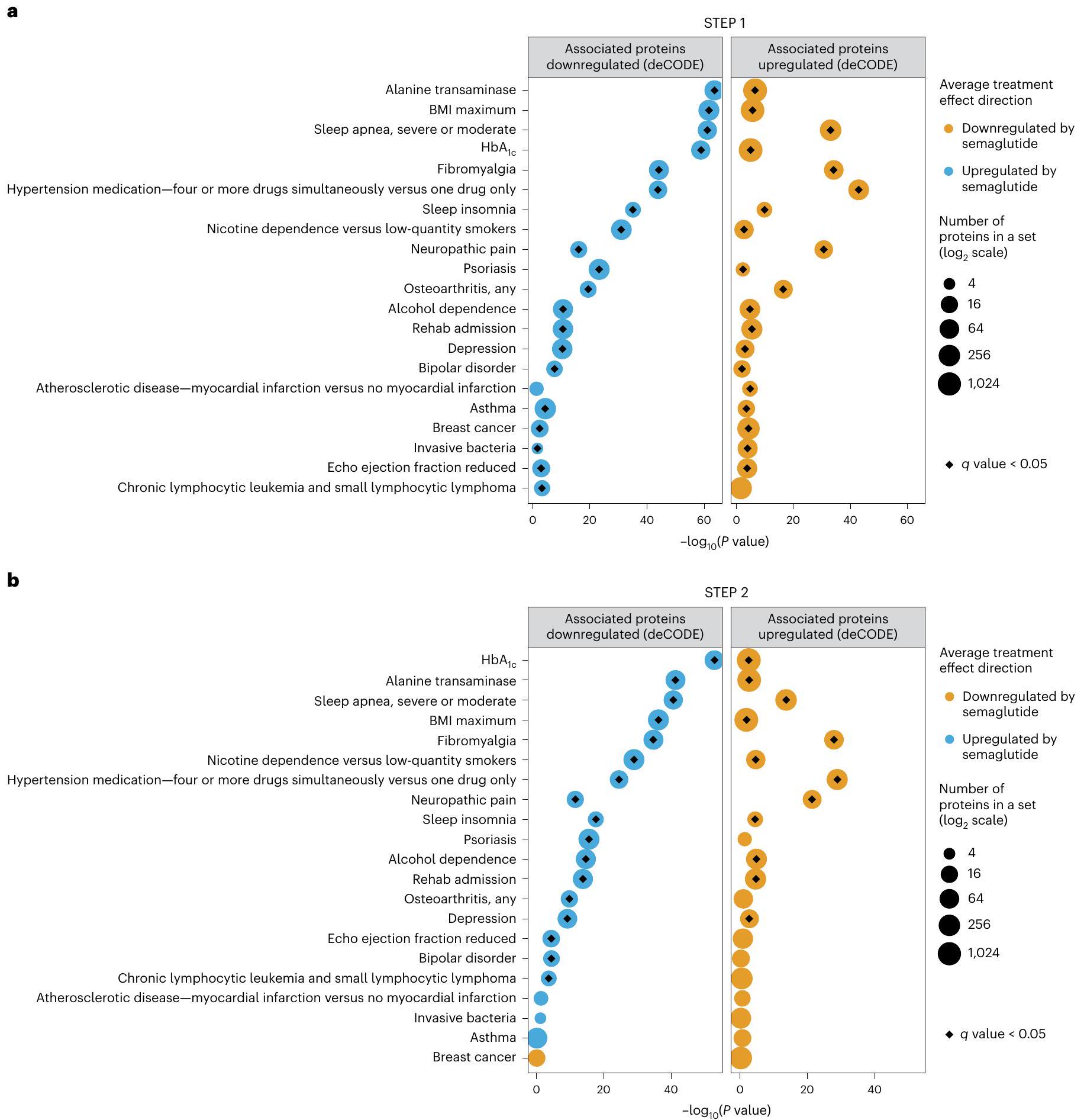
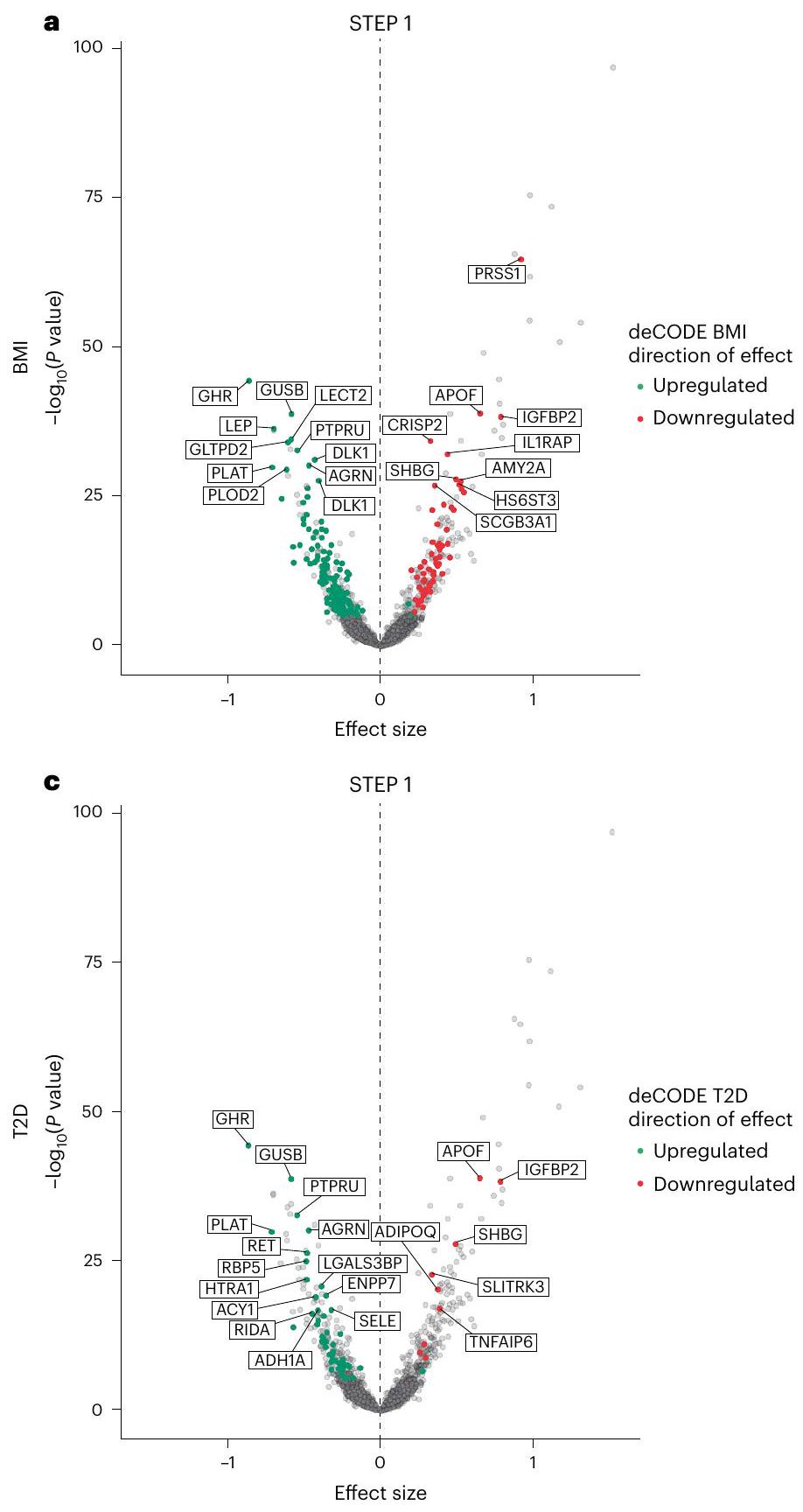
مقارنة مع بيانات مجموعة المراقبة الأيسلندية (deCODE)
(الشكل 4). على سبيل المثال، في STEP1، خفض السيماغلوتيد البروتينات التي يتم تنظيمها بشكل زائد في الفيبروميالجيا، ارتفاع ضغط الدم، اضطرابات تعاطي المواد، الألم العصبي، التهاب المفاصل، الصدفية، الاكتئاب، الربو، سرطان الثدي وانخفاض الكسر القذفي، وزاد البروتينات التي يتم تنظيمها بشكل ناقص في هذه الحالات (بالإضافة إلى اللوكيميا اللمفاوية المزمنة واللمفوما اللمفاوية الصغيرة على الرغم من
المقارنة مع تحليلات العشوائية المندلية لمؤشر كتلة الجسم والوراثة الجينية لـ T2D
المناقشة





(VLED) أدى إلى تغييرات مضادة في هرمونات تنظيم الشهية، بما في ذلك زيادة ملحوظة في مستويات الجريلين أثناء الصيام وانخفاضات ملحوظة في مستويات اللبتين وGLP-1 وبيبتيد YY (PYY) والكوليسيستوكينين (CCK) والأميلين أثناء الصيام.

قياس
المحتوى عبر الإنترنت
References
- World Obesity Federation. World Obesity Atlas 2023 (Global Obesity Observatory, 2023).
- Murray, C. J. L. et al. Global burden of 87 risk factors in 204 countries and territories, 1990-2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet 396, 1223-1249 (2020).
- Bhaskaran, K., dos-Santos-Silva, I., Leon, D. A., Douglas, I. J. & Smeeth, L. Association of BMI with overall and cause-specific mortality: a population-based cohort study of 3.6 million adults in the UK. Lancet Diabetes Endocrinol. 6, 944-953 (2018).
- Kivimäki, M. et al. Body-mass index and risk of obesity-related complex multimorbidity: an observational multicohort study. Lancet Diabetes Endocrinol. 10, 253-263 (2022).
- Tahrani, A. A. & Morton, J. Benefits of weight loss of
or more in patients with overweight or obesity: a review. Obesity 30, 802-840 (2022). - Chandramouli, K. & Qian, P. Y. Proteomics: challenges, techniques and possibilities to overcome biological sample complexity. Hum. Genomics Proteomics 2009, 239204 (2009).
- Lill, J. R., Mathews, W. R., Rose, C. M. & Schirle, M. Proteomics in the pharmaceutical and biotechnology industry: a look to the next decade. Expert Rev. Proteomics 18, 503-526 (2021).
- Gold, L. et al. Aptamer-based multiplexed proteomic technology for biomarker discovery. PLoS ONE 5, e15004 (2010).
- Figarska, S. M. et al. Proteomic profiles before and during weight loss: results from randomized trial of dietary intervention. Sci. Rep. 10, 7913 (2020).
- Dreyfuss, J. M. et al. High-throughput mediation analysis of human proteome and metabolome identifies mediators of post-bariatric surgical diabetes control. Nat. Commun. 12, 6951 (2021).
- OZEMPIC
(Semaglutide) Prescribing Information (US Food and Drug Administration, 2017). - RYBELSUS
(Semaglutide) Prescribing Information (US Food and Drug Administration, 2020). - Aroda, V. R. et al. Comparative efficacy, safety, and cardiovascular outcomes with once-weekly subcutaneous semaglutide in the treatment of type 2 diabetes: insights from the SUSTAIN 1-7 trials. Diabetes Metab. 45, 409-418 (2019).
- Meier, J. J. Efficacy of semaglutide in a subcutaneous and an oral formulation. Front. Endocrinol. 12, 645617 (2021).
- Friedrichsen, M., Breitschaft, A., Tadayon, S., Wizert, A. & Skovgaard, D. The effect of semaglutide 2.4 mg once weekly on energy intake, appetite, control of eating, and gastric emptying in adults with obesity. Diabetes Obes. Metab. 23, 754-762 (2021).
- Gabery, S. et al. Semaglutide lowers body weight in rodents via distributed neural pathways. JCI Insight 5, e133429 (2020).
- WEGOVY
(Semaglutide) Prescribing Information (US Food and Drug Administration, 2021). - WEGOVY
(Semaglutide) Prescribing Information (US Food and Drug Administration, 2024). - WEGOVY
(Semaglutide) Prescribing Information (US Food and Drug Administration, 2022). - Wilding, J. P. H. et al. Once-weekly semaglutide in adults with overweight or obesity. N. Engl. J. Med. 384, 989-1002 (2021).
- Davies, M. et al. Semaglutide 2.4 mg once a week in adults with overweight or obesity, and type 2 diabetes (STEP 2): a randomised, double-blind, double-dummy, placebo-controlled, phase 3 trial. Lancet 397, 971-984 (2021).
- Williams, S. A. et al. A proteomic surrogate for cardiovascular outcomes that is sensitive to multiple mechanisms of change in risk. Sci. Transl. Med. 14, eabj9625 (2022).
- Ferkingstad, E. et al. Large-scale integration of the plasma proteome with genetics and disease. Nat. Genet. 53, 1712-1721(2021).
- Wang, W. et al. Associations of semaglutide with incidence and recurrence of alcohol use disorder in real-world population. Nat. Commun. 15, 4548 (2024).
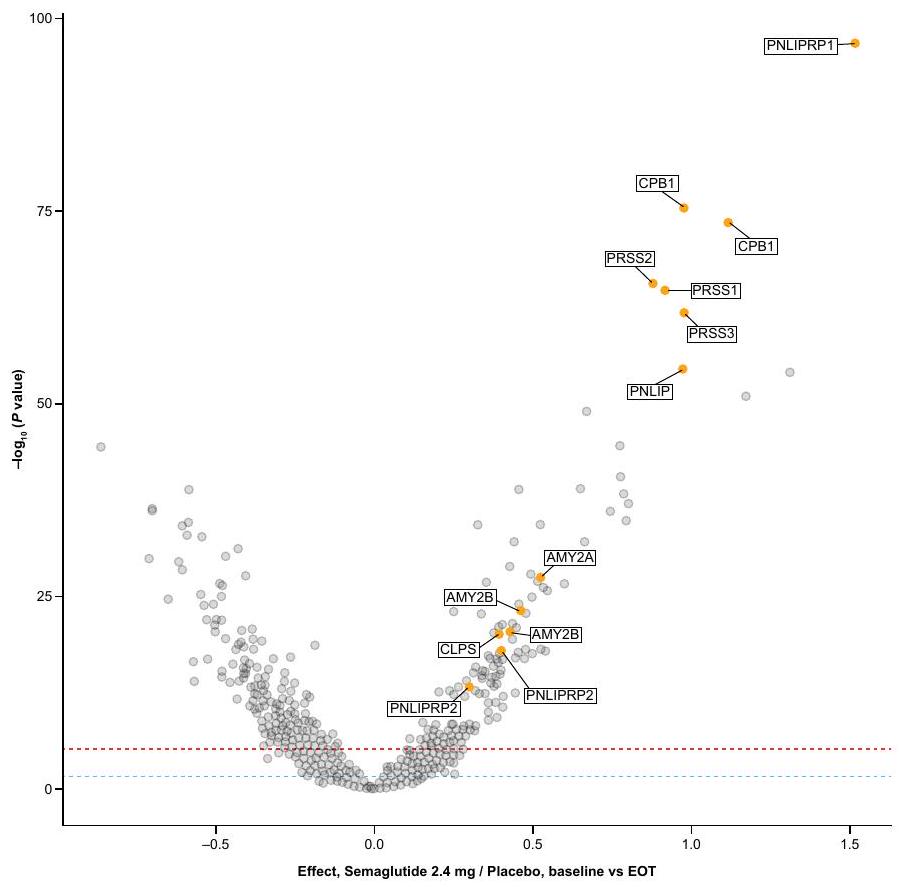
- Steinberg, W. M. et al. Impact of liraglutide on amylase, lipase, and acute pancreatitis in participants with overweight/obesity and normoglycemia, prediabetes, or type 2 diabetes: secondary analyses of pooled data from the SCALE Clinical Development Program. Diabetes Care 40, 839-848 (2017).
- Steinberg, W. M., Buse, J. B., Ghorbani, M. L. M., Ørsted, D. D. & Nauck, M. A. Amylase, lipase, and acute pancreatitis in people with type 2 diabetes treated with liraglutide: results from the LEADER randomized trial. Diabetes Care 40, 966-972 (2017).
- Li, L. et al. Incretin treatment and risk of pancreatitis in patients with type 2 diabetes mellitus: systematic review and meta-analysis of randomised and non-randomised studies. BMJ 348, g2366 (2014).
- Abd El Aziz, M., Cahyadi, O., Meier, J. J., Schmidt, W. E. & Nauck, M. A. Incretin-based glucose-lowering medications and the risk of acute pancreatitis and malignancies: a meta-analysis based on cardiovascular outcomes trials. Diabetes Obes. Metab. 22, 699-704 (2020).
- Pinto, L. C., Falcetta, M. R., Rados, D. V., Leitão, C. B. & Gross, J. L. Glucagon-like peptide-1 receptor agonists and pancreatic cancer: a meta-analysis with trial sequential analysis. Sci. Rep. 9, 2375 (2019).
- Sakamuri, S. et al. Absence of tissue inhibitor of metalloproteinase-4 (TIMP4) ameliorates high fat diet-induced obesity in mice due to defective lipid absorption. Sci. Rep. 7, 6210 (2017).
- Aller, E., Mariman, E. C. M., Bouwman, F. G. & van Baak, M. A. Genetic predictors of
weight loss by multidisciplinary advice to severely obese subjects. J. Nutrigenet. Nutrigenomics 10, 32-42 (2017). - Deanfield, J. et al. Relevance of body weight and weight change on cardiovascular benefit with semaglutide: a pre-specified analysis of the SELECT trial. Obes. Facts 17, 491-492 (2024).
- Marso, S. P. et al. Liraglutide and cardiovascular outcomes in type 2 diabetes. N. Engl. J. Med. 375, 311-322 (2016).
- Sattar, N. et al. Cardiovascular, mortality, and kidney outcomes with GLP-1 receptor agonists in patients with type 2 diabetes: a systematic review and meta-analysis of randomised trials. Lancet Diabetes Endocrinol. 9, 653-662 (2021).
- Gerstein, H. C. et al. Dulaglutide and cardiovascular outcomes in type 2 diabetes (REWIND): a double-blind, randomised placebo-controlled trial. Lancet 394, 121-130 (2019).
- Lincoff, A. M. et al. Semaglutide and cardiovascular outcomes in obesity without diabetes. N. Engl. J. Med. 389, 2221-2232 (2023).
- Panagopoulou, V. et al. NTproBNP: an important biomarker in cardiac diseases. Curr. Top. Med. Chem. 13, 82-94 (2013).
- Nicolini, G., Forini, F., Kusmic, C., Iervasi, G. & Balzan, S. Angiopoietin 2 signal complexity in cardiovascular disease and cancer. Life Sci. 239, 117080 (2019).
- Lugano, R. et al. CD93 maintains endothelial barrier function by limiting the phosphorylation and turnover of VE-cadherin. FASEB J. 37, e22894 (2023).
- Yu, H. et al. Scavenger receptor A (SR-A) is required for LPS-induced TLR4 mediated NF-кB activation in macrophages. Biochim. Biophys. Acta 1823, 1192-1198 (2012).
- Van Eck, M. et al. Effect of human scavenger receptor class A overexpression in bone marrow-derived cells on cholesterol levels and atherosclerosis in ApoE-deficient mice. Arterioscler. Thromb. Vasc. Biol. 20, 2600-2606 (2000).
- Trinh, K., Julovi, S. M. & Rogers, N. M. The role of matrix proteins in cardiac pathology. Int. J. Mol. Sci. 23, 1338 (2022).
- Peters, A. E. et al. Proteomic pathways across ejection fraction spectrum in heart failure: an EXSCEL substudy. Preprint at medRxiv https://doi.org/10.1101/2023.05.16.23288273 (2023).
- Kosiborod, M. N. et al. Design and baseline characteristics of STEP-HFpEF program evaluating semaglutide in patients with obesity HFpEF phenotype. JACC Heart Fail. 11, 1000-1010 (2023).
- Kosiborod, M. N. et al. Semaglutide in patients with heart failure with preserved ejection fraction and obesity. N. Engl. J. Med. 389, 1069-1084 (2023).
- Kosiborod, M. N. et al. Semaglutide in patients with obesityrelated heart failure and type 2 diabetes. N. Engl. J. Med. 390, 1394-1407 (2024).
- Wroe, A. L. Intentional and unintentional nonadherence: a study of decision making. J. Behav. Med. 25, 355-372 (2002).
- Sumithran, P. et al. Long-term persistence of hormonal adaptations to weight loss. N. Engl. J. Med. 365, 1597-1604 (2011).
- Wharton, S. et al. Two-year effect of semaglutide 2.4 mg on control of eating in adults with overweight/obesity: STEP 5. Obesity 31, 703-715 (2023).
- Garvey, W. T. et al. Two-year effects of semaglutide in adults with overweight or obesity: the STEP 5 trial. Nat. Med. 28, 2083-2091 (2022).
- Hill, J. W. Gene expression and the control of food intake by hypothalamic POMC/CART neurons. Open Neuroendocrinol. J. 3, 21-27 (2010).
- Morton, G. J. & Schwartz, M. W. The NPY/AgRP neuron and energy homeostasis. Int. J. Obes. Relat. Metab. Disord. 25, S56-S62 (2001).
- Jais, A. & Brüning, J. C. Arcuate nucleus-dependent regulation of metabolism-pathways to obesity and diabetes mellitus. Endocr. Rev. 43, 314-328 (2021).
- Yousri, N. A. et al. Proteome-wide associations with short- and long-term weight loss and regain after Roux-en-Y gastric bypass surgery. Obesity 30, 129-141 (2022).
- Purnell, J. Q. et al. Prospective evaluation of insulin and incretin dynamics in obese adults with and without diabetes for 2 years after Roux-en-Y gastric bypass. Diabetologia 61, 1142-1154 (2018).
- Clark, S. L. et al. Combined whole methylome and genomewide association study implicates CNTN4 in alcohol use. Alcohol Clin. Exp. Res. 39, 1396-1405 (2015).
- King, W. C. et al. Prevalence of alcohol use disorders before and after bariatric surgery. JAMA 307, 2516-2525 (2012).
- Hasanzadeh, Z. et al. Evaluation of the serum Dkk-1, tenascin-C, oxidative stress markers levels and Wnt signaling pathway genes expression in patients with Alzheimer’s disease. J. Mol. Neurosci. 71, 879-887 (2021).
- Mao, Q. et al. Disease and region specificity of granulin immunopositivities in Alzheimer disease and frontotemporal lobar degeneration. J. Neuropathol. Exp. Neurol. 76, 957-968 (2017).
- Mendsaikhan, A., Tooyama, I. & Walker, D. G. Microglial progranulin: involvement in Alzheimer’s disease and neurodegenerative diseases. Cells 8, 230 (2019).
- Bukhari, S. A. et al. Secreted frizzled-related protein 4 and its implication in obesity and type-2 diabetes. IUBMB Life 71, 1701-1710 (2019).
- Mahdi, T. et al. Secreted frizzled-related protein 4 reduces insulin secretion and is overexpressed in type 2 diabetes. Cell Metab. 16, 625-633 (2012).
- Özenirler, S. et al. Serum liver fatty acid binding protein shows good correlation with liver histology in NASH. Hepatogastroenterology 60, 1095-1100 (2013).
- Bao, X. et al. Proteomic profiles of body mass index and waist-to-hip ratio and their role in incidence of diabetes. J. Clin. Endocrinol. Metab. 107, e2982-e2990 (2022).
- Roh, J. D. et al. Plasma proteomics of COVID-19-associated cardiovascular complications: implications for pathophysiology and therapeutics. JACC Basic Transl. Sci. 7, 425-441 (2022).
- American Diabetes Association. 2. Classification and diagnosis of diabetes. Diabetes Care 40, S11-S24 (2017).
© The Author(s) 2025
genetic proxies. Single-nucleotide polymorphisms were clumped at a pairwise linkage disequilibrium
ملخص التقرير
توفر البيانات
توفر الشيفرة
References
- SomaLogic. SomaScan
Assay v4.1. (SomaLogic, 2021). - Ding, C. & Peng, H. Minimum redundancy feature selection from microarray gene expression data. J. Bioinform. Comput. Biol. 3, 185-205 (2005).
- Wu, D. & Smyth, G. K. Camera: a competitive gene set test accounting for inter-gene correlation. Nucleic Acids Res. 40, e133 (2012).
- camera: competitive gene set test accounting for inter-gene correlation (rdrr.io).
- Liberzon, A. et al. The Molecular Signatures Database (MSigDB) hallmark gene set collection. Cell Syst. 1, 417-425 (2015).
- Pulit, S. L. et al. Meta-analysis of genome-wide association studies for body fat distribution in 694649 individuals of European ancestry. Hum. Mol. Genet. 28, 166-174 (2019).
- Mahajan, A. et al. Multi-ancestry genetic study of type 2 diabetes highlights the power of diverse populations for discovery and translation. Nat. Genet. 54, 560-572(2022).
- Abecasis, G. R. et al. An integrated map of genetic variation from 1,092 human genomes. Nature 491, 56-65 (2012).
- Burgess, S., Butterworth, A. & Thompson, S. G. Mendelian randomization analysis with multiple genetic variants using summarized data. Genet. Epidemiol. 37, 658-665 (2013).
- Maretty, L. et al. Proteomic changes upon treatment with semaglutide in individuals with obesity. Zenodo https://doi.org/ 10.5281/zenodo. 13356055 (2024).
شكر وتقدير
مساهمات المؤلفين
المصالح المتنافسة
ل.ز. يعلن عدم وجود مصالح متنافسة.
معلومات إضافية
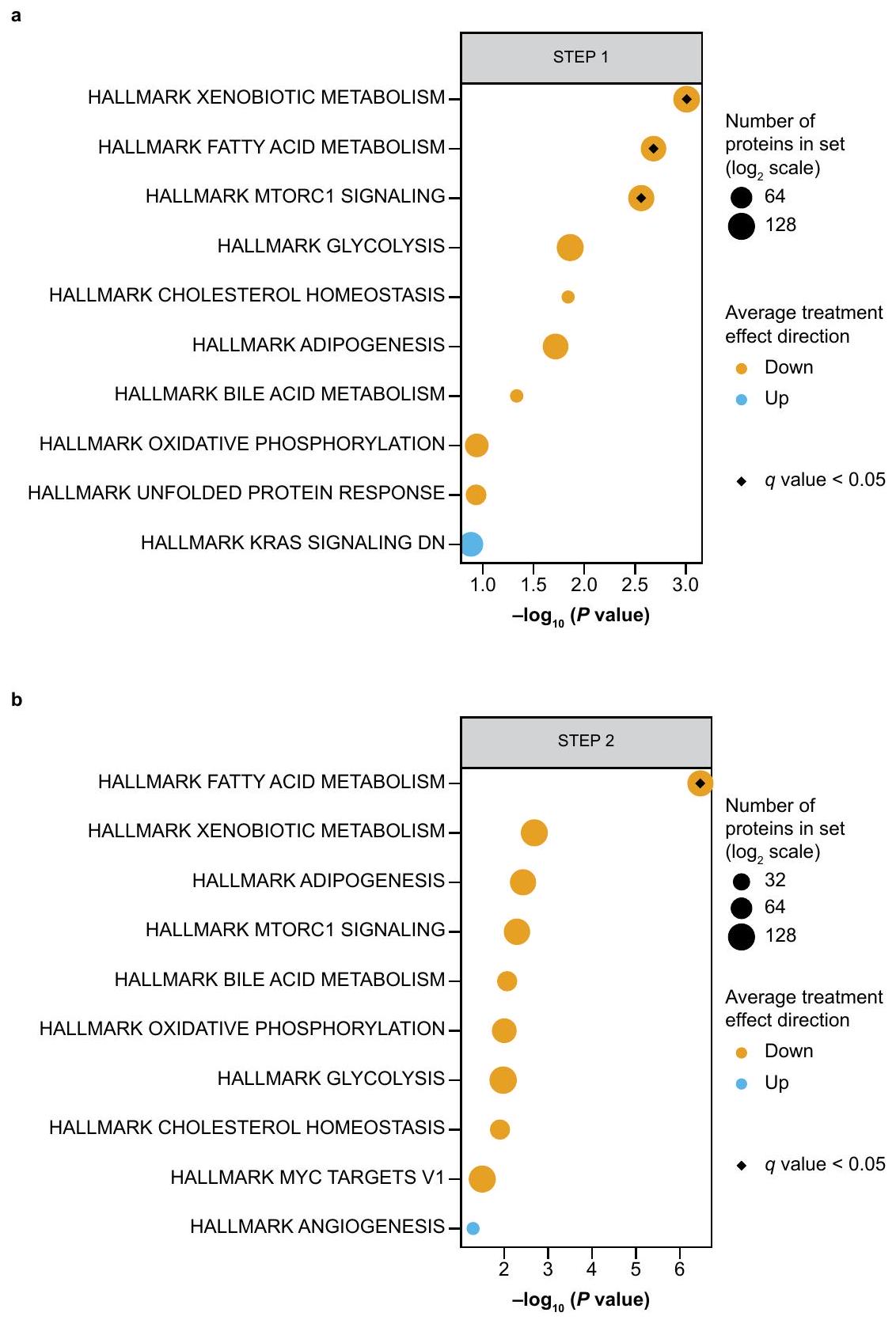
الشكل 2 من البيانات الموسعة | المسارات المتورطة بواسطة البروتينات المتأثرة بـ
حسب العلاج (معدل الاكتشاف الخاطئ المعدل
البيانات الموسعة الجدول 1 | بروتينات اختبار CVD2
| نظام بيولوجي | بروتينات | ||||||||||
| 1. حجم الدم وإدرار البول بالملح |
|
||||||||||
| 2. تكوين الحويصلات | 3. بروتين شبيه بعامل ريبوزيل أدينوزين 5′-ثنائي الفوسفات (ADP) 11 (ARL11) | ||||||||||
| 3. نمذجة المصفوفة/الأنسجة، النمو، تكوين الأوعية الدموية أو الالتصاق |
|
||||||||||
| 4. المناعة الخلوية |
|
||||||||||
| 5. تعديل قنوات الكالسيوم | 17. وحدة فرعية لقناة الكالسيوم المعتمدة على الجهد ألفا-2/دلتا-3 (CA2D3*) | ||||||||||
| 6. معدل تصفية الكبيبات | 18. عامل ثلاثي الأوراق 3 (TFF3) | ||||||||||
| 7. الأجسام المضادة/المستقبلات |
|
||||||||||
| 8. الأيض والدهون |
|
||||||||||
| 9. التهاب |
|
||||||||||
| 10. التجلط | 27. ديسينتجرين وبروتيناز معدني مع أنماط ثرومبوسبوندين 13 (ATS13*) |
محفظة الطبيعة
| المؤلف (المؤلفون) المراسلون: | عبد أ. طهراني |
| آخر تحديث من المؤلف(ين): 26 سبتمبر 2024 |
ملخص التقرير
الإحصائيات
غير متوفر
تم التأكيد
□ X
حجم العينة بالضبط
□

□

يجب أن تُوصف الاختبارات الشائعة فقط بالاسم؛ واصفًا التقنيات الأكثر تعقيدًا في قسم الطرق.
□

□

□

□ X
بالنسبة لاختبار الفرضية الصفرية، إحصائية الاختبار (مثل F، t، r) مع فترات الثقة، أحجام التأثير، درجات الحرية و
□ لتحليل بايزي، معلومات حول اختيار الأوليات وإعدادات سلسلة ماركوف مونت كارلو
□ للتصاميم الهرمية والمعقدة، تحديد المستوى المناسب للاختبارات والتقارير الكاملة عن النتائج
□ تقديرات أحجام التأثير (مثل حجم كوهين،
البرمجيات والشيفرة
جمع البيانات
لم يتم استخدام أي برمجيات لجمع البيانات
تم معالجة البيانات في R باستخدام حزمة SomaDatalO لتحميل بيانات البروتيوم الخام من ملفات .adat وحزم tidyverse لمعالجة البيانات. بالنسبة للمقارنة مع بيانات المجموعة الملاحظة، تم ذلك باستخدام cameraPR (نسخة “مُصنفة مسبقًا” من طريقة مجموعة الجينات التنافسية camera)، والتي هي جزء من حزمة Bioconductor limma. تم تشغيل CameraPR مع المعلمات الافتراضية باستخدام limma v3.52.4. R v4.3.1؛ SomaDataIO v6.0.0؛ tidyverse v2.0.0؛ Limma v3.52.4. جميع الشيفرات متاحة على: DOI: 10.5281/zenodo. 13356055
البيانات
معلومات السياسة حول توفر البيانات
- رموز الوصول، معرفات فريدة، أو روابط ويب لمجموعات البيانات المتاحة للجمهور
- وصف لأي قيود على توفر البيانات
- بالنسبة لمجموعات البيانات السريرية أو بيانات الطرف الثالث، يرجى التأكد من أن البيان يتماشى مع سياستنا
المشاركون في الأبحاث البشرية
خصائص السكان
الإشراف الأخلاقي
التجنيد
التقارير الخاصة بالمجال
علوم الحياة
العلوم السلوكية والاجتماعية □ العلوم البيئية والتطورية والبيئية
لنسخة مرجعية من الوثيقة مع جميع الأقسام، انظر nature.com/documents/nr-reporting-summary-flat.pdf
تصميم دراسة علوم الحياة
استبعاد البيانات
التكرار
التوزيع العشوائي
كانت كل من تجارب STEP 1 و STEP 2 مزدوجة التعمية. يرجى الرجوع إلى المنشورات الأصلية لـ STEP لمزيد من التفاصيل حول التعمية. في تحليلنا، استخدمنا إجراء التطبيع الخاص بـ SomaLogic، بما في ذلك التطبيع التكيفي بواسطة خطوة الاحتمالية القصوى، والتي تم استخدامها في SomaScan.
التقارير عن مواد وأنظمة وطرق محددة
| المواد والأنظمة التجريبية | طرق | ||
| غير متوفر | مشارك في الدراسة | غير متوفر | مشارك في الدراسة |
| إكس | □ |  |
□ |
 |
□ |  |
□ |
| إكس | □ | إكس | □ |
| إكس | □ | ||
| إكس | □ | ||
البيانات السريرية
معلومات السياسة حول الدراسات السريرية
بروتوكول الدراسة
علوم البيانات، نوفو نورديسك A/S، سوبورغ، الدنمارك. قسم علم الأوبئة والإحصاء الحيوي، كلية الصحة العامة، إمبريال كوليدج لندن، لندن، المملكة المتحدة. سيكويا جينتيكس، لندن، المملكة المتحدة. أبحاث السمنة، نوفو نورديسك A/S، مالوف، الدنمارك. مركز الإحصائيات وعلوم البيانات، جامعة هاسلت، هاسلت، بلجيكا. علم الدماغ والدهون، نوفو نورديسك A/S، مالوف، الدنمارك. جامعة أوريغون للصحة والعلوم (OHSU)، بورتلاند، أوريغون، الولايات المتحدة الأمريكية. مكتب المستشار العلمي الرئيسي، نوفو نورديسك A/S، مالوف، الدنمارك. الطب والعلوم، نوفو نورديسك A/S، سوبورغ، الدنمارك. قسم الأيض وعلوم الأنظمة، جامعة برمنغهام، برمنغهام، المملكة المتحدة. العنوان الحالي: QIAGEN A/S، آرهوس، الدنمارك. العنوان الحالي: جينماب A/S، فالبى، الدنمارك. ساهم هؤلاء المؤلفون بالتساوي: عبد أ. طهراني، ميلان جايبلز. البريد الإلكتروني:a.a.tahrani@bham.ac.uk - تم وصف درجة مكونة من 27 بروتينًا سابقًا تتنبأ بخطر الأمراض القلبية الوعائية الثانوية على مدى 4 سنوات، باستخدام بيانات متعددة المجموعات الكبيرة ونفس تقنية SomaScan.
التكنولوجيا المستخدمة في دراستنا . تم اشتقاق هذه النتيجة من عينات البلازما لـ 22,849 مشاركًا عبر تسع دراسات سريرية. كانت البروتينات المحددة مرتبطة بـ 10 أنظمة بيولوجية، كما هو ملخص أعلاه.
DOI: https://doi.org/10.1038/s41591-024-03355-2
PMID: https://pubmed.ncbi.nlm.nih.gov/39753963
Publication Date: 2025-01-01
Proteomic changes upon treatment with semaglutide in individuals with obesity
Accepted: 14 October 2024
Published online: 3 January 2025
Check for updates
Abstract
Obesity and type 2 diabetes are prevalent chronic diseases effectively managed by semaglutide. Here we studied the effects of semaglutide on the circulating proteome using baseline and end-of-treatment serum samples from two phase 3 trials in participants with overweight or obesity, with or without diabetes: STEP
and improve the quality of life of affected individuals

in the study who had an available biosample for proteomics profiling. The semaglutide 1.0 mg arm was excluded from most downstream analyses, except for the CVD risk analysis. MR, Mendelian randomization; QW, every week.
response and disease progression, and identification of novel therapeutic targets
throughout the trial in those with and without T2D, and by comparing proteomic profiles with those of observational cohorts, we aimed to comprehensively study the proteomic effects of semaglutide treatment and elucidate the mechanism of action driving its benefits on weightand obesity-related complications, and to determine its potential for use in new indications.
Results
Study participant characteristics
Effects of semaglutide on the circulating proteome
| Characteristics | STEP 1,
|
STEP 2,
|
| Age, mean ± s.d. (years) |
|
|
| Female sex,
|
955 (72.8) | 321 (49.8) |
| Race or ethnic group,
|
||
| White | 984 (75.1) | 388 (60.2) |
| Asian | 162 (12.4) | 183 (28.4) |
| Black or African American | 65 (5.0) | 55 (8.5) |
| Other | 100 (7.6) | 19 (2.9) |
| Hispanic or Latino ethnic group,
|
135 (10.3) | 77 (11.9) |
| Body weight, mean ± s.d. (kg) |
|
|
| BMI (
|
||
| Mean ± s.d. (
|
|
|
| Distribution,
|
||
| <30 | 80 (6.1) | 122 (18.9) |
|
|
433 (33.0) | 231 (35.8) |
|
|
401 (30.6) | 149 (23.1) |
|
|
397 (30.3) | 143 (22.2) |
| Waist circumference, mean ± s.d. (cm) |
|
|
|
|
|
|
| Prediabetes,
|
570 (43.5) |
|
in STEP 1 and STEP 2 are shown in Extended Data Fig. 1. No effect of sex was detected in the proteomic response to semaglutide treatment in either STEP 1 or STEP 2 (Supplementary Tables 4 and 5).
Weight-loss- and
and 7). Significantly regulated proteins in this analysis are implicated in diverse biological effects (for example, cardiac stress, inflammation and lipid metabolism) and have previously been found to be increased in CVD or associated with higher CVD risk. Significantly downregulated proteins when adjusting for body weight effects in STEP 1 known to be associated with CVD risk included tenascin C (TNC), NT-proBNP, thrombospondin 2 (THBS2), complement component C1q receptor (cluster of differentiation 93(CD93)), macrophage scavenger receptor 1-extracellular domain (MSR1) and angiopoietin-2 (ANGPT2). Other significantly downregulated proteins not related to CVD included secreted frizzled-related protein-4 (sFRP4) and liver fatty acid binding protein (LFABP), whereas granulin (GRN) was significantly upregulated. Similar to the previous analysis in which body weight and
Proteomic signature of semaglutide treatment
Effect of semaglutide treatment on a proteomic signature of CVD risk
Comparison with Icelandic observational cohort data (deCODE)
(Fig. 4). For example, in STEP1, semaglutide lowered proteins that are upregulated in fibromyalgia, hypertension, substance use disorders, neuropathic pain, osteoarthritis, psoriasis, depression, asthma, breast cancer and reduced ejection fraction, and increased proteins that are downregulated in these conditions (plus chronic lymphocytic leukemia and small lymphocytic lymphoma although
Comparison with Mendelian randomization analyses of body mass index and T2D genetic liability
Discussion








(VLED) resulted in counter-regulatory changes in appetite-regulating hormones, including a significant increase in fasting levels of ghrelin and significant reductions in the fasting levels of leptin, GLP-1, peptide YY (PYY), cholecystokinin (CCK) and amylin


measurement
Online content
References
- World Obesity Federation. World Obesity Atlas 2023 (Global Obesity Observatory, 2023).
- Murray, C. J. L. et al. Global burden of 87 risk factors in 204 countries and territories, 1990-2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet 396, 1223-1249 (2020).
- Bhaskaran, K., dos-Santos-Silva, I., Leon, D. A., Douglas, I. J. & Smeeth, L. Association of BMI with overall and cause-specific mortality: a population-based cohort study of 3.6 million adults in the UK. Lancet Diabetes Endocrinol. 6, 944-953 (2018).
- Kivimäki, M. et al. Body-mass index and risk of obesity-related complex multimorbidity: an observational multicohort study. Lancet Diabetes Endocrinol. 10, 253-263 (2022).
- Tahrani, A. A. & Morton, J. Benefits of weight loss of
or more in patients with overweight or obesity: a review. Obesity 30, 802-840 (2022). - Chandramouli, K. & Qian, P. Y. Proteomics: challenges, techniques and possibilities to overcome biological sample complexity. Hum. Genomics Proteomics 2009, 239204 (2009).
- Lill, J. R., Mathews, W. R., Rose, C. M. & Schirle, M. Proteomics in the pharmaceutical and biotechnology industry: a look to the next decade. Expert Rev. Proteomics 18, 503-526 (2021).
- Gold, L. et al. Aptamer-based multiplexed proteomic technology for biomarker discovery. PLoS ONE 5, e15004 (2010).
- Figarska, S. M. et al. Proteomic profiles before and during weight loss: results from randomized trial of dietary intervention. Sci. Rep. 10, 7913 (2020).
- Dreyfuss, J. M. et al. High-throughput mediation analysis of human proteome and metabolome identifies mediators of post-bariatric surgical diabetes control. Nat. Commun. 12, 6951 (2021).
- OZEMPIC
(Semaglutide) Prescribing Information (US Food and Drug Administration, 2017). - RYBELSUS
(Semaglutide) Prescribing Information (US Food and Drug Administration, 2020). - Aroda, V. R. et al. Comparative efficacy, safety, and cardiovascular outcomes with once-weekly subcutaneous semaglutide in the treatment of type 2 diabetes: insights from the SUSTAIN 1-7 trials. Diabetes Metab. 45, 409-418 (2019).
- Meier, J. J. Efficacy of semaglutide in a subcutaneous and an oral formulation. Front. Endocrinol. 12, 645617 (2021).
- Friedrichsen, M., Breitschaft, A., Tadayon, S., Wizert, A. & Skovgaard, D. The effect of semaglutide 2.4 mg once weekly on energy intake, appetite, control of eating, and gastric emptying in adults with obesity. Diabetes Obes. Metab. 23, 754-762 (2021).
- Gabery, S. et al. Semaglutide lowers body weight in rodents via distributed neural pathways. JCI Insight 5, e133429 (2020).
- WEGOVY
(Semaglutide) Prescribing Information (US Food and Drug Administration, 2021). - WEGOVY
(Semaglutide) Prescribing Information (US Food and Drug Administration, 2024). - WEGOVY
(Semaglutide) Prescribing Information (US Food and Drug Administration, 2022). - Wilding, J. P. H. et al. Once-weekly semaglutide in adults with overweight or obesity. N. Engl. J. Med. 384, 989-1002 (2021).
- Davies, M. et al. Semaglutide 2.4 mg once a week in adults with overweight or obesity, and type 2 diabetes (STEP 2): a randomised, double-blind, double-dummy, placebo-controlled, phase 3 trial. Lancet 397, 971-984 (2021).
- Williams, S. A. et al. A proteomic surrogate for cardiovascular outcomes that is sensitive to multiple mechanisms of change in risk. Sci. Transl. Med. 14, eabj9625 (2022).
- Ferkingstad, E. et al. Large-scale integration of the plasma proteome with genetics and disease. Nat. Genet. 53, 1712-1721(2021).
- Wang, W. et al. Associations of semaglutide with incidence and recurrence of alcohol use disorder in real-world population. Nat. Commun. 15, 4548 (2024).
- Steinberg, W. M. et al. Impact of liraglutide on amylase, lipase, and acute pancreatitis in participants with overweight/obesity and normoglycemia, prediabetes, or type 2 diabetes: secondary analyses of pooled data from the SCALE Clinical Development Program. Diabetes Care 40, 839-848 (2017).
- Steinberg, W. M., Buse, J. B., Ghorbani, M. L. M., Ørsted, D. D. & Nauck, M. A. Amylase, lipase, and acute pancreatitis in people with type 2 diabetes treated with liraglutide: results from the LEADER randomized trial. Diabetes Care 40, 966-972 (2017).
- Li, L. et al. Incretin treatment and risk of pancreatitis in patients with type 2 diabetes mellitus: systematic review and meta-analysis of randomised and non-randomised studies. BMJ 348, g2366 (2014).
- Abd El Aziz, M., Cahyadi, O., Meier, J. J., Schmidt, W. E. & Nauck, M. A. Incretin-based glucose-lowering medications and the risk of acute pancreatitis and malignancies: a meta-analysis based on cardiovascular outcomes trials. Diabetes Obes. Metab. 22, 699-704 (2020).
- Pinto, L. C., Falcetta, M. R., Rados, D. V., Leitão, C. B. & Gross, J. L. Glucagon-like peptide-1 receptor agonists and pancreatic cancer: a meta-analysis with trial sequential analysis. Sci. Rep. 9, 2375 (2019).
- Sakamuri, S. et al. Absence of tissue inhibitor of metalloproteinase-4 (TIMP4) ameliorates high fat diet-induced obesity in mice due to defective lipid absorption. Sci. Rep. 7, 6210 (2017).
- Aller, E., Mariman, E. C. M., Bouwman, F. G. & van Baak, M. A. Genetic predictors of
weight loss by multidisciplinary advice to severely obese subjects. J. Nutrigenet. Nutrigenomics 10, 32-42 (2017). - Deanfield, J. et al. Relevance of body weight and weight change on cardiovascular benefit with semaglutide: a pre-specified analysis of the SELECT trial. Obes. Facts 17, 491-492 (2024).
- Marso, S. P. et al. Liraglutide and cardiovascular outcomes in type 2 diabetes. N. Engl. J. Med. 375, 311-322 (2016).
- Sattar, N. et al. Cardiovascular, mortality, and kidney outcomes with GLP-1 receptor agonists in patients with type 2 diabetes: a systematic review and meta-analysis of randomised trials. Lancet Diabetes Endocrinol. 9, 653-662 (2021).
- Gerstein, H. C. et al. Dulaglutide and cardiovascular outcomes in type 2 diabetes (REWIND): a double-blind, randomised placebo-controlled trial. Lancet 394, 121-130 (2019).
- Lincoff, A. M. et al. Semaglutide and cardiovascular outcomes in obesity without diabetes. N. Engl. J. Med. 389, 2221-2232 (2023).
- Panagopoulou, V. et al. NTproBNP: an important biomarker in cardiac diseases. Curr. Top. Med. Chem. 13, 82-94 (2013).
- Nicolini, G., Forini, F., Kusmic, C., Iervasi, G. & Balzan, S. Angiopoietin 2 signal complexity in cardiovascular disease and cancer. Life Sci. 239, 117080 (2019).
- Lugano, R. et al. CD93 maintains endothelial barrier function by limiting the phosphorylation and turnover of VE-cadherin. FASEB J. 37, e22894 (2023).
- Yu, H. et al. Scavenger receptor A (SR-A) is required for LPS-induced TLR4 mediated NF-кB activation in macrophages. Biochim. Biophys. Acta 1823, 1192-1198 (2012).
- Van Eck, M. et al. Effect of human scavenger receptor class A overexpression in bone marrow-derived cells on cholesterol levels and atherosclerosis in ApoE-deficient mice. Arterioscler. Thromb. Vasc. Biol. 20, 2600-2606 (2000).
- Trinh, K., Julovi, S. M. & Rogers, N. M. The role of matrix proteins in cardiac pathology. Int. J. Mol. Sci. 23, 1338 (2022).
- Peters, A. E. et al. Proteomic pathways across ejection fraction spectrum in heart failure: an EXSCEL substudy. Preprint at medRxiv https://doi.org/10.1101/2023.05.16.23288273 (2023).
- Kosiborod, M. N. et al. Design and baseline characteristics of STEP-HFpEF program evaluating semaglutide in patients with obesity HFpEF phenotype. JACC Heart Fail. 11, 1000-1010 (2023).
- Kosiborod, M. N. et al. Semaglutide in patients with heart failure with preserved ejection fraction and obesity. N. Engl. J. Med. 389, 1069-1084 (2023).
- Kosiborod, M. N. et al. Semaglutide in patients with obesityrelated heart failure and type 2 diabetes. N. Engl. J. Med. 390, 1394-1407 (2024).
- Wroe, A. L. Intentional and unintentional nonadherence: a study of decision making. J. Behav. Med. 25, 355-372 (2002).
- Sumithran, P. et al. Long-term persistence of hormonal adaptations to weight loss. N. Engl. J. Med. 365, 1597-1604 (2011).
- Wharton, S. et al. Two-year effect of semaglutide 2.4 mg on control of eating in adults with overweight/obesity: STEP 5. Obesity 31, 703-715 (2023).
- Garvey, W. T. et al. Two-year effects of semaglutide in adults with overweight or obesity: the STEP 5 trial. Nat. Med. 28, 2083-2091 (2022).
- Hill, J. W. Gene expression and the control of food intake by hypothalamic POMC/CART neurons. Open Neuroendocrinol. J. 3, 21-27 (2010).
- Morton, G. J. & Schwartz, M. W. The NPY/AgRP neuron and energy homeostasis. Int. J. Obes. Relat. Metab. Disord. 25, S56-S62 (2001).
- Jais, A. & Brüning, J. C. Arcuate nucleus-dependent regulation of metabolism-pathways to obesity and diabetes mellitus. Endocr. Rev. 43, 314-328 (2021).
- Yousri, N. A. et al. Proteome-wide associations with short- and long-term weight loss and regain after Roux-en-Y gastric bypass surgery. Obesity 30, 129-141 (2022).
- Purnell, J. Q. et al. Prospective evaluation of insulin and incretin dynamics in obese adults with and without diabetes for 2 years after Roux-en-Y gastric bypass. Diabetologia 61, 1142-1154 (2018).
- Clark, S. L. et al. Combined whole methylome and genomewide association study implicates CNTN4 in alcohol use. Alcohol Clin. Exp. Res. 39, 1396-1405 (2015).
- King, W. C. et al. Prevalence of alcohol use disorders before and after bariatric surgery. JAMA 307, 2516-2525 (2012).
- Hasanzadeh, Z. et al. Evaluation of the serum Dkk-1, tenascin-C, oxidative stress markers levels and Wnt signaling pathway genes expression in patients with Alzheimer’s disease. J. Mol. Neurosci. 71, 879-887 (2021).
- Mao, Q. et al. Disease and region specificity of granulin immunopositivities in Alzheimer disease and frontotemporal lobar degeneration. J. Neuropathol. Exp. Neurol. 76, 957-968 (2017).
- Mendsaikhan, A., Tooyama, I. & Walker, D. G. Microglial progranulin: involvement in Alzheimer’s disease and neurodegenerative diseases. Cells 8, 230 (2019).
- Bukhari, S. A. et al. Secreted frizzled-related protein 4 and its implication in obesity and type-2 diabetes. IUBMB Life 71, 1701-1710 (2019).
- Mahdi, T. et al. Secreted frizzled-related protein 4 reduces insulin secretion and is overexpressed in type 2 diabetes. Cell Metab. 16, 625-633 (2012).
- Özenirler, S. et al. Serum liver fatty acid binding protein shows good correlation with liver histology in NASH. Hepatogastroenterology 60, 1095-1100 (2013).
- Bao, X. et al. Proteomic profiles of body mass index and waist-to-hip ratio and their role in incidence of diabetes. J. Clin. Endocrinol. Metab. 107, e2982-e2990 (2022).
- Roh, J. D. et al. Plasma proteomics of COVID-19-associated cardiovascular complications: implications for pathophysiology and therapeutics. JACC Basic Transl. Sci. 7, 425-441 (2022).
- American Diabetes Association. 2. Classification and diagnosis of diabetes. Diabetes Care 40, S11-S24 (2017).
© The Author(s) 2025
genetic proxies. Single-nucleotide polymorphisms were clumped at a pairwise linkage disequilibrium
Reporting summary
Data availability
Code availability
References
- SomaLogic. SomaScan
Assay v4.1. (SomaLogic, 2021). - Ding, C. & Peng, H. Minimum redundancy feature selection from microarray gene expression data. J. Bioinform. Comput. Biol. 3, 185-205 (2005).
- Wu, D. & Smyth, G. K. Camera: a competitive gene set test accounting for inter-gene correlation. Nucleic Acids Res. 40, e133 (2012).
- camera: competitive gene set test accounting for inter-gene correlation (rdrr.io).
- Liberzon, A. et al. The Molecular Signatures Database (MSigDB) hallmark gene set collection. Cell Syst. 1, 417-425 (2015).
- Pulit, S. L. et al. Meta-analysis of genome-wide association studies for body fat distribution in 694649 individuals of European ancestry. Hum. Mol. Genet. 28, 166-174 (2019).
- Mahajan, A. et al. Multi-ancestry genetic study of type 2 diabetes highlights the power of diverse populations for discovery and translation. Nat. Genet. 54, 560-572(2022).
- Abecasis, G. R. et al. An integrated map of genetic variation from 1,092 human genomes. Nature 491, 56-65 (2012).
- Burgess, S., Butterworth, A. & Thompson, S. G. Mendelian randomization analysis with multiple genetic variants using summarized data. Genet. Epidemiol. 37, 658-665 (2013).
- Maretty, L. et al. Proteomic changes upon treatment with semaglutide in individuals with obesity. Zenodo https://doi.org/ 10.5281/zenodo. 13356055 (2024).
Acknowledgements
Author contributions
Competing interests
L.Z. declares no competing interests.
Additional information


Extended Data Fig. 2 | Pathways implicated by proteins affected by
by treatment (false discovery rate-adjusted


Extended Data Table 1 | CVD2 test proteins
| Biological system | Proteins | ||||||||||
| 1. Blood volume and natriuresis |
|
||||||||||
| 2. Vesicle biogenesis | 3. Adenosine 5′-diphosphate (ADP)ribosylation factor-like protein 11 (ARL11) | ||||||||||
| 3. Matrix/tissue modeling, growth, angiogenesis or adhesion |
|
||||||||||
| 4. Cellular immunity |
|
||||||||||
| 5. Calcium channel modulation | 17. Voltage-dependent calcium channel subunit alpha-2/delta-3 (CA2D3*) | ||||||||||
| 6. Glomerular filtration rate | 18. trefoil factor 3 (TFF3) | ||||||||||
| 7. Immunoglobulins/receptors |
|
||||||||||
| 8. Metabolism and lipids |
|
||||||||||
| 9. Inflammation |
|
||||||||||
| 10. Coagulation | 27. A disintegrin and metalloproteinase with thrombospondin motifs 13 (ATS13*) |
natureportfolio
| Corresponding author(s): | Abd A. Tahrani |
| Last updated by author(s): Sept 26, 2024 |
Reporting Summary
Statistics
n/a
Confirmed
□ X
The exact sample size
□

□

Only common tests should be described solely by name; describe more complex techniques in the Methods section.
□

□

□

□ X
For null hypothesis testing, the test statistic (e.g. F, t, r) with confidence intervals, effect sizes, degrees of freedom and
□ For Bayesian analysis, information on the choice of priors and Markov chain Monte Carlo settings
□ For hierarchical and complex designs, identification of the appropriate level for tests and full reporting of outcomes
□ Estimates of effect sizes (e.g. Cohen’s
Software and code
Data collection
No software was used for data collection
Data were processed in R using the SomaDatalO package for loading raw proteomics data from .adat files and tidyverse packages for data processing. For the comparison with observational cohort data, this was performed using cameraPR (a “pre-ranked” version of the competitive gene set method camera), which is part of the Bioconductor limma package. CameraPR was run with default parameters using limma v3.52.4. R v4.3.1; SomaDataIO v6.0.0; tidyverse v2.0.0; Limma v3.52.4. All code is available at: DOI: 10.5281/zenodo. 13356055
Data
Policy information about availability of data
- Accession codes, unique identifiers, or web links for publicly available datasets
- A description of any restrictions on data availability
- For clinical datasets or third party data, please ensure that the statement adheres to our policy
Human research participants
Population characteristics
Ethics oversight
Recruitment
Field-specific reporting
Life sciences
Behavioural & social sciences □ Ecological, evolutionary & environmental sciences
For a reference copy of the document with all sections, see nature.com/documents/nr-reporting-summary-flat.pdf
Life sciences study design
Data exclusions
Replication
Randomization
Both STEP 1 and STEP 2 trials were double blinded. Please refer to the original STEP publications for further details regarding blinding. In our analysis, we employed SomaLogic’s normalization procedure, including the adaptive normalization by maximum likelihood step, which was used for the SomaScan
Reporting for specific materials, systems and methods
| Materials & experimental systems | Methods | ||
| n/a | Involved in the study | n/a | Involved in the study |
| X | □ |  |
□ |
 |
□ |  |
□ |
| X | □ | X | □ |
| X | □ | ||
| X | □ | ||
Clinical data
Policy information about clinical studies
Study protocol
Data Science, Novo Nordisk A/S, Søborg, Denmark. Department of Epidemiology and Biostatistics, School of Public Health, Imperial College London, London, UK. Sequoia Genetics, London, UK. Obesity Research, Novo Nordisk A/S, Måløv, Denmark. Center for Statistics and Data Science Institute, Hasselt University, Hasselt, Belgium. Brain and Adipose Biology, Novo Nordisk A/S, Måløv, Denmark. Oregon Health & Science University (OHSU), Portland, OR, USA. Chief Scientific Advisor Office, Novo Nordisk A/S, Måløv, Denmark. Medical & Science, Novo Nordisk A/S, Søborg, Denmark. Department of Metabolism and Systems Science, University of Birmingham, Birmingham, UK. Present address: QIAGEN A/S, Aarhus, Denmark. Present address: Genmab A/S, Valby, Denmark. These authors contributed equally: Abd A. Tahrani, Milan Geybels. e-mail: a.a.tahrani@bham.ac.uk - A 27-protein score has previously been described that predicts secondary CVD risk over 4 years, utilizing large multicohort data and the same SomaScan
technology used in our study . This score was derived from plasma samples of 22,849 participants across nine clinical studies. The identified proteins were related to 10 biological systems, as summarized above.
