DOI: https://doi.org/10.26599/nbe.2024.9290060
تاريخ النشر: 2024-02-05
التقدم والآفاق في علم الأورام النانوية المتكاملة
الاستشهاد: ج.ل. جيانغ، ش.ي. كوي، ي.ش. هوانغ، وآخرون. التقدم والآفاق في النانو-أونكولوجيا المتكاملة. النانو للطب الحيوي والهندسة، 2024، 16(2): 152-187.
http://doi.org/10.26599/NBE.2024.9290060
الملخص
في السنوات الأخيرة، أدى التكامل العميق بين البحث الأساسي والبحث السريري في تكنولوجيا النانو والأونكولوجيا إلى ظهور فرع جديد، وهو النانو-أونكولوجيا المتكاملة. هذا مجال ناشئ ومهم بين التخصصات، يلعب دورًا لا يمكن الاستغناء عنه في تشخيص الأورام وعلاجها والتحذير المبكر والمراقبة والوقاية منها، وأصبح جبهة جديدة بين التخصصات. هنا تم استعراض التقدم الرئيسي في النانو-أونكولوجيا المتكاملة، والذي شمل بشكل رئيسي التحضير المنضبط للمواد النانوية، والكشف الفائق الحساسية عن علامات الأورام، واستكشافات التصوير النانوية متعددة الوظائف، وتقنيات التشخيص والعلاج المتكاملة، والأدوية النانوية المبتكرة ونظام توصيل الأدوية النانوية، وتكنولوجيا النانو للحمض النووي، وتكنولوجيا النانو للحمض النووي الريبي، وتكنولوجيا التجميع الذاتي للنانو، وأجهزة الاستشعار النانوية، والروبوتات النانوية الذكية، وآلات العلاج النانوية. كما تم مناقشة المصطلحات والمفاهيم والاتجاهات والتحديات بهدف تعزيز تطبيق تكنولوجيا النانو في الأونكولوجيا المتكاملة وحل المشكلات العلمية والتقنية الرئيسية في البحث الأساسي والسريري في السرطان.
المقدمة
تصحيحات وتعديلات وفقًا للواقع الاجتماعي والبيئي والنفسي لجعله نظامًا طبيًا جديدًا يتماشى بشكل أفضل مع صحة الإنسان وعلاج الأمراض [1]. في العقد الماضي أو نحو ذلك، مع التطور السريع لتكنولوجيا النانو والتكامل العميق بين البحث الأساسي والبحث السريري في تكنولوجيا النانو والأونكولوجيا، ظهر فرع جديد،
وهو النانو-أونكولوجيا المتكاملة. النانو-أونكولوجيا المتكاملة، التي تشكلت من خلال دمج تكنولوجيا النانو والأونكولوجيا، هي مجال ناشئ ومهم في تقنيات النانو الحيوية، والذي يلعب دورًا لا يمكن الاستغناء عنه في تشخيص الأورام وعلاجها وتوقعها ومراقبتها والوقاية منها، وأصبح جبهة جديدة بين التخصصات وأحد المجالات الأساسية ذات الأولوية في تطوير العلوم والتكنولوجيا المتقدمة في مختلف البلدان في الوقت الحاضر. النانو-أونكولوجيا المتكاملة هي تخصص شامل بالكامل، يبدأ من الكائن البشري ككل ويستفيد بشكل كامل من المزايا الفريدة لتكنولوجيا النانو لحل سلسلة من التحديات والمشكلات العلمية الرئيسية التي تواجهها في عملية الوقاية من الأورام السريرية والتشخيص المبكر والعلاج، وإجراء البحث الأساسي والسريري، وتعزيز الترجمة السريرية لنتائج البحث؛ يشمل نطاق بحثها جميع جوانب الأونكولوجيا، بما في ذلك التحذير المبكر من الأورام، والفحص المبكر، يشمل نطاق بحثها جميع جوانب الأونكولوجيا، بما في ذلك التحذير المبكر من الأورام، والفحص المبكر، والمجسات النانوية متعددة الوظائف والتشخيص والعلاج، ونظام توصيل الأدوية النانوية، وأدوية علاج الأورام النانوية، والعلاج الفيزيائي القائم على النانو، والعلاج المناعي النانوي، والروبوتات العلاجية النانوية، وما إلى ذلك، مما يحدث تغييرات ثورية في علاج الأورام وتشخيصها [2].
تطبيق تكنولوجيا النانو في الأونكولوجيا المتكاملة وحل المشكلات العلمية والقضايا التقنية الرئيسية في البحث الأساسي والسريري في الأونكولوجيا.
التقدم في النانو-أونكولوجيا المتكاملة
أنواع الجسيمات النانوية لعلاج الأورام
الجسيمات النانوية المغناطيسية
الجسيمات النانوية، وقد تمت الموافقة على عوامل التباين MRI المعتمدة على الجسيمات النانوية المغناطيسية من قبل FDA واستخدمت في التطبيقات السريرية لسنوات عديدة [3، 4].
الجسيمات النانوية الذهبية
جزيئات النقاط الكمومية
جزيئات الكربون النانوية
جزيئات السيليكون النانوية
جزيئات نانوية ليفوسومية
تحقيق علاج خلايا الورم في الجسم الحي من خلال الجمع مع بعض الأدوية المضادة للورم على سطحها. تعتبر صيغة الليبوسوم الشكل الدوائي الأكثر استخدامًا.
جزيئات الألبومين النانوية
جزيئات تحويل الطاقة
التقدم في تكنولوجيا الكشف النانوي عن علامات الأورام
إلى الورم. تم العثور على علامات الورم لأكثر من 100 عام. منذ الستينيات، تم استخدامها على نطاق واسع في العيادات ولعبت دورًا مهمًا في تشخيص وعلاج الأورام. مع تطور التكنولوجيا الحيوية، تم اكتشاف مجموعة متنوعة من العلامات الجديدة بزيادة في الخصوصية والحساسية، بما في ذلك الجينات المسرطنة، جينات كابحة الورم ومنتجاتها، الحمض النووي للورم، السيتوكينات ومستقبلاتها، الميكرو RNA للورم وخلايا الجذع الورمية، وغيرها. كما أصبح التشخيص المشترك لعلامات الورم موضوعًا ساخنًا للاهتمام. لقد حسّن التشخيص المشترك لعدة علامات لأورام مختلفة بشكل كبير من حساسية اكتشاف الورم.
أقطاب كهربائية معدلة بجزيئات نانوية، تقنية شريحة ميكروفلويدية لفصل الإكسوزومات واكتشاف العلامات، تقنية اكتشاف شريحة PCR الرقمية، تقنية اكتشاف PCR الكمية المعتمدة على بيوصائد جزيئات نانوية، تقنية الشريحة المدمجة مع وسم الجزيئات النانوية، وخاصة سلسلة تقنيات الاكتشاف المعتمدة على النمذجة المدمجة مع خوارزميات الذكاء الاصطناعي، قد حسنت بشكل كبير من حساسية ودقة الاكتشاف، وقد دخلت بعض هذه التقنيات في التطبيق السريري. التقدم الرئيسي هو كما يلي:
التحضير القابل للتحكم لمجسات النانو بلازما وكشف جينات SNP
تكنولوجيا الكشف التسلسلي المعتمدة على شريحة SERS
(ب) شريحة SERS للكشف النانوي عن علامات الغاز الزفير
طريقة الكشف الكمي عن الإكسوزومات تعتمد على تضخيم الدائرة المتفرعة
إكسوزومات سرطان المعدة. تم فحص أبتامر يرتبط بشكل محدد بالإكسوزومات التي تفرزها خلايا سرطان المعدة، وتم تصميم بروب قفل بطول 63 قاعدة مع الأبتامر كبروبي رابط. تم حضانة الأبتامر وإكسوزومات سرطان المعدة وتم إزالة الأبتامر غير المرتبط بواسطة البيريبلازم. تم إيلاء الأبتامر المرتبط وتم معالجته عند درجة حرارة عالية، وتفاعل الأبتامر المفصول مع بروب القفل لتشكيل قالب حلقي مغلق. في عملية التضخيم اللاحقة، تم إضافة بادئ ثانٍ بنفس التسلسل الجزئي لقالب الحلقة. بعد التهجين مع المنتج المضخم، يمكن أن يحفز البادئ تضخيم السلسلة المتفرعة ويشكل حمض نووي مزدوج الشريطة بتدرج في الطول. أخيرًا، حققنا الكشف الكمي عن إكسوزومات سرطان المعدة باستخدام الفلورية القوية لصبغة الحمض النووي SYBR Green I بالاشتراك مع منطقة الأخدود الحلزوني المزدوج للحمض النووي مزدوج الشريطة. كانت إشارة الفلورية للمنتج مرتبطة إيجابيًا بتركيز الإكسوزومات الأولي، وكانت الحساسية يمكن أن تصل إلى 1 إكسوزوم/مل.
تقنية الكشف عن الميكرو RNA المعتمدة على
ثنائي كبيد الموليبدينوم
(ب) بناء مجس DNA AuNPs مزدوج الكتلة استنادًا إلى
مجسات NC/DNA لتقنية الكشف في الموقع عن علامات الميكرو RNA الحيوية في مقاطع الأنسجة
أنسجة، يمكن استخدامها لتشخيص سرطان المعدة [26].
محدد لمستقبل السركتين المعدي، وهو علامة حيوية محددة لسرطان المعدة. بمجرد التقاطها، تم جذب الخلايا بواسطة الشريحة المغناطيسية ونقلها إلى الطبقة العليا من القنوات الدقيقة من خلال تكوين جسر عالٍ. في الوقت نفسه، ظلت كريات الدم البيضاء وكريات الدم الحمراء في الطبقة السفلية من القنوات الدقيقة، مما يتيح فصلًا فعالًا مع معدل بقاء مرتفع. وصلت كفاءة الفصل إلى
تم تطوير طريقة الكشف عن تصنيف H. pylori. يعتبر H. pylori عامل خطر رئيسي لسرطان المعدة، وإنشاء طريقة تشخيص تصنيف لـ H. pylori هو نهج مهم للوقاية المبكرة من سرطان المعدة. بالاستفادة من مبدأ الشريحة المتعددة، وبالتعاون مع شركة شريكة، قمنا باستنساخ وتعبير CagA وVac A واليورياز لـ H. pylori، وأعددنا شريحة تحتوي على مواقع الكشف لـ CagA وVac A واليورياز. تم استخدام تجمعات جزيئات الذهب النانوية لتوسيم الأجسام المضادة لـ CagA وVac A واليورياز، وتم إنشاء طريقة كشف كمي للبروتين تعتمد على الفلورية لـ CagA وVac A واليورياز. تم تطوير قارئ للشريحة، وتم تحديد قيم القطع ومعايير الكشف. كما تم وضع معايير مؤسسية. حصلت الشريحة القابلة للكشف والقارئ المطور على شهادات الأجهزة الطبية من الفئة 3 والفئة 2، على التوالي.
تطوير نظام كشف يعتمد على الهواتف الذكية
شريحة الكشف المناعي المغناطيسي النانوي المدمجة مع خوارزمية الذكاء الاصطناعي
تطوير كاشف بيولوجي صغير في الطور السائل وكشف مؤشرات متعددة للأورام
التقدم في المجسات النانوية المتكاملة لتشخيص الأورام وعلاجها
التعرف المحدد على جزيئات الهدف الرئيسية، وتكوين الجسيمات النانوية، والأدوية الوظيفية العلاجية. في السنوات الخمس الماضية، مع التطور السريع لتقنية المجسات النانوية متعددة الوظائف، انتقلت تقنيات تكامل التشخيص والعلاج نحو التطبيقات السريرية العملية.
المجسات النانوية المتكاملة للتشخيص والعلاج المستندة إلى الجسيمات النانوية المغناطيسية
تصوير الرنين المغناطيسي والعلاج المغناطيسي الحراري، مما يؤدي إلى تعزيز التأثيرات العلاجية.
المجسات النانوية المتكاملة للتشخيص والعلاج المستندة إلى النقاط الكمومية
سرطان المعدة تحت الجلد بقطر 5 مم في الفئران العارية، وتحقيق تصوير فلوري مستهدف وتصوير بالرنين المغناطيسي النووي لسرطان المعدة. تحت المجال المغناطيسي الخارجي، يتم تحقيق العلاج المحلي لسرطان المعدة، مما يحمل آفاق التحول السريري.
مجسات نانوية متكاملة تشخيصية وعلاجية تعتمد على نقاط الكربون النانوية
الضوء الفلوري والضوء الكهروكيميائي، مع كون الفلورسنت هو السمة الأكثر بروزًا. كنانو مادة لديها القدرة على لعب دور مهم في مجالات مختلفة، تظهر نقاط الكربون خصائص فلورية ممتازة، بما في ذلك طيف تحفيز واسع ومستمر، وتحفيز بطول موجة واحدة، وانبعاث متعدد الأطوال الموجية. كما أنها تتمتع باستقرار فلوري عالي ومقاومة للتلاشي الضوئي. يمكن ضبط طول موجة الفلورسنت لنقاط الكربون، وبعض نقاط الكربون تظهر خصائص فلورية معكوسة. علاوة على ذلك، تعمل نقاط الكربون كمانحين ومقبولين ممتازين للإلكترونات وتظهر خصائص نقل الإلكترونات المستحثة بالضوء. من الأهمية بمكان أنها تتمتع بذوبانية ممتازة في الماء، وقابلية التوسع في الإنتاج، وتكلفة منخفضة، وغياب المعادن الثقيلة، وصديقة للبيئة، وأمان في الاستخدام.
يمكن استخدامها في التطبيقات الطبية الحيوية. نجح لي وآخرون في تحضير جزيئات الذهب النانوية المعدلة بواسطة جزيئات شجرية من خلال استخدام جزيئات شجرية لاستبدال جزيئات CTAB على سطح جزيئات الذهب النانوية، ثم ربطها مع ببتيد RGD لتحضير مجس نانوي يمكنه استهداف الأوعية الدموية للورم بنشاط في الجسم الحي وقتل خلايا الورم وتثبيط نمو الورم بشكل كبير تحت إشعاع الضوء القريب من الأشعة تحت الحمراء [45]. أظهرت التجارب الحيوانية أن هذا المجس يمكن أن يجعل جزءًا من الأنسجة الورمية المحلية يختفي.
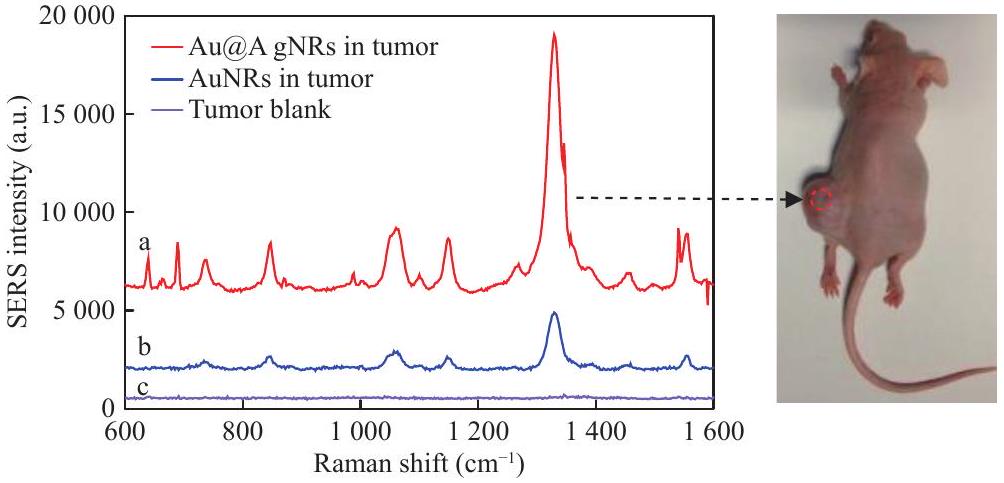
يمكن أن تستهدف الأنابيب النانوية الأوعية الدموية لسرطان المعدة، مما يحقق كل من التصوير الصوتي الضوئي والعلاج الحراري الضوئي لأنسجة سرطان المعدة. بالإضافة إلى ذلك، فقد مكنت من الكشف عالي الحساسية عن أنسجة سرطان المعدة باستخدام مطيافية رامان المعززة بالسطح (SERS) وتحديد حدود الورم (الشكل 5).
أظهرت الدراسات أن خلايا جذع سرطان المعدة تعبر عن علامات جزيئية مثل CD24 وCD44 وCD133 وCD166 وEpCAM على أسطحها. تم تحقيق فصل ناجح لخلايا جذع سرطان المعدة باستخدام أجسام مضادة لـ CD44، وتم تطوير نموذج لسرطان المعدة في الفئران باستخدام خلايا جذع سرطان المعدة المفصولة. لتحقيق التصوير المستهدف والعلاج المتزامن لخلايا جذع سرطان المعدة في الجسم الحي، تم تصميم وتخليق نجوم نانوية ذهبية، تلاها تعديل السطح باستخدام PEG وارتباطها بأجسام مضادة CD44-V6. أظهرت النتائج أن نجوم الذهب المرتبطة بأجسام مضادة CD44-V6 يمكن أن تستهدف بنشاط خلايا جذع سرطان المعدة في المختبر وتُبتلع بواسطة هذه الخلايا، مما يظهر إشارات فلورية قوية. كما تم إنشاء نموذج لفئران سرطان المعدة، وبعد الحقن الوريدي للنانوبروبيات المحضرة لمدة ساعتين، تراكمت النانوبروبيات في الأوعية الدموية لأنسجة سرطان المعدة. تم الحصول على تصوير صوتي ضوئي واضح لأوعية دم سرطان المعدة باستخدام جهاز تصوير صوتي ضوئي، وكشف التصوير الحراري عن درجة حرارة تقارب
تعديل السطح بسهولة وتفعيل الوظائف، والحفاظ على خصائص الفلورية المواتية لجزيئات الذهب النانوية. أظهرت نتائج اختبار MTT (3-(4,5-ثنائي ميثيل الثيازول-2-يل)-2,5-ثنائي الفينيل تيترازوليوم بروميد) أن جزيئات الذهب النانوية@
منصة نانوية تحمل الأدوية وتتمتع بوظائف علاجية.
مجسات نانوية متكاملة للتشخيص والعلاج تعتمد على جزيئات النانو ذات التحويل العلوي
مجسات نانوية متكاملة للتشخيص والعلاج تعتمد على جزيئات نانوية غير عضوية أخرى
إلى أنابيب نانوية مجوفة من أكسيد الكوبالت البزموت باستخدام طريقة الحل الحراري. مقارنة بالنقاط النانوية الصغيرة الحجم، فإن أنابيب أكسيد الكوبالت البزموت المجوفة لها وقت دوران أطول في الجسم ومن المرجح أن تتسرب إلى الأوعية الدموية في موقع الورم، مما يحقق إثراء الورم. ومن المثير للاهتمام أن هذا التجميع الشبيه بالأنابيب المجوفة سيفكك ببطء ويتجمع في جزيئات نانوية في البيئة الحمضية قليلاً لأنسجة الورم، والتي ستنتشر بعد ذلك إلى الدم وتتم إزالتها بواسطة الكلى، مما يتجنب إلى حد ما القضايا السمية المحتملة الناتجة عن تراكم المواد النانوية على المدى الطويل في الجسم. بناءً على أنابيب أكسيد الكوبالت البزموت المجوفة، واصلوا تطوير نظام نانوي للعلاج الإشعاعي والعلاج الكيميائي التآزري للورم. من ناحية، تحت إشعاع الأشعة السينية، يمكن لأنابيب أكسيد الكوبالت البزموت المتجمعة في موقع الورم تحقيق تصوير CT محدد للورم وتحسس الإشعاع. من ناحية أخرى، استخدموا خاصية المساحة السطحية الكبيرة للأنابيب المجوفة لتحميل دوكسوروبيسين بعد إزالة حمض الهيدروكلوريك داخل الأنبوب. وقد أكدت التجارب الخلوية والحيوانية أن الجمع بين العلاج الإشعاعي والعلاج الكيميائي يمكن أن يزيد بشكل كبير من مستويات أنواع الأكسجين التفاعلية (ROS) في خلايا الورم ويزيد من تلف الحمض النووي، مما يؤدي في النهاية إلى تحفيز موت خلايا الورم. يمكن أن نرى أن هذا التجميع الأنبوب الذكي المستجيب من أكسيد الكوبالت البزموت يوفر نهجًا جديدًا لبناء تركيبات تشخيصية وعلاجية نانوية فعالة وغير سامة.
سلسلة من مجسات الخلايا الجذعية الموسومة بجزيئات نانوية
لقد تشكل مجال جديد تدريجياً، وهو تكنولوجيا النانو للخلايا الجذعية. يمكن أن يؤدي تطبيق تكنولوجيا النانو في البحث والتطوير للخلايا الجذعية إلى حل سلسلة من المشكلات في أبحاث الخلايا الجذعية وتعزيز تكنولوجيا الخلايا الجذعية. هناك نوعان من الخلايا الجذعية، وهما الخلايا الجذعية الجنينية والخلايا الجذعية البالغة. تشير الخلايا الجذعية الجنينية إلى نوع من الخلايا التي تنشأ من الأجنة، وتكون في حالة غير متمايزة، ويمكن أن تتمايز وتجدد نفسها لفترة طويلة، ولديها القدرة على التمايز إلى خلايا أنسجة مختلفة تحت ظروف معينة.
دَرَسَت آلية استهداف خلايا جذعية من stroma نخاع العظم لسرطان المعدة في الجسم الحي، ولعب محور CXCL12CXCR4 و CCL19-CCR7 دورًا مهمًا.
مجسات نانوية متكاملة للتشخيص والعلاج تستهدف استجابات البيئة الدقيقة للأورام

التقدم في البحث عن الأدوية النانوية المضادة للأورام
| دواء | إشارة | الدول/المناطق المدرجة | وقت الوصول إلى السوق |
| أمبيسوم | عدوى فطرية جهازية | الولايات المتحدة الأمريكية | 1997 |
| داونوكسوم | ساركوما بويل | الولايات المتحدة الأمريكية | 1996 |
| ديبو سايت | السحايا الخبيثة | الولايات المتحدة الأمريكية | 1999 |
| ديبودور | ألم مزمن | الولايات المتحدة الأمريكية | 2004 |
| دوكسيل | الإيدز، الورم النقوي المتعدد، وسرطان المبيض | الولايات المتحدة الأمريكية | 1995 |
| إنفليكسال | إنفلونزا | سويسرا | 1997 |
| ماركيبو | لوكيميا اللمفاويات الحادة | الولايات المتحدة الأمريكية | 2012 |
| ميباكت | أوستيوساكروما | أوروبا | 2009 |
| مايوست | سرطان الثدي النقيلي | أوروبا | ٢٠٠٠ |
| فيسودين | تنكس البقعة | الولايات المتحدة الأمريكية | ٢٠٠٠ |
| أبيلسيت | عدوى فطرية جهازية | الولايات المتحدة الأمريكية | 1995 |
| أمفوتيك | عدوى فطرية جهازية | الولايات المتحدة الأمريكية | 1996 |
| أداجن | نقص إنزيم الأدينوزين دياميناز | الولايات المتحدة الأمريكية | 1990 |
| سيمزيا | مرض كرون والتهاب المفاصل الروماتويدي | الولايات المتحدة الأمريكية | 2008 |
| نيولاستا | الحمى النيوتروبينية والأورام الدموية | الولايات المتحدة الأمريكية | ٢٠٠٢ |
| أونكاسبار | سرطان الدم الليمفاوي الحاد | الولايات المتحدة الأمريكية | 1994 |
| بيغاسي | التهاب الكبد B و C | الولايات المتحدة الأمريكية | ٢٠٠٢ |
| بيجلنترون | التهاب الكبد الوبائي C | الولايات المتحدة الأمريكية | 2001 |
| سومافيرت | ميغالاكريا | الولايات المتحدة الأمريكية | ٢٠٠٣ |
| ماكوجين | تنكس البقعة | الولايات المتحدة الأمريكية | 2004 |
| ميرسيرا | الفشل الكلوي المزمن | الولايات المتحدة الأمريكية | 2007 |
| تصحيح | مضاد القيء | الولايات المتحدة الأمريكية | ٢٠٠٣ |
| ميغاس ES | فقدان الشهية والهزال | الولايات المتحدة الأمريكية | 2005 |
| رابامون | مثبطات المناعة | الولايات المتحدة الأمريكية | ٢٠٠٢ |
| تريكور | فرط كوليسترول الدم وفرط ثلاثي الغليسريد | الولايات المتحدة الأمريكية | 2004 |
| ترغلايد | Sarcoma بوهل | الولايات المتحدة الأمريكية | 2004 |
| كوبكسون | التصلب المتعدد | الولايات المتحدة الأمريكية | 2014 |
| إليغارد | سرطان البروستاتا | الولايات المتحدة الأمريكية | ٢٠٠٢ |
| جينكسول | سرطان الثدي النقيلي وسرطان البنكرياس | الولايات المتحدة الأمريكية | ٢٠٠١ |
| أوباكسيوا | لوكيميا اللمفاويات الحادة | الولايات المتحدة الأمريكية | 2012 |
| ريناغل | أوستيوساكروما | الولايات المتحدة الأمريكية | ٢٠٠٠ |
| زينوستاتينستيمالامير | سرطان الثدي النقيلي وسرطان البنكرياس | اليابان | 1994 |
| كادسيلا | سرطان الثدي النقيلي | الولايات المتحدة الأمريكية | 2013 |
| أونتاك | لمفوما الخلايا التائية | الولايات المتحدة الأمريكية | 2005 |
| فينديكس | تصوير بالرنين المغناطيسي لآفات الكبد والطحال | الولايات المتحدة الأمريكية | 1996/2008 |
| فيراهيم | فقر الدم الناتج عن نقص الحديد (IDA) في مرض الكلى المزمن | الولايات المتحدة الأمريكية | 2009 |
| نانوثيرم | ورم دبقي، سرطان البروستاتا، وسرطان البنكرياس. | أوروبا | 2013 |
| جينديسين | ورم | الصين | 2003 |
| ريكسين-جي | ورم صلب | الفلبين | 2007 |
| ديبريفان | التنويم المغناطيسي الهادئ والتخدير | الولايات المتحدة الأمريكية | 1989 |
| إسترازورب | العلاج بالهرمونات البديلة لانقطاع الطمث | الولايات المتحدة الأمريكية | ٢٠٠٣ |
| فنجزون | عدوى فطرية جهازية | الولايات المتحدة الأمريكية | 1966 |
| أبراكسان | سرطان الثدي النقيلي و | الولايات المتحدة الأمريكية | 2005 |
توصيل الأدوية النانوية المستهدفة للأورام
النطاق الهيكلي المرتبط بالدهون من البروتينات الدهنية لفضح النطاق الهيكلي المرتبط بالمستقبلات للبروتينات الدهنية من أجل توصيل مستهدف إلى الدماغ. يرتبط بروتين الألبومين بالمستقبل gp60 على سطح خلايا البطانة الوعائية مما يسهل نقل الأدوية عبر الغشاء ويزيد من تراكم الأدوية في خلايا الورم. قام يانغ وآخرون بربط المواد الحساسة للضوء مثل ثنائي هيدرو بروفيرين e6 (Ce6) وأوكساليبلاتين ببروتين الألبومين البشري وربطوهما بـ
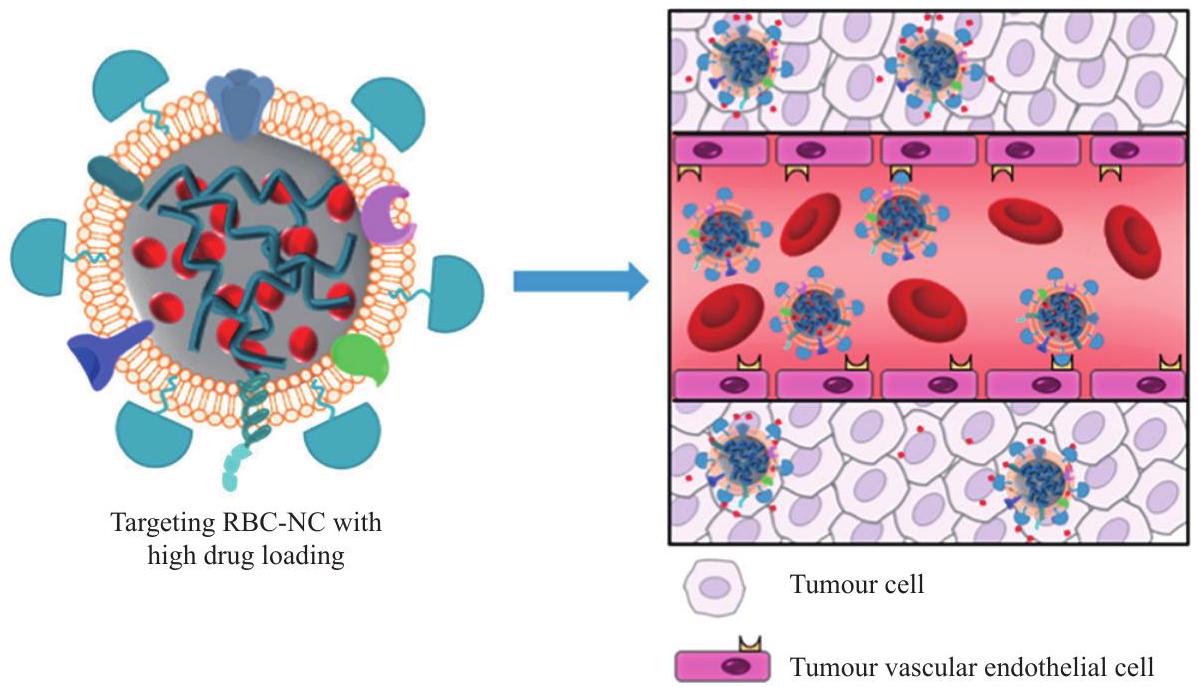
تقدم الجسيمات النانوية المغلفة بغشاء الخلية (CNPs) لتطبيقات طبية حيوية مثل توصيل الأدوية، والعلاج الضوئي، والعلاج المناعي. تمتلك CNPs مزايا واضحة مثل تحسين التوافق الحيوي، وتجنب المناعة، واستهداف الأورام. يمكن أن تقوم CNPs بتوصيل الدواء المحمّل بدقة لعلاج الأورام، ولها قيم تحويلية سريرية.
الأدوية النانوية تنظم بيئة الورم الدقيقة
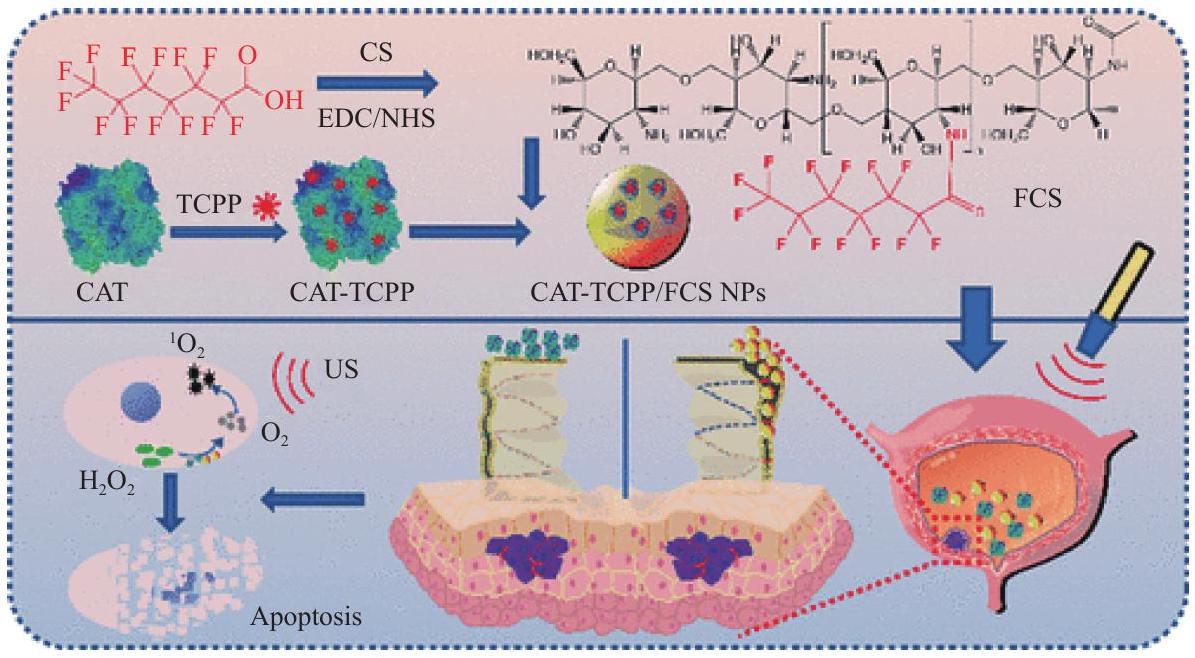
تم تجميعه بواسطة الكيتوزان الفلوري مع مادة حساسة للصوت الميسو-تترا(4-كربوكسي فينيل)بورفيرين (TCPP) المرتبطة بالكاتالاز (الشكل 9) لتخفيف نقص الأكسجين في بيئة الأنسجة الورمية عن طريق تحفيز المواد الداخلية للورم.
علاج الجينات الورمية المستند إلى الأدوية النانوية
تمت الموافقة على تسويقها في العالم بناءً على إعادة التركيب بين فيروس الأدينovirus وجين مثبط الورم (جين الإنسان p53) [79]. لقد جلب ظهور أدوات تحرير الجينات CRISPR/Cas9 فرصًا جديدة لعلاج أدوية الجينات الورمية. منذ أن تم إجراء أول تجربة سريرية لـ CRISPR/Cas9 لعلاج الأورام بواسطة مستشفى غرب الصين في سيتشوان في عام 2016 [80]، دخلت العديد من العلاجات الجينية الورمية المعتمدة على تقنية CRISPR/Cas9 التجارب السريرية. الناقلات الجينية المستخدمة بشكل شائع هي الناقلات الفيروسية وغير الفيروسية، حيث تعتبر الناقلات الفيروسية بشكل رئيسي ناقلات فيروس الأدينovirus ذات كفاءة نقل عالية، ولكن هناك مخاطر محتملة تتعلق بالمناعة، السمية الخلوية وإعادة التركيب الجيني، بينما تتجنب الناقلات غير الفيروسية المخاطر المحتملة للناقلات الفيروسية أثناء توصيل أدوية الجينات.

العلاج المناعي للأورام المعتمد على الأدوية النانوية
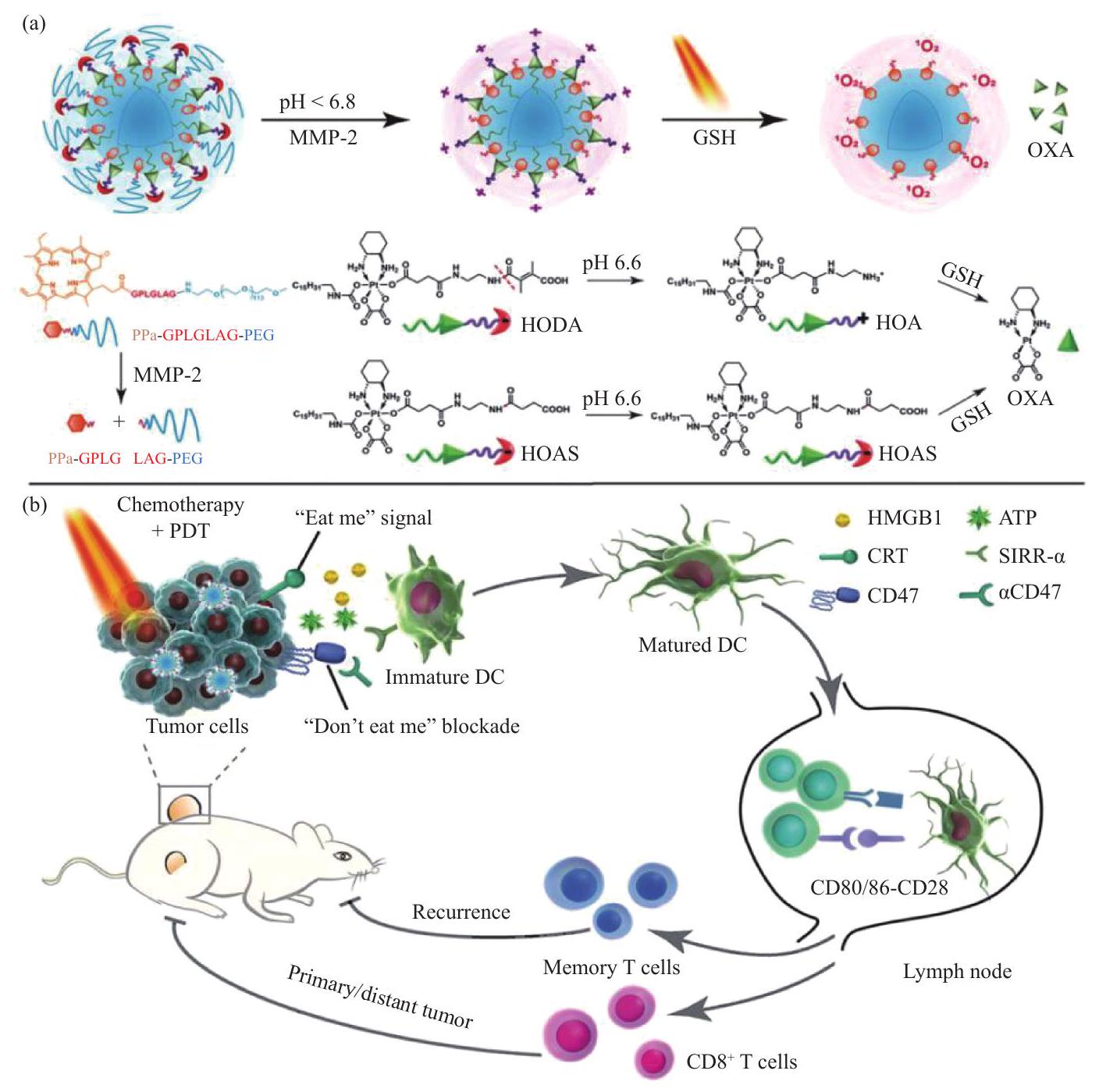
الإنزيمات، تحفز موت الخلايا المناعية في خلايا الورم، وتعزز نضوج خلايا الشجرة بالتزامن مع مثبط CD47، وتعزز تقديم المستضد بواسطة خلايا DC، وتثبط بشكل فعال نمو الأورام الأولية والثانوية، وتثبط نقائل الورم وتمنع انتكاسة الورم [88].
العلاج الإشعاعي للأورام المعتمد على الأدوية النانوية
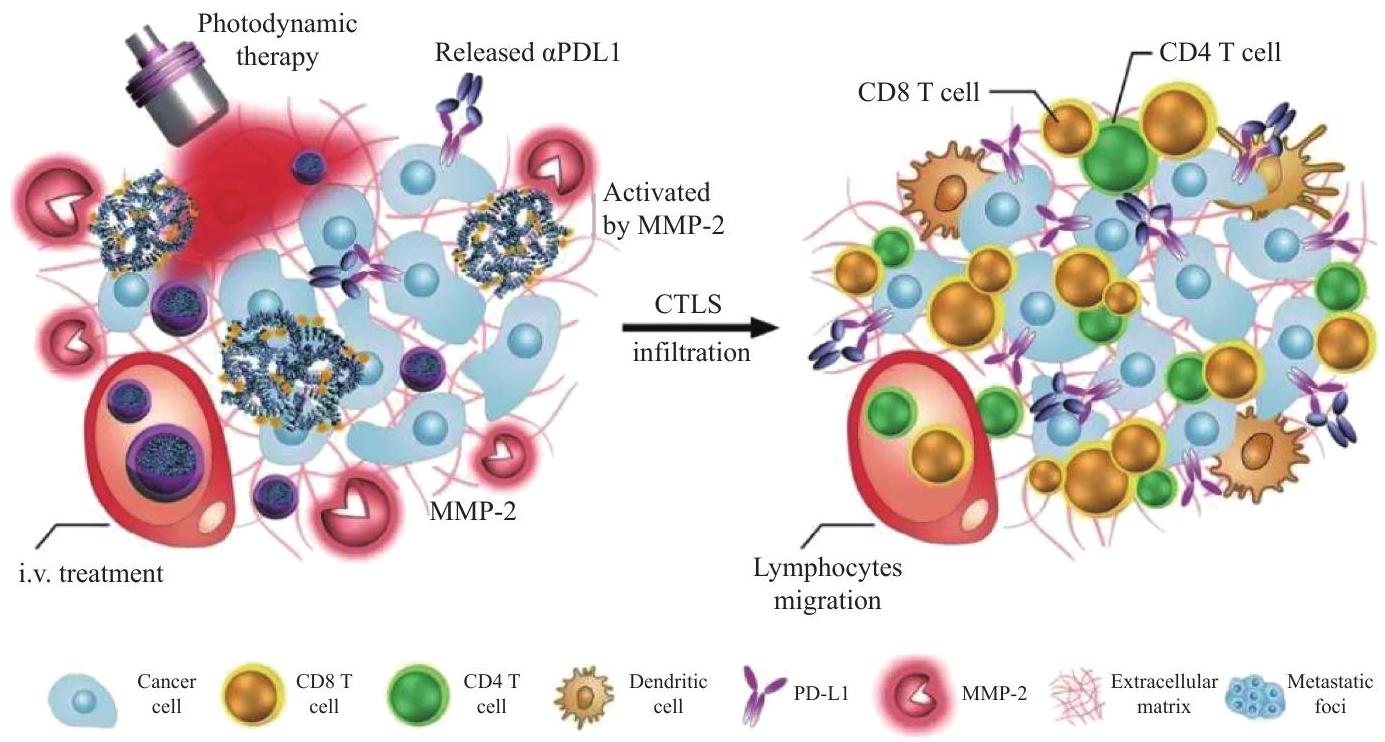
لقد أغنت الأبحاث والتطوير في علم الأحياء، وعلم الجينوم، وعلوم النانو، وسائل علاج الأورام بشكل كبير من خلال تطوير أدوية نانوية جديدة، مع مزايا في توصيل الأدوية المستهدف، وتنظيم البيئة الدقيقة للأورام، وتوصيل أدوية الجينات، وتعزيز العلاج المناعي للأورام وغيرها من الجوانب، مما يوفر فرصة جديدة لعلاج الأورام.
الملخص والتوقعات
أطلقت الولايات المتحدة الأمريكية “برنامج تكنولوجيا النانو لمكافحة السرطان” في عام 2005، بهدف دمج تكنولوجيا النانو، وبحوث السرطان، والطب الجزيئي، وتحقيق هدفها المتمثل في القضاء على وفيات السرطان والألم بحلول عام 2015 من خلال سلسلة من برامج البحث. المحتوى البحثي الرئيسي هو استخدام تكنولوجيا النانو، والتي تشمل بشكل رئيسي تكنولوجيا المواد النانوية وتكنولوجيا المستشعرات النانوية، لتشكيل بعض تقنيات وأجهزة النانو الجديدة للتشخيص المبكر، والتحذير، والعلاج للأورام الخبيثة. على الرغم من أن “خطة تكنولوجيا النانو لمكافحة السرطان” في الولايات المتحدة لا تزال بعيدة عن تحقيق الهدف الأصلي، إلا أن هذه التكنولوجيا قد رعت عددًا كبيرًا من المواهب التي تعمل في مجال البحث والتطوير في تكنولوجيا النانو، وعززت تطوير تكنولوجيا النانو الطبية، وأرست الأساس لاحتلال الولايات المتحدة لمكانة مهيمنة في مجال الطب الدقيق بتكنولوجيا النانو.
ملتزمون بتحسين الوضع الدولي لتكنولوجيا النانو. تشمل مجالات البحث المقترحة من قبل ألمانيا أنظمة توصيل الأدوية، والتلاعب بالجزيئات الحيوية، وتقنيات الكشف، والإلكترونيات النانوية مع الكيانات البيولوجية، والبحث في واجهات الكيانات البيولوجية وتقنيات الكشف. في الوقت الحالي، يركز البحث على نظام توصيل الأدوية المستهدف بالنانو الذي يمكنه تدمير خلايا الورم، والمستشعرات الحيوية النانوية المستخدمة لتشخيص تكوين الأجسام المضادة في دم الإنسان بعد الإصابة، والأجهزة النانوية المستخدمة لعلاج السرطان وأمراض القلب والأوعية الدموية.
تتمتع الجسيمات النانوية بحساسية أعلى في اكتشاف علامات الأمراض، مما يساعد بشكل كبير في التشخيص المبكر للعديد من الأمراض مثل الأورام؛ في علاج الأمراض، وُجد أن الأدوية التي تستخدم الجسيمات النانوية كحاملات يمكن أن تقلل من الآثار الجانبية وتزيد من استهداف الآفات. في الوقت الحالي، دخلت أدوية النانو مثل دوكسوروبيسين في شكل ليفوسوم و باكليتاكسيل في شكل ألبومين السوق، والعديد من أدوية النانو الأخرى تخضع حاليًا للتجارب السريرية، ومن المتوقع أن تدخل السوق للبيع قريبًا. من التقدم الحالي، من المتوقع أنه في السنوات القادمة
قادرة على التمايز الذاتي والتجديد الذاتي على المدى الطويل، ولديها القدرة على التمايز وتشكيل خلايا الأنسجة المختلفة تحت ظروف معينة. من خلال وسم خلايا الجذعية الجنينية للفئران بصبغة الفلورسنت القريبة من الأشعة تحت الحمراء DiR واستخدام نظام تصوير الحيوانات الصغيرة بعد ذلك، يمكن ملاحظة أن خلايا الجذعية الجنينية الموسومة بـ DiR يمكن أن تستهدف وتتعرف بنشاط على خلايا سرطان المعدة في الجسم الحي، مما يحقق تصوير الفلورسنت القريب من الأشعة تحت الحمراء لخلايا سرطان المعدة في الجسم الحي. كما يظهر أن محور CXCR4-CXCL12 يلعب دورًا رئيسيًا في عملية استهداف خلايا الجذعية الجنينية لسرطان المعدة في الجسم الحي. تم أيضًا دراسة تأثير الأنابيب النانوية الكربونية ذات الجدار الواحد على تكاثر وتمايز خلايا الجذعية الجنينية. يمكن أن تدخل الأنابيب النانوية الكربونية المعدلة بالبوليمر إلى خلايا الجذعية الجنينية وتحفز نمو وتطور خلايا الجذعية الجنينية. قام كوي وآخرون بنقل أربعة جينات (Oct4 وSox2 وLIN28 وNanog) إلى خلايا 293T باستخدام جزيئات نانوية مغناطيسية معدلة بالبوليمر، ونجحوا في تحضير خلايا جذعية متعددة القدرات مستحثة بشرية (iPS) في وسط مشروط، كما جمعوا وسط خلايا iPS المزروعة لمدة 72 ساعة، وزرعوها مع خلايا سرطان المعدة MGC803، وخطوط خلايا سرطان الكبد، وخطوط خلايا سرطان الثدي، وما إلى ذلك. أظهرت النتائج أن نمو خلايا سرطان المعدة وغيرها قد تم تثبيطه، مما يشير إلى أن المنتج الذي تفرزه خلايا iPS له وظيفة تثبيط نمو خلايا سرطان المعدة وغيرها. كما استخدموا جزيئات نانوية مغناطيسية فلورية لوسم خلايا iPS البشرية وحقنوها في فئران عارية تحمل الأورام عبر الوريد الذيل. أظهرت النتائج أن خلايا iPS البشرية تجمعت تدريجياً حول خلايا سرطان المعدة في الجسم الحي، وأن تصوير الفلورسنت المستهدف وتصوير الرنين المغناطيسي النووي لخلايا سرطان المعدة تم تحقيقه من خلال الاستفادة من خصائص الجزيئات النانوية المغناطيسية الفلورية. تحت تأثير مجال مغناطيسي في المختبر، باستخدام جهاز تصوير حراري، تم أيضًا اكتشاف أن درجة الحرارة المحلية للورم وصلت إلى أكثر من
تم حقن خلايا iPS المحملة بأنابيب الذهب المعدلة بـ CXCR4 من خلال الوريد الذيل في نموذج الفأر الحامل للورم، وقد لوحظ أن خلايا iPS كانت قادرة على استهداف موقع الورم، وأن العلاج الضوئي الحراري للورم يمكن تحقيقه بناءً على خصائص امتصاص الضوء وإنتاج الحرارة لأنابيب الذهب. تعتبر خلايا السرطان الجذعية سببًا مهمًا لانتشار الورم وعودته. قاموا بإعداد مجس من نجمة الذهب المرتبطة بالأجسام المضادة CD44، والذي حقق بنجاح التصوير الصوتي الضوئي المستهدف، وتصوير الأشعة المقطعية، والعلاج الضوئي الحراري لخلايا السرطان الجذعية في المعدة، مما أدى إلى تثبيط نمو خلايا السرطان الجذعية بشكل كبير وله قيمة ترجمة سريرية. تظهر السلسلة الحالية من التقدم أن تكنولوجيا النانو للخلايا الجذعية لديها آفاق تطبيق واسعة في البحث والتطوير في مجال الخلايا الجذعية، وهي مجال حاسم في الطب الدقيق.
تجمع الجزيئات الموجودة في الطبيعة، ولكن أيضًا تحقيق تحكم أعمق وذو هدف في الهياكل الجزيئية. واحدة من أهم صعوبات تقنية النانو هي عدم القدرة على رؤية كيفية تصرف موضوع البحث فعليًا. على سبيل المثال، الفيروسات أصغر من طول موجة الضوء، ولا يمكن رؤية هياكلها البيولوجية باستخدام المجهر الضوئي القياسي، كما أنه من الصعب أيضًا ملاحظتها باستخدام تقنيات التصوير الأخرى. أنشأ فريق بحثي متعدد التخصصات بالتعاون في جامعة كاليفورنيا، لوس أنجلوس، استخدم المجهر الإلكتروني بالتبريد لكشف الهيكل ثلاثي الأبعاد بدقة ذرية لفيروسات الأدينو والتفاعلات بين شبكات بروتيناتها، وأنه يمكن تعديل الفيروسات لتمكينها من توصيل الأدوية إلى المواقع المريضة، توفر هذه الاكتشافات معلومات حيوية للباحثين حول العالم الذين يحاولون تعديل فيروسات الأدينو لاستخدامها في اللقاحات وعلاج الجينات السرطانية.
تحديات دمج النانو-أونكولوجي
يعوق قدرتنا على التحقيق الكمي في الخصائص الهيكلية والميكانيكية والتشوه للمواد النانوية والأجهزة، من بين مواضيع أخرى. وبالتالي، فإن إنشاء نماذج نظرية قوية يمثل تحديات كبيرة في هذا المجال.
وجهات نظر دمج النانو-أونكولوجيا
تكنولوجيا النانو للحمض النووي الريبي [152] يمكّن من إنشاء تكنولوجيا نانو مع الأدوية الكيميائية التي تعالج التحديات المتعلقة بالذوبان، بينما يعزز تقارب تكنولوجيا النانو وتكنولوجيا التسلسل ظهور جيل جديد من تقنيات التسلسل النانوية. وهذا بدوره يغذي تطوير أدوات التسلسل النانوية الأساسية، والتقنيات الرائدة، وقدرات البحث والابتكار المستقلة، مما يعزز في النهاية القدرة التنافسية الأساسية المستقلة ويخفف من الاعتماد على الواردات الأجنبية.
بيان مؤلف CRediT
الشكر والتقدير
تعارض المصالح
References
[2] R.X. Zhang, H.L. Wong, H.Y. Xue, et al. Nanomedicine of synergistic drug combinations for cancer therapy-Strategies and perspectives. Journal of Controlled Release, 2016, 240: 489-503. https://doi.org/ 10.1016/j.jconrel.2016.06.012
[3] J. Kudr, Y. Haddad, L. Richtera, et al. Magnetic nanoparticles: From design and synthesis to real world applications. Nanomaterials, 2017, 7(9): 243. https://doi. org/10.3390/nano7090243
[4] T. Kang, F.Y. Li, S. Baik, et al. Surface design of magnetic nanoparticles for stimuli-responsive cancer imaging and therapy. Biomaterials, 2017, 136: 98-114. https://doi.org/10.1016/j.biomaterials.2017.05.013
[5] K. Sztandera, M. Gorzkiewicz, B. Klajnert-Maculewicz. Gold nanoparticles in cancer treatment. Molecular Pharmaceutics, 2019, 16(1): 1-23. https://doi.org/10. 1021/acs.molpharmaceut.8b00810
[6] N. Elahi, M. Kamali, M.H. Baghersad. Recent biomedical applications of gold nanoparticles: A review. Talanta, 2018, 184: 537-556. https://doi.org/10.1016/j. talanta.2018.02.088
[7] Y. Volkov. Quantum dots in nanomedicine: Recent trends, advances and unresolved issues. Biochemical and Biophysical Research Communications, 2015, 468(3): 419-427. https://doi.org/10.1016/j.bbrc.2015.07.039
[8] K.J. McHugh, L.H. Jing, A.M. Behrens, et al. Biocompatible semiconductor quantum dots as cancer imaging agents. Advanced Materials, 2018, 30(18): e1706356. https://doi.org/10.1002/adma. 201706356
[9] D. Maiti, X.M. Tong, X.Z. Mou, et al. Carbon-based nanomaterials for biomedical applications: A recent study. Frontiers in Pharmacology, 2018, 9: 1401. https:// doi.org/10.3389/fphar.2018.01401
[10] F. Farjadian, A. Roointan, S. Mohammadi-Samani, et al. Mesoporous silica nanoparticles: Synthesis, pharmaceutical applications, biodistribution, and biosafety assessment. Chemical Engineering Journal, 2019, 359: 684-705. https://doi.org/10.1016/j.cej.2018. 11.156
[11] M. Manzano, M. Vallet-Regí. Mesoporous silica nanoparticles for drug delivery. Advanced Functional Materials, 2020, 30(2): 1902634. https://doi.org/10.1002 /adfm. 201902634
[12] A. Gao, X.L. Hu, M. Saeed, et al. Overview of recent advances in liposomal nanoparticle-based cancer immunotherapy. Acta Pharmacologica Sinica, 2019, 40(9): 1129-1137. https://doi.org/10.1038/s41401-019-0281-1
[13] Y. Panahi, M. Farshbaf, M. Mohammadhosseini, et al. Recent advances on liposomal nanoparticles: Synthesis, characterization and biomedical applications. Artificial Cells, Nanomedicine, and Biotechnology, 2017, 45(4): 788-799. https://doi.org/10.1080/21691401.2017. 1282496
[14] Y.Z. Shen, W.T. Li. HA/HSA co-modified erlotinibalbumin nanoparticles for lung cancer treatment. Drug Design, Development and Therapy, 2018, 12: 2285-2292. https://doi.org/10.2147/DDDT.S169734
[15] R. Solanki, H. Rostamabadi, S. Patel, et al. Anticancer
nano-delivery systems based on bovine serum albumin nanoparticles: A critical review. International Journal of Biological Macromolecules, 2021, 193: 528-540. https:// doi.org/10.1016/j.ijbiomac.2021.10.040
[16] S.H. Wen, J.J. Zhou, K.Z. Zheng, et al. Advances in highly doped upconversion nanoparticles. Nature Communications, 2018, 9: 2415. https://doi.org/10.1038/ s41467-018-04813-5
[17] S. Wilhelm. Perspectives for upconverting nanoparticles. ACS Nano, 2017, 11(11): 10644-10653. https:// doi.org/10.1021/acsnano.7b07120
[18] J. Chao, H.L. Zhang, Y.K. Xing, et al. Programming DNA origami assembly for shape-resolved nanomechanical imaging labels. Nature Protocols, 2018, 13(7): 1569-1585. https://doi.org/10.1038/s41596-018-0004-y
[19] Y.S. Chen, S.L. Cheng, A.M. Zhang, et al. Salivary analysis based on surface enhanced Raman scattering sensors distinguishes early and advanced gastric cancer patients from healthy persons. Journal of Biomedical Nanotechnology, 2018, 14(10): 1773-1784. https://doi. org/10.1166/jbn.2018.2621
[20] M.A. Aslam, C.L. Xue, K. Wang, et al. SVM based classification and prediction system for gastric cancer using dominant features of saliva. Nano Biomedicine and Engineering, 2019, 12(1): 1-13. https://doi.org/10. 5101/nbe.v12i1.p1-13
[21] D.P. Yang, S.H. Chen, P. Huang, et al. Bacteriatemplate synthesized silver microspheres with hollow and porous structures as excellent SERS substrate. Green Chemistry, 2010, 12(11): 2038-2042. https://doi. org/10.1039/C0GC00431F
[22] X.C. Yu, L. He, M. Pentok, et al. An aptamer-based new method for competitive fluorescence detection of exosomes. Nanoscale, 2019, 11(33): 15589-15595. https:// doi.org/10.1039/C9NR04050A
[23] R. Huang, L. He, S. Li, et al. A simple fluorescence aptasensor for gastric cancer exosome detection based on branched rolling circle amplification. Nanoscale, 2020, 12(4): 2445-2451. https://doi.org/10.1039/ C9NR08747H
[24] D. Zhu, W. Liu, W.F. Cao, et al. Multiple amplified electrochemical detection of microRNA-21 using hierarchical flower-like gold nanostructures combined with gold-enriched hybridization chain reaction. Electroanalysis, 2018, 30(7): 1349-1356. https://doi.org /10.1002/elan. 201700696
[25] Y. Zhang, Z.H. Shuai, H. Zhou, et al. Single-molecule analysis of microRNA and logic operations using a smart plasmonic nanobiosensor. Journal of the American Chemical Society, 2018, 140(11): 3988-3993. https://doi.org/10.1021/jacs.7b12772
[26] J.P. Zhang, Y.L. Liu, X. Zhi, et al. DNA-templated silver nanoclusters locate microRNAs in the nuclei of gastric cancer cells. Nanoscale, 2018, 10(23): 11079-11090. https://doi.org/10.1039/C8NR02634C
[27] Y.Y. Tian, L. Zhang, L.H. Wang. DNA-functionalized plasmonic nanomaterials for optical biosensing. Biotechnology Journal, 2020, 15(1): e1800741. https:// doi.org/10.1002/biot. 201800741
[28] S.J. Lin, X. Zhi, D. Chen, et al. A flyover style microfluidic chip for highly purified magnetic cell separation. Biosensors and Bioelectronics, 2019, 129: 175-181. https://doi.org/10.1016/j.bios.2018.12.058
[29] H. Tang, J.Q. Niu, X.N. Pan, et al. Topology optimization based deterministic lateral displacement array design for cell separation. Journal of Chromatography A, 2022, 1679: 463384. https://doi.org/10.1016/j.chroma. 2022.463384
[30] X. Zhi, M. Deng, H. Yang, et al. A novel HBV genotypes detecting system combined with microfluidic chip, loop-mediated isothermal amplification and GMR sensors. Biosensors and Bioelectronics, 2014, 54: 372-377. https://doi.org/10.1016/j.bios.2013.11.025
[31] Y. Zheng, K. Wang, J.J. Zhang, et al. Simultaneous Quantitative Detection of Helicobacter Pylori Based on a Rapid and Sensitive Testing Platform using Quantum Dots-Labeled Immunochromatiographic Test Strips. Nanoscale Research Letters, 2016, 11(1): 62. https://doi. org/10.1186/s11671-016-1254-7
[32] S. Gao, L. Kang, M. Deng, et al. A giant magnetoimpedance-based microfluidic system for multiplex immunological assay. Nano Biomedicine and Engineering, 2016, 8(4): 240-245. https://doi.org/10. 5101/nbe.v8i4.p240-245
[33] K. Wang, J.C. Yang, H. Xu, et al. Smartphone-imaged multilayered paper-based analytical device for colorimetric analysis of carcinoembryonic antigen. Analytical and Bioanalytical Chemistry, 2020, 412(11): 2517-2528. https:// doi.org/10.1007/s00216-020-02475-1
[34] K. Wang, D.X. Cui. The application of immunochromatographic analysis in early detection of gastric cancer. In: Gastric Cancer Prewarning and Early Diagnosis System. Dordrecht: Springer, 2017: 129-156. https://doi.org/10.1007/978-94-024-0951-2_8
[35] W.J. Wu, X.Y. Liu, M.F. Shen, et al. Multicolor quantum dot nanobeads based fluorescence-linked immunosorbent assay for highly sensitive multiplexed detection. Sensors and Actuators B: Chemical, 2021, 338: 129827. https://doi.org/10.1016/j.snb.2021.129827
[36] J.A. Harrell, R. Kopelman. Biocompatible probes measure intracellular activity. Biophotonics International, 2000, 7: 22-24.
[37] R. Weissleder. Molecular imaging: Exploring the next frontier. Radiology, 1999, 212(3): 609-614. https://doi. org/10.1148/radiology.212.3.r99se18609
[38] C. Wang, C.C. Bao, S.J. Liang, et al. HAI-178 antibodyconjugated fluorescent magnetic nanoparticles for targeted imaging and simultaneous therapy of gastric cancer. Nanoscale Research Letters, 2014, 9(1): 274. https:// doi.org/10.1186/1556-276X-9-274
[39] T. Yin, H.G. Wu, Q. Zhang, et al. In vivo targeted therapy of gastric tumors via the mechanical rotation of a flower-like
[40] B.F. Pan, D.X. Cui, Y. Sheng, et al. Dendrimer-modified magnetic nanoparticles enhance efficiency of gene delivery system. Cancer Research, 2007, 67(17): 8156-8163. https://doi.org/10.1158/0008-5472.CAN-064762
[41] Y.F. Kong, J. Chen, F. Gao, et al. A multifunctional ribonuclease-A-conjugated CdTe quantum dot cluster nanosystem for synchronous cancer imaging and therapy. Small, 2010, 6(21): 2367-2373. https://doi.org/ 10.1002/smll. 201001050
[42] J. Ruan, H. Song, Q.R. Qian, et al. HER2 monoclonal antibody conjugated RNase-A-associated CdTe quantum dots for targeted imaging and therapy of gastric cancer. Biomaterials, 2012, 33(29): 7093-7102. https://doi.org/ 10.1016/j.biomaterials.2012.06.053
[43] C. Li, Y. Ji, C. Wang, et al. BRCAA1 antibody- and Her2 antibody-conjugated amphiphilic polymer engineered
[44] P. Huang, J. Lin, X.S. Wang, et al. Light-triggered theranostics based on photosensitizer-conjugated carbon dots for simultaneous enhanced-fluorescence imaging and photodynamic therapy. Advanced Materials, 2012, 24(37): 5104-5110. https://doi.org/10.1002/adma. 201200650
[45] Z.M. Li, P. Huang, X.J. Zhang, et al. RGD-conjugated dendrimer-modified gold nanorods for in vivo tumor targeting and photothermal therapy. Molecular Pharmaceutics, 2010, 7(1): 94-104. https://doi.org/10. 1021/mp9001415
[46] P. Huang, L. Bao, C.L. Zhang, et al. Folic acid-
conjugated Silica-modified gold nanorods for X-ray/CT imaging-guided dual-mode radiation and photo-thermal therapy. Biomaterials, 2011, 32(36): 9796-9809. https:// doi.org/10.1016/j.biomaterials.2011.08.086
[47] S.H. Chen, C.C. Bao, C.L. Zhang, et al. EGFR antibody conjugated bimetallic Au@Ag nanorods for enhanced SERS-based tumor boundary identification, targeted photoacoustic imaging and photothermal therapy. Nano Biomedicine and Engineering, 2016, 8(4): 315-328. https:// doi.org/10.5101/nbe.v8i4.p315-328
[48] C.C. Bao, N. Beziere, P. del Pino, et al. Gold nanoprisms as optoacoustic signal nanoamplifiers for in vivo bioimaging of gastrointestinal cancers. Small, 2013, 9(1): 68-74. https://doi.org/10.1002/smll.201201779
[49] S.J. Liang, C. Li, C.L. Zhang, et al. CD44v6 monoclonal antibody-conjugated gold nanostars for targeted photoacoustic imaging and plasmonic photothermal therapy of gastric cancer stem-like cells. Theranostics, 2015, 5(9): 970-984. https://doi.org/10.7150/thno. 11632
[50] X. Zhi, Y.L. Liu, L.N. Lin, et al. Oral pH sensitive GNS@ab nanoprobes for targeted therapy of Helicobacter pylori without disturbance gut microbiome. Nanomedicine: Nanotechnology, Biology and Medicine, 2019, 20: 102019. https://doi.org/10.1016/j.nano.2019. 102019
[51] Z.J. Zhou, C.L. Zhang, Q.R. Qian, et al. Folic acidconjugated silica capped gold nanoclusters for targeted fluorescence/X-ray computed tomography imaging. Journal of Nanobiotechnology, 2013, 11: 17. https://doi. org/10.1186/1477-3155-11-17
[52] C.L. Zhang, Z.J. Zhou, X. Zhi, et al. Insights into the distinguishing stress-induced cytotoxicity of chiral gold nanoclusters and the relationship with GSTP1. Theranostics, 2015, 5(2): 134-149. https://doi.org/10. 7150/thno. 10363
[53] C. Zhou, G.Y. Hao, P. Thomas, et al. Near-infrared emitting radioactive gold nanoparticles with molecular pharmacokinetics. Angewandte Chemie International Edition, 2012, 51(40): 10118-10122. https://doi.org/10. 1002/anie. 201203031
[54] M. He, P. Huang, C.L. Zhang, et al. Phase- and sizecontrollable synthesis of hexagonal upconversion rareearth fluoride nanocrystals through an oleic acid/ionic liquid two-phase system. Chemistry, 2012, 18(19): 5954-5969. https://doi.org/10.1002/chem. 201102419
[55] J.B. Ma, P. Huang, M. He, et al. Folic acid-conjugated
[56] F. Chen, P. Huang, Y.J. Zhu, et al. The photoluminescence, drug delivery and imaging properties of multifunctional
[57] X. Hu, J.H. Sun, F.Y. Li, et al. Renal-clearable hollow bismuth subcarbonate nanotubes for tumor targeted computed tomography imaging and chemoradiotherapy. Nano Letters, 2018, 18(2): 1196-1204. https://doi.org/ 10.1021/acs.nanolett.7b04741
[58] C.Y. Wang, Y.P. Xiao, W.W. Zhu, et al. Photosensitizermodified
[59] Y. Ding, Q. Yan, J.W. Ruan, et al. Bone marrow mesenchymal stem cells and electroacupuncture downregulate the inhibitor molecules and promote the axonal regeneration in the transected spinal cord of rats. Cell Transplantation, 2011, 20(4): 475-491. https://doi. org/10.3727/096368910X528102
[60] J. Ruan, H. Song, C. Li, et al. DiR-labeled Embryonic Stem Cells for Targeted Imaging of in vivo Gastric
[61] J. Ruan, J. Shen, Z. Wang, et al. Efficient preparation and labeling of human induced pluripotent stem cells by nanotechnology. International Journal of Nanomedicine, 2011, 6: 425-435. https://doi.org/10.2147/IJN.S16498
[62] D.X. Cui, C.L. Zhang, B. Liu, et al. Regression of gastric cancer by systemic injection of RNA nanoparticles carrying both ligand and siRNA. Scientific Reports, 2015, 5: 10726. https://doi.org/10.1038/srep10726
[63] C.X. Yue, Y.M. Yang, C.L. Zhang, et al. ROSresponsive mitochondria-targeting blended nanoparticles: Chemo- and photodynamic synergistic therapy for lung cancer with on-demand drug release upon irradiation with a single light source. Theranostics, 2016, 6(13): 2352-2366. https://doi.org/10.7150/thno
[64] C.X. Yue, C.L. Zhang, G. Alfranca, et al. Near-Infrared Light Triggered ROS-activated Theranostic Platform based on Ce6-CPT-UCNPs for Simultaneous Fluorescence Imaging and Chemo-Photodynamic Combined Therapy. Theranostics, 2016, 6(4): 456-469. https://doi.org/10.7150/thno. 14101
[65] Y.L. Liu, Y.X. Pan, W. Cao, et al. A tumor microenvironment responsive biodegradable
[66] H. Song, R. He, K. Wang, et al. Anti-HIF-1
[67] J.L. Huang, G. Jiang, Q.X. Song, et al. Lipoproteinbiomimetic nanostructure enables efficient targeting delivery of siRNA to Ras-activated glioblastoma cells via macropinocytosis. Nature Communications, 2017, 8: 15144. https://doi.org/10.1038/ncomms15144
[68] Z. Zhang, J. Guan, Z.X. Jiang, et al. Brain-targeted drug delivery by manipulating protein corona functions. Nature Communications, 2019, 10: 3561. https://doi.org/ 10.1038/s41467-019-11593-z
[69] G.B. Yang, S.Z.F. Phua, W.Q. Lim, et al. A hypoxiaresponsive albumin-based nanosystem for deep tumor penetration and excellent therapeutic efficacy. Advanced Materials, 2019, 31(25): e1901513. https://doi.org/10. 1002/adma.201901513
[70] Z.L. Chai, D.N. Ran, L.W. Lu, et al. Ligand-modified cell membrane enables the targeted delivery of drug nanocrystals to glioma. ACS Nano, 2019, 13(5): 5591-5601. https://doi.org/10.1021/acsnano.9b00661
[71] Y. Zhang, K.M. Cai, C. Li, et al. Macrophage-membrane-coated nanoparticles for tumor-targeted chemotherapy. Nano Letters, 2018, 18(3): 1908-1915. https:// doi.org/10.1021/acs.nanolett.7b05263
[72] R.H. Fang,W.W. Gao, L.F. Zhang. Targeting drugs to tumours using cell membrane-coated nanoparticles. Nat Rev Clin Oncol, 2023, 20(1): 33-48. https://doi.org/10. 1038/s41571-022-00699-x
[73] G.Z. Li, S.P. Wang, D.S. Deng, et al. Fluorinated chitosan to enhance transmucosal delivery of sonosensitizer-conjugated catalase for sonodynamic bladder cancer treatment post-intravesical instillation. ACS Nano, 2020, 14(2): 1586-1599. https://doi.org/10. 1021/acsnano.9b06689
[74] J. Chen, H.L. Luo, Y. Liu, et al. Oxygen-self-produced nanoplatform for relieving hypoxia and breaking resistance to sonodynamic treatment of pancreatic cancer. ACS Nano, 2017, 11(12): 12849-12862. https:// doi.org/10.1021/acsnano.7b08225
[75] C. Feng, R.Z. Chen, W.W. Fang, et al. Synergistic effect of CD47 blockade in combination with cordycepin treatment against cancer. Frontiers in Pharmacology, 2023, 14: 1144330. https://doi.org/10.3389/fphar.2023.
[76] P.F. Zhao, W.M. Yin, A.H. Wu, et al. Dual-targeting to cancer cells and M2 macrophages via biomimetic delivery of mannosylated albumin nanoparticles for drugresistant cancer therapy. Advanced Functional Materials, 2020, 30(16): 1700403. https://doi.org/10. 1002/adfm. 201700403
[77] Y. Qian, S. Qiao, Y.F. Dai, et al. Molecular-targeted immunotherapeutic strategy for melanoma via dualtargeting nanoparticles delivering small interfering RNA to tumor-associated macrophages. ACS Nano, 2017, 11(9): 9536-9549. https://doi.org/10.1021/acsnano. 7b05465
[78] C.R. Shi, T. Liu, Z.D. Guo, et al. Reprogramming tumorassociated macrophages by nanoparticle-based reactive oxygen species photogeneration. Nano Letters, 2018, 18(11): 7330-7342. https://doi.org/10.1021/acs.nanolett. 8b03568
[79] W.W. Zhang, L.J. Li, D.G. Li, et al. The first approved gene therapy product for cancer ad-p53 (gendicine): 12 years in the clinic. Human Gene Therapy, 2018, 29(2): 160-179. https://doi.org/10.1089/hum.2017.218
[80] T.Z. Zhan, N. Rindtorff, J. Betge, et al. CRISPR/Cas9 for cancer research and therapy. Seminars in Cancer Biology, 2019, 55: 106-119. https://doi.org/10.1016/j. semcancer.2018.04.001
[81] J. Kim, A. Jozic, Y.X. Lin, et al. Engineering lipid nanoparticles for enhanced intracellular delivery of mRNA through inhalation. ACS Nano, 2022, 16(9): 14792-14806. https://doi.org/10.1021/acsnano.2c05647
[82] F.M. Pi, D.W. Binzel, T.J. Lee, et al. Nanoparticle orientation to control RNA loading and ligand display on extracellular vesicles for cancer regression. Nature Nanotechnology, 2018, 13(1): 82-89. https://doi.org/10. 1038/s41565-017-0012-z
[83] Y.C. Pan, J.J. Yang, X.W. Luan, et al. Near-infrared upconversion-activated CRISPR-Cas9 system: A remotecontrolled gene editing platform. Science Advances, 2019, 5(4): eaav7199. https://doi.org/10.1126/sciadv. aav7199
[84] R.B. Patel, M.Z. Ye, P.M. Carlson, et al. Development of an in situ cancer vaccine via combinational radiation and bacterial-membrane-coated nanoparticles. Advanced Materials, 2019, 31(43): 1902626. https://doi.org/10. 1002/adma. 201902626
[85] B. Hou, D.G. Wang, J. Gao, H. Wang, Y.P. Li, H.J. Yu. Advances of microenvironment-activated nanosized drug delivery system for cancer immunotherapy. Acta Pharmaceutica Sinica, 2019, 12, 1802-1809. (in Chinese)
[86] R. Yang, J. Xu, L.G. Xu, et al. Cancer cell membranecoated adjuvant nanoparticles with mannose modification for effective anticancer vaccination.
[87] L.Q. Liu, Y. Wang, X. Guo, et al. A biomimetic polymer magnetic nanocarrier polarizing tumor-associated macrophages for potentiating immunotherapy. Small, 2020, 16(38): e2003543. https://doi.org/10.1002/smll. 202003543
[88] F.Y. Zhou, B. Feng, H.J. Yu, et al. Tumor microenvironment-activatable prodrug vesicles for nanoenabled cancer chemoimmunotherapy combining immunogenic cell death induction and CD47 blockade. Advanced Materials, 2019, 31(14): e1805888. https://doi. org/10.1002/adma. 201805888
[89] O. Rixe, J.C. Morris, V.K. Puduvalli, et al. First-inhuman, first-in-class phase 1a study of BXQ-350 for solid tumors and gliomas. Journal of Clinical Oncology, 2018, 36(15_suppl): 2517. https://doi.org/10.1200/jco. 2018.36.15_suppl. 2517
[90] W. Li, F.L. Wu, S.L. Zhao, et al. Correlation between PD-1/PD-L1 expression and polarization in tumorassociated macrophages: A key player in tumor
immunotherapy. Cytokine & Growth Factor Reviews, 2022, 67: 49-57. https://doi.org/10.1016/j.cytogfr.2022. 07.004
[91] W.Q. Wang, Y.L. Jin, X. Liu, et al. Endogenous stimuliactivatable nanomedicine for immune theranostics for cancer. Advanced Functional Materials, 2021, 31(26): 2100386. https://doi.org/10.1002/adfm. 202100386
[92] E. M. Cheng, N. W. Tsarovsky, P. M, Sondel, A. L. Rakhmilevich. Interleukin-12 as an in situ cancer vaccine component: a review. Cancer Immunol Immunother, 2022, 71(9): 2057-2065. https://doi.org/10. 1007/s00262-022-03144-1
[93] L. Zhou, P.C. Zhang, H. Wang, et al. Smart nanosized drug delivery systems inducing immunogenic cell death for combination with cancer immunotherapy. Accounts of Chemical Research, 2020, 53(9): 1761-1772. https:// doi.org/10.1021/acs.accounts.0c00254
[94] Y.Z. Chang, L.Z. He, Z.B. Li, et al. Designing core-shell gold and selenium nanocomposites for cancer radiochemotherapy. ACS Nano, 2017, 11(5): 4848-4858. https://doi.org/10.1021/acsnano.7b01346
[95] H.J. Song, H. Sun, N.N. He, et al. Gadolinium-based ultra-small nanoparticles augment radiotherapy-induced T-cell response to synergize with checkpoint blockade immunotherapy. Nanoscale, 2022, 14(31): 11429-11442. https://doi.org/10.1039/D2NR02620A
[96] A. Wicki, D. Witzigmann, V. Balasubramanian, et al. Nanomedicine in cancer therapy: Challenges, opportunities, and clinical applications. Journal of Controlled Release, 2015, 200: 138-157. https://doi.org/ 10.1016/j.jconrel.2014.12.030
[97] M.L. Etheridge, S.A. Campbell, A.G. Erdman, et al. The big picture on nanomedicine: The state of investigational and approved nanomedicine products. Nanomedicine: Nanotechnology, Biology and Medicine, 2013, 9(1): 1-14. https://doi.org/10.1016/j.nano.2012.05.013
[98] Chen, H. B., Gu, Z. J., An, H. W., Chen, C. Y., Chen, J., Cui, R., Chen, S. Q., Chen, W. H., Chen, X. S., Chen, X. Y. et al. Precise nanomedicine for intelligent therapy of cancer. Science China Chemistry, 2018, 61(12): 1503-1552. https://doi.org/10.1007/s11426-018-9397-5
[99] M. Germain, F. Caputo, S. Metcalfe, et al. Delivering the power of nanomedicine to patients today. Journal of Controlled Release, 2020, 326: 164-171. https://doi.org/ 10.1016/j.jconrel.2020.07.007
[100] E.K.H. Chow, D. Ho. Cancer nanomedicine: From drug delivery to imaging. Science Translational Medicine, 2013, 5(216): 216rv4 https://doi.org/10.1126/ scitranslmed. 3005872
[101] Gonzalez-Valdivieso, J., Girotti, A., Schneider, J., Arias, F. J. Advanced nanomedicine and cancer: Challenges and opportunities in clinical translation. International Journal of Pharmaceutics, 2021, 599: 120438. https:// doi.org/10.1016/j.ijpharm.2021.120438
[102] C. von Roemeling, W. Jiang, C.K. Chan, et al. Breaking down the barriers to precision cancer nanomedicine. Trends in Biotechnology, 2017, 35(2): 159-171. https:// doi.org/10.1016/j.tibtech.2016.07.006
[103] J.I. Hare, T. Lammers, M.B. Ashford, et al. Challenges and strategies in anti-cancer nanomedicine development: An industry perspective. Advanced Drug Delivery Reviews, 2017, 108: 25-38. https://doi.org/10.1016/j. addr.2016.04.025
[104] Z.M. Li, X.T. Shan, Z.D. Chen, et al. Applications of surface modification technologies in nanomedicine for deep tumor penetration. Advanced Science, 2020, 8(1): 2002589. https://doi.org/10.1002/advs. 202002589
[105] S. Kunjachan, J. Ehling, G. Storm, et al. Noninvasive imaging of nanomedicines and nanotheranostics: Principles, progress, and prospects. Chemical Reviews, 2015, 115(19): 10907-10937. https://doi.org/10.1021/ cr500314d
[106] Y.Z. Min, J.M. Caster, M.J. Eblan, et al. Clinical translation of nanomedicine. Chemical Reviews, 2015,
[107] B. Pelaz, C. Alexiou, R.A. Alvarez-Puebla, et al. Diverse applications of nanomedicine. ACS Nano, 2017, 11(3): 2313-2381. https://doi.org/10.1021/acsnano. 6b06040
[108] J.Y. Ren, N. Andrikopoulos, K. Velonia, et al. Chemical and biophysical signatures of the protein corona in nanomedicine. Journal of the American Chemical Society, 2022, 144(21): 9184-9205. https://doi.org/10. 1021/jacs.2c02277
[109] M. Sousa de Almeida, E. Susnik, B. Drasler, et al. Understanding nanoparticle endocytosis to improve targeting strategies in nanomedicine. Chemical Society Reviews, 2021, 50(9): 5397-5434. https://doi.org/10. 1039/D0CS01127D
[110] C.B. He, D.M. Liu, W.B. Lin. Nanomedicine applications of hybrid nanomaterials built from metalligand coordination bonds: Nanoscale metal-organic frameworks and nanoscale coordination polymers. Chemical Reviews, 2015, 115(19): 11079-11108. https:// doi.org/10.1021/acs.chemrev.5b00125
[111] J.H. Lee, J.H. Choi, S.TD. Chueng, et al. Nondestructive characterization of stem cell neurogenesis by a magnetoplasmonic nanomaterial-based exosomal miRNA detection. ACS Nano, 2019, 13(8): 8793-8803. https:// doi.org/10.1021/acsnano.9b01875
[112] S.Y. Xu, B. Liu, J.Y. Fan, et al. Engineered mesenchymal stem cell-derived exosomes with high CXCR4 levels for targeted siRNA gene therapy against cancer. Nanoscale, 2022, 14(11): 4098-4113. https://doi. org/10.1039/D1NR08170E
[113] J. Czyz, C. Wiese, A. Rolletschek, et al. Potential of embryonic and adult stem cells in vitro. Biological Chemistry, 2003, 384(10-11): 1391-1409. https://doi. org/10.1515/bc.2003.155
[114] P.C. Chagastelles, N.B. Nardi. Biology of stem cells: An overview. Kidney International Supplements, 2011, 1(3): 63-67. https://doi.org/10.1038/kisup.2011.15
[115] U.M. Domanska, R.C. Kruizinga, W.B. Nagengast, et al. A review on CXCR4/CXCL12 axis in oncology: No place to hide. European Journal of Cancer, 2013, 49(1): 219-230. https://doi.org/10.1016/j.ejca.2012.05.005
[116] Z.D. Wang, J. Sun, Y.Q. Feng, et al. Oncogenic roles and drug target of CXCR4/CXCL12 axis in lung cancer and cancer stem cell. Tumor Biology, 2016, 37(7): 8515-8528. https://doi.org/10.1007/s13277-016-5016-z
[117] D.X. Cui, H. Zhang, Z. Wang, et al. Effects of dendrimer-functionalized multi-walled carbon nanotubes on murine embryonic stem cells. ECS Transactions, 2008, 13(14): 111-116. https://doi.org/10.1149/1. 2998536
[118] J. Ruan, J.J. Ji, H. Song, et al. Fluorescent magnetic nanoparticle-labeled mesenchymal stem cells for targeted imaging and hyperthermia therapy of in vivo gastric cancer. Nanoscale Research Letters, 2012, 7: 309. https://doi.org/10.1186/1556-276X-7-309
[119] C. Li, J. Ruan, M. Yang, et al. Human induced pluripotent stem cells labeled with fluorescent magnetic nanoparticles for targeted imaging and hyperthermia therapy for gastric cancer. Cancer Biology & Medicine, 2015, 12(3): 163-174. https://doi.org/10.7497/j.issn. 2095-3941.2015.0040
[120] Y.L. Liu, M. Yang, J.P. Zhang, et al. Human induced pluripotent stem cells for tumor targeted delivery of gold nanorods and enhanced photothermal therapy.
[121] J. Conde, C.C. Bao, D.X. Cui, et al. Antibody-drug gold nanoantennas with Raman spectroscopic fingerprints for in vivo tumour theranostics. Journal of Controlled Release, 2014, 183: 87-93. https://doi.org/10.1016/j. jconrel.2014.03.045
[122] J. Conde, F.R. Tian, Y. Hernández, et al. In vivo tumor
targeting via nanoparticle-mediated therapeutic siRNA coupled to inflammatory response in lung cancer mouse models. Biomaterials, 2013, 34(31): 7744-7753. https:// doi.org/10.1016/j.biomaterials.2013.06.041
[123] C.C. Bao, J. Conde, F. Pan, et al. Gold nanoprisms as a hybrid in vivo cancer theranostic platform for in situ photoacoustic imaging, angiography, and localized hyperthermia. Nano Research, 2016, 9(4): 1043-1056. https:// doi.org/10.1007/s12274-016-0996-y
[124] J. Conde, J.T. Dias, V. Grazú, et al. Revisiting 30 years of biofunctionalization and surface chemistry of inorganic nanoparticles for nanomedicine. Frontiers in Chemistry, 2014, 2: 48. https://doi.org/10.3389/fchem. 2014.00048
[125] J. Conde, A. Ambrosone, Y. Hernandez, et al. 15 years on siRNA delivery: Beyond the State-of-the-Art on inorganic nanoparticles for RNAi therapeutics. Nano Today, 2015, 10(4): 421-450. https://doi.org/10.1016/j. nantod.2015.06.008
[126] A. Kumari, S.K. Yadav, S.C. Yadav. Biodegradable polymeric nanoparticles based drug delivery systems. Colloids and Surfaces B: Biointerfaces, 2010, 75(1): 1-18. https://doi.org/10.1016/j.colsurfb.2009.09.001
[127] M.M. Roberts, J.L. White, M.G. Grütter, et al. Threedimensional structure of the adenovirus major coat protein hexon. Science, 1986, 232(4754): 1148-1151. https:// doi.org/10.1126/science. 3704642
[128] Y.L. Liu, X. Zhi, M. Yang, et al. Tumor-triggered drug release from calcium carbonate-encapsulated gold nanostars for near-infrared photodynamic/photothermal combination antitumor therapy. Theranostics, 2017, 7(6): 1650-1662. https://doi.org/10.7150/thno. 17602
[129] A.A. Date, J. Hanes, L.M. Ensign, Nanoparticles for oral delivery: Design, evaluation and state-of-the-art. Journal of Controlled Release, 2016, 240: 504-526. https://doi. org/10.1016/j.jconrel.2016.06.016
[130] P. Singh, S.K. Sahoo. Nano-oncology: Clinical application for cancer therapy and future perspectives. In: Cancer Nanotheranostics. Cham: Springer, 2021: 49-95. https://doi.org/10.1007/978-3-030-76263-6_3
[131] Liu, Y., Solomon, M., Achilefu, S. Perspectives and potential applications of nanomedicine in breast and prostate cancer. Medicinal Research Reviews, 2013, 33(1): 3-32. https://doi.org/10.1002/med. 20233
[132] N. Abood, M. Jabir, H. Kadhim. TNF-
[133] X.X. Han, M.J. Mitchell, G.J. Nie. Nanomaterials for therapeutic RNA delivery. Matter, 2020, 3(6): 1948-1975. https://doi.org/10.1016/j.matt.2020.09.020
[134] M. Kumar, U. Kumar, A.K. Singh. Therapeutic nanoparticles: Recent developments and their targeted delivery applications. Nano Biomedicine and Engineering, 2022, 14(1): 38-52. https://doi.org/10.5101/nbe.v14i1. p38-52
[135] Y. Lu, W.J. Sun, Z. Gu. Stimuli-responsive nanomaterials for therapeutic protein delivery. Journal of Controlled Release, 2014, 194: 1-19. https://doi.org/ 10.1016/j.jconrel.2014.08.015
[136] A. Alekhya, A.K. Sailaja. Formulation and evaluation of letrozole nanoparticles by salting out technique and determination of anti-cancer activity by MTT assay. Nano Biomedicine and Engineering, 2022, 14(3): 246-253. https://doi.org/10.5101/nbe.v14i3.p246-253
[137] V. Biju. Chemical modifications and bioconjugate reactions of nanomaterials for sensing, imaging, drug delivery and therapy. Chemical Society Reviews, 2014, 43(3): 744-764. https://doi.org/10.1039/C3CS60273G
[138] S.A. Rashdan. Chemical detection of the toxicity of nanoparticles of metals and metal oxides. Nano Biomedicine and Engineering, 2021, 13(4): 401-413. https:// doi.org/10.5101/nbe.v13i4.p401-413
[139] B. Elder, R. Neupane, E. Tokita, et al. Nanomaterial patterning in 3D printing. Advanced Materials, 2020, 32(17): e1907142. https://doi.org/10.1002/adma. 201907142
[140] K. Thorkelsson, P. Bai, T. Xu. Self-assembly and applications of anisotropic nanomaterials: A review. Nano Today, 2015, 10(1): 48-66. https://doi.org/10. 1016/j.nantod.2014.12.005
[141] E. Baquedano, R.V. Martinez, J.M. Llorens, et al. Fabrication of silicon nanobelts and nanopillars by soft lithography for hydrophobic and hydrophilic photonic surfaces. Nanomaterials, 2017, 7(5): 109. https://doi.org /10.3390/nano7050109
[142] D.M. Ju, Y. Zhang, R. Li, et al. Mechanism-independent manipulation of single-wall carbon nanotubes with atomic force microscopy tip. Nanomaterials, 2020, 10(8): 1494. https://doi.org/10.3390/nano10081494
[143] G. Gonçalves, M. Vila, M.T. Portolés, et al. Nanographene oxide: A potential multifunctional platform for cancer therapy. Advanced Healthcare Materials, 2013, 2(8): 1072-1090. https://doi.org/10.1002/adhm. 201300023
[144] A. Sawdon, E. Weydemeyer, C.A. Peng. Tumor photothermolysis: Using carbon nanomaterials for cancer therapy. European Journal of Nanomedicine, 2013, 5(3): 131-140. https://doi.org/10.1515/ejnm-20130006
[145] A.O. Choi, S.J. Cho, J. Desbarats, et al. Quantum dotinduced cell death involves Fas upregulation and lipid peroxidation in human neuroblastoma cells. Journal of Nanobiotechnology, 2007, 5: 1. https://doi.org/10.1186/ 1477-3155-5-1
[146] W.J. Chen, Y.T. Xu, D.C. Yang, et al. Preparation of liposomes coated superparamagnetic iron oxide nanoparticles for targeting and imaging brain glioma. Nano Biomedicine and Engineering, 2022, 14(1): 71-80. https://doi.org/10.5101/nbe.v14i1.p71-80
[147] G.K. Ibadi, A.A. Taha, S.M.H. Al-Jawad. Anticancer activity of copper-chitosan nanocomposite conjugated with folic acid. Nano Biomedicine and Engineering, 2022, 14(4): 317-328. https://doi.org/10.5101/nbe.v14i4. p317-328
[148] A.M. Tomşa, A.L. Răchişan, A.A. Aldea, et al. Perspectives of gold nanoparticles and their applications in pancreatic cancer (Review). Experimental and Therapeutic Medicine, 2021, 21(3): 258. https://doi.org/ 10.3892/etm.2021.9689
[149] G. Barsisa, A. Belay, G. Beyene, et al. Synthesis europium
[150] Y.H. Zheng, Y. Wang, M.Y. Xia, et al. The combination of nanotechnology and traditional Chinese medicine (TCM) inspires the modernization of TCM: Review on nanotechnology in TCM-based drug delivery systems. Drug Delivery and Translational Research, 2022, 12(6): 1306-1325. https://doi.org/10.1007/s13346-021-01029-x
[151] N.C. Seeman, H.F. Sleiman. DNA nanotechnology. Nature Reviews Materials, 2017, 3: 17068. https://doi. org/10.1038/natrevmats. 2017.68
[152] P.X. Guo, F. Haque, B. Hallahan, et al. Uniqueness, advantages, challenges, solutions, and perspectives in therapeutics applying RNA nanotechnology. Nucleic Acid Therapeutics, 2012, 22(4): 226-245. https://doi.org /10.1089/nat.2012.0350
© The author(s) 2024. This is an open-access article distributed under the terms of the Creative Commons Attribution 4.0 International License (CC BY) (http://creativecommons.org/ licenses/by/4.0/), which permits unrestricted use, distribution, and reproduction in any medium, provided the original author and source are credited.
DOI: https://doi.org/10.26599/nbe.2024.9290060
Publication Date: 2024-02-05
Advances and Prospects in Integrated Nano-oncology
Citation: J.L. Jiang, X.Y. Cui, Y.X. Huang, et al. Advances and prospects in integrated nano-oncology. Nano Biomedicine and Engineering, 2024, 16(2): 152-187.
http://doi.org/10.26599/NBE.2024.9290060
Abstract
In recent years, the deep integration of basic research and clinical translational research of nanotechnology and oncology has led to the emergence of a new branch, namely integrated nanooncology. This is an emerging and important interdisciplinary field, which plays an irreplaceable role in the diagnosis, treatment, early warning, monitoring and prevention of tumors, and has become a new interdisciplinary frontier. Here main advances of integrated nano-oncology was reviewed, mainly included controlled preparation of nanomaterials, ultra-sensitive detection of tumor biomarkers, multifunctional nanoimaging probes and integrated diagnosis and treatment technology, innovative nano drugs and nano drug delivery system, DNA nanotechnology, RNA nanotechnology, nano selfassembly technology, nanosensors, intelligent nanorobots, nanotherapeutic machines. The terms, concepts, trends and challenges are also discussed with the aim of promoting the application of nanotechnology in integrated oncology and solving the scientific and key technical problems in basic and clinical translational research of cancer.
Introduction
corrections and adjustments according to the social, environmental and psychological realities to make it a new medical system that is more in line with and more suitable for human health and disease treatment [1]. In the last decade or so, with the rapid development of nanotechnology and the deep integration of basic research and clinical translational research in nanotechnology and oncology, a new
branch, namely integrated nano-oncology, has emerged. Integrated nano-oncology, formed by combining nanotechnology and oncology, is an emerging and important intersectional field in nanobiotechnology, which plays an irreplaceable role in tumor diagnosis, treatment, prediction, monitoring and tumor prevention, and has become a new interdisciplinary frontier and one of the core areas of priority development of frontier science and technology in various countries at present. Integrated nano-oncology is a fully interdisciplinary discipline, which starts from the whole person and makes full use of the unique advantages of nanotechnology to solve the series of challenges and key scientific problems faced in the process of clinical tumor prevention, early diagnosis and treatment, carry out basic and clinical translational research, and promote the clinical translation of research results; its research scope involves all aspects of oncology, including tumor early warning, early screening, The scope of its research covers all aspects of oncology, including tumor early warning, early screening, multifunctional nanoprobes and imaging diagnosis and treatment, nano-drug delivery system, nano-tumor treatment drugs, nano-effect-based physical therapy, nano-immunotherapy, nano-treatment robot, etc., which make revolutionary changes in tumor treatment and diagnosis [2].
the application of nanotechnology in integrated oncology and solving the scientific problems and key technical issues in basic and clinical translational research in oncology.
Advances in Integrated Nanooncology
Types of nanoparticles for tumor treatment
Magnetic nanoparticles
used nanoparticles, and MRI contrast agents based on magnetic nanoparticles have been approved by FDA and used in clinical applications for many years [3, 4].
Gold nanoparticles
Quantum dot nanoparticles
Carbon nanoparticles
Silicon nanoparticles
Liposomal nanoparticles
achieve the treatment of tumor cells in vivo by combining with some antitumor drugs on its surface. Liposome formulation is the most widely used dosage form [12, 13].
Albumin nanoparticles
Upconversion nanoparticles
Advances in tumor marker nano-detection technology
to the tumor. Tumor markers have been found for more than 100 years. Since the 1960s, they have been widely used in clinic and played an important role in the diagnosis and treatment of tumors. With the development of biotechnology, various new markers have been discovered with increasing specificity and sensitivity, including oncogenes, tumor suppressor genes and their products, tumor DNA, cytokines and their receptors, tumor miRNAs and tumor stem cells, etc. The combined diagnosis of tumor markers has also become a hot topic of interest. The combined diagnosis of multiple markers for different tumors has greatly improved the sensitivity of tumor detection.
nanoparticle-modified electrodes, microfluidic chip technology for exosome separation and marker detection, digital PCR chip detection technology, quantitative PCR detection technology based on nanocluster molecular beacons, combined chip technology with nanoparticle labelling, especially the series of detection technologies based on modeling combined with artificial intelligence algorithms, have significantly improved the sensitivity and accuracy of detection, and some of the technologies have entered clinical application. The main advances are as follows:
Controllable preparation of nano-plasma probes and SNP gene detection

Serial detection technology based on SERS chip
(b) SERS chip for nano-detection of exhaled gas markers
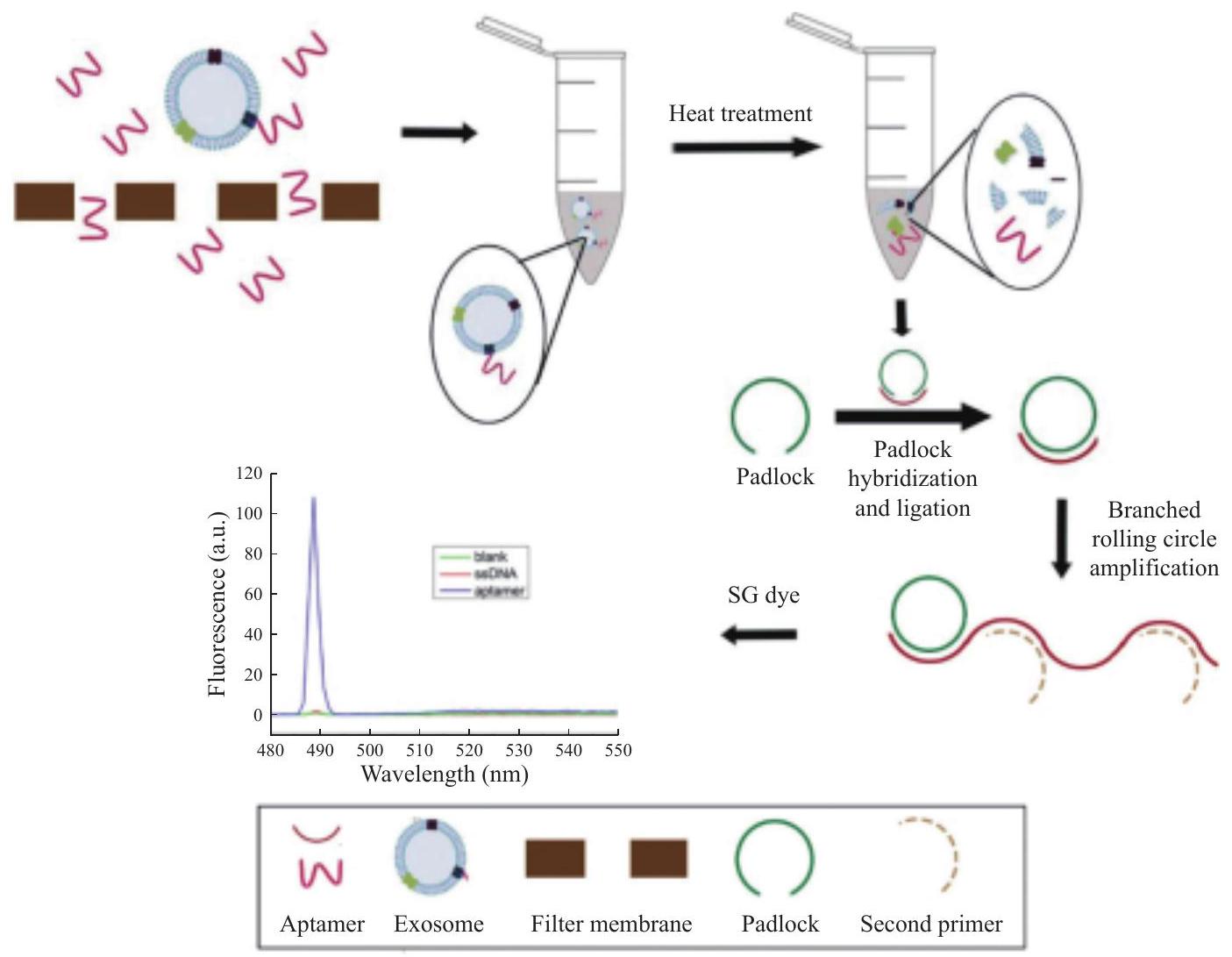
Quantitative detection method of exosomes based on branch rolling circle amplification
gastric cancer exosomes. An aptamer that specifically binds exosomes secreted by gastric cancer cells was screened, and a padlock probe of 63 bases in length was designed with the aptamer as the linking probe. The aptamer and gastric cancer exosomes were incubated and the unbound aptamer was removed by periplasm. The bound aptamer was eluted and treated at high temperature, and the separated aptamer was interacted with the padlock probe to form a closedloop template. In the subsequent amplification, a second primer with the same partial sequence as the loop template was added. After hybridization with the amplified product, the primer could trigger branched chain amplification and form a length gradient double stranded nucleic acid [22]. Finally, we realized the quantitative detection of gastric cancer exosomes by using the strong fluorescence of nucleic acid dye SYBR Green I combined with the double helix groove region of double stranded nucleic acid. The fluorescence signal of the product was positively correlated with the initial concentration of exosomes, and the sensitivity could reach 1 exosome/mL (Fig. 2) [23].
(a) MicroRNA detection technology based on
Molybdenum disulfide

(b) Construction of double block DNA AuNPs probe based on
Ag NC/DNA probes for in situ detection of microRNA biomarkers in tissue sections
tissues, which can be used for gastric cancer diagnosis [26].
specific to the gastric secretin receptor, a gastric cancer-specific biomarker. Once captured, the cells were attracted by the magnetic chip and transported to the upper layer of microchannels through a highbridge configuration. Meanwhile, white blood cells and red blood cells remained in the lower layer of microchannels, enabling efficient separation with a high survival rate. The separation efficiency reached
pylori typing detection was developed. H. pylori is a primary risk factor for gastric cancer, and establishing a typing diagnostic method for H. pylori is an important approach for early gastric cancer prevention [31]. Leveraging the principle of the multiplex chip, in collaboration with a partner company, we cloned and expressed CagA, Vac A, and urease of H. pylori, and prepared a chip with detection sites for CagA, Vac A, and urease. Gold nanoparticle clusters were utilized for labeling CagA, Vac A, and urease antibodies, and a fluorescencebased quantitative protein chip detection method for CagA, Vac A, and urease was established. A chip reader was developed, and cut-off values and detection standards were established. Enterprise standards were also established. The developed detection chip and reader obtained medical device Class 3 and Class 2 certificates, respectively.
Development of a detection system based on smartphones
Magnetic nano immunochromatographic detection chip combined with artificial intelligence algorithm
Development of a small liquid phase biochip detector and detection of multiple tumor indicators
Advances in integrated nanoprobes for tumor diagnosis and treatment
specific identification of key target molecules, composition of nanoparticles, and therapeutic functional drugs. In the past five years, with the rapid development of multifunctional nanoprobes technology, nanodiagnosis and therapy integration techniques have shifted towards practical clinical applications.
Diagnostic and therapeutic integrated nanoprobes based on magnetic nanoparticles
magnetic resonance imaging and magnetothermal therapy, resulting in enhanced therapeutic effects.
Diagnostic and therapeutic integrated nanoprobes based on quantum dots

subcutaneous gastric cancer with a diameter of 5 mm in nude mice, and realize targeted fluorescence imaging and nuclear magnetic resonance imaging of gastric cancer. Under the external magnetic field, the local treatment of gastric cancer is realized, which has the prospect of clinical transformation.
Diagnostic and therapeutic integrated nanoprobes based on nanocarbon dots
photoluminescence and electrochemiluminescence, with fluorescence being the most prominent feature. As a nanomaterial with the potential to play an important role in various fields, carbon dots exhibit excellent fluorescence properties, including broad and continuous excitation spectra, single-wavelength excitation, and multi-wavelength emission. They also possess high fluorescence stability and resistance to photobleaching. The fluorescence wavelength of carbon dots can be tuned, and some carbon dots exhibit upconversion fluorescence properties. Furthermore, carbon dots act as excellent electron donors and acceptors and exhibit light-induced electron transfer characteristics. Of particular importance is their excellent water solubility, scalability in production, low cost, absence of heavy metals, environmental friendliness, and safety in use.

can be used in biomedical applications. Li et al. successfully prepared gold nanorods modified with tree molecules by using tree molecules to replace CTAB molecules on the surface of gold nanorods, and then connected with RGD peptide to prepare a nanoprobe that can actively target tumor vessels in vivo and kill tumor cells and significantly inhibit tumor growth under near-infrared light irradiation [45]. Animal experiments showed that this probe can make part of the local tumor tissue disappear.
nanorods could target the blood vessels of gastric cancer, achieving both photoacoustic imaging and photothermal therapy of gastric cancer tissues. Additionally, they enabled highly sensitive detection of gastric cancer tissues using surface-enhanced Raman spectroscopy (SERS) and tumor boundary localization (Fig. 5).
studies revealed that gastric cancer stem cells express molecular markers such as CD24, CD44, CD133, CD166, and EpCAM on their surfaces. Successful separation of gastric cancer stem cells was achieved using CD44 antibodies, and a gastric cancer mouse model was developed using the sorted gastric cancer stem cells. To achieve targeted imaging and synchronous therapy of gastric cancer stem cells in vivo, gold nanostars were designed and synthesized, followed by surface modification with PEG and conjugation with CD44-V6 antibodies [49]. The results demonstrated that CD44-V6 antibodyconjugated gold nanostars could actively target gastric cancer stem cells in vitro and be engulfed by these cells, exhibiting strong fluorescence signals. A gastric cancer stem cell mouse model was also established, and after intravenous injection of the prepared nanoprobes for 2 hours, the nanoprobes accumulated in the blood vessels of gastric cancer tissues. Clear photoacoustic imaging of gastric cancer blood vessels was obtained using a photoacoustic imaging device, and thermal imaging revealed a temperature of approximately

easy surface modification and functionalization, and maintained the favorable fluorescence properties of AuNCs. 3-(4,5-Dimethylthiazol-2-yl)-2,5diphenyltetrazolium bromide (MTT) assay results showed that AuNCs@
nanoplatform that carries drugs and possesses therapeutic functions.
Integrated nanoprobes for diagnosis and treatment based on upconversion nanoparticles
Integrated nanoprobes for diagnosis and treatment based on other inorganic nanoparticles
into hollow bismuth oxycarbonate nanotubes using solvothermal method. Compared to small-sized nanodots, hollow bismuth oxycarbonate nanotubes have a longer circulating time in the body and are more likely to leak into the blood vessels at the tumor site, subsequently achieving tumor enrichment. Interestingly, this hollow nanotube like assembly will slowly dissociate and assemble into nanoparticles in the slightly acidic environment of tumor tissue, which will then spread to the blood and be cleared by the kidneys, to some extent avoiding the potential toxicity issues caused by long-term accumulation of nanomaterials in the body. Based on this hollow bismuth oxycarbonate nanotube, they continued to develop a nanosystem for synergistic tumor radiotherapy and chemotherapy. On the one hand, under X-ray irradiation, bismuth oxycarbonate nanotubes enriched in the tumor site can achieve tumor specific CT imaging and radiation sensitization. On the other hand, they utilized the characteristic of large specific surface area of hollow nanotubes to load doxorubicin after hydrochloric acid removal inside the pipeline. Both cellular and animal experiments have confirmed that compared to a single radiotherapy or chemotherapy method, the combination of radiotherapy and chemotherapy can significantly increase the levels of reactive oxygen species (ROS) in tumor cells and worsen DNA damage, ultimately inducing tumor cell apoptosis. It can be seen that this intelligent responsive tubular assembly of bismuth oxycarbonate provides a new approach for constructing efficient and non-toxic nano diagnostic and therapeutic formulations.
Nanoparticle-labeled series of stem cell probes
other, and a new field has gradually formed, that is, stem cell nanotechnology. Applying nanotechnology to the research and development of stem cells can solve a series of problems in stem cell research and promote stem cell technology. There are two types of stem cells, embryonic stem cells and adult stem cells. Embryonic stem cells refer to a type of cells that originate from embryos, are in an undifferentiated state, can self-differentiate and self-renew for a long time, and have the potential to differentiate into various tissue cells under certain conditions.
studied the mechanism of bone marrow stromal stem cells targeting gastric cancer in vivo, and the CXCL12CXCR4 and CCL19-CCR7 axis played an important role.

Integrated nanoprobes for diagnosis and treatment targeting tumor microenvironmental responses

Progress in research on anti-tumor nanomedicines
| Drug | Indication | Listed countries/ regions | Time to market |
| AmBisome | Systemic fungal infections | USA | 1997 |
| Daunoxome | Boehl sarcoma | USA | 1996 |
| DepoCyt | Meninges of malignant | USA | 1999 |
| DepoDur | Chronic pain | USA | 2004 |
| Doxil | AIDS,multiple myeloma, and ovarian cancer | USA | 1995 |
| Inflexal | Flu | Switzerland | 1997 |
| Marqibo | Acute lymphoblastic leukemia | USA | 2012 |
| Mepact | Osteosarcoma | Europe | 2009 |
| Myocet | Metastatic breast cancer | Europe | 2000 |
| Visudyne | Macular degeneration | USA | 2000 |
| Abelcet | Systemic fungal infections | USA | 1995 |
| Amphotec | Systemic fungal infections | USA | 1996 |
| Adagen | Adenosine deaminase deficiency | USA | 1990 |
| Cimzia | Crohn’s disease and rheumatoid arthritis | USA | 2008 |
| Neulasta | Febrile neutropenia and hematological malignancies | USA | 2002 |
| Oncaspar | Acute lymphoblastic leukaemia | USA | 1994 |
| Pegasy | Hepatitis B and C | USA | 2002 |
| Peglntron | Hepatitis C | USA | 2001 |
| Somavert | Megalakria | USA | 2003 |
| Macugen | Macular degeneration | USA | 2004 |
| Mircera | Chronic renal failure | USA | 2007 |
| Emend | Antemetic | USA | 2003 |
| Megace ES | Anorexia and cachexia | USA | 2005 |
| Rapamune | Immunosuppressants | USA | 2002 |
| Tricor | Hypercholesterolemia and hypertriglyceridemia | USA | 2004 |
| Triglide | Boehl sarcoma | USA | 2004 |
| Copaxone | Multiple sclerosis | USA | 2014 |
| Eligard | Prostate cancer | USA | 2002 |
| Genexol | Metastatic breast cancer and pancreatic cancer | USA | 2001 |
| Opaxio | Acute lymphoblastic leukemia | USA | 2012 |
| Renagle | Osteosarcoma | USA | 2000 |
| Zinostatinstimalamer | Metastatic breast cancer and pancreatic cancer | Japan | 1994 |
| Kadcyla | Metastatic breast cancer | USA | 2013 |
| Ontak | T-Cell Lymphoma | USA | 2005 |
| Fendex | Liver and splenic lesions MRI | USA | 1996/2008 |
| Feraheme | Iron deficiency anemia (IDA) in chronic kidney disease | USA | 2009 |
| NanoTherm | Glioblastoma, prostate, and pancreatic cancer. | Europe | 2013 |
| Gendicine | Tumour | China | 2003 |
| Rexin-G | Solid tumour | The Philippines | 2007 |
| Diprivan | Calm hypnosis and anesthesia | USA | 1989 |
| Estrasorb | Hormone replacement therapy for menopause | USA | 2003 |
| Fungizone | Systemic fungal infections | USA | 1966 |
| Abraxane | Metastatic breast cancer and | USA | 2005 |
Tumor-targeted delivery of nanomedicines
the lipid-binding structural domain of apolipoproteins to expose the receptor-binding structural domain of apolipoproteins for brain-targeted delivery. The binding of albumin to the receptor gp60 on the surface of vascular endothelial cells mediates transmembrane drug transport and increases drug accumulation in tumor cells [68]. Yang et al. attached the photosensitizers dihydro porphyrin e6 (Ce6) and oxaliplatin to human serum albumin and coupled them to a
advance of cell membrane-coated nanoparticles (CNPs) for biomedical applications such as drug delivery, phototherapy and immunotherapy. CNPs own obvious advantages such as improved biocompatibility, immune evasion and tumour targeting. CNPs may precisely deliver loaded drug for tumor therapy, owns clinical translational values [72].
Nanodrugs regulate tumor microenvironment
assembled by fluorinated chitosan with sonosensitizer meso-tetra(4-carboxyphenyl)porphine (TCPP)conjugated catalase (Fig. 9) to alleviate hypoxia in tumor tissue microenvironment by catalyzing tumor endogenous


Tumor gene therapy based on nanodrugs
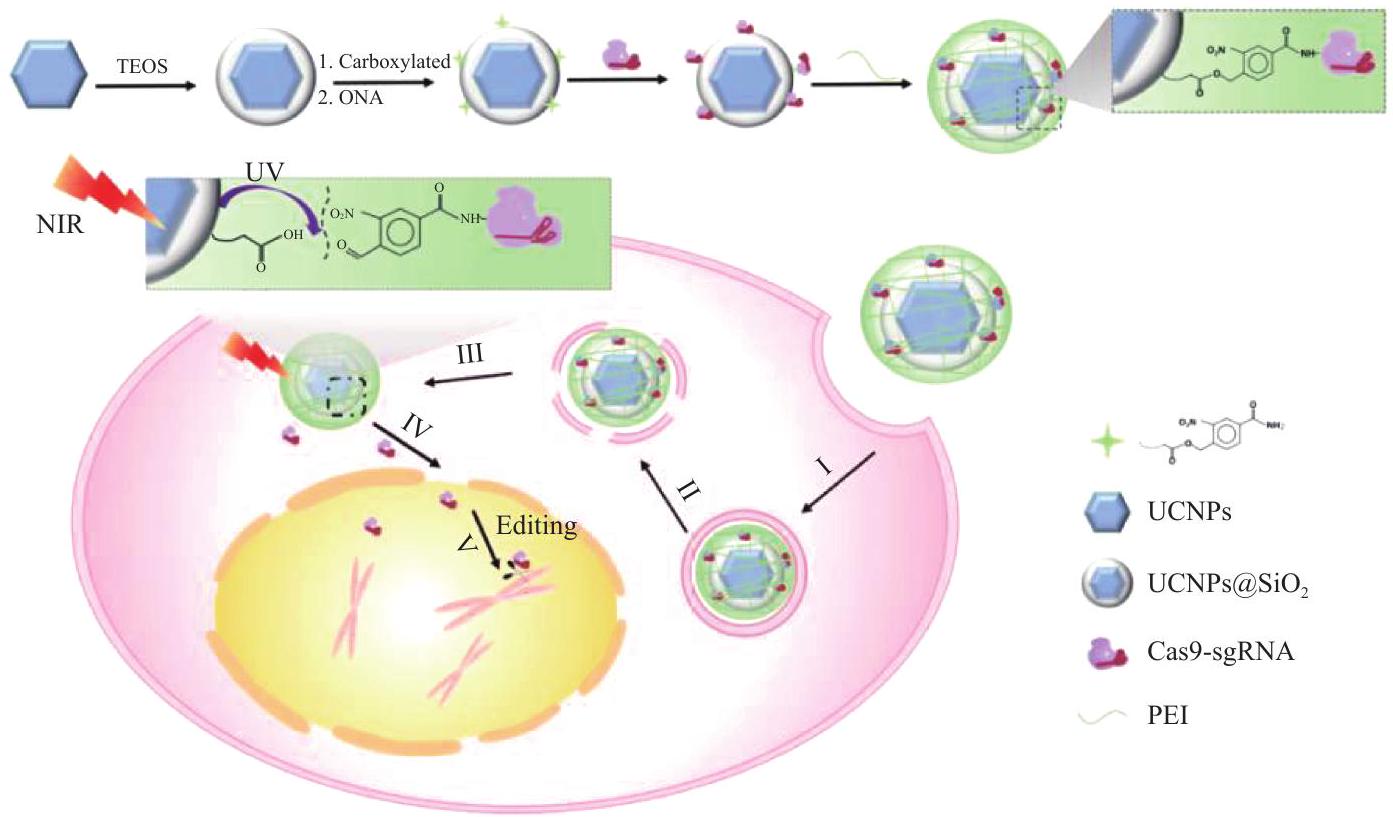
approved for marketing in the world which based on the recombination between adenovirus and tumor suppressor gene (human p53 gene) [79]. The emergence of CRISPR/Cas9 gene editing tools has brought new opportunities for the treatment of tumor gene drugs. Since the first clinical trial of CRISPR/Cas9 for tumor treatment was conducted by Sichuan West China Hospital in 2016 [80], multiple tumor gene therapies based on CRISPR/Cas9 technology have entered clinical trials. The commonly used gene drug carriers are viral and non viral vectors, viral vectors are mainly adenoviral vectors with high transfection efficiency, but there are potential risks of immunogenicity, cytotoxicity and genetic recombination, non viral vectors avoid potential risks of viral vectors while delivering gene drugs.

Nanodrug-mediated tumor immunotherapy

enzymes, induce immunogenic cell death in tumor cells, further promote dendritic cell maturation in combination with CD47 blocker, promote antigen presentation by DC cells, and effectively inhibit the growth of primary and secondary tumors, inhibits tumor metastasis and prevents tumor relapse [88].

Nanodrug-mediated tumor radiation therapy

biology, genomics and nano-science, the research and development of new nano-drugs have greatly enriched the means of tumor treatment, with advantages in targeted delivery of drugs, regulation of tumor microenvironment, delivery of gene drugs, enhancing tumor immunotherapy and other aspects, providing a new opportunity for tumor treatment.
Summary and Outlook
the USA launched the “Cancer Nanotechnology Program” in 2005, aiming to integrate nanotechnology, cancer research, and molecular biomedicine, and achieve its goal of eliminating cancer deaths and pain by 2015 through a series of research programs [97, 98]. The key research content is to utilize nanotechnology, mainly including nanoparticle material technology and nanosensor technology, to form some new early diagnosis, warning and treatment technologies and nanodevices for malignant tumors. Although the “Cancer Nanotechnology Plan” of the United States is far from reaching the original goal, this technology has cultivated a large number of talents engaged in nanotechnology research and development, promoted the development of Nanomedicine technology, and laid the foundation for the USA to occupy a dominant position in the field of nanotechnology precision medicine [96, 99].
committed to enhancing the international status of nanotechnology. The research focuses proposed by Germany include drug delivery systems, biomolecular manipulation, and detection technologies, nanoelectronics with biological entities, and research on biological entity interfaces and detection technologies. At present, the research focuses on the nano-targeted drug delivery system that can destroy tumor cells, the nano biosensor used to diagnose the formation of antibodies in human blood after infection, and the nanodevices used to treat cancer and cardiovascular diseases.
nanoparticles have higher sensitivity in detecting disease markers, which is greatly helpful for the early diagnosis of many diseases such as tumors; In the treatment of diseases, it has been found that drugs using nanoparticles as carriers can reduce side effects and increase lesion targeting [109]. At present, doxorubicin liposome nanomedicine and paclitaxel albumin nanomedicine have entered the market, and dozens of nanomedicines are currently undergoing clinical trials, which are expected to enter the market for sale soon. From the current progress, it is expected that in the next
capable of long-term self-differentiation and selfrenewal, and have the potential to differentiate and form various tissue cells under certain conditions. By labeling mouse embryonic stem cells with the nearinfrared fluorescent dye DiR and using the small animal imaging system afterward, it can be observed that DiR-labeled embryonic stem cells can actively target and recognize gastric cancer cells in vivo, realizing near-infrared fluorescence imaging of gastric cancer cells in vivo. And it also demonstrates that the CXCR4-CXCL12 axis plays a major role in the process of embryonic stem cells targeting gastric cancer in vivo [115, 116]. The effect of single-walled carbon nanotubes on the proliferation and differentiation of embryonic stem cells was also investigated. The dendrimer-modified carbon nanotubes could enter embryonic stem cells and stimulate the growth and development of embryonic stem cells [117]. Cui et al. transfected four genes (Oct4, Sox2, LIN28, and Nanog) into 293T cells by using dendrimer-modified magnetic nanoparticles, and successfully prepared human induced pluripotent stem (iPS) cells in a conditioned medium, and also collected the medium of iPS cells cultured for 72 hours, and co-cultured with gastric cancer MGC803 cells, liver cancer cell lines, and breast cancer cell lines, etc. The results showed that the growth of gastric cancer cells and others was inhibited, indicating that the product secreted by iPS cells has the function of inhibiting the growth of gastric cancer and other cells61. They also used fluorescent magnetic nanoparticles to label human iPS cells and injected them into tumor-bearing nude mice through the tail vein. The results demonstrated that human iPS cells gradually gathered around gastric cancer cells in vivo, and that targeted fluorescence imaging and nuclear magnetic resonance imaging of gastric cancer cells were realized by utilizing the properties of fluorescent magnetic nanoparticles. Under the effect of an in vitro magnetic field, using a thermal imager, it was also detected that the local temperature of the tumor reached above
tumor-bearing mouse model, iPS cells loaded with CXCR4-modified gold nanorods were injected through the tail vein, and it was observed that the iPS cells were able to target the tumor site, and the photothermal treatment of the tumor could be achieved based on the light-absorbing and heatproducing properties of the gold nanorods [120]. Cancer stem cells are an important cause of tumor metastasis and recurrence. They prepared a CD44 antibody-coupled gold nanostar probe, which successfully achieved targeted photoacoustic imaging, CT imaging, and photothermal therapy for gastric cancer stem cells, significantly inhibiting the growth of cancer stem cells and having clinical translational value [49]. The current series of progress shows that stem cell nanotechnology has broad application prospects in stem cell research and development, and it is a critical field of precision medicine.
the assembly of existing molecules in nature, but also achieve deeper and purposeful control of molecular structures. One of the most important difficulties of nanotechnology is the inability to actually see how the research object behaves. For example, viruses are smaller than the wavelength of light, and their biological structures cannot be seen with standard light microscopy, and are also difficult to observe with other imaging techniques. A multidisciplinary collaborative research team established at the University of California, Los Angeles, used cryoelectron microscopy to reveal the precise atomically resolved three-dimensional structure of adenoviruses and the interactions of their protein networks, and that the viruses can be modified to enable them to deliver drugs to diseased sites, this discovery provides critical information for researchers around the world attempting to modify adenoviruses for use in vaccines and cancer gene therapy [127].
Challenges of integrating nano-oncology
methodologies hinders our ability to quantitatively investigate the structural, mechanical, and deformation properties of nanomaterials and devices, among other subjects. Consequently, the establishment of robust theoretical models presents substantial challenges in this field.
The perspectives of integrating nanooncology
nanotechnology [152] enables the creation of nanotechnology with chemical drugs addresses challenges related to solubility, while the convergence of nanotechnology and sequencing technology fosters the emergence of a new generation of nano-sequencing technologies. This, in turn, fuels the development of core nano-sequencing instruments, frontier technologies, and self-reliant research and innovation capabilities, ultimately strengthening independent core competitiveness and alleviating dependence on foreign imports.
CRediT Author Statement
Acknowledgements
Conflict of Interests
References
[2] R.X. Zhang, H.L. Wong, H.Y. Xue, et al. Nanomedicine of synergistic drug combinations for cancer therapy-Strategies and perspectives. Journal of Controlled Release, 2016, 240: 489-503. https://doi.org/ 10.1016/j.jconrel.2016.06.012
[3] J. Kudr, Y. Haddad, L. Richtera, et al. Magnetic nanoparticles: From design and synthesis to real world applications. Nanomaterials, 2017, 7(9): 243. https://doi. org/10.3390/nano7090243
[4] T. Kang, F.Y. Li, S. Baik, et al. Surface design of magnetic nanoparticles for stimuli-responsive cancer imaging and therapy. Biomaterials, 2017, 136: 98-114. https://doi.org/10.1016/j.biomaterials.2017.05.013
[5] K. Sztandera, M. Gorzkiewicz, B. Klajnert-Maculewicz. Gold nanoparticles in cancer treatment. Molecular Pharmaceutics, 2019, 16(1): 1-23. https://doi.org/10. 1021/acs.molpharmaceut.8b00810
[6] N. Elahi, M. Kamali, M.H. Baghersad. Recent biomedical applications of gold nanoparticles: A review. Talanta, 2018, 184: 537-556. https://doi.org/10.1016/j. talanta.2018.02.088
[7] Y. Volkov. Quantum dots in nanomedicine: Recent trends, advances and unresolved issues. Biochemical and Biophysical Research Communications, 2015, 468(3): 419-427. https://doi.org/10.1016/j.bbrc.2015.07.039
[8] K.J. McHugh, L.H. Jing, A.M. Behrens, et al. Biocompatible semiconductor quantum dots as cancer imaging agents. Advanced Materials, 2018, 30(18): e1706356. https://doi.org/10.1002/adma. 201706356
[9] D. Maiti, X.M. Tong, X.Z. Mou, et al. Carbon-based nanomaterials for biomedical applications: A recent study. Frontiers in Pharmacology, 2018, 9: 1401. https:// doi.org/10.3389/fphar.2018.01401
[10] F. Farjadian, A. Roointan, S. Mohammadi-Samani, et al. Mesoporous silica nanoparticles: Synthesis, pharmaceutical applications, biodistribution, and biosafety assessment. Chemical Engineering Journal, 2019, 359: 684-705. https://doi.org/10.1016/j.cej.2018. 11.156
[11] M. Manzano, M. Vallet-Regí. Mesoporous silica nanoparticles for drug delivery. Advanced Functional Materials, 2020, 30(2): 1902634. https://doi.org/10.1002 /adfm. 201902634
[12] A. Gao, X.L. Hu, M. Saeed, et al. Overview of recent advances in liposomal nanoparticle-based cancer immunotherapy. Acta Pharmacologica Sinica, 2019, 40(9): 1129-1137. https://doi.org/10.1038/s41401-019-0281-1
[13] Y. Panahi, M. Farshbaf, M. Mohammadhosseini, et al. Recent advances on liposomal nanoparticles: Synthesis, characterization and biomedical applications. Artificial Cells, Nanomedicine, and Biotechnology, 2017, 45(4): 788-799. https://doi.org/10.1080/21691401.2017. 1282496
[14] Y.Z. Shen, W.T. Li. HA/HSA co-modified erlotinibalbumin nanoparticles for lung cancer treatment. Drug Design, Development and Therapy, 2018, 12: 2285-2292. https://doi.org/10.2147/DDDT.S169734
[15] R. Solanki, H. Rostamabadi, S. Patel, et al. Anticancer
nano-delivery systems based on bovine serum albumin nanoparticles: A critical review. International Journal of Biological Macromolecules, 2021, 193: 528-540. https:// doi.org/10.1016/j.ijbiomac.2021.10.040
[16] S.H. Wen, J.J. Zhou, K.Z. Zheng, et al. Advances in highly doped upconversion nanoparticles. Nature Communications, 2018, 9: 2415. https://doi.org/10.1038/ s41467-018-04813-5
[17] S. Wilhelm. Perspectives for upconverting nanoparticles. ACS Nano, 2017, 11(11): 10644-10653. https:// doi.org/10.1021/acsnano.7b07120
[18] J. Chao, H.L. Zhang, Y.K. Xing, et al. Programming DNA origami assembly for shape-resolved nanomechanical imaging labels. Nature Protocols, 2018, 13(7): 1569-1585. https://doi.org/10.1038/s41596-018-0004-y
[19] Y.S. Chen, S.L. Cheng, A.M. Zhang, et al. Salivary analysis based on surface enhanced Raman scattering sensors distinguishes early and advanced gastric cancer patients from healthy persons. Journal of Biomedical Nanotechnology, 2018, 14(10): 1773-1784. https://doi. org/10.1166/jbn.2018.2621
[20] M.A. Aslam, C.L. Xue, K. Wang, et al. SVM based classification and prediction system for gastric cancer using dominant features of saliva. Nano Biomedicine and Engineering, 2019, 12(1): 1-13. https://doi.org/10. 5101/nbe.v12i1.p1-13
[21] D.P. Yang, S.H. Chen, P. Huang, et al. Bacteriatemplate synthesized silver microspheres with hollow and porous structures as excellent SERS substrate. Green Chemistry, 2010, 12(11): 2038-2042. https://doi. org/10.1039/C0GC00431F
[22] X.C. Yu, L. He, M. Pentok, et al. An aptamer-based new method for competitive fluorescence detection of exosomes. Nanoscale, 2019, 11(33): 15589-15595. https:// doi.org/10.1039/C9NR04050A
[23] R. Huang, L. He, S. Li, et al. A simple fluorescence aptasensor for gastric cancer exosome detection based on branched rolling circle amplification. Nanoscale, 2020, 12(4): 2445-2451. https://doi.org/10.1039/ C9NR08747H
[24] D. Zhu, W. Liu, W.F. Cao, et al. Multiple amplified electrochemical detection of microRNA-21 using hierarchical flower-like gold nanostructures combined with gold-enriched hybridization chain reaction. Electroanalysis, 2018, 30(7): 1349-1356. https://doi.org /10.1002/elan. 201700696
[25] Y. Zhang, Z.H. Shuai, H. Zhou, et al. Single-molecule analysis of microRNA and logic operations using a smart plasmonic nanobiosensor. Journal of the American Chemical Society, 2018, 140(11): 3988-3993. https://doi.org/10.1021/jacs.7b12772
[26] J.P. Zhang, Y.L. Liu, X. Zhi, et al. DNA-templated silver nanoclusters locate microRNAs in the nuclei of gastric cancer cells. Nanoscale, 2018, 10(23): 11079-11090. https://doi.org/10.1039/C8NR02634C
[27] Y.Y. Tian, L. Zhang, L.H. Wang. DNA-functionalized plasmonic nanomaterials for optical biosensing. Biotechnology Journal, 2020, 15(1): e1800741. https:// doi.org/10.1002/biot. 201800741
[28] S.J. Lin, X. Zhi, D. Chen, et al. A flyover style microfluidic chip for highly purified magnetic cell separation. Biosensors and Bioelectronics, 2019, 129: 175-181. https://doi.org/10.1016/j.bios.2018.12.058
[29] H. Tang, J.Q. Niu, X.N. Pan, et al. Topology optimization based deterministic lateral displacement array design for cell separation. Journal of Chromatography A, 2022, 1679: 463384. https://doi.org/10.1016/j.chroma. 2022.463384
[30] X. Zhi, M. Deng, H. Yang, et al. A novel HBV genotypes detecting system combined with microfluidic chip, loop-mediated isothermal amplification and GMR sensors. Biosensors and Bioelectronics, 2014, 54: 372-377. https://doi.org/10.1016/j.bios.2013.11.025
[31] Y. Zheng, K. Wang, J.J. Zhang, et al. Simultaneous Quantitative Detection of Helicobacter Pylori Based on a Rapid and Sensitive Testing Platform using Quantum Dots-Labeled Immunochromatiographic Test Strips. Nanoscale Research Letters, 2016, 11(1): 62. https://doi. org/10.1186/s11671-016-1254-7
[32] S. Gao, L. Kang, M. Deng, et al. A giant magnetoimpedance-based microfluidic system for multiplex immunological assay. Nano Biomedicine and Engineering, 2016, 8(4): 240-245. https://doi.org/10. 5101/nbe.v8i4.p240-245
[33] K. Wang, J.C. Yang, H. Xu, et al. Smartphone-imaged multilayered paper-based analytical device for colorimetric analysis of carcinoembryonic antigen. Analytical and Bioanalytical Chemistry, 2020, 412(11): 2517-2528. https:// doi.org/10.1007/s00216-020-02475-1
[34] K. Wang, D.X. Cui. The application of immunochromatographic analysis in early detection of gastric cancer. In: Gastric Cancer Prewarning and Early Diagnosis System. Dordrecht: Springer, 2017: 129-156. https://doi.org/10.1007/978-94-024-0951-2_8
[35] W.J. Wu, X.Y. Liu, M.F. Shen, et al. Multicolor quantum dot nanobeads based fluorescence-linked immunosorbent assay for highly sensitive multiplexed detection. Sensors and Actuators B: Chemical, 2021, 338: 129827. https://doi.org/10.1016/j.snb.2021.129827
[36] J.A. Harrell, R. Kopelman. Biocompatible probes measure intracellular activity. Biophotonics International, 2000, 7: 22-24.
[37] R. Weissleder. Molecular imaging: Exploring the next frontier. Radiology, 1999, 212(3): 609-614. https://doi. org/10.1148/radiology.212.3.r99se18609
[38] C. Wang, C.C. Bao, S.J. Liang, et al. HAI-178 antibodyconjugated fluorescent magnetic nanoparticles for targeted imaging and simultaneous therapy of gastric cancer. Nanoscale Research Letters, 2014, 9(1): 274. https:// doi.org/10.1186/1556-276X-9-274
[39] T. Yin, H.G. Wu, Q. Zhang, et al. In vivo targeted therapy of gastric tumors via the mechanical rotation of a flower-like
[40] B.F. Pan, D.X. Cui, Y. Sheng, et al. Dendrimer-modified magnetic nanoparticles enhance efficiency of gene delivery system. Cancer Research, 2007, 67(17): 8156-8163. https://doi.org/10.1158/0008-5472.CAN-064762
[41] Y.F. Kong, J. Chen, F. Gao, et al. A multifunctional ribonuclease-A-conjugated CdTe quantum dot cluster nanosystem for synchronous cancer imaging and therapy. Small, 2010, 6(21): 2367-2373. https://doi.org/ 10.1002/smll. 201001050
[42] J. Ruan, H. Song, Q.R. Qian, et al. HER2 monoclonal antibody conjugated RNase-A-associated CdTe quantum dots for targeted imaging and therapy of gastric cancer. Biomaterials, 2012, 33(29): 7093-7102. https://doi.org/ 10.1016/j.biomaterials.2012.06.053
[43] C. Li, Y. Ji, C. Wang, et al. BRCAA1 antibody- and Her2 antibody-conjugated amphiphilic polymer engineered
[44] P. Huang, J. Lin, X.S. Wang, et al. Light-triggered theranostics based on photosensitizer-conjugated carbon dots for simultaneous enhanced-fluorescence imaging and photodynamic therapy. Advanced Materials, 2012, 24(37): 5104-5110. https://doi.org/10.1002/adma. 201200650
[45] Z.M. Li, P. Huang, X.J. Zhang, et al. RGD-conjugated dendrimer-modified gold nanorods for in vivo tumor targeting and photothermal therapy. Molecular Pharmaceutics, 2010, 7(1): 94-104. https://doi.org/10. 1021/mp9001415
[46] P. Huang, L. Bao, C.L. Zhang, et al. Folic acid-
conjugated Silica-modified gold nanorods for X-ray/CT imaging-guided dual-mode radiation and photo-thermal therapy. Biomaterials, 2011, 32(36): 9796-9809. https:// doi.org/10.1016/j.biomaterials.2011.08.086
[47] S.H. Chen, C.C. Bao, C.L. Zhang, et al. EGFR antibody conjugated bimetallic Au@Ag nanorods for enhanced SERS-based tumor boundary identification, targeted photoacoustic imaging and photothermal therapy. Nano Biomedicine and Engineering, 2016, 8(4): 315-328. https:// doi.org/10.5101/nbe.v8i4.p315-328
[48] C.C. Bao, N. Beziere, P. del Pino, et al. Gold nanoprisms as optoacoustic signal nanoamplifiers for in vivo bioimaging of gastrointestinal cancers. Small, 2013, 9(1): 68-74. https://doi.org/10.1002/smll.201201779
[49] S.J. Liang, C. Li, C.L. Zhang, et al. CD44v6 monoclonal antibody-conjugated gold nanostars for targeted photoacoustic imaging and plasmonic photothermal therapy of gastric cancer stem-like cells. Theranostics, 2015, 5(9): 970-984. https://doi.org/10.7150/thno. 11632
[50] X. Zhi, Y.L. Liu, L.N. Lin, et al. Oral pH sensitive GNS@ab nanoprobes for targeted therapy of Helicobacter pylori without disturbance gut microbiome. Nanomedicine: Nanotechnology, Biology and Medicine, 2019, 20: 102019. https://doi.org/10.1016/j.nano.2019. 102019
[51] Z.J. Zhou, C.L. Zhang, Q.R. Qian, et al. Folic acidconjugated silica capped gold nanoclusters for targeted fluorescence/X-ray computed tomography imaging. Journal of Nanobiotechnology, 2013, 11: 17. https://doi. org/10.1186/1477-3155-11-17
[52] C.L. Zhang, Z.J. Zhou, X. Zhi, et al. Insights into the distinguishing stress-induced cytotoxicity of chiral gold nanoclusters and the relationship with GSTP1. Theranostics, 2015, 5(2): 134-149. https://doi.org/10. 7150/thno. 10363
[53] C. Zhou, G.Y. Hao, P. Thomas, et al. Near-infrared emitting radioactive gold nanoparticles with molecular pharmacokinetics. Angewandte Chemie International Edition, 2012, 51(40): 10118-10122. https://doi.org/10. 1002/anie. 201203031
[54] M. He, P. Huang, C.L. Zhang, et al. Phase- and sizecontrollable synthesis of hexagonal upconversion rareearth fluoride nanocrystals through an oleic acid/ionic liquid two-phase system. Chemistry, 2012, 18(19): 5954-5969. https://doi.org/10.1002/chem. 201102419
[55] J.B. Ma, P. Huang, M. He, et al. Folic acid-conjugated
[56] F. Chen, P. Huang, Y.J. Zhu, et al. The photoluminescence, drug delivery and imaging properties of multifunctional
[57] X. Hu, J.H. Sun, F.Y. Li, et al. Renal-clearable hollow bismuth subcarbonate nanotubes for tumor targeted computed tomography imaging and chemoradiotherapy. Nano Letters, 2018, 18(2): 1196-1204. https://doi.org/ 10.1021/acs.nanolett.7b04741
[58] C.Y. Wang, Y.P. Xiao, W.W. Zhu, et al. Photosensitizermodified
[59] Y. Ding, Q. Yan, J.W. Ruan, et al. Bone marrow mesenchymal stem cells and electroacupuncture downregulate the inhibitor molecules and promote the axonal regeneration in the transected spinal cord of rats. Cell Transplantation, 2011, 20(4): 475-491. https://doi. org/10.3727/096368910X528102
[60] J. Ruan, H. Song, C. Li, et al. DiR-labeled Embryonic Stem Cells for Targeted Imaging of in vivo Gastric
[61] J. Ruan, J. Shen, Z. Wang, et al. Efficient preparation and labeling of human induced pluripotent stem cells by nanotechnology. International Journal of Nanomedicine, 2011, 6: 425-435. https://doi.org/10.2147/IJN.S16498
[62] D.X. Cui, C.L. Zhang, B. Liu, et al. Regression of gastric cancer by systemic injection of RNA nanoparticles carrying both ligand and siRNA. Scientific Reports, 2015, 5: 10726. https://doi.org/10.1038/srep10726
[63] C.X. Yue, Y.M. Yang, C.L. Zhang, et al. ROSresponsive mitochondria-targeting blended nanoparticles: Chemo- and photodynamic synergistic therapy for lung cancer with on-demand drug release upon irradiation with a single light source. Theranostics, 2016, 6(13): 2352-2366. https://doi.org/10.7150/thno
[64] C.X. Yue, C.L. Zhang, G. Alfranca, et al. Near-Infrared Light Triggered ROS-activated Theranostic Platform based on Ce6-CPT-UCNPs for Simultaneous Fluorescence Imaging and Chemo-Photodynamic Combined Therapy. Theranostics, 2016, 6(4): 456-469. https://doi.org/10.7150/thno. 14101
[65] Y.L. Liu, Y.X. Pan, W. Cao, et al. A tumor microenvironment responsive biodegradable
[66] H. Song, R. He, K. Wang, et al. Anti-HIF-1
[67] J.L. Huang, G. Jiang, Q.X. Song, et al. Lipoproteinbiomimetic nanostructure enables efficient targeting delivery of siRNA to Ras-activated glioblastoma cells via macropinocytosis. Nature Communications, 2017, 8: 15144. https://doi.org/10.1038/ncomms15144
[68] Z. Zhang, J. Guan, Z.X. Jiang, et al. Brain-targeted drug delivery by manipulating protein corona functions. Nature Communications, 2019, 10: 3561. https://doi.org/ 10.1038/s41467-019-11593-z
[69] G.B. Yang, S.Z.F. Phua, W.Q. Lim, et al. A hypoxiaresponsive albumin-based nanosystem for deep tumor penetration and excellent therapeutic efficacy. Advanced Materials, 2019, 31(25): e1901513. https://doi.org/10. 1002/adma.201901513
[70] Z.L. Chai, D.N. Ran, L.W. Lu, et al. Ligand-modified cell membrane enables the targeted delivery of drug nanocrystals to glioma. ACS Nano, 2019, 13(5): 5591-5601. https://doi.org/10.1021/acsnano.9b00661
[71] Y. Zhang, K.M. Cai, C. Li, et al. Macrophage-membrane-coated nanoparticles for tumor-targeted chemotherapy. Nano Letters, 2018, 18(3): 1908-1915. https:// doi.org/10.1021/acs.nanolett.7b05263
[72] R.H. Fang,W.W. Gao, L.F. Zhang. Targeting drugs to tumours using cell membrane-coated nanoparticles. Nat Rev Clin Oncol, 2023, 20(1): 33-48. https://doi.org/10. 1038/s41571-022-00699-x
[73] G.Z. Li, S.P. Wang, D.S. Deng, et al. Fluorinated chitosan to enhance transmucosal delivery of sonosensitizer-conjugated catalase for sonodynamic bladder cancer treatment post-intravesical instillation. ACS Nano, 2020, 14(2): 1586-1599. https://doi.org/10. 1021/acsnano.9b06689
[74] J. Chen, H.L. Luo, Y. Liu, et al. Oxygen-self-produced nanoplatform for relieving hypoxia and breaking resistance to sonodynamic treatment of pancreatic cancer. ACS Nano, 2017, 11(12): 12849-12862. https:// doi.org/10.1021/acsnano.7b08225
[75] C. Feng, R.Z. Chen, W.W. Fang, et al. Synergistic effect of CD47 blockade in combination with cordycepin treatment against cancer. Frontiers in Pharmacology, 2023, 14: 1144330. https://doi.org/10.3389/fphar.2023.
[76] P.F. Zhao, W.M. Yin, A.H. Wu, et al. Dual-targeting to cancer cells and M2 macrophages via biomimetic delivery of mannosylated albumin nanoparticles for drugresistant cancer therapy. Advanced Functional Materials, 2020, 30(16): 1700403. https://doi.org/10. 1002/adfm. 201700403
[77] Y. Qian, S. Qiao, Y.F. Dai, et al. Molecular-targeted immunotherapeutic strategy for melanoma via dualtargeting nanoparticles delivering small interfering RNA to tumor-associated macrophages. ACS Nano, 2017, 11(9): 9536-9549. https://doi.org/10.1021/acsnano. 7b05465
[78] C.R. Shi, T. Liu, Z.D. Guo, et al. Reprogramming tumorassociated macrophages by nanoparticle-based reactive oxygen species photogeneration. Nano Letters, 2018, 18(11): 7330-7342. https://doi.org/10.1021/acs.nanolett. 8b03568
[79] W.W. Zhang, L.J. Li, D.G. Li, et al. The first approved gene therapy product for cancer ad-p53 (gendicine): 12 years in the clinic. Human Gene Therapy, 2018, 29(2): 160-179. https://doi.org/10.1089/hum.2017.218
[80] T.Z. Zhan, N. Rindtorff, J. Betge, et al. CRISPR/Cas9 for cancer research and therapy. Seminars in Cancer Biology, 2019, 55: 106-119. https://doi.org/10.1016/j. semcancer.2018.04.001
[81] J. Kim, A. Jozic, Y.X. Lin, et al. Engineering lipid nanoparticles for enhanced intracellular delivery of mRNA through inhalation. ACS Nano, 2022, 16(9): 14792-14806. https://doi.org/10.1021/acsnano.2c05647
[82] F.M. Pi, D.W. Binzel, T.J. Lee, et al. Nanoparticle orientation to control RNA loading and ligand display on extracellular vesicles for cancer regression. Nature Nanotechnology, 2018, 13(1): 82-89. https://doi.org/10. 1038/s41565-017-0012-z
[83] Y.C. Pan, J.J. Yang, X.W. Luan, et al. Near-infrared upconversion-activated CRISPR-Cas9 system: A remotecontrolled gene editing platform. Science Advances, 2019, 5(4): eaav7199. https://doi.org/10.1126/sciadv. aav7199
[84] R.B. Patel, M.Z. Ye, P.M. Carlson, et al. Development of an in situ cancer vaccine via combinational radiation and bacterial-membrane-coated nanoparticles. Advanced Materials, 2019, 31(43): 1902626. https://doi.org/10. 1002/adma. 201902626
[85] B. Hou, D.G. Wang, J. Gao, H. Wang, Y.P. Li, H.J. Yu. Advances of microenvironment-activated nanosized drug delivery system for cancer immunotherapy. Acta Pharmaceutica Sinica, 2019, 12, 1802-1809. (in Chinese)
[86] R. Yang, J. Xu, L.G. Xu, et al. Cancer cell membranecoated adjuvant nanoparticles with mannose modification for effective anticancer vaccination.
[87] L.Q. Liu, Y. Wang, X. Guo, et al. A biomimetic polymer magnetic nanocarrier polarizing tumor-associated macrophages for potentiating immunotherapy. Small, 2020, 16(38): e2003543. https://doi.org/10.1002/smll. 202003543
[88] F.Y. Zhou, B. Feng, H.J. Yu, et al. Tumor microenvironment-activatable prodrug vesicles for nanoenabled cancer chemoimmunotherapy combining immunogenic cell death induction and CD47 blockade. Advanced Materials, 2019, 31(14): e1805888. https://doi. org/10.1002/adma. 201805888
[89] O. Rixe, J.C. Morris, V.K. Puduvalli, et al. First-inhuman, first-in-class phase 1a study of BXQ-350 for solid tumors and gliomas. Journal of Clinical Oncology, 2018, 36(15_suppl): 2517. https://doi.org/10.1200/jco. 2018.36.15_suppl. 2517
[90] W. Li, F.L. Wu, S.L. Zhao, et al. Correlation between PD-1/PD-L1 expression and polarization in tumorassociated macrophages: A key player in tumor
immunotherapy. Cytokine & Growth Factor Reviews, 2022, 67: 49-57. https://doi.org/10.1016/j.cytogfr.2022. 07.004
[91] W.Q. Wang, Y.L. Jin, X. Liu, et al. Endogenous stimuliactivatable nanomedicine for immune theranostics for cancer. Advanced Functional Materials, 2021, 31(26): 2100386. https://doi.org/10.1002/adfm. 202100386
[92] E. M. Cheng, N. W. Tsarovsky, P. M, Sondel, A. L. Rakhmilevich. Interleukin-12 as an in situ cancer vaccine component: a review. Cancer Immunol Immunother, 2022, 71(9): 2057-2065. https://doi.org/10. 1007/s00262-022-03144-1
[93] L. Zhou, P.C. Zhang, H. Wang, et al. Smart nanosized drug delivery systems inducing immunogenic cell death for combination with cancer immunotherapy. Accounts of Chemical Research, 2020, 53(9): 1761-1772. https:// doi.org/10.1021/acs.accounts.0c00254
[94] Y.Z. Chang, L.Z. He, Z.B. Li, et al. Designing core-shell gold and selenium nanocomposites for cancer radiochemotherapy. ACS Nano, 2017, 11(5): 4848-4858. https://doi.org/10.1021/acsnano.7b01346
[95] H.J. Song, H. Sun, N.N. He, et al. Gadolinium-based ultra-small nanoparticles augment radiotherapy-induced T-cell response to synergize with checkpoint blockade immunotherapy. Nanoscale, 2022, 14(31): 11429-11442. https://doi.org/10.1039/D2NR02620A
[96] A. Wicki, D. Witzigmann, V. Balasubramanian, et al. Nanomedicine in cancer therapy: Challenges, opportunities, and clinical applications. Journal of Controlled Release, 2015, 200: 138-157. https://doi.org/ 10.1016/j.jconrel.2014.12.030
[97] M.L. Etheridge, S.A. Campbell, A.G. Erdman, et al. The big picture on nanomedicine: The state of investigational and approved nanomedicine products. Nanomedicine: Nanotechnology, Biology and Medicine, 2013, 9(1): 1-14. https://doi.org/10.1016/j.nano.2012.05.013
[98] Chen, H. B., Gu, Z. J., An, H. W., Chen, C. Y., Chen, J., Cui, R., Chen, S. Q., Chen, W. H., Chen, X. S., Chen, X. Y. et al. Precise nanomedicine for intelligent therapy of cancer. Science China Chemistry, 2018, 61(12): 1503-1552. https://doi.org/10.1007/s11426-018-9397-5
[99] M. Germain, F. Caputo, S. Metcalfe, et al. Delivering the power of nanomedicine to patients today. Journal of Controlled Release, 2020, 326: 164-171. https://doi.org/ 10.1016/j.jconrel.2020.07.007
[100] E.K.H. Chow, D. Ho. Cancer nanomedicine: From drug delivery to imaging. Science Translational Medicine, 2013, 5(216): 216rv4 https://doi.org/10.1126/ scitranslmed. 3005872
[101] Gonzalez-Valdivieso, J., Girotti, A., Schneider, J., Arias, F. J. Advanced nanomedicine and cancer: Challenges and opportunities in clinical translation. International Journal of Pharmaceutics, 2021, 599: 120438. https:// doi.org/10.1016/j.ijpharm.2021.120438
[102] C. von Roemeling, W. Jiang, C.K. Chan, et al. Breaking down the barriers to precision cancer nanomedicine. Trends in Biotechnology, 2017, 35(2): 159-171. https:// doi.org/10.1016/j.tibtech.2016.07.006
[103] J.I. Hare, T. Lammers, M.B. Ashford, et al. Challenges and strategies in anti-cancer nanomedicine development: An industry perspective. Advanced Drug Delivery Reviews, 2017, 108: 25-38. https://doi.org/10.1016/j. addr.2016.04.025
[104] Z.M. Li, X.T. Shan, Z.D. Chen, et al. Applications of surface modification technologies in nanomedicine for deep tumor penetration. Advanced Science, 2020, 8(1): 2002589. https://doi.org/10.1002/advs. 202002589
[105] S. Kunjachan, J. Ehling, G. Storm, et al. Noninvasive imaging of nanomedicines and nanotheranostics: Principles, progress, and prospects. Chemical Reviews, 2015, 115(19): 10907-10937. https://doi.org/10.1021/ cr500314d
[106] Y.Z. Min, J.M. Caster, M.J. Eblan, et al. Clinical translation of nanomedicine. Chemical Reviews, 2015,
[107] B. Pelaz, C. Alexiou, R.A. Alvarez-Puebla, et al. Diverse applications of nanomedicine. ACS Nano, 2017, 11(3): 2313-2381. https://doi.org/10.1021/acsnano. 6b06040
[108] J.Y. Ren, N. Andrikopoulos, K. Velonia, et al. Chemical and biophysical signatures of the protein corona in nanomedicine. Journal of the American Chemical Society, 2022, 144(21): 9184-9205. https://doi.org/10. 1021/jacs.2c02277
[109] M. Sousa de Almeida, E. Susnik, B. Drasler, et al. Understanding nanoparticle endocytosis to improve targeting strategies in nanomedicine. Chemical Society Reviews, 2021, 50(9): 5397-5434. https://doi.org/10. 1039/D0CS01127D
[110] C.B. He, D.M. Liu, W.B. Lin. Nanomedicine applications of hybrid nanomaterials built from metalligand coordination bonds: Nanoscale metal-organic frameworks and nanoscale coordination polymers. Chemical Reviews, 2015, 115(19): 11079-11108. https:// doi.org/10.1021/acs.chemrev.5b00125
[111] J.H. Lee, J.H. Choi, S.TD. Chueng, et al. Nondestructive characterization of stem cell neurogenesis by a magnetoplasmonic nanomaterial-based exosomal miRNA detection. ACS Nano, 2019, 13(8): 8793-8803. https:// doi.org/10.1021/acsnano.9b01875
[112] S.Y. Xu, B. Liu, J.Y. Fan, et al. Engineered mesenchymal stem cell-derived exosomes with high CXCR4 levels for targeted siRNA gene therapy against cancer. Nanoscale, 2022, 14(11): 4098-4113. https://doi. org/10.1039/D1NR08170E
[113] J. Czyz, C. Wiese, A. Rolletschek, et al. Potential of embryonic and adult stem cells in vitro. Biological Chemistry, 2003, 384(10-11): 1391-1409. https://doi. org/10.1515/bc.2003.155
[114] P.C. Chagastelles, N.B. Nardi. Biology of stem cells: An overview. Kidney International Supplements, 2011, 1(3): 63-67. https://doi.org/10.1038/kisup.2011.15
[115] U.M. Domanska, R.C. Kruizinga, W.B. Nagengast, et al. A review on CXCR4/CXCL12 axis in oncology: No place to hide. European Journal of Cancer, 2013, 49(1): 219-230. https://doi.org/10.1016/j.ejca.2012.05.005
[116] Z.D. Wang, J. Sun, Y.Q. Feng, et al. Oncogenic roles and drug target of CXCR4/CXCL12 axis in lung cancer and cancer stem cell. Tumor Biology, 2016, 37(7): 8515-8528. https://doi.org/10.1007/s13277-016-5016-z
[117] D.X. Cui, H. Zhang, Z. Wang, et al. Effects of dendrimer-functionalized multi-walled carbon nanotubes on murine embryonic stem cells. ECS Transactions, 2008, 13(14): 111-116. https://doi.org/10.1149/1. 2998536
[118] J. Ruan, J.J. Ji, H. Song, et al. Fluorescent magnetic nanoparticle-labeled mesenchymal stem cells for targeted imaging and hyperthermia therapy of in vivo gastric cancer. Nanoscale Research Letters, 2012, 7: 309. https://doi.org/10.1186/1556-276X-7-309
[119] C. Li, J. Ruan, M. Yang, et al. Human induced pluripotent stem cells labeled with fluorescent magnetic nanoparticles for targeted imaging and hyperthermia therapy for gastric cancer. Cancer Biology & Medicine, 2015, 12(3): 163-174. https://doi.org/10.7497/j.issn. 2095-3941.2015.0040
[120] Y.L. Liu, M. Yang, J.P. Zhang, et al. Human induced pluripotent stem cells for tumor targeted delivery of gold nanorods and enhanced photothermal therapy.
[121] J. Conde, C.C. Bao, D.X. Cui, et al. Antibody-drug gold nanoantennas with Raman spectroscopic fingerprints for in vivo tumour theranostics. Journal of Controlled Release, 2014, 183: 87-93. https://doi.org/10.1016/j. jconrel.2014.03.045
[122] J. Conde, F.R. Tian, Y. Hernández, et al. In vivo tumor
targeting via nanoparticle-mediated therapeutic siRNA coupled to inflammatory response in lung cancer mouse models. Biomaterials, 2013, 34(31): 7744-7753. https:// doi.org/10.1016/j.biomaterials.2013.06.041
[123] C.C. Bao, J. Conde, F. Pan, et al. Gold nanoprisms as a hybrid in vivo cancer theranostic platform for in situ photoacoustic imaging, angiography, and localized hyperthermia. Nano Research, 2016, 9(4): 1043-1056. https:// doi.org/10.1007/s12274-016-0996-y
[124] J. Conde, J.T. Dias, V. Grazú, et al. Revisiting 30 years of biofunctionalization and surface chemistry of inorganic nanoparticles for nanomedicine. Frontiers in Chemistry, 2014, 2: 48. https://doi.org/10.3389/fchem. 2014.00048
[125] J. Conde, A. Ambrosone, Y. Hernandez, et al. 15 years on siRNA delivery: Beyond the State-of-the-Art on inorganic nanoparticles for RNAi therapeutics. Nano Today, 2015, 10(4): 421-450. https://doi.org/10.1016/j. nantod.2015.06.008
[126] A. Kumari, S.K. Yadav, S.C. Yadav. Biodegradable polymeric nanoparticles based drug delivery systems. Colloids and Surfaces B: Biointerfaces, 2010, 75(1): 1-18. https://doi.org/10.1016/j.colsurfb.2009.09.001
[127] M.M. Roberts, J.L. White, M.G. Grütter, et al. Threedimensional structure of the adenovirus major coat protein hexon. Science, 1986, 232(4754): 1148-1151. https:// doi.org/10.1126/science. 3704642
[128] Y.L. Liu, X. Zhi, M. Yang, et al. Tumor-triggered drug release from calcium carbonate-encapsulated gold nanostars for near-infrared photodynamic/photothermal combination antitumor therapy. Theranostics, 2017, 7(6): 1650-1662. https://doi.org/10.7150/thno. 17602
[129] A.A. Date, J. Hanes, L.M. Ensign, Nanoparticles for oral delivery: Design, evaluation and state-of-the-art. Journal of Controlled Release, 2016, 240: 504-526. https://doi. org/10.1016/j.jconrel.2016.06.016
[130] P. Singh, S.K. Sahoo. Nano-oncology: Clinical application for cancer therapy and future perspectives. In: Cancer Nanotheranostics. Cham: Springer, 2021: 49-95. https://doi.org/10.1007/978-3-030-76263-6_3
[131] Liu, Y., Solomon, M., Achilefu, S. Perspectives and potential applications of nanomedicine in breast and prostate cancer. Medicinal Research Reviews, 2013, 33(1): 3-32. https://doi.org/10.1002/med. 20233
[132] N. Abood, M. Jabir, H. Kadhim. TNF-
[133] X.X. Han, M.J. Mitchell, G.J. Nie. Nanomaterials for therapeutic RNA delivery. Matter, 2020, 3(6): 1948-1975. https://doi.org/10.1016/j.matt.2020.09.020
[134] M. Kumar, U. Kumar, A.K. Singh. Therapeutic nanoparticles: Recent developments and their targeted delivery applications. Nano Biomedicine and Engineering, 2022, 14(1): 38-52. https://doi.org/10.5101/nbe.v14i1. p38-52
[135] Y. Lu, W.J. Sun, Z. Gu. Stimuli-responsive nanomaterials for therapeutic protein delivery. Journal of Controlled Release, 2014, 194: 1-19. https://doi.org/ 10.1016/j.jconrel.2014.08.015
[136] A. Alekhya, A.K. Sailaja. Formulation and evaluation of letrozole nanoparticles by salting out technique and determination of anti-cancer activity by MTT assay. Nano Biomedicine and Engineering, 2022, 14(3): 246-253. https://doi.org/10.5101/nbe.v14i3.p246-253
[137] V. Biju. Chemical modifications and bioconjugate reactions of nanomaterials for sensing, imaging, drug delivery and therapy. Chemical Society Reviews, 2014, 43(3): 744-764. https://doi.org/10.1039/C3CS60273G
[138] S.A. Rashdan. Chemical detection of the toxicity of nanoparticles of metals and metal oxides. Nano Biomedicine and Engineering, 2021, 13(4): 401-413. https:// doi.org/10.5101/nbe.v13i4.p401-413
[139] B. Elder, R. Neupane, E. Tokita, et al. Nanomaterial patterning in 3D printing. Advanced Materials, 2020, 32(17): e1907142. https://doi.org/10.1002/adma. 201907142
[140] K. Thorkelsson, P. Bai, T. Xu. Self-assembly and applications of anisotropic nanomaterials: A review. Nano Today, 2015, 10(1): 48-66. https://doi.org/10. 1016/j.nantod.2014.12.005
[141] E. Baquedano, R.V. Martinez, J.M. Llorens, et al. Fabrication of silicon nanobelts and nanopillars by soft lithography for hydrophobic and hydrophilic photonic surfaces. Nanomaterials, 2017, 7(5): 109. https://doi.org /10.3390/nano7050109
[142] D.M. Ju, Y. Zhang, R. Li, et al. Mechanism-independent manipulation of single-wall carbon nanotubes with atomic force microscopy tip. Nanomaterials, 2020, 10(8): 1494. https://doi.org/10.3390/nano10081494
[143] G. Gonçalves, M. Vila, M.T. Portolés, et al. Nanographene oxide: A potential multifunctional platform for cancer therapy. Advanced Healthcare Materials, 2013, 2(8): 1072-1090. https://doi.org/10.1002/adhm. 201300023
[144] A. Sawdon, E. Weydemeyer, C.A. Peng. Tumor photothermolysis: Using carbon nanomaterials for cancer therapy. European Journal of Nanomedicine, 2013, 5(3): 131-140. https://doi.org/10.1515/ejnm-20130006
[145] A.O. Choi, S.J. Cho, J. Desbarats, et al. Quantum dotinduced cell death involves Fas upregulation and lipid peroxidation in human neuroblastoma cells. Journal of Nanobiotechnology, 2007, 5: 1. https://doi.org/10.1186/ 1477-3155-5-1
[146] W.J. Chen, Y.T. Xu, D.C. Yang, et al. Preparation of liposomes coated superparamagnetic iron oxide nanoparticles for targeting and imaging brain glioma. Nano Biomedicine and Engineering, 2022, 14(1): 71-80. https://doi.org/10.5101/nbe.v14i1.p71-80
[147] G.K. Ibadi, A.A. Taha, S.M.H. Al-Jawad. Anticancer activity of copper-chitosan nanocomposite conjugated with folic acid. Nano Biomedicine and Engineering, 2022, 14(4): 317-328. https://doi.org/10.5101/nbe.v14i4. p317-328
[148] A.M. Tomşa, A.L. Răchişan, A.A. Aldea, et al. Perspectives of gold nanoparticles and their applications in pancreatic cancer (Review). Experimental and Therapeutic Medicine, 2021, 21(3): 258. https://doi.org/ 10.3892/etm.2021.9689
[149] G. Barsisa, A. Belay, G. Beyene, et al. Synthesis europium
[150] Y.H. Zheng, Y. Wang, M.Y. Xia, et al. The combination of nanotechnology and traditional Chinese medicine (TCM) inspires the modernization of TCM: Review on nanotechnology in TCM-based drug delivery systems. Drug Delivery and Translational Research, 2022, 12(6): 1306-1325. https://doi.org/10.1007/s13346-021-01029-x
[151] N.C. Seeman, H.F. Sleiman. DNA nanotechnology. Nature Reviews Materials, 2017, 3: 17068. https://doi. org/10.1038/natrevmats. 2017.68
[152] P.X. Guo, F. Haque, B. Hallahan, et al. Uniqueness, advantages, challenges, solutions, and perspectives in therapeutics applying RNA nanotechnology. Nucleic Acid Therapeutics, 2012, 22(4): 226-245. https://doi.org /10.1089/nat.2012.0350
© The author(s) 2024. This is an open-access article distributed under the terms of the Creative Commons Attribution 4.0 International License (CC BY) (http://creativecommons.org/ licenses/by/4.0/), which permits unrestricted use, distribution, and reproduction in any medium, provided the original author and source are credited.
