DOI: https://doi.org/10.1038/s41586-024-07274-7
PMID: https://pubmed.ncbi.nlm.nih.gov/38632407
تاريخ النشر: 2024-04-17
العوامل البيئية لزيادة تنفس النظام البيئي في التندرا المتزايدة الحرارة
تاريخ الاستلام: 29 نوفمبر 2022
تم القبول: 6 مارس 2024
نُشر على الإنترنت: 17 أبريل 2024
الوصول المفتوح
س. ل. ميس
إي. إتش. جي. ألتويزن
C. ت. كريستيانسن
P. فوبيرت
ج. غودموندسون
C. هيكس برايس
إي. كارليجارفي
م. إ. ماروشتشاك
م. نايبرغ
أ. بيتراغليا
N. م. شميت
أ. تولفانن
ج. ت. ويدون
الملخص
تعتبر نظم التندرا القطبية والجبال العالية خزانات كبيرة للكربون العضوي
آثار الاحترار غير المباشرة
الإمداد للميكروبات في التربة المشبعة بالمياه أو التربة اللاهوائية، بينما يمكن أن يقلل من التنفس من خلال تعزيز نقص المياه في الأيض الميكروبي في التربة الجافة أو الهوائية.
اعتماديات السياق
اختلافات في الإنتاجية الأولية الصافية (NPP) وكمية ونوعية اللتر وكفاءة استخدام الكربون.
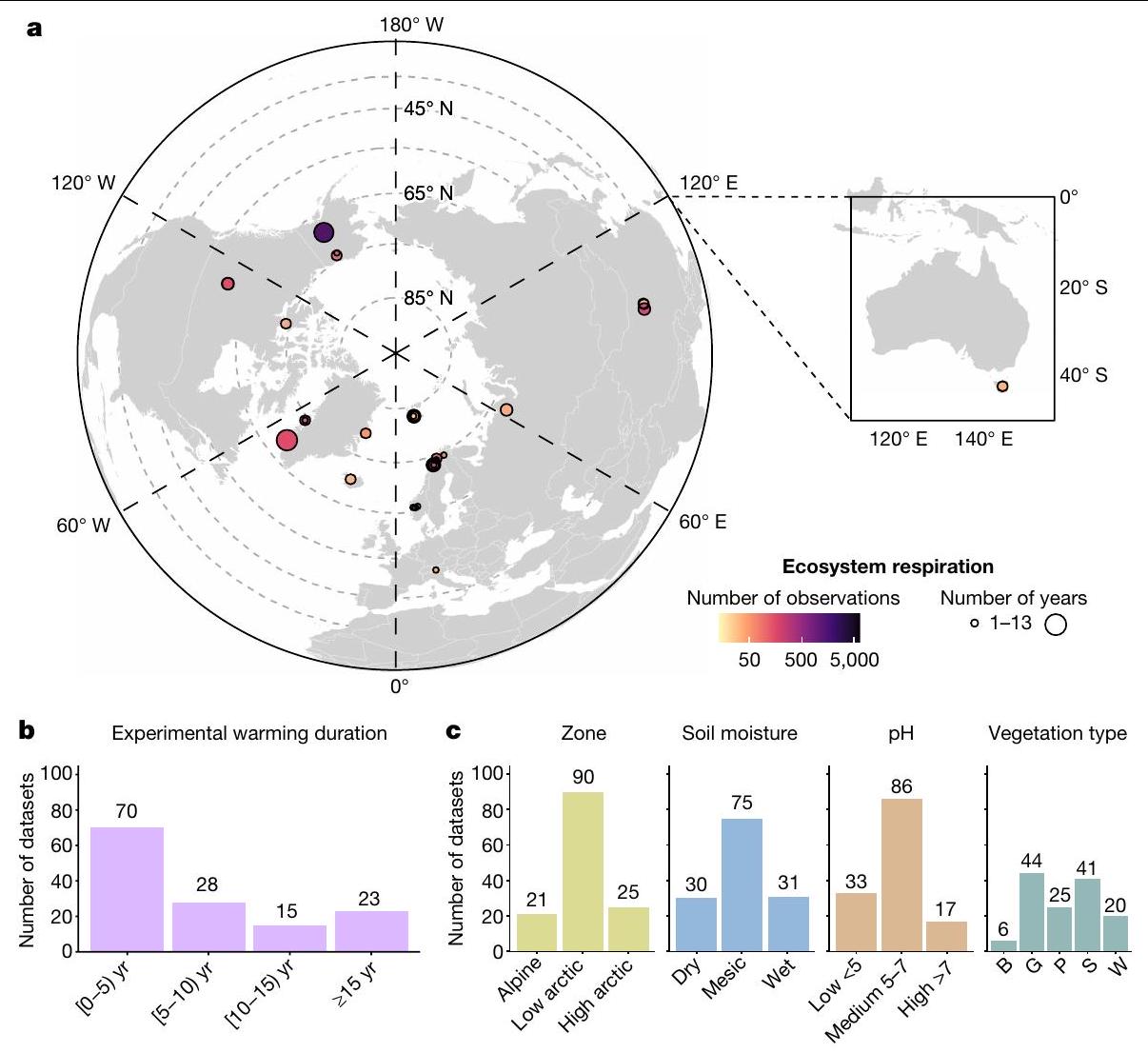
الهدف وتصميم الدراسة

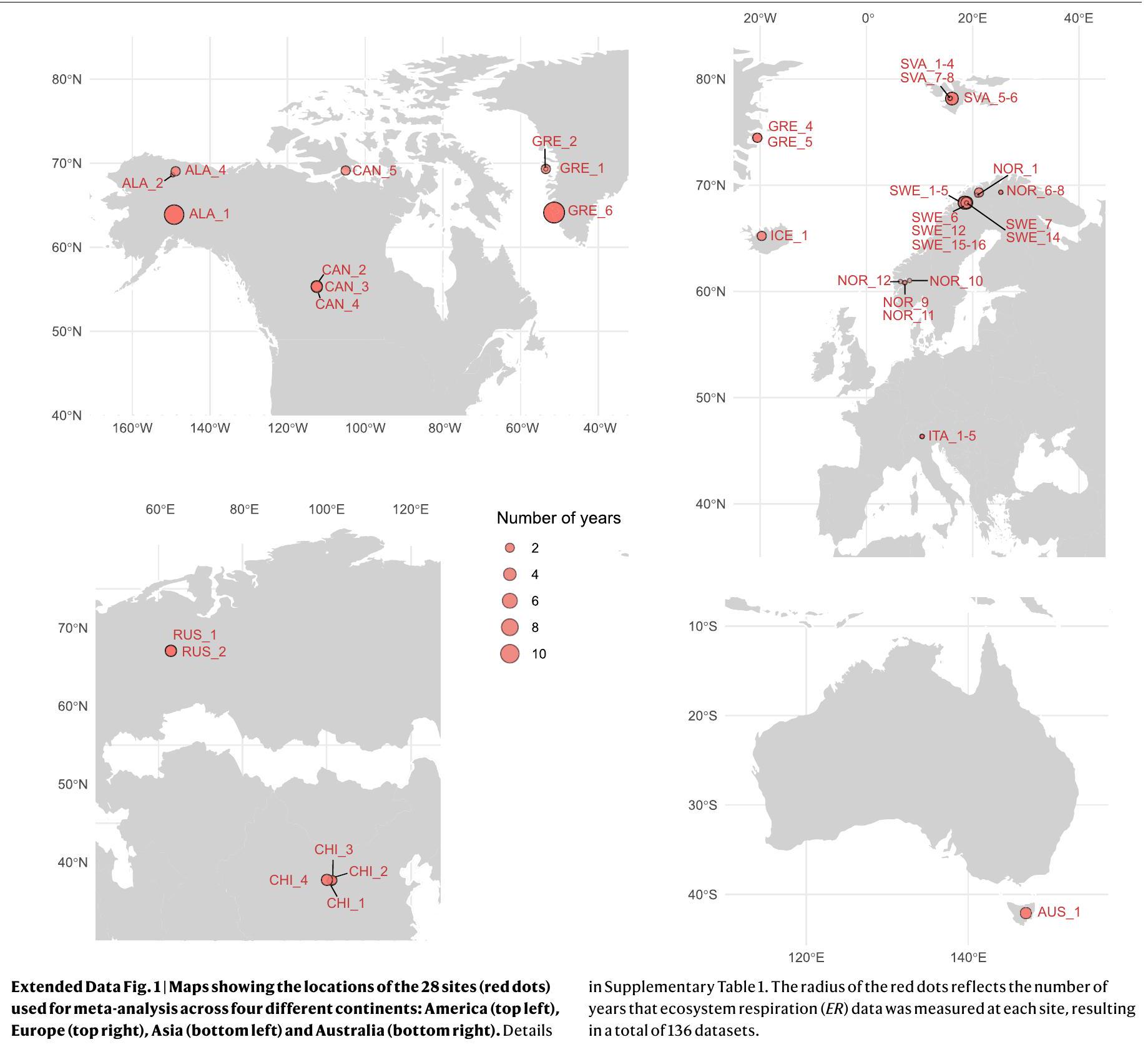
ممثلة بواسطة معرف التجربة باللون الأسود (يسار) وسنة قياس التنفس البيئي (يمين) في مقياس لوني يتراوح من الأزرق الداكن، الأزرق الفاتح، البرتقالي إلى الأحمر والذي يمثل مدة تسخين أطول بشكل متزايد في وقت قياسات التنفس البيئي. تم تجميع التجارب التي تحتوي على أكثر من سنة واحدة من بيانات التنفس البيئي. انظر الجداول التكملية 1 و2 و4 للحصول على تفاصيل حول مجموعات البيانات وقيم SMD وCI. يمثل الخط العمودي المنقط الأسود (SMD
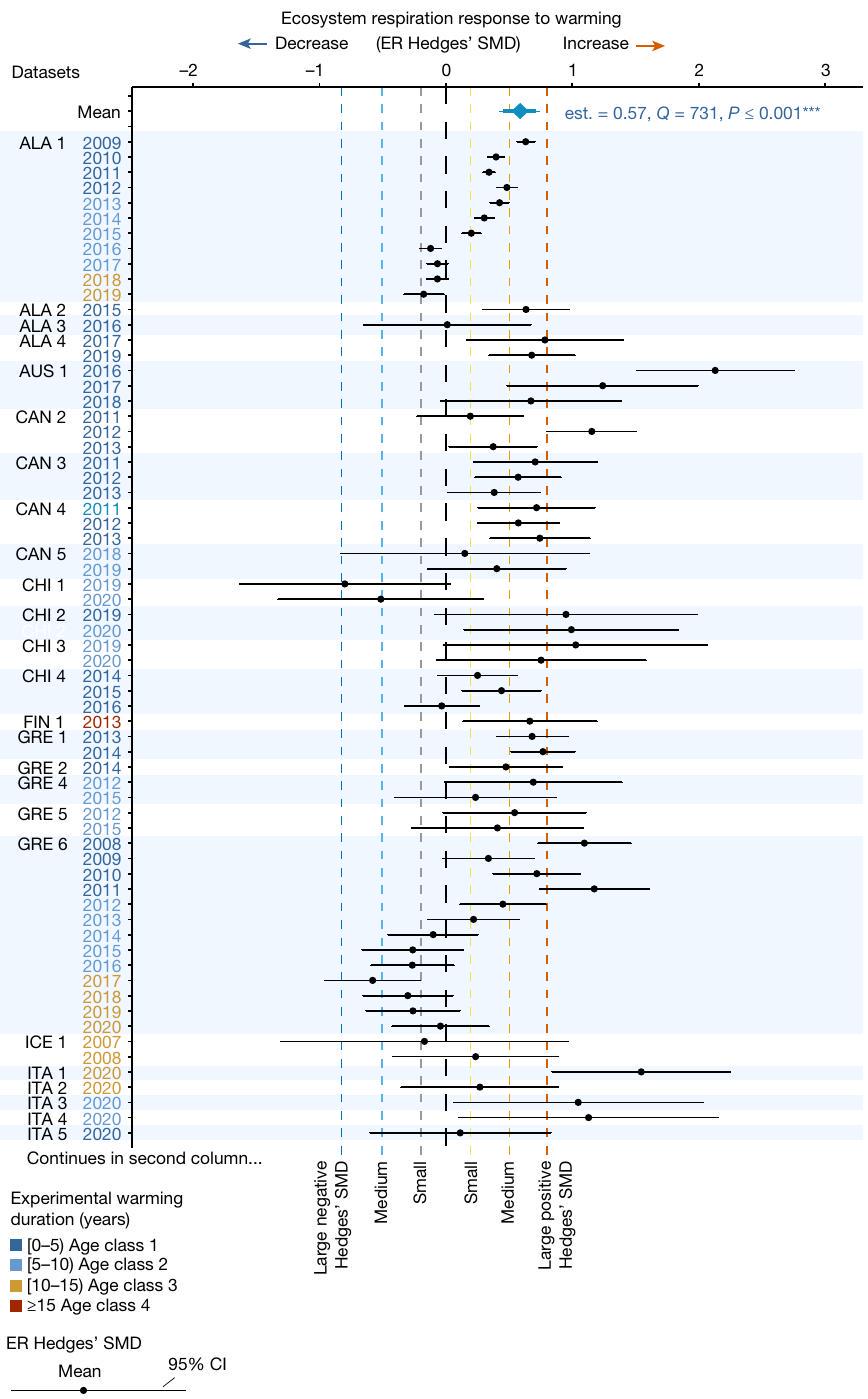
الأكثر نشاطًا. قمنا بحساب استجابة التنفس البيئي كـ SMD هيدجز
للتباين داخل الدراسة، مع الفقاعات الأكبر تشير إلى أوزان أكبر. تظهر قيم Qm،
لنا لتقييم ما إذا كانت وكيف اختلفت استجابة التنفس البيئي تجاه الاحترار على مر الزمن (الجدول البياني الممتد 2). علاوة على ذلك، سمح العدد الكبير والنطاق الجغرافي والمناخي والموائل الواسعة لمواقع التندرا المدرجة (الشكل 1ج) لنا بتحليل المحركات التي تؤثر على تباين استجابة التنفس البيئي باستخدام الانحدار الميتا (الجداول البيانية الممتدة 3 و4). شملت هذه المحركات (1) التغيرات في الظروف غير الحية والحية الناتجة عن معالجة الاحترار (أي، الخصائص المناخية والتربة والنباتات وخصائص المجتمع الميكروبي) و(2) السياق البيئي غير الحي والحيوي (أي، الخصائص المناخية والتربة وخصائص مجتمع النباتات؛ الطرق التكميلية 1). سمحت لنا هذان النوعان من المحركات بتقييم كيف يعتمد تباين حجم استجابة التنفس البيئي على، على التوالي، التأثيرات غير المباشرة للاحتباس الحراري وكذلك الاعتماد على السياق. لا تتضمن قاعدة البيانات بيانات الإنتاجية الأولية الإجمالية (GPP)، حيث أن تضمينها في مجموعات بيانات التنفس البيئي يمثل تحديًا بسبب الاعتماد على الضوء لعملية التمثيل الضوئي والتباين المكاني الزمني العالي المرتبط بقياسات GPP (الطرق). ومع ذلك، من خلال التركيز على التنفس البيئي وأخذ GPP في الاعتبار بشكل غير مباشر من خلال NPP وكتلة النبات، تتضمن تحليلاتنا استجابة نمو النبات تجاه الاحترار في توازن الكربون في النظام البيئي.
معالجة التسخين التجريبي
زيادة في تنفس النظام البيئي
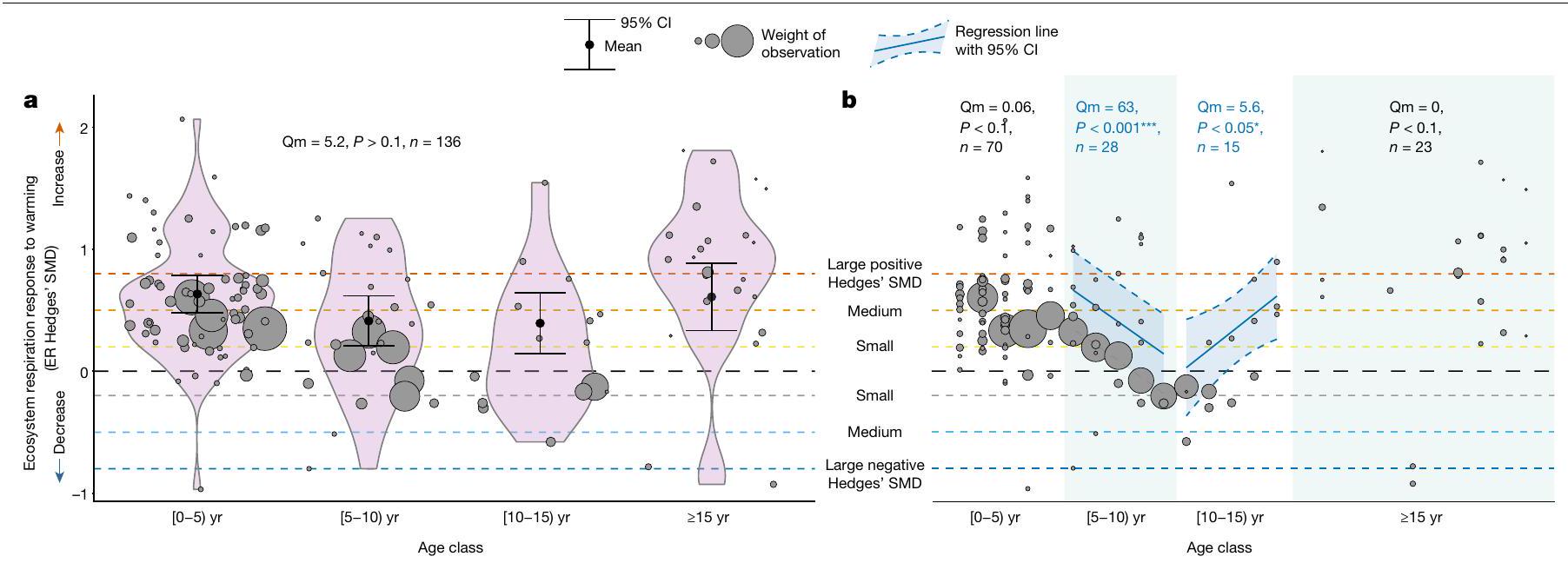
كان الميل العام عبر جميع السنوات غير ذي دلالة، مما يشير إلى أن ER استمر في أن يكون إيجابيًا في المواقع ذات تاريخ الاحترار الأطول (الشكل 3 أ والجدول 2 من البيانات الموسعة). على الرغم من أن استجابة ER للاحتباس الحراري التجريبي قد تتراجع في نهاية العقد الأول من الاحترار، إلا أن بياناتنا لا تقدم دليلًا على أن استجابات ER للاحتباس الحراري التجريبي تتراجع على المدى الطويل (أي، على مدى عدة عقود).
آثار الاحترار غير المباشرة
استجابات التنفس المعتمدة على السياق
الآثار العالمية لروابط النبات والتربة
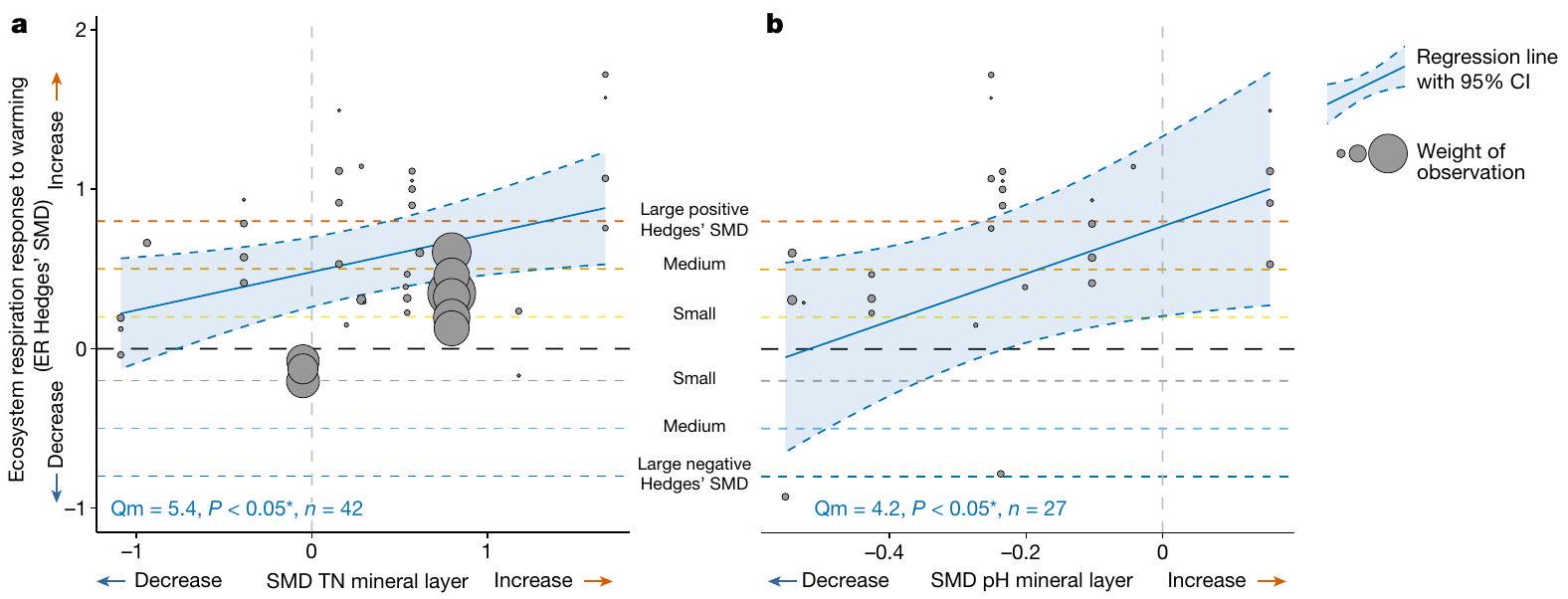
تظهر نتائجنا أهمية الظروف المحلية للتربة في التوسط في تأثيرات الاحترار المستقبلية على التنفس، وبشكل خاص من طبقة التربة المعدنية الأعمق في ملف التربة. يمكن أن يحفز الاحترار التجريبي بشكل غير متناسب كل من النشاط الميكروبي ونشاط جذور النباتات، وبالتالي معدل التنفس، في طبقات التربة المعدنية أو الأعمق

موضحة بخطوط زرقاء ومناطق مظللة باللون الأزرق، على التوالي. في أسفل اليسار في كل لوحة يظهر Qm (
أنماط مكانية
سيعزز فهمنا فقط من خلال توسيع قاعدة البيانات عبر الزمن والمكان
تعتمد شدة التغذية الراجعة للكربون والمناخ على المدى الطويل بشكل حاسم على التوازن بين امتصاص الكربون من خلال التغيرات في نشاط التمثيل الضوئي وإطلاق الكربون من خلال التغيرات في
تأثيرات الاحترار على الإنتاجية البيئية من خلال التغيرات في توفر العناصر الغذائية في التربة، أصبحت واضحة بالفعل خلال فترة تصل إلى 25 عامًا من دراسات الاحترار التجريبية في التندرا.
المحتوى عبر الإنترنت
- شور، إ. أ. ج. وآخرون. التربة المتجمدة وتغير المناخ: ردود فعل دورة الكربون من القطب الشمالي الدافئ. مراجعة سنوية للموارد البيئية 47، 343-371 (2022).
- تارنوكاي، سي. وآخرون. خزانات الكربون العضوي في التربة في منطقة التربة الصقيعية القطبية الشمالية. الدورات البيوجيوكيميائية العالمية.https://doi.org/10.1029/2008GBO03327 (2009).
- فيركالا، أ.-م. وآخرون. الترقية الإحصائية للنظام البيئي
التدفقات عبر التندرا الأرضية والنطاق الشمالي: الأنماط الإقليمية والشكوك. تغير المناخ العالمي 27، 4040-4059 (2021). - كارهو، ك. حساسية درجة الحرارة لمعدلات تنفس التربة المعززة باستجابة المجتمع الميكروبي. ناتشر 513، 81-83 (2014).
- راستاد، ل. إ. وآخرون. تحليل ميتا لاستجابة تنفس التربة، وتحرير النيتروجين الصافي، ونمو النباتات فوق الأرض للاحترار التجريبي للنظام البيئي. أوكولوجيا 126، 543-562 (2001).
- كاري، ج. سي. وآخرون. استجابة درجة حرارة تنفس التربة لم تتغير بشكل كبير مع التسخين التجريبي. وقائع الأكاديمية الوطنية للعلوم في الولايات المتحدة الأمريكية 113، 13797-13802 (2016).
- بوسكيل، ن. ج.، رايلي، و. ج. وغرانت، ر. ف. ستكون ردود الفعل الكربونية المناخية في ألاسكا أضعف مما تم استنتاجه من التجارب قصيرة الأجل. نات. كوميون. 11، 5798 (2020).
- شادل، سي. وآخرون. أنماط متباينة من الديناميات الكربونية لنظام التربة المتجمدة المستندة إلى التجارب والنماذج استجابةً للاحتباس الحراري في القطب الشمالي. رسائل البحث البيئي 13، 105002 (2018).
- لو، م. وآخرون. استجابات دورة الكربون في النظام البيئي للاحتباس الحراري التجريبي: تحليل شامل. علم البيئة 94، 726-738 (2013).
- ناتالي، س. م. وآخرون. خسارة كبيرة من
في الشتاء لوحظ عبر منطقة التربة المتجمدة الشمالية. Nat. Clim. Change 9، 852-857 (2019). - أوبر باور، س. ف. وآخرون. التندرا
التدفقات استجابةً للتسخين التجريبي عبر التدرجات العرضية والرطوبة. المجلة البيئية. 77، 221-238 (2007). - شور، إ. أ. ج. وآخرون. ضعف الكربون في التربة المتجمدة أمام تغير المناخ: الآثار على الدورة الكربونية العالمية. علوم الحياة 58، 701-714 (2008).
- بوند-لامبرتي، ب.، وانغ، ج. وغاور، س. ت. علاقة عالمية بين المكونات غير الذاتية والذاتية للتنفس التربة؟ بيولوجيا التغير العالمي 10، 1756-1766 (2004).
- تحديث تغير المناخ في القطب الشمالي 2021: الاتجاهات الرئيسية والتأثيرات. ملخص لصانعي السياسات (AMAP، 2021).
- رانتانين، م. وآخرون. لقد ارتفعت درجة حرارة القطب الشمالي تقريبًا أربع مرات أسرع من الكرة الأرضية منذ عام 1979. اتصالات الأرض والبيئة 3، 168 (2022).
- بوسكيل، ن. ج.، رايلي، و. ج. وتانغ، ج. ي. تحليل ميتا لدراسات إضافة النيتروجين والتسخين في المناطق ذات العرض العالي يشير إلى آليات بيئية تم تجاهلها من قبل نماذج الأراضي. علوم البيوجيوكيمياء 11، 6969-6983 (2014).
- فان جيستيل، ن. وآخرون. توقع فقدان الكربون في التربة مع ارتفاع درجات الحرارة. ناتشر 554، E4-E5 (2018).
- هيكس برايز، سي. إي. وآخرون. تسبب الاحترار العقدي في تحول متسق ومستمر من التنفس غير الذاتي إلى التنفس الذاتي في نظم بيئية مختلفة من التربة المتجمدة. بيولوجيا التغير العالمي 21، 4508-4519 (2015).
- دورباال، إ. وآخرون. تنفس الكربون من الخث تحت السطح تسارع بفعل الاحترار المناخي في المناطق شبه القطبية. ناتشر 460، 616-619 (2009).
- ناتالي، س. م. وآخرون. آثار التسخين التجريبي للهواء والتربة والتربة المتجمدة على توازن الكربون في التندرا الألاسكية. التغير العالمي في البيولوجيا 17، 1394-1407 (2011).
- روميرو-أوليفاريس، أ. ل.، أليسون، س. د. وتريسييدر، ك. ك. ميكروبات التربة واستجابتها للاحتباس الحراري التجريبي على مر الزمن: تحليل شامل للدراسات الميدانية. علم الأحياء والتغذية في التربة 107، 32-40 (2017).
- وانغ، إكس. وآخرون. تنفس التربة تحت ارتفاع درجة حرارة المناخ: استجابة مختلفة للتنفس غير الذاتي والتنفس الذاتي. التغير العالمي في البيولوجيا 20، 3229-3237 (2014).
- شافر، ج. ر. وآخرون. الاحترار العالمي والنظم البيئية الأرضية: إطار مفاهيمي للتحليل: ستكون استجابات النظم البيئية للاحتباس الحراري معقدة ومتنوعة. علوم الحياة 50، 871-882 (2000).
- كريستيانسن، سي. تي. وآخرون. زيادة الاحترار الصيفي تقلل من تنوع الفطريات المحللة وفقدان كتلة الأوراق بشكل أقوى في التندرا الجافة مقارنة بالتندرا الرطبة. التغير العالمي في البيولوجيا 23، 406-420 (2017).
- شارن، ر.، ليتل، ج. ج.، بيكون، ج. د.، ألاتالو، ج. م. وأنتونيلي، أ. انخفاض رطوبة التربة بسبب الاحترار يدفع التنوع النشوء والتطور وانتقالات المجتمع في التندرا. رسائل البحث البيئي 16، 064031 (2021).
- شور، إ. أ. ج. وآخرون. تغير المناخ واستجابة الكربون في التربة المتجمدة. ناتشر 520، 171-179 (2015).
- بولد، ج.، بايلاجيون، ن.، ليبي، أ.، راستتر، إ. ب. وسستلا، س. أ. تأثيرات الاحترار على الكيمياء الحيوية للتندرا القطبية محدودة ولكن تعتمد على الموائل: تحليل شامل. إيكوسفير 12، e03777 (2021).
- إلمندورف، س. ج. وآخرون. أدلة على تغيير نباتات التندرا على مستوى القطعة وروابطها مع الاحترار الصيفي الأخير. نات. مناخ. تغيير 2، 453-457 (2012).
- جانبيل، م. وآخرون. استجابات محددة للموقع لوفرة الفطريات والبكتيريا للتسخين التجريبي في النفايات والتربة عبر التندرا القطبية والتندرا الجبلية. العلوم القطبية. https:// doi.org/10.1139/as-2020-0053 (2021).
- بيوركمان، أ. د. وآخرون. تغيير الصفات الوظيفية للنباتات عبر بيئة التندرا المتزايدة الحرارة. ناتشر 562، 57-62 (2018).
- نيبرغ، م. & هوفندن، م. ج. زيادة درجة الحرارة تزيد من تنفس التربة في تربة غنية بالكربون دون تغيير الإمكانات التنفسية الميكروبية. علوم الأحياء الجيولوجية 17، 4405-4420 (2020).
- كيبر، ف. وآخرون. فقدان الكربون من تربة الجليد الدائم في المناطق القطبية الشمالية المعزز بواسطة تنشيط الجذور. نات. جيوسي. 13، 560-565 (2020).
- شافر، أ. ج. ر.، ستريت، ل. إ.، راستتر، إ. ب.، فان ويك، م. ت. وويليامز، م. التقارب الوظيفي في تنظيم صافي
التدفق في المناظر الطبيعية التندرا غير المتجانسة في ألاسكا والسويد. J. Ecol. 95، 802-817 (2007). - كونانت، ر. ت. وآخرون. حساسية تحلل المادة العضوية للاحتباس الحراري تختلف حسب جودتها. التغيرات العالمية في البيولوجيا 14، 868-877 (2008).
- باو، ت.، زو، ر.، لي، إكس.، يي، و. وتشينغ، إكس. تأثيرات المتغيرات البيئية المتعددة على تنفس نظام التندرا البيئي في القارة القطبية الجنوبية البحرية. تقارير العلوم. 8، 12336 (2018).
- ستيوارت تشابين، ف. الثالث وآخرون. دورة الكربون العالمية المتغيرة: ربط ديناميات الكربون في النبات والتربة بالعواقب العالمية. مجلة علم البيئة 97، 840-850 (2009).
- أليسون، س. د.، روميرو-أوليفاريس، أ. ل.، لو، ي.، تايلور، ج. و تريسييدر، ك. ك. حساسية درجات الحرارة للإنزيمات خارج الخلوية
و عبر البيئات الحرارية. التغير العالمي في علم الأحياء 24، 2884-2897 (2018). - ديفيدسون، إ. أ. وجانسنس، إ. أ. حساسية درجة الحرارة لتحلل الكربون في التربة والتغذية الراجعة لتغير المناخ. ناتشر 440، 165-173 (2006).
- باو، ت.، جيا، ج. & شو، إكس. ضعف مصدات غازات الدفيئة في الأراضي الرطبة البكر تحت تأثير الاحترار. نات. تغير المناخhttps://doi.org/10.1038/s41558-023-01637-0 (2023).
- جيزلر، ر.، إسبيرغ، س.، لاجيرستروم، أ. وغراي، ب. توافر الفوسفور والتنفس الميكروبي عبر أنواع مختلفة من نباتات التندرا. الكيمياء الحيوية 108، 429-445 (2012).
- ميكونن، ز. أ.، رايلي، و. ج. وغرانت، ر. ف. قد تؤدي شجيرات التندرا في القرن الحادي والعشرين إلى تعزيز امتصاص الكربون الصافي في تندرا القطب الشمالي في أمريكا الشمالية تحت مسار مناخ RCP8.5. رسائل البحث البيئي 13، 054029 (2018).
- باركر، ت. س. وآخرون. تخصيص الجذور بواسطة الأنواع التي تشكل المظلة تهيمن على التربة
تدفق في منظر طبيعي شبه قطبي. نيو فيتولوجي. 227، 1818-1830 (2020). - سيستلا، س. أ. وآخرون. الاحترار على المدى الطويل يعيد هيكلة التندرا القطبية دون تغيير صافي تخزين الكربون في التربة. الطبيعة 497، 615-617 (2013).
- ماريون، ج. م. وآخرون. تصاميم مفتوحة من الأعلى للتلاعب بدرجة حرارة الحقل في النظم البيئية ذات العرض العالي. التغير العالمي في البيولوجيا 3، 20-32 (1997).
- وو، ز.، ديكسترا، ب.، كوتش، ج. و.، بينويلاس، ج. وهونغيت، ب. أ. استجابات النظم البيئية الأرضية لتغيرات درجة الحرارة وهطول الأمطار: تحليل شامل للتلاعب التجريبي. بيولوجيا التغير العالمي 17، 927-942 (2011).
- هادجز، ل. ف. نظرية التوزيع لمقدّر غلاس لحجم التأثير والمقدّرات ذات الصلة. مجلة الإحصاء التعليمي 6، 107-128 (1981).
- ديكسترا، ف. أ.، كاريّلو، ي.، بيندال، إ. ومورغان، ج. أ. تنشيط منطقة الجذور: منظور غذائي. فرونت. ميكروبيول. 4، 216 (2013).
- فينغ، ج. وزو، ب. الأنماط العالمية والعوامل المرتبطة بتأثير التهيئة استجابةً لإضافة المغذيات. علم الأحياء والتغذية التربة 153، 108118 (2021).
- ين، هـ. وآخرون. زيادة إفراز الجذور تحفز تحولات النيتروجين في التربة في غابة صنوبرية تحت التجارب الحرارية. التغير العالمي في البيولوجيا 19، 2158-2167 (2013).
- جيانغ، ز.، ليو، ي.، يانغ، ج.، تشو، ز. وغونينا، أ. تأثيرات تخصيب النيتروجين على تنشيط منطقة الجذور. تربة النبات 462، 489-503 (2021).
- تيرير، سي. وآخرون. استجابات النظام البيئي لارتفاع
تحكمها تفاعلات النبات والتربة وتكلفة الحصول على النيتروجين. نيو فيتولوجي. 217، 507-522 (2018). - الهيئة الحكومية الدولية المعنية بتغير المناخ: ملخص لصانعي السياسات. في تغير المناخ 2022: الآثار، التكيف والهشاشة (تحرير بورتنر، هـ.-أو. وآخرون) (مطبعة جامعة كامبريدج، 2022).
- بلوم-ويري، ج.، ميلباو، أ.، تيوبير، ل. م.، يوهانسون، م. ودورباال، إ. السكن في الأعماق – زيادة كبيرة في نمو الجذور وعمق الجذور تعزز تفاعلات النباتات مع تربة الجليد المتجمد الذائبة. نيو فيتولوجي. 223، 1328-1339 (2019).
- فويت، سي. وآخرون. ارتفاع درجة حرارة التندرا تحت القطبية يزيد من انبعاثات جميع غازات الدفيئة الثلاثة المهمة – ثاني أكسيد الكربون، والميثان، وأكسيد النيتروز. التغير العالمي في البيولوجيا 23، 3121-3138 (2017).
- لي، ف. وآخرون. تأثيرات الاحترار على تدفقات الميثان تختلف بين مرعيين جبليين بحالة مائية للتربة متباينة. الزراعة. الغابات. الأرصاد الجوية 290، 107988 (2020).
- بيورك، ر. ج. وآخرون. الروابط بين دوران النيتروجين وبنية مجتمع النباتات في منظر طبيعي من التندرا. التربة والنبات 294، 247-261 (2007).
- سوليفان، ب. و هارت، س. سي. تقييم الآليات التي تتحكم في تنشيط الكربون في التربة على طول تدرج عمر الركيزة. علم الأحياء والتغذية في التربة 58، 293-301 (2013).
- ميلكو، أ.، هايم، أ.، إليس، ر. ج.، شيو، س. & مانينغ، ب. تحديد الأنماط العامة للتحكم في المغذيات والكربون القابل للتغير على ديناميات الكربون في التربة عبر تدرج الخلافة. النظم البيئية 14، 710-719 (2011).
- ميتكلف، د. ب. وآخرون. التحيزات في أخذ عينات الحقول المتقطعة تؤثر على فهم تأثيرات تغير المناخ عبر القطب الشمالي. نات. إيكول. إيفول. 2، 1443-1448 (2018).
- بيوركمان، م. ب. وآخرون. تدفقات ثاني أكسيد الكربون في الشتاء من النظم البيئية القطبية: نظرة عامة ومقارنة للمنهجيات. الدورات البيوجيوكيميائية العالميةhttps://doi.org/10.1029/2009 GB003667 (2010).
- بلوك، د.، إلبيرلينغ، ب. & ميشيلسن، أ. قد تتسارع المراحل الأولية لتحلل أوراق شجيرات التندرا بسبب الثلوج العميقة في الشتاء ولكنها تتباطأ بسبب ارتفاع درجات الحرارة في الربيع. النظم البيئية 19، 155-169 (2016).
- مورغنر، إ.، إلبيرلينغ، ب.، ستريبل، د. وكوبر، إ. ج. أهمية الشتاء في تنفس النظام البيئي السنوي في القطب الشمالي العالي: آثار عمق الثلج في نوعين من الغطاء النباتي. أبحاث قطبية. 29، 58-74 (2010).
- تشين، هـ.، جوزيف، ر. وزينغ، ن. زيادة امتصاص الكربون الأرضي في العروض العليا الشمالية في القرن الحادي والعشرين من توقعات نماذج مشروع المقارنة بين نماذج دورة الكربون المناخية المتصلة. التغير العالمي في البيولوجيا 16، 641-656 (2010).
- ميللو، ج. م. وآخرون. نمط وحجم تغذية الكربون في التربة للنظام المناخي على المدى الطويل في عالم دافئ. ساينس 358، 101-105 (2017).
- هيكس برايز، سي. إي.، شور، إي. إيه. جي.، ناتالي، إس. إم. وكرومر، ك. جي. خسائر الكربون القديمة في التربة تزداد مع تنفس النظام البيئي في التندرا التي تم إذابتها تجريبياً. تغير المناخ الطبيعي 6، 214-218 (2016).
- هيكس برايز، سي. إي.، شور، إي. إيه. جي. وكرومر، ك. جي. ذوبان التربة المتجمدة يزيد من تنفس التربة القديمة والتنفّس الذاتي في التندرا: تقسيم تنفس النظام البيئي باستخدام
و {increment} تغير المناخ العالمي البيولوجي 19، 649-661 (2013). - وي، د. وآخرون. امتصاص النبات لـ
يتجاوز الخسائر الناتجة عن التربة المتجمدة وتنفس النباتات على هضبة التبت. نشر في الأكاديمية الوطنية للعلوم في الولايات المتحدة الأمريكية 118، e2015283118 (2021).
© المؤلف(ون) 2024
أستراليا.
جمع البيانات
حساب حجم التأثير
أنماط زمنية
محركات بيئية ER
على مستوى القطعة، أي نسبة التغطية لكل مجموعة وظيفية (الأعشاب، الزهور، الشجيرات المتساقطة، الشجيرات دائمة الخضرة، الطحالب والطحالب الجليدية)، الكتلة الحيوية فوق الأرض ومتوسط ارتفاع المجتمع، على مستوى القطعة؛ و(4) المجتمع الميكروبي على مستوى القطعة، أي مؤشرات للكتلة الحيوية البكتيرية والفطرية ونسب الفطريات إلى البكتيريا المستمدة (البيانات الموسعة الجدول 3). على الرغم من أن معدل التنفس التربة يمكن أن يكون مرتبطًا بشكل قوي بالإنتاجية الأولية للنباتات، إلا أن قاعدة بياناتنا لا تتضمن بيانات الإنتاجية الأولية، حيث أن تضمينها ومقارنتها عبر الزمن وعبر عدة تجارب يمثل تحديًا بسبب اعتماد الضوء في عملية التمثيل الضوئي والتغير العالي في الزمان والمكان لقياسات الإنتاجية الأولية. ومع ذلك، فإن كلا العمليتين مدفوعتان جزئيًا بنشاط النباتات، والذي بدوره يتأثر بالاستجابات المباشرة لبيئتها (على سبيل المثال، المناخ المحلي) وكذلك، على سبيل المثال، بكتلتها الحيوية وتركيب المجتمع. لذلك، نرى أنه من أجل زيادة فهمنا الميكانيكي للعوامل البيئية الأساسية التي تؤثر على استجابة معدل التنفس التربة للاحتباس الحراري، من الأكثر معنى دمج دور استجابة نمو النباتات للاحتباس الحراري في تنفس النظام البيئي من خلال تضمين (التغيرات في) الكتلة الحيوية للنباتات وتركيب المجتمع، بالإضافة إلى الإنتاجية الأولية (انظر قسم “اعتماديات السياق”) كعوامل محتملة لمعدل التنفس التربة، كما نفعل هنا. لاحظ أننا نشير إلى تركيز الكربون والنيتروجين الكلي في التربة طوال المخطوطة، لأن هذه العوامل تم قياسها على التربة الصلبة (المجففة) باستخدام محللات عناصر الكربون والنيتروجين. لذلك، فإنها تشير إلى مجموع تركيزات كل من المركبات غير العضوية والعضوية من الكربون والنيتروجين، على الرغم من أن الكربون الكلي من المحتمل أن يعكس بشكل أساسي تركيز الكربون العضوي في التربة لأن تربة التندرا تحتوي على كربون غير عضوي محدود أو معدوم.
التحليلات الإحصائية
نهج النمذجة. التحليل التلوي. لتقييم آثار الاحترار التجريبي على معدل التنفس، قمنا بإجراء تحليل تلوي متعدد المتغيرات معrma.mvوظيفة من حزمة metafor في R
حجم الفروق المتوسطة الخام (أي الفرق في القيم المطلقة للسائق بين متوسطات العلاج والتحكم) كحجم تأثير ثانوي لأن الأخير يوفر تقديرات للتغيرات المطلقة في السائقين (الجدول التكميلي 3).
التحليل الميتا. الأنماط الزمنية. لتقييم ما إذا كانت استجابة ER وكيفية اختلافها مع مدة التسخين التجريبي، قمنا بإجراء نوعين من نماذج التحليل الميتا ذات العامل الواحد. أولاً، اختبرنا ما إذا كانت المدة (عدد سنوات التسخين عند قياسات ER) تؤثر على حجم استجابة ER (SMD هيدجز). تم إجراء هذه النماذج عبر التجارب و (1) عبر الفئات العمرية الأربع للمدة، لتحليل الأنماط العامة طويلة الأجل لتأثيرات التسخين و (2) في كل فئة عمرية (
تأثيرات التسخين غير المباشرة. لتقييم ما إذا كانت التغيرات في استجابة ER للتسخين مدفوعة بتأثيرات غير مباشرة للتسخين على الظروف البيئية، قمنا بتشغيل نماذج تحليل ميتا ذات عامل واحد باستخدام SMD هيدجز للسائقين البيئيين المختلفين (التي تعكس التغيرات الناتجة عن التسخين في المناخ والتربة والنباتات وظروف المجتمع الميكروبي) كمتنبئات فردية وSMD هيدجز كاستجابة (انظر القسم السابق حول ‘تأثيرات التسخين غير المباشرة’؛ الشكل 4 والجدول التكميلي 3).
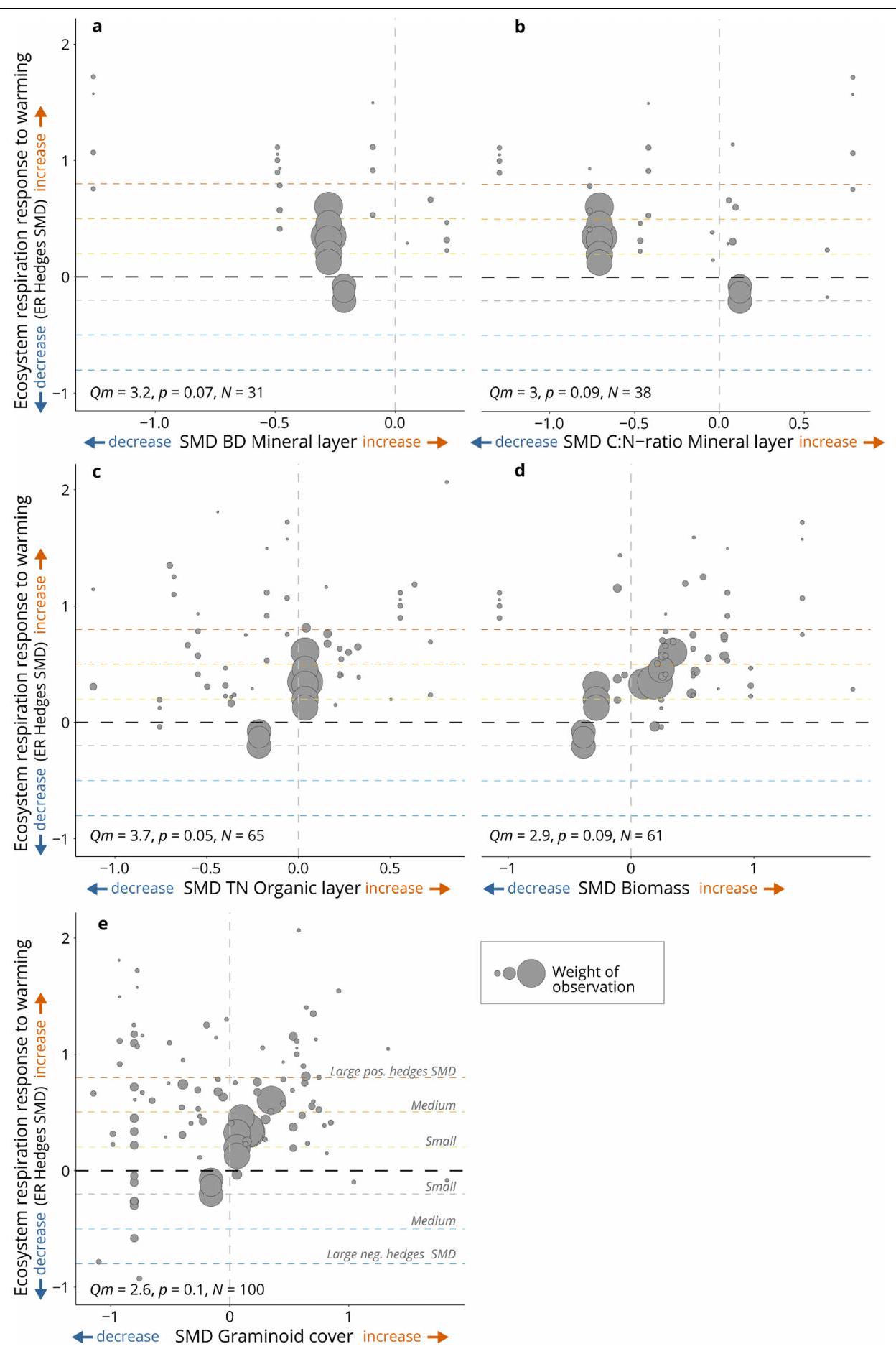
اعتماديات السياق. لتقييم ما إذا كان يمكن تفسير التغير في استجابة ER للتسخين من خلال السائقين البيئيين المحددين بالسياق والمتعلقين بالمناخ أو التربة أو النباتات، قمنا بإجراء نماذج تحليل ميتا ذات عامل واحد لاختبار تأثير كل من هؤلاء السائقين على SMD هيدجز لـ ER (انظر القسم السابق حول ‘اعتماديات السياق’؛ الشكل 5 والجدول التكميلي 4).
المقال
التحليلات التكملية
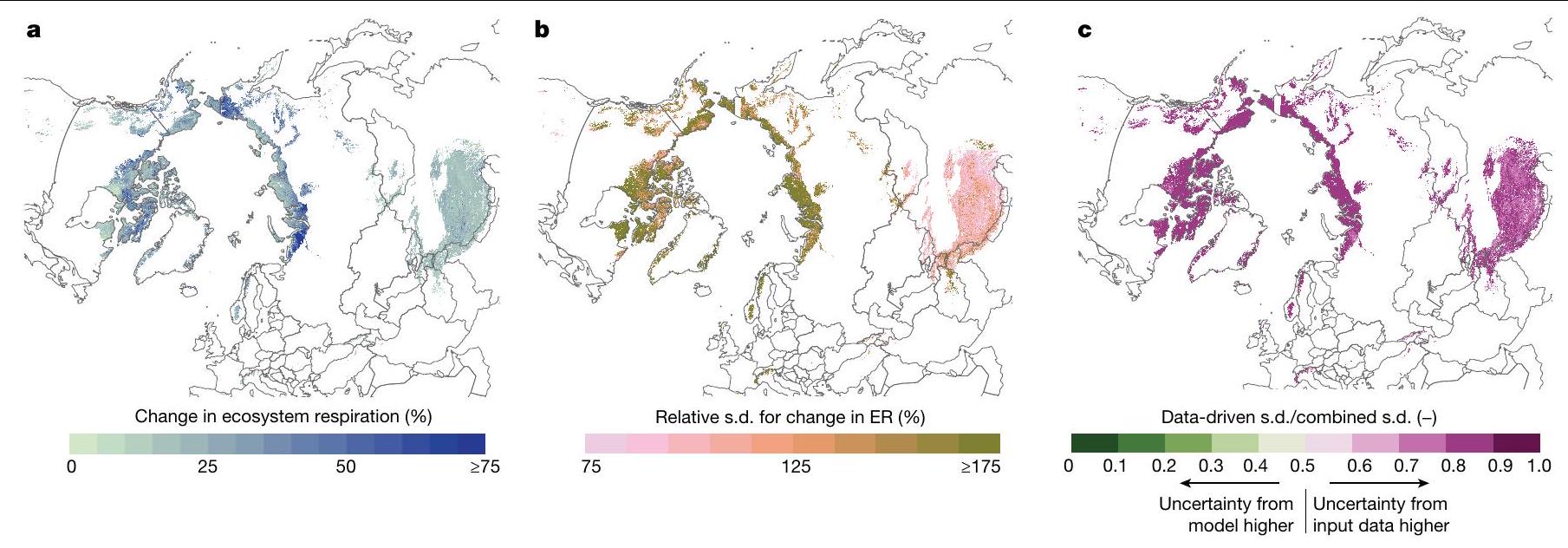
التوسع المكاني
تم استخدامه (انظر التفاصيل أدناه). الإجراء التفصيلي موضح أدناه ومصور في الطرق التكميلية 2.
كتوزيع مختلط من 100 فترة توقع. يتم إعطاء الانحراف المعياري للتوزيع الناتج بواسطة:
توفر البيانات
توفر الكود
68. هنري، ج. هـ. ر. ومولاو، أ. نباتات التندرا وتغير المناخ: التجربة الدولية للتندرا (ITEX). تغير المناخ العالمي 3، 1-9 (1997).
69. روسيو، ب. ج. وهوبير، م. إحصائيات قوية لاكتشاف القيم الشاذة. WIREs Data Mining Knowl. Discov. 1، 73-79 (2011).
70. بورنشتاين، م.، هيدجز، ل. ف.، هيغينز، ج. ب. ت. وروثشتاين، هـ. ر. مقدمة في الميتا-تحليل (وايلي، 2009).
71. ووكر، د. أ. وآخرون. خريطة نباتات القطب الشمالي الدائرية. J. Veg. Sci. 16، 267-282 (2005).
72. فريق R الأساسي. R: لغة وبيئة للحوسبة الإحصائية (مؤسسة R للحوسبة الإحصائية، 2021).
73. فيشتباور، و. إجراء الميتا-تحليلات في R باستخدام الميتافور. J. Stat. Softw. 36، 1-48 (2010).
74. هيدجز، ل. ف.، غوريفيتش، ج. وكيرتس، ب. س. الميتا-تحليل لنسب الاستجابة في علم البيئة التجريبية. علم البيئة 80، 1150-1156 (1999).
75. كونستانتوبولوس، س. تقدير التأثيرات الثابتة ومكونات التباين في الميتا-تحليل ثلاثي المستويات. Res. Synth. Methods 2، 61-76 (2011).
76. ناكاغاوا، س. وسانتوس، إ. س. أ. القضايا المنهجية والتقدم في الميتا-تحليل البيولوجي. Evol. Ecol. 26، 1253-1274 (2012).
77. I shak، K. J.، Platt، R. W.، Joseph، L.، Hanley، J. A. & Caro، J. J. تحليل ميتا للدراسات الطولية. التجارب السريرية 4، 525-539 (2007).
78. تريكالينوس، ت. أ. وأولكين، إ. تحليل ميتا لحجم التأثير المبلغ عنه في نقاط زمنية متعددة: نهج متعدد المتغيرات. التجارب السريرية 9، 610-620 (2012).
79. Signorini، م.، Midolo، ج.، Cesco، س.، Mimmo، ت. & Borruso، ل. مسألة المعادن: النحاس ولكن ليس الكادميوم يؤثر على التنوع الألفا الميكروبي للتربة والرواسب – تحليل ميتا. علم البيئة الميكروبية.https://doi.org/10.1007/s00248-022-02115-4 (2022).
80. جنكينز، د. ج. وآخرون. تحليل ميتا لعزل المسافة: أثر أو معيار مرجعي لعلم الوراثة المنظري؟ إيكوغرافي 33، 315-320 (2010).
81. فاسن، ت. وآخرون. العلاقة بين الضغط النفسي المبلغ عنه ذاتياً وقياسات القلب والأوعية الدموية في الحياة اليومية: مراجعة منهجية. PLoS ONEhttps://doi.org/10.1371/journal. بون. 0259557 (2021).
82. راوي، أ. وآخرون. تحليل التعرف الهيكلي والعملي للنماذج الديناميكية الملاحظة جزئيًا من خلال استغلال احتمال الملف الشخصي. المعلوماتية الحيوية 25، 1923-1929 (2009).
83. جينيونز، م. د. ومولر، أ. ب. انحياز النشر في علم البيئة والتطور: تقييم تجريبي باستخدام طريقة ‘التقليم والملء’. مراجعة بيولوجية 77، 211-222 (2002).
84. تيستولين، ر.، أتوور، ف. وجيمينيز-ألفارو، ب. التوزيع العالمي والتوصيف البيوكيميائي للبيئات الجبلية. إيكوغرافي 43، 779-788 (2020).
85. بوجيو، ل. وآخرون. SoilGrids 2.0: إنتاج معلومات عن التربة للعالم مع عدم اليقين المكاني الكمي. SOIL 7، 217-240 (2021).
86. وارنر، د. ل.، بوند-لامبرتي، ب. ب.، جيان، ج.، ستيل، إ. وفارغاس، ر. التنفس السنوي للتربة بدقة 1 كم على مستوى العالم وعدم اليقين المستمد من SRDB V3 (ORNL DAAC، 2019)؛https://doi.org/10.3334/ORNLDAAC/1736.
87. هنتنجفورد، سي. وآخرون. تداعيات تحسين تمثيلات تنفس النبات في مناخ متغير. نات. كوميونيك. 8، 1602 (2017).
88. مجموعة البيانات لـ “العوامل البيئية لزيادة تنفس النظام البيئي في التندرا الدافئة”. زينودوhttps://doi.org/10.5281/zenodo. 10572479 (2024).
89. نصوص لـ “العوامل البيئية لزيادة تنفس النظام البيئي في التندرا الدافئة”. GitHubhttps://github.com/mjalava/tundraflux (2024).
مقالة
المصالح المتنافسة يعلن المؤلفون عدم وجود مصالح متنافسة.
معلومات إضافية النسخة الإلكترونية تحتوي على مواد إضافية متاحة علىhttps://doi.org/10.1038/s41586-024-07274-7.
يجب توجيه المراسلات والطلبات للحصول على المواد إلى S. L. Maes.
تُعرب مجلة Nature عن شكرها لجيسيكا غوريفيتش، إيفان يانسنس والمراجعين الآخرين المجهولين على مساهمتهم في مراجعة هذا العمل. تقارير مراجعي الأقران متاحة.
معلومات إعادة الطباعة والتصاريح متاحة علىhttp://www.nature.com/reprints.
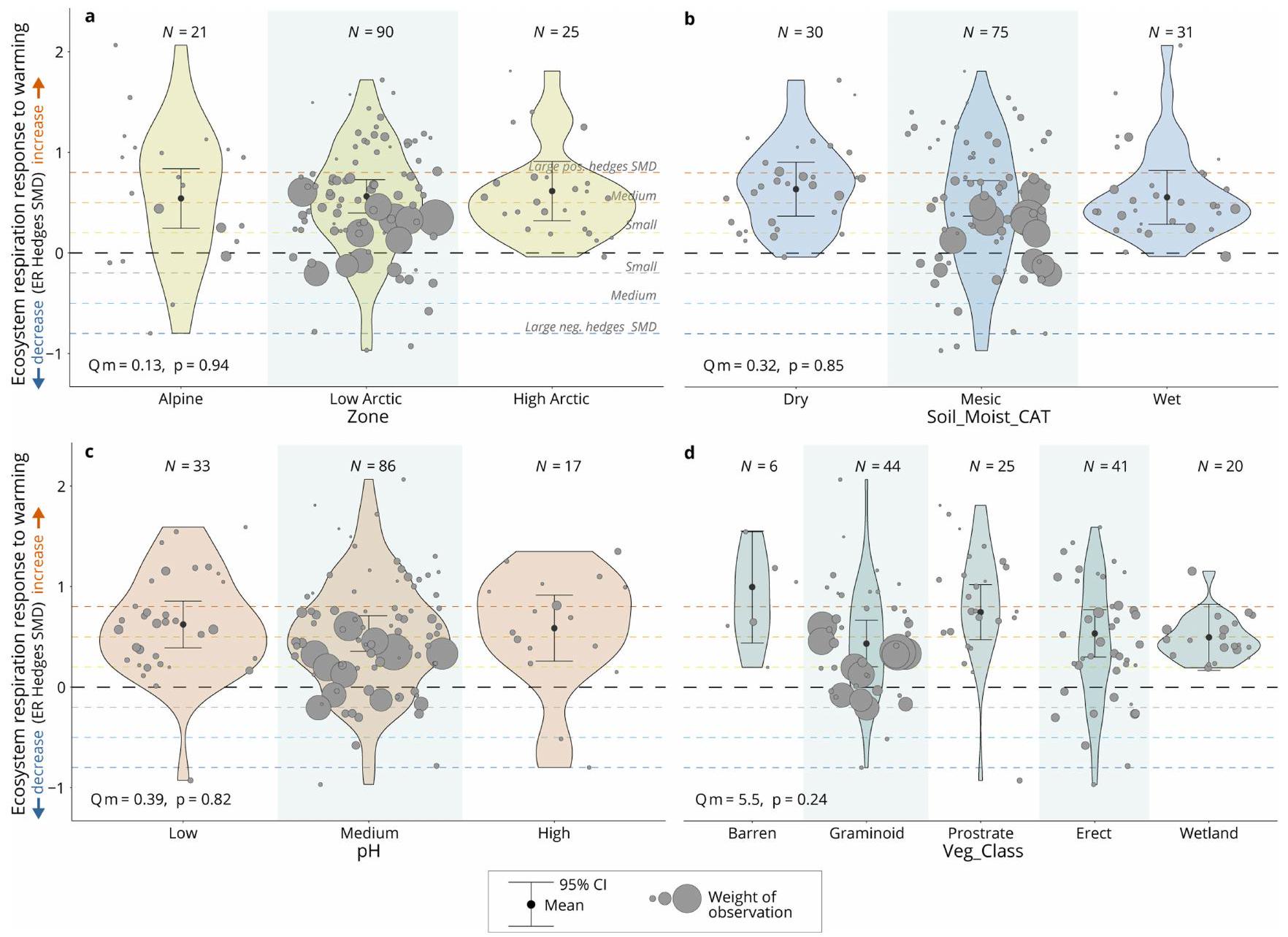
الأوزان. ضمن مخططات الكمان، تقديرات نموذج الميتا-تحليل أحادي العامل و
الزاوية السفلى اليسرى تظهر ‘Qm’ (قيمة Q لأهمية العوامل البيئية) و
مقالة
البيانات الموسعة الجدول 1 | التحليلات الميتا التي تقيم تأثيرات الاحترار التجريبي على التنفس البيئي (ER) والتنفس الذاتي (Ra) والتنفس غير الذاتي (Rh)
| استجابة | الانحدار [95%CI]* | قيمة Q | هيكل متعدد المستويات | مكون الانحدار الذاتي (داخلي | خارجي) | ن | نسبة التغيير
|
||||
|
|
|
تاو تربيع | رو | |||||||
| التحليل التلوي الرئيسي | ||||||||||
|
تحوطات SMD | |||||||||
|
|
731 | 0.00 | 0.00 | 0.19 | 0.92 | ١٣٦ | غير متوفر | |||
| نسبة المتوسطات (ROM) | ||||||||||
|
|
907 | 0.00 | 0.00 | 0.04 | 0.94 | ١٣٦ |
|
|||
| تحليل فرعي | ||||||||||
| تنفس النظام البيئي (ER) | تحوطات SMD | |||||||||
|
|
19 | 0.02 | 0.09 | 0.00 | 0.00 | ٩ | غير متوفر | |||
| روم
|
23 | |||||||||
| 0.03 | 0.00 | 0.00 | 0.35 | 9 |
|
|||||
| تحوطات SMD | ||||||||||
| التنفس التلقائي (Ra) |
|
26 | 0.00 | 0.20 | 0.00 | 0.00 | 9 | غير متوفر | ||
| روم | ||||||||||
|
|
27 | 0.07 | 0.13 | 0.00 | 0.00 | ٩ |
|
|||
| التنفس غير الذاتي (Rh) | تحوطات SMD
|
|||||||||
| 43 | 0.00 | 0.00 | 0.50 | 0.84 | 9 | غير متوفر | ||||
| 19 | 0.03 | 0.00 | 0.00 | 1.00 | 9 |
|
||||
| نتائج هامة مميزة بخط عريض: *
|
||||||||||
| سائق | المنحدر [95% فترة الثقة]* | التيسير الكمي | QM |
|
هيكل متعدد المستويات | مكون الانحدار الذاتي (داخلي | خارجي) | ن | |||||||||
| مدة التسخين | عبر فئات العمر (جميع البيانات) |
|
|
تاو^2 | رو | ١٣٦ | ||||||||||
| داخل فئات العمر | ||||||||||||||||
| [0-5 سنوات) | ||||||||||||||||
|
|
186 | 0.1 | 0.00 | 0.06 | 0.03 | 0.00 | 0.05 | 70 | ||||||||
|
|
63 | 63 | 0.45 | 0.23 | 0.00 | 0.00 | 1.00 | ٢٨ | ||||||||
|
|
٣٦ | ٥.٦ | 0.33 | 0.13 | 0.00 | 0.00 | 1.00 | 15 | ||||||||
| 0.00 [-0.13, 0.13] | 85 | 0.0 | 0.00 | 0.51 | 0.00 | 0.00 | 1.00 | 23 | ||||||||
| فئة العمر | أثر فئة العمر | ٤٦٨ | 5.2 | 0.03 | 0.00 | 0.00 | 0.20 | 0.93 | ١٣٦ | |||||||
| الأهمية من الصفر | ||||||||||||||||
|
||||||||||||||||
مقالة
البيانات الموسعة الجدول 3 | نماذج الميتا-تحليل التي تقيم تأثيرات العوامل البيئية (تأثيرات الاحترار غير المباشرة) على استجابة معدل التنفس للاحتباس الحراري
| سائق | الانحدار [95%CI]* | التيسير الكمي | QM |
|
هيكل متعدد المستويات | مكون الانحدار الذاتي (داخلي | خارجي) | ن | ||
| نوع |
|
|
|
رو | |||||
| المناخ | |||||||||
| درجة حرارة الهواء SMD |
|
٤٦٧ | 0.2 | 0.00 | 0.00 | 0.00 | 0.16 | 0.90 | 77 |
| درجة حرارة التربة SMD |
|
٥٣٦ | 2.0 | 0.02 | 0.00 | 0.00 | 0.12 | 0.95 | ١١٨ |
| رطوبة التربة SMD |
|
621 | 0.3 | 0.00 | 0.00 | 0.00 | 0.18 | 0.93 | 111 |
| التربة | |||||||||
| SMD SOM (دقيقة، منظمة) |
|
٨٠ | 0.4 | 0.01 | 0.49 | 0.00 | 0.00 | 1.00 | ٢٨ |
|
|
93 | 0.6 | 0.01 | 0.00 | 0.00 | 0.26 | 1.00 | 41 | |
| SMD TC (الحد الأدنى، المنظمة) |
|
٢٧٠ | 1.0 | 0.04 | 0.00 | 0.00 | 0.14 | 0.95 | 42 |
|
|
٣٧٩ | 0.1 | 0.00 | 0.00 | 0.00 | 0.12 | 0.94 | 65 | |
| SMD TN (الحد الأدنى، المنظم) |
|
186 | ٥.٤ | 0.22 | 0.00 | 0.00 | 0.11 | 0.95 | 42 |
|
|
341 | 3.7 | 0.08 | 0.00 | 0.00 | 0.11 | 0.95 | 65 | |
| SMD CN (الحد الأدنى، المنظم) |
|
185 | 3.8 | 0.12 | 0.00 | 0.00 | 0.13 | 0.96 | ٣٨ |
|
|
404 | 0.6 | 0.00 | 0.00 | 0.00 | 0.11 | 0.94 | 71 | |
| SMD pH (الحد الأدنى، العضوي) |
|
65 | ٤.٢ | 0.12 | 0.37 | 0.00 | 0.00 | 1.00 | 27 |
|
|
١١٥ | 0.2 | 0.00 | 0.00 | 0.00 | 0.18 | 0.99 | 53 | |
| كثافة الكتلة SMD |
|
231 | 3.2 | 0.27 | 0.00 | 0.00 | 0.12 | 0.94 | 31 |
| (دقيقة، منظمة) |
|
٣٧٩ | 1.3 | 0.03 | 0.00 | 0.00 | 0.31 | 0.98 | ٤٩ |
| نباتات | |||||||||
| نباتات الحشائش |
|
565 | 2.6 | 0.02 | 0.00 | 0.00 | 0.18 | 0.91 | 100 |
| فوربس SMD |
|
593 | 0.1 | 0.00 | 0.00 | 0.00 | 0.18 | 0.91 | 111 |
| شجيرات SMD Decid |
|
579 | 0.6 | 0.01 | 0.00 | 0.00 | 0.20 | 0.93 | 90 |
| شجيرات SMD إيفرجرين |
|
566 | 0.7 | 0.01 | 0.00 | 0.00 | 0.19 | 0.91 | ٨٨ |
| طحالب SMD |
|
585 | 1.6 | 0.02 | 0.00 | 0.00 | 0.20 | 0.91 | ٨٨ |
| الطحالب SMD |
|
518 | 0.7 | 0.01 | 0.00 | 0.00 | 0.20 | 0.93 | 78 |
| الكتلة الحيوية SMD |
|
222 | 2.9 | 0.06 | 0.00 | 0.00 | 0.12 | 0.95 | 61 |
| ارتفاع SMD Comm |
|
١٠٢ | 0.4 | 0.01 | 0.00 | 0.00 | 0.16 | 1.00 | 43 |
| ميكروبي | |||||||||
| وفرة البكتيريا SMD |
|
11 | 2.2 | 0.27 | 0.01 | 0.00 | 0.00 | 0.99 | 16 |
| وفرة الفطريات SMD |
|
14 | 0.2 | 0.03 | 0.04 | 0.00 | 0.00 | 0.94 | 16 |
| نسبة FB-SMD |
|
١٣ | 0.4 | 0.07 | 0.04 | 0.00 | 0.00 | 1.00 | 16 |
| سائق | المنحدر [95% فترة الثقة]* | التيسير الكمي | QM |
|
هيكل متعدد المستويات | مكون الانحدار الذاتي (داخلي | خارجي) | ن | ||
| نوع |
|
|
تاو تربيع | رو | |||||
| المناخ | |||||||||
| منطقة | غير مهم | 713 | 0.1 | 0.00 | 0.00 | 0.00 | 0.20 | 0.93 | ١٣٦ |
| مشكلة الجليد الدائم |
|
709 | 0.2 | 0.00 | 0.00 | 0.00 | 0.19 | 0.93 | ١٣٣ |
| درجة حرارة الهواء | 0.00 [-0.02, 0.03] | 479 | 0.1 | 0.00 | 0.00 | 0.00 | 0.16 | 0.90 | 77 |
| درجة حرارة التربة |
|
٥٠٠ | 1.2 | 0.01 | 0.00 | 0.00 | 0.12 | 0.94 | ١١٨ |
| التربة | |||||||||
| رطوبة التربة | 0.00 [0.00، 0.00] | 612 | 0.1 | 0.00 | 0.00 | 0.00 | 0.18 | 0.93 | 111 |
| فئة رطوبة التربة | غير مهم | 673 | 0.3 | 0.00 | 0.00 | 0.00 | 0.20 | 0.93 | ١٣٦ |
| SOM (حد أدنى، منظمة) |
|
79 | 0.2 | 0.01 | 0.46 | 0.00 | 0.00 | 1.00 | ٢٨ |
| 0.00 [-0.02, 0.01] | 96 | 0.8 | 0.02 | 0.00 | 0.00 | 0.27 | 1.00 | 41 | |
| رصيد الكربون في التربة | 0.00 [-0.00, 0.00] | 682 | 0.0 | 0.00 | 0.00 | 0.00 | 0.20 | 0.93 | 131 |
| TC (دقيقة، منظمة) |
|
263 | 1.9 | 0.08 | 0.00 | 0.00 | 0.11 | 0.92 | 42 |
| 0.00 [-0.01, 0.01] | ٣٥٧ | 0.1 | 0.00 | 0.00 | 0.00 | 0.17 | 0.96 | 70 | |
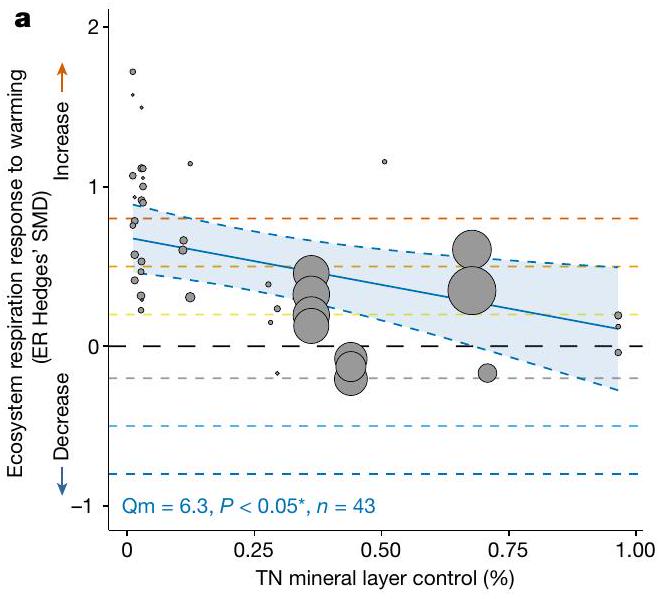
| TN (دقيقة، منظمة) |
|
302 | 6.3 | 0.27 | 0.00 | 0.00 | 0.08 | 0.91 | 43 |
| 0.00 [-0.26, 0.26] | 394 | 0.0 | 0.02 | 0.00 | 0.00 | 0.17 | 0.96 | 70 | |
| C:N (دقيقة، عضوي) |
|
244 | ٤.٧ | 0.22 | 0.00 | 0.00 | 0.13 | 0.96 | ٣٩ |
|
|
370 | 1.1 | 0.02 | 0.00 | 0.00 | 0.13 | 0.95 | 75 | |
| فئة pH | غير مهم | 666 | 0.4 | 0.00 | 0.00 | 0.00 | 0.20 | 0.93 | ١٣٦ |
| درجة الحموضة (الحد الأدنى، العضوي) |
|
82 | 0.2 | 0.01 | 0.46 | 0.00 | 0.00 | 1.00 | ٢٩ |
|
|
١٣٣ | 1.6 | 0.02 | 0.00 | 0.00 | 0.20 | 0.93 | ٥٥ | |
| الكثافة الظاهرية |
|
٢٨٠ | 0.1 | 0.01 | 0.00 | 0.00 | 0.16 | 0.95 | ٣٨ |
| (دقيقة، منظمة) |
|
٤٤٩ | 0.0 | 0.00 | 0.00 | 0.00 | 0.24 | 0.96 | 69 |
| نباتات | |||||||||
| فئة الغطاء النباتي | غير مهم | 624 | ٥.٥ | 0.04 | 0.00 | 0.00 | 0.19 | 0.92 | ١٣٦ |
| الإنتاج الأولي الصافي | 0.00 [-0.89, 0.88] | 721 | 0.0 | 0.00 | 0.00 | 0.00 | 0.20 | 0.93 | ١٣٦ |
من الأعلى إلى الأسفل: نتائج نموذج الميتا-تحليل لاختبار تأثيرات الظروف البيئية المحددة بالسياق على SMD حواف ER (‘اعتماديات السياق’). من اليسار إلى اليمين: نوع المحرك البيئي الذي تم التحقيق فيه؛ المحرك المحدد المستخدم كمتنبئ لاختبار التأثير على SMD حواف ER (‘المحرك’); نتائج النموذج لكل محرك، لاختبار ما إذا كانت SMD حواف ER تتأثر بشكل كبير بالمحرك (‘الانحدار’); قيمة ‘QE’ للتباين، بالإضافة إلى قيمة ‘QM’، التي تعكس أهمية المحرك و
- *تُبرز النتائج المهمة بالخط العريض:*
; **<0.01; **<0.001. الاتجاهات ( ) يتم الإشارة إليها بـ ().
من الأعلى إلى الأسفل: نتائج نموذج الميتا-تحليل التي تختبر تأثيرات التغيرات البيئية المحلية الناتجة عن الاحترار على قيم Hedges SMD الخاصة بـ ER (‘التأثيرات غير المباشرة للاحتباس الحراري’). من اليسار إلى اليمين: نوع المحرك البيئي الذي تم التحقيق فيه؛ المحرك المحدد المستخدم كمتنبئ لاختبار التأثير على قيم Hedges SMD الخاصة بـ ER (‘المحرك’)؛ نتائج النموذج لكل محرك، تختبر ما إذا كانت قيم Hedges SMD الخاصة بـ ER تتأثر بشكل كبير بالمحرك (‘الانحدار’); قيمة ‘QE’ للتباين، بالإضافة إلى قيمة ‘QM’، التي تعكس أهمية المحرك وزائف- (‘ ‘); ناتج هيكل النموذج متعدد المستويات (الممثل بـ و ) ومكون النموذج الذاتي الانحدار ( و rho)؛ وحجم العينة (‘N’ أو عدد مجموعات البيانات).
تُعرض نتائج الميتا-تحليل كمتوسط تقدير النموذج وفترات الثقة (‘الميل ( )’), مع سهم لأعلى/لأسفل ( ) مما يشير إلى أن القيم الأعلى للسائق قد انخفضت أو زادت بشكل كبير الاستجابات للاحتباس الحراري ومستوى الأهمية بناءً على -القيم. المحركات والنتائج الهامة بالخط العريض.
DOI: https://doi.org/10.1038/s41586-024-07274-7
PMID: https://pubmed.ncbi.nlm.nih.gov/38632407
Publication Date: 2024-04-17
Environmental drivers of increased ecosystem respiration in a warming tundra
Received: 29 November 2022
Accepted: 6 March 2024
Published online: 17 April 2024
Open access
S. L. Maes
I. H. J. Althuizen
C. T. Christiansen
P. Faubert
J. Guðmundsson
C. Hicks Pries
E. Kaarlejärvi
M. E. Marushchak
M. Nyberg
A. Petraglia
N. M. Schmidt
A. Tolvanen
J. T. Weedon
Abstract
Arctic and alpine tundra ecosystems are large reservoirs of organic carbon
Indirect warming effects

supply for microbes in waterlogged or anaerobic soils, whereas it can decrease respiration by promoting water limitation of microbial metabolism in dry or aerobic soils
Context-dependencies
differences in net primary productivity (NPP), litter quantity and quality and carbon-use efficiency.
Objective and study design


represented by the experiment ID in black (left) and ER measurement year (right) in a colour scale ranging from dark blue, light blue, orange to red which represents increasingly longer warming duration at the time of ER measurements. Experiments with more than 1 year of ER data are grouped. See Supplementary Tables 1, 2 and 4 for details on the datasets and SMD and CI values. The black dashed vertical line (SMD
are most active. We calculated the ER response as Hedges’

of within-study variance, with greater bubbles indicating greater weights. Qm values,
us to evaluate whether and how the ER response to warming varied over time (Extended Data Table 2). Furthermore, the high number and wide geographic, climatic and habitat range of the included tundra sites (Fig. 1c), allowed us to analyse the drivers of variability in the ER response using metaregression (Extended Data Tables 3 and 4). These drivers included (1) changes in abiotic and biotic conditions induced by the warming treatment (that is, climatic, soil, vegetation and microbial community properties) and (2) the abiotic and biotic environmental context (that is, climatic, soil and vegetation community properties; Supplementary Methods 1). These two types of drivers allowed us to assess how the variation in the ER response magnitude depended on, respectively, indirect effects of warming as well as on context-dependencies. The database does not include gross primary productivity (GPP) data, as its inclusion in ER datasets is challenging because of the light-dependency of photosynthesis and associated high spatiotemporal variability of GPP measurements (Methods). However, by focusing on ER and accounting for GPP indirectly through NPP and plant biomass, our analysis incorporates the response of plant growth to warming in the ecosystem carbon balance.
Experimental warming treatment
Increased ecosystem respiration

the overall slope across all years was non-significant, indicating that ER continued to be positive in locations with longer warming histories (Fig. 3a and Extended Data Table2). Although the ER response to experimental warming may thus falter around the end of the first decade of warming, our data do not provide evidence that ER responses to experimental warming wane in the longer term (that is, multidecadal duration).
Indirect warming effects
Context-dependent respiration responses

Global implications of plant-soil linkages
Our results demonstrate the importance of local soil conditions in mediating future warming impacts on respiration, specifically of the mineral soil layer deeper in the soil profile. Experimental warming can disproportionately stimulate both microbial and plant root activity, and thus ER, in deeper or mineral soil layers

shown with blue lines and blue shaded areas, respectively. Bottom left in each panel shows the Qm (
Spatial patterns

of the database across time and space will only further strengthen our understanding
The magnitude of the long-term land carbon-climate feedback critically depends on the balance between C uptake through changes in photosynthesis activity and C release through changes in
effects of warming on ER through changes in soil nutrient availability, are already apparent during the time-span of up to 25 years of experimental warming studies in the tundra.
Online content
- Schuur, E. A. G. et al. Permafrost and climate change: carbon cycle feedbacks from the warming arctic. Annu. Rev. Environ. Resour. 47, 343-371 (2022).
- Tarnocai, C. et al. Soil organic carbon pools in the northern circumpolar permafrost region. Glob. Biogeochem. Cycles https://doi.org/10.1029/2008GBO03327 (2009).
- Virkkala, A.-M. et al. Statistical upscaling of ecosystem
fluxes across the terrestrial tundra and boreal domain: regional patterns and uncertainties. Glob. Change Biol. 27, 4040-4059 (2021). - Karhu, K. Temperature sensitivity of soil respiration rates enhanced by microbial community response. Nature 513, 81-83 (2014).
- Rustad, L. E. et al. A meta-analysis of the response of soil respiration, net nitrogen mineralization and aboveground plant growth to experimental ecosystem warming. Oecologia 126, 543-562 (2001).
- Carey, J. C. et al. Temperature response of soil respiration largely unaltered with experimental warming. Proc. Natl Acad. Sci. USA 113, 13797-13802 (2016).
- Bouskill, N. J., Riley, W. J. & Grant, R. F. Alaskan carbon-climate feedbacks will be weaker than inferred from short-term experiments. Nat. Commun. 11, 5798 (2020).
- Schadel, C. et al. Divergent patterns of experimental and model-derived permafrost ecosystem carbon dynamics in response to Arctic warming. Environ. Res. Lett. 13, 105002 (2018).
- Lu, M. et al. Responses of ecosystem carbon cycle to experimental warming: a metaanalysis. Ecology 94, 726-738 (2013).
- Natali, S. M. et al. Large loss of
in winter observed across the northern permafrost region. Nat. Clim. Change 9, 852-857 (2019). - Oberbauer, S. F. et al. Tundra
fluxes in response to experimental warming across latitudinal and moisture gradients. Ecol. Monogr. 77, 221-238 (2007). - Schuur, E. A. G. et al. Vulnerability of permafrost carbon to climate change: Implications for the global carbon cycle. Bioscience 58, 701-714 (2008).
- Bond-Lamberty, B., Wang, C. & Gower, S. T. A global relationship between the heterotrophic and autotrophic components of soil respiration? Glob. Change Biol. 10, 1756-1766 (2004).
- Arctic Climate Change Update 2021: Key Trends and Impacts. Summary for Policy-makers (AMAP, 2021).
- Rantanen, M. et al. The Arctic has warmed nearly four times faster than the globe since 1979. Commun. Earth Environ. 3, 168 (2022).
- Bouskill, N. J., Riley, W. J. & Tang, J. Y. Meta-analysis of high-latitude nitrogen-addition and warming studies implies ecological mechanisms overlooked by land models. Biogeosciences 11, 6969-6983 (2014).
- van Gestel, N. et al. Predicting soil carbon loss with warming. Nature 554, E4-E5 (2018).
- Hicks Pries, C. E. et al. Decadal warming causes a consistent and persistent shift from heterotrophic to autotrophic respiration in contrasting permafrost ecosystems. Glob. Change Biol. 21, 4508-4519 (2015).
- Dorrepaal, E. et al. Carbon respiration from subsurface peat accelerated by climate warming in the subarctic. Nature 460, 616-619 (2009).
- Natali, S. M. et al. Effects of experimental warming of air, soil and permafrost on carbon balance in Alaskan tundra. Glob. Change Biol. 17, 1394-1407 (2011).
- Romero-Olivares, A. L., Allison, S. D. & Treseder, K. K. Soil microbes and their response to experimental warming over time: a meta-analysis of field studies. Soil Biol. Biochem. 107, 32-40 (2017).
- Wang, X. et al. Soil respiration under climate warming: differential response of heterotrophic and autotrophic respiration. Glob. Change Biol. 20, 3229-3237 (2014).
- Shaver, G. R. et al. Global warming and terrestrial ecosystems: a conceptual framework for analysis: ecosystem responses to global warming will be complex and varied. Bioscience 50, 871-882 (2000).
- Christiansen, C. T. et al. Enhanced summer warming reduces fungal decomposer diversity and litter mass loss more strongly in dry than in wet tundra. Glob. Change Biol. 23, 406-420 (2017).
- Scharn, R., Little, C. J., Bacon, C. D., Alatalo, J. M. & Antonelli, A. Decreased soil moisture due to warming drives phylogenetic diversity and community transitions in the tundra. Environ. Res. Lett. 16, 064031 (2021).
- Schuur, E. A. G. et al. Climate change and the permafrost carbon feedback. Nature 520, 171-179 (2015).
- Pold, G., Baillargeon, N., Lepe, A., Rastetter, E. B. & Sistla, S. A. Warming effects on arctic tundra biogeochemistry are limited but habitat-dependent: a meta-analysis. Ecosphere 12, e03777 (2021).
- Elmendorf, S. C. et al. Plot-scale evidence of tundra vegetation change and links to recent summer warming. Nat. Clim. Change 2, 453-457 (2012).
- Jeanbille, M. et al. Site-specific responses of fungal and bacterial abundances to experimental warming in litter and soil across Arctic and alpine tundra. Arct. Sci. https:// doi.org/10.1139/as-2020-0053 (2021).
- Bjorkman, A. D. et al. Plant functional trait change across a warming tundra biome. Nature 562, 57-62 (2018).
- Nyberg, M. & Hovenden, M. J. Warming increases soil respiration in a carbon-rich soil without changing microbial respiratory potential. Biogeosciences 17, 4405-4420 (2020).
- Keuper, F. et al. Carbon loss from northern circumpolar permafrost soils amplified by rhizosphere priming. Nat. Geosci. 13, 560-565 (2020).
- Shaver, A. G. R., Street, L. E., Rastetter, E. B., Van Wijk, M. T. & Williams, M. Functional convergence in regulation of net
flux in heterogeneous tundra landscapes in Alaska and Sweden. J. Ecol. 95, 802-817 (2007). - Conant, R. T. et al. Sensitivity of organic matter decomposition to warming varies with its quality. Glob. Change Biol. 14, 868-877 (2008).
- Bao, T., Zhu, R., Li, X., Ye, W. & Cheng, X. Effects of multiple environmental variables on tundra ecosystem respiration in maritime Antarctica. Sci Rep. 8, 12336 (2018).
- Stuart Chapin, F. III et al. The changing global carbon cycle: linking plant-soil carbon dynamics to global consequences. J. Ecol. 97, 840-850 (2009).
- Allison, S. D., Romero-Olivares, A. L., Lu, Y., Taylor, J. W. & Treseder, K. K. Temperature sensitivities of extracellular enzyme
and across thermal environments. Glob. Change Biol. 24, 2884-2897 (2018). - Davidson, E. A. & Janssens, I. A. Temperature sensitivity of soil carbon decomposition and feedbacks to climate change. Nature 440, 165-173 (2006).
- Bao, T., Jia, G. & Xu, X. Weakening greenhouse gas sink of pristine wetlands under warming. Nat. Clim. Change https://doi.org/10.1038/s41558-023-01637-0 (2023).
- Giesler, R., Esberg, C., Lagerström, A. & Graae, B. J. Phosphorus availability and microbial respiration across different tundra vegetation types. Biogeochemistry 108, 429-445 (2012).
- Mekonnen, Z. A., Riley, W. J. & Grant, R. F. 21st century tundra shrubification could enhance net carbon uptake of North America Arctic tundra under an RCP8.5 climate trajectory. Environ. Res. Lett. 13, 054029 (2018).
- Parker, T. C. et al. Rhizosphere allocation by canopy-forming species dominates soil
efflux in a subarctic landscape. New Phytol. 227, 1818-1830 (2020). - Sistla, S. A. et al. Long-term warming restructures Arctic tundra without changing net soil carbon storage. Nature 497, 615-617 (2013).
- Marion, G. M. et al. Open-top designs for manipulating field temperature in high-latitude ecosystems. Glob. Change Biol. 3, 20-32 (1997).
- Wu, Z., Dijkstra, P., Koch, G. W., Peñuelas, J. & Hungate, B. A. Responses of terrestrial ecosystems to temperature and precipitation change: a meta-analysis of experimental manipulation. Glob. Change Biol. 17, 927-942 (2011).
- Hedges, L. V. Distribution theory for Glass’s estimator of effect size and related estimators. J. Educ. Stat. 6, 107-128 (1981).
- Dijkstra, F. A., Carrillo, Y., Pendall, E. & Morgan, J. A. Rhizosphere priming: a nutrient perspective. Front. Microbiol. 4, 216 (2013).
- Feng, J. & Zhu, B. Global patterns and associated drivers of priming effect in response to nutrient addition. Soil Biol. Biochem. 153, 108118 (2021).
- Yin, H. et al. Enhanced root exudation stimulates soil nitrogen transformations in a subalpine coniferous forest under experimental warming. Glob. Change Biol. 19, 2158-2167 (2013).
- Jiang, Z., Liu, Y., Yang, J., Zhou, Z. & Gunina, A. Effects of nitrogen fertilization on the rhizosphere priming. Plant Soil 462, 489-503 (2021).
- Terrer, C. et al. Ecosystem responses to elevated
governed by plant-soil interactions and the cost of nitrogen acquisition. New Phytol. 217, 507-522 (2018). - IPCC: Summary for Policymakers. In Climate Change 2022: Impacts, Adaptation and Vulnerability (eds Pörtner, H.-O. et al.) (Cambridge Univ. Press, 2022).
- Blume-Werry, G., Milbau, A., Teuber, L. M., Johansson, M. & Dorrepaal, E. Dwelling in the deep-strongly increased root growth and rooting depth enhance plant interactions with thawing permafrost soil. New Phytol. 223, 1328-1339 (2019).
- Voigt, C. et al. Warming of subarctic tundra increases emissions of all three important greenhouse gases-carbon dioxide, methane and nitrous oxide. Glob. Change Biol. 23, 3121-3138 (2017).
- Li, F. et al. Warming effects on methane fluxes differ between two alpine grasslands with contrasting soil water status. Agric. For. Meteorol. 290, 107988 (2020).
- Björk, R. G. et al. Linkages between N turnover and plant community structure in a tundra landscape. Plant Soil 294, 247-261 (2007).
- Sullivan, B. W. & Hart, S. C. Evaluation of mechanisms controlling the priming of soil carbon along a substrate age gradient. Soil Biol. Biochem. 58, 293-301 (2013).
- Milcu, A., Heim, A., Ellis, R. J., Scheu, S. & Manning, P. Identification of general patterns of nutrient and labile carbon control on soil carbon dynamics across a successional gradient. Ecosystems 14, 710-719 (2011).
- Metcalfe, D. B. et al. Patchy field sampling biases understanding of climate change impacts across the Arctic. Nat. Ecol. Evol. 2, 1443-1448 (2018).
- Björkman, M. P. et al. Winter carbon dioxide effluxes from arctic ecosystems: an overview and comparison of methodologies. Global Biogeochem. Cycles https://doi.org/10.1029/ 2009 GB003667 (2010).
- Blok, D., Elberling, B. & Michelsen, A. Initial stages of tundra shrub litter decomposition maybe accelerated by deeper winter snow but slowed down by spring warming. Ecosystems 19, 155-169 (2016).
- Morgner, E., Elberling, B., Strebel, D. & Cooper, E. J. The importance of winter in annual ecosystem respiration in the High Arctic: effects of snow depth in two vegetation types. Polar Res. 29, 58-74 (2010).
- Qian, H., Joseph, R. & Zeng, N. Enhanced terrestrial carbon uptake in the northern high latitudes in the 21st century from the Coupled Carbon Cycle Climate Model Intercomparison Project model projections. Glob. Change Biol. 16, 641-656 (2010).
- Melillo, J. M. et al. Long-term pattern and magnitude of soil carbon feedback to the climate system in a warming world. Science 358, 101-105 (2017).
- Hicks Pries, C. E., Schuur, E. A. G., Natali, S. M. & Crummer, K. G. Old soil carbon losses increase with ecosystem respiration in experimentally thawed tundra. Nat. Clim. Change 6, 214-218 (2016).
- Hicks Pries, C. E., Schuur, E. A. G. & Crummer, K. G. Thawing permafrost increases old soil and autotrophic respiration in tundra: partitioning ecosystem respiration using
and {increment} C. Glob. Change Biol. 19, 649-661 (2013). - Wei, D. et al. Plant uptake of
outpaces losses from permafrost and plant respiration on the Tibetan Plateau. Proc. Natl Acad. Sci. USA 118, e2015283118 (2021).
© The Author(s) 2024
Australia.
Data collection
Effect size calculation
Temporal patterns
Environmental drivers ER
at plot level, that is, percentage cover per functional group (graminoids, forbs, deciduous shrubs, evergreen shrubs, mosses and lichens), aboveground biomass and mean community height, at plot level; and (4) the microbial community at plot level, that is, proxies for bacterial and fungal biomass and derived fungal:bacterial (FB) ratios (Extended Data Table 3). Although ER can be strongly correlated to GPP of the vegetation, our database does not include GPP data, as its inclusion and comparison across time and across several experiments is challenging because of the light-dependency of photosynthesis and associated high spatiotemporal variability of GPP measurements. However, both processes are (partly) driven by the activity of the vegetation, which in turn is driven by direct responses to their environment (for example, microclimate) as well as by, for example, its biomass and community composition. We therefore argue that to increase our mechanistic understanding of the underlying ecological drivers of ER response to warming, it is more meaningful to incorporate the role of the response of plant growth to warming for ecosystem respiration by including (changes in) plant biomass and community composition, as well as NPP (see section ‘Context-dependencies’) as potential drivers of ER, as we do here. Note that we refer to the soil total C and N concentration throughout the manuscript, because these drivers were measured on solid (dried) soil with CNS element analysers. Therefore, they refer to the sum of concentrations of both inorganic and organic compounds of C and N , even though TC most likely reflects primarily the SOC concentration because tundra soils contain limited-to-no inorganic C .
Statistical analyses
Modelling approach. Meta-analysis. To evaluate the effects of experimental warming on ER, we performed multivariate meta-analysis with the rma.mv function from the metafor R package
size and raw mean differences (that is, the difference in absolute values of the driver between treatment and control means) as secondary effect size because the latter provides estimates of absolute changes in the drivers (Supplementary Table 3).
Metaregression. Temporal patterns. To evaluate whether and how the ER response varied with duration of experimental warming, we performed two types of single-factor metaregression models. First, we tested whether duration (number of years of warming at time of ER measurements) influenced the magnitude of the ER response (ER Hedges’ SMD). These models were performed across experiments and both (1) across the four age classes of duration, to analyse overall long-term patterns of warming effects and (2) in each age class (
Indirect warming effects. To assess whether the variation in the ER response to warming was driven by indirect effects of warming on environmental conditions, we ran single-factor metaregression models using the Hedges’ SMD of the different environmental drivers (reflecting warming-induced changes in climate, soil, vegetation and microbial community conditions) as individual predictors and ER Hedges’ SMD as response (see previous section on ‘Indirect warming effects’; Fig. 4 and Extended Data Table 3).
Context-dependencies. To assess whether variation in the ER response to warming could be explained by context-specific environmental drivers related to climate, soil or vegetation, we performed single-factor metaregression models testing the influence of each of these drivers on ER Hedges’ SMD (see previous section on ‘Context-dependencies’; Fig. 5 and Extended Data Table 4).
Article
Supplementary analyses
Spatial upscaling
was used (see details below). The detailed procedure is outlined below and visualized in Supplementary Methods 2.
distribution as a mixture of the 100 prediction intervals. The standard deviation of the resulting distribution is given by:
Data availability
Code availability
68. Henry, G. H. R. & Molau, U. Tundra plants and climate change: the international tundra experiment (ITEX). Glob. Change Biol. 3, 1-9 (1997).
69. Rousseeuw, P. J. & Hubert, M. Robust statistics for outlier detection. WIREs Data Mining Knowl. Discov. 1, 73-79 (2011).
70. Borenstein, M., Hedges, L. V., Higgins, J. P. T. & Rothstein, H. R. Introduction to Meta-analysis (Wiley, 2009).
71. Walker, D. A. et al. The Circumpolar Arctic vegetation map. J. Veg. Sci. 16, 267-282 (2005).
72. R Core Team. R: A Language and Environment for Statistical Computing (R Foundation for Statistical Computing, 2021) .
73. Viechtbauer, W. Conducting meta-analyses in R with the metafor. J. Stat. Softw. 36, 1-48 (2010).
74. Hedges, L. V., Gurevitch, J. & Curtis, P. S. The meta-analysis of response ratios in experimental ecology. Ecology 80, 1150-1156 (1999).
75. Konstantopoulos, S. Fixed effects and variance components estimation in three-level meta-analysis. Res. Synth. Methods 2, 61-76 (2011).
76. Nakagawa, S. & Santos, E. S. A. Methodological issues and advances in biological meta-analysis. Evol. Ecol. 26, 1253-1274 (2012).
77. I shak, K. J., Platt, R. W., Joseph, L., Hanley, J. A. & Caro, J. J. Meta-analysis of longitudinal studies. Clin. Trials 4, 525-539 (2007).
78. Trikalinos, T. A. & Olkin, I. Meta-analysis of effect sizes reported at multiple time points: a multivariate approach. Clin. Trials 9, 610-620 (2012).
79. Signorini, M., Midolo, G., Cesco, S., Mimmo, T. & Borruso, L. A Matter of metals: copper but not cadmium affects the microbial alpha-diversity of soils and sediments-a metaanalysis. Microb. Ecol. https://doi.org/10.1007/s00248-022-02115-4 (2022).
80. Jenkins, D. G. et al. A meta-analysis of isolation by distance: relic or reference standard for landscape genetics? Ecography 33, 315-320 (2010).
81. Vaessen, T. et al. The association between self-reported stress and cardiovascular measures in daily life: a systematic review. PLoS ONE https://doi.org/10.1371/journal. pone. 0259557 (2021).
82. Raue, A. et al. Structural and practical identifiability analysis of partially observed dynamical models by exploiting the profile likelihood. Bioinformatics 25, 1923-1929 (2009).
83. Jennions, M. D. & Møller, A. P. Publication bias in ecology and evolution: an empirical assessment using the ‘trim and fill’ method. Biol. Rev. 77, 211-222 (2002).
84. Testolin, R., Attorre, F. & Jiménez-Alfaro, B. Global distribution and bioclimatic characterization of alpine biomes. Ecography 43, 779-788 (2020).
85. Poggio, L. et al. SoilGrids 2.0: producing soil information for the globe with quantified spatial uncertainty. SOIL 7, 217-240 (2021).
86. Warner, D. L., Bond-Lamberty, B. P., Jian, J., Stell, E. & Vargas, R. Global Gridded 1-km Annual Soil Respiration and Uncertainty Derived from SRDB V3 (ORNL DAAC, 2019); https://doi.org/10.3334/ORNLDAAC/1736.
87. Huntingford, C. et al. Implications of improved representations of plant respiration in a changing climate. Nat. Commun. 8, 1602 (2017).
88. Dataset for “Environmental drivers of increased ecosystem respiration in a warming tundra”. Zenodo https://doi.org/10.5281/zenodo. 10572479 (2024).
89. Scripts for “Environmental drivers of increasd ecosystem respiration in a warming tundra”. GitHub https://github.com/mjalava/tundraflux (2024).
Article
Competing interests The authors declare no competing interests.
Supplementary information The online version contains supplementary material available at https://doi.org/10.1038/s41586-024-07274-7.
Correspondence and requests for materials should be addressed to S. L. Maes.
Peer review information Nature thanks Jessica Gurevitch, Ivan Janssens and the other, anonymous, reviewer(s) for their contribution to the peer review of this work. Peer reviewer reports are available.
Reprints and permissions information is available at http://www.nature.com/reprints.


weights. Within the violin plots, single-factor metaregression model estimates and

bottom left shows the ‘Qm’ (Q-value of importance of the environmental drivers) and ‘
Article
Extended Data Table 1 | Meta-analyses evaluating effects of experimental warming on Ecosystem (ER), Autotrophic (Ra) and Heterotrophic Respiration (Rh)
| Response | Slope [95%CI]* | Q value | Multilevel structure | Autoregressive component (inner | outer) | N | Percentage change
|
||||
|
|
|
tau^2 | rho | |||||||
| Main meta-analysis | ||||||||||
|
Hedges SMD | |||||||||
|
|
731 | 0.00 | 0.00 | 0.19 | 0.92 | 136 | NA | |||
| Ratio of Means (ROM) | ||||||||||
|
|
907 | 0.00 | 0.00 | 0.04 | 0.94 | 136 |
|
|||
| Sub meta-analysis | ||||||||||
| Ecosystem Respiration (ER) | Hedges SMD | |||||||||
|
|
19 | 0.02 | 0.09 | 0.00 | 0.00 | 9 | NA | |||
| ROM
|
23 | |||||||||
| 0.03 | 0.00 | 0.00 | 0.35 | 9 |
|
|||||
| Hedges SMD | ||||||||||
| Autotrophic Respiration (Ra) |
|
26 | 0.00 | 0.20 | 0.00 | 0.00 | 9 | NA | ||
| ROM | ||||||||||
|
|
27 | 0.07 | 0.13 | 0.00 | 0.00 | 9 |
|
|||
| Heterotrophic Respiration (Rh) | Hedges SMD
|
|||||||||
| 43 | 0.00 | 0.00 | 0.50 | 0.84 | 9 | NA | ||||
| 19 | 0.03 | 0.00 | 0.00 | 1.00 | 9 |
|
||||
| “Significant results are highlighted in bold: *
|
||||||||||
| Driver | Slope [95%CI]* | QE | QM |
|
Multilevel structure | Autoregressive component (inner | outer) | N | |||||||||
| a Warming duration | Across age classes (all data) |
|
|
tau^2 | rho | 136 | ||||||||||
| Within age classes | ||||||||||||||||
| [0-5 years) | ||||||||||||||||
|
|
186 | 0.1 | 0.00 | 0.06 | 0.03 | 0.00 | 0.05 | 70 | ||||||||
|
|
63 | 63 | 0.45 | 0.23 | 0.00 | 0.00 | 1.00 | 28 | ||||||||
|
|
36 | 5.6 | 0.33 | 0.13 | 0.00 | 0.00 | 1.00 | 15 | ||||||||
| 0.00 [-0.13, 0.13] | 85 | 0.0 | 0.00 | 0.51 | 0.00 | 0.00 | 1.00 | 23 | ||||||||
| b Age class | Age class effect | 468 | 5.2 | 0.03 | 0.00 | 0.00 | 0.20 | 0.93 | 136 | |||||||
| Significance from zero | ||||||||||||||||
|
||||||||||||||||
Article
Extended Data Table 3 | Metaregression models evaluating effects of environmental drivers (indirect warming effects) on ER response to warming
| Driver | Slope [95%CI]* | QE | QM |
|
Multilevel structure | Autoregressive component (inner | outer) | N | ||
| Type |
|
|
|
rho | |||||
| Climate | |||||||||
| SMD Air temperature |
|
467 | 0.2 | 0.00 | 0.00 | 0.00 | 0.16 | 0.90 | 77 |
| SMD Soil temperature |
|
536 | 2.0 | 0.02 | 0.00 | 0.00 | 0.12 | 0.95 | 118 |
| SMD Soil moisture |
|
621 | 0.3 | 0.00 | 0.00 | 0.00 | 0.18 | 0.93 | 111 |
| Soil | |||||||||
| SMD SOM (min, org) |
|
80 | 0.4 | 0.01 | 0.49 | 0.00 | 0.00 | 1.00 | 28 |
|
|
93 | 0.6 | 0.01 | 0.00 | 0.00 | 0.26 | 1.00 | 41 | |
| SMD TC (min, org) |
|
270 | 1.0 | 0.04 | 0.00 | 0.00 | 0.14 | 0.95 | 42 |
|
|
379 | 0.1 | 0.00 | 0.00 | 0.00 | 0.12 | 0.94 | 65 | |
| SMD TN (min, org) |
|
186 | 5.4 | 0.22 | 0.00 | 0.00 | 0.11 | 0.95 | 42 |
|
|
341 | 3.7 | 0.08 | 0.00 | 0.00 | 0.11 | 0.95 | 65 | |
| SMD CN (min, org) |
|
185 | 3.8 | 0.12 | 0.00 | 0.00 | 0.13 | 0.96 | 38 |
|
|
404 | 0.6 | 0.00 | 0.00 | 0.00 | 0.11 | 0.94 | 71 | |
| SMD pH (min, org) |
|
65 | 4.2 | 0.12 | 0.37 | 0.00 | 0.00 | 1.00 | 27 |
|
|
115 | 0.2 | 0.00 | 0.00 | 0.00 | 0.18 | 0.99 | 53 | |
| SMD Bulk density |
|
231 | 3.2 | 0.27 | 0.00 | 0.00 | 0.12 | 0.94 | 31 |
| (min, org) |
|
379 | 1.3 | 0.03 | 0.00 | 0.00 | 0.31 | 0.98 | 49 |
| Vegetation | |||||||||
| SMD Graminoids |
|
565 | 2.6 | 0.02 | 0.00 | 0.00 | 0.18 | 0.91 | 100 |
| SMD Forbs |
|
593 | 0.1 | 0.00 | 0.00 | 0.00 | 0.18 | 0.91 | 111 |
| SMD Decid shrubs |
|
579 | 0.6 | 0.01 | 0.00 | 0.00 | 0.20 | 0.93 | 90 |
| SMD Evergr shrubs |
|
566 | 0.7 | 0.01 | 0.00 | 0.00 | 0.19 | 0.91 | 88 |
| SMD Mosses |
|
585 | 1.6 | 0.02 | 0.00 | 0.00 | 0.20 | 0.91 | 88 |
| SMD Lichens |
|
518 | 0.7 | 0.01 | 0.00 | 0.00 | 0.20 | 0.93 | 78 |
| SMD Biomass |
|
222 | 2.9 | 0.06 | 0.00 | 0.00 | 0.12 | 0.95 | 61 |
| SMD Comm height |
|
102 | 0.4 | 0.01 | 0.00 | 0.00 | 0.16 | 1.00 | 43 |
| Microbial | |||||||||
| SMD Bacterial Abund |
|
11 | 2.2 | 0.27 | 0.01 | 0.00 | 0.00 | 0.99 | 16 |
| SMD Fungal Abund |
|
14 | 0.2 | 0.03 | 0.04 | 0.00 | 0.00 | 0.94 | 16 |
| SMD FB-Ratio |
|
13 | 0.4 | 0.07 | 0.04 | 0.00 | 0.00 | 1.00 | 16 |
| Driver | Slope [95%CI]* | QE | QM |
|
Multilevel structure | Autoregressive component (inner | outer) | N | ||
| Type |
|
|
tau^2 | rho | |||||
| Climate | |||||||||
| Zone | Non-significant | 713 | 0.1 | 0.00 | 0.00 | 0.00 | 0.20 | 0.93 | 136 |
| Permafrost prob |
|
709 | 0.2 | 0.00 | 0.00 | 0.00 | 0.19 | 0.93 | 133 |
| Air temperature | 0.00 [-0.02, 0.03] | 479 | 0.1 | 0.00 | 0.00 | 0.00 | 0.16 | 0.90 | 77 |
| Soil temperature |
|
500 | 1.2 | 0.01 | 0.00 | 0.00 | 0.12 | 0.94 | 118 |
| Soil | |||||||||
| Soil moisture | 0.00 [0.00, 0.00] | 612 | 0.1 | 0.00 | 0.00 | 0.00 | 0.18 | 0.93 | 111 |
| Soil moisture class | Non-significant | 673 | 0.3 | 0.00 | 0.00 | 0.00 | 0.20 | 0.93 | 136 |
| SOM (min, org) |
|
79 | 0.2 | 0.01 | 0.46 | 0.00 | 0.00 | 1.00 | 28 |
| 0.00 [-0.02, 0.01] | 96 | 0.8 | 0.02 | 0.00 | 0.00 | 0.27 | 1.00 | 41 | |
| Soil Carbon stock | 0.00 [-0.00, 0.00] | 682 | 0.0 | 0.00 | 0.00 | 0.00 | 0.20 | 0.93 | 131 |
| TC (min, org) |
|
263 | 1.9 | 0.08 | 0.00 | 0.00 | 0.11 | 0.92 | 42 |
| 0.00 [-0.01, 0.01] | 357 | 0.1 | 0.00 | 0.00 | 0.00 | 0.17 | 0.96 | 70 | |
| TN (min, org) |
|
302 | 6.3 | 0.27 | 0.00 | 0.00 | 0.08 | 0.91 | 43 |
| 0.00 [-0.26, 0.26] | 394 | 0.0 | 0.02 | 0.00 | 0.00 | 0.17 | 0.96 | 70 | |
| C:N (min, org) |
|
244 | 4.7 | 0.22 | 0.00 | 0.00 | 0.13 | 0.96 | 39 |
|
|
370 | 1.1 | 0.02 | 0.00 | 0.00 | 0.13 | 0.95 | 75 | |
| pH class | Non-significant | 666 | 0.4 | 0.00 | 0.00 | 0.00 | 0.20 | 0.93 | 136 |
| pH (min, org) |
|
82 | 0.2 | 0.01 | 0.46 | 0.00 | 0.00 | 1.00 | 29 |
|
|
133 | 1.6 | 0.02 | 0.00 | 0.00 | 0.20 | 0.93 | 55 | |
| Bulk density |
|
280 | 0.1 | 0.01 | 0.00 | 0.00 | 0.16 | 0.95 | 38 |
| (min, org) |
|
449 | 0.0 | 0.00 | 0.00 | 0.00 | 0.24 | 0.96 | 69 |
| Vegetation | |||||||||
| Vegetation class | Non-significant | 624 | 5.5 | 0.04 | 0.00 | 0.00 | 0.19 | 0.92 | 136 |
| Net primary prod | 0.00 [-0.89, 0.88] | 721 | 0.0 | 0.00 | 0.00 | 0.00 | 0.20 | 0.93 | 136 |
From top to bottom: Metaregression model results testing the effects of context-specific environmental conditions on ER Hedges SMD (‘context-dependencies’). From left to right: The type of environmental driver investigated; the specific driver used as predictor to test the effect on ER Hedges SMDs (‘Driver’); the model results for each driver, testing whether ER Hedges SMDs are significantly influenced by the driver (‘Slope’); the ‘ QE ‘-value of heterogeneity, as well as the ‘ QM ‘-value, reflecting importance of the driver and the
- *Significant results are highlighted in bold: *
; **<0.01; **<0.001. Trends ( ) are indicated with ().
From top to bottom: Metaregression model results testing the effects of warming-induced changes in local environmental conditions on ER Hedges SMD (‘indirect warming effects’). From left to right: The type of environmental driver investigated; the specific driver used as predictor to test the effect on ER Hedges SMDs (‘Driver’); the model results for each driver, testing whether ER Hedges SMDs are significantly influenced by the driver (‘Slope’); the ‘ QE ‘-value of heterogeneity, as well as the ‘ QM ‘-value, reflecting importance of the driver and thepseudo- (‘ ‘); the output of the multilevel model structure (represented by and ) and of the autoregressive model component ( and rho); and the sample size (‘ N ‘ or number of datasets).
Metaregression results are presented as the mean model estimate andconfidence intervals (‘Slope ( )’), with a down/upward arrow ( ) indicating that higher values of the driver significantly decreased or increased responses to warming and the significance level based on -values. Significant drivers and results are in bold.
