DOI: https://doi.org/10.1038/s41586-023-06901-z
PMID: https://pubmed.ncbi.nlm.nih.gov/38267679
تاريخ النشر: 2024-01-24
الفولاذ الأخضر من الطين الأحمر من خلال اختزال البلازما الهيدروجينية المحايدة مناخياً
تم الاستلام: 14 سبتمبر 2022
تم القبول: 27 نوفمبر 2023
تم النشر عبر الإنترنت: 24 يناير 2024
الوصول المفتوح
الملخص
الطين الأحمر هو نفايات تنقية البوكسيت إلى الألومينا، وهي المادة الخام لإنتاج الألمنيوم
في المراجع 8-10 بشكل حتمي مزيدًا من المعالجة المسبقة للطين الأحمر من خلال التحميص، والطحن، والتكوير، والفصل المغناطيسي الرطب. تجعل هذه المعالجة المعقدة من تقييم الطين الأحمر ماليًا غير جذاب ولا تساعد أيضًا في القضاء على الانبعاثات المباشرة لـ
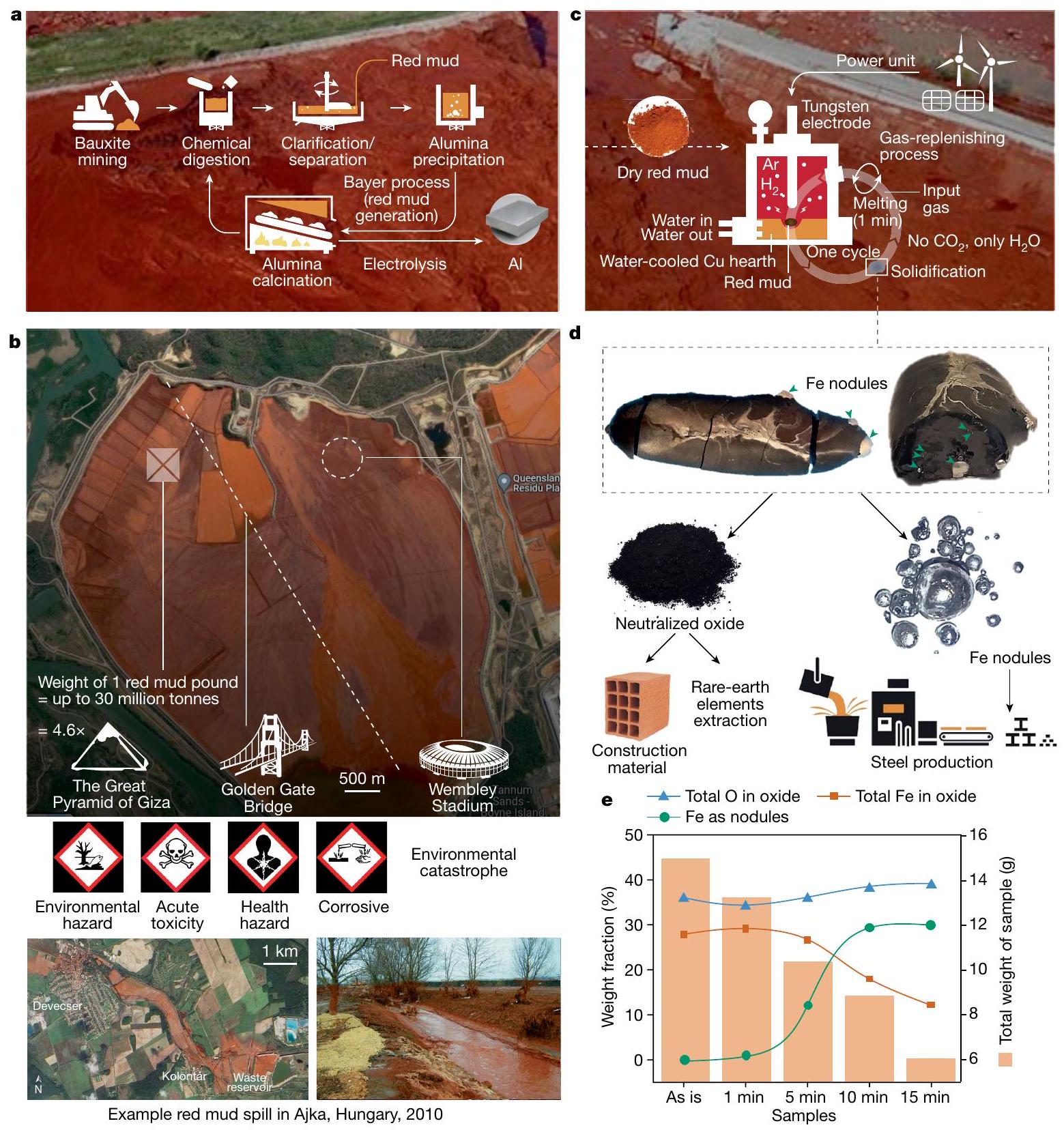
لإنتاج الفولاذ اللاحق دون أي تنقية إضافية؛ انظر الشكل 1د) يمكن استخراجها من الطين الأحمر في خطوة عملية واحدة.
بالتفصيل كيف يمكن أن يعمل الطين الأحمر كمادة خام مستدامة لصناعة الحديد الأخضر. يخلق هذا ارتباطًا مستدامًا بين أكبر مجموعتين من المعادن المنتجة بكميات كبيرة، الحديد والألمنيوم. يمكن أن يساعد هذا النهج في حل اثنين من أكثر المشاكل البيئية إلحاحًا في عصرنا، وهما، استخدام نفايات الطين الأحمر وإنتاج الحديد دون أي انبعاثات مباشرة
للتفاعلات الأكسدة والاختزال الأساسية التي تحدث خلال تقليل الطين الأحمر باستخدام البلازما الهيدروجينية (انظر أيضًا قسم المعلومات التكميلية ‘الحسابات الديناميكية الحرارية’). توفر نتائجنا أيضًا رؤى حول كيفية استغلال الطين الأحمر بشكل أفضل كمورد اقتصادي قابل للاستدامة، بدلاً من كونه خطرًا بيئيًا مكلفًا.
أداء التقليل واستخراج الحديد
تطور الكيمياء وانتقالات الطور
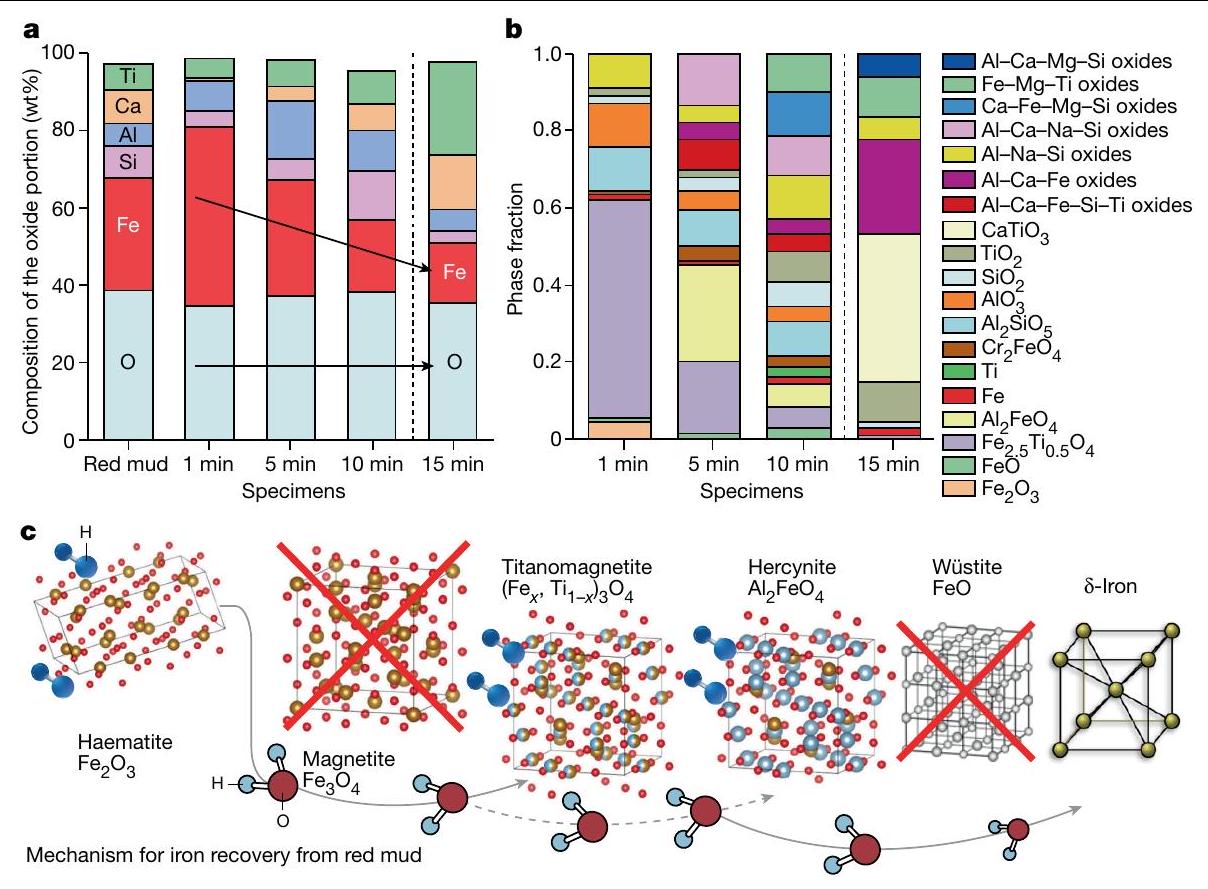
عينات الطين الأحمر المخفضة جزئيًا، تظهر التعقيد المختلف وتطور الأكاسيد مع زمن الاختزال. للتوضيح، يتم عرض الأكاسيد المعقدة الفردية التي تحتوي على أكثر من ثلاثة مكونات معدنية كمجموعات فردية. ج، الآلية الكيميائية لاستعادة الحديد من الطين الأحمر بواسطة اختزال البلازما الهيدروجينية.
يبقى مقدار صغير من الحديد داخل الجزء المؤكسد، مرتبطًا في الغالب داخل أكاسيد معقدة قائمة على التيتانيوم والكالسيوم.
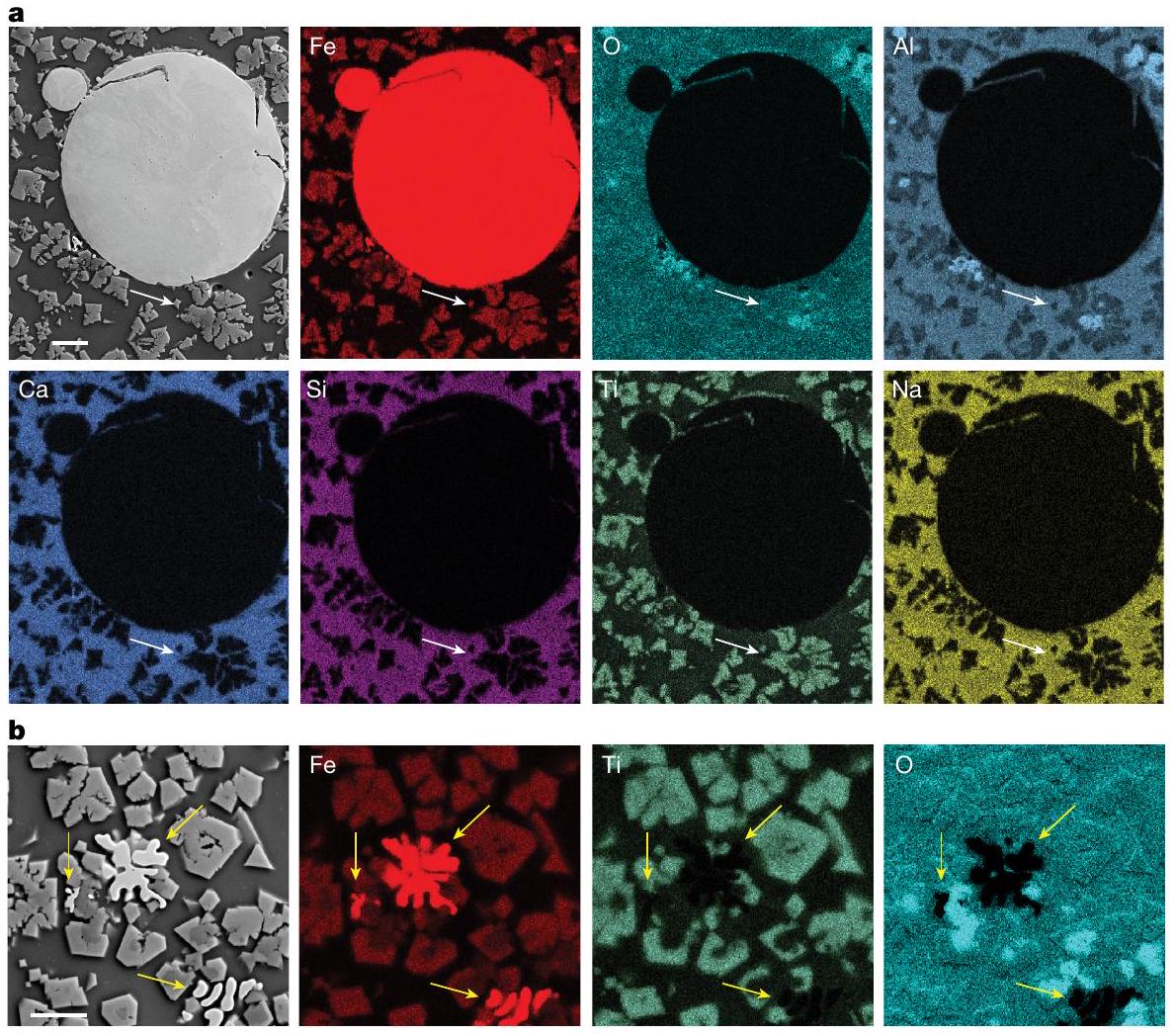
الهيكل الدقيق والتوزيع الكيميائي
الميكروهيكل لعينة تقليل 10 دقائق، المعروضة في الشكل 4، يظهر نظامًا ديناميكيًا مكانيًا أكثر بكثير كما تم الاستدلال عليه سابقًا من تحليل XRD. على عكس عينة 1 دقيقة، تُظهر العينة التي تم تقليلها لمدة 10 دقائق فرقًا كيميائيًا وميكروهيكليًا كبيرًا بين جزئيها العلوي والسفلي. يكشف التوصيف الميكروهيكلي والكيميائي المحلي، الذي تم إجراؤه في منطقة تقع على بعد حوالي 1 مم تحت السطح العلوي للعينة المتصلبة، عن استنفاد قوي للحديد وغنى عالي بـ
الميكروهيكل المقدم في الشكل 4أ يظهر عزلًا
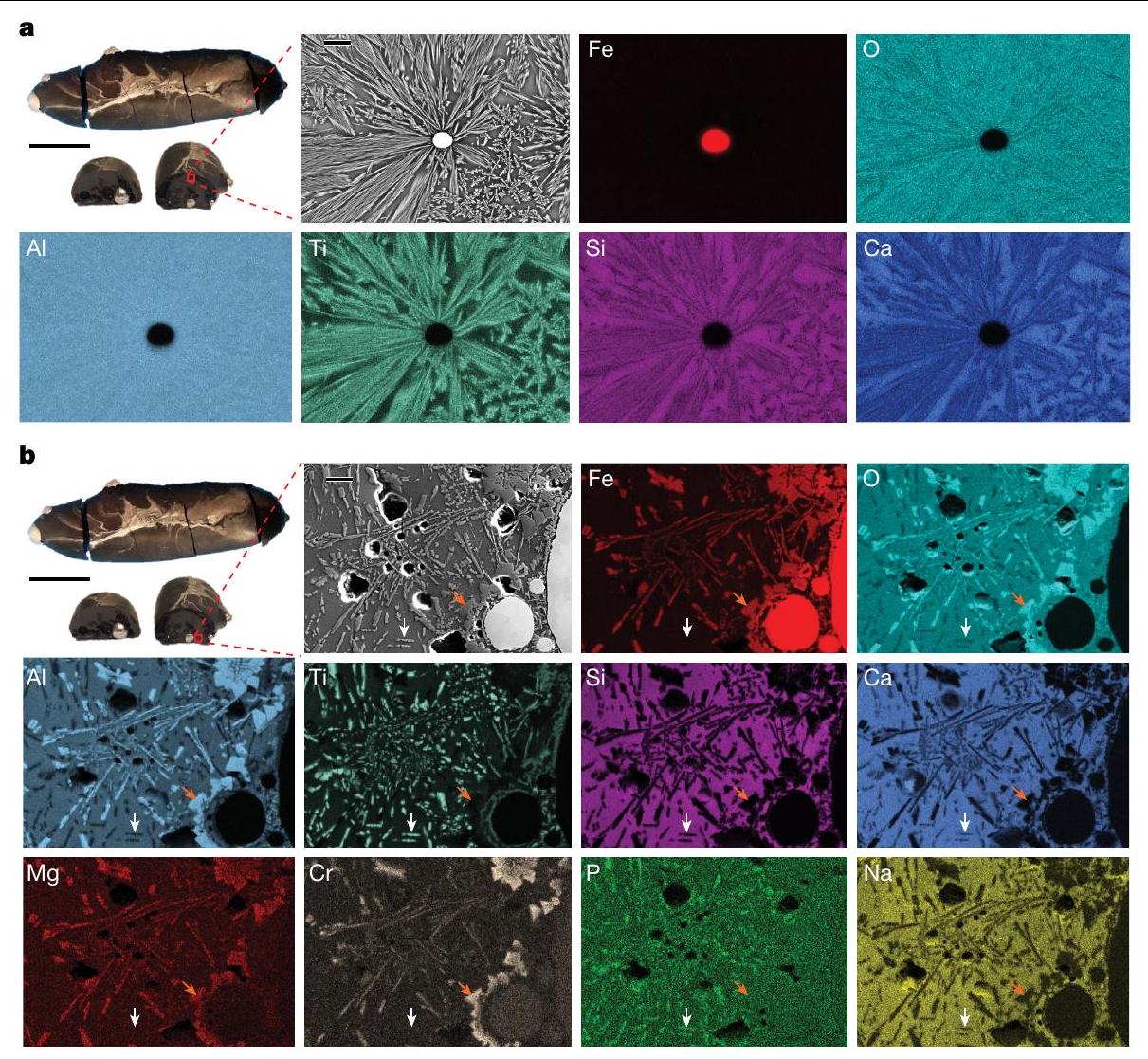
فعالية بلازما الهيدروجين
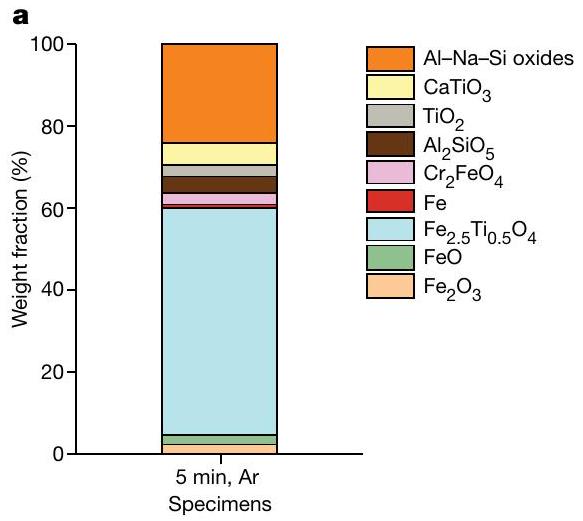
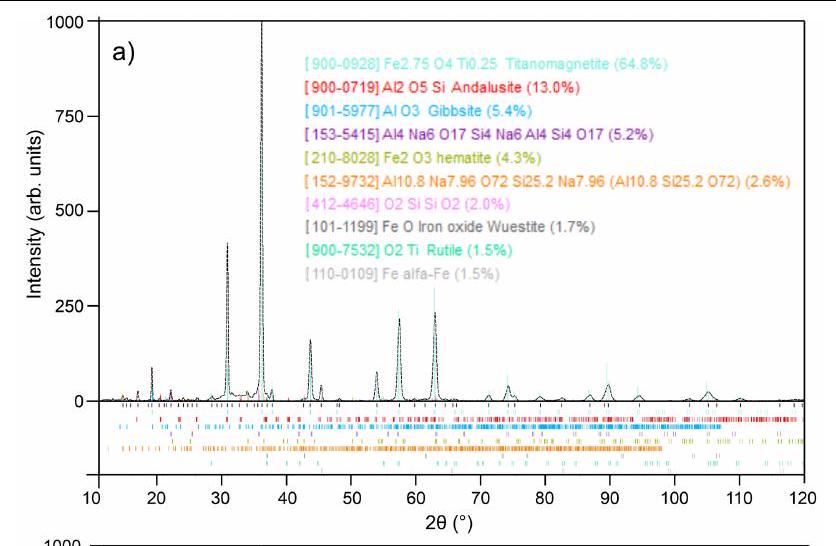
الذي يتم فيه التفاعل بالتزامن من خلال تقسيم كيميائي على مقياس ذري وفصل ماكرو مدفوع باللزوجة بين المعادن والأكاسيد الأخف. ومع ذلك، فإن التأثير الفعلي لتحلل الأكاسيد الحراري والتعرض للبلازما الحاملة للطاقة العالية بالتزامن مع غاز الهيدروجين المستخدم ليس مفصولاً. للحصول على رؤى حول هذا، تم إجراء تجارب إضافية من خلال معالجة 15 جرامًا من الطين الأحمر تحت بلازما الأرجون النقية (غير المختزلة) لمدة 5 دقائق باستخدام نفس الجهاز كما في السابق، كعملية مرجعية. تم طحن العينة المعالجة وفحصها باستخدام حيود الأشعة السينية (XRD) والنتائج التي تم الحصول عليها موضحة في الشكل 5a. تحتوي العينة المستخرجة بشكل أساسي على التيتانوماجنيت، والذي يرتبط بتحلل الهيماتيت الحراري (انظر الشكل 4 في البيانات الموسعة للعلاقة المقارنة لقمم XRD). من المدهش، على الرغم من عدم وجود عوامل مختزلة داخل بلازما الأرجون الخاملة، إلا أن العينة تظهر كميات ضئيلة من كل من FeO و Fe النقي. ومع ذلك، فإن محتوى الحديد الناتج عن مثل هذه البلازما الخاملة أقل بكثير (إجمالي الكمية هو فقط 0.27 جرام، حوالي 7% من إجمالي الحديد المتاح) مقارنةً بالكمية التي تم الحصول عليها بعد 5 دقائق من الاختزال باستخدام بلازما الهيدروجين المختزلة (1.34 جرام من الحديد النقي، حوالي
فقدان الكتلة) عند مقارنته مع العينة المقابلة المعالجة بالبلازما الهيدروجينية (
نقاش
تقليل الأكسيد في كل من الصلب
بالإضافة إلى استخراج الحديد النقي، يبدو أن عملية الاختزال المعتمدة على الهيدروجين والبلازما من الطين الأحمر هي أيضًا طريقة قابلة للتطبيق لاستخراج معادن أخرى، مثل التيتانيوم، كما تم تأكيده من خلال اكتشاف مجالات غنية بالتيتانيوم بحجم الميكرومتر (الأشكال 2ب و4ب). وهذا يوفر ليس فقط عملية معقولة لمعالجة نفايات التعدين وإجراء استخراج الحديد، ولكن أيضًا طريقة قابلة للتطبيق لاستخراج مجموعة متنوعة من المعادن الثمينة الأخرى في خطوة معالجة واحدة. وهذا يشير إلى أن العملية يمكن توسيعها وتعزيزها لتشمل استخراج مجموعة من المعادن النادرة مثل السكنديم واليوروبيوم، والتي يمكن الحصول عليها من خلال المعالجة اللاحقة للأجزاء المتبقية الغنية بالأكسيد باستخدام تقنيات استخراج راسخة.
لأن وجود الحديد ووجود مراحل غنية بالحديد يبدو أنه السبب الرئيسي لانخفاض كفاءة استخراج عناصر الأرض النادرة من خلال تقنيات الاستخراج التقليدية.

الطين الأحمر المعالج مع الهيدروجين المخفض (لمدة 1 دقيقة و 5 دقائق) والغاز الخامل الأرجون (5 دقائق) بالمقارنة مع التركيب الكيميائي المقابل للطين الأحمر الأصلي. تم تطبيع التركيب حسب كتلة كل عينة مقابلة لتصور فقدان الوزن للجزء الأكسيدي مع عملية الاختزال.
نوع المعالجات المسبقة أو اللاحقة، الكربون كمصدر للحرارة أو مختزل، تحميص المعادن
المحتوى عبر الإنترنت
- استطلاع يكشف أن الألمنيوم لا يزال أسرع المواد نمواً في صناعة السيارات، ويظهر كمعادن مفضلة للمركبات الكهربائية. جمعية الألمنيومhttps://www.aluminum.org/استطلاع-يكشف-أن-الألمنيوم-يظل-أسرع-المواد-النمو-في-صناعة-السيارات-المعدن-المفضل-الناشئ (2020).
- ليو، ي. ونايدو، ر. القيم المخفية في مخلفات البوكسيت (الطين الأحمر): استرداد المعادن. إدارة النفايات. 34، 2662-2673 (2014).
- أغراوال، س. ودهوان، ن. تقييم الطين الأحمر كمصدر متعدد المعادن – مراجعة. هندسة التعدين. 171، 107084 (2021).
- أرشامبو، م. وكاواترا، س. ك. الطين الأحمر: الأسس وطرق جديدة للاستخدام. مراجعة معالجة المعادن واستخراج المعادن. 42، 427-450 (2021).
- موكزا، إ.، زانغ، ل. ل. وزانغ، ن. استخدام الطين الأحمر في مواد قاعدة الطرق والتحتية: مراجعة. موارد. الحفاظ على. إعادة التدوير. 141، 187-199 (2019).
- سيلفيرا، ن. س. ج.، مارتينز، م. ل. ف.، بيزيرا، أ. س. س. وأراوجو، ف. ج. س. الطين الأحمر من صناعة الألمنيوم: الإنتاج، الخصائص، والتطبيقات البديلة في مواد البناء – مراجعة. الاستدامة 13، 12741 (2021).
- خدمة، ر. ف. إنذار أحمر. العلوم 369، 910-911 (2020).
- بوي، ب.، بهيرا، ب. ر. ومشرا، س. ر. في وقائع الندوة الدولية السادسة حول معالجة المعادن في درجات الحرارة العالية (تحرير جيانغ، ت. وآخرون) 19-26 (سبرينجر، 2015).
- بوي، ب.، راجبوت، ب. وميشرا، س. ر. في مؤتمر ICSOBA الدولي الخامس والثلاثين 565-574 (ICSOBA، 2017).
- بارهي، ب. ر. وآخرون. ترقية البوكسيت بواسطة الهيدروجين الجزيئي وبلازما الهيدروجين. المجلة الدولية للمعادن والسبائك والمواد 23، 1141-1149 (2016).
- تشين، ز.، زيلسترا، س.، فان دير ستيل، ج.، سيتسما، ج. ويانغ، ي. حركيات تفاعل التحلل الحراري لخام الهيماتيت. ISIJ Int. 60، 65-72 (2020).
- يانتي، إ. د. و براتيوي، إ. العلاقة بين السلوك الحراري للطين وتركيبها الكيميائي والمعدني: مراجعة. سلسلة مؤتمرات IOP. علوم الأرض والبيئة. 118، 12078 (2018).
- زينغ، هـ. وآخرون. التقدم في التطبيقات الصناعية للطين الأحمر مع التركيز على الصين. المعادن 10، 773 (2020).
- سامال، س. استخدام الطين الأحمر كمصدر لأيونات المعادن – مراجعة. المواد 14، 2211 (2021).
- سوزا فيلهو، إ. ر. وآخرون. الصلب المستدام من خلال تقليل خام الحديد باستخدام بلازما الهيدروجين: العملية، الحركيات، البنية المجهرية، الكيمياء. أكتا ماتير. 213، 116971 (2021).
- جيله، ب.، جيو، ف.، برايس، ج. د.، تورنيري، ب. ولي كليش، أ. تغييرات الطور والخصائص الديناميكية الحرارية لـ
بيانات الطيف، النمذجة الاهتزازية وبعض الرؤى حول الخصائص لـ بيروفسكايت. فيزي. كيم. معادن. 20، 159-170 (1993). - بيترسن، هـ. وآخرون. هياكل بلورية لموصلات البروتون المعتمدة على فوسفات التيتانيوم: حل الهيكل من أولياته وخصائص المواد. الكيمياء غير العضوية 61، 2379-2390 (2022).
- كيم، س. هـ. وآخرون. تأثير البنية المجهرية والكيمياء على المستوى الذري في الاختزال المباشر لخام الحديد باستخدام الهيدروجين في
. أكتا ماتر. 212، 116933 (2021). - هاياشي، س. وإيغوتشي، ي. تقليل الهيدروجين لجزيئات أكسيد الحديد السائلة في أنظمة نقل الغاز. ISIJ Int. 34، 555-561 (1994).
- بوريسوف، أ.، بيهريز، هـ. وهولtz، ف. تأثير التيتانيوم والفوسفور على نسبة الحديد الثلاثي/الثنائي في الصهارات السيليكاتية: دراسة تجريبية. مساهمات في المعادن والبتروغرافيا 166، 1577-1591 (2013).
- لي، و.، لي، ز.، وانغ، ن. وغو، هـ. الاستخراج الانتقائي لعناصر الأرض النادرة من الطين الأحمر باستخدام حمض الأكساليك وحمض الكبريتيك. مجلة هندسة الكيمياء البيئية 10، 108650 (2022).
- بورا، سي. آر.، بلانبين، ب.، بونتيكيس، ي.، بينيمانس، ك. وفان جيرفن، ت. استعادة العناصر الأرضية النادرة والمعادن القيمة الأخرى من مخلفات البوكسيت (الطين الأحمر): مراجعة. مجلة المعادن المستدامة 2، 365-386 (2016).
- غينتزمان، م. س.، بول، أ.، سيرانو، ج. وآدم، ج. فهم تسرب الإسكنديم من بقايا البوكسيت ذات الخلفيات الجيولوجية المختلفة باستخدام تصميم تجارب إحصائي. مجلة استكشاف الجيochem. 240، 107041 (2022).
- جاكوباش، إ. وآخرون. التقييم الاقتصادي لصناعة الصلب منخفض الكربون من خلال دمج التحليل الكهربائي والتقليل المباشر. ج. إنتاج نظيف. 328، 129502 (2021).
- جاياسانكار، ك. وآخرون. إنتاج الحديد الزهر من نفايات الطين الأحمر باستخدام تقنية البلازما الحرارية. المجلة الدولية لعلوم المعادن والسبائك والمواد 19، 679-684 (2012).
- وانغ، ل.، سون، ن.، تانغ، هـ. وسون، و. مراجعة حول الاستخدام الشامل للطين الأحمر وتحليل الآفاق. المعادن 9، 362 (2019).
- فالييف، د.، زينوفيف، د.، كوندراتيف، أ.، لوبيانوي، د. وبانكراتوف، د. الصهر الاختزالي للطين الأحمر المعادل لاستعادة الحديد وإنتاج الحديد الزهر المقاوم للحرارة. المعادن 10، 32 (2019).
- مايس، و. م. وآخرون. انتشار وتخفيف الملوثات الدقيقة downstream من فشل مستودع بقايا البوكسيت (الطين الأحمر) في أجيكا، هنغاريا. علوم البيئة والتكنولوجيا 45، 5147-5155 (2011).
© المؤلف(ون) 2024
مقالة
طرق
المادة
تجارب التخفيض
تQuantification الطور
توصيف البنية المجهرية
تقييمه
حسابات الديناميكا الحرارية
تقييم التكنولوجيا الاقتصادية
توفر البيانات
29. ريتفيلد، هـ. م. طريقة تحسين الملف للهياكل النووية والمغناطيسية. مجلة البلورات التطبيقية 2، 65-71 (1969).
30. تورايا، هـ. طريقة جديدة للتحليل الكمي للطور باستخدام حيود الأشعة السينية: اشتقاق مباشر لنسب الوزن من الكثافات المتكاملة الملاحظة والتركيبات الكيميائية للطور الفردي. مجلة البلورات التطبيقية 49، 1508-1516 (2016).
31. فوجل، ف.، أمان، م. ونيلسون، ل. ج. تقييم تقليل الهيدروجين المباشر لصناعة الصلب الخالية من الوقود الأحفوري. مجلة الإنتاج النظيف 203، 736-745 (2018).
32. بالومينوس، إ.، دافريس، ب.، بونتيكيس، ي. وبانياس، د. Mud2Metal: الدروس المستفادة في الطريق لتحقيق الاستخدام الكامل لبقايا البوكسيت من خلال التآزر الصناعي. مجلة المعادن المستدامة 3، 551-560 (2017).
33. بوررا، سي. آر.، بلانبين، ب.، بونتيكيس، ي.، بينيمانس، ك. وفان جيرفن، ت. صهر مخلفات البوكسيت (الطين الأحمر) بهدف استعادة الحديد والعناصر الأرضية النادرة الانتقائية. مجلة المعادن المستدامة 2، 28-37 (2016).
34. وو، ج.، تشانغ، ف.، لي، هـ.، فانغ، ب. & شو، إكس. تحضير وآلية تفاعل الطوب البسيط القائم على الطين الأحمر. مجلة جامعة ووهان للتكنولوجيا. علوم المواد. 25، 1001-1005 (2010).
35. مات ويب: مورد معلومات المواد عبر الإنترنت.https://www.matweb.com/.
36. ديغريمونت. استهلاك الطاقة لوحدة التجفيف.https://www.suezwaterhandbook.com/عمليات-وتقنيات/معالجة الحمأة المجففة/التجفيف/استهلاك الطاقة لوحدة التجفيف.
37. اقتصاديات التداول. خام الحديد 62% حديد.https://tradingeconomics.com/commodity/حديد خام 62.
38. تشانديو، أ. د. وآخرون. تحسين خام الحديد منخفض الدرجة من ديلباندي عن طريق التحميص بالاختزال. المعادن 13، 296 (2023).
كتب المخطوطة الأصلية. ناقش جميع المؤلفين النتائج بالتفصيل وساهموا في الكتابة والمراجعة والتحرير للمخطوطة المقدمة.
معلومات إضافية
يجب توجيه المراسلات والطلبات للحصول على المواد إلى إيسنالدِي ر. سوزا فيلهو. تشكر مجلة نيتشر ديران أبيليان، تشينا راو بورا، فينا ساهاجوالا والمراجعين الآخرين المجهولين على مساهمتهم في مراجعة هذه العمل. تتوفر معلومات إعادة الطبع والتصاريح علىhttp://www.nature.com/reprints.
مقالة
مقالة



مقالة
| عنصر |
|
|
|
|
|
|
|
|
|
|
|
٣٩.٠٥ | ٢٨.٩٦ | ٨.٥٥ | 8.54 | 6.73 | ٥.٩١ | 2.08 | 0.59 | 0.24 |
| عنصر | طين أحمر أولي | 1 دقيقة طين أحمر مخفض – بقايا أكسيد | 10 دقائق من الطين الأحمر المخفض – بقايا أكسيد | 10 دقائق من الطين الأحمر المخفض – كتل الحديد |
| 0 |
|
|
|
|
| حديد |
|
|
|
|
| ال |
|
|
|
|
| لا |
|
|
|
|
| كا |
|
|
|
|
| تي |
|
|
|
|
| نعم |
|
|
|
|
| S |
|
|
|
|
| مغنيسيوم |
|
|
|
|
| V |
|
|
|
|
| ك |
|
|
|
|
| P |
|
|
<0.002 | <0.002 |
| لا |
|
|
|
|
| Sc |
|
|
|
|
| ي |
|
|
|
|
- التركيب المستخرج على أساس النسبة المثالية (المحددة بواسطة بطاقات الفهرس المختارة) ونسبة المراحل المحددة باستخدام حيود الأشعة السينية (XRD).
DOI: https://doi.org/10.1038/s41586-023-06901-z
PMID: https://pubmed.ncbi.nlm.nih.gov/38267679
Publication Date: 2024-01-24
Green steel from red mud through climate-neutral hydrogen plasma reduction
Received: 14 September 2022
Accepted: 27 November 2023
Published online: 24 January 2024
Open access
Abstract
Red mud is the waste of bauxite refinement into alumina, the feedstock for aluminium production
in refs. 8-10 inevitably require further preprocessing of the red mud through roasting, milling, pelletizing and wet magnetic separation. Such complex processing makes the red mud valorization financially unattractive and also does not help eliminate the direct emissions of

for subsequent steel production without any further refinement; see Fig. 1d) can be extracted from red mud in one single process step.
in detail how red mud can serve as a sustainable feedstock for green ironmaking. This creates a sustainability nexus between the two largest mass-produced metal groups, iron and aluminium. This approach can help to solve two of the most pressing environmental problems of our time, namely, use of red mud waste and production of iron without any direct
of the underlying redox reactions occurring during the reduction of red mud with hydrogen plasma (see also Supplementary information section ‘Thermodynamic calculations’). Our findings also provide insights on how to better exploit red mud as an economically viable and sustainable resource, rather than a costly environmental hazard.
Reduction performance and Fe extraction
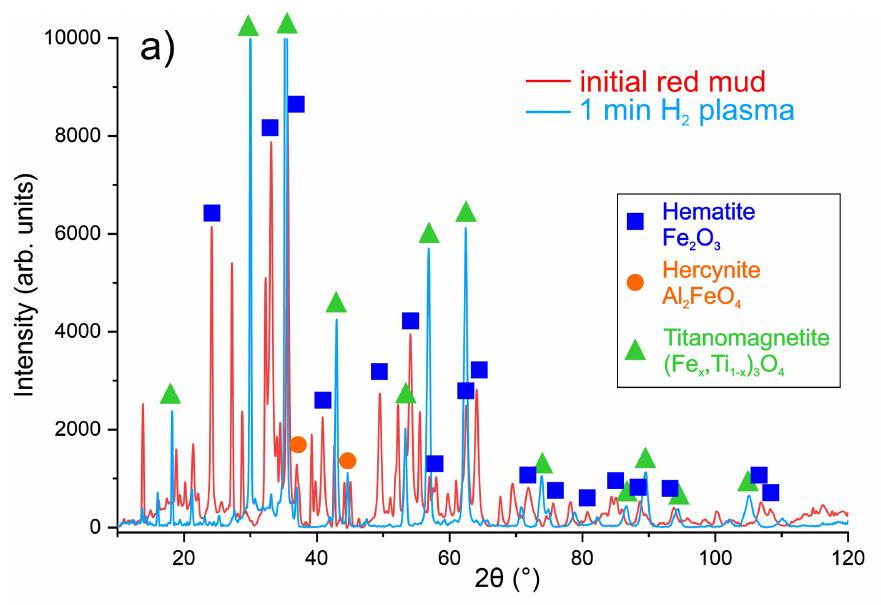
Chemistry evolution and phase transitions

partially reduced red mud samples, showing the differing complexity and evolution of oxides with reduction time. For clarity, the individual complex oxides with more than three metallic constituents are shown as individual groups.c, Chemical mechanism for iron recovery from red mud by means of hydrogen plasma reduction.
input, a small amount of Fe remains within the oxide portion, bound mostly within complex Ti-based and Ca-based oxides.
Microstructure and chemical partitioning
The microstructure of the 10 min reduced sample, presented in Fig.4, shows a much more spatially dynamic system as previously inferred from the XRD analysis. Unlike the 1 min sample, the 10 min specimen shows a considerable chemical and microstructural difference between its top and bottom portions. The microstructural and local chemical characterization, conducted in a region approximately 1 mm below the top surface of the solidified sample, reveals a strong depletion of Fe and high enrichment of
microstructure provided in Fig. 4a shows an isolated
Effectiveness of hydrogen plasma

which the reduction proceeds simultaneously through atomic-scale chemical partitioning and viscosity-driven macroseparation between metals and the lighter oxides. However, the actual effect of the thermal decomposition of the oxides and exposure to the high-energy-carrying plasma in correlation with the used hydrogen gas is not decoupled. To gain insight into this, further experiments were carried out by processing 15 g of red mud under pure (non-reducing) Ar plasma for 5 min and using the same apparatus as before, as a reference process. The processed sample was powdered and examined using XRD and the obtained results are shown in Fig. 5a. The sample obtained contains predominantly titanomagnetite, which is associated with the thermal decomposition of haematite (see Extended Data Fig. 4 for comparative relation of XRD peaks). Surprisingly, despite the lack of reducing agents within the inert Ar plasma, the sample shows minor amounts of both FeO and pure Fe . However, the content of Fe produced by such an inert plasma is considerably lower (the total amount is only 0.27 g , about 7% of the total available Fe) compared with the amount obtained after 5 min reduction with reducing hydrogen plasma ( 1.34 g of pure Fe , about
mass loss) when compared with the counterpart sample processed with hydrogen plasma (
Discussion

oxide reduction in both the solid
As well as pure Fe extraction, the presented hydrogen-plasma-based reduction process of red mud also seems to be a feasible method to extract other metals, such as Ti, confirmed by the discovery of micrometre-sized Ti-enriched domains (Figs. 2b and 4b). This provides not only a reasonable process for treating mining waste material and conducting Fe extraction but also a feasible method to extract a variety of other precious metals in a single processing step. This suggests that the process can be expanded and further valorized to include extraction of various rare-earth metals such as Sc and Y , which can be obtained through subsequent processing of the remaining oxide-enriched portions with well-established extraction techniques
because the presence of Fe and Fe -rich phases seem to be the main cause of the low efficiency of rare-earth-element extraction through conventional extraction techniques


the processed red mud with reducing hydrogen (for 1 min and 5 min ) and inert argon ( 5 min ) plasmas in comparison with the corresponding chemical composition of the original red mud. The composition was normalized by the mass of each corresponding specimen to visualize the weight loss of the oxide portion with the reduction process.
type of pre-treatments or post-treatments, carbon as heat source or reductant, mineral roasting
Online content
- Survey reveals aluminum remains fastest growing automotive material, emerging as a preferred metal for electric vehicles. The Aluminum Association https://www.aluminum. org/survey-reveals-aluminum-remains-fastest-growing-automotive-material-emerging-preferred-metal (2020).
- Liu, Y. & Naidu, R. Hidden values in bauxite residue (red mud): recovery of metals. Waste Manag. 34, 2662-2673 (2014).
- Agrawal, S. & Dhawan, N. Evaluation of red mud as a polymetallic source – a review. Miner. Eng. 171, 107084 (2021).
- Archambo, M. & Kawatra, S. K. Red mud: fundamentals and new avenues for utilization. Miner. Process. Extr. Metall. Rev. 42, 427-450 (2021).
- Mukiza, E., Zhang, L. L. & Zhang, N. Utilization of red mud in road base and subgrade materials: a review. Resour. Conserv. Recycl. 141, 187-199 (2019).
- Silveira, N. C. G., Martins, M. L. F., Bezerra, A. C. S. & Araújo, F. G. S. Red mud from the aluminium industry: production, characteristics, and alternative applications in construction materials-a review. Sustainability 13, 12741 (2021).
- Service, R. F. Red alert. Science 369, 910-911 (2020).
- Bhoi, B., Behera, P. R. & Mishra, C. R. in Proc. 6th International Symposium on HighTemperature Metallurgical Processing (eds Jiang, T. et al.) 19-26 (Springer, 2015).
- Bhoi, B., Rajput, P. & Mishra, C. R. in Proc. 35th International ICSOBA Conference 565-574 (ICSOBA, 2017).
- Parhi, B. R. et al. Upgradation of bauxite by molecular hydrogen and hydrogen plasma. Int. J. Miner. Metall. Mater. 23, 1141-1149 (2016).
- Chen, Z., Zeilstra, C., van der Stel, J., Sietsma, J. & Yang, Y. Thermal decomposition reaction kinetics of hematite ore. ISIJ Int. 60, 65-72 (2020).
- Yanti, E. D. & Pratiwi, I. Correlation between thermal behavior of clays and their chemical and mineralogical composition: a review. IOP Conf. Ser. Earth Environ. Sci. 118, 12078 (2018).
- Zeng, H. et al. Progress on the industrial applications of red mud with a focus on China. Minerals 10, 773 (2020).
- Samal, S. Utilization of red mud as a source for metal ions-a review. Materials 14, 2211 (2021).
- Souza Filho, I. R. et al. Sustainable steel through hydrogen plasma reduction of iron ore: process, kinetics, microstructure, chemistry. Acta Mater. 213, 116971 (2021).
- Gillet, P., Guyot, F., Price, G. D., Tournerie, B. & Le Cleach, A. Phase changes and thermodynamic properties of
. Spectroscopic data, vibrational modelling and some insights on the properties of perovskite. Phys. Chem. Miner. 20, 159-170 (1993). - Petersen, H. et al. Crystal structures of two titanium phosphate-based proton conductors: ab initio structure solution and materials properties. Inorg. Chem. 61, 2379-2390 (2022).
- Kim, S. H. et al. Influence of microstructure and atomic-scale chemistry on the direct reduction of iron ore with hydrogen at
. Acta Mater. 212, 116933 (2021). - Hayashi, S. & Iguchi, Y. Hydrogen reduction of liquid iron oxide fines in gas-conveyed systems. ISIJ Int. 34, 555-561 (1994).
- Borisov, A., Behrens, H. & Holtz, F. The effect of titanium and phosphorus on ferric/ferrous ratio in silicate melts: an experimental study. Contrib. Mineral. Petrol. 166, 1577-1591 (2013).
- Li, W., Li, Z., Wang, N. & Gu, H. Selective extraction of rare earth elements from red mud using oxalic and sulfuric acids. J. Environ. Chem. Eng. 10, 108650 (2022).
- Borra, C. R., Blanpain, B., Pontikes, Y., Binnemans, K. & Van Gerven, T. Recovery of rare earths and other valuable metals from bauxite residue (red mud): a review. J. Sustain. Metall. 2, 365-386 (2016).
- Gentzmann, M. C., Paul, A., Serrano, J. & Adam, C. Understanding scandium leaching from bauxite residues of different geological backgrounds using statistical design of experiments. J. Geochem. Explor. 240, 107041 (2022).
- Jacobasch, E. et al. Economic evaluation of low-carbon steelmaking via coupling of electrolysis and direct reduction. J. Clean. Prod. 328, 129502 (2021).
- Jayasankar, K. et al. Production of pig iron from red mud waste fines using thermal plasma technology. Int. J. Miner. Metall. Mater. 19, 679-684 (2012).
- Wang, L., Sun, N., Tang, H. & Sun, W. A review on comprehensive utilization of red mud and prospect analysis. Minerals 9, 362 (2019).
- Valeev, D., Zinoveev, D., Kondratiev, A., Lubyanoi, D. & Pankratov, D. Reductive smelting of neutralized red mud for iron recovery and produced pig iron for heat-resistant castings. Metals 10, 32 (2019).
- Mayes, W. M. et al. Dispersal and attenuation of trace contaminants downstream of the Ajka bauxite residue (red mud) depository failure, Hungary. Environ. Sci. Technol. 45, 5147-5155 (2011).
© The Author(s) 2024
Article
Methods
Material
Reduction experiments
Phase quantification
Microstructural characterization
pHevaluation
Thermodynamic calculations
Technoeconomic assessment
Data availability
29. Rietveld, H. M. A profile refinement method for nuclear and magnetic structures. J. Appl. Crystallogr. 2, 65-71 (1969).
30. Toraya, H. A new method for quantitative phase analysis using X-ray powder diffraction: direct derivation of weight fractions from observed integrated intensities and chemical compositions of individual phases. J. Appl. Crystallogr. 49, 1508-1516 (2016).
31. Vogl, V., Åhman, M. & Nilsson, L. J. Assessment of hydrogen direct reduction for fossil-free steelmaking. J. Clean. Prod. 203, 736-745 (2018).
32. Balomenos, E., Davris, P., Pontikes, Y. & Panias, D. Mud2Metal: lessons learned on the path for complete utilization of bauxite residue through industrial symbiosis. J. Sustain. Metall. 3, 551-560 (2017).
33. Borra, C. R., Blanpain, B., Pontikes, Y., Binnemans, K. & Van Gerven, T. Smelting of bauxite residue (red mud) in view of iron and selective rare earths recovery. J. Sustain. Metall. 2, 28-37 (2016).
34. Wu, J., Zhang, F., Li, H., Fang, B. & Xu, X. Preparation and reaction mechanism of red mud based ceramic simple bricks. J. Wuhan Univ. Technol. Mater. Sci. Ed. 25, 1001-1005 (2010).
35. MatWeb: Online Materials Information Resource. https://www.matweb.com/.
36. Degremont. Drying unit energy consumption. https://www.suezwaterhandbook.com/ processes-and-technologies/dewatered-sludge-treatment/drying/drying-unit-energyconsumption.
37. Trading Economics. Iron Ore 62% FE. https://tradingeconomics.com/commodity/ ironore62.
38. Chandio, A. D. et al. Beneficiation of low-grade dilband iron ore by reduction roasting. Metals 13, 296 (2023).
wrote the original manuscript. All authors discussed the results in detail and contributed to the writing, revision and editing of the submitted manuscript.
Additional information
Correspondence and requests for materials should be addressed to Isnaldi R. Souza Filho. Peer review information Nature thanks Diran Apelian, Chenna Rao Borra, Veena Sahajwalla and the other, anonymous, reviewer(s) for their contribution to the peer review of this work. Reprints and permissions information is available at http://www.nature.com/reprints.
Article


Article





Article
| Element |
|
|
|
|
|
|
|
|
|
|
|
39.05 | 28.96 | 8.55 | 8.54 | 6.73 | 5.91 | 2.08 | 0.59 | 0.24 |
| Element | Initial red mud | 1 min reduced red mud – oxide residual | 10 min reduced red mud – oxide residual | 10 min reduced red mud – Fe nodules |
| 0 |
|
|
|
|
| Fe |
|
|
|
|
| Al |
|
|
|
|
| Na |
|
|
|
|
| Ca |
|
|
|
|
| Ti |
|
|
|
|
| Si |
|
|
|
|
| S |
|
|
|
|
| Mg |
|
|
|
|
| V |
|
|
|
|
| K |
|
|
|
|
| P |
|
|
<0.002 | <0.002 |
| La |
|
|
|
|
| Sc |
|
|
|
|
| Y |
|
|
|
|
- Composition extracted on the basis of the ideal stoichiometry (set by the selected index cards) and fraction of the determined phases with XRD.
