DOI: https://doi.org/10.1016/j.envint.2024.108751
PMID: https://pubmed.ncbi.nlm.nih.gov/38761430
تاريخ النشر: 2024-05-14
الميكروبلاستيك في دم الإنسان: أنواع البوليمرات، التركيزات والتوصيف باستخدام μFTIR
معلومات المقال
الكلمات المفتاحية:
دم الإنسان
إنسان
فثالات
الملخص
الميكروبلاستيك (MPs) هو جزء من الحياة اليومية، وأصبح الآن موجودًا في جميع أنحاء البيئة. والأهم من ذلك، لم يتم العثور على الميكروبلاستيك فقط في البيئة، ولكن أيضًا داخل أجسام البشر، بما في ذلك الدم. هدفنا هو تقديم معلومات جديدة حول مجموعة أنواع البوليمر للميكروبلاستيك الموجودة، بالإضافة إلى خصائص الحجم والشكل، في دم كامل من 20 متطوعًا صحيًا. تم تحديد أربعة وعشرون نوعًا من البوليمر من 18 من
1. المقدمة
الكشف في عينات البراز (شوابل وآخرون، 2019) وأنسجة رئة الجثث (أماتو-لورينكو وآخرون، 2021)، إلى عينات المرضى التي تم تحليلها مؤخرًا من الرئة (جينر وآخرون، 2022)، القولون (إبراهيم وآخرون، 2021)، الكبد (هورفاتيتس وآخرون، 2022)، المشيمة (راجوزا وآخرون، 2021)، حليب الثدي (راجوزا وآخرون، 2022)، الوريد (روتشيل وآخرون، 2023)، والخصية/الحيوانات المنوية (تشاو وآخرون، 2023). نظرًا لهذا المجال المتوسع من البحث، فإن أحد الطرق المحتملة لانتقال الجسيمات الدقيقة عبر الجسم وتراكمها في أنسجة وأعضاء الإنسان المختلفة هو عبر مجرى الدم (دونغ وآخرون، 2023). من المرجح أن تكون الطريقة الأكثر احتمالًا لدخول الدم هي عبر النظام الغذائي/الأمعاء، ولكن هناك بالتأكيد طريقتان إضافيتان للتعرض: الجسيمات الدقيقة المستنشقة التي تعبر الرئة إلى مجرى الدم (جينر وآخرون، 2022) أو أثناء الجراحة مباشرة إلى مجرى الدم كترسبات هوائية أو من تقشر المعدات الطبية (فيلد وآخرون، 2022).
2. الطرق
2.1. الحصول على عينة دم
2.2. هضم عينة الدم وترشيحها
2.3. التوصيف الكيميائي للجسيمات باستخدام
2.4. تدابير ضمان الجودة والرقابة
2.5. التحليل الإحصائي
3. النتائج
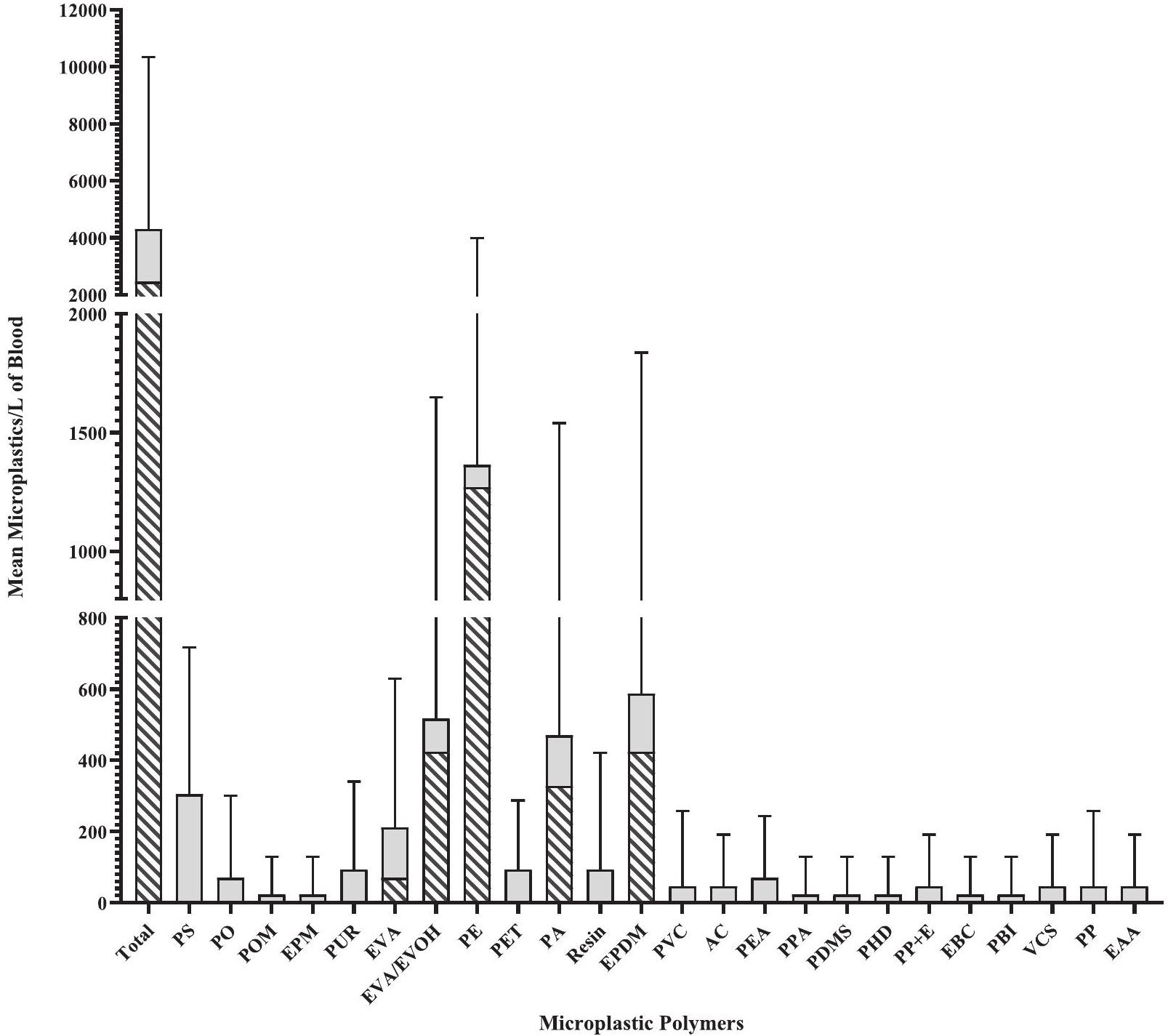
3.1. تركيزات الجسيمات الدقيقة المكتشفة في عينات دم الإنسان
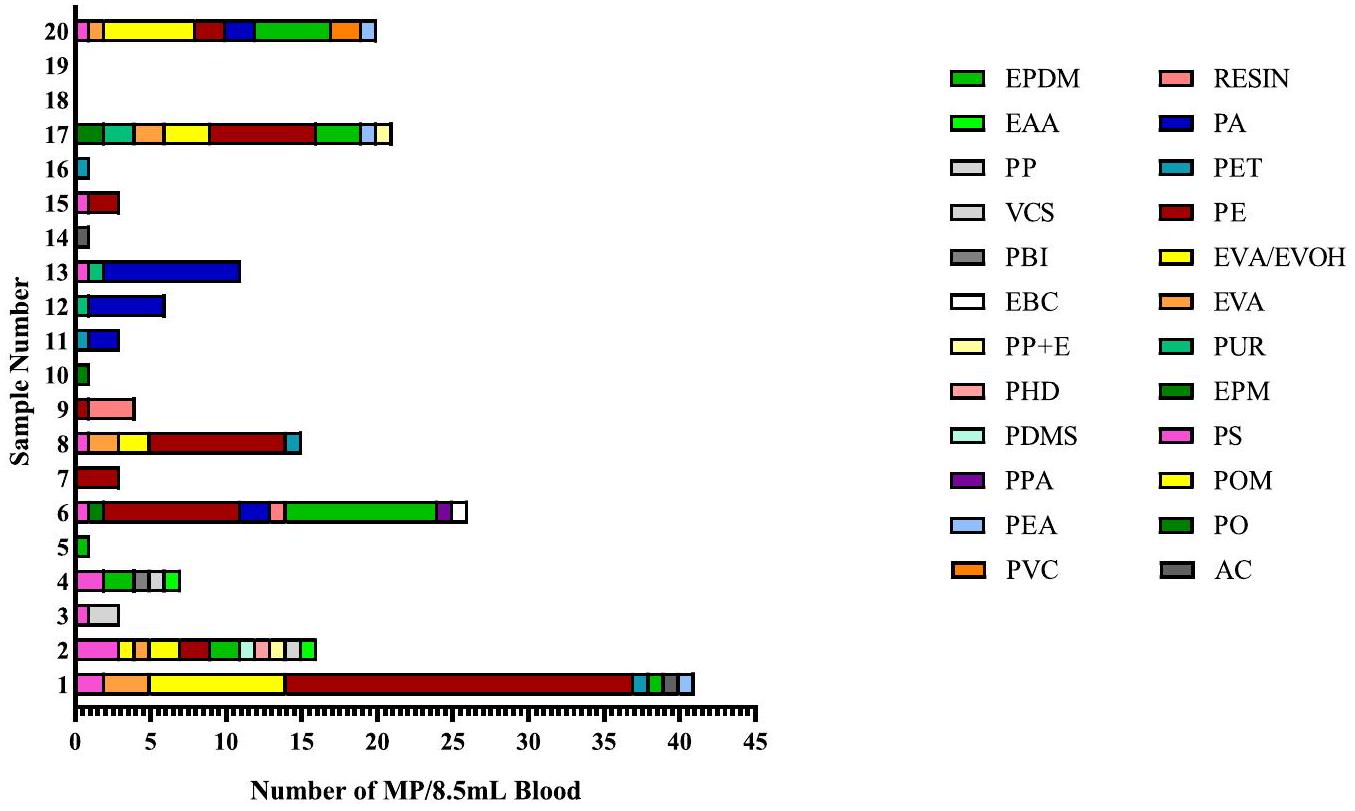
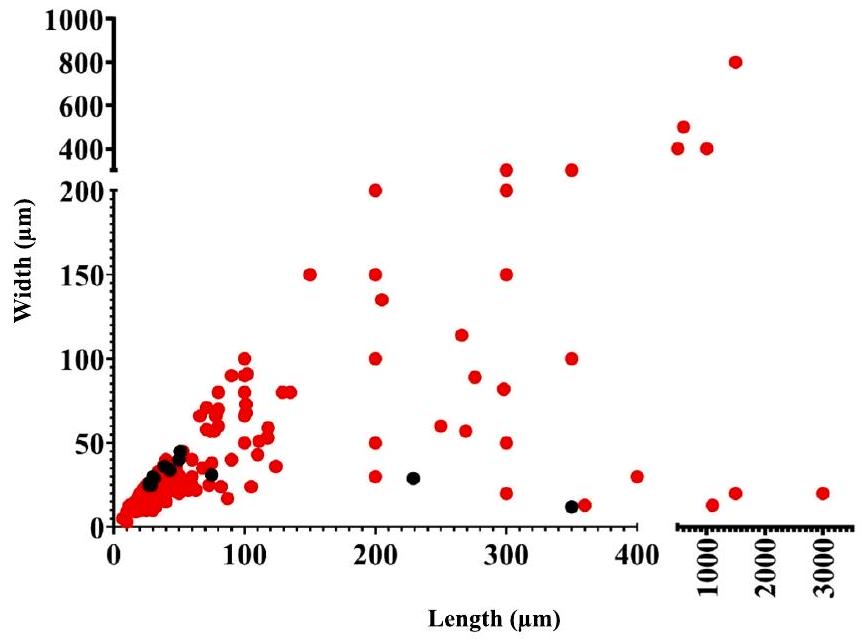
3.2. توصيف جزيئات MP من عينات الدم
3.3. المواد المضافة MP الموجودة في عينات دم الإنسان
4. المناقشة
عدد النواب المحددين ضمن عينات الدم بواسطة
| رقم عينة الدم | التربية البدنية | EVA/EVOH | إيفا | EPDM | با |
| 1 | 10,729 | ٤٢٣٥ | ١٤١٢ | – | – |
| 2 | – | – | – | – | – |
| ٣ | – | – | – | – | – |
| ٤ | – | – | – | – | – |
| ٥ | – | – | – | – | – |
| ٦ | ٤١٤١ | – | – | ٥١٢٩ | – |
| ٧ | – | – | – | – | – |
| ٨ | ٤١٤١ | – | – | – | – |
| 9 | – | – | – | – | – |
| 10 | – | – | – | – | – |
| 11 | – | – | – | – | – |
| 12 | – | – | – | – | ٢,٣٥٣ |
| ١٣ | – | – | – | – | ٤٢٣٥ |
| 14 | – | – | – | – | – |
| 15 | ٣٢٠٠ | – | – | – | – |
| 16 | – | – | – | – | – |
| 17 | ٣٢٠٠ | ١٤١٢ | – | – | – |
| 18 | – | – | – | – | – |
| 19 | – | – | – | – | – |
| 20 | – | ٢,٨٢٤ | – | ٢٣٠٦ | – |
| المتوسط العام | ٢٤٦٥.٨٥ | ||||
| SD | |||||
| ٤١٧٣.٥١ |

نوع البوليمر، أي، PE، الذي يرتبط بأكثر بوليمر MP وفرة تم اكتشافه في هذه الدراسة (للمراجعة حول الهيكل: غاستون وآخرون، 2021).
تداعيات وجود MP في الدم البشري وتبرز بشكل أكبر ضرورة إجراء مثل هذه التحليلات نظرًا للوفرة التي تم إثباتها في هذه التحقيق.
بيان مساهمة المؤلفين
إعلان عن تضارب المصالح
توفر البيانات
شكر وتقدير
الملحق أ. البيانات التكميلية
References
Amato-Lourenço, L.F., Carvalho-Oliveira, R., Júnior, G.R., dos Santos, G.L., Ando, R.A., Mauad, T., 2021. Presence of airborne microplastics in human lung tissue. J Hazard Mat. 416, 126124. https://doi.org/10.1016/j.jhazmat.2021.126124.
Barham, P.J., Keller, A., Otun, R.L., Holmes, P.A., 1984. Crystallisation and morphology of a bacterial thermoplastic: poly-3-hydroxybutyrate. J Mat Sci. 19, 2781-2794.
Bihari, P., Holzer, M., Praetner, M., Fent, J., Lerchenberger, M., Reichel, C., et al., 2010. Single-walled carbon nanotubes activate platelets and accelerate thrombus formation in the microcirculation. Toxicol. 269, 148-154. https://doi.org/10.1016/ j.tox.2009.08.011.
Choi, D., Hwang, J., Bang, J., Han, S., Kim, T., Oh, Y., et al., 2021. In vitro toxicity from a physical perspective of polyethylene microplastics based on statistical curvature change analysis. Sci Total Environ. 752, 142242. https://doi.org/10.1016/j. scitotenv.2020.142242.
Çobanoğlu, H., Belivermiş, M., Sıkdokur, E., Kılıç, Ö., Çayır, A., 2021. Genotoxic and cytotoxic effects of polyethylene microplastics on human peripheral blood
lymphocytes. Chemosphere 272, 129805. https://doi.org/10.1016/J. Chemosphere.2021.129805.
Cole, M., Lindeque, P., Halsband, C., Galloway, T.S., 2011. Microplastics as contaminants in the marine environment: A review. Mar Pollut Bull. 62, 2588-2597. https://doi. org/10.1016/j.marpolbul.2011.09.025.
Danopoulos, E., Twiddy, M., West, R., Rotchell, J.M., 2021. A rapid review and metaregression analyses of the toxicological impacts of microplastic exposure in human cells. J Hazard Mat. 427, 127861. https://doi.org/10.1016/j.jhazmat.2021.127861.
Domenech, J., Hernández, A., Rubio, L., Marcos, R., Cortés, C., 2020. Interactions of polystyrene nanoplastics with in vitro models of the human intestinal barrier. Arch. Toxicol. 94, 2997-3012.
Dong, X., Liu, X., Hou, Q., Wang, Z., 2023. From natural environment to animal tissues: A review of microplastics (nanoplastics) translocation and hazards studies. Sci Tot Environ. 855, 158686. https://doi.org/10.1016/j.scitotenv.2022.158686.
EFSA, 2019. Panel on Food Contact Materials. Safety assessment of the substance trimellitic acid, tris (2-ethylhexyl) ester, for use in food contact materials. EFSA J. 17, e05864. https://doi.org/10.2903/j.efsa.2019.5864.
Elzayat, E.A., Corcos, J., 2008. Urethral injectables in the management of stress urinary incontinence. In: Urology, F. (Ed.), Female Urology, Third Edition. Elsevier, London, pp. 348-361.
Espinosa, C., Beltrán, J.M.G., Esteban, M.A., Cuesta, A., 2018. In vitro effects of virgin microplastics on fish head-kidney leucocyte activities. Environ Pollut. 235, 30-38. https://doi.org/10.1016/j.envpol.2017.12.054.
Florance, I., Ramasubbu, S., Mukherjee, A., Chandrasekaran, N., 2021. Polystyrene nanoplastics dysregulate lipid metabolism in murine macrophages in vitro. Toxicol. 458, 152850.
Free, C.M., Jensen, O.P., Mason, S.A., Eriksen, M., Williamson, N.J., Boldgiy, B., 2014. High-levels of microplastic pollution in a large, remote, mountain lake. Mar Pollut Bull. 85, 156-163. https://doi.org/10.1016/J.MARPOLBUL.2014.06.001.
Gaston, F., Dupuy, N., Girard-Perier, N., Marque, S.R.A., Dorey, S., 2021. Investigations at the product, macromolecular, and molecular level of the physical and chemical properties of a
Gaucher-Miri, V., Jones, G.K., Kaas, R., Hiltner, A., Baer, E., 2002. Plastic deformation of EVA, EVOH and their multilayers. J Mat Sci. 37, 2635-2644.
Griffin, M.T., Zhu, Y., Liu, Z., Aidun, C.K., Ku, D.N., 2018. Inhibition of high shear arterial thrombosis by charged nanoparticles. Biomicrofluidics 12, 042210. https:// doi.org/10.1063/1.5025349.
Hahladakis, J.H., Velis, C.A., Weber, R., Iacovidou, E., Purnell, P., 2018. An overview of chemical additives present in plastics: migration, release, fate and environmental impact during their use, disposal and recycling. J Hazard Mater. 344, 179-199. https://doi.org/10.1016/j.hazmat.2017.10014.
Hartmann, N.B., Hüffer, T., Thompson, R.C., Hassellöv, M., Verschoor, A., Daugaard, A. E., et al., 2019. Are we speaking the same language? Recommendations for a definition and categorization framework for plastic debris. Environ Sci Technol. 53, 1039-1047. https://doi.org/10.1021/acs.est.8b05297.
Horton, A.A., Cross, R.K., Read, D.S., Jürgens, M.D., Ball, H.L., Svendsen, C., et al., 2021. Semi-automated analysis of microplastics in complex wastewater samples. Environ Pollut. 268, 115841. https://doi.org/10.1016/j.envpol.2020.115841.
Horvatits, T., Tamminga, M., Liu, B., Sebode, M., Carambia, A., Fischer, L., et al., 2022. Microplastics detected in cirrhotic liver tissue. E Bio Medicine 82, 104147. https:// doi.org/10.1016/j.ebiom.2022.104147.
Hwang, J., Choi, D., Han, S., Choi, J., Hong, J., 2019. An assessment of the toxicity of polypropylene microplastics in human derived cells. Sci Tot Environ. 684, 657-669. https://doi.org/10.1016/j.scitotenv.2019.05.071.
Hwang, J., Choi, D., Han, S., Jung, S.Y., Choi, J., Hong, J., 2020. Potential toxicity of polystyrene microplastic particles. Sci Rep. 10, 7391. https://doi.org/10.1038/ s41598-020-64464-9.
Ibrahim, Y.S., Tuan Anuar, S., Azmi, A.A., Wan Mohd Khalik, W.M.A., Lehata, S., Hamzah, S.R., et al., 2021. Detection of microplastics in human colectomy specimens. JGH Open. 5, 116-121. https://doi.org/10.1002/jgh3.12457.
Jacob, S., Jourdain, E.P., 2011. Advancements in EPDM sponge compound processing using EPDM bimodal polymers. Rubber Chem Technol. 84, 527-542. https://doi. org/10.5254/1.3601888.
Jenner, L.C., Rotchell, J.M., Bennett, R.T., Cowen, M., Tentzeris, V., Sadofsky, L.R., 2022. Detection of microplastics in human lung tissue using
Leslie, H.A., van Velzen, M.J.M., Brandsma, S.H., Vethaak, A.D., Garcia-Vallejo, J.J., Lamoree, M.H., 2022. Discovery and quantification of plastic particle pollution in human blood. Environ Int. 163, 107199. https://doi.org/10.1016/j. envint.2022.107199.
Leusch, F.D.L., Ziajahromi, S., 2021. Converting mg/L to particles/L: reconciling the occurrence and toxicity literature in microplastics. Environ Sci Technol. 55, 11470-11472. https://doi.org/10.1021/acs.est.1c04093.
Li, B., Ding, Y., Cheng, X., Sheng, D., Xu, Z., Rong, Q., et al., 2020. Polyethylene microplastics affect the distribution of gut microbiota and inflammation development in mice. Chemosphere 244, 125492. https://doi.org/10.1016/j. chemosphere.2019.125492.
Li, Y., Peng, L., Fu, J., Dai, X., Wang, G., 2022. A microscopic survey on microplastics in beverages: the case of beer, mineral water and tea. Analyst 147, 1099-1105. https:// doi.org/10.1039/d2an00083k.
Liu, Z., Zhuan, Q., Zhang, L., Meng, L., Fu, X., Hou, Y., 2022. Polystyrene microplastics induced female reproductive toxicity in mice. J Hazard Mater. 424, 127629. https:// doi.org/10.1016/j.jhazmat.2021.127629.
Mamun, A.A., Prasetya, T.A.E., Dewi, I.R., Ahmad, M., 2023. Microplastics in human food chains: Food becoming a threat to health safety. Sci Tot Environ. 858, 159834. https://doi.org/10.1016/j.scitotenv.2022.159834.
Mariana, M., Castelo-Branco, M., Soares, A.M., Cairrao, E., 2023. Phthalates’ exposure leads to an increasing concern on cardiovascular health. J Hazard Mater. 457, 131680. https://doi.org/10.1016/j.jhazmat.2023.131680.
Mirshafiee, V., Kim, R., Park, S., Mahmoudi, M., Kraft, M.L., 2016. Impact of protein precoating on the corona composition and nanoparticle cellular uptake. Biomaterials 75, 295-304. https://doi.org/10.1016/j.biomaterials.2015.10.019.
Munno, K., Helm, P.A., Jackson, D.A., Rochman, C., Sims, A., 2018. Impacts of temperature and selected chemical digestion methods on microplastic particles. Environ Toxicol Chem. 37, 91-98. https://doi.org/10.1002/etc.3935.
Nemmar, A., Hoylaerts, M.F., Hoet, P.H.M., Dinsdale, D., Smith, T., Xu, H., et al., 2002. Ultrafine particles affect experimental thrombosis in an in vivo hamster model. Am J Respir Crit Care Med 166, 998-1004. https://doi.org/10.1164/rccm.2001100260C.
Noonan, M.J., Grechi, N., Mills, C.L., de AMM Ferraz, M., 2023. Microplastics analytics: why we should not underestimate the importance of blank controls. Micropl & Nanopl. 3, 17. https://doi.org/10.1186/s43591-023-00065-3.
O’Brien, S., Rauert, C., Ribeiro, F., Okoffo, E.D., Burrows, S.D., O’Brien, J.W., et al., 2023. There’s something in the air: A review of sources, prevalence and behaviour of microplastics in the atmosphere. Sci Tot Environ. 874, 162193. https://doi.org/ 10.1016/j.scitotenv.2023.162193.
Ragusa, A., Svelato, A., Santacroce, C., Catalano, P., Notarstefano, V., Carnevali, O., et al., 2021. Plasticenta: First evidence of microplastics in human placenta. Environ Int. 146, 106274. https://doi.org/10.1016/j.envint.2020.106274.
Ragusa, A., Notarstefano, V., Svelato, A., Belloni, A., Gioacchini, G., Blondeel, C., et al., 2022. Raman microspectroscopy detection and characterisation of microplastics in human breastmilk. Polymers 14, 2700. https://doi.org/10.3390/polym14132700.
Ramsperger, A.F.R.M., Narayana, V.K.B., Gross, W., Mohanraj, J., Thelakkat, M., Greiner, A., et al., 2020. Environmental exposure enhances the internalization of microplastic particles into cells. Sci Adv. 6, eabd1211 https://doi.org/10.1126/ sciadv.abd1211.
Rotchell, J.M., Jenner, L.C., Chapman, E., Bennett, R.T., Bolanle, I.O., Loubani, M., et al., 2023. Detection of microplastics in human saphenous vein tissue using
Schneider, C., Langer, R., Loveday, D., Hair, D., 2017. Applications of ethylene vinyl acetate copolymers (EVA) in drug delivery systems. J Control Rel. 262, 284-295. https://doi.org/10.1016/j.jconrel.2017.08.004.
Schwabl, P., Koeppel, S., Koenigshofer, P., Bucsics, T., Trauner, M., Reiberger, T., et al., 2019. Detection of various microplastics in human stool: a prospective case series. Ann Intern Med. 171, 453-457. https://doi.org/10.7326/M19-0618.
Sun, X., Song, R., Liu, J., et al., 2023. Characterization of airborne microplastics at different workplaces of the poly(ethylene:propylene:diene) (EPDM) rubber industry. Environ Sci Pollut Res. 30, 78839-78848. https://doi.org/10.1007/s11356-023-27750-3.
Tadic, M., Cuspidi, C., Grassi, G., 2018. Heart rate as a predictor of cardiovascular risk. Eur J Clin Invest. 48, 12892. https://doi.org/10.1111/eci.12892.
Vianello, A., Jensen, R.L., Liu, L., Vollertsen, J., 2019. Simulating human exposure to indoor airborne microplastics using a Breathing Thermal Manikin. Sci Rep. 9, 8670. https://doi.org/10.1038/s41598-019-45054-w.
Vlacil, A.K., Bänfer, S., Jacob, R., Trippel, N., Kuzu, I., Schieffer, B., Grote, K., 2021. Polystyrene microplastic particles induce endothelial activation. PLoS One 16, e0260181. https://doi.org/10.1371/journal.pone. 0260181.
Wang, C., Li, J., Zhao, L., Qian, P., 2022. Shape transformations of red blood cells in the capillary and their possible connections to oxygen transport. J Biol Phys 48, 79-92. https://doi.org/10.1007/s10867-021-09594-5.
Wang, Y., Qian, H., 2021. Phthalates and their impacts on human health. Healthcare 9, 603. https://doi.org/10.3390/healthcare9050603.
Yang, L., Zhang, Y., Kang, S., Wang, Z., Wu, C., 2021. Microplastics in soil: A review on methods, occurrence, sources, and potential risk. Sci Tot Environ. 780, 146546. https://doi.org/10.1016/j.scitotenv.2021.146546.
Zhao, Q., Zhu, L., Weng, J., Jin, Z., Cao, Y., Jiang, H., et al., 2023. Detection and characterization of microplastics in the human testis and semen. Sci Tot Environ. 877, 162713 https://doi.org/10.1016/j.scitotenv.2023.162713.
Zhao, T., Shen, L., Ye, X., Bai, G., Liao, C., Chen, Z., et al., 2023. Prenatal and postnatal exposure to polystyrene microplastics induces testis developmental disorder and affects male fertility in mice. J Hazard Mater. 445, 130544 https://doi.org/10.1016/ j.jhazmat.2022.130544.
Zhu, X., Wang, C., Duan, X., Liang, B., Genbo, X.E., Huang, Z., 2023. Micro- and nanoplastics: A new cardiovascular risk factor? Environ Int. 171, 107662. https:// doi.org/10.1016/j.envint.2022.107662.
- Corresponding authors.
E-mail addresses: Simon.Calaminus@hyms.ac.uk (S. D. J. Calaminus), JRotchell@lincoln.ac.uk (J.M. Rotchell).
DOI: https://doi.org/10.1016/j.envint.2024.108751
PMID: https://pubmed.ncbi.nlm.nih.gov/38761430
Publication Date: 2024-05-14
Microplastics in human blood: Polymer types, concentrations and characterisation using
ARTICLE INFO
Keywords:
Human blood
Human
Phthalate
Abstract
Microplastics (MPs) are an everyday part of life, and are now ubiquitous in the environment. Crucially, MPs have not just been found within the environment, but also within human bodies, including the blood. We aimed to provide novel information on the range of MP polymer types present, as well as their size and shape characteristics, in human whole blood from 20 healthy volunteers. Twenty-four polymer types were identified from 18 out of
1. Introduction
detection in stool samples (Schwabl et al., 2019) and cadaver lung tissues (Amato-Lourenço et al., 2021), to more recently analysed patient samples from lung (Jenner et al., 2022), colon (Ibrahim et al., 2021), liver (Horvatits et al., 2022), placenta (Ragusa et al., 2021), breast milk (Ragusa et al., 2022), vein (Rotchell et al., 2023), and testis/sperm (Zhao Q et al., 2023). Given this expanding field of research one of the likely routes for MPs to travel through the body and accumulate in different human tissues and organs is via the bloodstream (Dong et al., 2023). The most likely route to enter the blood is via diet/gut but there are certainly two additional routes of exposure: inhaled MPs crossing the lung to the bloodstream (Jenner et al., 2022) or during surgery directly into the bloodstream as airborne fallout or from spallation of medical equipment (Field et al., 2022).
2. Methods
2.1. Blood sample acquisition
2.2. Blood sample digestion and filtration
2.3. Chemical characterisation of particles using
2.4. Quality assurance and control measures
2.5. Statistical analysis
3. Results
3.1. MP concentrations detected in human blood samples
3.2. MP particle characterisation from blood samples

3.3. MP additives found in human blood samples
4. Discussion

The number of MPs identified within the blood samples by
| Blood sample number | PE | EVA/EVOH | EVA | EPDM | PA |
| 1 | 10,729 | 4,235 | 1,412 | – | – |
| 2 | – | – | – | – | – |
| 3 | – | – | – | – | – |
| 4 | – | – | – | – | – |
| 5 | – | – | – | – | – |
| 6 | 4,141 | – | – | 5,129 | – |
| 7 | – | – | – | – | – |
| 8 | 4,141 | – | – | – | – |
| 9 | – | – | – | – | – |
| 10 | – | – | – | – | – |
| 11 | – | – | – | – | – |
| 12 | – | – | – | – | 2,353 |
| 13 | – | – | – | – | 4,235 |
| 14 | – | – | – | – | – |
| 15 | 3,200 | – | – | – | – |
| 16 | – | – | – | – | – |
| 17 | 3,200 | 1,412 | – | – | – |
| 18 | – | – | – | – | – |
| 19 | – | – | – | – | – |
| 20 | – | 2,824 | – | 2,306 | – |
| Overall Mean | 2465.85 | ||||
| SD | |||||
| 4173.51 |


type of polymer, i.e., PE, which links back to most abundant MP polymer detected in this study (for review of the structure: Gaston et al., 2021).
implications of MP presence in human blood and further highlights the urgency of conducting such analyses given the abundance evidenced in this investigation.
CRediT authorship contribution statement
Declaration of competing interest
Data availability
Acknowledgements
Appendix A. Supplementary data
References
Amato-Lourenço, L.F., Carvalho-Oliveira, R., Júnior, G.R., dos Santos, G.L., Ando, R.A., Mauad, T., 2021. Presence of airborne microplastics in human lung tissue. J Hazard Mat. 416, 126124. https://doi.org/10.1016/j.jhazmat.2021.126124.
Barham, P.J., Keller, A., Otun, R.L., Holmes, P.A., 1984. Crystallisation and morphology of a bacterial thermoplastic: poly-3-hydroxybutyrate. J Mat Sci. 19, 2781-2794.
Bihari, P., Holzer, M., Praetner, M., Fent, J., Lerchenberger, M., Reichel, C., et al., 2010. Single-walled carbon nanotubes activate platelets and accelerate thrombus formation in the microcirculation. Toxicol. 269, 148-154. https://doi.org/10.1016/ j.tox.2009.08.011.
Choi, D., Hwang, J., Bang, J., Han, S., Kim, T., Oh, Y., et al., 2021. In vitro toxicity from a physical perspective of polyethylene microplastics based on statistical curvature change analysis. Sci Total Environ. 752, 142242. https://doi.org/10.1016/j. scitotenv.2020.142242.
Çobanoğlu, H., Belivermiş, M., Sıkdokur, E., Kılıç, Ö., Çayır, A., 2021. Genotoxic and cytotoxic effects of polyethylene microplastics on human peripheral blood
lymphocytes. Chemosphere 272, 129805. https://doi.org/10.1016/J. Chemosphere.2021.129805.
Cole, M., Lindeque, P., Halsband, C., Galloway, T.S., 2011. Microplastics as contaminants in the marine environment: A review. Mar Pollut Bull. 62, 2588-2597. https://doi. org/10.1016/j.marpolbul.2011.09.025.
Danopoulos, E., Twiddy, M., West, R., Rotchell, J.M., 2021. A rapid review and metaregression analyses of the toxicological impacts of microplastic exposure in human cells. J Hazard Mat. 427, 127861. https://doi.org/10.1016/j.jhazmat.2021.127861.
Domenech, J., Hernández, A., Rubio, L., Marcos, R., Cortés, C., 2020. Interactions of polystyrene nanoplastics with in vitro models of the human intestinal barrier. Arch. Toxicol. 94, 2997-3012.
Dong, X., Liu, X., Hou, Q., Wang, Z., 2023. From natural environment to animal tissues: A review of microplastics (nanoplastics) translocation and hazards studies. Sci Tot Environ. 855, 158686. https://doi.org/10.1016/j.scitotenv.2022.158686.
EFSA, 2019. Panel on Food Contact Materials. Safety assessment of the substance trimellitic acid, tris (2-ethylhexyl) ester, for use in food contact materials. EFSA J. 17, e05864. https://doi.org/10.2903/j.efsa.2019.5864.
Elzayat, E.A., Corcos, J., 2008. Urethral injectables in the management of stress urinary incontinence. In: Urology, F. (Ed.), Female Urology, Third Edition. Elsevier, London, pp. 348-361.
Espinosa, C., Beltrán, J.M.G., Esteban, M.A., Cuesta, A., 2018. In vitro effects of virgin microplastics on fish head-kidney leucocyte activities. Environ Pollut. 235, 30-38. https://doi.org/10.1016/j.envpol.2017.12.054.
Florance, I., Ramasubbu, S., Mukherjee, A., Chandrasekaran, N., 2021. Polystyrene nanoplastics dysregulate lipid metabolism in murine macrophages in vitro. Toxicol. 458, 152850.
Free, C.M., Jensen, O.P., Mason, S.A., Eriksen, M., Williamson, N.J., Boldgiy, B., 2014. High-levels of microplastic pollution in a large, remote, mountain lake. Mar Pollut Bull. 85, 156-163. https://doi.org/10.1016/J.MARPOLBUL.2014.06.001.
Gaston, F., Dupuy, N., Girard-Perier, N., Marque, S.R.A., Dorey, S., 2021. Investigations at the product, macromolecular, and molecular level of the physical and chemical properties of a
Gaucher-Miri, V., Jones, G.K., Kaas, R., Hiltner, A., Baer, E., 2002. Plastic deformation of EVA, EVOH and their multilayers. J Mat Sci. 37, 2635-2644.
Griffin, M.T., Zhu, Y., Liu, Z., Aidun, C.K., Ku, D.N., 2018. Inhibition of high shear arterial thrombosis by charged nanoparticles. Biomicrofluidics 12, 042210. https:// doi.org/10.1063/1.5025349.
Hahladakis, J.H., Velis, C.A., Weber, R., Iacovidou, E., Purnell, P., 2018. An overview of chemical additives present in plastics: migration, release, fate and environmental impact during their use, disposal and recycling. J Hazard Mater. 344, 179-199. https://doi.org/10.1016/j.hazmat.2017.10014.
Hartmann, N.B., Hüffer, T., Thompson, R.C., Hassellöv, M., Verschoor, A., Daugaard, A. E., et al., 2019. Are we speaking the same language? Recommendations for a definition and categorization framework for plastic debris. Environ Sci Technol. 53, 1039-1047. https://doi.org/10.1021/acs.est.8b05297.
Horton, A.A., Cross, R.K., Read, D.S., Jürgens, M.D., Ball, H.L., Svendsen, C., et al., 2021. Semi-automated analysis of microplastics in complex wastewater samples. Environ Pollut. 268, 115841. https://doi.org/10.1016/j.envpol.2020.115841.
Horvatits, T., Tamminga, M., Liu, B., Sebode, M., Carambia, A., Fischer, L., et al., 2022. Microplastics detected in cirrhotic liver tissue. E Bio Medicine 82, 104147. https:// doi.org/10.1016/j.ebiom.2022.104147.
Hwang, J., Choi, D., Han, S., Choi, J., Hong, J., 2019. An assessment of the toxicity of polypropylene microplastics in human derived cells. Sci Tot Environ. 684, 657-669. https://doi.org/10.1016/j.scitotenv.2019.05.071.
Hwang, J., Choi, D., Han, S., Jung, S.Y., Choi, J., Hong, J., 2020. Potential toxicity of polystyrene microplastic particles. Sci Rep. 10, 7391. https://doi.org/10.1038/ s41598-020-64464-9.
Ibrahim, Y.S., Tuan Anuar, S., Azmi, A.A., Wan Mohd Khalik, W.M.A., Lehata, S., Hamzah, S.R., et al., 2021. Detection of microplastics in human colectomy specimens. JGH Open. 5, 116-121. https://doi.org/10.1002/jgh3.12457.
Jacob, S., Jourdain, E.P., 2011. Advancements in EPDM sponge compound processing using EPDM bimodal polymers. Rubber Chem Technol. 84, 527-542. https://doi. org/10.5254/1.3601888.
Jenner, L.C., Rotchell, J.M., Bennett, R.T., Cowen, M., Tentzeris, V., Sadofsky, L.R., 2022. Detection of microplastics in human lung tissue using
Leslie, H.A., van Velzen, M.J.M., Brandsma, S.H., Vethaak, A.D., Garcia-Vallejo, J.J., Lamoree, M.H., 2022. Discovery and quantification of plastic particle pollution in human blood. Environ Int. 163, 107199. https://doi.org/10.1016/j. envint.2022.107199.
Leusch, F.D.L., Ziajahromi, S., 2021. Converting mg/L to particles/L: reconciling the occurrence and toxicity literature in microplastics. Environ Sci Technol. 55, 11470-11472. https://doi.org/10.1021/acs.est.1c04093.
Li, B., Ding, Y., Cheng, X., Sheng, D., Xu, Z., Rong, Q., et al., 2020. Polyethylene microplastics affect the distribution of gut microbiota and inflammation development in mice. Chemosphere 244, 125492. https://doi.org/10.1016/j. chemosphere.2019.125492.
Li, Y., Peng, L., Fu, J., Dai, X., Wang, G., 2022. A microscopic survey on microplastics in beverages: the case of beer, mineral water and tea. Analyst 147, 1099-1105. https:// doi.org/10.1039/d2an00083k.
Liu, Z., Zhuan, Q., Zhang, L., Meng, L., Fu, X., Hou, Y., 2022. Polystyrene microplastics induced female reproductive toxicity in mice. J Hazard Mater. 424, 127629. https:// doi.org/10.1016/j.jhazmat.2021.127629.
Mamun, A.A., Prasetya, T.A.E., Dewi, I.R., Ahmad, M., 2023. Microplastics in human food chains: Food becoming a threat to health safety. Sci Tot Environ. 858, 159834. https://doi.org/10.1016/j.scitotenv.2022.159834.
Mariana, M., Castelo-Branco, M., Soares, A.M., Cairrao, E., 2023. Phthalates’ exposure leads to an increasing concern on cardiovascular health. J Hazard Mater. 457, 131680. https://doi.org/10.1016/j.jhazmat.2023.131680.
Mirshafiee, V., Kim, R., Park, S., Mahmoudi, M., Kraft, M.L., 2016. Impact of protein precoating on the corona composition and nanoparticle cellular uptake. Biomaterials 75, 295-304. https://doi.org/10.1016/j.biomaterials.2015.10.019.
Munno, K., Helm, P.A., Jackson, D.A., Rochman, C., Sims, A., 2018. Impacts of temperature and selected chemical digestion methods on microplastic particles. Environ Toxicol Chem. 37, 91-98. https://doi.org/10.1002/etc.3935.
Nemmar, A., Hoylaerts, M.F., Hoet, P.H.M., Dinsdale, D., Smith, T., Xu, H., et al., 2002. Ultrafine particles affect experimental thrombosis in an in vivo hamster model. Am J Respir Crit Care Med 166, 998-1004. https://doi.org/10.1164/rccm.2001100260C.
Noonan, M.J., Grechi, N., Mills, C.L., de AMM Ferraz, M., 2023. Microplastics analytics: why we should not underestimate the importance of blank controls. Micropl & Nanopl. 3, 17. https://doi.org/10.1186/s43591-023-00065-3.
O’Brien, S., Rauert, C., Ribeiro, F., Okoffo, E.D., Burrows, S.D., O’Brien, J.W., et al., 2023. There’s something in the air: A review of sources, prevalence and behaviour of microplastics in the atmosphere. Sci Tot Environ. 874, 162193. https://doi.org/ 10.1016/j.scitotenv.2023.162193.
Ragusa, A., Svelato, A., Santacroce, C., Catalano, P., Notarstefano, V., Carnevali, O., et al., 2021. Plasticenta: First evidence of microplastics in human placenta. Environ Int. 146, 106274. https://doi.org/10.1016/j.envint.2020.106274.
Ragusa, A., Notarstefano, V., Svelato, A., Belloni, A., Gioacchini, G., Blondeel, C., et al., 2022. Raman microspectroscopy detection and characterisation of microplastics in human breastmilk. Polymers 14, 2700. https://doi.org/10.3390/polym14132700.
Ramsperger, A.F.R.M., Narayana, V.K.B., Gross, W., Mohanraj, J., Thelakkat, M., Greiner, A., et al., 2020. Environmental exposure enhances the internalization of microplastic particles into cells. Sci Adv. 6, eabd1211 https://doi.org/10.1126/ sciadv.abd1211.
Rotchell, J.M., Jenner, L.C., Chapman, E., Bennett, R.T., Bolanle, I.O., Loubani, M., et al., 2023. Detection of microplastics in human saphenous vein tissue using
Schneider, C., Langer, R., Loveday, D., Hair, D., 2017. Applications of ethylene vinyl acetate copolymers (EVA) in drug delivery systems. J Control Rel. 262, 284-295. https://doi.org/10.1016/j.jconrel.2017.08.004.
Schwabl, P., Koeppel, S., Koenigshofer, P., Bucsics, T., Trauner, M., Reiberger, T., et al., 2019. Detection of various microplastics in human stool: a prospective case series. Ann Intern Med. 171, 453-457. https://doi.org/10.7326/M19-0618.
Sun, X., Song, R., Liu, J., et al., 2023. Characterization of airborne microplastics at different workplaces of the poly(ethylene:propylene:diene) (EPDM) rubber industry. Environ Sci Pollut Res. 30, 78839-78848. https://doi.org/10.1007/s11356-023-27750-3.
Tadic, M., Cuspidi, C., Grassi, G., 2018. Heart rate as a predictor of cardiovascular risk. Eur J Clin Invest. 48, 12892. https://doi.org/10.1111/eci.12892.
Vianello, A., Jensen, R.L., Liu, L., Vollertsen, J., 2019. Simulating human exposure to indoor airborne microplastics using a Breathing Thermal Manikin. Sci Rep. 9, 8670. https://doi.org/10.1038/s41598-019-45054-w.
Vlacil, A.K., Bänfer, S., Jacob, R., Trippel, N., Kuzu, I., Schieffer, B., Grote, K., 2021. Polystyrene microplastic particles induce endothelial activation. PLoS One 16, e0260181. https://doi.org/10.1371/journal.pone. 0260181.
Wang, C., Li, J., Zhao, L., Qian, P., 2022. Shape transformations of red blood cells in the capillary and their possible connections to oxygen transport. J Biol Phys 48, 79-92. https://doi.org/10.1007/s10867-021-09594-5.
Wang, Y., Qian, H., 2021. Phthalates and their impacts on human health. Healthcare 9, 603. https://doi.org/10.3390/healthcare9050603.
Yang, L., Zhang, Y., Kang, S., Wang, Z., Wu, C., 2021. Microplastics in soil: A review on methods, occurrence, sources, and potential risk. Sci Tot Environ. 780, 146546. https://doi.org/10.1016/j.scitotenv.2021.146546.
Zhao, Q., Zhu, L., Weng, J., Jin, Z., Cao, Y., Jiang, H., et al., 2023. Detection and characterization of microplastics in the human testis and semen. Sci Tot Environ. 877, 162713 https://doi.org/10.1016/j.scitotenv.2023.162713.
Zhao, T., Shen, L., Ye, X., Bai, G., Liao, C., Chen, Z., et al., 2023. Prenatal and postnatal exposure to polystyrene microplastics induces testis developmental disorder and affects male fertility in mice. J Hazard Mater. 445, 130544 https://doi.org/10.1016/ j.jhazmat.2022.130544.
Zhu, X., Wang, C., Duan, X., Liang, B., Genbo, X.E., Huang, Z., 2023. Micro- and nanoplastics: A new cardiovascular risk factor? Environ Int. 171, 107662. https:// doi.org/10.1016/j.envint.2022.107662.
- Corresponding authors.
E-mail addresses: Simon.Calaminus@hyms.ac.uk (S. D. J. Calaminus), JRotchell@lincoln.ac.uk (J.M. Rotchell).
