DOI: https://doi.org/10.1038/s41467-024-44751-z
PMID: https://pubmed.ncbi.nlm.nih.gov/38245507
تاريخ النشر: 2024-01-20
تحليل متعدد الأنماط لشرائح حيوية مرتبطة بالعرق والفينيل ألانين بين الأفراد ومرتبط بالدم لتتبع عملية الأيض أثناء التمرين
تاريخ القبول: 3 يناير 2024
تاريخ النشر على الإنترنت: 20 يناير 2024
الملخص
يمكن أن يوفر المراقبة في الموقع لفقدان الأحماض الأمينية الذاتية من خلال العرق رؤى فسيولوجية حول الصحة والأيض. ومع ذلك، فإن أجهزة استشعار الأحماض الأمينية الحالية غير قادرة على تقييم الحالة الأيضية بشكل كمي أثناء التمرين ونادراً ما تستخدم لتحديد العلاقات بين الدم والعرق لأنها تكتشف فقط مؤشر تركيز واحد وتتجاهل معدل العرق. هنا، نقدم شريحة حيوية متعددة الأنماط قابلة للارتداء مدمجة مع أقطاب كهربائية كيميائية متقدمة وقنوات ميكروفلويدية متعددة الأغراض تتيح القياس المتزامن لعدة مؤشرات عرق، بما في ذلك الفينيل ألانين والكلوريد، بالإضافة إلى معدل العرق. تكشف هذه الطريقة المجمعة للقياس عن علاقة سلبية بين مستويات الفينيل ألانين في العرق ومعدلات العرق بين الأفراد، مما يمكّن من تحديد الأفراد المعرضين لمخاطر أيضية عالية. من خلال تتبع تقلبات الفينيل ألانين الناتجة عن تناول البروتين أثناء التمرين وتطبيع مؤشر التركيز بواسطة معدلات العرق لتقليل التباين بين الأفراد، نوضح طريقة موثوقة لربط وتحليل مستويات الفينيل ألانين في العرق والدم لمراقبة الصحة الشخصية.
أمراض الجلد لأنها تنشأ من كل من فقدان البلازما الذاتي
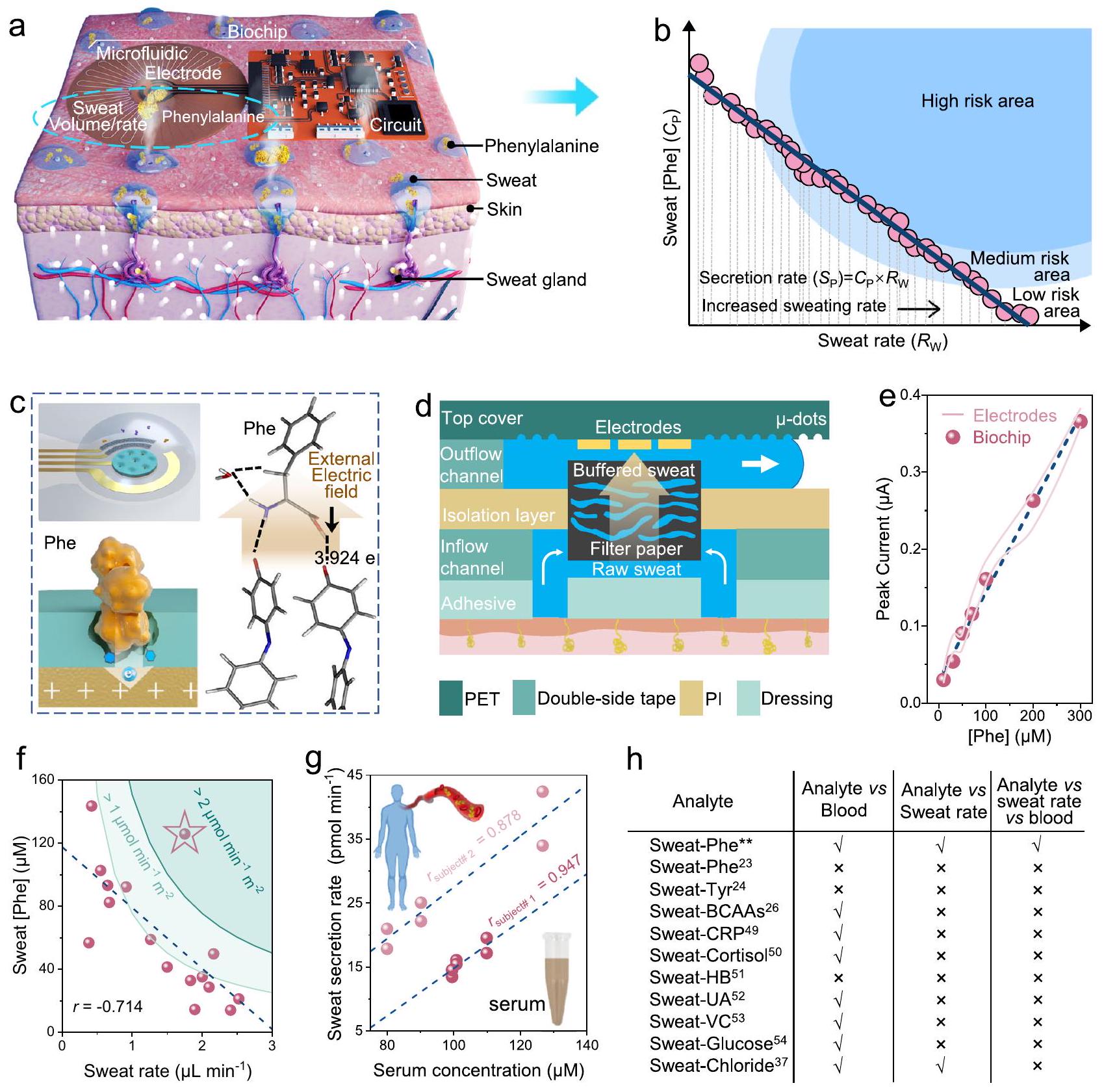
مبدأ وقطع عرضي لوحدة الميكروفلويدية مع هيكل مجمع عمودي. هـ مقارنة استجابات Phe DPV للنظام اللاسلكي المتكامل والأقطاب الكهربائية النقية.
يوفر فرصًا جذابة لمراقبة الصحة غير الغازية والمريحة.
يُفترض أنه يتوزع في العرق عبر الانتشار بسبب حجمه الصغير وخصائص سلسلة الجانبية غير القطبية.
أيض بروتين العضلات أثناء التمرين
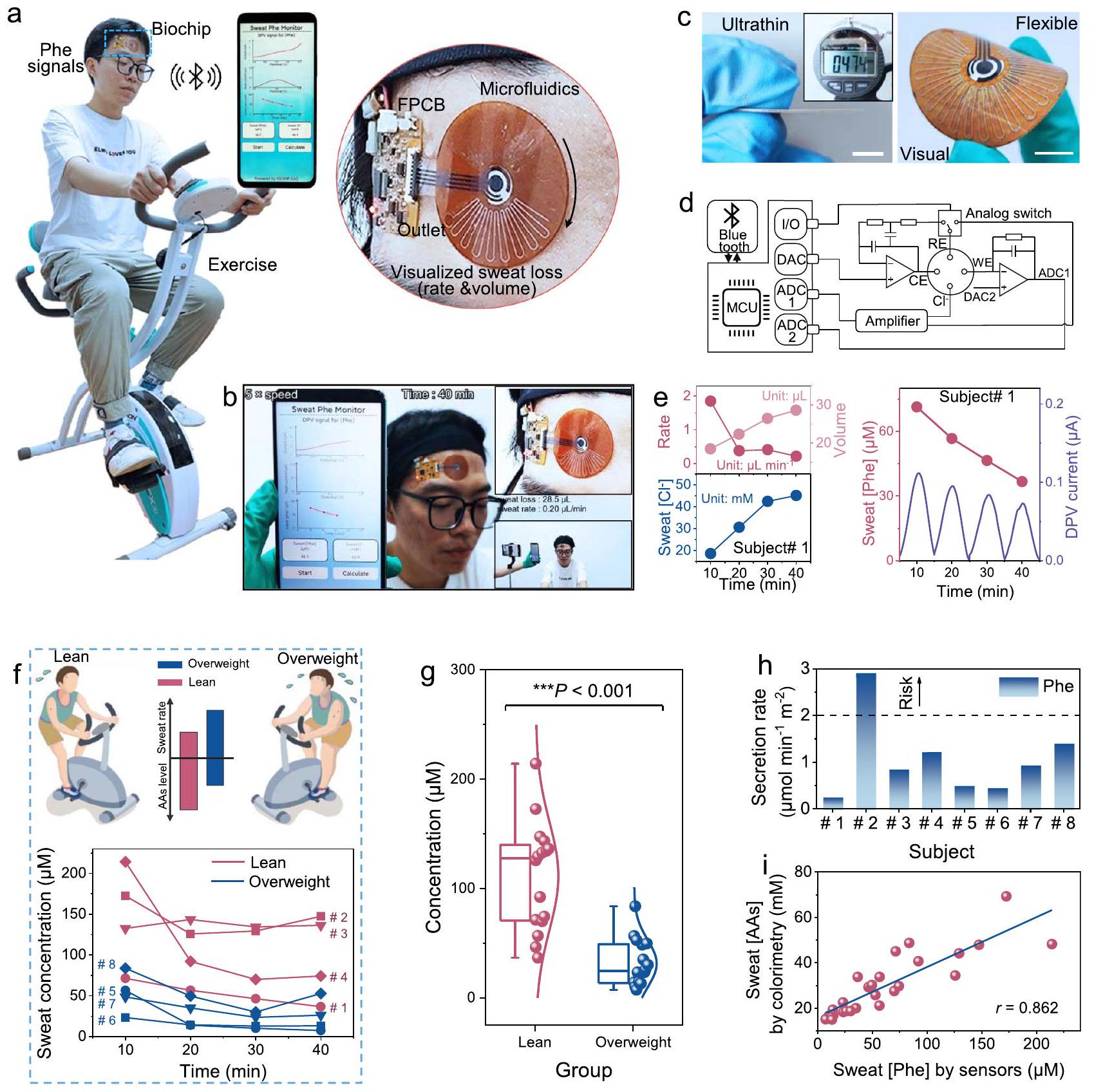
نحن نوضح وجود علاقات قوية ومشابهة بين مستويات الفينيل ألانين في العرق والمصل لدى متطوعين مختلفين قبل وبعد تناول البروتين من خلال تطبيع معدل العرق لتقليل التباين بين الأفراد. تكشف جميع هذه العروض عن الفائدة المحتملة لنظامنا القابل للارتداء متعدد الوسائط لإدارة التمارين الغذائية الشخصية المستندة إلى العرق.
النتائج
استراتيجية استشعار النظام المتكامل والتطبيقات
جمع البيانات من عدة متطوعين بعد 20 دقيقة من التمرين، لاحظنا وجود علاقة سلبية متوسطة بين معدل التعرق وتركيز الفينيل ألانين (الشكل 1f)، مما يشير إلى أن آلية توزيع الفينيل ألانين في العرق تعتمد على الانتشار وقد يتأثر تركيزه بتخفيف العرق.
التوصيف الكهروكيميائي لمستشعر E-MIP
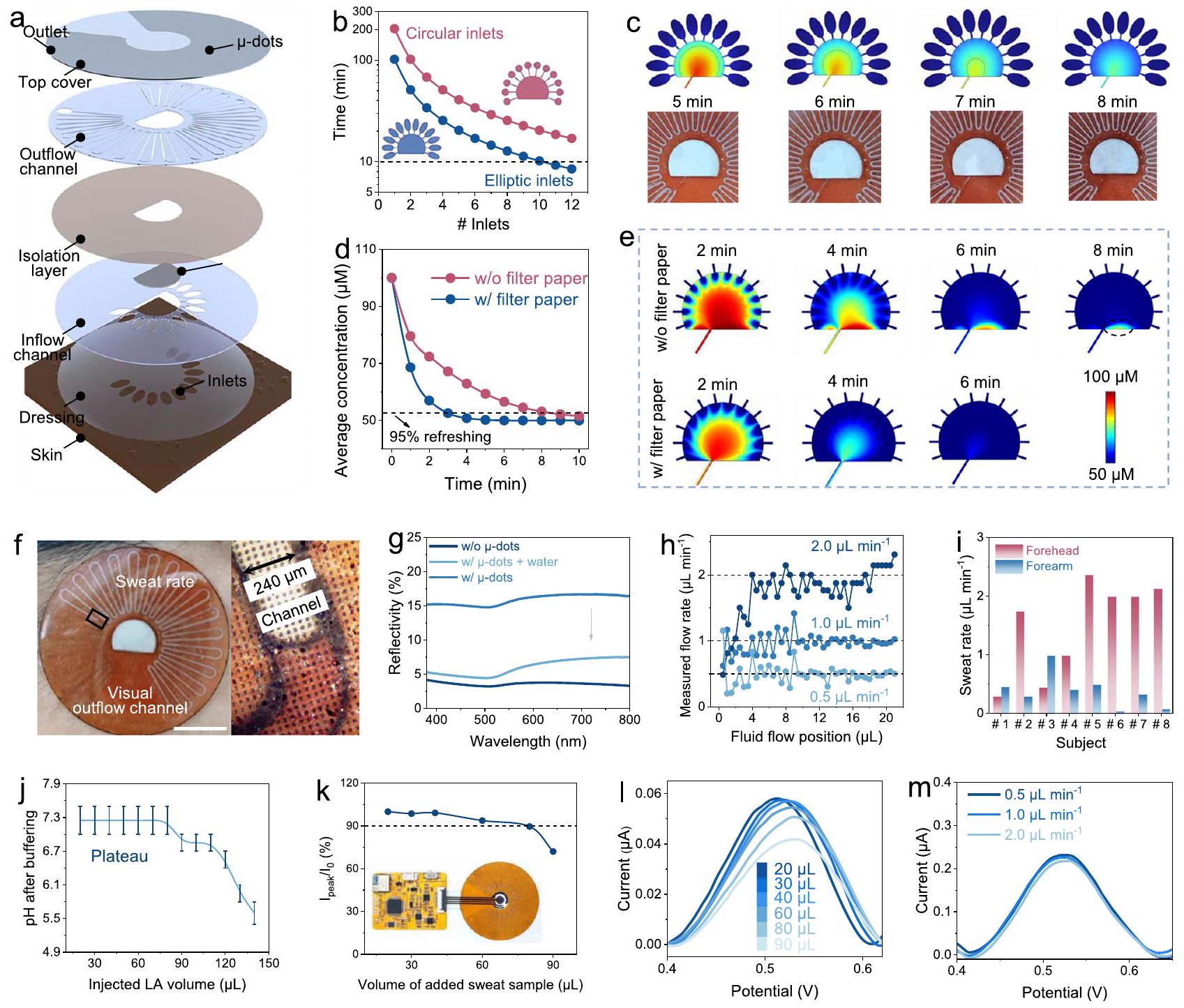
تصميم وتوصيف أداء الميكروفلويديات متعددة الأغراض
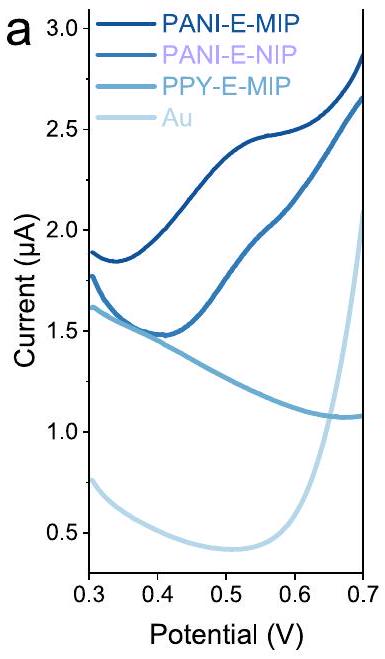
| إلكترود |
|
| باني-إمب | 3.924 e |
| باني-إن-نيب | 3.013 e |
| بي بي واي – إي – ني بي | 2.861 e |
| أو | 2.757 e |



إلكترود، إلكترود MIP، وإلكترود Au في محلول PBS يحتوي على
و الشكل التوضيحي الإضافي 23). بالإضافة إلى ذلك، تم استخدام خوارزمية رؤية الكمبيوتر لقراءة فقدان العرق تلقائيًا (الملاحظة التكميلية 3). بناءً على ذلك، تم قياس معدلات عرق التمرين لجزئين متماثلين من الجسم (الجبهة والساعد) لثمانية متطوعين لإظهار جدوى تصميم هذه التصوير (الشكل 3i، الشكل التوضيحي الإضافي 24، والجدول التوضيحي الإضافي 3)، والذي يمكن استخدامه لـ
التحقيق بشكل شامل في العلاقة بين فقدان الأحماض الأمينية وفقدان الماء أثناء التمرين.
القدرة على تخزين العرق في ظروف pH محايدة لأكثر من 40 دقيقة أثناء التمرين الشديد مع معدل عرق مرتفع باستمرار
استجابة المستشعر ضمن توقعات التصميم. علاوة على ذلك، تم الحصول على استجابة مستقرة للمستشعر في نطاق درجة حرارة الجلد الفسيولوجية (الشكل التوضيحي 26). والأهم من ذلك، أن المستشعر المتكامل أظهر أيضًا قراءات DPV مستقرة لاستشعار الفينيل ألانين عند معدلات تدفق مختلفة من 0.5 إلى
تقييم المستشعر لتقييم مخاطر التمثيل الغذائي أثناء التمرين
حوالي
استجابة الجسم لحمولة التمرين كما هو متوقع
تقييم مستشعر Phe في العرق لإدارة النظام الغذائي وارتباط المصل
(الاستقرار بعد 30 دقيقة)، أدى تناول النظام الغذائي البروتيني إلى زيادة مستويات Phe في العرق في كلا الموضوعين، بينما تم قياس مستويات منخفضة بعد الراحة (الشكل 5b). علاوة على ذلك، يشير الانخفاض المتتالي لمستويات Phe في المرحلة الأولية من التعرق أثناء التمرين (10 دقائق) إلى استهلاك Phe من الجلد وتجديده غير المناسب (الشكل التكميلي 30). ومع ذلك، لم تظهر مستويات Phe المقاسة بعد 20 دقيقة هذا الاتجاه في التغيير. بالاقتران مع الظاهرتين المختلفتين المذكورتين أعلاه، يمكن استنتاج أن Phe في الجلد في العرق لم يعد سائدًا في هذا الوقت، بل تم استبداله بالمساهمة من الدم. من المهم أن كان هناك مدى أكبر من تقلب نسبة Phe (خاصة لتغيرات العرق) في الموضوع ذي الوزن الزائد مقارنة بالموضوع النحيف، وهو ما يُحتمل أن يكون بسبب ظروف الأيض المختلفة (الشكل التكميلي 31).
التوافق الحيوي
المناقشة
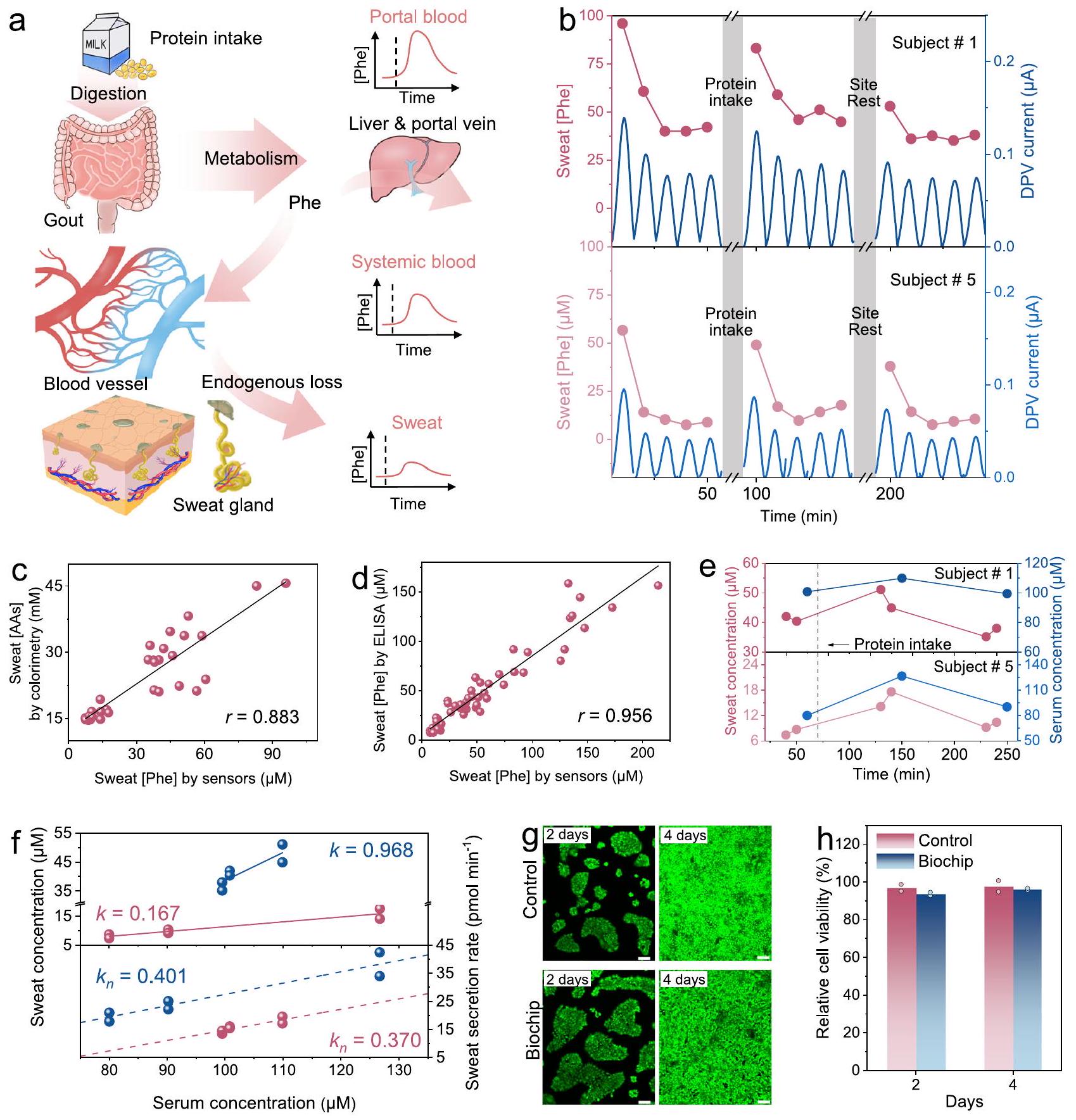
عينات تم جمعها في تجربة التقييم المذكورة أعلاه. الخط الصلب يمثل خط الاتجاه الملائم خطيًا. دراسة مقارنة لمستويات الفينيل ألانين في العرق والمصل في ثلاث فترات من التمرين من الموضوع #1 (الأعلى) والموضوع #5 (الأسفل).
اختيارية لمراقبة العرق. علاوة على ذلك، تم تصميم ميكروفلويديك متعدد الأغراض بشكل متقن من خلال تقنية النقش بالليزر القابلة للتوسع ومنخفضة التكلفة لتحقيق أهداف متعددة، بما في ذلك تخزين درجة الحموضة المحايدة للعرق للكشف المستقر عن الفينيل ألانين، وأخذ عينات سريعة من العرق وتجديدها لتحقيق دقة زمنية عالية، ورؤية تدفق العرق لفقدان العرق القابل للقراءة. من خلال دمج هذين النهجين المتكاملين والمفيدين بشكل متبادل، يتيح النظام القابل للارتداء الذي يتم ارتداؤه على سطح الجلد المراقبة المستمرة والموثوقة والسريعة.
كشف تركيزات الفينيل ألانين جنبًا إلى جنب مع القراءة المتاحة والمرئية لفقدان العرق أثناء التمرين. يمكن أن تركز التحسينات المحتملة في النظام على تطوير قراءات مستمرة لفقدان العرق من خلال الطرق الكهربائية لتطبيقات أكثر تنوعًا.
لذا نقوم بتحليل الآلية المحتملة لتقسيم الفينيل ألانين. بالإضافة إلى ذلك، قمنا بدمج هذين المؤشرين كمؤشر جديد، وهو معدل إفراز الفينيل ألانين في العرق، لتقييم المخاطر الأيضية الناتجة عن التمارين الرياضية بشكل كمي لدى مجموعتين مختلفتين من حيث مؤشر كتلة الجسم. أخيرًا، أجرينا دراسة تجريبية لفهم العلاقة الأيضية لمحتوى الفينيل ألانين في العرق مقابل المصل قبل وأثناء وبعد تناول نظام غذائي غني بالبروتين أثناء ممارسة الرياضة، مما يكشف عن ارتباطات عالية ومشابهة بينهما في شخصين بعد تطبيع معدل العرق. جميع هذه النتائج توضح أن التحديد المتزامن لتركيز الأحماض الأمينية في العرق ومعدل العرق يمكن أن يوفر رؤى جديدة وقيمة في تقييم الحالة الأيضية ومستويات الدم المقابلة. للتغلب على محدودية بيانات المشاركين في الدراسة، ستتضمن الأعمال المستقبلية التحقيق في مزيد من المشاركين ذوي الحالات الأيضية المختلفة لتوسيع بيانات إثبات المفهوم هنا وبناء ارتباط أقوى بين مستويات الفينيل ألانين في العرق والمصل من خلال أخذ تأثير تخفيف العرق في الاعتبار. ستفتح مثل هذه الأساليب الطريق لمجموعة من سيناريوهات التطبيقات السريرية، مثل إدارة نظام غذائي منخفض الفينيل ألانين غير الغازي والشخصي لمرضى الفينيل كيتون يوريا. والأهم من ذلك، فإن اكتشافنا أن الأحماض الأمينية غير NMF في العرق تنبع أساسًا من فقدان الأحماض الأمينية في البلازما مع تقدم عملية التعرق يمكن أن يمتد إلى أنواع أخرى. يمكن استخدام هذه القدرات القياسية لدراسة المزيد من ارتباطات الأحماض الأمينية في العرق والمصل وآليات تقسيمها التفصيلية بمساعدة استشعار العرق متعدد الأنماط في الدراسات اللاحقة.
طرق
تصنيع وتحضير مستشعر العرق
توصيف مستشعر العرق
منهجية المحاكاة الحاسوبية للتفاعلات الجزيئية
تصنيع وتجميع وتوصيف الميكروفلويديات متعددة الأغراض
ورقة فلتر بنمط الحجرة (Whatman، الولايات المتحدة) تم تغطيسها وتجفيفها بواسطة
-نقاط (الشكل 3g والشكل التكميلي 22).
تم إجراء جميع المحاكاة باستخدام COMSOL Multiphysics 6.0. للتحقق من سلوك التدفق تحت أخذ عينات العرق من الميكروفلويديات مع اثني عشر مدخلًا، تم استخدام وحدة ديناميكا السوائل الحسابية (تدفق ذو مرحلتين، واجهة مستوى المجموعة) لمحاكاة عملية ملء الماء مع/بدون ورقة الفلتر (مجال الوسائط المسامية) في الشكل التكميلي 18. علاوة على ذلك، كما هو موضح في الشكل التكميلي 19، تم أيضًا محاكاة عملية نقل الكتلة من خلال ربط واجهة نقل الأنواع المخففة وواجهات التدفق الطبقي لتحليل وقت التجديد للميكروفلويديات مع/بدون ورقة الفلتر (مجال الوسائط المسامية). انظر الملاحظة التكملية 3 للحصول على التفاصيل.
تم نقل البيانات الخام بعد ذلك لاسلكيًا عبر Bluetooth (E104BT5005A) وعرضها في الوقت الحقيقي في تطبيق مخصص تم تطويره للهاتف الذكي. قبل تحويلها إلى قيم التركيز المقدمة، تم تصحيح البيانات الخام لـ DPV، وتصفيتها، وتنعيمها على التطبيق للحصول على منحنيات تيار قمة DPV موثوقة. ثم، تم الحصول على قيم التركيز في الموقع وعرضها في واجهة المستخدم، مع تسجيل منحنى مستويات Phe على مر الزمن.
تم تشغيل النظام بالكامل بواسطة بطارية ليثيوم أيون بوليمر قابلة للشحن بجهد 3.7 فولت بسعة وحجم مرغوبين. تم استخدام منظم انخفاض منخفض (S-1206B33-M3T1G) لتحويل وإنتاج إمدادات طاقة رقمية وتماثلية مستقرة ومنفصلة لخدمة MCU والمكونات المحيطية التماثلية، على التوالي، مما ينشئ دوائر رقمية وتماثلية منفصلة لمنع الدوائر الرقمية من التأثير على الإشارات التماثلية.
تجنيد المشاركين البشريين
اختبار النظام المتكامل على الجسم
اللونيمترية لتحليل عينات العرق
امتصاصية معيار الجلايسين (10 مللي مول). تم تخزين الكواشف غير المستخدمة المذكورة أعلاه في مجموعات الاختبار اللوني في
تحقق النظام مع تناول البروتين
الكروماتوغرافيا السائلة المتصلة بمطياف الكتلة لتحليل المصل
تقييم التوافق الحيوي في المختبر
التحليل الإحصائي
ملخص التقرير
توفر البيانات
توفر الشيفرة
References
- Wu, G. Amino acids: metabolism, functions, and nutrition. Amino Acids 37, 1-17 (2009).
- Braverman E. R., Pfeiffer C. C., Blum K. & Smayda R. The healing nutrients within: facts, findings, and new research on amino acids. Basic Health Publications, Inc. (2003).
- Li, P., Yin, Y. L., Li, D., Kim, S. W. & Wu, G. Amino acids and immune function. Br. J. Nutr. 98, 237-252 (2007).
- Nie, C., He, T., Zhang, W., Zhang, G. & Ma, X. Branched chain amino acids: beyond nutrition metabolism. Int. J. Mol. Sci. 19, 954 (2018).
- Fernstrom, J. D. & Wurtman, R. J. Brain serotonin content: physiological regulation by plasma neutral amino acids. Science 178, 414-416 (1972).
- Hu, X. & Guo, F. Amino acid sensing in metabolic homeostasis and health. Endocr. Rev. 42, 56-76 (2021).
- Munro H. N. Mammalian protein metabolism. Elsevier (2012).
- Felig, P. Amino acid metabolism in man. Annu. Rev. Biochem. 44, 933-955 (1975).
- Wagenmakers, A. J. M. 11 muscle amino acid metabolism at rest and during exercise: role in human physiology and metabolism. Exerc. Sport Sci. Rev. 26, 287-314 (1998).
- Nasset, E. S., Heald, F. P., Calloway, D. H., Margen, S. & Schneeman, P. Amino acids in human blood plasma after single meals of meat, oil, sucrose and whiskey. J. Nutr. 109, 621-630 (1979).
- Atila, A. et al. The serum amino acid profile in COVID-19. Amino Acids 53, 1569-1588 (2021).
- Rao, T. S., Asha, M. R., Ramesh, B. N. & Rao, K. S. Understanding nutrition, depression and mental illnesses. Indian J. Psychiatry 50, 77-82 (2008).
- Cynober, L. A. Plasma amino acid levels with a note on membrane transport: characteristics, regulation, and metabolic significance. Nutrition 18, 761-766 (2002).
- Baker, L. B. & Wolfe, A. S. Physiological mechanisms determining eccrine sweat composition. Eur. J. Appl. Physiol. 120, 719-752 (2020).
- Baker, L. B. Physiology of sweat gland function: The roles of sweating and sweat composition in human health. Temperature 6, 211-259 (2019).
- Sylvestre, J. P., Bouissou, C. C., Guy, R. H. & Delgado-Charro, M. B. Extraction and quantification of amino acids in human stratum corneum in vivo. Br. J. Dermatol. 163, 458-465 (2010).
- Yang, D. S., Ghaffari, R. & Rogers, J. A. Sweat as a diagnostic biofluid. Science 379, 760-761 (2023).
- Bariya, M., Nyein, H. Y. Y. & Javey, A. Wearable sweat sensors. Nat. Electron. 1, 160-171 (2018).
- Luo, Y. et al. Technology roadmap for flexible sensors. ACS Nano 17, 5211-5295 (2023).
- Dunstan, R. H. et al. Sweat facilitated amino acid losses in male athletes during exercise at 32-34 degrees C. PLoS One 11, e0167844 (2016).
- Murphy, G. R. et al. Relationships between electrolyte and amino acid compositions in sweat during exercise suggest a role for amino acids and
in reabsorption of and Cl – from sweat. PLoS One 14, e0223381 (2019). - Jankovskaja, S. et al. Non-invasive, topical sampling of potential, low-molecular weight, skin cancer biomarkers: a study on healthy volunteers. Anal. Chem. 94, 5856-5865 (2022).
- Wang, M. et al. A wearable electrochemical biosensor for the monitoring of metabolites and nutrients. Nat. Biomed. Eng. 6, 1225-1235 (2022).
- Yang, Y. et al. A laser-engraved wearable sensor for sensitive detection of uric acid and tyrosine in sweat. Nat. Biotechnol. 38, 217-224 (2019).
- Pei, X. et al. A bifunctional fully integrated wearable tracker for epidermal sweat and wound exudate multiple biomarkers monitoring. Small 18, 2205061 (2022).
- Mukasa, D. et al. A computationally assisted approach for designing wearable biosensors toward non-invasive personalized molecular analysis. Adv. Mater. 35, e2212161 (2023).
- Souza, S. L., Graca, G. & Oliva, A. Characterization of sweat induced with pilocarpine, physical exercise, and collected passively by metabolomic analysis. Ski. Res. Technol. 24, 187-195 (2018).
- Harshman, S. W. et al. Metabolomic stability of exercise-induced sweat. J. Chromatogr. B: Anal. Technol. Biomed. Life Sci. 1126-1127, 121763 (2019).
- Heikenfeld, J. Non-invasive analyte access and sensing through eccrine sweat: challenges and outlook circa 2016. Electroanalysis 28, 1242-1249 (2016).
- Gitlitz, P. H., Sunderman, F. W. & Hohnadel, D. C. Ion-exchange chromatography of amino acids in sweat collected from healthy subjects during sauna bathing. Clin. Chem. 20, 1305-1312 (1974).
- Longo, N. et al. Noninvasive measurement of phenylalanine by iontophoretic extraction in patients with phenylketonuria. J. Inherit. Metab. Dis. 30, 910-915 (2007).
- van Spronsen, F. J. et al. Key European guidelines for the diagnosis and management of patients with phenylketonuria. Lancet Diabetes Endocrinol. 5, 743-756 (2017).
- Volpi, E., Kobayashi, H., Sheffield-Moore, M., Mittendorfer, B. & Wolfe, R. R. Essential amino acids are primarily responsible for the amino acid stimulation of muscle protein anabolism in healthy elderly adults. Am. J. Clin. Nutr. 78, 250-258 (2003).
- Swierczynski, J., Sledzinski, T., Slominska, E., Smolenski, R. & Sledzinski, Z. Serum phenylalanine concentration as a marker of liver function in obese patients before and after bariatric surgery. Obes. Surg. 19, 883-889 (2009).
- Dunstan, R. H. et al. Diverse characteristics of the urinary excretion of amino acids in humans and the use of amino acid supplementation to reduce fatigue and sub-health in adults. Nutr. J. 16, 19 (2017).
- Sonner, Z. et al. The microfluidics of the eccrine sweat gland, including biomarker partitioning, transport, and biosensing implications. Biomicrofluidics 9, 031301 (2015).
- Nyein, H. Y. Y. et al. Regional and correlative sweat analysis using high-throughput microfluidic sensing patches toward decoding sweat. Sci. Adv. 5, eaaw9906 (2019).
- Yu, Q. et al. Semisynthetic sensor proteins enable metabolic assays at the point of care. Science 361, 1122-1126 (2018).
- Wentland, L., Polaski, R. & Fu, E. Characterization methods in porous materials for the rational design of multi-step processing in the context of a paper microfluidic phenylalanine test. Anal. Methods 12, 768-780 (2020).
- Cheung, K. M. et al. Phenylalanine monitoring via aptamer-fieldeffect transistor sensors. ACS Sens 4, 3308-3317 (2019).
- Hsu, L.-W. et al. Simultaneous determination of l-Phenylalanine, Phenylethylamine, and Phenylacetic acid using three-color wholecell biosensors within a microchannel device. ACS Appl. Bio Mater. 3, 5120-5125 (2020).
- Ahmad, O. S., Bedwell, T. S., Esen, C., Garcia-Cruz, A. & Piletsky, S. A. Molecularly imprinted polymers in electrochemical and optical sensors. Trends Biotechnol. 37, 294-309 (2019).
- Parrilla, M., Vanhooydonck, A., Watts, R. & De Wael, K. Wearable wristband-based electrochemical sensor for the detection of phenylalanine in biofluids. Biosens. Bioelectron. 197, 113764 (2022).
- Sheridan, E. M. & Breslin, C. B. Enantioselective detection of D- and L-phenylalanine using optically active polyaniline. Electroanalysis 17, 532-537 (2005).
- He, S. et al. Electrochemical enantioselective sensor for effective recognition of tryptophan isomers based on chiral polyaniline twisted nanoribbon. Anal. Chim. Acta 1147, 155-164 (2021).
- Hu, Y. F., Zhang, Z. H., Zhang, H. B., Luo, L. J. & Yao, S. Z. Electrochemical determination of L-phenylalanine at polyaniline modified carbon electrode based on beta-cyclodextrin incorporated carbon nanotube composite material and imprinted sol-gel film. Talanta 84, 305-313 (2011).
- Zhong, B., Jiang, K., Wang, L. & Shen, G. Wearable sweat loss measuring devices: from the role of sweat loss to advanced mechanisms and designs. Adv. Sci. 9, e2103257 (2022).
- Sun, M. et al. A flexible and wearable epidermal ethanol biofuel cell for on-body and real-time bioenergy harvesting from human sweat. Nano Energy 86, 106061 (2021).
- Tu, J. et al. A wireless patch for the monitoring of C-reactive protein in sweat. Nat. Biomed. Eng. 7, 1293-1306 (2023).
- Torrente-Rodríguez, R. M. et al. Investigation of cortisol dynamics in human sweat using a graphene-based wireless mhealth system. Matter 2, 921-937 (2020).
- Zhang, X., Xia, Y., Liu, Y., Mugo, S. M. & Zhang, Q. Integrated wearable sensors for sensing physiological pressure signals and beta-hydroxybutyrate in physiological fluids. Anal. Chem. 94, 993-1002 (2021).
- Bi, Y. et al. Universal fully integrated wearable sensor arrays for the multiple electrolyte and metabolite monitoring in raw sweat, saliva, or urine. Anal. Chem. 95, 6690-6699 (2023).
- Zhao, J. et al. A wearable nutrition tracker. Adv. Mater. 33, e2006444 (2020).
- Sempionatto, J. R., Moon, J. M. & Wang, J. Touch-based fingertip blood-free reliable glucose monitoring: personalized data processing for predicting blood glucose concentrations. ACS Sens. 6, 1875-1883 (2021).
- Reeder, J. T. et al. Resettable skin interfaced microfluidic sweat collection devices with chemesthetic hydration feedback. Nat. Commun. 10, 5513 (2019).
- Lu Y. et al. Stretchable graphene-hydrogel interfaces for wearable and implantable bioelectronics. Nat. Electron. https://doi.org/10. 1038/s41928-023-01091-y (2023).
- Liu, Y. et al. Skin-interfaced superhydrophobic insensible sweat sensors for evaluating body thermoregulation and skin barrier functions. ACS Nano 17, 5588-5599 (2023).
- Nyein, H. Y. Y. et al. A wearable microfluidic sensing patch for dynamic sweat secretion analysis. ACS Sens. 3, 944-952 (2018).
- Eijsvogels, T. M. et al. The impact of obesity on physiological responses during prolonged exercise. Int. J. Obes. 35, 1404-1412 (2011).
- Harshman, S. W. et al. The impact of nutritional supplementation on sweat metabolomic content: a proof-of-concept study. Front. Chem. 9, 659583 (2021).
شكر وتقدير
مساهمات المؤلفين
المصالح المتنافسة
معلومات إضافية
المواد التكميلية المتاحة على
https://doi.org/10.1038/s41467-024-44751-z.
http://www.nature.com/reprints
© المؤلفون 2024
المختبر الوطني الرئيسي للهياكل الفائقة والميكروهياكل، معهد أشباه الموصلات، الأكاديمية الصينية للعلوم، بكين 100083، الصين. مركز علوم المواد والهندسة الضوئية، جامعة الأكاديمية الصينية للعلوم، بكين 100049، الصين. مختبر تيانجين الرئيسي لانتقال سرطان الرئة وبيئة الورم، معهد سرطان الرئة في تيانجين، مستشفى تيانجين الطبي العام، تيانجين 300052، الصين. مدرسة الهندسة الكيميائية ومركز أبحاث النانو الحيوية الانتقالية، جامعة سونغكيوكوان، سوون 16419، جمهورية كوريا. مدرسة علوم المواد والهندسة، جامعة نانيانغ التكنولوجية، 637553 سنغافورة، سنغافورة. البريد الإلكتروني:liliwang@semi.ac.cn
DOI: https://doi.org/10.1038/s41467-024-44751-z
PMID: https://pubmed.ncbi.nlm.nih.gov/38245507
Publication Date: 2024-01-20
Interindividual- and blood-correlated sweat phenylalanine multimodal analytical biochips for tracking exercise metabolism
Accepted: 3 January 2024
Published online: 20 January 2024
Abstract
In situ monitoring of endogenous amino acid loss through sweat can provide physiological insights into health and metabolism. However, existing amino acid biosensors are unable to quantitatively assess metabolic status during exercise and are rarely used to establish blood-sweat correlations because they only detect a single concentration indicator and disregard sweat rate. Here, we present a wearable multimodal biochip integrated with advanced electrochemical electrodes and multipurpose microfluidic channels that enables simultaneous quantification of multiple sweat indicators, including phenylalanine and chloride, as well as sweat rate. This combined measurement approach reveals a negative correlation between sweat phenylalanine levels and sweat rates among individuals, which further enables identification of individuals at high metabolic risk. By tracking phenylalanine fluctuations induced by protein intake during exercise and normalizing the concentration indicator by sweat rates to reduce interindividual variability, we demonstrate a reliable method to correlate and analyze sweat-blood phenylalanine levels for personal health monitoring.
skin diseases because they arise from both the endogenous loss of plasma

principle and cross-section of the microfluidic module with vertically assembled structure. e Comparation of Phe DPV responses of the integrated wireless system and pristine electrodes.
provides attractive opportunities for non-invasive and convenient health monitoring.
is hypothesized to partition into sweat via diffusion due to its small size and nonpolar side chain properties
muscle protein metabolism during exercise
we demonstrate similar and strong correlations between sweat and serum Phe levels in different volunteers before and after protein intake via sweat rate normalization to reduce interindividual variability. All these demonstrations reveal the potential utility of our wearable multimodal system for sweat-based personalized exercise and diet management.
Results
Integrated system sensing strategy and applications
collect data from multiple volunteers after 20 min of exercise, we observed a moderately negative correlation between sweat rate and Phe concentration (Fig. 1f), indicating that the mechanism of Phe partitioning into sweat relies on diffusion and its concentration may be affected by sweat dilution
Electrochemical characterization of E-MIP sensor
Design and performance characterization of multipurpose microfluidics

| Electrode |
|
| PANI-E-MIP | 3.924 e |
| PANI-E-NIP | 3.013 e |
| PPY-E-NIP | 2.861 e |
| Au | 2.757 e |



electrode, a MIP electrode, and an Au electrode in a PBS containing
and Supplementary Fig. 23). Additionally, a computer vision algorithm was used for automatic sweat loss reading (Supplementary Note 3). Based on this, the exercise sweat rates of two identical body parts (forehead and forearm) of eight volunteers were measured to demonstrate the practicality of this visualization design (Fig. 3i, Supplementary Fig. 24, and Supplementary Table 3), which can be used to
comprehensively investigate the relationship between AA loss and water loss during exercise.

ability to buffer sweat to neutral pH conditions for more than 40 min during intense exercise with a persistently high sweat rate of
sensor response within the design expectation. Furthermore, A stable response of the sensor was been obtained in the skin physiological temperature range (Supplementary Fig. 26). More importantly, the integrated sensor also exhibited stable DPV readouts for Phe sensing at different flow rates from 0.5 to
Sensor evaluation for assessing exercise metabolic risk

[around
body’s response to the exercise load as expected
Evaluation of sweat Phe sensor for diet management and serum correlation
(plateau after 30 min ), protein diet intake resulted in elevated sweat Phe levels in both subjects, while decreased levels were measured after rest (Fig. 5b). Moreover, the successive decrease of Phe levels in the initial stage of exercise sweating ( 10 min ) points to the consumption of skin Phe and its untimely replenishment (Supplementary Fig. 30). However, Phe levels measured after 20 min did not show this change trend. Combined with the above two different phenomena, it could be inferred that skin Phe in sweat is no longer dominant at this time, but is replaced by the contribution from blood. Importantly, there was a greater extent of Phe percentage fluctuation (especially for sweat changes) in the overweight subject than in the lean subject, which is likely due to different metabolic conditions (Supplementary Fig. 31).
Biocompatibility
Discussion

samples collected in the above evaluation experiment. The solid line represents the linear-fitted trendline. e Comparative study of sweat and serum Phe levels in the three periods of exercise from subject #1 (top) and subject #5 (bottom).
selectivity for sweat monitoring. Furthermore, an elaborate multipurpose microfluidics was designed via a scalable and low-cost laserengraving technique to achieve multiple goals, including sweat neutral pH buffering for stable Phe detection, rapid sweat sampling and refreshing for high temporal resolution, and sweat flow visualization for readable sweat loss. By integrating these two highly complementary and mutually beneficial approaches, the wearable system worn on the skin surface enables the continuous, reliable, and rapid
detection of Phe concentrations along with the accessible and visual readout of sweat loss during exercise. Potential improvements in the system could focus on the development of continuous sweat loss readings through electrical methods for more diverse application scenarios.
thus analyze the potential mechanism of Phe partitioning. Additionally, we have combined these two indicators as a new indicator, sweat Phe secretion rate, for quantitatively assessing the exercise metabolic risk of two populations with different BMI. Finally, we have conducted a pilot study to understand the metabolic correlation of Phe content in sweat versus serum before, during, and after protein diet intake at exercise, revealing their high and similar correlations in two subjects after sweat rate normalization. All these results demonstrate that simultaneous determination of sweat amino acid concentration and sweat rate can offer new and valuable insights into the assessment of metabolic status and corresponding blood levels. To overcome the limited subjects’ data in the study, future work will include the investigation of more subjects with different metabolic conditions to expand on the proof-of-concept data herein and to build a stronger correlation of sweat and serum Phe levels by considering the sweat dilution effect. Such approaches will pave the way for a range of clinical application scenarios, such as non-invasive and personalized low-Phe diet management for PKU patients. More importantly, our finding that non-NMF AAs in sweat mainly stem from the endogenous loss of plasma AAs as sweating progresses can be extended to other species. These measurement capabilities can be utilized to study more sweatserum AA correlations and their detailed partitioning mechanisms with the help of multimodal sweat sensing in follow-up studies.
Methods
Fabrication and preparation of the sweat sensor
Characterization of the sweat sensor
Computational simulation methodology of molecular interactions
Fabrication, assembly and characterization of the multipurpose microfluidics
chamber-patterned filter paper (Whatman, USA) drip-coated and dried by
Numerical simulations of sweat dynamics in microfluidics
Wireless flexible circuit module and smartphone application
Power source
regulator (S-1206B33-M3T1G) was used to convert and produce a stable and separate 3.3 V digital and analog power supplies to serve the MCU and analog peripheral components, respectively, which creates separate digital and analog circuitry to prevent the digital circuitry from affecting analog signals.
Human subject recruitment
On-body integrated system test
Colorimetry for sweat sample analysis
absorbance of a Glycine standard ( 10 mM ). The above unspent reagents in the colorimetric assay kits were stored at
System validation with protein diet intake
LC-MS for serum analysis
In vitro biocompatibility assessment
Statistical analysis
Reporting summary
Data availability
Code availability
References
- Wu, G. Amino acids: metabolism, functions, and nutrition. Amino Acids 37, 1-17 (2009).
- Braverman E. R., Pfeiffer C. C., Blum K. & Smayda R. The healing nutrients within: facts, findings, and new research on amino acids. Basic Health Publications, Inc. (2003).
- Li, P., Yin, Y. L., Li, D., Kim, S. W. & Wu, G. Amino acids and immune function. Br. J. Nutr. 98, 237-252 (2007).
- Nie, C., He, T., Zhang, W., Zhang, G. & Ma, X. Branched chain amino acids: beyond nutrition metabolism. Int. J. Mol. Sci. 19, 954 (2018).
- Fernstrom, J. D. & Wurtman, R. J. Brain serotonin content: physiological regulation by plasma neutral amino acids. Science 178, 414-416 (1972).
- Hu, X. & Guo, F. Amino acid sensing in metabolic homeostasis and health. Endocr. Rev. 42, 56-76 (2021).
- Munro H. N. Mammalian protein metabolism. Elsevier (2012).
- Felig, P. Amino acid metabolism in man. Annu. Rev. Biochem. 44, 933-955 (1975).
- Wagenmakers, A. J. M. 11 muscle amino acid metabolism at rest and during exercise: role in human physiology and metabolism. Exerc. Sport Sci. Rev. 26, 287-314 (1998).
- Nasset, E. S., Heald, F. P., Calloway, D. H., Margen, S. & Schneeman, P. Amino acids in human blood plasma after single meals of meat, oil, sucrose and whiskey. J. Nutr. 109, 621-630 (1979).
- Atila, A. et al. The serum amino acid profile in COVID-19. Amino Acids 53, 1569-1588 (2021).
- Rao, T. S., Asha, M. R., Ramesh, B. N. & Rao, K. S. Understanding nutrition, depression and mental illnesses. Indian J. Psychiatry 50, 77-82 (2008).
- Cynober, L. A. Plasma amino acid levels with a note on membrane transport: characteristics, regulation, and metabolic significance. Nutrition 18, 761-766 (2002).
- Baker, L. B. & Wolfe, A. S. Physiological mechanisms determining eccrine sweat composition. Eur. J. Appl. Physiol. 120, 719-752 (2020).
- Baker, L. B. Physiology of sweat gland function: The roles of sweating and sweat composition in human health. Temperature 6, 211-259 (2019).
- Sylvestre, J. P., Bouissou, C. C., Guy, R. H. & Delgado-Charro, M. B. Extraction and quantification of amino acids in human stratum corneum in vivo. Br. J. Dermatol. 163, 458-465 (2010).
- Yang, D. S., Ghaffari, R. & Rogers, J. A. Sweat as a diagnostic biofluid. Science 379, 760-761 (2023).
- Bariya, M., Nyein, H. Y. Y. & Javey, A. Wearable sweat sensors. Nat. Electron. 1, 160-171 (2018).
- Luo, Y. et al. Technology roadmap for flexible sensors. ACS Nano 17, 5211-5295 (2023).
- Dunstan, R. H. et al. Sweat facilitated amino acid losses in male athletes during exercise at 32-34 degrees C. PLoS One 11, e0167844 (2016).
- Murphy, G. R. et al. Relationships between electrolyte and amino acid compositions in sweat during exercise suggest a role for amino acids and
in reabsorption of and Cl – from sweat. PLoS One 14, e0223381 (2019). - Jankovskaja, S. et al. Non-invasive, topical sampling of potential, low-molecular weight, skin cancer biomarkers: a study on healthy volunteers. Anal. Chem. 94, 5856-5865 (2022).
- Wang, M. et al. A wearable electrochemical biosensor for the monitoring of metabolites and nutrients. Nat. Biomed. Eng. 6, 1225-1235 (2022).
- Yang, Y. et al. A laser-engraved wearable sensor for sensitive detection of uric acid and tyrosine in sweat. Nat. Biotechnol. 38, 217-224 (2019).
- Pei, X. et al. A bifunctional fully integrated wearable tracker for epidermal sweat and wound exudate multiple biomarkers monitoring. Small 18, 2205061 (2022).
- Mukasa, D. et al. A computationally assisted approach for designing wearable biosensors toward non-invasive personalized molecular analysis. Adv. Mater. 35, e2212161 (2023).
- Souza, S. L., Graca, G. & Oliva, A. Characterization of sweat induced with pilocarpine, physical exercise, and collected passively by metabolomic analysis. Ski. Res. Technol. 24, 187-195 (2018).
- Harshman, S. W. et al. Metabolomic stability of exercise-induced sweat. J. Chromatogr. B: Anal. Technol. Biomed. Life Sci. 1126-1127, 121763 (2019).
- Heikenfeld, J. Non-invasive analyte access and sensing through eccrine sweat: challenges and outlook circa 2016. Electroanalysis 28, 1242-1249 (2016).
- Gitlitz, P. H., Sunderman, F. W. & Hohnadel, D. C. Ion-exchange chromatography of amino acids in sweat collected from healthy subjects during sauna bathing. Clin. Chem. 20, 1305-1312 (1974).
- Longo, N. et al. Noninvasive measurement of phenylalanine by iontophoretic extraction in patients with phenylketonuria. J. Inherit. Metab. Dis. 30, 910-915 (2007).
- van Spronsen, F. J. et al. Key European guidelines for the diagnosis and management of patients with phenylketonuria. Lancet Diabetes Endocrinol. 5, 743-756 (2017).
- Volpi, E., Kobayashi, H., Sheffield-Moore, M., Mittendorfer, B. & Wolfe, R. R. Essential amino acids are primarily responsible for the amino acid stimulation of muscle protein anabolism in healthy elderly adults. Am. J. Clin. Nutr. 78, 250-258 (2003).
- Swierczynski, J., Sledzinski, T., Slominska, E., Smolenski, R. & Sledzinski, Z. Serum phenylalanine concentration as a marker of liver function in obese patients before and after bariatric surgery. Obes. Surg. 19, 883-889 (2009).
- Dunstan, R. H. et al. Diverse characteristics of the urinary excretion of amino acids in humans and the use of amino acid supplementation to reduce fatigue and sub-health in adults. Nutr. J. 16, 19 (2017).
- Sonner, Z. et al. The microfluidics of the eccrine sweat gland, including biomarker partitioning, transport, and biosensing implications. Biomicrofluidics 9, 031301 (2015).
- Nyein, H. Y. Y. et al. Regional and correlative sweat analysis using high-throughput microfluidic sensing patches toward decoding sweat. Sci. Adv. 5, eaaw9906 (2019).
- Yu, Q. et al. Semisynthetic sensor proteins enable metabolic assays at the point of care. Science 361, 1122-1126 (2018).
- Wentland, L., Polaski, R. & Fu, E. Characterization methods in porous materials for the rational design of multi-step processing in the context of a paper microfluidic phenylalanine test. Anal. Methods 12, 768-780 (2020).
- Cheung, K. M. et al. Phenylalanine monitoring via aptamer-fieldeffect transistor sensors. ACS Sens 4, 3308-3317 (2019).
- Hsu, L.-W. et al. Simultaneous determination of l-Phenylalanine, Phenylethylamine, and Phenylacetic acid using three-color wholecell biosensors within a microchannel device. ACS Appl. Bio Mater. 3, 5120-5125 (2020).
- Ahmad, O. S., Bedwell, T. S., Esen, C., Garcia-Cruz, A. & Piletsky, S. A. Molecularly imprinted polymers in electrochemical and optical sensors. Trends Biotechnol. 37, 294-309 (2019).
- Parrilla, M., Vanhooydonck, A., Watts, R. & De Wael, K. Wearable wristband-based electrochemical sensor for the detection of phenylalanine in biofluids. Biosens. Bioelectron. 197, 113764 (2022).
- Sheridan, E. M. & Breslin, C. B. Enantioselective detection of D- and L-phenylalanine using optically active polyaniline. Electroanalysis 17, 532-537 (2005).
- He, S. et al. Electrochemical enantioselective sensor for effective recognition of tryptophan isomers based on chiral polyaniline twisted nanoribbon. Anal. Chim. Acta 1147, 155-164 (2021).
- Hu, Y. F., Zhang, Z. H., Zhang, H. B., Luo, L. J. & Yao, S. Z. Electrochemical determination of L-phenylalanine at polyaniline modified carbon electrode based on beta-cyclodextrin incorporated carbon nanotube composite material and imprinted sol-gel film. Talanta 84, 305-313 (2011).
- Zhong, B., Jiang, K., Wang, L. & Shen, G. Wearable sweat loss measuring devices: from the role of sweat loss to advanced mechanisms and designs. Adv. Sci. 9, e2103257 (2022).
- Sun, M. et al. A flexible and wearable epidermal ethanol biofuel cell for on-body and real-time bioenergy harvesting from human sweat. Nano Energy 86, 106061 (2021).
- Tu, J. et al. A wireless patch for the monitoring of C-reactive protein in sweat. Nat. Biomed. Eng. 7, 1293-1306 (2023).
- Torrente-Rodríguez, R. M. et al. Investigation of cortisol dynamics in human sweat using a graphene-based wireless mhealth system. Matter 2, 921-937 (2020).
- Zhang, X., Xia, Y., Liu, Y., Mugo, S. M. & Zhang, Q. Integrated wearable sensors for sensing physiological pressure signals and beta-hydroxybutyrate in physiological fluids. Anal. Chem. 94, 993-1002 (2021).
- Bi, Y. et al. Universal fully integrated wearable sensor arrays for the multiple electrolyte and metabolite monitoring in raw sweat, saliva, or urine. Anal. Chem. 95, 6690-6699 (2023).
- Zhao, J. et al. A wearable nutrition tracker. Adv. Mater. 33, e2006444 (2020).
- Sempionatto, J. R., Moon, J. M. & Wang, J. Touch-based fingertip blood-free reliable glucose monitoring: personalized data processing for predicting blood glucose concentrations. ACS Sens. 6, 1875-1883 (2021).
- Reeder, J. T. et al. Resettable skin interfaced microfluidic sweat collection devices with chemesthetic hydration feedback. Nat. Commun. 10, 5513 (2019).
- Lu Y. et al. Stretchable graphene-hydrogel interfaces for wearable and implantable bioelectronics. Nat. Electron. https://doi.org/10. 1038/s41928-023-01091-y (2023).
- Liu, Y. et al. Skin-interfaced superhydrophobic insensible sweat sensors for evaluating body thermoregulation and skin barrier functions. ACS Nano 17, 5588-5599 (2023).
- Nyein, H. Y. Y. et al. A wearable microfluidic sensing patch for dynamic sweat secretion analysis. ACS Sens. 3, 944-952 (2018).
- Eijsvogels, T. M. et al. The impact of obesity on physiological responses during prolonged exercise. Int. J. Obes. 35, 1404-1412 (2011).
- Harshman, S. W. et al. The impact of nutritional supplementation on sweat metabolomic content: a proof-of-concept study. Front. Chem. 9, 659583 (2021).
Acknowledgements
Author contributions
Competing interests
Additional information
supplementary material available at
https://doi.org/10.1038/s41467-024-44751-z.
http://www.nature.com/reprints
© The Author(s) 2024
State Key Laboratory for Superlattices and Microstructures, Institute of Semiconductors, Chinese Academy of Sciences, Beijing 100083, China. Center of Materials Science and Optoelectronic Engineering, University of Chinese Academy of Sciences, Beijing 100049, China. Tianjin Key Laboratory of Lung Cancer Metastasis and Tumor Microenvironment, Tianjin Lung Cancer Institute, Tianjin Medical University General Hospital, Tianjin 300052, China. School of Chemical Engineering and Translational Nanobioscience Research Center, Sungkyunkwan University, Suwon 16419, Republic of Korea. School of Materials Science and Engineering, Nanyang Technological University, 637553 Singapore, Singapore. e-mail: liliwang@semi.ac.cn
