DOI: https://doi.org/10.1038/s41598-024-55810-2
PMID: https://pubmed.ncbi.nlm.nih.gov/38472251
تاريخ النشر: 2024-03-12
تحمي جزيئات النانو من السيليكون والحديد الأرز من إجهاد الرصاص (Pb) من خلال تحسين التحمل التأكسدي وتقليل امتصاص الرصاص
الملخص
الرصاص (Pb) سام لتطور ونمو نباتات الأرز. تم اعتبار الجسيمات النانوية (NPs) واحدة من التقنيات الفعالة للتخفيف من إجهاد الرصاص في النباتات. لذلك، تم إجراء دراسة لفحص الآلية الأساسية لتخفيف سمية الرصاص الناتجة عن الجسيمات النانوية من الحديد (Fe) والسيليكون (Si) في شتلات الأرز.
ضغط المعادن الثقيلة على الأرز. لذلك، تم التخطيط لهذا العمل للتحقق من كفاءة التطبيق التآزري للسيليكون و
المواد والطرق
مواد نباتية ورعاية النمو
تقييم إنتاج الكتلة الحيوية للنباتات
تحليلات محتويات الكاروتينات والكلوروفيل
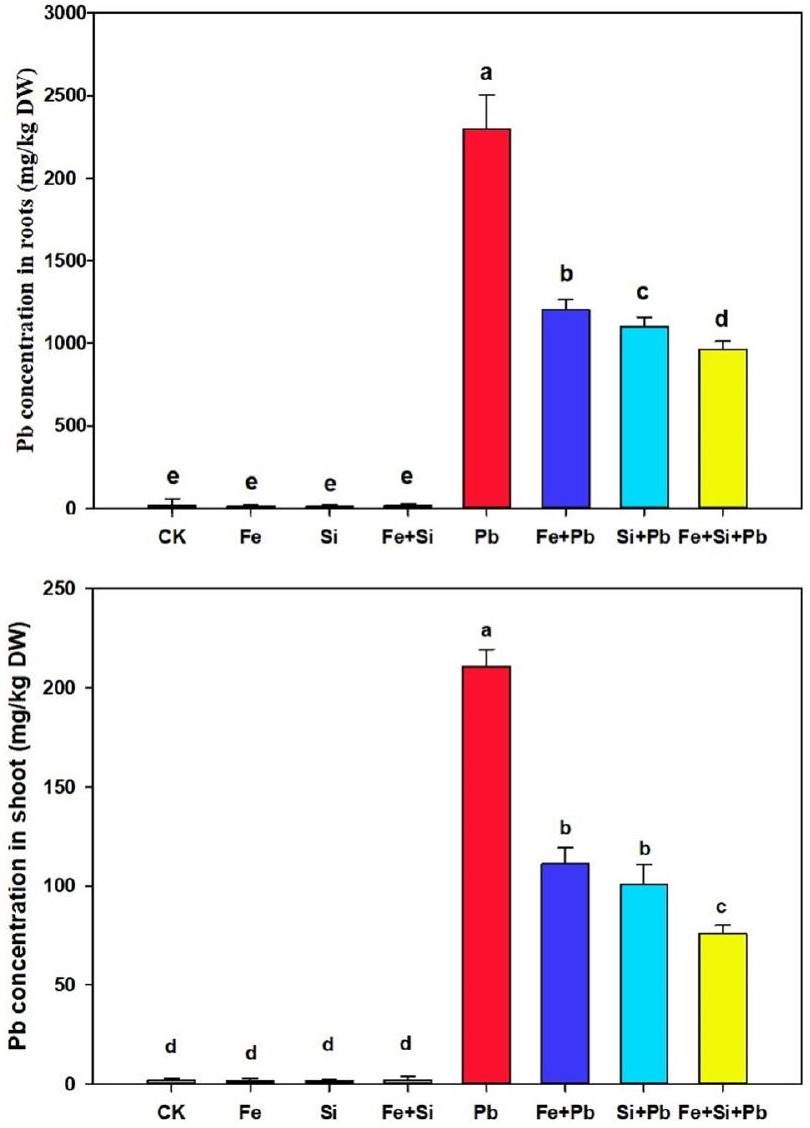
قياسات تركيز الرصاص في شتلات الأرز
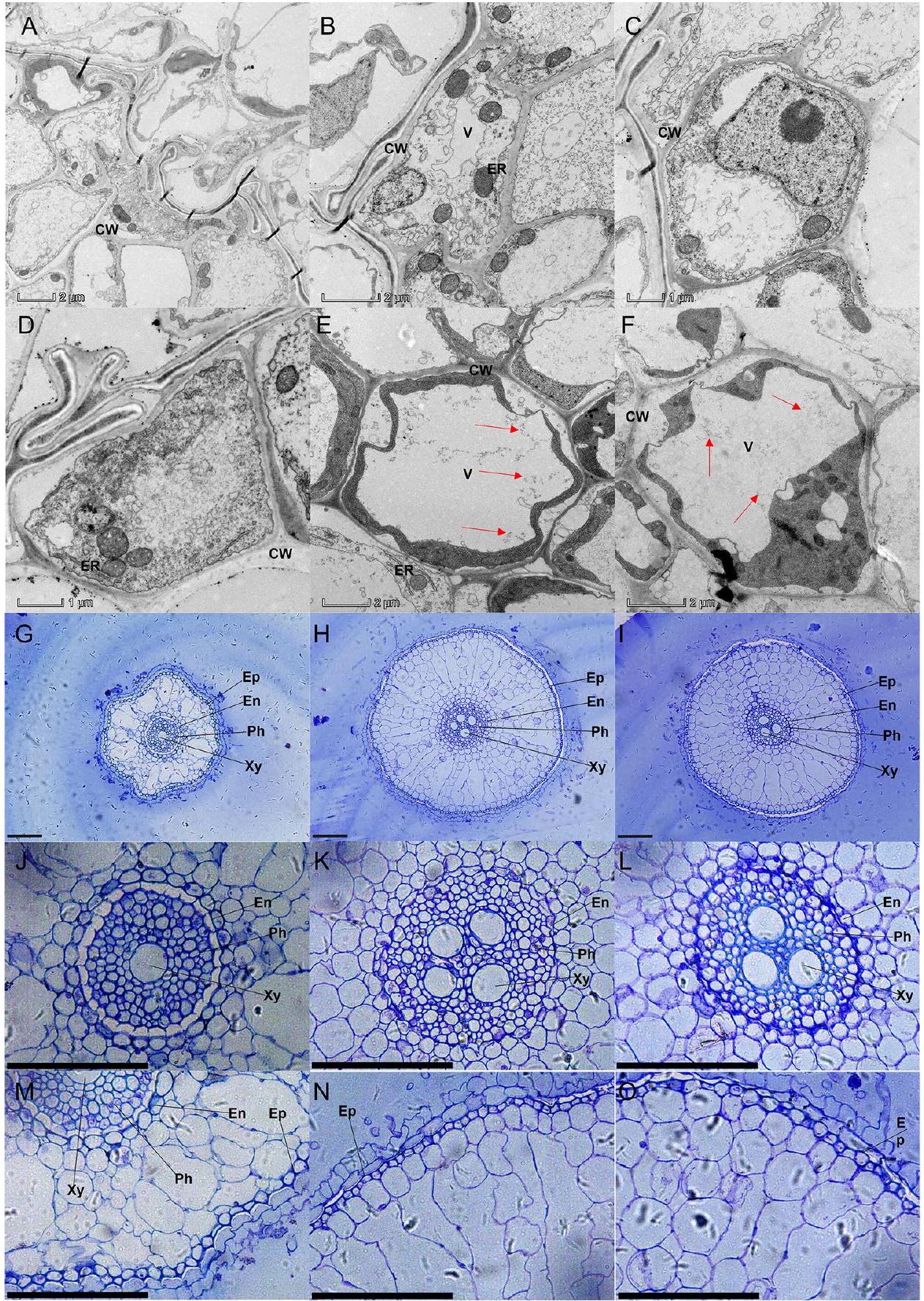
التحقيقات الخلوية بواسطة المجهر الإلكتروني الناقل (TEM)
ثم تم استخدام ميكروتوم (لايكا، ألمانيا) لقطع مقاطع رقيقة للغاية. تم رؤية هيكل الخلية تحت مجهر إلكتروني نافذ مزود بنظام تحليل الطاقة إينكا (أوكسفورد INCA Energy TEM 200 EDX) (فيلبس TECNAI 10، هولندا).
تحليل qRT-PCR
أنشطة مضادات الأكسدة والأكسدة
التحليلات الإحصائية
النتائج
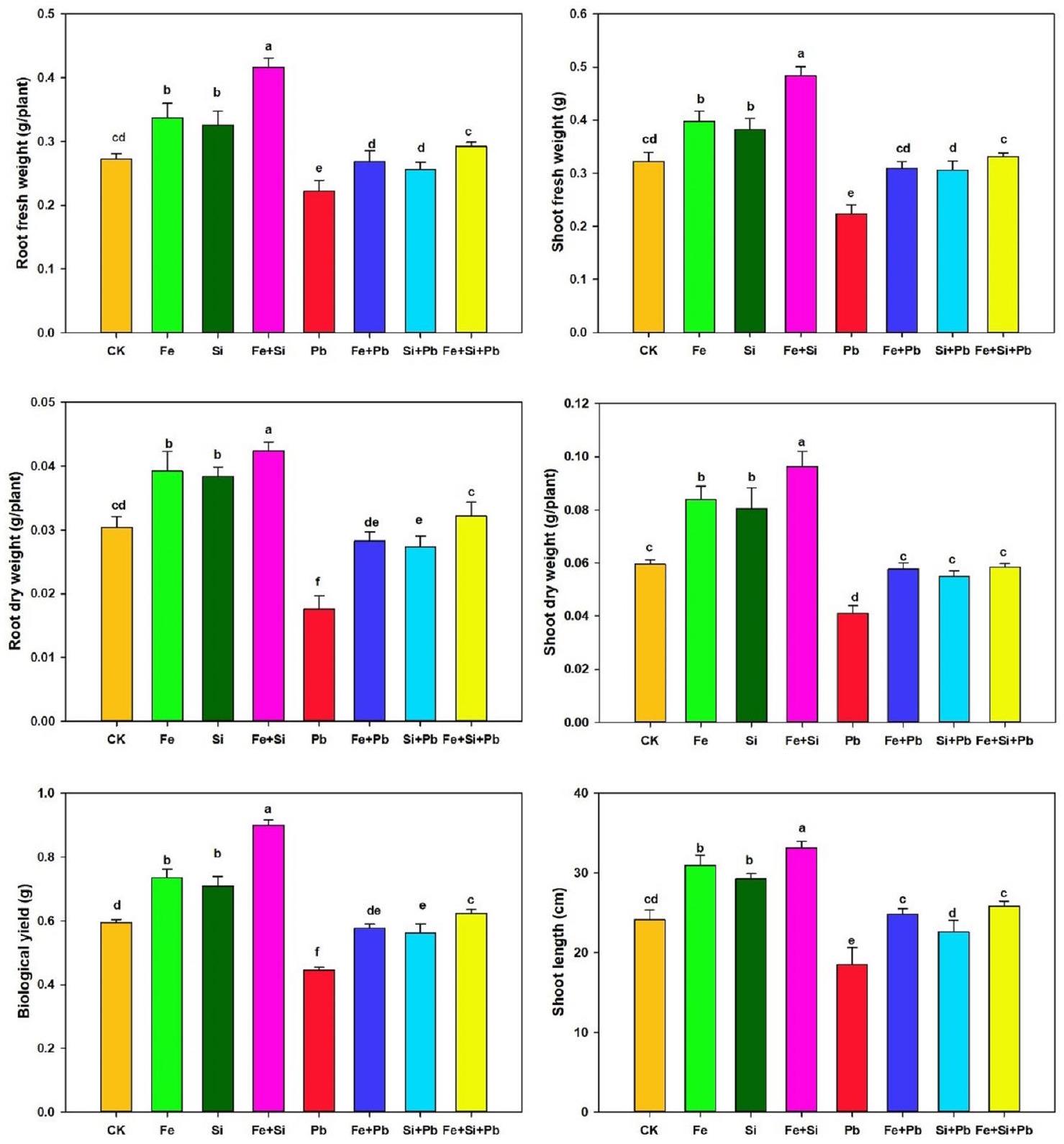
كتلة النباتات والكلوروفيل
سي و
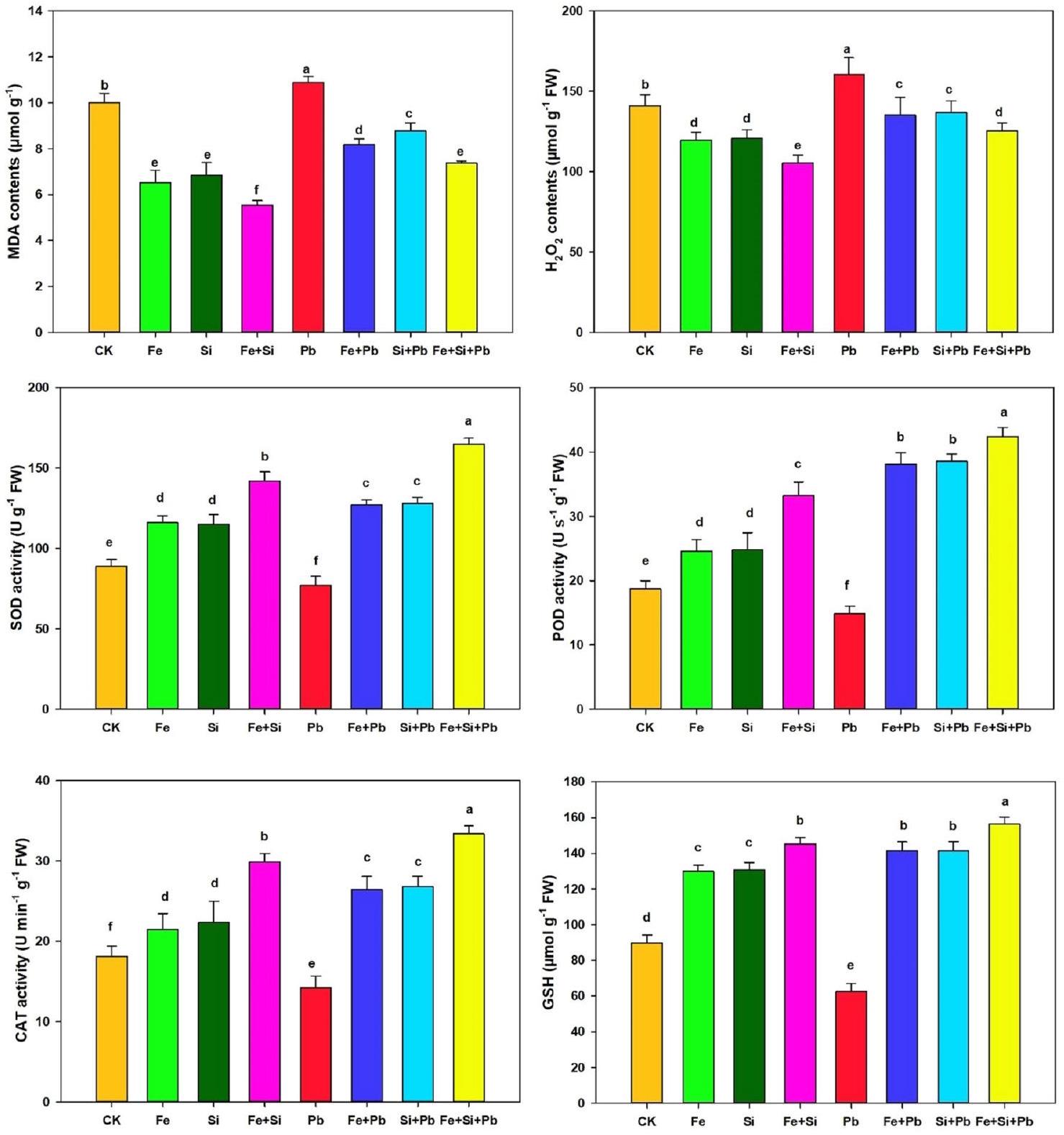
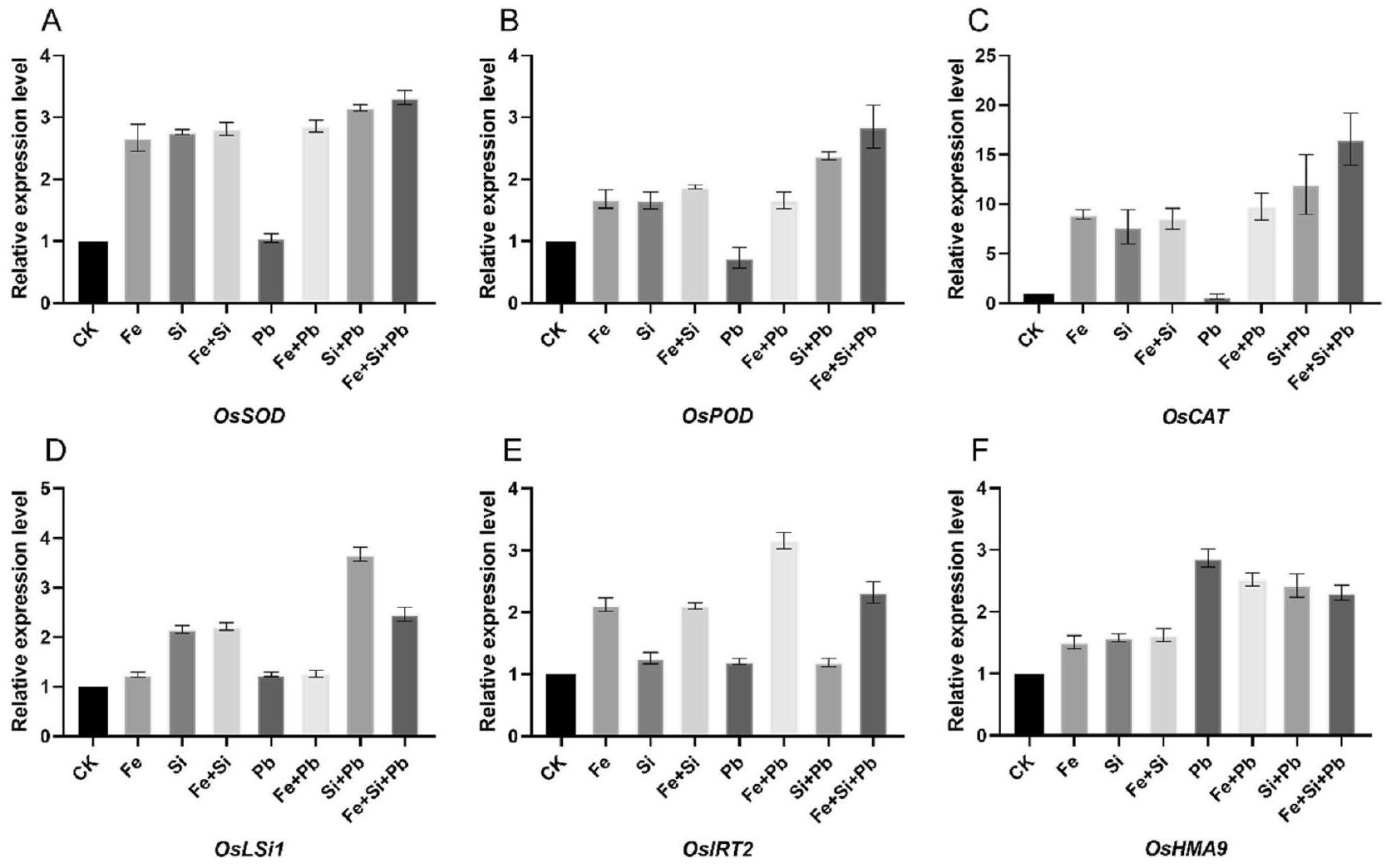
تأثير على أنشطة مضادات الأكسدة والأكسدة
تأثير جزيئات النانو من السيليكون والحديد على البنية الدقيقة للجذور
| المتغيرات | حديد | نعم | الرصاص |
|
|
|
|
| SL | <0.001 | <0.001 | <0.001 | <0.001 | 0.461 | 0.087 | 0.065 |
| RFW | <0.001 | <0.001 | <0.001 | <0.001 | 0.757 | 0.178 | 0.086 |
| RDW | <0.001 | <0.001 | <0.001 | <0.001 | 0.134 | 0.033 | 0.213 |
| SDW | <0.001 | <0.001 | <0.001 | <0.001 | 0.568 | 0.149 | 0.74 |
| جذر الرصاص | 0.988 | 0.979 | <0.001 | 0.974 | <0.001 | <0.001 | <0.001 |
| إطلاق الرصاص | 0.293 | 0.071 | <0.001 | 0.051 | <0.001 | <0.001 | <0.001 |
| جذر في | <0.001 | 0.524 | 0.464 | <0.001 | <0.001 | 0.66 | <0.001 |
| في شوت | <0.001 | 0.855 | 0.014 | <0.001 | <0.001 | 0.314 | <0.001 |
| إذا كان الجذر | 0.858 | <0.001 | 0.٦٩٩ | <0.001 | 0.697 | <0.001 | <0.001 |
| سي شوت | 0.977 | <0.001 | 0.853 | <0.001 | 0.844 | <0.001 | <0.001 |
| سود | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 |
| بود | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 |
| قط | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 |
| جي إس إتش | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 |
| كلوروفيل أ | <0.001 | <0.001 | <0.001 | <0.001 | 0.643 | 0.674 | 0.001 |
| كلوروفيل ب | <0.001 | <0.001 | <0.001 | <0.001 | 0.005 | 0.032 | 0.001 |
| كاروتينات | <0.001 | <0.001 | <0.001 | <0.001 | 0.002 | 0.003 | <0.001 |
|
|
<0.001 | <0.001 | 0.001 | <0.001 | 0.201 | 0.302 | 0.002 |
| MDA | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 |
تم قياس مستويات التعبير الجيني لجينات مضادات الأكسدة وناقلات المعادن تحت ضغط السيليكون و
الارتباط، خريطة الحرارة، التجانس، وتحليل المكونات الرئيسية
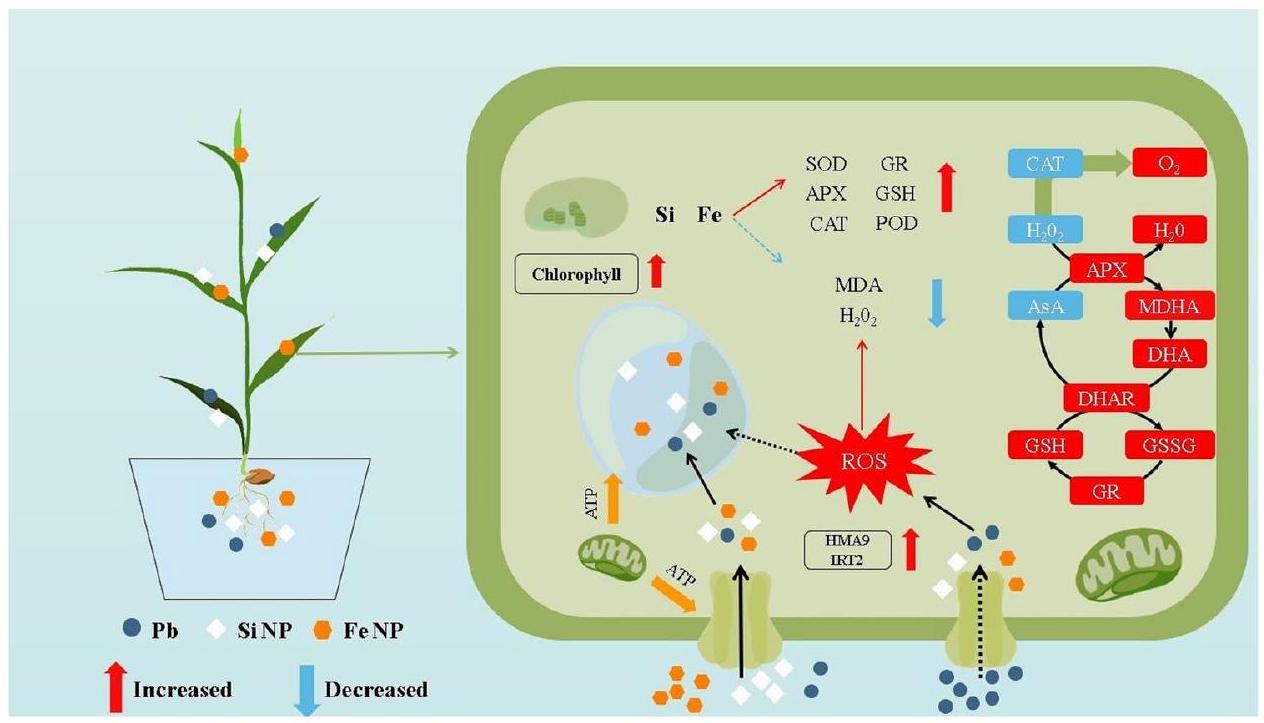
المناقشة

| حجم التأثير (r) | |||||||
| حديد | نعم | رصاص |
|
|
|
|
|
| SL | 0.908 | 0.899 | 0.778 | 0.962 | 0.124 | 0.308 | 0.501 |
| RFW | 0.832 | 0.784 | 0.816 | 0.979 | 0.021 | 0.429 | 0.656 |
| RDW | 0.811 | 0.891 | 0.939 | 0.952 | 0.386 | 0.524 | 0.209 |
| SDW | 0.933 | 0.822 | 0.951 | 0.961 | 0.201 | 0.636 | 0.125 |
| جذر الرصاص | 0.407 | 0.649 | 0.998 | 0.766 | 0.999 | 0.998 | 0.991 |
| إطلاق الرصاص | 0.702 | 0.938 | 0.996 | 0.880 | 0.995 | 0.999 | 0.998 |
| جذر في | 1.000 | 0.922 | 0.835 | 0.999 | 0.998 | 0.704 | 1.000 |
| في شوت | 0.998 | 0.018 | 0.847 | 0.981 | 0.996 | 0.354 | 0.987 |
| إذا كان الجذر | 0.908 | 0.999 | 0.976 | 0.999 | 0.976 | 0.997 | 0.997 |
| سي شوت | 0.032 | 0.996 | 0.٥٢٢ | 0.998 | 0.547 | 0.999 | 0.995 |
| سود | 0.989 | 0.983 | 0.843 | 0.992 | 0.994 | 0.993 | 0.997 |
| بود | 0.820 | 0.748 | 0.764 | 0.958 | 0.982 | 0.989 | 0.990 |
| قط | 0.984 | 0.9785 | 0.922 | 0.998 | 0.993 | 0.996 | 0.998 |
| جي إس إتش | 0.972 | 0.969 | 0.927 | 0.984 | 0.976 | 0.975 | 0.988 |
| كلوروفيل أ | 0.977 | 0.923 | 0.990 | 0.993 | 0.029 | 0.023 | 0.912 |
| كلوروفيل ب | 0.977 | 0.879 | 0.856 | 0.919 | 0.716 | 0.674 | 0.679 |
| كاروتينات | 0.964 | 0.878 | 0.976 | 0.944 | 0.760 | 0.786 | 0.934 |
|
|
0.862 | 0.862 | 0.630 | 0.950 | 0.184 | 0.171 | 0.767 |
| MDA | 0.958 | 0.949 | 0.728 | 0.984 | 0.917 | 0.757 | 0.964 |
الاستنتاجات
توفر البيانات
تم النشر على الإنترنت: 12 مارس 2024
References
- Zulfiqar, U. et al. Lead toxicity in plants: Impacts and remediation. J. Environ. Manage. 250, 109557 (2019).
- Ali, H., Khan, E. & Ilahi, I. Environmental chemistry and ecotoxicology of hazardous heavy metals: Environmental persistence, toxicity, and bioaccumulation. J. Chem. 2019, 1-14 (2019).
- Agarwal, P., Vibhandik, R., Agrahari, R., Daverey, A. & Rani, R. Role of root exudates on the soil microbial diversity and biogeochemistry of heavy metals. Appl. Biochem. Biotechnol. https://doi.org/10.1007/s12010-023-04465-2 (2023).
- Baldantoni, D., Morra, L., Zaccardelli, M. & Alfani, A. Cadmium accumulation in leaves of leafy vegetables. Ecotoxicol. Environ Saf 123, 89-94 (2016).
- Chibowska, K. et al. Pre- and neonatal exposure to lead (Pb) induces neuroinflammation in the forebrain cortex, hippocampus and cerebellum of rat pups. IJMS 21, 1083 (2020).
- Vega, F. A., Andrade, M. L. & Covelo, E. F. Influence of soil properties on the sorption and retention of cadmium, copper and lead, separately and together, by 20 soil horizons: Comparison of linear regression and tree regression analyses. J. Hazard Mater 174, 522-533 (2010).
- Saghi, A., Rashed Mohassel, M. H., Parsa, M. & Hammami, H. Phytoremediation of lead-contaminated soil by Sinapis arvensis and Rapistrum rugosum. Int. J. Phytoremediat. 18, 387-392 (2016).
- Hakeem, K. R., Alharby, H. F. & Rehman, R. Antioxidative defense mechanism against lead-induced phytotoxicity in Fagopyrum kashmirianum. Chemosphere 216, 595-604 (2019).
- Feng, L. et al. Carbonate-bound Pb percentage distribution in agricultural soil and its toxicity: Impact on plant growth, nutrient cycling, soil enzymes, and functional genes. J. Hazard. Mater. 451, 131205 (2023).
- Le, Q. H., Tran, D. D., Chen, Y.-C. & Nguyen, H. L. Risk of lead exposure from transport stations to human health: A case study in the Highland Province of Vietnam. Toxics 7, 48 (2019).
- Islam, M. S. et al. Assessment of heavy metals in foods around the industrial areas: Health hazard inference in Bangladesh. Geocarto Int. 35(3), 280-295. https://doi.org/10.1080/10106049.2018.1516246 (2020).
- Zhou, J., Zhang, Z., Zhang, Y., Wei, Y. & Jiang, Z. Effects of lead stress on the growth, physiology, and cellular structure of privet seedlings. PLoS ONE 13, e0191139 (2018).
- Aslam, M. et al. Lead toxicity in cereals: Mechanistic insight into toxicity, mode of action, and management. Front. Plant Sci. 11, 587785 (2021).
- Ghouri, F. et al. Alleviated lead toxicity in rice plant by co-augmented action of genome doubling and
nanoparticles on gene expression, cytological and physiological changes. Sci. Total Environ 911, 168709 (2024). - Ashraf, U. et al. Lead toxicity in rice: Effects, mechanisms, and mitigation strategies-A mini review. Environ. Sci. Pollut. Res. 22, 18318-18332 (2015).
- Ashraf, U. et al. Lead (Pb) toxicity: Physio-biochemical mechanisms, grain yield, quality, and Pb distribution proportions in scented rice. Front. Plant Sci. 8, 259 (2017).
- The Combined Strategy for iron uptake is not exclusive to domesticated rice (Oryza sativa) | Scientific Reports. https://www.nature. com/articles/s41598-019-52502-0.
- Liang, G. Iron uptake, signaling, and sensing in plants. Plant Commun. 3, 100349 (2022).
- Debona, D., Rodrigues, F. A. & Datnoff, L. E. Silicon’s role in abiotic and biotic plant stresses. Annu. Rev. Phytopathol. 55, 85-107 (2017).
- Etesami, H. & Jeong, B. R. Silicon (Si): Review and future prospects on the action mechanisms in alleviating biotic and abiotic stresses in plants. Ecotoxicol. Environ. Saf. 147, 881-896 (2018).
- Yu, H.-Y. et al. The availabilities of arsenic and cadmium in rice paddy fields from a mining area: The role of soil extractable and plant silicon. Environ. Pollut. 215, 258-265 (2016).
- Cai, Y. et al. The Cd sequestration effects of rice roots affected by different Si management in Cd -contaminated paddy soil. Sci. Total Environ. 849, 157718 (2022).
- Ghouri, F. et al. The protective role of tetraploidy and nanoparticles in arsenic-stressed rice: Evidence from RNA sequencing, ultrastructural and physiological studies. J. Hazard. Mater. 458, 132019 (2023).
- Lai, M. et al. Modulation of metal transporters, oxidative stress and cell abnormalities by synergistic application of silicon and titanium oxide nanoparticles: A strategy for cadmium tolerance in rice. Chemosphere 345, 140439 (2023).
- Hokkanen, S., Repo, E., Lou, S. & Sillanpää, M. Removal of arsenic(V) by magnetic nanoparticle activated microfibrillated cellulose. Chem. Eng. J. 260, 886-894 (2015).
- Ali, A. et al. Synthesis, characterization, applications, and challenges of iron oxide nanoparticles. NSA 9, 49-67 (2016).
- Xu, P. et al. Use of iron oxide nanomaterials in wastewater treatment: A review. Sci. Total Environ. 424, 1-10 (2012).
- Latif, A. et al. Remediation of heavy metals polluted environment using Fe-based nanoparticles: Mechanisms, influencing factors, and environmental implications. Environ. Pollut. 264, 114728 (2020).
- Hussain, A. et al. Responses of wheat (Triticum aestivum) plants grown in a Cd contaminated soil to the application of iron oxide nanoparticles. Ecotoxicol. Environ. Saf. 173, 156-164 (2019).
- Zou, Y. et al. Environmental remediation and application of nanoscale zero-valent iron and its composites for the removal of heavy metal ions: A review. Environ. Sci. Technol. 50, 7290-7304 (2016).
- Khan, S. et al. Biosynthesized iron oxide nanoparticles (
NPs) mitigate arsenic toxicity in rice seedlings. Toxics 9, 2 (2020). - Chen, R., Zhang, C., Zhao, Y., Huang, Y. & Liu, Z. Foliar application with nano-silicon reduced cadmium accumulation in grains by inhibiting cadmium translocation in rice plants. Environ. Sci. Pollut. Res. 25, 2361-2368 (2018).
- Du, J. et al. Silica nanoparticles protect rice against biotic and abiotic stresses. J. Nanobiotechnol. 20, 197 (2022).
- Li, Y. et al. Silica nanoparticles promote wheat growth by mediating hormones and sugar metabolism. J. Nanobiotechnol. 21, 2 (2023).
- Tripathi, D. K. et al. Silicon nanoparticles more efficiently alleviate arsenate toxicity than silicon in maize cultiver and hybrid differing in arsenate tolerance. Front. Environ. Sci. 4, 46 (2016).
- Saritha, G. N. G., Anju, T. & Kumar, A. Nanotechnology-Big impact: How nanotechnology is changing the future of agriculture?. J. Agric. Food Res. 10, 100457 (2022).
- Malik, S., Muhammad, K. & Waheed, Y. Nanotechnology: A revolution in modern industry. Molecules 28, 661 (2023).
- Rizwan, M. et al. Effect of metal and metal oxide nanoparticles on growth and physiology of globally important food crops: A critical review. J. Hazard. Mater. 322, 2-16 (2017).
- Manzoor, N. et al. Iron oxide nanoparticles ameliorated the cadmium and salinity stresses in wheat plants, facilitating photosynthetic pigments and restricting cadmium uptake. Sci. Total Environ. 769, 145221 (2021).
- Haydar, M. S., Ghosh, S. & Mandal, P. Application of iron oxide nanoparticles as micronutrient fertilizer in mulberry propagation. J. Plant Growth Regul. 41, 1726-1746 (2022).
- Liu, R., Zhang, H. & Lal, R. Effects of stabilized nanoparticles of copper, zinc, manganese, and Iron oxides in low concentrations on lettuce (Lactuca sativa) seed germination: Nanotoxicants or nanonutrients?. Water Air Soil Pollut. 227, 42 (2016).
- Iannone, M. F. et al. Impact of magnetite iron oxide nanoparticles on wheat (Triticum aestivum L.) development: Evaluation of oxidative damage. Environ. Exp. Bot. 131, 77-88 (2016).
- Lichtenthaler, H. K. [34] Chlorophylls and carotenoids: Pigments of photosynthetic biomembranes. In Methods in Enzymology vol. 148 350-382 (Academic Press, 1987).
- Ghouri, F. et al. Polyploidy and zinc oxide nanoparticles alleviated Cd toxicity in rice by modulating oxidative stress and expression levels of sucrose and metal-transporter genes. J. Hazard. Mater. 448, 130991 (2023).
- Riaz, M., Kamran, M., Rizwan, M., Ali, S. & Wang, X. Foliar application of silica sol alleviates boron toxicity in rice (Oryza sativa) seedlings. J. Hazard. Mater. 423, 127175 (2022).
- Livak, K. J. & Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the
method. Methods 25, 402-408 (2001). - Guo, G., Lei, M., Wang, Y., Song, B. & Yang, J. Accumulation of As, Cd, and Pb in sixteen wheat cultivars grown in contaminated soils and associated health risk assessment. IJERPH 15, 2601 (2018).
- Muramoto, S. Heavy metal tolerance of rice plants (Oryza sativa L.) to some metal oxides at the critical levels. J. Environ Sci. Health Part B 24, 559-656 (1989).
- Okant, M. & Kaya, C. The role of endogenous nitric oxide in melatonin-improved tolerance to lead toxicity in maize plants. Environ. Sci. Pollut. Res. 26, 11864-11874 (2019).
- Li, L. et al. Silicate-mediated alleviation of Pb toxicity in banana grown in Pb -contaminated soil. Biol. Trace Elem. Res. 145, 101-108 (2012).
- Saman, R. U. et al. Foliar application of ethylenediamine tetraacetic acid (EDTA) improves the growth and yield of brown mustard (Brassica juncea) by modulating photosynthetic pigments, antioxidant defense, and osmolyte production under lead (Pb) stress. Plants 12, 115 (2022).
- Riaz, M. et al. Cadmium uptake and translocation: selenium and silicon roles in Cd detoxification for the production of low Cd crops: A critical review. Chemosphere 273, 129690 (2021).
- Fisiologia Vegetal, Departamento de Biologia, Universidade Federal de Lavras, Lavras, Minas Gerais, Brasil et al. Copper (Cu) stress affects carbon and antioxidant metabolism in Coffea arabica seedlings. Aust J Crop Sci 11, 960-967 (2017).
- Konate, A. et al. Magnetic (
) nanoparticles reduce heavy metals uptake and mitigate their toxicity in wheat seedling. Sustainability 9, 790 (2017). - Ma, J. et al. Bacillus mycoides PM35 in combination with titanium dioxide (
)__Nanoparticles enhanced morpho-physiobiochemical attributes in Barley (Hordeum vulgare L.) under cadmium stress. Chemosphere 323, 138224 (2023). - Hussain, B. et al. Foliage application of selenium and silicon nanoparticles alleviates Cd and Pb toxicity in rice (Oryza sativa L .). Sci. Total Environ. 712, 136497 (2020).
- Rizwan, M. et al. Effects of nanoparticles on trace element uptake and toxicity in plants: A review. Ecotoxicol. Environ. Saf. 221, 112437 (2021).
- Hussain, A., Rizwan, M., Ali, Q. & Ali, S. Seed priming with silicon nanoparticles improved the biomass and yield while reduced the oxidative stress and cadmium concentration in wheat grains. Environ. Sci. Pollut. Res. 26, 75`79-7588 (2019).
- Ur Rahman, S. et al. Silicon elevated cadmium tolerance in wheat (Triticum aestivum L.) by endorsing nutrients uptake and antioxidative defense mechanisms in the leaves. Plant Physiol. Biochem. 166, 148-159 (2021).
- Ogunkunle, C. O. et al. Foliar application of nanoceria attenuated cadmium stress in okra (Abelmoschus esculentus L.). J. Hazard. Mater. 445, 130567 (2023).
- Huang, Y. et al. Enhanced vacuole compartmentalization of cadmium in root cells contributes to glutathione-induced reduction of cadmium translocation from roots to shoots in pakchoi (Brassica chinensis L.). Ecotoxicol. Environ. Saf. 208, 111616 (2021).
- Shi, G. et al. Sulfur reduces the root-to-shoot translocation of arsenic and cadmium by regulating their vacuolar sequestration in wheat (Triticum aestivum L.). Front. Plant Sci. 13, 1032681 (2022).
- Leyser, O. Auxin signaling. Plant Physiol. 176, 465-479 (2018).
- Lee, S., Kim, Y.-Y., Lee, Y. & An, G. Rice P1B-type heavy-metal ATPase, OsHMA9, is a metal efflux protein. Plant Physiol. 145, 831-842 (2007).
- Huang, G. et al. Regulation of iron and cadmium uptake in rice roots by iron(III) oxide nanoparticles: Insights from iron plaque formation, gene expression, and nanoparticle accumulation. Environ. Sci. Nano 9, 4093-4103 (2022).
- Lin, Y. et al. Deficiency in silicon transporter Lsi1 compromises inducibility of anti-herbivore defense in rice plants. Front. Plant Sci. 10, 652 (2019).
- Itai, R. N., Ogo, Y., Kobayashi, T., Nakanishi, H. & Nishizawa, N. K. Rice genes involved in phytosiderophore biosynthesis are synchronously regulated during the early stages of iron deficiency in roots. Rice 6, 16 (2013).
- Fang, C. et al. Lsil modulates the antioxidant capacity of rice and protects against ultraviolet-B radiation. Plant Sci. 278, 96-106 (2019).
- Wang, P., Yamaji, N., Inoue, K., Mochida, K. & Ma, J. F. Plastic transport systems of rice for mineral elements in response to diverse soil environmental changes. New Phytol. 226, 156-169 (2020).
- Vaculík, M., Pavlovič, A. & Lux, A. Silicon alleviates cadmium toxicity by enhanced photosynthetic rate and modified bundle sheath’s cell chloroplasts ultrastructure in maize. Ecotoxicol. Environ. Saf. 120, 66-73 (2015).
- Pompeu, G. B. et al. Abscisic acid-deficient sit tomato mutant responses to cadmium-induced stress. Protoplasma 254, 771-783 (2017).
- Van Bockhaven, J., De Vleesschauwer, D. & Höfte, M. Towards establishing broad-spectrum disease resistance in plants: Silicon leads the way. J. Exp. Bot. 64, 1281-1293 (2013).
- Bhat, J. A. et al. Role of silicon in mitigation of heavy metal stresses in crop plants. Plants 8, 71 (2019).
- Głazowska, S. et al. The impact of silicon on cell wall composition and enzymatic saccharification of Brachypodium distachyon. Biotechnol. Biofuels 11, 171 (2018).
الشكر والتقدير
مساهمات المؤلفين
التمويل
المصالح المتنافسة
معلومات إضافية
معلومات إعادة الطبع والتصاريح متاحة على www.nature.com/reprints.
ملاحظة الناشر تظل Springer Nature محايدة فيما يتعلق بالمطالبات القضائية في الخرائط المنشورة والانتماءات المؤسسية.
© المؤلفون 2024
المختبر الوطني الرئيسي للحفاظ على واستخدام الموارد الحيوية الزراعية شبه الاستوائية، مختبر قوانغدونغ للزراعة الحديثة في لينغنان، جامعة الزراعة في جنوب الصين، قوانغتشو 510642، الصين. المختبر الرئيسي لمختبر التربية الجزيئية للنباتات في قوانغدونغ، جامعة الزراعة في جنوب الصين، قوانغتشو 510642، الصين. بنك قاعدة قوانغدونغ لموارد جينات الأرز لينغنان، كلية الزراعة، جامعة الزراعة في جنوب الصين، قوانغتشو 510642، الصين. قسم علم النبات، جامعة الحكومة الكلية، فيصل آباد 38000، باكستان. المختبر الرئيسي لاستعادة وإدارة الغطاء النباتي للأنظمة البيئية المتدهورة، حديقة النباتات في جنوب الصين، الأكاديمية الصينية للعلوم، قوانغتشو 510650، الصين. قسم العلوم البيئية، جامعة الحكومة الكلية، فيصل آباد 38000، باكستان. قسم العلوم والتكنولوجيا البيولوجية، جامعة الطب في الصين، تايتشونغ 40402، تايوان. ساهم هؤلاء المؤلفون بالتساوي: فوزية غوري وسمرين ساروار. البريد الإلكتروني: shafaqataligill@yahoo.com; xdliu@scau.edu.cn; qasim@scau.edu.cn
DOI: https://doi.org/10.1038/s41598-024-55810-2
PMID: https://pubmed.ncbi.nlm.nih.gov/38472251
Publication Date: 2024-03-12
Silicon and iron nanoparticles protect rice against lead (Pb) stress by improving oxidative tolerance and minimizing Pb uptake
Abstract
Lead (Pb) is toxic to the development and growth of rice plants. Nanoparticles (NPs) have been considered one of the efficient remediation techniques to mitigate Pb stress in plants. Therefore, a study was carried out to examine the underlying mechanism of iron ( Fe ) and silicon ( Si ) nanoparticleinduced Pb toxicity alleviation in rice seedlings.
heavy metal stress on rice. Therefore, this work was planned to check the efficiency of the synergistic application of Si and
Materials and methods
Plant materials and growth husbandry
Evaluation of plant biomass production
Analyses of carotenoid and chlorophyll contents
Measurements of Pb concentration in rice seedlings
Cytological investigations by transmission electron microscope (TEM)
spur resin. Then, a microtome (Leica, Germany) was used to cut ultrathin sections. The cell structure was seen under a TEM equipped with an Oxford INCA Energy TEM 200 EDX system (Philips TECNAI 10, Netherlands).
qRT-PCR analysis
Antioxidant and oxidant activities
Statistical analyses
Results
Plants biomass and Chlorophyll
Si and
Effect on antioxidant and oxidant activities

Influence of Si and Fe -NPs on root ultrastructure
| Variables | Fe | Si | Pb |
|
|
|
|
| SL | <0.001 | <0.001 | <0.001 | <0.001 | 0.461 | 0.087 | 0.065 |
| RFW | <0.001 | <0.001 | <0.001 | <0.001 | 0.757 | 0.178 | 0.086 |
| RDW | <0.001 | <0.001 | <0.001 | <0.001 | 0.134 | 0.033 | 0.213 |
| SDW | <0.001 | <0.001 | <0.001 | <0.001 | 0.568 | 0.149 | 0.74 |
| Pb root | 0.988 | 0.979 | <0.001 | 0.974 | <0.001 | <0.001 | <0.001 |
| Pb shoot | 0.293 | 0.071 | <0.001 | 0.051 | <0.001 | <0.001 | <0.001 |
| Fe root | <0.001 | 0.524 | 0.464 | <0.001 | <0.001 | 0.66 | <0.001 |
| Fe shoot | <0.001 | 0.855 | 0.014 | <0.001 | <0.001 | 0.314 | <0.001 |
| Si root | 0.858 | <0.001 | 0.699 | <0.001 | 0.697 | <0.001 | <0.001 |
| Si shoot | 0.977 | <0.001 | 0.853 | <0.001 | 0.844 | <0.001 | <0.001 |
| SOD | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 |
| POD | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 |
| CAT | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 |
| GSH | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 |
| Chl a | <0.001 | <0.001 | <0.001 | <0.001 | 0.643 | 0.674 | 0.001 |
| Chl b | <0.001 | <0.001 | <0.001 | <0.001 | 0.005 | 0.032 | 0.001 |
| Carotenoids | <0.001 | <0.001 | <0.001 | <0.001 | 0.002 | 0.003 | <0.001 |
|
|
<0.001 | <0.001 | 0.001 | <0.001 | 0.201 | 0.302 | 0.002 |
| MDA | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 |
Gene expression levels of antioxidant and metal transporter genes under Si and
Correlation, heatmap, homogeneity, and principal component analysis

Discussion




| Effect size (r) | |||||||
| Fe | Si | Pb |
|
|
|
|
|
| SL | 0.908 | 0.899 | 0.778 | 0.962 | 0.124 | 0.308 | 0.501 |
| RFW | 0.832 | 0.784 | 0.816 | 0.979 | 0.021 | 0.429 | 0.656 |
| RDW | 0.811 | 0.891 | 0.939 | 0.952 | 0.386 | 0.524 | 0.209 |
| SDW | 0.933 | 0.822 | 0.951 | 0.961 | 0.201 | 0.636 | 0.125 |
| Pb root | 0.407 | 0.649 | 0.998 | 0.766 | 0.999 | 0.998 | 0.991 |
| Pb shoot | 0.702 | 0.938 | 0.996 | 0.880 | 0.995 | 0.999 | 0.998 |
| Fe root | 1.000 | 0.922 | 0.835 | 0.999 | 0.998 | 0.704 | 1.000 |
| Fe shoot | 0.998 | 0.018 | 0.847 | 0.981 | 0.996 | 0.354 | 0.987 |
| Si root | 0.908 | 0.999 | 0.976 | 0.999 | 0.976 | 0.997 | 0.997 |
| Si shoot | 0.032 | 0.996 | 0.522 | 0.998 | 0.547 | 0.999 | 0.995 |
| SOD | 0.989 | 0.983 | 0.843 | 0.992 | 0.994 | 0.993 | 0.997 |
| POD | 0.820 | 0.748 | 0.764 | 0.958 | 0.982 | 0.989 | 0.990 |
| CAT | 0.984 | 0.9785 | 0.922 | 0.998 | 0.993 | 0.996 | 0.998 |
| GSH | 0.972 | 0.969 | 0.927 | 0.984 | 0.976 | 0.975 | 0.988 |
| Chl a | 0.977 | 0.923 | 0.990 | 0.993 | 0.029 | 0.023 | 0.912 |
| Chl b | 0.977 | 0.879 | 0.856 | 0.919 | 0.716 | 0.674 | 0.679 |
| Carotenoids | 0.964 | 0.878 | 0.976 | 0.944 | 0.760 | 0.786 | 0.934 |
|
|
0.862 | 0.862 | 0.630 | 0.950 | 0.184 | 0.171 | 0.767 |
| MDA | 0.958 | 0.949 | 0.728 | 0.984 | 0.917 | 0.757 | 0.964 |

Conclusions
Data availability
Published online: 12 March 2024
References
- Zulfiqar, U. et al. Lead toxicity in plants: Impacts and remediation. J. Environ. Manage. 250, 109557 (2019).
- Ali, H., Khan, E. & Ilahi, I. Environmental chemistry and ecotoxicology of hazardous heavy metals: Environmental persistence, toxicity, and bioaccumulation. J. Chem. 2019, 1-14 (2019).
- Agarwal, P., Vibhandik, R., Agrahari, R., Daverey, A. & Rani, R. Role of root exudates on the soil microbial diversity and biogeochemistry of heavy metals. Appl. Biochem. Biotechnol. https://doi.org/10.1007/s12010-023-04465-2 (2023).
- Baldantoni, D., Morra, L., Zaccardelli, M. & Alfani, A. Cadmium accumulation in leaves of leafy vegetables. Ecotoxicol. Environ Saf 123, 89-94 (2016).
- Chibowska, K. et al. Pre- and neonatal exposure to lead (Pb) induces neuroinflammation in the forebrain cortex, hippocampus and cerebellum of rat pups. IJMS 21, 1083 (2020).
- Vega, F. A., Andrade, M. L. & Covelo, E. F. Influence of soil properties on the sorption and retention of cadmium, copper and lead, separately and together, by 20 soil horizons: Comparison of linear regression and tree regression analyses. J. Hazard Mater 174, 522-533 (2010).
- Saghi, A., Rashed Mohassel, M. H., Parsa, M. & Hammami, H. Phytoremediation of lead-contaminated soil by Sinapis arvensis and Rapistrum rugosum. Int. J. Phytoremediat. 18, 387-392 (2016).
- Hakeem, K. R., Alharby, H. F. & Rehman, R. Antioxidative defense mechanism against lead-induced phytotoxicity in Fagopyrum kashmirianum. Chemosphere 216, 595-604 (2019).
- Feng, L. et al. Carbonate-bound Pb percentage distribution in agricultural soil and its toxicity: Impact on plant growth, nutrient cycling, soil enzymes, and functional genes. J. Hazard. Mater. 451, 131205 (2023).
- Le, Q. H., Tran, D. D., Chen, Y.-C. & Nguyen, H. L. Risk of lead exposure from transport stations to human health: A case study in the Highland Province of Vietnam. Toxics 7, 48 (2019).
- Islam, M. S. et al. Assessment of heavy metals in foods around the industrial areas: Health hazard inference in Bangladesh. Geocarto Int. 35(3), 280-295. https://doi.org/10.1080/10106049.2018.1516246 (2020).
- Zhou, J., Zhang, Z., Zhang, Y., Wei, Y. & Jiang, Z. Effects of lead stress on the growth, physiology, and cellular structure of privet seedlings. PLoS ONE 13, e0191139 (2018).
- Aslam, M. et al. Lead toxicity in cereals: Mechanistic insight into toxicity, mode of action, and management. Front. Plant Sci. 11, 587785 (2021).
- Ghouri, F. et al. Alleviated lead toxicity in rice plant by co-augmented action of genome doubling and
nanoparticles on gene expression, cytological and physiological changes. Sci. Total Environ 911, 168709 (2024). - Ashraf, U. et al. Lead toxicity in rice: Effects, mechanisms, and mitigation strategies-A mini review. Environ. Sci. Pollut. Res. 22, 18318-18332 (2015).
- Ashraf, U. et al. Lead (Pb) toxicity: Physio-biochemical mechanisms, grain yield, quality, and Pb distribution proportions in scented rice. Front. Plant Sci. 8, 259 (2017).
- The Combined Strategy for iron uptake is not exclusive to domesticated rice (Oryza sativa) | Scientific Reports. https://www.nature. com/articles/s41598-019-52502-0.
- Liang, G. Iron uptake, signaling, and sensing in plants. Plant Commun. 3, 100349 (2022).
- Debona, D., Rodrigues, F. A. & Datnoff, L. E. Silicon’s role in abiotic and biotic plant stresses. Annu. Rev. Phytopathol. 55, 85-107 (2017).
- Etesami, H. & Jeong, B. R. Silicon (Si): Review and future prospects on the action mechanisms in alleviating biotic and abiotic stresses in plants. Ecotoxicol. Environ. Saf. 147, 881-896 (2018).
- Yu, H.-Y. et al. The availabilities of arsenic and cadmium in rice paddy fields from a mining area: The role of soil extractable and plant silicon. Environ. Pollut. 215, 258-265 (2016).
- Cai, Y. et al. The Cd sequestration effects of rice roots affected by different Si management in Cd -contaminated paddy soil. Sci. Total Environ. 849, 157718 (2022).
- Ghouri, F. et al. The protective role of tetraploidy and nanoparticles in arsenic-stressed rice: Evidence from RNA sequencing, ultrastructural and physiological studies. J. Hazard. Mater. 458, 132019 (2023).
- Lai, M. et al. Modulation of metal transporters, oxidative stress and cell abnormalities by synergistic application of silicon and titanium oxide nanoparticles: A strategy for cadmium tolerance in rice. Chemosphere 345, 140439 (2023).
- Hokkanen, S., Repo, E., Lou, S. & Sillanpää, M. Removal of arsenic(V) by magnetic nanoparticle activated microfibrillated cellulose. Chem. Eng. J. 260, 886-894 (2015).
- Ali, A. et al. Synthesis, characterization, applications, and challenges of iron oxide nanoparticles. NSA 9, 49-67 (2016).
- Xu, P. et al. Use of iron oxide nanomaterials in wastewater treatment: A review. Sci. Total Environ. 424, 1-10 (2012).
- Latif, A. et al. Remediation of heavy metals polluted environment using Fe-based nanoparticles: Mechanisms, influencing factors, and environmental implications. Environ. Pollut. 264, 114728 (2020).
- Hussain, A. et al. Responses of wheat (Triticum aestivum) plants grown in a Cd contaminated soil to the application of iron oxide nanoparticles. Ecotoxicol. Environ. Saf. 173, 156-164 (2019).
- Zou, Y. et al. Environmental remediation and application of nanoscale zero-valent iron and its composites for the removal of heavy metal ions: A review. Environ. Sci. Technol. 50, 7290-7304 (2016).
- Khan, S. et al. Biosynthesized iron oxide nanoparticles (
NPs) mitigate arsenic toxicity in rice seedlings. Toxics 9, 2 (2020). - Chen, R., Zhang, C., Zhao, Y., Huang, Y. & Liu, Z. Foliar application with nano-silicon reduced cadmium accumulation in grains by inhibiting cadmium translocation in rice plants. Environ. Sci. Pollut. Res. 25, 2361-2368 (2018).
- Du, J. et al. Silica nanoparticles protect rice against biotic and abiotic stresses. J. Nanobiotechnol. 20, 197 (2022).
- Li, Y. et al. Silica nanoparticles promote wheat growth by mediating hormones and sugar metabolism. J. Nanobiotechnol. 21, 2 (2023).
- Tripathi, D. K. et al. Silicon nanoparticles more efficiently alleviate arsenate toxicity than silicon in maize cultiver and hybrid differing in arsenate tolerance. Front. Environ. Sci. 4, 46 (2016).
- Saritha, G. N. G., Anju, T. & Kumar, A. Nanotechnology-Big impact: How nanotechnology is changing the future of agriculture?. J. Agric. Food Res. 10, 100457 (2022).
- Malik, S., Muhammad, K. & Waheed, Y. Nanotechnology: A revolution in modern industry. Molecules 28, 661 (2023).
- Rizwan, M. et al. Effect of metal and metal oxide nanoparticles on growth and physiology of globally important food crops: A critical review. J. Hazard. Mater. 322, 2-16 (2017).
- Manzoor, N. et al. Iron oxide nanoparticles ameliorated the cadmium and salinity stresses in wheat plants, facilitating photosynthetic pigments and restricting cadmium uptake. Sci. Total Environ. 769, 145221 (2021).
- Haydar, M. S., Ghosh, S. & Mandal, P. Application of iron oxide nanoparticles as micronutrient fertilizer in mulberry propagation. J. Plant Growth Regul. 41, 1726-1746 (2022).
- Liu, R., Zhang, H. & Lal, R. Effects of stabilized nanoparticles of copper, zinc, manganese, and Iron oxides in low concentrations on lettuce (Lactuca sativa) seed germination: Nanotoxicants or nanonutrients?. Water Air Soil Pollut. 227, 42 (2016).
- Iannone, M. F. et al. Impact of magnetite iron oxide nanoparticles on wheat (Triticum aestivum L.) development: Evaluation of oxidative damage. Environ. Exp. Bot. 131, 77-88 (2016).
- Lichtenthaler, H. K. [34] Chlorophylls and carotenoids: Pigments of photosynthetic biomembranes. In Methods in Enzymology vol. 148 350-382 (Academic Press, 1987).
- Ghouri, F. et al. Polyploidy and zinc oxide nanoparticles alleviated Cd toxicity in rice by modulating oxidative stress and expression levels of sucrose and metal-transporter genes. J. Hazard. Mater. 448, 130991 (2023).
- Riaz, M., Kamran, M., Rizwan, M., Ali, S. & Wang, X. Foliar application of silica sol alleviates boron toxicity in rice (Oryza sativa) seedlings. J. Hazard. Mater. 423, 127175 (2022).
- Livak, K. J. & Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the
method. Methods 25, 402-408 (2001). - Guo, G., Lei, M., Wang, Y., Song, B. & Yang, J. Accumulation of As, Cd, and Pb in sixteen wheat cultivars grown in contaminated soils and associated health risk assessment. IJERPH 15, 2601 (2018).
- Muramoto, S. Heavy metal tolerance of rice plants (Oryza sativa L.) to some metal oxides at the critical levels. J. Environ Sci. Health Part B 24, 559-656 (1989).
- Okant, M. & Kaya, C. The role of endogenous nitric oxide in melatonin-improved tolerance to lead toxicity in maize plants. Environ. Sci. Pollut. Res. 26, 11864-11874 (2019).
- Li, L. et al. Silicate-mediated alleviation of Pb toxicity in banana grown in Pb -contaminated soil. Biol. Trace Elem. Res. 145, 101-108 (2012).
- Saman, R. U. et al. Foliar application of ethylenediamine tetraacetic acid (EDTA) improves the growth and yield of brown mustard (Brassica juncea) by modulating photosynthetic pigments, antioxidant defense, and osmolyte production under lead (Pb) stress. Plants 12, 115 (2022).
- Riaz, M. et al. Cadmium uptake and translocation: selenium and silicon roles in Cd detoxification for the production of low Cd crops: A critical review. Chemosphere 273, 129690 (2021).
- Fisiologia Vegetal, Departamento de Biologia, Universidade Federal de Lavras, Lavras, Minas Gerais, Brasil et al. Copper (Cu) stress affects carbon and antioxidant metabolism in Coffea arabica seedlings. Aust J Crop Sci 11, 960-967 (2017).
- Konate, A. et al. Magnetic (
) nanoparticles reduce heavy metals uptake and mitigate their toxicity in wheat seedling. Sustainability 9, 790 (2017). - Ma, J. et al. Bacillus mycoides PM35 in combination with titanium dioxide (
)__Nanoparticles enhanced morpho-physiobiochemical attributes in Barley (Hordeum vulgare L.) under cadmium stress. Chemosphere 323, 138224 (2023). - Hussain, B. et al. Foliage application of selenium and silicon nanoparticles alleviates Cd and Pb toxicity in rice (Oryza sativa L .). Sci. Total Environ. 712, 136497 (2020).
- Rizwan, M. et al. Effects of nanoparticles on trace element uptake and toxicity in plants: A review. Ecotoxicol. Environ. Saf. 221, 112437 (2021).
- Hussain, A., Rizwan, M., Ali, Q. & Ali, S. Seed priming with silicon nanoparticles improved the biomass and yield while reduced the oxidative stress and cadmium concentration in wheat grains. Environ. Sci. Pollut. Res. 26, 75`79-7588 (2019).
- Ur Rahman, S. et al. Silicon elevated cadmium tolerance in wheat (Triticum aestivum L.) by endorsing nutrients uptake and antioxidative defense mechanisms in the leaves. Plant Physiol. Biochem. 166, 148-159 (2021).
- Ogunkunle, C. O. et al. Foliar application of nanoceria attenuated cadmium stress in okra (Abelmoschus esculentus L.). J. Hazard. Mater. 445, 130567 (2023).
- Huang, Y. et al. Enhanced vacuole compartmentalization of cadmium in root cells contributes to glutathione-induced reduction of cadmium translocation from roots to shoots in pakchoi (Brassica chinensis L.). Ecotoxicol. Environ. Saf. 208, 111616 (2021).
- Shi, G. et al. Sulfur reduces the root-to-shoot translocation of arsenic and cadmium by regulating their vacuolar sequestration in wheat (Triticum aestivum L.). Front. Plant Sci. 13, 1032681 (2022).
- Leyser, O. Auxin signaling. Plant Physiol. 176, 465-479 (2018).
- Lee, S., Kim, Y.-Y., Lee, Y. & An, G. Rice P1B-type heavy-metal ATPase, OsHMA9, is a metal efflux protein. Plant Physiol. 145, 831-842 (2007).
- Huang, G. et al. Regulation of iron and cadmium uptake in rice roots by iron(III) oxide nanoparticles: Insights from iron plaque formation, gene expression, and nanoparticle accumulation. Environ. Sci. Nano 9, 4093-4103 (2022).
- Lin, Y. et al. Deficiency in silicon transporter Lsi1 compromises inducibility of anti-herbivore defense in rice plants. Front. Plant Sci. 10, 652 (2019).
- Itai, R. N., Ogo, Y., Kobayashi, T., Nakanishi, H. & Nishizawa, N. K. Rice genes involved in phytosiderophore biosynthesis are synchronously regulated during the early stages of iron deficiency in roots. Rice 6, 16 (2013).
- Fang, C. et al. Lsil modulates the antioxidant capacity of rice and protects against ultraviolet-B radiation. Plant Sci. 278, 96-106 (2019).
- Wang, P., Yamaji, N., Inoue, K., Mochida, K. & Ma, J. F. Plastic transport systems of rice for mineral elements in response to diverse soil environmental changes. New Phytol. 226, 156-169 (2020).
- Vaculík, M., Pavlovič, A. & Lux, A. Silicon alleviates cadmium toxicity by enhanced photosynthetic rate and modified bundle sheath’s cell chloroplasts ultrastructure in maize. Ecotoxicol. Environ. Saf. 120, 66-73 (2015).
- Pompeu, G. B. et al. Abscisic acid-deficient sit tomato mutant responses to cadmium-induced stress. Protoplasma 254, 771-783 (2017).
- Van Bockhaven, J., De Vleesschauwer, D. & Höfte, M. Towards establishing broad-spectrum disease resistance in plants: Silicon leads the way. J. Exp. Bot. 64, 1281-1293 (2013).
- Bhat, J. A. et al. Role of silicon in mitigation of heavy metal stresses in crop plants. Plants 8, 71 (2019).
- Głazowska, S. et al. The impact of silicon on cell wall composition and enzymatic saccharification of Brachypodium distachyon. Biotechnol. Biofuels 11, 171 (2018).
Acknowledgements
Author contributions
Funding
Competing interests
Additional information
Reprints and permissions information is available at www.nature.com/reprints.
Publisher’s note Springer Nature remains neutral with regard to jurisdictional claims in published maps and institutional affiliations.
© The Author(s) 2024
State Key Laboratory for Conservation and Utilization of Subtropical Agro-Bioresources, Guangdong Laboratory for Lingnan Modern Agriculture, South China Agricultural University, Guangzhou 510642, China. Guangdong Provincial Key Laboratory of Plant Molecular Breeding, South China Agricultural University, Guangzhou 510642, China. Guangdong Base Bank for Lingnan Rice Germplasm Resources, College of Agriculture, South China Agricultural University, Guangzhou 510642, China. Department of Botany, Government College University, Faisalabad 38000, Pakistan. Key Laboratory of Vegetation Restoration and Management of Degraded Ecosystems, South China Botanical Garden, Chinese Academy of Sciences, Guangzhou 510650, China. Department of Environmental Sciences, Government College University, Faisalabad 38000, Pakistan. Department of Biological Sciences and Technology, China Medical University, Taichung 40402, Taiwan. These authors contributed equally: Fozia Ghouri and Samreen Sarwar. email: shafaqataligill@yahoo.com; xdliu@scau.edu.cn; qasim@scau.edu.cn
