DOI: https://doi.org/10.1186/s12951-023-02284-5
PMID: https://pubmed.ncbi.nlm.nih.gov/38183090
تاريخ النشر: 2024-01-05
تسليط الضوء على الكفاءة العلاجية للمعادن التي تم تصنيعها بطريقة خضراء وجزيئات أكسيدها النانوية في التهاب اللثة
الملخص
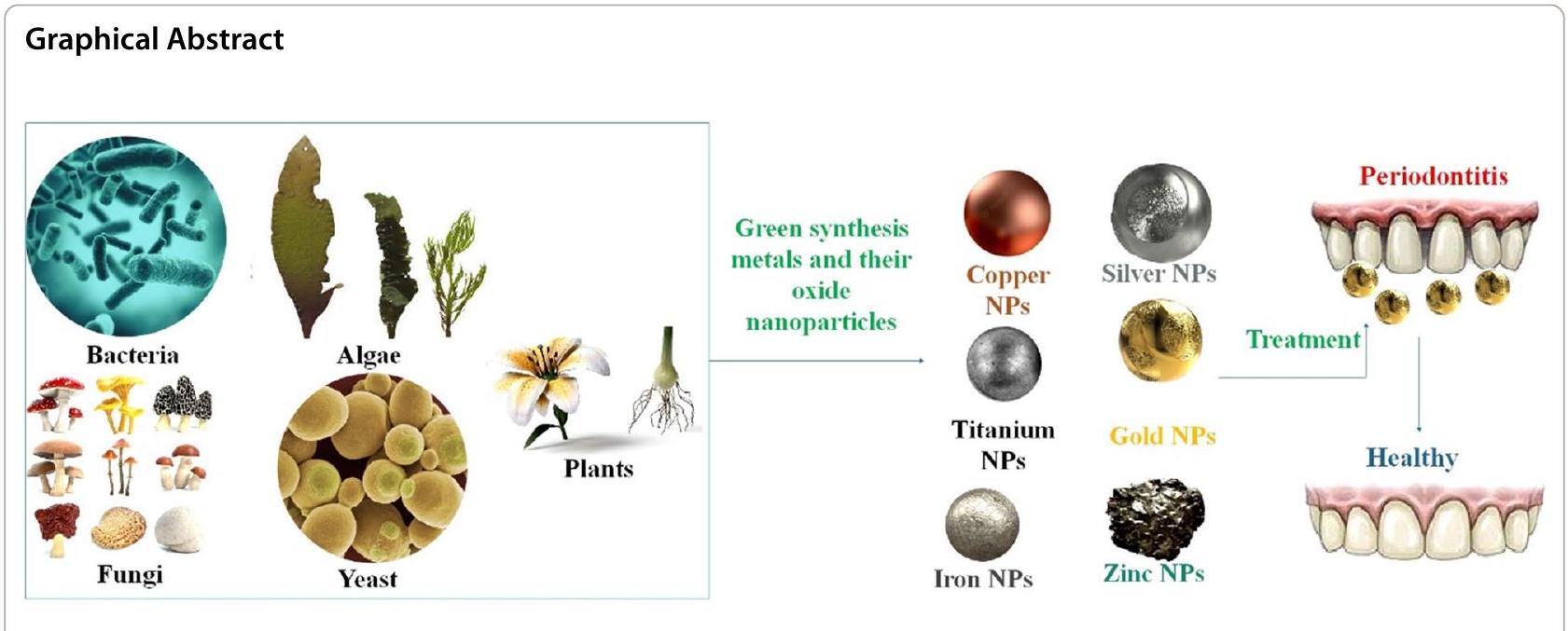
التهاب اللثة، أحد أكثر الأمراض السنية انتشارًا، يسبب فقدان العظام والأنسجة اللثوية التي تثبت الأسنان في مكانها. قد تؤدي عدة بكتيريا، موجودة عادة في تجويف الفم الصحي سريريًا، إلى تحفيز واستمرار التهاب اللثة عندما ترتفع تركيزاتها في الشق اللثوي. لقد أظهرت عدة جزيئات معدنية مؤقتة وأكسيد المعادن تأثيرًا مضادًا للبكتيريا ضد أنواع مختلفة من البكتيريا سالبة وموجبة الجرام، بما في ذلك البكتيريا المسببة للأمراض والمقاومة للأدوية. لذلك، يمكن استخدام الجزيئات النانوية في الطب الحيوي لعلاج مشاكل اللثة وفي تكنولوجيا النانو لمنع تطور الكائنات الدقيقة. بدلاً من استخدام المواد الكيميائية الضارة أو الآلات التي تستهلك الطاقة، تم اقتراح تصنيع جزيئات أكسيد المعادن والمعادن النانوية (NPs) بطريقة حيوية. لإنتاج جزيئات أكسيد المعادن والمعادن النانوية، فإن التقنية المثالية هي “التصنيع الأخضر” بسبب سمّيتها المنخفضة وسلامتها على صحة الإنسان والبيئة. يبدو أن جزيئات الذهب النانوية (AuNPs) أقل سمية للخلايا الثديية مقارنةً بالمعادن النانوية الأخرى لأن نشاطها المضاد للبكتيريا لا يعتمد على أنواع الأكسجين التفاعلية (ROS). كما أن جزيئات الفضة النانوية (AgNPs) تتمتع أيضًا بالاستقرار الكيميائي، والنشاط التحفيزي، والتوصيل الكهربائي والحراري الممتاز، على سبيل المثال من بين خصائصها الأخرى المفيدة. لوحظ أن جزيئات أكسيد الزنك (ZnO) وجزيئات النحاس (Cu) أظهرت تأثيرات مثبطة ملحوظة ضد سلالات البكتيريا موجبة وسالبة الجرام، على التوالي. أظهرت جزيئات ZnO نشاطًا قاتلًا ضد الكائنات الدقيقة المسؤولة عن التهاب اللثة. الأدوية التي تحتوي على جزيئات نانوية مغناطيسية فعالة للغاية ضد العدوى البكتيرية والفطرية المقاومة للأدوية المتعددة. جزيئات أكسيد التيتانيوم (
المقدمة
لعلاج التهاب اللثة. يمكن علاج الألم والتورم الناتج عن التهاب اللثة بالأدوية المضادة للالتهابات. عادةً ما تأخذ هذه الأدوية شكل أدوية مضادة للالتهابات غير الستيرويدية (NSAIDs). تقلل NSAIDs الالتهاب والألم من خلال منع الجسم من إنتاج البروستاجلاندين. الإيبوبروفين والأسبرين هما مثالان شائعان على NSAIDs. علاوة على ذلك، فإن استخدام توصيل الأدوية المزدوجة له إمكانيات لعلاج حالات التهاب اللثة. تشمل الأمثلة التوضيحية استخدام هلام يتشكل في الموقع (ISFG) يحتوي على دوكسيسيكلين هايكليت وإيبوبروفين، بالإضافة إلى تطبيق مصفوفة تتشكل في الموقع (ISFM) تشمل فانومايسين هيدروكلوريد (VH) وبورنول. منهجية بديلة هي استخدام زراعة الأدوية التي تطلق الأدوية، والتي يتم إدخالها مباشرة في الجيب اللثوي [5، 6] (الشكل 1).

العامل المضاد للبكتيريا في جيب اللثة. قد يمنع النقل طويل الأمد للعوامل المضادة للبكتيريا إلى المنطقة المحيطة بفتحة الجيب إعادة استعمار الجيب من الفم عن طريق إيقاف اللويحات الهامشية. إن تطوير الأغشية الحيوية بواسطة مسببات الأمراض الفموية يمثل عقبة كبيرة في تطوير مقاومة المضادات الحيوية. لمنع أو القضاء على الأغشية الحيوية الميكروبية، يمكن استخدام مركبات تعيق عوامل الالتصاق وت extinguish الكميات الحيوية النشطة. هناك حاجة إلى مزيد من البحث لتقييم فعالية استراتيجيات قمع الكمية في مكافحة تشكيل الأغشية الحيوية لمسببات الأمراض اللثوية.
لا تتجاوز معظم الأدوية المراحل الأولى من الاختبار في عملية تطوير الأدوية، ومعدل النجاح منخفض بشكل عام. ومع ذلك، بسبب زيادة مقاومة المضادات الحيوية بين مسببات الأمراض اللثوية، تحول التركيز في علاج التهاب اللثة من قتل البكتيريا إلى إعادة تأسيس توازن صحي بين الميكروبات الفموية وأنسجة اللثة المضيفة. لذا، ما هو مطلوب هو تصميم دوائي منهجي يكون حديثًا وفعالًا لعلاج التهاب اللثة. يمكن وصف عوامل صيدلانية ذات آليات عمل متنوعة للمرضى الذين يحملون ميكروبات مقاومة للمضادات الحيوية، من بين أمور أخرى، بسبب حساسيتهم لمثل هذه المسببات. علاوة على ذلك، يمكن وصف هذه العوامل بشكل فردي أو مجتمعة لتعزيز فعاليتها. بعد العمليات الجراحية اللثوية الخطرة، غالبًا ما يتم إعطاء المرضى مضادات حيوية كإجراء وقائي. ولكن، تماشيًا مع الاتجاه الحالي لزيادة مقاومة البكتيريا البشرية للمضادات الحيوية، زادت مقاومة الأدوية أيضًا لدى الأشخاص الذين يعانون من أمراض اللثة خلال السنوات القليلة الماضية. لا تعمل المضادات الحيوية بشكل جيد على هذه الجراثيم بسبب البيئة الخاصة في منطقة اللثة وطريقة تكوين الأغشية الحيوية. نحتاج إلى طرق جديدة لعلاج أمراض اللثة.

أظهرت النتائج مؤشر ارتباط مرتفع نسبيًا (0.995 لاكتشاف MMP-8، 0.976 لـ IL-1
[42]. تم تضمين الكيانات البيولوجية، بما في ذلك مستخلصات النباتات، والبكتيريا، والطحالب، في التخليق الحيوي لجزيئات النانو المعدنية وأكاسيد المعادن. بالمقارنة مع جزيئات النانو المنتجة من الطحالب والفطريات والبكتيريا، فإن التحضير القائم على النباتات هو إجراء سريع وسهل وبسيط لتخليق جزيئات النانو على نطاق واسع. يعد تخليق الأجهزة النانوية الوظيفية، وإنتاج أدوية جديدة، وتجسيد عمليات توصيل الأدوية بعضًا من العديد من الاستخدامات الصيدلانية للمواد النانوية الخضراء التي تم إنشاؤها (NMs) [43]. تم استخدام مبادئ “الكيمياء الخضراء” الصديقة للبيئة في الإنتاج البيولوجي (باستخدام كائنات مثل النباتات، والبكتيريا، والفطريات، والطحالب، والأكتينوميسيتات) لجزيئات النانو المعدنية أو أكاسيد المعادن [44]. بديل أكثر صداقة للبيئة لإنشاء جزيئات النانو ذات الخصائص المناسبة هو تخليقها بواسطة الكائنات الحية. يمكن أن تستجيب الكائنات الحية أحادية الخلية ومتعددة الخلايا للتخليق البيولوجي [45]. تتمتع جزيئات النانو التي يتم إنتاجها بواسطة النباتات بفائدة تتمثل في وجود حركيات أعلى بشكل ملحوظ من تلك الخاصة بالعمليات البيولوجية الأخرى. نظرًا للمواد الكيميائية النباتية الاستثنائية، تم استخدام عدة أجزاء من النبات، بما في ذلك الورقة، والساق، والبذور، والفاكهة، والجذور، على نطاق واسع لإنتاج جزيئات النانو. لإنشاء جزيئات النانو، يتم أولاً تنظيف بعض أجزاء النبات بالماء العادي أو المقطر، ثم يتم إضافة المحاليل الملحية المقابلة التي تحتوي على جزيئات النانو المرغوبة، ثم يتم تصفيتها وعصرها. يتغير لون المحلول، مما يدل على تخليق جزيئات النانو، والتي يمكننا فصلها بسهولة [46، 47]. في العقود الأخيرة، برز التخليق الحيوي لجزيئات النانو المعدنية وأكاسيد المعادن كمنطقة دراسة واعدة. لقد زاد الاهتمام بدراسة الكيمياء الخضراء واستخدام الأساليب الخضراء لتخليق جزيئات النانو من أجل الحصول على إجراء أقل ضررًا للبيئة [47]. بشكل محدد، تقدم هذه المقالة ملخصًا لجزيئات النانو الخضراء، بما في ذلك
المكونات البيولوجية للتخليق “الأخضر”
تتمثل مزايا استخدام طريقة خضراء لتوليد الجسيمات النانوية في أنها رخيصة وسهلة التنفيذ. ومع ذلك، فإن الحجم والشكل الصغيرين المحققين والخصائص الفريدة للركائز البيولوجية المستخدمة تعني أن إنتاج الجسيمات النانوية الخضراء قد يعزز خصائص هذه المواد النانوية. باستخدام مجموعة متنوعة من التقنيات الطيفية، تم إنتاج الجسيمات النانوية الفضية من خلال تخليق مستخلصات جذور مائية من نبات Rheum palmatum. تم اكتشاف الجسيمات النانوية السداسية والكرية. المكورات العنقودية الذهبية (S. aureus) و
تم التحقيق فيه بشكل شامل ضد البكتيريا سالبة الجرام (
بكتيري
cecembensis (B. cecembensis) بشكل واسع في تخليق الجسيمات النانوية الفضية المخفضة حيويًا بأحجام وأشكال متنوعة. Shewanella oneidensis، Corynebacterium Spp. SH09، Aeromonas Spp. SH10، Phaeocystis antarctica، Pseudomonas proteolytica، Enterobacter cloacae، Geobacter Spp..، وArthrobacter gangotriensis. على غرار كيفية استخدام العديد من سلالات البكتيريا المختلفة في تخليق الجسيمات النانوية الذهبية (بما في ذلك Bacillus megaterium D01، Desulfovibrio desulfuricans، E. coli DH5a، Bacillus subtilis (B. subtilis) 168، Shewanella alga، Rhodopseudomonas capsulate، وPlectonema boryanum UTEX 485) [50].
ملخص
يمكن أيضًا إنتاج الجسيمات النانوية أحادية التشتت ذات الأشكال المحددة بشكل فعال من خلال التخليق الحيوي للمعادن/أكسيد المعادن بواسطة الفطريات. لأنها تحتوي على العديد من الإنزيمات المختلفة داخل خلاياها، فهي عوامل بيولوجية متفوقة لصنع الجسيمات النانوية من المعادن وأكسيد المعادن. يمكن تخليق المزيد من الجسيمات النانوية بواسطة الفطريات الكفؤة أكثر من البكتيريا. وفرة الإنزيمات والبروتينات والمكونات المخفضة على أسطح خلايا الفطريات هي سبب آخر لتفوقها على الأنواع الأخرى. يُعتقد أن الجسيمات النانوية المعدنية تنشأ من خلال الاختزال الإنزيمي (الاختزال) في جدار الخلية الفطرية أو السيتوبلازم.
ملخص
الطحالب الطحالب الدقيقة، المعروفة غالبًا باسم الطحالب، هي كائنات دقيقة في البيئات المائية تقوم بعملية التمثيل الضوئي. لقد ثبت أن الطحالب، مثل الكائنات الدقيقة الأخرى، تلعب دورًا حيويًا في الإنتاج البيولوجي للمواد النانوية وتراكم المعادن الثقيلة الأخرى. في بعض الأحيان، تُستخدم الطحالب في إنتاج الجسيمات النانوية ZnO والإنتاج الصناعي للجسيمات النانوية AU وAg. الطحالب الدقيقة معروفة بقدرتها على تحويل المعادن السامة المحتملة إلى نظائرها غير السامة. Phaeodactylum tricornutum هو نوع من الطحالب الدقيقة، وقد تم استخدام مصلها مؤخرًا في التخليق الحيوي للجسيمات النانوية Ti بمتوسط قطر جزيئي يبلغ 49.7 نانومتر. بسبب أنشطتها السامة للخلايا، ومضادة للبكتيريا، ومضادة للكهرباء، والبيوجينية، كانت الجسيمات النانوية الناتجة من الطحالب الدقيقة لها القدرة على الاستخدام في تطبيقات طبية متنوعة. وشملت هذه طرق التصوير
الخميرة
ملخص
خلايا النبات يمكن للنباتات تخزين مستويات متفاوتة من المعادن الثقيلة في أنسجتها المختلفة. لذلك، تلقت استراتيجيات التخليق الحيوي باستخدام مستخلصات النباتات مزيدًا من الاهتمام كبديل بسيط وفعال ومنخفض التكلفة وقابل للتطبيق عمليًا لعمليات التحضير القياسية لتوليد الجسيمات النانوية [76]. من بين الجزيئات الحيوية الموجودة في النباتات تلك التي تتمتع بقدرة استثنائية على تحفيز اختزال ملح المعدن إلى الجسيمات النانوية. كان التخليق بمساعدة مستخلصات النباتات هو أول مسار تخليقي حيوي يتم استكشافه للجسيمات النانوية الذهبية والفضية. تم استخدام نباتات مختلفة، بما في ذلك الألوة فيرا (Aloe barbadensis Miller)، الشوفان (Avena sativa)، البرسيم (Medicago sativa)، تولسي (Osimum sanctum)، الليمون (Citrus limon)، النيم (Azadirachta indica)، الكزبرة (Coriandrum sativum)، الخردل (Brassica juncea) وعشب الليمون (Cymbopogon flexuosus)، لتخليق الجسيمات النانوية Ag وAu. أظهرت نباتات أخرى، بما في ذلك الخردل (Brassica juncea)، والبرسيم (Medicago sativa)، وعباد الشمس (Helianthus annuus)، أنها تنتج الجسيمات النانوية في الجسم الحي أيضًا. الكزبرة (Coriandrum sativum)، وزهرة التاج (Calotropis gigantean)، وورقة النحاس (Acalypha indica)، ووردة الصين (Hibiscus rosa-sinensis)، والشاي الأخضر (Camellia sinensis)، ومستخلص ورقة الألوة (Aloe barbadensis Miller) هي بعض من العديد من مستخلصات أوراق النباتات التي تم استخدامها لتحضير الجسيمات النانوية ZnO [46، 77-80].
آلية التخليق “الأخضر” للمعادن وجسيماتها النانوية أكسيدها
آلية قائمة على الكائنات الدقيقة
تم إثبات مسؤولية B. licheniformis عن تقليل AgNPs بواسطة كاليسوارالال وآخرون [82]. على الرغم من أن الكائنات الدقيقة تنتج أيونات أملاح المعادن ونانو جزيئات معدنية، إلا أن آليات الاختزال الحيوي المعنية في هذه العمليات ليست مفهومة جيدًا [81، 82] (الشكل 3).
آلية مستندة إلى مستخلص أوراق النباتات

البروتينات والكاروتينات. تساهم المكونات الكيميائية النباتية المذكورة أعلاه في تقليل وتثبيت أيونات المعادن خلال عملية تخليق الجسيمات النانوية الصديقة للبيئة.
جزيئات المعادن النانوية في التهاب اللثة

إثبات مختلط أن هذه العوامل تساعد في معظم أمراض اللثة، وأن المضادات الحيوية يمكن أن تكون ضارة أيضًا. بعض المشاكل المتعلقة بالمضادات الحيوية الجهازية تشمل الاستجابات التحسسية، خطر الإصابة بعدوى أخرى، السمية، تركيبات الأدوية، تعاون المريض، والأهم من ذلك، مقاومة الجراثيم للدواء. بالنسبة لمعظم أمراض اللثة، يجب أن تكون طرق التنظيف الميكانيكية، مثل تصريف القيح من خراجات اللثة الحادة، هي الخيار الأول. يجب استخدام المضادات الحيوية الجهازية فقط مع طرق التنظيف الميكانيكية. يجب ألا يستخدمها الأشخاص الذين يعانون من أمراض مزمنة لأنها قد تجعل الخراجات أكثر احتمالاً للتشكل. عندما تكون هناك حالة حادة يصعب تنظيفها أو تصريف القيح منها، أو عندما يكون هناك انتشار محلي أو اضطراب نظامي، يمكن التفكير في استخدام مضادات حيوية جهازية إضافية. عندما يعاني شخص ما من مرض لثة مزمن يبدأ مبكرًا أو يتفاقم بسرعة، أو عندما تفشل العلاجات الميكانيكية، ولا تكون الجراحة خيارًا، يجب عليهم التفكير في إضافة المضادات الحيوية إلى خطة علاجهم. إذا كنت لا تنظف أسنانك أو تدخن التبغ، فلا ينبغي عليك استخدام المضادات الحيوية [93].
الأمراض الالتهابية التنكسية شيوعًا التي تؤثر على الناس. أمراض اللثة والهياكل الداعمة للأسنان، الناتجة عن جزيئات اللويحات التي تتشكل على سطح الجذر الصلب بجوار الأنسجة اللينة للدعامة اللثوية، يمكن أن تكون سطحية (التهاب اللثة) أو جهازية (التهاب اللثة)، مما يدمر العظم السنخي الذي يثبت الأسنان في مكانها والرباط اللثوي. قد تصبح الأسنان رخوة أو تسقط إذا تعرضت لفقدان مثل هذا في الارتباط وخلق جيوب لثوية لاحقًا. تشمل العدوى اللثوية الأولية Porphyromonas gingivalis و Prevotella intermedia و Aggregatibacter actinomycetemcomitans [96، 97].
تمت دراسة الجسيمات النانوية بشكل شامل في تطبيقات بيولوجية متنوعة. أظهرت الجسيمات النانوية المعدنية فعالية ضد مسببات الأمراض ذات الأولوية، بالإضافة إلى حجمها الصغير وانتقائيتها للبكتيريا، كما ذكرت منظمة الصحة العالمية (WHO) [102]. ليس من الصعب على البكتيريا اكتساب المقاومة للجسيمات النانوية المعدنية لأنها لا ترتبط بمستقبل معين في الخلية البكتيرية، ولكن نطاق عملها المضاد للبكتيريا يتوسع أيضًا. لذلك، أظهرت معظم الأبحاث حول فعالية الجسيمات النانوية المعدنية نتائج مشجعة في كل من البكتيريا إيجابية الجرام وسلبية الجرام. سيجد الباحثون أنه على الرغم من أن الجسيمات النانوية الأخرى التي غالبًا ما تستخدم في العلاج بالمضادات الحيوية (مثل
كعوامل مضادة للالتهابات ومضادة للبكتيريا فعالة [104].
| الجسيمات النانوية المعدنية | آلية العمل المضادة للبكتيريا | طريقة الإنتاج الشائعة | المراجع |
| AuNPs | من خلال التسبب في تكوين ثقوب في جدار الخلية البكتيرية، تمارس AuNPs تأثيرها المضاد للبكتيريا، مما يظهر في موت الخلايا وفقدان المحتويات الخلوية لاحقًا | تعتبر واحدة من أكثر الطرق المعروفة لتخليق AuNPs، تم تطوير طريقة توركيفيتش بواسطة توركيفيتش في عام 1951 وتعتمد على اختزال HAuCl 4 بواسطة سترات في الماء | [114، 115] |
| AgNPs | يمكن لجزيئات الفضة النانوية (AgNPs) اختراق جدران الخلايا البكتيرية، مما يؤدي إلى تغيير تكوين أغشية الخلايا وقد يتسبب في موت الخلايا. من خلال إطلاق أيونات الفضة، يمكنها زيادة نفاذية أغشية الخلايا، وتوليد أنواع الأكسجين التفاعلية (ROS)، والتداخل مع تكرار الحمض النووي الريبي منقوص الأكسجين. | يمكن تصنيف طرق التخليق الحالية إلى نوعين متميزين: من الأسفل إلى الأعلى ومن الأعلى إلى الأسفل. تتضمن الطريقة من الأعلى إلى الأسفل استخدام قوى فيزيائية متنوعة – بما في ذلك التأثيرات الميكانيكية (مثل السحق والطحن والطحن الدقيق)؛ والقوى الكهربائية (مثل تفريغ القوس الكهربائي أو التبخر بالليزر)؛ والقوى الحرارية (مثل تكثف البخار) – لتوليد جزيئات نانوية معدنية من المواد الضخمة. تتضمن الطريقة من الأسفل إلى الأعلى نواة وتكاثر المكونات الجزيئية لتشكيل تجمعات معقدة. تعتبر التخليق الكيميائي والبيولوجي من الطرق الشائعة من الأسفل إلى الأعلى لإنتاج الجزيئات النانوية من أملاح السلف. | [١١٦، ١١٧] |
| MNPs | يُعتقد أن الآليات المضادة للبكتيريا التي تظهرها الجسيمات النانوية المغناطيسية (MNPs) ناتجة عن عاملين: تنشيط أنواع الأكسجين التفاعلية (ROS) على أسطح الجسيمات النانوية يؤدي إلى إجهاد أكسدي داخل الخلية البكتيرية، مما يؤدي إلى موت الخلية. | تمت عملية إنتاج جزيئات نانوية من Fe2O3 عبر وسائل هيدروحرارية. تضمنت الإجراء إذابة 0.85 ملغ من FeCl 3.6 H 2 O في 100 مل من الماء المقطر مرتين داخل دورق دائري سعة 250 مل. تلا ذلك 45 دقيقة من التحريك المغناطيسي عند
|
[١١٨، ١١٩] |
| جزيئات النحاس النانوية | تتميز جزيئات النحاس النانوية بكونها تفاعلية بشكل استثنائي بسبب نسبة المساحة السطحية إلى الحجم العالية، مما يمكنها من التفاعل بشكل كبير مع غشاء الخلية، مما يؤدي إلى موت الخلايا من خلال إتلاف المواد الوراثية الخلوية. | التحقيق الحالي يتعلق بالإنتاج الصديق للبيئة لجزيئات النحاس النانوية (CuNPs) باستخدام تقنيتين متميزتين: (I) نهج قائم على الزمن و(II) المعالجة الحرارية لمحلول مائي. المستخلص النباتي المعني هو المورينغا (Moringa oleifera Lam). | [120, 121] |
| TiONPs | العمل المضاد للميكروبات
|
أنتجت تقنية الرش بالمصفوفة المنصهرة (MMS) راتينجًا شفافًا يتكون من جزيئات أكسيد التيتانيوم النانوية. للحصول على تشتتات متجانسة من الجزيئات النانوية، يسمح الضغط البخاري المنخفض لركيزة الإيثوكسيليت البنتايريثريتول (PEEL) بتطبيق هذه التقنية الفراغية مباشرة على PEEL السائل أثناء التحريك. | [١٢٢، ١٢٣] |
| جزيئات نانوية من أكسيد الزنك | تعتبر الخصائص المضادة للبكتيريا لجزيئات ZnO النانوية جذابة، والتي يمكن أن تُعزى إلى زيادة المساحة السطحية المحددة لها وتحسين تفاعل سطح الجسيمات الناتج عن تقليل حجم الجسيمات. | تم تخليق جزيئات ZnO النانوية بواسطة عملية هيدروحرارية باستخدام هيدروكسيد الصوديوم ونيترات الزنك سداسية الماء. | [١٢٤، ١٢٥] |

تم تنشيطها. قد تجلس هذه البروتينات أمام NF-кB. إعطاء خلايا PDL مثبط MEK1/2 U0126 ومثبط PI3K LY294002 قلل بشكل كبير من نشاط NF-кB وإنتاج COX-2 عندما
التخليق الأخضر للمعادن وجسيمات أكسيدها النانوية في التهاب اللثة
تطوير التهاب اللثة [129]. الهدف الأساسي من العلاج اللثوي هو القضاء على الفيلم الحيوي البكتيري وتقليل الالتهاب بحيث يمكن السيطرة على المرض بشكل فعال. في الماضي، تم استخدام عدة أدوية مضادة للميكروبات لعلاج أمراض اللثة. لذلك، من الضروري استكشاف مجموعة واسعة من العوامل ذات الخصائص الفيزيائية الكيميائية المتطورة، مع التركيز بشكل خاص على العوامل المضادة للبكتيريا التي تتمتع بخصائص جديدة ومميزة يمكن استخدامها كبديل للعلاجات اللثوية [130، 131]. لقد ظهرت المواد النانوية كعلاج مؤخرًا كنهج مبتكر لوقف تقدم العديد من الأمراض المدمرة. وقد استخدم الباحثون مراقبة ردود الفعل الشديدة للتمييز بين الاختزال البيوكيميائي للجسيمات النانوية وطرق التصنيع القياسية. كانت السمية الخلوية للجسيمات النانوية الخضراء أقل بكثير من تلك الخاصة بالجسيمات النانوية الكيميائية، مما يشير إلى أنها آمنة للاستخدام في مجموعة متنوعة من البيئات الطبية الحيوية [132] (الجدول 2) (الشكل 5).
الملخص
جزيئات الذهب النانوية (AuNPs) تم استكشاف العديد من التقنيات الفيزيائية والكيميائية المختلفة واستخدامها في إنتاج جزيئات الذهب النانوية. وقد ركزت العديد من المقالات الحديثة على تخليق وتوصيف جزيئات الذهب النانوية بسبب خصائصها الفيزيائية والكيميائية المميزة ونطاق تطبيقاتها الواسع. يتم إنتاج جزيئات الذهب النانوية من خلال وسائل فيزيائية (مثل إزالة الليزر) ولها توزيع ضيق في حجم الجسيمات، ولكن العائد ضعيف والتكلفة مرتفعة. توجد طرق كيميائية (مثل استخدام بوروهيدريد الصوديوم) لإنتاج جزيئات الذهب النانوية. تم تطوير طرق خضراء بديلة بسبب الآثار الضارة للمذيبات العضوية والمواد المخفضة المستخدمة في التصنيع الكيميائي لجزيئات الذهب النانوية. يمكن تصنيع المواد النانوية المعروفة باسم جزيئات الذهب النانوية بسهولة من خلال إجراء كيميائي أخضر من خطوة واحدة. وهي معروفة بأنها غير سامة ومتوافقة حيوياً. نظراً لخصائصها، تعتبر جزيئات الذهب النانوية مرشحاً واعداً للاستخدام في العلوم البيولوجية. النباتات المعروفة باسم “المجمعات الفائقة” يمكن أن تستخرج المعادن من البيئة. قد تحتوي جزء من الكتلة الحيوية في أوراق وسيقان نبات البرسيم على ذرات من الذهب. من أجل إنتاج خارجي فعال وسريع لـ
| جزيئات النانو المعدنية وأكسيد المعدن | آثار | طريقة التخليق الأخضر | الحكام |
|
|
الخصائص المضادة للبكتيريا ومضادة للفيلم الحيوي لـ
|
|
[١٣٣] |
| جزيئات النحاس النانوية | تعتبر جزيئات النحاس النانوية خيارًا واعدًا للاستخدام كعامل مضاد للتثبيت في زراعة الأسنان نظرًا لتأثيرها القاتل للبكتيريا ضد بكتيريا Aggregatibacter actinomycetemcomitans (وهي واحدة من العوامل الممرضة الرئيسية المسؤولة عن توليد التهاب اللثة العدواني الموضعي) وتوافقها مع الخلايا. | أحد أكثر الأساليب شيوعًا لإنتاج نانو جزيئات النحاس ونانو أكسيد النحاس يتضمن دمج تركيز معروف من مستخلص النبات مع تركيز مسبق متاح، وتسخين المزيج إلى درجة حرارة محددة، والتحريك المستمر للمزيج لمدة محددة مسبقًا. على سبيل المثال، تم الحصول على هذه المستخلصات من نباتات تشمل Celastrus paniculatus وCardiospermum halicacabum وZingiber officinale | [134-136] |
| IONPs | أظهرت النتائج أن نانو جزيئات BEP-IONPs المصنعة تظهر تأثيرًا قويًا مضادًا للبكتيريا، مع قدرة عالية على امتصاص صبغة MB تصل إلى
|
استخدم الباحثون في دراستهم مستخلص البروبوليس المصري البني (BEP) في تخليق IONPs بسبب خصائصه المخفضة والمستقرة | [137] |
| AgNPs | تجد الدراسة الحالية أن نانو جزيئات الفضة البيوجينية المصنعة باستخدام EFLAE لديها قدرة عالية على التثبيط ضد مسببات الأمراض الميكروبية التي تسبب التهاب اللثة، بما في ذلك E. Coli وB. cereus وS. pyogenes وP. aeruginosa | قام المحققون في الدراسة بصنع نانو جزيئات الفضة البيوسنتيكية باستخدام مستخلص مائي من أوراق Erythrina fusca (EFLAE) | [138] |
| AuNPs | أظهرت نانو جزيئات BCL-AuNPs عند تركيز أقل من MIC فعالية ملحوظة ضد تشكيل الأغشية الحيوية ضد P. aeruginosa PAO1. لوحظ انخفاض في تشكيل الأغشية الحيوية قدره
|
تم تصنيع نانو جزيئات AuNPs الكروية باستخدام المركب النباتي بايكالين كعامل تغليف وتقليل، كما أظهر الباحثون | [139] |
| ZnO NPs | كانت النشاط المضاد للبكتيريا لمركب الراتنج الذي يحتوي على نانو جزيئات ZnO أكبر بكثير من ذلك الذي يحتوي على نانو جزيئات الفضة | يمكن تصنيع نانو جزيئات ZnO من الفينولات والفلافونات، وهما مستخلصان نباتيان | [136, 140-142] |
|
|
أظهرت المطهرات الفموية تأثيرات مماثلة لهذه النانو جزيئات في التجارب التي أجريت. أدت إضافة نانو جزيئات BiNPs صفرية التكافؤ إلى إيقاف إنتاج الأغشية الحيوية لـ
|
|
[143, 144] |
. latifolia أظهرت تأثيرًا كبيرًا مضادًا للألم. أظهر الباحثون أن نانو جزيئات AuNPs المستقرة والمتوافقة حيويًا والصديقة للبيئة تم استخدامها كعامل محفز للعظام أثناء علاجات زراعة الأنسجة السنية وكخاصية مسكنة فعالة لإدارة الألم في رعاية التمريض [154].
تم إعاقة سلوكيات التجمع بشكل كبير عند وجود BCL-AuNPs. تم التحقيق في تأثير BCL-AuNPs على الطبوغرافيا السطحية وهندسة حيوانات P. aeruginosa الحيوية باستخدام المجهر الضوئي وCLSM. لذلك، تثير نتائج التحقيق إمكانية استخدام BCL-AuNPs في إنشاء علاجات جديدة لتجنب وعلاج الأمراض المزمنة الناتجة عن الأغشية الحيوية [139].
جزيئات الفضة النانوية
عمليات الطرد المركزي بسرعة
23.2 نانومتر بواسطة TEM، 59.4 نانومتر بواسطة DLS)، ومحمية بواسطة عوامل التغطية. تراوحت قيم الحد الأدنى من التركيز المثبط (MICs) لجزيئات الفضة النانوية (AgNPs) التي تظهر نشاطًا مضادًا للبكتيريا من 8 إلى
اكتشفت أبحاث مختلفة أن استخدام مستخلص أوراق Justicia glauca يعزز من إنتاج جزيئات الفضة النانوية (AgNPs). المواد العضوية القابلة للذوبان في الماء في مستخلص الأوراق هي المسؤولة بشكل أساسي عن التحويل.
(A. naeslundii، C. albicans، F. nucleatum، S. aureus، S. epidermidis، S. mutans، S. oralis، و V. dispar). تظهر العدوى الطبية وطب الأسنان MICs محددة الأنواع وتركيزات مثبطة دنيا (MMCs) لاستخراج بذور وزهور S. cumini. قد تتحقق التأثيرات البكتيريا والفطرية لـ AgNPs-HEScSeed و AgNPs-HEScFlower عند تركيزات أقل بكثير من تلك الخاصة باستخراجات النباتات بسبب أشكالها الفريدة، وأحجامها، ومكوناتها الكيميائية، واستقرارها، وسالبية الشحنة (التغطية). نمو S. aureus (قطر منطقة التثبيط:
قد يكون S. rochei MS-37 أول بكتيريا أكتينوبكتيرية بحرية يتم دراسة أدائها فيما يتعلق بجزيئات الفضة النانوية (AgNPs) وإمكاناتها كخيارات مضادة للبكتيريا، ومضادة للالتهابات، ومضادة للفيلم الحيوي، ومضادة للأكسدة لتقليل الأمراض السنية المرتبطة بالغشاء. في هذا البحث، تم استخدام السلالة البحرية الجديدة من البكتيريا الأكتيوبكتيرية S. rochei MS-37 لتخليق AgNPs ذات استخدامات طبية محتملة. كانت جزيئات الفضة النانوية تظهر ذروة عند 429 نانومتر في مطيافية الرنين السطحي البلازمي. كانت جزيئات الفضة النانوية كروية، ومستقرة جداً (26 مللي فولت)، وصغيرة جداً (متوسط 23.2 نانومتر بواسطة المجهر الإلكتروني النافذ، 59.4 نانومتر بواسطة تشتت الضوء الديناميكي)، ومحمية بواسطة عوامل تغليف. كانت جزيئات الفضة النانوية ذات نشاط مضاد للبكتيريا واعدة، حيث كانت تركيزات الحد الأدنى المثبطة (MICs) تتراوح بين 8 و
تمت دراسة الالتصاق واختراق البكتيريا عبر أغشية تجديد الأنسجة الموجهة باستخدام مسببات الأمراض اللثوية. أظهرت النتائج أن جزيئات الفضة النانوية (AgNPs) يمكن أن تساعد في منع العدوى المرتبطة بالأغشية. بالإضافة إلى ذلك، تم إظهار أن جزيئات الفضة النانوية أظهرت تأثيرًا كبيرًا مضادًا للتخثر وقدرة عالية على القضاء على الجذور الحرة لأكسيد النيتريك عند تقييم وظيفتها المضادة للالتهابات باستخدام هذه الطرق. كانت قيم IC50 لجزيئات الفضة النانوية هي
جزيئات الحديد النانوية
واحد مع INP والأموكسيسيلين، وواحد مع مستخلص النبات فقط لدراسة تأثيرات تركيبات العلاج المختلفة على S. mutans. إن دمج INP مع عامل مضاد للميكروبات يزيد من فعالية عامل المضاد للميكروبات. كان كل من مستخلص البذور الباردة (S-MNP) ومستخلص اللب (P-MNP) من MNPs دائري الشكل بعد تصنيعهما. كان لدى S-MNP نطاق حجم أضيق من
منطقة تثبيط بمقدار 23.5 مم للبكتيريا سالبة الجرام P. aeruginosa. مع معدل ثابت من
جزيئات النحاس النانوية
المخلفات [170]. واحدة من أكثر الطرق شيوعًا لإنتاج نانو جزيئات النحاس (Cu) وأكسيد النحاس (CuO) تتضمن دمج تركيز معروف من مستخلص النبات مع تركيز مسبق متاح، وتسخين المزيج إلى درجة حرارة محددة، وتحريك الخليط باستمرار لمدة محددة مسبقًا. نظرًا لخصائصها الفيزيائية الاستثنائية، تُستخدم نانو جزيئات النحاس في المضادات الحيوية. وبفضل خصائصها المطهرة وثباتها في المصفوفة، تغطي المعدات الطبية بما في ذلك أنظمة نقل الحرارة، والمواد المضادة للميكروبات، والمواد فائقة القوة، وأجهزة الاستشعار، والمح catalysts [171، 172]. تم استخدام مستخلصات النباتات في تخليق نانو جزيئات النحاس. وقد جاءت هذه المستخلصات من نباتات تشمل Celastrus paniculatus وCardiospermum halicacabum وZingiber officinale وEryngium caucasicum وPlectranthus amboinicus وAzadirachta indica وPunica granatum وEclipta prostrata وCitrus medica Linn. وMadhuca longifolia. إطلاق الأيونات ليس العامل الأكثر أهمية في العمل البكتيري لنانو جزيئات النحاس، على عكس الفضة. حالة الأكسدة، الحجم، والبنية البلورية للنانو جزيئات كلها عوامل أساسية. نانو جزيئات النحاس هي خيار واعد للاستخدام كعامل مضاد للزراعة حول الزرعات السنية بسبب تأثيرها البكتيري ضد Aggregatibacter actinomycetemcomitans (واحد من العوامل الممرضة الرئيسية المسؤولة عن توليد التهاب اللثة العدواني الموضعي) وتوافقها الخلوي. أظهرت نانو جزيئات أكسيد النحاس المستخلصة من الألوة فيرا تأثيرات قوية مضادة للتسوس وقد وجدت استخدامًا واسع النطاق في مجال طب الأسنان [134-136]. تم استخدام مستخلصات الإيثانول والماء من ثمار الزعرور لصنع نانو جزيئات الفضة والنحاس. تم التحقيق في توزيع حجم الجسيمات كدالة لدرجة حموضة المحلول، ومدة الاتصال، ودرجة الحرارة، ومعدن الأيون المسبق، ونوع مستخلص الزعرور. تم تخليق نانو جزيئات الفضة والنحاس بحجم متجانس وتوزيع مستقر بمتوسط حجم 60 نانومتر و200 نانومتر، على التوالي. تم تحليل المستخلصات لمحتواها الكلي من الفينولات ومحتوى الأنثوسيانين. في هذه الدراسة، تم استخدام مستخلص الزعرور كعامل مثبت ومختزل لإنشاء عملية خضراء لتحضير نانو جزيئات الفضة والنحاس. وقد تم الإبلاغ عن تقليل أيونات الفضة والنحاس باستخدام مستخلص الإيثانول من ثمار الزعرور المجففة والماء. عند تركيزات منخفضة نسبيًا (أقل من
التهاب اللثة. ثم، باستخدام التحليل المورفولوجي/الكيميائي الحيوي وطرق 16S-rRNA، تم تقييم الأنشطة المضادة للبكتيريا لجزيئات CME-CuNPs ضد الكائنات الدقيقة الفموية (M. luteus وB. subtilis وP. aerioginosa) التي تسبب أمراض اللثة. بعد وصف CME-CuNPs، تم الإشارة إلى تطوير CME-CuNPs المستقرة من خلال الذروة المكتشفة عند 577 نانومتر باستخدام مطياف الأشعة فوق البنفسجية والمرئية. بالإضافة إلى ذلك، تم توضيح تأثير CME-CuNPs الأحادية التشتت البيضاوية والكرية بأقطار تتراوح من 11.3 إلى 22.4 نانومتر من خلال البيانات. وفقًا لدراسة FTIR، قد تحتوي CME على Ras، الذي ساهم في تقليل النحاس وتخليق CME-CuNP. بالإضافة إلى ذلك، أظهرت CME-CuNPs فعالية مضادة للبكتيريا قوية ضد عدة عزلات، متجاوزة القيم الموثقة في الأدبيات. تم اختبار البكتيريا الفموية لمدى حساسيتها لـ CME-CuNPs ومحلول التآزر من الكليندامايسين مع CME-CuNPs. كانت قدرة المحلول على تثبيط نمو البكتيريا ملحوظة. تم العثور على الحد الأدنى من التركيز المثبط (MIC) والحد الأدنى من التركيز القاتل (MBC) وتركيز التثبيط الجزئي (FIC) لـ CME-CuNPs مع الكليندامايسين ضد الكائنات الدقيقة المختارة المسببة لأمراض اللثة تتراوح بين 2.6 و
كان الهدف هو إنشاء نانو نحاس مضاد للبكتيريا باستخدام تركيبة عشبية من CME كعامل مضاد للميكروبات التي تسبب الأمراض المعدية في منطقة اللثة، بما في ذلك الجراثيم سالبة الجرام.

و C. albicans. تظهر هذه الدراسة أن
ضد الكائنات الدقيقة المذكورة أعلاه [186]. في هذا العمل، قام الباحثون بدراسة النشاط المضاد للبكتيريا لـ
جزيئات نانوية من أكسيد الزنك
تم استخدامه لتخليق ZnO -NPs في البحث. في هذا البحث، تم إنتاج ZnO-NPs كروية الشكل ذات بنية بلورية وأقصى SPR (رنين البلازمون السطحي) يبلغ 380 نانومتر بشكل فعال. أظهر فحص البيانات أن التركيز أثر على هذه الأنشطة الحيوية.
NPs الأخرى
نهج تصنيع الجسيمات النانوية المعدنية. تستخدم هذه الطرق كيانات بيولوجية مثل البكتيريا والفطريات والفيروسات والخمائر والأكتينوميسيتات ومستخلصات النباتات والمزيد. تم تصنيعها حيوياً
آفاق المستقبل
يمكن إنتاج الجسيمات النانوية كيميائيًا أو عبر الطرق الخضراء؛ ومع ذلك، فإن التخليق الكيميائي للجسيمات النانوية يتطلب جهدًا كبيرًا، ويكون مكلفًا، ويستهلك طاقة كبيرة. نظرًا لقدرتها السهلة على التعديل، فإن الجسيمات النانوية الذهبية لديها القدرة على العمل كحاملات لعوامل مضادة للميكروبات. ومع ذلك، فإن تنفيذ العمليات الفيزيائية أو الكيميائية لإنتاج الجسيمات النانوية يعد مكلفًا للغاية، ويتطلب جهدًا كبيرًا، ويكون ضارًا بالنظم البيئية. من ناحية أخرى، فإن إنتاج الجسيمات النانوية عبر الطرق الخضراء أكثر اقتصادية ويستهلك طاقة أقل. الآثار الجانبية الضارة للمذيبات العضوية وسُمّية المواد المخفضة المستخدمة في الإنتاج الكيميائي للجسيمات النانوية الذهبية دفعت إلى البحث عن بدائل صديقة للبيئة. الجسيمات النانوية الذهبية، وهي نوع من المواد النانوية، يمكن إنتاجها بسهولة من خلال إجراء كيمياء خضراء من خطوة واحدة، وهو ما يعد مفيدًا للبيئة. إن عدم سُمّيتها وتوافقها الحيوي معروف عالميًا. تعتبر الجسيمات النانوية الذهبية مرشحة واعدة للتطبيقات البيولوجية بسبب خصائصها الفريدة. الفائدة التشخيصية للجسيمات النانوية الذهبية في أمراض اللثة.
تعتبر الأمراض كبيرة نظرًا لخصائصها البصرية المميزة والحاسمة. تم استخدام الكائنات الدقيقة المسببة للتسوس السني وأمراض اللثة، بما في ذلك S. mutans و S. aureus و L. acidophilus و M. luteus و B. subtilis و E. coli و P. aeruginosa و C. albicans، لتقييم الخصائص المضادة للميكروبات لجزيئات الفضة النانوية التي تم تصنيعها بطريقة خضراء وجزيئات الفضة النانوية الممزوجة بالأدوية. تظهر جزيئات الفضة النانوية، بالاشتراك مع جزيئات الفضة النانوية الممزوجة بالأدوية، خصائص ملحوظة مضادة للبكتيريا والفطريات. يمكن ملاحظة قيم التركيز المثبط الأدنى لجزيئات الفضة النانوية، كما تم تحديدها ضد كائنات دقيقة معينة تسبب التسوس السني وأمراض اللثة، ضمن نطاق التركيز.
آثارها على صحة الإنسان والأنظمة البيئية. أي منتج نانو طبي أو أسنان أكمل مرحلة البحث والتطوير يخضع لبروتوكول اختبار قبل سريري صارم في المختبر لفحص خصائصه الميكانيكية والمناعية والسمية. تم وضع إرشادات لمراجعة مخاطر المواد النانوية من قبل عدة منظمات، بما في ذلك المعهد الوطني للسلامة والصحة المهنية ووكالة حماية البيئة الأمريكية. التحديات التشريعية مستمرة عند إنشاء إطار تنظيمي متعدد التخصصات لتقييم وإدارة تكنولوجيا النانو ومعالجة القضايا الأخلاقية التي تقع في أربعة مجالات: الميتافيزيقا، والمساواة، والخصوصية، والأمن. نتيجة لذلك، من الضروري أن يفهم المشاركون درجة الخطر المرتبطة بتعرضهم لمواد ومعلومات جديدة، وأن يتم إنشاء مجالس لمراقبة السلامة في كل تجربة سريرية مكلفة بمراقبة وتوثيق أي آثار سلبية مبكرة، وتحديد الشذوذ في إدارة البيانات، وحماية رفاهية وأمن المشاركين في التجارب. إن عدم القدرة على التنبؤ بطبيعة المواد النانوية يضع أطباء الأسنان في معضلة أخلاقية عند مواجهتهم لمجموعة واسعة من المواد، بعضها له فائدة سريرية مثبتة من خلال دراسات سريرية قصيرة الأجل (مثل الراتنجات المركبة المملوءة بالنانو). في المقابل، فإن مواد أخرى، بما في ذلك الراتنجات المركبة الهجينة أو المملوءة بالميكرو، جذابة من الناحية المفاهيمية ولكن تفتقر إلى مثل هذا الدعم. إن الطريقة التقليدية لاتخاذ القرارات الأخلاقية، التي تعتمد أساسًا على النفعية، ليست متماشية مع التقدم السريع في تكنولوجيا النانو ومستقبلها غير المتوقع. بسبب ذلك، هناك حاجة لفهم أعمق للعلم، جنبًا إلى جنب مع تقييمات المخاطر والفوائد والمخاوف الأخلاقية في كل مرحلة من مراحل التطوير. وقد أدى ذلك إلى مفهوم الأخلاقيات الاستباقية والحكم، الذي تم إنشاؤه لاستخدام نماذج التحليل الأخلاقي لتحديد ومعالجة الآثار الأخلاقية والاجتماعية عندما تكون التكنولوجيا لا تزال في مراحلها المبكرة. وهذا يسمح بتعديل وتوجيه التكنولوجيا نحو نتيجة مقبولة أخلاقياً بسهولة. وبالتالي، فإن القرار باستخدام المواد النانوية يعتمد على الحالة السريرية المحددة والسن الذي يحتاج إلى ترميم، مع مراعاة دقيقة للمتطلبات الجمالية، والتحميل، والمخاطر المحتملة مثل العادات غير الوظيفية. تهدف الأبحاث المستمرة إلى تحسين أداء المواد النانوية الحالية. تشمل التطورات المستقبلية المحتملة أجهزة استشعار حيوية نانوية أكثر كفاءة من حيث التكلفة والفعالية، قادرة على تشخيص سرطان الفم بدقة. بالإضافة إلى ذلك، يتم تطوير أنظمة جديدة لتوصيل الأدوية عن طريق الفم لمنع تكوين الأغشية الحيوية وتقليل انتشار أمراض اللثة وتسوس الأسنان. بينما المبادئ العلمية الكامنة وراء تكنولوجيا النانو هي
رغم أنها جذابة، إلا أن تطبيقها السريري الواسع محدود بسبب غياب الأدلة السريرية طويلة الأمد حول فعاليتها [215].
تشير المنشورات التي تمت مراجعتها هنا إلى أن التحقيق في استخدام الجسيمات النانوية المعدنية لعلاج التهاب اللثة لا يزال في مراحله المبكرة. جزء كبير من الدراسات التي تم فحصها في هذه المقالة فني وغالبًا ما لا تتضمن تحليلًا رئيسيًا للتكاليف/الفوائد أو أوصافًا مفصلة للإجراءات الأساسية المتبعة في كل تحقيق. تتطلب الآليات الكامنة وراء امتصاص الخلايا للجسيمات النانوية المعدنية وخصائصها المضادة للبكتيريا في علاج التهاب اللثة مزيدًا من البحث. من المهم ملاحظة أن معظم آليات النقل المحددة للموقع تؤدي بشكل جيد في المختبر ولكن بشكل غير كافٍ في الجسم الحي. وبالتالي، قد تستفيد الأبحاث لعلاج التهاب اللثة في الجسم الحي من هذه التحقيقات. على الرغم من أن العيش بشكل مستدام هو هدف مرغوب، إلا أن هناك العديد من العيوب المحتملة للتكنولوجيا والعمليات الخضراء، بما في ذلك التكاليف العالية للتنفيذ، والجهل، وغياب المواد الكيميائية أو المواد الخام البديلة. على الرغم من وجود العديد من الفوائد لتخليق المواد النانوية الخضراء، إلا أن هناك عيوبًا. تشمل هذه المشكلات اختيار المواد الخام، وظروف التفاعل، ومراقبة جودة المنتج، والتطبيق. تتحدى هذه العناصر إنشاء مواد نانوية صديقة للبيئة للإنتاج والاستخدام الواسع النطاق. وجد الباحثون أن العديد من النباتات المتاحة بسهولة في المنطقة يمكن استخدامها لصنع الجسيمات النانوية الخضراء. تشير هذه الدراسات إلى أنه على الرغم من أن الاستخدام الكامل للنباتات المحلية ممكن، إلا أن الإنتاج العالمي الكبير للمواد النانوية لا يزال يمثل تحديًا. قد يكون من الصعب استخدام المكونات الخام في التصنيع الفعلي بسبب قيود الوقت. خلال مرحلة الإزهار، يجب أن تجمع ورقة القطن المكونات اللازمة لصنع الجسيمات النانوية الفضية. علاوة على ذلك، فإن درجة الحرارة المثالية للعديد من العمليات الاصطناعية الصديقة للبيئة مرتفعة، وعملية التخليق تستغرق وقتًا طويلاً، مما يتطلب كمية كبيرة من الطاقة التي قد تكون ضارة بالبيئة. حتى مع المواد الأولية الصديقة للبيئة، لا تتبع العملية دائمًا إرشادات التخليق المستدام. تظهر الجسيمات النانوية الناتجة عن مستخلصات مختلفة اختلافات كبيرة في الشكل والحجم، مع كون الجودة المقاسة غير كافية. تشير المصادر الحالية إلى أنه بسبب الاختلافات الواسعة في قطر الجسيمات، فإن التكنولوجيا الخضراء غير مناسبة للإنتاج على نطاق واسع، ويصبح التحكم في حجم الجسيمات تحديًا كبيرًا خلال عملية التصنيع. فقط دراسة حديثة كانت قادرة على إظهار كيف أثرت مستخلصات النباتات على التخليق، وحتى في تلك الحالة، تظل العمليات الجزيئية الدقيقة المعنية غامضة. تختلف الجسيمات النانوية الناتجة عن اقتباسات مختلفة بشكل كبير في الحجم والشكل، والخصائص الموجودة غير كافية. تشير المصادر الحالية إلى وجود اختلافات كبيرة في حجم الجسيمات، مما يجعل التكنولوجيا الخضراء غير مناسبة للإنتاج على نطاق واسع ويقدم تحديات كبيرة للتحكم في حجم الجسيمات خلال التصنيع. بالإضافة إلى ذلك، هناك العديد من التحديات، مثل العائد المنخفض، وعدم الانتظام.
يجب التغلب على حجم الجسيمات، وإجراءات الفصل المعقدة، والدورية، وإمكانية الوصول إلى المواد الخام المحلية، والعديد من الأمور الأخرى قبل أن يمكن تحقيق تخليق المواد النانوية المستدامة واستخداماتها. هناك الآن العديد من تقنيات وعمليات تخليق المواد النانوية الخضراء المختلفة المتاحة، وسيتم تطوير المزيد في المستقبل [223].
مقارنة الجسيمات النانوية مع بعضها البعض
امتصاص الخلايا للفضة (Ag
وفقًا لأبحاث حديثة، قد يزيد استخدام الجسيمات النانوية المعدنية الهجينة معًا من فعاليتها البكتيرية [229]. قد يكون تزاوج الجسيمات النانوية المضادة للبكتيريا طريقة تكتيكية جديدة لمكافحة هذه الكائنات الدقيقة المسببة للأمراض. قد تصبح المعادن النبيلة، مثل الجسيمات النانوية الفضية، أكثر نشاطًا بيولوجيًا بسبب التأين الأسرع الناتج عن التزاوج مع النانو-
ضد الجسيمات النانوية المدعمة بالفضة
أبحاث الأسنان منذ أن كانت عاملًا مضادًا للبكتيريا ومعدلًا للملغم. يقال إن CuNPs، محور الدراسة الحالية، مفيدة عند إضافتها إلى الأسمنت السني، والمواد الترميمية، واللاصقات، والراتنجات، ومحاليل الري، والتعبئة، والأسلاك التقويمية والدعائم، وطلاءات سطح الزرع، وعملية تجديد العظام. مقارنةً بـ AgNPs، فإن CuONPs أقل تكلفة، وآمنة بيئيًا، ومستقرة كيميائيًا. CuONPs أقل تكلفة، وأكثر صداقة للبيئة، ولها بنية كيميائية أكثر استقرارًا من AgNPs [31].
وفقًا لبعض الأبحاث، قد تحتوي البكتيريا سالبة الجرام على تركيز عالٍ من
تثبيط مسار إشارة العامل النووي كابا-B، الذي ينظم المناعة. في vivo، تم تعزيز قدرة إصلاح الأنسجة الالتهابية اللثوية. يقدم هذا التصميم طرقًا جديدة لاستخدام MPNs في العلاج المناعي والعلاج الضوئي الحراري. يوفر نهجًا جديدًا لعلاج الاضطرابات المعدية، بما في ذلك التهاب اللثة [239].
الخاتمة
شكر وتقدير
مساهمات المؤلفين
تمويل
توفر البيانات والمواد
إعلانات
موافقة الأخلاقيات والموافقة على المشاركة
الموافقة على النشر
المصالح المتنافسة
تفاصيل المؤلف
تم الاستلام: 29 أكتوبر 2023 تم القبول: 19 ديسمبر 2023
References
- Holla G, Yeluri R, Munshi AK. Evaluation of minimum inhibitory and minimum bactericidal concentration of nano-silver base inorganic antimicrobial agent (Novaron
) against Streptococcus mutans. Contemp Clin Dent. 2012;3(3):288. - Chen
, et al. Advanced biomaterials and their potential applications in the treatment of periodontal disease. Crit Rev Biotechnol. 2016;36(4):760-75. - Sudiono J, et al. Bactericidal and cytotoxic effects of Erythrina fusca leaves aquadest extract. Dent J Majal Kedokt Gigi. 2013;46:9-13.
- Lu H, et al. Effect of adjunctive systemic antibiotics on microbial populations compared with scaling and root planing alone for the treatment of periodontitis: a pilot randomized clinical trial. J Periodontol. 2022;93(4):570-83.
- Lertsuphotvanit N , et al. Borneol-based antisolvent-induced in situ forming matrix for crevicular pocket delivery of vancomycin hydrochloride. Int J Pharm. 2022;617: 121603.
- Lee F-Y, et al. In vitro and in vivo investigation of drug-eluting implants for the treatment of periodontal disease. AAPS PharmSciTech. 2011;12:1110-5.
- Shaddox LM, Walker CB. Treating chronic periodontitis: current status, challenges, and future directions. Clin Cosmet Investig Dent. 2010;2:79-91.
- Graziani F, et al. Nonsurgical and surgical treatment of periodontitis: how many options for one disease? Periodontol 2000. 2017;75(1):152-88.
- Jain N, et al. Recent approaches for the treatment of periodontitis. Drug Discovery Today. 2008;13(21-22):932-43.
- Sanz I, et al. Nonsurgical treatment of periodontitis. J Evi Based Dental Pract. 2012;12(3):76-86.
- Haque MM , et al. Advances in novel therapeutic approaches for periodontal diseases. BMC Oral Health. 2022;22(1):1-23.
- Tonetti MS , Greenwell H , Kornman KS . Staging and grading of periodontitis: framework and proposal of a new classification and case definition. J Periodontol. 2018;89:S159-72.
- Wang C-T, Chen B-S. Drug discovery for periodontitis treatment based on big data mining, systems biology, and deep learning methods. SynBio. 2023;1(1):116-43.
- Gasner, N.S. and R.S. Schure, Periodontal disease, in StatPearls. 2022, StatPearls Publishing.
- Belibasakis GN , et al. Periodontal microbiology and microbial etiology of periodontal diseases: historical concepts and contemporary perspectives. Periodontol 2000. 2023. https://doi.org/10.1111/prd.12473.
- Muñoz Navarro C, et al. Analysis of the oral microbiome in a patient with cardiofaciocutaneous syndrome and severe periodontal disease: impact of systemic antibiotic therapy. Antibiotics. 2022;11(12):1754.
- Curtis DA, et al. Treatment planning considerations in the older adult with periodontal disease. Periodontol 2000. 2021;87(1):157-65.
- Shaddox LM, Walker CB. Treating chronic periodontitis: current status, challenges, and future directions. Clin Cosmetic Investi Dent. 2010. https://doi.org/10.2147/CCIDE.S7712.
- Jain P, et al. Nanotechnology interventions as a putative tool for the treatment of dental afflictions. Nanotechnol Rev. 2022;11(1):1935-46.
- Kang J, et al. Applications of nanotechnology in virus detection, tracking, and infection mechanisms. Wiley Interdiscipl Rev Nanomed Nanobiotechnol. 2021. https://doi.org/10.1002/wnan.1700.
- Sahu AK, et al. SARS-CoV-2: phylogenetic origins, pathogenesis, modes of transmission, and the potential role of nanotechnology. VirusDisease. 2021. https://doi.org/10.1007/s13337-021-00653-y.
- Assefi M, et al. A state-of-the-art review on solid lipid nanoparticles as a nanovaccines delivery system. J Drug Deliv Sci Technology. 2023. https://doi.org/10.1016/j.jddst.2023.104623.
- Jafari-Gharabaghlou D, et al. Combination of metformin and phenformin synergistically inhibits proliferation and hTERT expression in human breast cancer cells. Iran J Basic Med Sci. 2018;21(11):1167.
- Javan N, et al. Synergistic antiproliferative effects of co-nanoencapsulated curcumin and chrysin on mda-mb-231 breast cancer cells through upregulating mir-132 and mir-502c. Nutr Cancer. 2019;71(7):1201-13.
- Yasamineh S, et al. An overview on nanoparticle-based strategies to fight viral infections with a focus on COVID-19. J Nanobiotechnol. 2022;20(1):440.
- Yasamineh S , et al. A state-of-the-art review on the recent advances of niosomes as a targeted drug delivery system. Int J Pharmac. 2022. https://doi.org/10.1016/j.ijpharm.2022.121878.
- Gholizadeh O , et al. Therapeutic and diagnostic applications of nanoparticles in the management of COVID-19: a comprehensive overview. Virol J. 2022;19(1):1-22.
- Dizaj SM, et al. Antimicrobial activity of carbon-based nanoparticles. Adv Pharmac Bull. 2015;5(1):19.
- Rudramurthy GR, et al. Nanoparticles: alternatives against drug-resistant pathogenic microbes. Molecules. 2016;21(7):836.
- Safarov T, et al. An overview of nanotechnology-based treatment approaches against Helicobacter Pylori. Expert Rev Anti Infect Ther. 2019;17(10):829-40.
- Nasiri K, et al. Recent advances in metal nanoparticles to treat periodontitis. J Nanobiotechnol. 2023;21(1):283 .
- Priyadarsini S, Mukherjee S, Mishra M. Nanoparticles used in dentistry: a review. J Oral Biol Craniofacial Res. 2018;8(1):58-67.
- Chen H, et al. Nano-Based drug delivery systems for periodontal tissue regeneration. Pharmaceutics. 2022;14(10):2250.
- Oveili E, et al. The potential use of mesenchymal stem cells-derived exosomes as microRNAs delivery systems in different diseases. Cell Commun Signaling. 2023;21(1):1-26.
- Yasamineh S , et al. A state-of-the-art review on the recent advances of niosomes as a targeted drug delivery system. Int J Pharm. 2022;624: 121878.
- Basudan AM. Nanoparticle based periodontal drug delivery-a review on current trends and future perspectives. Saudi Dent J. 2022;34(8):669-80.
- Kelotte D, Melath A. Nanotechnology and periodontics. J Period Implant Sci. 2023;53(4):245-7.
- He W, et al. Upconversion nanoparticles-based lateral flow immunoassay for point-of-care diagnosis of periodontitis. Sens Actuators B Chem. 2021;334: 129673.
- Bae G , et al. Nanometric lamination of zinc oxide nanofilms with gold nanoparticles for self-perceived periodontal disease sensors. Compos B Eng. 2022;230: 109490.
- de Carvalho Bernardo WL, et al. Antimicrobial effects of silver nanoparticles and extracts of Syzygium cumini flowers and seeds: Periodontal, cariogenic and opportunistic pathogens. Arch Oral Biol. 2021;125: 105101.
- Kurhade P, Kodape S, Choudhury R. Overview on green synthesis of metallic nanoparticles. Chem Pap. 2021;75(10):5187-222.
- Salem SS, Fouda A. Green synthesis of metallic nanoparticles and their prospective biotechnological applications: an overview. Biol Trace Elem Res. 2021;199:344-70.
- Shafey AME. Green synthesis of metal and metal oxide nanoparticles from plant leaf extracts and their applications: a review. Green Proc Synt. 2020;9(1):304-39.
- Pal G, Rai P, Pandey A. Green synthesis of nanoparticles: A greener approach for a cleaner future. In: Green synthesis, characterization and applications of nanoparticles. Elsevier; 2019. p. 1-26.
- Mohanpuria P, Rana NK, Yadav SK. Biosynthesis of nanoparticles: technological concepts and future applications. J Nanopart Res. 2008;10:507-17.
- Iravani S. Green synthesis of metal nanoparticles using plants. Green Chem. 2011;13(10):2638-50.
- Bukhari A, et al. Green synthesis of metal and metal oxide nanoparticles using different plants’ parts for antimicrobial activity and anticancer activity: a review article. Coatings. 2021;11(11):1374.
- Vijayaram S, et al. Applications of green synthesized metal nanoparticles—a review. Biol Trace Element Res. 2023. https://doi.org/10.1007/ s12011-023-03645-9.
- Subbiah U, Elango S, Jayesh R. Herbals and green synthesized nanoparticles in dentistry. In: Nanobiomaterials in Clinical Dentistry. Elsevier; 2019. p. 617-46.
- Singh J, et al. ‘Green’synthesis of metals and their oxide nanoparticles: applications for environmental remediation. J Nanobiotechnol. 2018;16(1):1-24.
- Mughal B, et al. Biogenic nanoparticles: synthesis, characterisation and applications. Appl Sci. 2021;11(6):2598.
- Fanoro OT, Oluwafemi OS. Bactericidal antibacterial mechanism of plant synthesized silver, gold and bimetallic nanoparticles. Pharmaceutics. 2020;12(11):1044.
- Rai
ade , Yadav A. Biogenic nanoparticles: an introduction to what they are, how they are synthesized and their applications. In: Metal nanoparticles in microbiology. Springer; 2011. p. 1-14. - Kumar A, et al. Biogenic metallic nanoparticles: Biomedical, analytical, food preservation, and applications in other consumable products. Front Nanotechnol. 2023;5:1175149.
- Patil S, Chandrasekaran R. Biogenic nanoparticles: a comprehensive perspective in synthesis, characterization, application and its challenges. J Genetic Eng Biotechnol. 2020;18:1-23.
- Doble, M., K. Rollins, and A. Kumar, Green chemistry and engineering. 2010: Academic Press.
- Devi D, et al. Eco-friendly green synthesis approach and evaluation of environmental and biological applications of Iron oxide nanoparticles. Inorganic Chem Commun. 2023. https://doi.org/10.1016/j. inoche.2023.110700.
- Alprol AE, et al. Algal extracts for green synthesis of zinc oxide nanoparticles: promising approach for algae bioremediation. Materials. 2023;16(7):2819.
- Arokiyaraj S, et al. Green synthesis of silver nanoparticles using Rheum palmatum root extract and their antibacterial activity against Staphylococcus aureus and Pseudomonas aeruginosa. Artificial cells Nanomed Biotechnol. 2017;45(2):372-9.
- Huq MA, Akter S. Biosynthesis, characterization and antibacterial application of novel silver nanoparticles against drug resistant pathogenic Klebsiella pneumoniae and Salmonella enteritidis. Molecules. 2021;26(19):5996.
- Pillai AM, et al. Green synthesis and characterization of zinc oxide nanoparticles with antibacterial and antifungal activity. J Mol Struct. 2020;1211: 128107.
- Umaralikhan L, Jamal Mohamed Jaffar M. Green synthesis of MgO nanoparticles and it antibacterial activity. Iranian J Sci Technol Trans A Sci. 2018;42:477-85.
- Bhattarai B, Zaker Y, Bigioni TP. Green synthesis of gold and silver nanoparticles: challenges and opportunities. Current Opinion Green Sustain Chem. 2018;12:91-100.
- Ying S, et al. Green synthesis of nanoparticles: Current developments and limitations. Environ Technol Innov. 2022;26: 102336.
- Bahrulolum
, et al. Green synthesis of metal nanoparticles using microorganisms and their application in the agrifood sector. J Nanobiotechnol. 2021;19(1):1-26. - Iravani S. Bacteria in nanoparticle synthesis: current status and future prospects. Int Schol Res Notices. 2014. https://doi.org/10.1155/2014/ 359316.
- Thakkar KN, Mhatre SS, Parikh RY. Biological synthesis of metallic nanoparticles. Nanomed Nanotechnol Biol Med. 2010;6(2):257-62.
- Alsaiari NS, et al. Plant and microbial approaches as green methods for the synthesis of nanomaterials: synthesis, applications, and future perspectives. Molecules. 2023;28(1):463.
- Pavithra KG, et al. Microalgae for biofuel production and removal of heavy metals: a review. Environ Chem Lett. 2020;18:1905-23.
- Agarwal H, Kumar SV, Rajeshkumar S. A review on green synthesis of zinc oxide nanoparticles-an eco-friendly approach. Resource-Efficient Technol. 2017;3(4):406-13.
- Aldayel MF, AI Kuwayti MA, El Semary NA. Investigating the production of antimicrobial nanoparticles by Chlorella vulgaris and the link to its loss of viability. Microorganisms. 2022;10(1):145.
- AI-Enazi NM, Alwakeel S, Alhomaidi E. Photocatalytic and biological activities of green synthesized SnO 2 nanoparticles using Chlorella vulgaris. J Appl Microbiol. 2022;133(6):3265-75.
- Bhuyar P, et al. Synthesis of silver nanoparticles using marine macroalgae Padina sp and its antibacterial activity towards pathogenic bacteria. Beni-Suef Univ J Basic Appl Sci. 2020;9:1-15.
- Bhattacharya D, Gupta RK. Nanotechnology and potential of microorganisms. Crit Rev Biotechnol. 2005;25(4):199-204.
- Yurkov AM, Kemler M, Begerow D. Species accumulation curves and incidence-based species richness estimators to appraise the diversity of cultivable yeasts from beech forest soils. PLoS ONE. 2011;6(8): e23671.
- Hudlikar M , et al. Green synthesis of TiO 2 nanoparticles by using aqueous extract of Jatropha curcas L. latex. Mater Lett. 2012;75:196-9.
- Vidya C, et al. Green synthesis of ZnO nanoparticles by Calotropis gigantea. Int J Curr Eng Technol. 2013;1(1):118-20.
- Gnanasangeetha D, Thambavani DS. Biogenic production of zinc oxide nanoparticles using Acalypha indica. J Chem Biol and Phy Sci (JCBPS). 2013;4(1):238.
- Devi HS, Singh TD. Synthesis of copper oxide nanoparticles by a novel method and its application in the degradation of methyl orange. Adv Electron Electr Eng. 2014;4(1):83-8.
- Gunalan S, Sivaraj R, Rajendran V. Green synthesized ZnO nanoparticles against bacterial and fungal pathogens. Prog Nat Sci Mat Int. 2012;22(6):693-700.
- Sneha K, et al. Corynebacterium glutamicum-mediated crystallization of silver ions through sorption and reduction processes. Chem Eng J. 2010;162(3):989-96.
- Kalishwaralal K, et al. Extracellular biosynthesis of silver nanoparticles by the culture supernatant of Bacillus licheniformis. Mater Lett. 2008;62(29):4411-3.
- Mittal AK, Chisti Y, Banerjee UC. Synthesis of metallic nanoparticles using plant extracts. Biotechnol Adv. 2013;31(2):346-56.
- Malik P, et al. Green chemistry based benign routes for nanoparticle synthesis. J Nanopart. 2014. https://doi.org/10.1155/2014/302429.
- Mukunthan K, Balaji S. Cashew apple juice (Anacardium occidentale L.) speeds up the synthesis of silver nanoparticles. Int J Green Nanotechnol. 2012;4(2):71-9.
- Makarov VV, et al. “Green” nanotechnologies: synthesis of metal nanoparticles using plants. Acta Naturae. 2014;6(1):35-44.
- Singh
, et al. Revisiting the green synthesis of nanoparticles: uncovering influences of plant extracts as reducing agents for enhanced
synthesis efficiency and its biomedical applications. Int J Nanomed. 2023. https://doi.org/10.2147/IJN.S419369. - Saravanan M, et al. Synthesis of silver nanoparticles from Bacillus brevis (NCIM 2533) and their antibacterial activity against pathogenic bacteria. Microb Pathog. 2018;116:221-6.
- Arya A, et al. Biogenic synthesis of copper and silver nanoparticles using green alga Botryococcus braunii and its antimicrobial activity. Bioinorg Chem Appl. 2018. https://doi.org/10.1155/2018/7879403.
- Soni V, et al. Sustainable and green trends in using plant extracts for the synthesis of biogenic metal nanoparticles toward environmental and pharmaceutical advances: a review. Environ Res. 2021;202: 111622.
- Thatyana M , et al. Advances in phytonanotechnology: a plant-mediated green synthesis of metal nanoparticles using phyllanthus plant extracts and their antimicrobial and anticancer applications. Nanomaterials. 2023;13(19):2616.
- Kapoor A, et al. Systemic antibiotic therapy in periodontics. Dent Res J (Isfahan). 2012;9(5):505-15.
- Addy M, Martin M. Systemic antimicrobials in the treatment of chronic periodontal diseases: a dilemma. Oral Dis. 2003;9:38-44.
- John MT, et al. Network meta-analysis of studies included in the Clinical Practice Guideline on the nonsurgical treatment of chronic periodontitis. J Clin Periodontol. 2017;44(6):603-11.
- Ranjbar-Mohammadi M, et al. Electrospinning of PLGA/gum tragacanth nanofibers containing tetracycline hydrochloride for periodontal regeneration. Mater Sci Eng C. 2016;58:521-31.
- Vargas-Reus MA, et al. Antimicrobial activity of nanoparticulate metal oxides against peri-implantitis pathogens. Int J Antimicrob Agents. 2012;40(2):135-9.
- Allaker RP, Memarzadeh K. Nanoparticles and the control of oral infections. Int J Antimicrob Agents. 2014;43(2):95-104.
- Roduner E. Size matters: why nanomaterials are different. Chem Soc Rev. 2006;35(7):583-92.
- Wang L, Hu C, Shao L. The antimicrobial activity of nanoparticles: present situation and prospects for the future. Int J Nanomedicine. 2017;12:1227-49.
- Franco D, et al. Metal-based nanoparticles: antibacterial mechanisms and biomedical application. Microorganisms. 2022;10(9):1778.
- Yang X, et al. Pharmaceutical intermediate-modified gold nanoparticles: against multidrug-resistant bacteria and wound-healing application via an electrospun scaffold. ACS Nano. 2017;11(6):5737-45.
- Organization, W.H., Antibacterial agents in clinical development: an analysis of the antibacterial clinical development pipeline, including tuberculosis. 2017, World Health Organization.
- Sánchez-López E, et al. Metal-based nanoparticles as antimicrobial agents: an overview. Nanomaterials. 2020;10(2):292.
- Shiva Manjunath RG. Anju Rana, Nanotechnology in periodontal management. J Adv Oral Res. 2015;6(1):1-8.
- Kırmusaoğlu, S., Bacterial pathogenesis and antibacterial control. 2018: BoD-Books on Demand.
- Priyadarsini S, Mukherjee S, Mishra M. Nanoparticles used in dentistry: a review. J Oral Biol Craniofac Res. 2018;8(1):58-67.
- Dizaj SM, et al. Antimicrobial activity of the metals and metal oxide nanoparticles. Mater Sci Eng C. 2014;44:278-84.
- Zhang S, et al. Antimicrobial properties of metal nanoparticles and their oxide materials and their applications in oral biology. J Nanomat. 2022. https://doi.org/10.1155/2022/2063265.
- Steckiewicz KP, et al. Silver nanoparticles as chlorhexidine and metronidazole drug delivery platforms: their potential use in treating periodontitis. Int J Nanomed. 2022. https://doi.org/10.2147/IJN.S339046.
- Ni C, et al. Gold nanoparticles modulate the crosstalk between macrophages and periodontal ligament cells for periodontitis treatment. Biomaterials. 2019;206:115-32.
- Bahrami R, et al. Anti-biofilm and bystander effects of antimicrobial photo-sonodynamic therapy against polymicrobial periopathogenic biofilms formed on coated orthodontic mini-screws with zinc oxide nanoparticles. Photodiag Photodyn Ther. 2023. https://doi.org/10. 1016/j.pdpdt.2023.103288.
- Kim D-H, et al. Titanium dioxide nanoparticles induce COX-2 expression through ROS generation in human periodontal ligament cells. J Toxicol Sci. 2019;44(5):335-45.
- Fritz, S.R., et al. Superparamagnetic nanoparticles for the treatment of periodontal disease. in Colloidal Nanoparticles for Biomedical Applications XVIII. 2023. SPIE.
- Sathiyaraj S, et al. Biosynthesis, characterization, and antibacterial activity of gold nanoparticles. J Infect Public Health. 2021;14(12):1842-7.
- Herizchi R, et al. Current methods for synthesis of gold nanoparticles. Artif Cells Nanomed Biotechnol. 2016;44(2):596-602.
- Yin IX, et al. The antibacterial mechanism of silver nanoparticles and its application in dentistry. International J Nanomed. 2020. https:// doi.org/10.2147/IJN.S246764.
- Nguyen NPU, et al. Synthesis of silver nanoparticles: from conventional to ‘modern’methods—a review. Processes. 2023;11(9):2617.
- Alangari A, et al. Iron oxide nanoparticles: preparation, characterization, and assessment of antimicrobial and anticancer activity. Adsorpt Sci Technol. 2022;2022:1-9.
- Abdulsada FM, et al. Evaluation of the antibacterial properties of iron oxide, polyethylene glycol, and gentamicin conjugated nanoparticles against some multidrug-resistant bacteria. J Funct Biomat. 2022;13(3):138.
- Rajeshkumar S, et al. Antibacterial and antioxidant potential of biosynthesized copper nanoparticles mediated through Cissus arnotiana plant extract. J Photochem Photobiol, B. 2019;197: 111531.
- Saran M, et al. Green synthesis and characterisation of CuNPs: insights into their potential bioactivity. IET Nanobiotechnol. 2018;12(3):357-64.
- Porta M , et al. Titanium oxide nanoparticle dispersions in a liquid monomer and solid polymer resins prepared by sputtering. New J Chem. 2016;40(11):9337-43.
- de Dicastillo, C.L., et al., Antimicrobial effect of titanium dioxide nanoparticles. Antimicrobial Resistance-A One Health Perspective, 2020.
- Sirelkhatim A, et al. Review on zinc oxide nanoparticles: antibacterial activity and toxicity mechanism. Nano-micro letters. 2015;7:219-42.
- Bulcha B, et al. Synthesis of zinc oxide nanoparticles by hydrothermal methods and spectroscopic investigation of ultraviolet radiation protective properties. J Nanomater. 2021;2021:1-10.
- Mustapha T, et al. A review on plants and microorganisms mediated synthesis of silver nanoparticles, role of plants metabolites and applications. Int J Environ Res Public Health. 2022;19(2):674.
- Matussin S , et al. Plant-extract-mediated SnO 2 nanoparticles: synthesis and applications. ACS Sustain Chem Eng. 2020;8(8):3040-54.
- Brar KK, et al. Green route for recycling of low-cost waste resources for the biosynthesis of nanoparticles (NPs) and nanomaterials (NMs)-a review. Environ Res. 2022;207: 112202.
- Khalil M, et al. Antibacterial activity of Salvadora persica against oral pathogenic bacterial isolates. Niger J Clin Pract. 2019;22(10):1378-87.
- Moghadam ET, et al. Current herbal medicine as an alternative treatment in dentistry: in vitro, in vivo and clinical studies. Eur J Pharmacol. 2020;889: 173665.
- Wei Y, et al. Pyroptosis-induced inflammation and tissue damage. J Mol Biol. 2022;434(4): 167301.
- Elsilk SE, et al. Streptomyces rochei MS-37 as a novel marine actinobacterium for green biosynthesis of silver nanoparticles and their biomedical applications. Molecules. 2022;27(21):7296.
- Achudhan D , et al. The antibacterial, antibiofilm, antifogging and mosquitocidal activities of titanium dioxide (TiO2) nanoparticles green-synthesized using multiple plants extracts. J Environ Chem Eng. 2020;8(6): 104521.
- Fernández-Arias M , et al. Copper nanoparticles obtained by laser ablation in liquids as bactericidal agent for dental applications. Appl Surf Sci. 2020;507: 145032.
- Rajeshkumar S, et al. Anticariogenic activity of fresh aloe vera gel mediated copper oxide nanoparticles. Indian J Public Health Res Devel. 2019. https://doi.org/10.5958/0976-5506.2019.04158.5.
- Yazdanian M, et al. The potential application of green-synthesized metal nanoparticles in dentistry: a comprehensive review. Bioinorg Chem Appl. 2022. https://doi.org/10.1155/2022/2311910.
- Matar GH, Andac M. Green synthesis of iron oxide nanoparticles using brown Egyptian propolis extract for evaluation of their antibacterial activity and degradation of dyes. Inorg Chem Commun. 2023. https:// doi.org/10.1016/j.inoche.2023.110889.
- Fuloria NK, et al. Response of green synthesized drug blended silver nanoparticles against periodontal disease triggering pathogenic microbiota. J Appl Biol Biotechnol. 2019;7(4):46-56.
- Rajkumari J, et al. Facile green synthesis of baicalein fabricated gold nanoparticles and their antibiofilm activity against Pseudomonas aeruginosa PAO1. Microb Pathog. 2017;107:261-9.
- Anbuvannan
, et al. Anisochilus carnosus leaf extract mediated synthesis of zinc oxide nanoparticles for antibacterial and photocatalytic activities. Mater Sci Semicond Proc. 2015;39:621-8. - Ambika S, Sundrarajan M. Antibacterial behaviour of Vitex negundo extract assisted ZnO nanoparticles against pathogenic bacteria. J Photochem Photobiol, B. 2015;146:52-7.
- Baranwal A, et al. Prospects of nanostructure materials and their composites as antimicrobial agents. Front Microbiol. 2018;9:422.
- Hernandez-Delgadillo R, et al. Zerovalent bismuth nanoparticles inhibit Streptococcus mutans growth and formation of biofilm. Int J Nanomed. 2012. https://doi.org/10.2147/IJN.S29854.
- Prakash
, et al. Green synthesis of bismuth based nanoparticles and its applications-a review. Sust Chem Pharmacy. 2022;25: 100547. - Pourmortazavi SM, et al. Reducing power of Eucalyptus oleosa leaf extracts and green synthesis of gold nanoparticles using the extract. Int J Food Prop. 2017;20(5):1097-103.
- Yadi M , et al. Current developments in green synthesis of metallic nanoparticles using plant extracts: a review. Artif Cells Nanomed Biotechnol. 2018;46(sup3):336-43.
- Teimuri-Mofrad R , et al. Green synthesis of gold nanoparticles using plant extract: Mini-review. Nanochem Res. 2017;2(1):8-19.
- Bapat RA, et al. Recent advances of gold nanoparticles as biomaterial in dentistry. Int J Pharm. 2020;586: 119596.
- Bharadwaj KK, et al. Green synthesis of gold nanoparticles using plant extracts as beneficial prospect for cancer theranostics. Molecules. 2021;26(21):6389.
- Stozhko NY, et al. The effect of the antioxidant activity of plant extracts on the properties of gold nanoparticles. Nanomaterials. 2019;9(12):1655.
- Teimouri M, et al. Gold nanoparticles fabrication by plant extracts: synthesis, characterization, degradation of 4-nitrophenol from industrial wastewater, and insecticidal activity-a review. J Clean Prod. 2018;184:740-53.
- Suman T, et al. The Green synthesis of gold nanoparticles using an aqueous root extract of Morinda citrifolia L. Spectrochim Acta Part A Mol Biomol Spectrosc. 2014;118:11-6.
- Alizadeh SR, et al. Scrophularia striata extract mediated synthesis of gold nanoparticles; their antibacterial, antileishmanial, antioxidant, and photocatalytic activities. Inorg Chem Commun. 2023;156: 111138.
- Wang M, Wang L. Plant polyphenols mediated synthesis of gold nanoparticles for pain management in nursing care for dental tissue implantation applications. J Drug Delivery Sci Technol. 2020;58: 101753.
- Navya PD, et al. Assessment of antioxidant and anti-inflammatory properties of gold nanoparticles synthesized using pterocarpus santa-an in vitro study. J Popul Ther Clin Pharmacol. 2023;30(16):361-7.
- Worakitjaroenphon S, et al. Green synthesis of silver and gold nanoparticles using Oroxylum indicum plant extract for catalytic and antimicrobial activity. Biomass Conv Biorefinery. 2023. https://doi.org/10.1007/ s13399-023-04734-4.
- Emmanuel R, et al. Antimicrobial efficacy of drug blended biosynthesized colloidal gold nanoparticles from Justicia glauca against oral pathogens: a nanoantibiotic approach. Microb Pathog. 2017;113:295-302.
- Wankar S, et al. The era of green nanomaterials for sensing. In: Kulkarni S, editor., et al., Innovations in green nanoscience and nanotechnology. Boca Raton: CRC Press; 2022. p. 209-25.
- Suwan T, Khongkhunthian S, Okonogi S. Green synthesis and inhibitory effects against oral pathogens of silver nanoparticles mediated by rice extracts. Drug Discov Therap. 2018;12(4):189-96.
- Ahmed S , et al. A review on plants extract mediated synthesis of silver nanoparticles for antimicrobial applications: a green expertise. J Adv Res. 2016;7(1):17-28.
- Makvandi P, et al. Biofabricated nanostructures and their composites in regenerative medicine. ACS Appl Nano Materials. 2020;3(7):6210-38.
- Pandit
, et al. Biological agents for synthesis of nanoparticles and their applications. J King Saud University-Sci. 2022;34(3): 101869. - Emmanuel R, et al. Antimicrobial efficacy of green synthesized drug blended silver nanoparticles against dental caries and periodontal disease causing microorganisms. Mater Sci Eng, C. 2015;56:374-9.
- Sirisha P, et al. Antimicrobial effect of silver nanoparticles synthesised with Ocimum sanctum leaf extract on periodontal pathogens. J Oral Health Dent Sci. 2017;1:1-7.
- Sharma, K. and C. Chauhan, Role of magnetic nanoparticle (MNPs) in cancer treatment: a review. Materials Today: Proceedings, 2021.
- Farouk F, et al. Synthesis of magnetic iron oxide nanoparticles using pulp and seed aqueous extract of Citrullus colocynth and evaluation of their antimicrobial activity. Biotech Lett. 2020;42:231-40.
- Mane-Gavade, S., et al. Green synthesis of magnetite nanoparticles (Fe3O4 NPs) using Acacia concinna fruit extract and their antibacterial activity. in Macromolecular Symposia. 2021. Wiley Online Library.
- Mohandoss S, et al. Ulvan as a reducing agent for the green synthesis of silver nanoparticles: a novel mouthwash. Inorganics. 2023;11(1):5.
- Devi RS, et al. Free radical scavenging activity of copper nanoparticles synthesized from dried ginger. J Pharm Res Int. 2020;32(19):1-7.
- Din MI, Rehan R. Synthesis, characterization, and applications of copper nanoparticles. Anal Lett. 2017;50(1):50-62.
- Letchumanan D, et al. Plant-based biosynthesis of copper/copper oxide nanoparticles: an update on their applications in biomedicine, mechanisms, and toxicity. Biomolecules. 2021;11(4):564.
- Rafique M , et al. A review on synthesis, characterization and applications of copper nanoparticles using green method. NANO. 2017;12(04):1750043.
- Abbas AH, Fairouz NY. Characterization, biosynthesis of copper nanoparticles using ginger roots extract and investigation of its antibacterial activity. Mater Today Proc. 2022;61:908-13.
- El-Rab, S.M.G., et al., Green Synthesis of Copper Nano-Drug and Its Dental Application upon Periodontal Disease-Causing Microorganisms. 2021.
- Kaur P, Thakur R, Chaudhury A. Biogenesis of copper nanoparticles using peel extract of Punica granatum and their antimicrobial activity against opportunistic pathogens. Green Chem Lett Rev. 2016;9(1):33-8.
- Nadeem M, et al. The current trends in the green syntheses of titanium oxide nanoparticles and their applications. Green Chem Lett Rev. 2018;11(4):492-502.
- Buraso W, et al. Synthesis of TiO2 nanoparticles via a simple precipitation method and photocatalytic performance. Mater Res Express. 2018;5(11): 115003.
- Ziental D, et al. Titanium dioxide nanoparticles: prospects and applications in medicine. Nanomaterials. 2020;10(2):387.
- Manimaran K, et al. Enhanced photocatalytic degradation, antimicrobial and anticancer efficiency of mycosynthesized TiO2 nanoparticles using Pleurotus ostreatus mushroom extract: an eco-friendly approach. J Environ Chem Eng. 2023. https://doi.org/10.1016/j.jece. 2023.111512.
- Sun J, et al. Improving performance of dental resins by adding titanium dioxide nanoparticles. Dent Mater. 2011;27(10):972-82.
- Rehman K, et al. A Coronopus didymus based eco-benign synthesis of Titanium dioxide nanoparticles (TiO2 NPs) with enhanced photocatalytic and biomedical applications. Inorganic Chem Commun. 2022;137:109179.
- Xin Y, et al. A robust ROS generation nanoplatform combating periodontitis via sonodynamic/chemodynamic combination therapy. Chem Eng J. 2023;451: 138782.
- Nabi G, et al. A review on novel eco-friendly green approach to synthesis TiO 2 nanoparticles using different extracts. J Inorg Organomet Polym Mater. 2018;28:1552-64.
- Dobrucka R. Synthesis of titanium dioxide nanoparticles using Echinacea purpurea herba. Iranian J Pharm Res IJPR. 2017;16(2):756.
- Hinaz N. Green synthesis and antimicrobial activity of titanium dioxide nanoparticles with neem and tulsi extract against oral pathogens. Int J Periodontal Rehabil. 2022;3(1):17-29.
- Tahmasebi E, et al. Antimicrobial properties of green synthesized novel TiO2 nanoparticles using Iranian propolis extracts. J Basic Microbiol. 2023. https://doi.org/10.1002/jobm. 202300221.
- Anbumani
, et al. Green synthesis and antimicrobial efficacy of titanium dioxide nanoparticles using Luffa acutangula leaf extract. J King Saud University-Sci. 2022;34(3): 101896. - Król A, et al. Zinc oxide nanoparticles: synthesis, antiseptic activity and toxicity mechanism. Adv Coll Interface Sci. 2017;249:37-52.
- Kaliamurthi S , et al. The relationship between Chlorella sp. and zinc oxide nanoparticles: changes in biochemical, oxygen evolution, and lipid production ability. Proc Biochem. 2019;85:43-50.
- Abdo AM, et al. Green synthesis of Zinc Oxide Nanoparticles (ZnO-NPs) by Pseudomonas aeruginosa and their activity against pathogenic microbes and common house mosquito, Culex pipiens. Materials. 2021;14(22):6983.
- Delfani
, et al. Potent effects of green synthesized zinc nanoparticles against some cariogenic bacteria (Streptococcus mutans and Actinomyces viscosus). Global J Med Pharm Biomed Update. 2022. https://doi.org/ 10.25259/GJMPBU_17_2022. - Khan ST, Musarrat J, Al-Khedhairy AA. Countering drug resistance, infectious diseases, and sepsis using metal and metal oxides nanoparticles: current status. Colloids Surf, B. 2016;146:70-83.
- Norouzi M, et al. Recent advances on nanomaterials-based fluorimetric approaches for microRNAs detection. Mater Sci Eng, C. 2019;104: 110007.
- Yasamineh S, et al. Future Prospects of Natural Polymer-Based Drug Delivery Systems in Combating Lung Diseases. In: Natural Polymeric Materials based Drug Delivery Systems in Lung Diseases. Springer; 2023. p. 465-82.
- Norman, N.C., Chemistry of arsenic, antimony and bismuth. 1997: Springer Science & Business Media.
- Badireddy AR, Chellam S. Antibacterial and antifouling properties of lipophilic bismuth compounds. Adv Chem Res Nova Sci Publ. 2014;21:1-28.
- Shakibaie M, et al. Cytotoxic and antioxidant activity of the biogenic bismuth nanoparticles produced by Delftia sp. SFG Materials Res Bulletin. 2018;104:155-63.
- Karnan T, Samuel S. A novel bio-mimetic approach for the fabrication of Bi2O3 nanoflakes from rambutan (Nephelium lappaceum L.) peel extract and their photocatalytic activity. Ceramics Int. 2016;42(4):4779-87.
- Liu C, et al. Biomolecules-assisted synthesis of degradable bismuth nanoparticles for dual-modal imaging-guided chemo-photothermal therapy. Chem Eng J. 2020;382: 122720.
- Vega-Jiménez A, et al. Bismuth subsalicylate nanoparticles with anaerobic antibacterial activity for dental applications. Nanotechnology. 2017;28(43): 435101.
- Hafeez M , et al. Green synthesis of cobalt oxide nanoparticles for potential biological applications. Mater Res Expr. 2020;7(2): 025019.
- Hao W-J, et al. A new Co (II)-coordination complex: application values against chronic periodontitis through regulating Porphyromonas gingivalis survival genes expression. Inorganic Nano-Metal Chem. 2021;51(11):1507-11.
- Abbaszadeh H, et al. Chronic obstructive pulmonary disease and asthma: mesenchymal stem cells and their extracellular vesicles as potential therapeutic tools. Stem Cell Res Ther. 2022;13(1):1-15.
- Samuel MS, et al. A review on green synthesis of nanoparticles and their diverse biomedical and environmental applications. Catalysts. 2022;12(5):459.
- Abdelhameed RM, El-Shahat M, Emam HE. Employable metal (Ag & Pd)@ MIL-125-NH2@ cellulose acetate film for visible-light driven photocatalysis for reduction of nitro-aromatics. Carbohyd Polym. 2020;247: 116695.
- Chowdhury MA, et al. Green synthesis and characterization of zirconium nanoparticlefor dental implant applications. Heliyon. 2023. https://doi.org/10.1016/j.heliyon.2022.e12711.
- Kasthuri G, Reddy AN, Roopa PM. Application of green synthesized iron nanoparticles for enhanced antimicrobial activity of selected traditional and commonly exploited drug amoxicillin against Streptococcus mutans. Biosci, Biotechnol Res Asia. 2017;14(3):1135-41.
- Ahmadi M. Iron oxide nanoparticles for delivery purposes. In: Nanoengineered Biomaterials for Advanced Drug Delivery. Elsevier; 2020. p. 373-93.
- Porter GC, et al. AgNP/Alginate nanocomposite hydrogel for antimicrobial and antibiofilm applications. Carbohyd Polym. 2021;251: 117017.
- Mahadlek J, Charoenteeraboon J, Phaechamud T. Zinc oxide gels for periodontitis treatment. J Metal Mater Mineral. 2010;20(3):159-63.
- Ahmad W, Jaiswal KK, Soni S. Green synthesis of titanium dioxide (TiO2) nanoparticles by using Mentha arvensis leaves extract and its antimicrobial properties. Inorganic Nano-Metal Chem. 2020;50(10):1032-8.
- Anandarup G, et al. Cu and Cu-Based nanoparticles: synthesis and applications in catalysis. Chem Rev. 2016. https://doi.org/10.1021/acs. chemrev.5b00482.
- Murthy H, et al. Synthesis of green copper nanoparticles using medicinal plant hagenia abyssinica (Brace) JF. Gmel. leaf extract: antimicrobial properties. J Nanomat. 2020. https://doi.org/10.1155/2020/3924081.
- Ahana G , et al. Biogenesis and green synthesis of metal nanoparticles and their pharmacological applications. Plant Sci Today. 2023. https:// doi.org/10.14719/pst.2417.
- AlKahtani RN. The implications and applications of nanotechnology in dentistry: a review. Saudi dental J. 2018;30(2):107-16.
- Hester K, et al. Anticipatory ethics and governance (AEG): towards a future care orientation around nanotechnology. NanoEthics. 2015;9:123-36.
- Uzair B, et al. Green and cost-effective synthesis of metallic nanoparticles by algae: safe methods for translational medicine. Bioengineering. 2020;7(4):129.
- Wongpreecha J, et al. One-pot, large-scale green synthesis of silver nanoparticles-chitosan with enhanced antibacterial activity and low cytotoxicity. Carbohyd Polym. 2018;199:641-8.
- Turunc E, et al. Green synthesis of silver and palladium nanoparticles using Lithodora hispidula (Sm.) Griseb. (Boraginaceae) and application to the electrocatalytic reduction of hydrogen peroxide. Mater Chem Phys. 2017;202:310-9.
- Sana SS, Dogiparthi LK. Green synthesis of silver nanoparticles using Givotia moluccana leaf extract and evaluation of their antimicrobial activity. Mater Lett. 2018;226:47-51.
- Turakhia B, Turakhia P, Shah S. Green synthesis of zero valent iron nanoparticles from Spinacia oleracea (spinach) and its application in waste water treatment. J Adv Res Appl Sci. 2018;5(1):46-51.
- Kora AJ, Rastogi L. Catalytic degradation of anthropogenic dye pollutants using palladium nanoparticles synthesized by gum olibanum, a glucuronoarabinogalactan biopolymer. Ind Crops Prod. 2016;81:1-10.
- Pal K, Chakroborty S, Nath N. Limitations of nanomaterials insights in green chemistry sustainable route: review on novel applications. Green Proc Synt. 2022;11(1):951-64.
- Li C, et al. Gold nanoparticles promote proliferation of human periodontal ligament stem cells and have limited effects on cells differentiation. J Nanomaterials. 2016. https://doi.org/10.1155/2016/1431836.
- Hossain N, Islam MA, Chowdhury MA. Synthesis and characterization of plant extracted silver nanoparticles and advances in dental implant applications. Heliyon. 2022;8:e12313.
- Zorraquín-Peña I, et al. Glutathione-stabilized silver nanoparticles: antibacterial activity against periodontal bacteria, and cytotoxicity and inflammatory response in oral cells. Biomedicines. 2020;8(10):375.
- Franzolin MR, et al. Antimicrobial activity of silver and gold nanoparticles prepared by photoreduction process with leaves and fruit extracts of Plinia cauliflora and Punica granatum. Molecules. 2022. https://doi. org/10.3390/molecules27206860.
- Grande F, Tucci P. Titanium dioxide nanoparticles: a risk for human health? Mini Rev Med Chem. 2016;16(9):762-9.
- Shabatina TI, Vernaya Ol. Hybrid nanosystems of antibiotics with metal nanoparticles-novel antibacterial agents. Molecules. 2023. https://doi. org/10.3390/molecules28041603.
- Tri PN, et al. Antibacterial behavior of hybrid nanoparticles. In: Noble Metal-Metal Oxide Hybrid Nanoparticles. Elsevier; 2019. p. 141-55.
- Yeniyol S, et al. Antibacterial activity of As-annealed TiO2 nanotubes doped with Ag nanoparticles against periodontal pathogens. Bioinorg Chem Appl. 2014. https://doi.org/10.1155/2014/829496.
- Ibrahim L, et al. Estimation of ZnO nanoparticles effect on salivary alp activity in chronic periodontitis patients: in vitro study. Int J Adv Res Biol Sci. 2016;3(4):152-9.
- Schug H, et al. Effect of TiO2 nanoparticles and UV radiation on extracellular enzyme activity of intact heterotrophic biofilms. Environ Sci Technol. 2014;48(19):11620-8.
- Tan X , et al. Near-infrared-enhanced dual enzyme-mimicking
TiO2-x@alginate microspheres with antibactericidal and oxygeneration abilities to treat periodontitis. ACS Appl Mater Interfaces. 2022;15(1):391-406. - Nasiri K, et al. MicroRNAs function in dental stem cells as a promising biomarker and therapeutic target for dental diseases. Mol Diag Ther. 2023. https://doi.org/10.1007/s40291-023-00675-w.
- Wei F, et al. Recoverable peroxidase-like Fe3O4@ MoS2-Ag nanozyme with enhanced antibacterial ability. Chem Eng J. 2021;408: 127240.
- Zhang X, et al. Highly biosafe biomimetic stem cell membranedisguised nanovehicles for cartilage regeneration. Journal of Materials Chemistry B. 2020;8(38):8884-93.
- Guo C, et al. Engineering magnetically induced antibacterial organic/ inorganic hybrid nanoparticles for the treatment of periodontitis. Giant. 2023;13:100145.
- Wang H, et al. Branched AuAg nanoparticles coated by metal-phenolic networks for treating bacteria-induced periodontitis via photothermal antibacterial and immunotherapy. Mater Des. 2022;224: 111401.
ملاحظة الناشر
هل أنت مستعد لتقديم بحثك؟ اختر BMC واستفد من:
- تقديم سريع ومريح عبر الإنترنت
- مراجعة دقيقة من قبل باحثين ذوي خبرة في مجالك
- نشر سريع عند القبول
- دعم لبيانات البحث، بما في ذلك أنواع البيانات الكبيرة والمعقدة
- الوصول المفتوح الذهبي الذي يعزز التعاون الأوسع وزيادة الاقتباسات
- أقصى رؤية لبحثك: أكثر من 100 مليون مشاهدة للموقع سنويًا
- *المراسلة:
سامن ياسامينة
Yassaman124@gmail.com
علي جوداكي
Joudakic@gmail.com
القائمة الكاملة لمعلومات المؤلف متاحة في نهاية المقال
DOI: https://doi.org/10.1186/s12951-023-02284-5
PMID: https://pubmed.ncbi.nlm.nih.gov/38183090
Publication Date: 2024-01-05
Spotlight on therapeutic efficiency of green synthesis metals and their oxide nanoparticles in periodontitis
Abstract
Periodontitis, one of the most prevalent dental diseases, causes the loss of bone and gum tissue that hold teeth in place. Several bacteria, commonly present in clinically healthy oral cavities, may induce and perpetuate periodontitis when their concentration rises in the gingival sulcus. Antibacterial effect against various Gram-negative and Gram-positive bacteria, including pathogenic and drug-resistant ones, has been shown for several distinct transient metal and metal oxide NPs. Therefore, NPs may be used in biomedicine to treat periodontal problems and in nanotechnology to inhibit the development of microorganisms. Instead of using harmful chemicals or energyintensive machinery, biosynthesis of metal and metal oxide nanoparticles (NPs) has been suggested. To produce metal and metal oxide NPs, the ideal technique is “Green” synthesis because of its low toxicity and safety for human health and the environment. Gold NPs (AuNPs) appear to be less toxic to mammalian cells than other nanometals because their antibacterial activity is not dependent on reactive oxygen species (ROS). AgNPs also possess chemical stability, catalytic activity, and superior electrical and thermal conductivity, to name a few of their other advantageous characteristics. It was observed that zinc oxide (ZnO) NPs and copper (Cu) NPs exhibited discernible inhibitory effects against gram-positive and gram-negative bacterial strains, respectively. ZnO NPs demonstrated bactericidal activity against the microorganisms responsible for periodontitis. Medications containing magnetic NPs are highly effective against multidrug-resistant bacterial and fungal infections. The titanium dioxide (

Introduction
used for periodontitis. Pain and swelling from periodontitis may be treated with anti-inflammatory medications. These medications usually take the form of nonsteroidal anti-inflammatory medicines (NSAIDs). NSAIDs reduce inflammation and discomfort by preventing the body from making prostaglandins. Ibuprofen and aspirin are two common NSAIDs. Moreover, the use of dual medication delivery has potential for the treatment of periodontal conditions. Illustrative instances include the use of in situ forming gel (ISFG) containing doxycycline hyclate and ibuprofen, as well as the application of in situ forming matrix (ISFM) including vancomycin hydrochloride (VH) and borneol. An alternative methodology is the use of drug-eluting implants, which are inserted directly into the periodontal pocket [5, 6] (Fig. 1).

the antibacterial agent in the periodontal pocket. Longterm transport of antibacterial agents to the area around the pocket’s opening may then stop pocket recolonization from the mouth by stopping marginal plaque [9, 10]. The development of biofilm by oral pathogens presents a significant obstacle in developing antibiotic resistance. To prevent or eliminate microbial biofilms, compounds that inhibit adherence factors and extinguish bioactive quorums can be utilized. Further research is necessary to evaluate the efficacy of quorum suppression strategies in combating periodontal pathogen biofilm formation [11].
never make it beyond the first stages of testing in the drug development process, and the success rate is low overall. However, due to rising antibiotic resistance among periodontal pathogens, the focus of periodontitis treatment has switched from killing off bacteria to reestablishing a healthy balance between the oral microbiota and the host periodontal tissue. So, what is required is a systematic medication design that is both modern and effective for the treatment of periodontitis [13] (Fig. 2). Pharmaceutical agents with diverse mechanisms of action may be prescribed to patients harboring antibacterial-resistant microorganisms, among others, due to their susceptibility to such pathogens. Furthermore, these agents may be prescribed singly or in combination to further their utility [14, 15]. After risky periodontal surgeries, patients are often given antibiotics as a preventative measure. But, in line with the current trend of human bacteria becoming more antibiotic-resistant, drug resistance has also grown in people with gum disease over the past few years. Antibiotics don’t work as well on these germs because of the particular environment in the gum area and the way biofilm forms. For gum diseases, we need new ways to treat them [11, 16].

results demonstrated a comparatively high correlation index ( 0.995 for MMP-8 detection, 0.976 for IL-1
[42]. Biological entities, including plant extracts, bacteria, and algae, have been included in the biosynthesis of metal and metal oxide NPs. Compared to algae-, fungi-, and bacteria-based produced NPs, plant-based preparation is a fast, quick, and simple procedure for synthesizing NPs at a large scale. Synthesis of functional nanodevices, production of new medications, and personification of drug delivery processes are only some of the many pharmacological uses for the created green nanomaterials (NMs) [43]. Environmentally friendly “green chemistry” principles have been used in biological production (using organisms like plants, bacteria, fungus, algae, and actinomycetes) of metal or metal oxide NPs [44]. One greener alternative to creating NPs with the appropriate qualities is to synthesize them by living organisms. For biological synthesis, both unicellular and multicellular organisms may respond [45]. Plant-mediated NPs have the benefit of having kinetics that are noticeably greater than those of other biological processes. Due to exceptional phytochemicals, several plant parts, including the leaf, stem, seed, fruit, and roots, have been employed extensively for the production of NPs. To create NPs, certain plant sections are first cleaned with tap or distilled water, then the corresponding salt solutions containing the desired NPs are added, filtered, and squeezed out. The solution’s color shifts, indicating the synthesis of NPs, which we can readily separate [46, 47]. In recent decades, the biosynthesis of metal and metal oxide NPs has emerged as a promising study area. To get a procedure that is less harmful to the environment, there has been an increase in the study of green chemistry and the use of green approaches for the synthesis of NPs [47]. Specifically, this article provides a synopsis of green NPs, including
Biological components for “green” synthesis
advantages of using a green method to generate NPs are that it is cheap and simple to implement. However, the tiny size and shape achieved and the unique characteristics of the biological substrates employed mean that green NP production may enhance the characteristics of these NMs [58]. Utilizing a variety of spectroscopic techniques, AgNPs were produced by the synthesis of aqueous root extracts of Rheum palmatum. Hexagonal and spherical NPs were discovered. Staphylococcus aureus (S. aureus) and
been thoroughly investigated against Gram-negative (
Bacterial
cecembensis (B. cecembensis) have been used extensively in the synthesis of bioreduced AgNPs with varied size/ shape morphologies. Shewanella oneidensis, Corynebacterium Spp. SH09, Aeromonas Spp. SH10, Phaeocystis antarctica, Pseudomonas proteolytica, Enterobacter cloacae, Geobacter Spp.., and Arthrobacter gangotriensis. Similar to how many different bacteria strains have been employed for the synthesis of AuNPs (including Bacillus megaterium D01, Desulfovibrio desulfuricans, E. coli DH5a, Bacillus subtilis (B. subtilis) 168, Shewanella alga, Rhodopseudomonas capsulate, and Plectonema boryanum UTEX 485) [50].
Abstract
Fungi Monodispersed NPs with well-defined morphologies may also be efficiently produced by the fungal-mediated biosynthesis of metal/metal oxide NPs. Because they contain many different enzymes inside their cells, they are superior biological agents for making NPs out of metals and metal oxides. More NPs can be synthesized by competent fungi than by bacteria. The abundance of enzymes, proteins, and reducing components on the cell surfaces of fungi is another reason they excel over other species. Metal NPs are thought to arise by enzymatic reduction (reductase) in the fungal cell wall or cytoplasm.
Abstract
Algae Microalgae, often known as algae, are microorganisms in aquatic environments that perform photosynthesis. It has been shown that algae, like other microorganisms, play a crucial role in the biological production of NMs and the buildup of other heavy metals. On occasion, algae are used in producing ZnO NPs and the industrial production of AU and AgNPs. Microalgae are well-known for their ability to transform potentially toxic metals into their nontoxic analogs. Phaeodactylum tricornutum is a kind of microalgae, and its supernatant has recently been employed in the biosynthesis of Ti NPs with a mean particle diameter of 49.7 nm . Because of their cytotoxic, antibacterial, antistatic, and biogenic activities, the NPs generated from microalgae had the potential for use in various biomedical applications. These included imaging
Yeast
Abstract
Plant cell Plants may store varying levels of heavy metals in their many tissues. Therefore, biosynthetic strategies using plant extracts have received more attention as a straightforward, productive, reasonably priced, and practically doable alternative to standard preparation processes for NP generation [76]. Among the biomolecules found in plants are those with exceptional ability to catalyze the reduction of metal salt into NPs. Plant extract-assisted synthesis was the first biosynthetic route to explore for Au and AgNPs. Various plants, including aloe vera (Aloe barbadensis Miller), Oat (Avena sativa), alfalfa (Medicago sativa), Tulsi (Osimum sanctum), Lemon (Citrus limon), Neem (Azadirachta indica), Coriander (Coriandrum sativum), Mustard (Brassica juncea) and lemon grass (Cymbopogon flexuosus), have been utilized to synthesize AgNPs and AuNPs. Other plants, including mustard (Brassica juncea), alfalfa (Medicago sativa), and sunflower (Helianthus annuus), were shown to produce NPs in vivo as well. Coriander (Coriandrum sativum), crown flower (Calotropis gigantean), Cu leaf (Acalypha indica), China rose (Hibiscus rosa-sinensis), Green Tea (Camellia sinensis), and aloe leaf broth extract (Aloe barbadensis Miller) are just some of the many plant leaf extracts that have been used to prepare ZnO NPs [46, 77-80].
Mechanism of “green” synthesis for metals and their oxide nanoparticles
Microorganism-based mechanism
shown to be responsible for B. licheniformis’ bioreduction of AgNPs by Kalishwaralal et al. [82]. Although microorganisms produce metal salt ions and metallic NPs, the bioreduction mechanisms involved in these processes are not well understood [81, 82] (Fig. 3).
Plant leaf extract-based mechanism

proteins, and carotenoids. The phytochemical components mentioned above contribute to the reduction and stabilization of metal ions throughout the environmentally friendly NP synthesis process [88-91].
Metal nanoparticles in periodontitis

mixed proof that these agents help with most periodontal diseases, and antimicrobials can also hurt. Some problems with systemic antimicrobials are allergic responses, the risk of getting another infection, toxicity, drug combinations, patient cooperation, and, most importantly, germs becoming resistant to the drug. For most periodontal diseases, mechanical cleaning methods, such as draining pus from acute gum abscesses, should be the first choice. Systemic antimicrobials should only be used with mechanical cleaning methods. They should never be used by people with chronic diseases because they can make abscesses more likely to form. When there is an acute disease that is hard to debride or drain pus from, or when there is local spread or systemic upset, additional systemic antimicrobials may be thought of. When someone has a chronic periodontal disease that starts early or gets worse quickly, or when mechanical treatments have failed, and surgery is not a choice, they should think about adding antimicrobials to their treatment plan. If you don’t brush your teeth or smoke tobacco, you shouldn’t use antimicrobials [93].
frequent inflammatory degenerative ailments affecting people. Diseases of the gums and supporting structures of the teeth, caused by plaque particles that form on the hard root surface next to the soft tissues of the supporting periodontium, can be superficial (gingivitis) or systemic (periodontitis), destroying the alveolar bone that anchors the teeth in place and the periodontal ligament. Teeth may become loose or fall out if they experience such attachment loss and the subsequent creation of periodontal pockets. Primary periodontal infections include Porphyromonas gingivalis, Prevotella intermedia, and Aggregatibacter actinomycetemcomitans [96, 97].
NPs have been subject to a comprehensive investigation of various biological applications. Metal-based NPs have shown efficacy against priority pathogens, in addition to their decreased size and selectivity for bacteria, as stated by the World Health Organization (WHO) [102]. Not only is it more challenging for bacteria to acquire resistance to metal-based NPs because they do not bind to a particular receptor in the bacterial cell, but the range of their antibacterial action is also expanded. Therefore, most research on the effectiveness of metal-based NPs has shown encouraging results in both Gram-positive and Gram-negative bacteria. Researchers will find that although other NPs often utilized in antibiotherapy (such as
as effective anti-inflammatory and antibacterial agents [104].
| Metal NPs | Antibacterial mechanism | Common production method | Refs |
| AuNPs | By causing the formation of perforations in the bacterial cell wall, AuNPs exert their antibacterial effect, manifesting in cell demise and the subsequent loss of cellular contents | One of the most well-known methods for the synthesis of AuNPs, the Turkevich method, was developed by Turkevich in 1951 and relies on the reduction of HAuCl 4 by citrate in water | [114, 115] |
| AgNPs | AgNPs are capable of penetrating bacterial cell walls, thereby altering the configuration of cell membranes and potentially inducing cellular demise. By releasing silver ions, they are capable of increasing the permeability of cell membranes, generating reactive oxygen species (ROS), and interfering with the replication of deoxyribonucleic acid | The categorization of current synthesis methods can be delineated into two distinct types: bottom-up and top-down. The top-down approach involves the utilization of diverse physical forces-including mechanical influences (e.g., crushing, grinding, and milling); electrical forces (e.g., electrical arc discharge or laser ablation); and thermal forces (e.g., vapor condensation-to generate metal NPs from bulk materials. The bottom-up approach involves the nucleation and proliferation of molecular components to form complex aggregates. Chemical and biological synthesis are prevalent bottom-up approaches to produce NPs from precursor salts | [116, 117] |
| MNPs | The antibacterial mechanisms exhibited by magnetic nanoparticles (MNPs) are believed to result from two factors: Activation of ROS on the surfaces of the NPs induces oxidative stress within the bacterial cell, leading to cellular demise | The process of producing Fe2O3-NPs was carried out via hydrothermal means. The procedure entailed the dissolution of 0.85 mg of FeCl 3.6 H 2 O in 100 mL of doubledistilled water within a 250 mL round-bottom flask. This was followed by 45 min of magnetic agitation at
|
[118, 119] |
| CuNPs | CuNPs are exceptionally reactive by their high surface area to volume ratio, which enables them to interact profusely with the cell membrane, thereby causing cell mortality by damaging cellular genetic materials | The present inquiry pertains to the environmentally friendly production of CuNPs using two distinct techniques: (I) a time-based approach and (II) thermal treatment of an aqueous solution. The plant extract in question is Moringa oleifera Lam | [120, 121] |
| TiONPs | The antimicrobial action of
|
Molten matrix sputtering (MMS) produced a transparent resin comprising titanium oxide NPs. To acquire homogenous dispersions of NPs, the low vapor pressure of the liquid pentaerythritol ethoxylate (PEEL) substrate enables the direct application of this vacuum technique to liquid PEEL while agitating | [122, 123] |
| ZnO NPs | The antibacterial properties of ZnO NPs are appealing, which can be attributed to their increased specific surface area and improved particle surface reactivity resulting from the reduced particle size | ZnO NPs were synthesized by a hydrothermal process employing sodium hydroxide and Zn nitrate hex-hydrate | [124, 125] |

activated. These proteins may sit before NF-кB. Giving PDL cells the MEK1/2 inhibitor U0126 and the PI3K inhibitor LY294002 greatly reduced the activity of NF-кВ and the production of COX-2 when
Green synthesis of metals and their oxide nanoparticles in periodontitis
the development of periodontitis [129]. The fundamental goal of periodontal therapy is to eliminate the bacterial biofilm and reduce inflammation so that the illness may be controlled effectively. In the past, several different antimicrobial drugs were used to treat periodontal disease. Therefore, it is essential to look into a wide range of agents with cutting-edge physicochemical properties, with a particular focus on antibacterial agents that have novel and distinctive qualities that might be used as a replacement for periodontal therapies [130, 131]. NMs as therapeutics have recently emerged as an innovative approach to halting the progression of many devastating illnesses. Extreme reaction monitoring has been used by researchers to differentiate between biochemical reduction of NPs and standard manufacturing methods. The cytotoxicity of green NPs was much lower than that of chemical NPs, indicating that they are safe for usage in a variety of biomedical settings [132] (Table 2) (Fig. 5).
Abstract
AuNPs Many different physical and chemical techniques have been explored and/or used in producing AuNPs. Many recent articles have focused on the synthesis and characterization of AuNPs because of their distinctive physicochemical properties and extensive range of applications. AuNPs produced through physical means (such as laser ablation) have a narrow particle size distribution, but the yield is poor, and the cost is high. Chemical methods (such as using sodium borohydride) exist for producing AuNPs. Alternative green methods were developed because of the harmful effects of organic solvents and reducing reagents used in the chemical manufacturing of AuNPs. NMs known as AuNPs may be easily manufactured by a single-step green chemical procedure. They are well-known for being non-toxic and biocompatible. Due to their properties, AuNPs are a promising candidate for usage in the biological sciences [136, 145, 146]. Plants known as “hyperaccumulators” can scavenge metals from the environment. A portion of the biomass in an alfalfa plant’s leaves and stems may contain atoms of Au. For efficient and rapid extracellular production of
| Metal and metal oxide nanoparticles | Effects | Green synthesis method | Refs |
|
|
The antibacterial and antibiofilm qualities of
|
|
[133] |
| CuNPs | CuNPs are a promising option for usage as an anti-peri-implantation agent in dental implants due to their bactericidal effect against Aggregatibacter actinomycetemcomitans (one of the primary pathogens responsible for generating localized aggressive periodontitis) and their cytocompatibility | One of the most common approaches for producing Cu and CuO NPs involves combining a known concentration of the plant extract with an available precursor concentration, heating the combination to a specified temperature, and continuously stirring the mixture at a predetermined duration. For example, these extracts have come from plants including Celastrus paniculatus, Cardiospermum halicacabum, and Zingiber officinale | [134-136] |
| IONPs | The results showed that the synthesized BEP-IONPs exhibit potent antibacterial action, with a high MB dye adsorption capacity of up to
|
Researchers in their study, Brown Egyptian Propolis (BEP) extract was used in the synthesis of IONPs because of its reducing and stabilizing properties | [137] |
| AgNPs | The current work finds that biogenic AgNPs manufactured using EFLAE have a high potential for inhibition against microbiota pathogens that generate periodontitis, including E. Coli, B. cereus, S. pyogenes, and P. aeruginosa | Investigators in the study made biosynthetic AgNPs using an aqueous extract from Erythrina fusca leaves (EFLAE) | [138] |
| AuNPs | BCL-AuNPs at a sub-MIC concentration demonstrated noteworthy antibiofilm efficacy against P. aeruginosa PAO1. A decrease in biofilm formation of
|
The spherical AuNPs were synthesized using the phytocompound baicalein as a capping and reducing agent, as demonstrated by the researchers | [139] |
| ZnO NPs | The antibacterial activity of ZnO NPs-containing composite resin on S. mutans was much greater than that of AgNPs-containing composite resin | ZnO NPs may be synthesized from phenols and flavones, two plant extracts | [136, 140-142] |
|
|
Oral antiseptics have been shown to exhibit comparable effects to these NPs in the conducted experiments. The introduction of zerovalent BiNPs halted
|
|
[143, 144] |
As a result of its anti-inflammatory, antipyretic, and anti-hyperglycemic characteristics, Pterocarpus santa, also known as red sandal, yerra chandanam, or lal chandan, is one of the world’s most costly plants. The purpose of this research was to create a synthetic version of red sandal AuNPs and to define and evaluate their antioxidant and anti-inflammatory activities; color change and UV-visible spectroscopy were used to track AuNPs’ formation, and transmission electron microscopy (TEM) examination confirmed that the Pterocarpus santamediated AuNPs are of spherical shape and measure between 2 and 35 nm in size. At a concentration of
swarming behaviors were significantly impeded when BCL-AuNPs were present. The impact of BCL-AuNPs on the surface topography and architecture of P. aeruginosa biofilm was further investigated using light microscopy and CLSM. Therefore, the results of the investigation raise the possibility of using BCL-AuNPs in the creation of new treatments for the avoidance and treatment of chronic illnesses caused by biofilms [139].
AgNPs
centrifugation processes at a speed of
23.2 nm by TEM, 59.4 nm by DLS), and protected by capping agents. The MICs of the AgNPs exhibiting antibacterial activity varied from 8 to
Different research discovered that using the leaf extract of Justicia glauca enhanced the GS of AgNPs. The watersoluble organics in the leaf extract are primarily responsible for converting
(A. naeslundii, C. albicans, F. nucleatum, S. aureus, S. epidermidis, S. mutans, S. oralis, and V. dispar). Medically and dentally relevant infections show species-specific MICs and minimum inhibitory concentrations (MMCs) for the extracts of S. cumini seed and flower. The bacteriostatic and fungistatic effects of AgNPs-HEScSeed and AgNPs-HEScFlower may be achieved at much lower concentrations than those of plant extracts due to their unique forms, sizes, chemical components, stability, and electronegativity (capping). The growth of S. aureus (diameter of the zone of inhibition:
S. rochei MS-37 may be the first marine actinobacterium to have its performance studied about the GS of AgNPs and its potential as antibacterial, anti-inflammatory, anti-biofilm, and antioxidant options for decreasing membrane-associated dental illnesses. In this research, the novel marine actinobacterial strain S. rochei MS-37 was employed to biosynthesize AgNPs with potential medicinal uses. The AgNPs had a peak at 429 nm in surface plasmon resonance spectroscopy. The AgNPs were spherical, very stable ( 26 mV ), extremely small (average 23.2 nm by TEM, 59.4 nm by Dynamic Light Scattering (DLS)), and protected by capping agents. AgNPs with promising antibacterial activity have MICs between 8 and
adherence and bacterial penetration across guided tissue regeneration membranes were performed using periodontal pathogens. The results indicated that AgNPs could help prevent membrane-associated infection. Additionally, it was shown that the AgNPs exhibited a substantial anti-denaturation effect and a high capacity for scavenging nitric oxide free radicals when their anti-inflammatory function was evaluated using these methods. The IC50 values for the AgNPs were
IONPs
one with INP and amoxicillin, and one with only the plant extract to examine the effects of different treatment combinations on S. mutans. The combination of INP with an antimicrobial agent increases the antimicrobial agent’s effectiveness. Both the cold seed extract (S-MNP) and the pulp extract (P-MNP) MNPs were round after they were manufactured. The S-MNP had a narrower size range of
zone of inhibition of 23.5 mm for gram-negative bacteria P. aeruginosa. With a constant rate of
CuNPs
byproducts [170]. One of the most common approaches for producing Cu and CuO NPs involves combining a known concentration of the plant extract with an available precursor concentration, heating the combination to a specified temperature, and continuously stirring the mixture at a predetermined duration. Due to their exceptional physical properties, CuNPs are used in antibiotics. Due to their disinfecting properties and matrix stability, they cover medical equipment including heat transfer systems, antimicrobial materials, superstrong materials, sensors, and catalysts [171, 172]. Plant extracts have been used in the synthesis of CuNP. These extracts have come from plants including Celastrus paniculatus, Cardiospermum halicacabum, Zingiber officinale, Eryngium caucasicum, Plectranthus amboinicus, Azadirachta indica, Punica granatum, Eclipta prostrata, Citrus medica Linn., and Madhuca longifolia. The release of ions is not the most critical factor in the bactericidal action of CuNPs, unlike Ag. The oxidation state, size, and crystalline structure of the NPs are all essential factors. CuNPs are a promising option for usage as an anti-peri-implantation agent in dental implants due to their bactericidal effect against Aggregatibacter actinomycetemcomitans (one of the primary pathogens responsible for generating localized aggressive periodontitis) and their cytocompatibility. Aloe vera-derived CuO NPs have been shown to have potent anti-cariogenic effects and have found widespread usage in the dentistry field [134-136]. Hawthorn fruit ethanol and water extracts were used to make Ag and CuNPs. Particle size distribution was investigated as a function of solution pH , contact duration, temperature, metal ion precursor, and hawthorn extract type. AgNPs and CuNPs were synthesized with a monodisperse size distribution and a stable average size of 60 nm and 200 nm , respectively. Extracts were analyzed for their total phenolic content and anthocyanin content. In this study, hawthorn extract was used as a stabilizer and reductant to create a green process for preparing silver and CuNPs. There have been reports of reducing Ag and Cu ions using ethanol extract from dried hawthorn fruit and water. At relatively low concentrations (below
periodontitis. Then, utilizing morphological/biochemical analysis and 16S-rRNA approaches, the antibacterial activities of CME-CuNPs were evaluated against oral microorganisms (M. luteus, B. subtilis, and P. aerioginosa) that cause periodontal disease. After the CME-CuNPs were described, the development of stable CME-CuNPs was indicated by the peak discovered at 577 nm using a UV-Vis spectrometer. Additionally, the effect of elliptical and spherical monodispersed CME-CuNPs with diameters ranging from 11.3 to 22.4 nm was demonstrated by the data. According to the FTIR study, the CME may include Ras, which contributed to Cu reduction and the synthesis of CME-CuNP. Additionally, the CME-CuNPs demonstrated strong antibacterial effectiveness against several isolates, surpassing the documented values in the literature. Oral bacteria were tested for their susceptibility to CME-CuNPs and the synergistic solution of clindamycin with CME-CuNPs. The solution’s ability to inhibit bacterial growth was remarkable. The MIC, MBC, and fractional inhibitory concentration (FIC) of CME-CuNPs with clindamycin against the chosen periodontal diseasecausing microbes were found to be between 2.6 and
was to create antibacterial nano Cu using an herbal formulation of CME as an RA against microorganisms that cause infectious diseases of the periodontal region, including gram-negative

and C. albicans. This work shows that
against the microorganisms mentioned above [186]. In this work, investigators investigated the antibacterial activity of
ZnO NPs
was utilized to biosynthesize ZnO -NPs in research. In this research, spherical ZnO-NPs with a crystalline structure and a maximum SPR (surface plasmon resonance) of 380 nm were effectively generated. The examination of the data revealed that the concentration affected these bioactivities. The
Other NPs
approach to manufacturing metal NPs. These methods employ biological entities such as bacteria, fungi, viruses, yeast, actinomycetes, plant extracts, and more. Biosynthesized
Future prospective
NPs can be produced chemically or via GS; however, the chemical synthesis of NPs is labor-intensive, costly, and energy-intensive. Due to their facile functionalization, AuNPs have the potential to serve as antimicrobial agent carriers. Nevertheless, implementing physical or chemical processes to generate NPs is prohibitively expensive, labor-intensive, and detrimental to ecosystems. Conversely, the GS of NPs is more economical and consumes less energy [206]. The harmful side effects of organic solvents and the toxicity of reducing reagents used in the chemical production of AuNPs prompted the search for environmentally friendly alternatives. AuNPs, a type of NMs, are readily produced via a onestep green chemistry procedure that is favorable to the environment. Their non-toxicity and biocompatibility are renowned worldwide. AuNPs are up-and-coming candidates for biological applications due to their unique properties. The diagnostic utility of AuNPs in periodontal
disease is substantial owing to their distinctive and crucial optical characteristics [145, 146]. Dental caries and periodontal disease-causing microorganisms, including S. mutans, S. aureus, L. acidophilus, M. luteus, B. subtilis, E. coli, P. aeruginosa, C. albicans, were used to assess the antimicrobial properties of green synthesized AgNPs and drug-blended AgNPs. The AgNPs, in combination with drug-blended AgNPs, exhibit noteworthy antibacterial and antifungal properties. The MIC values of AgNPs, as determined against specific microorganisms that cause dental caries and periodontal disease, are observable within the concentration range of
effects on human health and ecosystems [214]. Any dental or medical nanoproduct that has completed its research and development phase is subjected to a rigorous preclinical in vitro testing protocol to examine its mechanical, immunological, and toxicological qualities. Guidelines for reviewing the dangers of NMs have been established by several organizations, including the National Institute of Occupational Safety and Health and the US Environmental Protection Agency. Legislative challenges are persistent when creating a multidisciplinary regulatory framework to evaluate and manage nanotechnology and address ethical issues that fall into the four areas of metaphysics, equality, privacy, and security. As a result, it is imperative that participants comprehend the degree of danger linked to their exposure to novel substances and information and that each clinical trial establish safety monitoring boards tasked with diligently monitoring and documenting any earlyonset adverse effects, identifying irregularities in data management, and safeguarding the welfare and security of test subjects. The inherent unpredictability of NMs presents dentists with an ethical quandary when confronted with an extensive selection of materials, some of which have established clinical utility through short-term clinical studies (e.g., nano filled composite resins). In contrast, others, including hybrid or micro filled composite resins, are conceptually appealing but lack such support. The conventional method of making ethical decisions, which primarily relies on utilitarianism, is not up to speed with the rapid advancements in nanotechnology and its unpredictable future. Because of this, a deeper comprehension of the science is needed, along with risk/benefit assessments and ethical concerns at every stage of development. This resulted in the concept of anticipatory ethics and governance, created to use ethical analysis models to identify and address ethical and societal implications when the technology is still in its early stages. This allows for easy modification and guidance of the technology towards an ethically acceptable outcome [215, 216]. Consequently, the decision to utilize NMs is contingent upon the specific clinical situation and the tooth that requires restoration, with careful consideration given to aesthetic requirements, loading, and potential hazards like parafunctional habits. Ongoing research aims to enhance the performance of current NMs. Possible future developments include nano-biosensing devices that are more cost-effective and efficient, capable of accurately diagnosing oral cancer. Additionally, novel oral drug delivery systems are being developed to impede biofilm formation and decrease the prevalence of periodontal disease and dental caries. While the scientific principles underlying nanotechnology are
captivating, their extensive clinical application is limited by the absence of long-term clinical evidence about their efficacy [215].
publications reviewed here indicates that the investigation into using metal NPs to treat periodontitis is still in its early phases. A significant portion of the studies examined in this article are technical and frequently do not include a principal expense/benefit analysis or detailed descriptions of the fundamental procedures involved in each investigation. The mechanisms underlying the cellular uptake of metal NPs and their antibacterial properties in treating periodontitis require additional research. It is important to note that most site-specific transfer mechanisms perform admirably in vitro but inadequately in vivo. Thus, research for periodontitis therapy in vivo could benefit this investigation [31]. Although living sustainably is a desirable goal, there are several potential drawbacks to green technology and processes, including high implementation costs, ignorance, and the absence of substitute chemicals or raw materials. Although there are many benefits to green NMs synthesis, there are drawbacks. These include problems with raw material selection, reaction conditions, product quality control, and application. These elements challenge the creation of environmentally friendly NMs for production and widespread use. Researchers found that various easily found plants in the area may be used to make green NPs. These studies indicate that although full use of native plants is feasible, significant global NMs production remains challenging. Utilizing raw components in actual manufacturing may be difficult due to time constraints. Throughout the blossoming stage, the cotton leaf should gather the ingredients required to make Ag NPs [64, 219, 220]. Furthermore, the ideal temperature for several environmentally friendly synthetic processes is high, and the synthesis process takes a long time, requiring a significant amount of energy that might be harmful to the environment. Even with ecologically friendly starting materials, the procedure doesn’t always follow sustainable synthesis guidelines. The NPs generated by distinct extracts exhibit significant variation in form and size, with the measured quality being inadequate. Current sources state that because of the wide variations in particle diameter, green technology is inappropriate for large-scale production, and managing particle size becomes a significant difficulty throughout the manufacturing process. Only a recent study was able to show how plant extracts affected synthesis, and even then, the precise molecular processes involved remain mysterious. The NPs produced by different quotes differ significantly in size and shape, and the properties found are insufficient. Current sources indicate significant differences in particle size, which renders green technology inappropriate for large-scale production and presents substantial challenges for controlling particle size throughout manufacture [221-223]. In addition, several challenges, such as poor yield, irregular
particle size, complex separation procedures, periodic, local raw material accessibility, and much more, need to be overcome before sustainable NMs synthesis and its uses can be achieved. There are now many different green NM synthesis techniques and processes accessible, and more will be developed in the future [223].
Comparison of nanoparticles with each other
the cellular absorption of Ag (
According to recent research, using hybrid metal NPs in combination may increase their bactericidal efficacy [229]. Antibiotic NP hybridization might thus be a novel tactical method for combating these pathogenic microorganisms. Noble metals, like Ag NPs, may become more biologically active due to faster ionization resulting from hybridization with nano-
against Ag-doped
dental research since they are an antibacterial agent and an amalgam modifier. CuNPs, the focus of the current study, are said to be beneficial when added to dental cement, restorative materials, adhesives, resins, irrigating solutions, obturations, orthodontic archwires and brackets, implant surface coatings, and the bone regeneration process. Compared to AgNPs, CuONPs are less costly, environmentally safe, and chemically stable. CuONPs are less expensive, more ecologically friendly, and have a more stable chemical structure than AgNPs [31].
According to some research, gram-negative bacteria may have an enrichment of
suppressing the nuclear factor kappa-B signaling pathway, which regulates immunity. In vivo, repair capacity of periodontal inflammatory tissue was enhanced. This design offers novel approaches to using MPNs in immunotherapy and photothermal treatment. It provides a fresh approach to treating infectious disorders, including periodontitis [239].
Conclusion
Acknowledgements
Author contributions
Funding
Availability of data and materials
Declarations
Ethics approval and consent to participate
Consent for publication
Competing interests
Author details
Received: 29 October 2023 Accepted: 19 December 2023
References
- Holla G, Yeluri R, Munshi AK. Evaluation of minimum inhibitory and minimum bactericidal concentration of nano-silver base inorganic antimicrobial agent (Novaron
) against Streptococcus mutans. Contemp Clin Dent. 2012;3(3):288. - Chen
, et al. Advanced biomaterials and their potential applications in the treatment of periodontal disease. Crit Rev Biotechnol. 2016;36(4):760-75. - Sudiono J, et al. Bactericidal and cytotoxic effects of Erythrina fusca leaves aquadest extract. Dent J Majal Kedokt Gigi. 2013;46:9-13.
- Lu H, et al. Effect of adjunctive systemic antibiotics on microbial populations compared with scaling and root planing alone for the treatment of periodontitis: a pilot randomized clinical trial. J Periodontol. 2022;93(4):570-83.
- Lertsuphotvanit N , et al. Borneol-based antisolvent-induced in situ forming matrix for crevicular pocket delivery of vancomycin hydrochloride. Int J Pharm. 2022;617: 121603.
- Lee F-Y, et al. In vitro and in vivo investigation of drug-eluting implants for the treatment of periodontal disease. AAPS PharmSciTech. 2011;12:1110-5.
- Shaddox LM, Walker CB. Treating chronic periodontitis: current status, challenges, and future directions. Clin Cosmet Investig Dent. 2010;2:79-91.
- Graziani F, et al. Nonsurgical and surgical treatment of periodontitis: how many options for one disease? Periodontol 2000. 2017;75(1):152-88.
- Jain N, et al. Recent approaches for the treatment of periodontitis. Drug Discovery Today. 2008;13(21-22):932-43.
- Sanz I, et al. Nonsurgical treatment of periodontitis. J Evi Based Dental Pract. 2012;12(3):76-86.
- Haque MM , et al. Advances in novel therapeutic approaches for periodontal diseases. BMC Oral Health. 2022;22(1):1-23.
- Tonetti MS , Greenwell H , Kornman KS . Staging and grading of periodontitis: framework and proposal of a new classification and case definition. J Periodontol. 2018;89:S159-72.
- Wang C-T, Chen B-S. Drug discovery for periodontitis treatment based on big data mining, systems biology, and deep learning methods. SynBio. 2023;1(1):116-43.
- Gasner, N.S. and R.S. Schure, Periodontal disease, in StatPearls. 2022, StatPearls Publishing.
- Belibasakis GN , et al. Periodontal microbiology and microbial etiology of periodontal diseases: historical concepts and contemporary perspectives. Periodontol 2000. 2023. https://doi.org/10.1111/prd.12473.
- Muñoz Navarro C, et al. Analysis of the oral microbiome in a patient with cardiofaciocutaneous syndrome and severe periodontal disease: impact of systemic antibiotic therapy. Antibiotics. 2022;11(12):1754.
- Curtis DA, et al. Treatment planning considerations in the older adult with periodontal disease. Periodontol 2000. 2021;87(1):157-65.
- Shaddox LM, Walker CB. Treating chronic periodontitis: current status, challenges, and future directions. Clin Cosmetic Investi Dent. 2010. https://doi.org/10.2147/CCIDE.S7712.
- Jain P, et al. Nanotechnology interventions as a putative tool for the treatment of dental afflictions. Nanotechnol Rev. 2022;11(1):1935-46.
- Kang J, et al. Applications of nanotechnology in virus detection, tracking, and infection mechanisms. Wiley Interdiscipl Rev Nanomed Nanobiotechnol. 2021. https://doi.org/10.1002/wnan.1700.
- Sahu AK, et al. SARS-CoV-2: phylogenetic origins, pathogenesis, modes of transmission, and the potential role of nanotechnology. VirusDisease. 2021. https://doi.org/10.1007/s13337-021-00653-y.
- Assefi M, et al. A state-of-the-art review on solid lipid nanoparticles as a nanovaccines delivery system. J Drug Deliv Sci Technology. 2023. https://doi.org/10.1016/j.jddst.2023.104623.
- Jafari-Gharabaghlou D, et al. Combination of metformin and phenformin synergistically inhibits proliferation and hTERT expression in human breast cancer cells. Iran J Basic Med Sci. 2018;21(11):1167.
- Javan N, et al. Synergistic antiproliferative effects of co-nanoencapsulated curcumin and chrysin on mda-mb-231 breast cancer cells through upregulating mir-132 and mir-502c. Nutr Cancer. 2019;71(7):1201-13.
- Yasamineh S, et al. An overview on nanoparticle-based strategies to fight viral infections with a focus on COVID-19. J Nanobiotechnol. 2022;20(1):440.
- Yasamineh S , et al. A state-of-the-art review on the recent advances of niosomes as a targeted drug delivery system. Int J Pharmac. 2022. https://doi.org/10.1016/j.ijpharm.2022.121878.
- Gholizadeh O , et al. Therapeutic and diagnostic applications of nanoparticles in the management of COVID-19: a comprehensive overview. Virol J. 2022;19(1):1-22.
- Dizaj SM, et al. Antimicrobial activity of carbon-based nanoparticles. Adv Pharmac Bull. 2015;5(1):19.
- Rudramurthy GR, et al. Nanoparticles: alternatives against drug-resistant pathogenic microbes. Molecules. 2016;21(7):836.
- Safarov T, et al. An overview of nanotechnology-based treatment approaches against Helicobacter Pylori. Expert Rev Anti Infect Ther. 2019;17(10):829-40.
- Nasiri K, et al. Recent advances in metal nanoparticles to treat periodontitis. J Nanobiotechnol. 2023;21(1):283 .
- Priyadarsini S, Mukherjee S, Mishra M. Nanoparticles used in dentistry: a review. J Oral Biol Craniofacial Res. 2018;8(1):58-67.
- Chen H, et al. Nano-Based drug delivery systems for periodontal tissue regeneration. Pharmaceutics. 2022;14(10):2250.
- Oveili E, et al. The potential use of mesenchymal stem cells-derived exosomes as microRNAs delivery systems in different diseases. Cell Commun Signaling. 2023;21(1):1-26.
- Yasamineh S , et al. A state-of-the-art review on the recent advances of niosomes as a targeted drug delivery system. Int J Pharm. 2022;624: 121878.
- Basudan AM. Nanoparticle based periodontal drug delivery-a review on current trends and future perspectives. Saudi Dent J. 2022;34(8):669-80.
- Kelotte D, Melath A. Nanotechnology and periodontics. J Period Implant Sci. 2023;53(4):245-7.
- He W, et al. Upconversion nanoparticles-based lateral flow immunoassay for point-of-care diagnosis of periodontitis. Sens Actuators B Chem. 2021;334: 129673.
- Bae G , et al. Nanometric lamination of zinc oxide nanofilms with gold nanoparticles for self-perceived periodontal disease sensors. Compos B Eng. 2022;230: 109490.
- de Carvalho Bernardo WL, et al. Antimicrobial effects of silver nanoparticles and extracts of Syzygium cumini flowers and seeds: Periodontal, cariogenic and opportunistic pathogens. Arch Oral Biol. 2021;125: 105101.
- Kurhade P, Kodape S, Choudhury R. Overview on green synthesis of metallic nanoparticles. Chem Pap. 2021;75(10):5187-222.
- Salem SS, Fouda A. Green synthesis of metallic nanoparticles and their prospective biotechnological applications: an overview. Biol Trace Elem Res. 2021;199:344-70.
- Shafey AME. Green synthesis of metal and metal oxide nanoparticles from plant leaf extracts and their applications: a review. Green Proc Synt. 2020;9(1):304-39.
- Pal G, Rai P, Pandey A. Green synthesis of nanoparticles: A greener approach for a cleaner future. In: Green synthesis, characterization and applications of nanoparticles. Elsevier; 2019. p. 1-26.
- Mohanpuria P, Rana NK, Yadav SK. Biosynthesis of nanoparticles: technological concepts and future applications. J Nanopart Res. 2008;10:507-17.
- Iravani S. Green synthesis of metal nanoparticles using plants. Green Chem. 2011;13(10):2638-50.
- Bukhari A, et al. Green synthesis of metal and metal oxide nanoparticles using different plants’ parts for antimicrobial activity and anticancer activity: a review article. Coatings. 2021;11(11):1374.
- Vijayaram S, et al. Applications of green synthesized metal nanoparticles—a review. Biol Trace Element Res. 2023. https://doi.org/10.1007/ s12011-023-03645-9.
- Subbiah U, Elango S, Jayesh R. Herbals and green synthesized nanoparticles in dentistry. In: Nanobiomaterials in Clinical Dentistry. Elsevier; 2019. p. 617-46.
- Singh J, et al. ‘Green’synthesis of metals and their oxide nanoparticles: applications for environmental remediation. J Nanobiotechnol. 2018;16(1):1-24.
- Mughal B, et al. Biogenic nanoparticles: synthesis, characterisation and applications. Appl Sci. 2021;11(6):2598.
- Fanoro OT, Oluwafemi OS. Bactericidal antibacterial mechanism of plant synthesized silver, gold and bimetallic nanoparticles. Pharmaceutics. 2020;12(11):1044.
- Rai
ade , Yadav A. Biogenic nanoparticles: an introduction to what they are, how they are synthesized and their applications. In: Metal nanoparticles in microbiology. Springer; 2011. p. 1-14. - Kumar A, et al. Biogenic metallic nanoparticles: Biomedical, analytical, food preservation, and applications in other consumable products. Front Nanotechnol. 2023;5:1175149.
- Patil S, Chandrasekaran R. Biogenic nanoparticles: a comprehensive perspective in synthesis, characterization, application and its challenges. J Genetic Eng Biotechnol. 2020;18:1-23.
- Doble, M., K. Rollins, and A. Kumar, Green chemistry and engineering. 2010: Academic Press.
- Devi D, et al. Eco-friendly green synthesis approach and evaluation of environmental and biological applications of Iron oxide nanoparticles. Inorganic Chem Commun. 2023. https://doi.org/10.1016/j. inoche.2023.110700.
- Alprol AE, et al. Algal extracts for green synthesis of zinc oxide nanoparticles: promising approach for algae bioremediation. Materials. 2023;16(7):2819.
- Arokiyaraj S, et al. Green synthesis of silver nanoparticles using Rheum palmatum root extract and their antibacterial activity against Staphylococcus aureus and Pseudomonas aeruginosa. Artificial cells Nanomed Biotechnol. 2017;45(2):372-9.
- Huq MA, Akter S. Biosynthesis, characterization and antibacterial application of novel silver nanoparticles against drug resistant pathogenic Klebsiella pneumoniae and Salmonella enteritidis. Molecules. 2021;26(19):5996.
- Pillai AM, et al. Green synthesis and characterization of zinc oxide nanoparticles with antibacterial and antifungal activity. J Mol Struct. 2020;1211: 128107.
- Umaralikhan L, Jamal Mohamed Jaffar M. Green synthesis of MgO nanoparticles and it antibacterial activity. Iranian J Sci Technol Trans A Sci. 2018;42:477-85.
- Bhattarai B, Zaker Y, Bigioni TP. Green synthesis of gold and silver nanoparticles: challenges and opportunities. Current Opinion Green Sustain Chem. 2018;12:91-100.
- Ying S, et al. Green synthesis of nanoparticles: Current developments and limitations. Environ Technol Innov. 2022;26: 102336.
- Bahrulolum
, et al. Green synthesis of metal nanoparticles using microorganisms and their application in the agrifood sector. J Nanobiotechnol. 2021;19(1):1-26. - Iravani S. Bacteria in nanoparticle synthesis: current status and future prospects. Int Schol Res Notices. 2014. https://doi.org/10.1155/2014/ 359316.
- Thakkar KN, Mhatre SS, Parikh RY. Biological synthesis of metallic nanoparticles. Nanomed Nanotechnol Biol Med. 2010;6(2):257-62.
- Alsaiari NS, et al. Plant and microbial approaches as green methods for the synthesis of nanomaterials: synthesis, applications, and future perspectives. Molecules. 2023;28(1):463.
- Pavithra KG, et al. Microalgae for biofuel production and removal of heavy metals: a review. Environ Chem Lett. 2020;18:1905-23.
- Agarwal H, Kumar SV, Rajeshkumar S. A review on green synthesis of zinc oxide nanoparticles-an eco-friendly approach. Resource-Efficient Technol. 2017;3(4):406-13.
- Aldayel MF, AI Kuwayti MA, El Semary NA. Investigating the production of antimicrobial nanoparticles by Chlorella vulgaris and the link to its loss of viability. Microorganisms. 2022;10(1):145.
- AI-Enazi NM, Alwakeel S, Alhomaidi E. Photocatalytic and biological activities of green synthesized SnO 2 nanoparticles using Chlorella vulgaris. J Appl Microbiol. 2022;133(6):3265-75.
- Bhuyar P, et al. Synthesis of silver nanoparticles using marine macroalgae Padina sp and its antibacterial activity towards pathogenic bacteria. Beni-Suef Univ J Basic Appl Sci. 2020;9:1-15.
- Bhattacharya D, Gupta RK. Nanotechnology and potential of microorganisms. Crit Rev Biotechnol. 2005;25(4):199-204.
- Yurkov AM, Kemler M, Begerow D. Species accumulation curves and incidence-based species richness estimators to appraise the diversity of cultivable yeasts from beech forest soils. PLoS ONE. 2011;6(8): e23671.
- Hudlikar M , et al. Green synthesis of TiO 2 nanoparticles by using aqueous extract of Jatropha curcas L. latex. Mater Lett. 2012;75:196-9.
- Vidya C, et al. Green synthesis of ZnO nanoparticles by Calotropis gigantea. Int J Curr Eng Technol. 2013;1(1):118-20.
- Gnanasangeetha D, Thambavani DS. Biogenic production of zinc oxide nanoparticles using Acalypha indica. J Chem Biol and Phy Sci (JCBPS). 2013;4(1):238.
- Devi HS, Singh TD. Synthesis of copper oxide nanoparticles by a novel method and its application in the degradation of methyl orange. Adv Electron Electr Eng. 2014;4(1):83-8.
- Gunalan S, Sivaraj R, Rajendran V. Green synthesized ZnO nanoparticles against bacterial and fungal pathogens. Prog Nat Sci Mat Int. 2012;22(6):693-700.
- Sneha K, et al. Corynebacterium glutamicum-mediated crystallization of silver ions through sorption and reduction processes. Chem Eng J. 2010;162(3):989-96.
- Kalishwaralal K, et al. Extracellular biosynthesis of silver nanoparticles by the culture supernatant of Bacillus licheniformis. Mater Lett. 2008;62(29):4411-3.
- Mittal AK, Chisti Y, Banerjee UC. Synthesis of metallic nanoparticles using plant extracts. Biotechnol Adv. 2013;31(2):346-56.
- Malik P, et al. Green chemistry based benign routes for nanoparticle synthesis. J Nanopart. 2014. https://doi.org/10.1155/2014/302429.
- Mukunthan K, Balaji S. Cashew apple juice (Anacardium occidentale L.) speeds up the synthesis of silver nanoparticles. Int J Green Nanotechnol. 2012;4(2):71-9.
- Makarov VV, et al. “Green” nanotechnologies: synthesis of metal nanoparticles using plants. Acta Naturae. 2014;6(1):35-44.
- Singh
, et al. Revisiting the green synthesis of nanoparticles: uncovering influences of plant extracts as reducing agents for enhanced
synthesis efficiency and its biomedical applications. Int J Nanomed. 2023. https://doi.org/10.2147/IJN.S419369. - Saravanan M, et al. Synthesis of silver nanoparticles from Bacillus brevis (NCIM 2533) and their antibacterial activity against pathogenic bacteria. Microb Pathog. 2018;116:221-6.
- Arya A, et al. Biogenic synthesis of copper and silver nanoparticles using green alga Botryococcus braunii and its antimicrobial activity. Bioinorg Chem Appl. 2018. https://doi.org/10.1155/2018/7879403.
- Soni V, et al. Sustainable and green trends in using plant extracts for the synthesis of biogenic metal nanoparticles toward environmental and pharmaceutical advances: a review. Environ Res. 2021;202: 111622.
- Thatyana M , et al. Advances in phytonanotechnology: a plant-mediated green synthesis of metal nanoparticles using phyllanthus plant extracts and their antimicrobial and anticancer applications. Nanomaterials. 2023;13(19):2616.
- Kapoor A, et al. Systemic antibiotic therapy in periodontics. Dent Res J (Isfahan). 2012;9(5):505-15.
- Addy M, Martin M. Systemic antimicrobials in the treatment of chronic periodontal diseases: a dilemma. Oral Dis. 2003;9:38-44.
- John MT, et al. Network meta-analysis of studies included in the Clinical Practice Guideline on the nonsurgical treatment of chronic periodontitis. J Clin Periodontol. 2017;44(6):603-11.
- Ranjbar-Mohammadi M, et al. Electrospinning of PLGA/gum tragacanth nanofibers containing tetracycline hydrochloride for periodontal regeneration. Mater Sci Eng C. 2016;58:521-31.
- Vargas-Reus MA, et al. Antimicrobial activity of nanoparticulate metal oxides against peri-implantitis pathogens. Int J Antimicrob Agents. 2012;40(2):135-9.
- Allaker RP, Memarzadeh K. Nanoparticles and the control of oral infections. Int J Antimicrob Agents. 2014;43(2):95-104.
- Roduner E. Size matters: why nanomaterials are different. Chem Soc Rev. 2006;35(7):583-92.
- Wang L, Hu C, Shao L. The antimicrobial activity of nanoparticles: present situation and prospects for the future. Int J Nanomedicine. 2017;12:1227-49.
- Franco D, et al. Metal-based nanoparticles: antibacterial mechanisms and biomedical application. Microorganisms. 2022;10(9):1778.
- Yang X, et al. Pharmaceutical intermediate-modified gold nanoparticles: against multidrug-resistant bacteria and wound-healing application via an electrospun scaffold. ACS Nano. 2017;11(6):5737-45.
- Organization, W.H., Antibacterial agents in clinical development: an analysis of the antibacterial clinical development pipeline, including tuberculosis. 2017, World Health Organization.
- Sánchez-López E, et al. Metal-based nanoparticles as antimicrobial agents: an overview. Nanomaterials. 2020;10(2):292.
- Shiva Manjunath RG. Anju Rana, Nanotechnology in periodontal management. J Adv Oral Res. 2015;6(1):1-8.
- Kırmusaoğlu, S., Bacterial pathogenesis and antibacterial control. 2018: BoD-Books on Demand.
- Priyadarsini S, Mukherjee S, Mishra M. Nanoparticles used in dentistry: a review. J Oral Biol Craniofac Res. 2018;8(1):58-67.
- Dizaj SM, et al. Antimicrobial activity of the metals and metal oxide nanoparticles. Mater Sci Eng C. 2014;44:278-84.
- Zhang S, et al. Antimicrobial properties of metal nanoparticles and their oxide materials and their applications in oral biology. J Nanomat. 2022. https://doi.org/10.1155/2022/2063265.
- Steckiewicz KP, et al. Silver nanoparticles as chlorhexidine and metronidazole drug delivery platforms: their potential use in treating periodontitis. Int J Nanomed. 2022. https://doi.org/10.2147/IJN.S339046.
- Ni C, et al. Gold nanoparticles modulate the crosstalk between macrophages and periodontal ligament cells for periodontitis treatment. Biomaterials. 2019;206:115-32.
- Bahrami R, et al. Anti-biofilm and bystander effects of antimicrobial photo-sonodynamic therapy against polymicrobial periopathogenic biofilms formed on coated orthodontic mini-screws with zinc oxide nanoparticles. Photodiag Photodyn Ther. 2023. https://doi.org/10. 1016/j.pdpdt.2023.103288.
- Kim D-H, et al. Titanium dioxide nanoparticles induce COX-2 expression through ROS generation in human periodontal ligament cells. J Toxicol Sci. 2019;44(5):335-45.
- Fritz, S.R., et al. Superparamagnetic nanoparticles for the treatment of periodontal disease. in Colloidal Nanoparticles for Biomedical Applications XVIII. 2023. SPIE.
- Sathiyaraj S, et al. Biosynthesis, characterization, and antibacterial activity of gold nanoparticles. J Infect Public Health. 2021;14(12):1842-7.
- Herizchi R, et al. Current methods for synthesis of gold nanoparticles. Artif Cells Nanomed Biotechnol. 2016;44(2):596-602.
- Yin IX, et al. The antibacterial mechanism of silver nanoparticles and its application in dentistry. International J Nanomed. 2020. https:// doi.org/10.2147/IJN.S246764.
- Nguyen NPU, et al. Synthesis of silver nanoparticles: from conventional to ‘modern’methods—a review. Processes. 2023;11(9):2617.
- Alangari A, et al. Iron oxide nanoparticles: preparation, characterization, and assessment of antimicrobial and anticancer activity. Adsorpt Sci Technol. 2022;2022:1-9.
- Abdulsada FM, et al. Evaluation of the antibacterial properties of iron oxide, polyethylene glycol, and gentamicin conjugated nanoparticles against some multidrug-resistant bacteria. J Funct Biomat. 2022;13(3):138.
- Rajeshkumar S, et al. Antibacterial and antioxidant potential of biosynthesized copper nanoparticles mediated through Cissus arnotiana plant extract. J Photochem Photobiol, B. 2019;197: 111531.
- Saran M, et al. Green synthesis and characterisation of CuNPs: insights into their potential bioactivity. IET Nanobiotechnol. 2018;12(3):357-64.
- Porta M , et al. Titanium oxide nanoparticle dispersions in a liquid monomer and solid polymer resins prepared by sputtering. New J Chem. 2016;40(11):9337-43.
- de Dicastillo, C.L., et al., Antimicrobial effect of titanium dioxide nanoparticles. Antimicrobial Resistance-A One Health Perspective, 2020.
- Sirelkhatim A, et al. Review on zinc oxide nanoparticles: antibacterial activity and toxicity mechanism. Nano-micro letters. 2015;7:219-42.
- Bulcha B, et al. Synthesis of zinc oxide nanoparticles by hydrothermal methods and spectroscopic investigation of ultraviolet radiation protective properties. J Nanomater. 2021;2021:1-10.
- Mustapha T, et al. A review on plants and microorganisms mediated synthesis of silver nanoparticles, role of plants metabolites and applications. Int J Environ Res Public Health. 2022;19(2):674.
- Matussin S , et al. Plant-extract-mediated SnO 2 nanoparticles: synthesis and applications. ACS Sustain Chem Eng. 2020;8(8):3040-54.
- Brar KK, et al. Green route for recycling of low-cost waste resources for the biosynthesis of nanoparticles (NPs) and nanomaterials (NMs)-a review. Environ Res. 2022;207: 112202.
- Khalil M, et al. Antibacterial activity of Salvadora persica against oral pathogenic bacterial isolates. Niger J Clin Pract. 2019;22(10):1378-87.
- Moghadam ET, et al. Current herbal medicine as an alternative treatment in dentistry: in vitro, in vivo and clinical studies. Eur J Pharmacol. 2020;889: 173665.
- Wei Y, et al. Pyroptosis-induced inflammation and tissue damage. J Mol Biol. 2022;434(4): 167301.
- Elsilk SE, et al. Streptomyces rochei MS-37 as a novel marine actinobacterium for green biosynthesis of silver nanoparticles and their biomedical applications. Molecules. 2022;27(21):7296.
- Achudhan D , et al. The antibacterial, antibiofilm, antifogging and mosquitocidal activities of titanium dioxide (TiO2) nanoparticles green-synthesized using multiple plants extracts. J Environ Chem Eng. 2020;8(6): 104521.
- Fernández-Arias M , et al. Copper nanoparticles obtained by laser ablation in liquids as bactericidal agent for dental applications. Appl Surf Sci. 2020;507: 145032.
- Rajeshkumar S, et al. Anticariogenic activity of fresh aloe vera gel mediated copper oxide nanoparticles. Indian J Public Health Res Devel. 2019. https://doi.org/10.5958/0976-5506.2019.04158.5.
- Yazdanian M, et al. The potential application of green-synthesized metal nanoparticles in dentistry: a comprehensive review. Bioinorg Chem Appl. 2022. https://doi.org/10.1155/2022/2311910.
- Matar GH, Andac M. Green synthesis of iron oxide nanoparticles using brown Egyptian propolis extract for evaluation of their antibacterial activity and degradation of dyes. Inorg Chem Commun. 2023. https:// doi.org/10.1016/j.inoche.2023.110889.
- Fuloria NK, et al. Response of green synthesized drug blended silver nanoparticles against periodontal disease triggering pathogenic microbiota. J Appl Biol Biotechnol. 2019;7(4):46-56.
- Rajkumari J, et al. Facile green synthesis of baicalein fabricated gold nanoparticles and their antibiofilm activity against Pseudomonas aeruginosa PAO1. Microb Pathog. 2017;107:261-9.
- Anbuvannan
, et al. Anisochilus carnosus leaf extract mediated synthesis of zinc oxide nanoparticles for antibacterial and photocatalytic activities. Mater Sci Semicond Proc. 2015;39:621-8. - Ambika S, Sundrarajan M. Antibacterial behaviour of Vitex negundo extract assisted ZnO nanoparticles against pathogenic bacteria. J Photochem Photobiol, B. 2015;146:52-7.
- Baranwal A, et al. Prospects of nanostructure materials and their composites as antimicrobial agents. Front Microbiol. 2018;9:422.
- Hernandez-Delgadillo R, et al. Zerovalent bismuth nanoparticles inhibit Streptococcus mutans growth and formation of biofilm. Int J Nanomed. 2012. https://doi.org/10.2147/IJN.S29854.
- Prakash
, et al. Green synthesis of bismuth based nanoparticles and its applications-a review. Sust Chem Pharmacy. 2022;25: 100547. - Pourmortazavi SM, et al. Reducing power of Eucalyptus oleosa leaf extracts and green synthesis of gold nanoparticles using the extract. Int J Food Prop. 2017;20(5):1097-103.
- Yadi M , et al. Current developments in green synthesis of metallic nanoparticles using plant extracts: a review. Artif Cells Nanomed Biotechnol. 2018;46(sup3):336-43.
- Teimuri-Mofrad R , et al. Green synthesis of gold nanoparticles using plant extract: Mini-review. Nanochem Res. 2017;2(1):8-19.
- Bapat RA, et al. Recent advances of gold nanoparticles as biomaterial in dentistry. Int J Pharm. 2020;586: 119596.
- Bharadwaj KK, et al. Green synthesis of gold nanoparticles using plant extracts as beneficial prospect for cancer theranostics. Molecules. 2021;26(21):6389.
- Stozhko NY, et al. The effect of the antioxidant activity of plant extracts on the properties of gold nanoparticles. Nanomaterials. 2019;9(12):1655.
- Teimouri M, et al. Gold nanoparticles fabrication by plant extracts: synthesis, characterization, degradation of 4-nitrophenol from industrial wastewater, and insecticidal activity-a review. J Clean Prod. 2018;184:740-53.
- Suman T, et al. The Green synthesis of gold nanoparticles using an aqueous root extract of Morinda citrifolia L. Spectrochim Acta Part A Mol Biomol Spectrosc. 2014;118:11-6.
- Alizadeh SR, et al. Scrophularia striata extract mediated synthesis of gold nanoparticles; their antibacterial, antileishmanial, antioxidant, and photocatalytic activities. Inorg Chem Commun. 2023;156: 111138.
- Wang M, Wang L. Plant polyphenols mediated synthesis of gold nanoparticles for pain management in nursing care for dental tissue implantation applications. J Drug Delivery Sci Technol. 2020;58: 101753.
- Navya PD, et al. Assessment of antioxidant and anti-inflammatory properties of gold nanoparticles synthesized using pterocarpus santa-an in vitro study. J Popul Ther Clin Pharmacol. 2023;30(16):361-7.
- Worakitjaroenphon S, et al. Green synthesis of silver and gold nanoparticles using Oroxylum indicum plant extract for catalytic and antimicrobial activity. Biomass Conv Biorefinery. 2023. https://doi.org/10.1007/ s13399-023-04734-4.
- Emmanuel R, et al. Antimicrobial efficacy of drug blended biosynthesized colloidal gold nanoparticles from Justicia glauca against oral pathogens: a nanoantibiotic approach. Microb Pathog. 2017;113:295-302.
- Wankar S, et al. The era of green nanomaterials for sensing. In: Kulkarni S, editor., et al., Innovations in green nanoscience and nanotechnology. Boca Raton: CRC Press; 2022. p. 209-25.
- Suwan T, Khongkhunthian S, Okonogi S. Green synthesis and inhibitory effects against oral pathogens of silver nanoparticles mediated by rice extracts. Drug Discov Therap. 2018;12(4):189-96.
- Ahmed S , et al. A review on plants extract mediated synthesis of silver nanoparticles for antimicrobial applications: a green expertise. J Adv Res. 2016;7(1):17-28.
- Makvandi P, et al. Biofabricated nanostructures and their composites in regenerative medicine. ACS Appl Nano Materials. 2020;3(7):6210-38.
- Pandit
, et al. Biological agents for synthesis of nanoparticles and their applications. J King Saud University-Sci. 2022;34(3): 101869. - Emmanuel R, et al. Antimicrobial efficacy of green synthesized drug blended silver nanoparticles against dental caries and periodontal disease causing microorganisms. Mater Sci Eng, C. 2015;56:374-9.
- Sirisha P, et al. Antimicrobial effect of silver nanoparticles synthesised with Ocimum sanctum leaf extract on periodontal pathogens. J Oral Health Dent Sci. 2017;1:1-7.
- Sharma, K. and C. Chauhan, Role of magnetic nanoparticle (MNPs) in cancer treatment: a review. Materials Today: Proceedings, 2021.
- Farouk F, et al. Synthesis of magnetic iron oxide nanoparticles using pulp and seed aqueous extract of Citrullus colocynth and evaluation of their antimicrobial activity. Biotech Lett. 2020;42:231-40.
- Mane-Gavade, S., et al. Green synthesis of magnetite nanoparticles (Fe3O4 NPs) using Acacia concinna fruit extract and their antibacterial activity. in Macromolecular Symposia. 2021. Wiley Online Library.
- Mohandoss S, et al. Ulvan as a reducing agent for the green synthesis of silver nanoparticles: a novel mouthwash. Inorganics. 2023;11(1):5.
- Devi RS, et al. Free radical scavenging activity of copper nanoparticles synthesized from dried ginger. J Pharm Res Int. 2020;32(19):1-7.
- Din MI, Rehan R. Synthesis, characterization, and applications of copper nanoparticles. Anal Lett. 2017;50(1):50-62.
- Letchumanan D, et al. Plant-based biosynthesis of copper/copper oxide nanoparticles: an update on their applications in biomedicine, mechanisms, and toxicity. Biomolecules. 2021;11(4):564.
- Rafique M , et al. A review on synthesis, characterization and applications of copper nanoparticles using green method. NANO. 2017;12(04):1750043.
- Abbas AH, Fairouz NY. Characterization, biosynthesis of copper nanoparticles using ginger roots extract and investigation of its antibacterial activity. Mater Today Proc. 2022;61:908-13.
- El-Rab, S.M.G., et al., Green Synthesis of Copper Nano-Drug and Its Dental Application upon Periodontal Disease-Causing Microorganisms. 2021.
- Kaur P, Thakur R, Chaudhury A. Biogenesis of copper nanoparticles using peel extract of Punica granatum and their antimicrobial activity against opportunistic pathogens. Green Chem Lett Rev. 2016;9(1):33-8.
- Nadeem M, et al. The current trends in the green syntheses of titanium oxide nanoparticles and their applications. Green Chem Lett Rev. 2018;11(4):492-502.
- Buraso W, et al. Synthesis of TiO2 nanoparticles via a simple precipitation method and photocatalytic performance. Mater Res Express. 2018;5(11): 115003.
- Ziental D, et al. Titanium dioxide nanoparticles: prospects and applications in medicine. Nanomaterials. 2020;10(2):387.
- Manimaran K, et al. Enhanced photocatalytic degradation, antimicrobial and anticancer efficiency of mycosynthesized TiO2 nanoparticles using Pleurotus ostreatus mushroom extract: an eco-friendly approach. J Environ Chem Eng. 2023. https://doi.org/10.1016/j.jece. 2023.111512.
- Sun J, et al. Improving performance of dental resins by adding titanium dioxide nanoparticles. Dent Mater. 2011;27(10):972-82.
- Rehman K, et al. A Coronopus didymus based eco-benign synthesis of Titanium dioxide nanoparticles (TiO2 NPs) with enhanced photocatalytic and biomedical applications. Inorganic Chem Commun. 2022;137:109179.
- Xin Y, et al. A robust ROS generation nanoplatform combating periodontitis via sonodynamic/chemodynamic combination therapy. Chem Eng J. 2023;451: 138782.
- Nabi G, et al. A review on novel eco-friendly green approach to synthesis TiO 2 nanoparticles using different extracts. J Inorg Organomet Polym Mater. 2018;28:1552-64.
- Dobrucka R. Synthesis of titanium dioxide nanoparticles using Echinacea purpurea herba. Iranian J Pharm Res IJPR. 2017;16(2):756.
- Hinaz N. Green synthesis and antimicrobial activity of titanium dioxide nanoparticles with neem and tulsi extract against oral pathogens. Int J Periodontal Rehabil. 2022;3(1):17-29.
- Tahmasebi E, et al. Antimicrobial properties of green synthesized novel TiO2 nanoparticles using Iranian propolis extracts. J Basic Microbiol. 2023. https://doi.org/10.1002/jobm. 202300221.
- Anbumani
, et al. Green synthesis and antimicrobial efficacy of titanium dioxide nanoparticles using Luffa acutangula leaf extract. J King Saud University-Sci. 2022;34(3): 101896. - Król A, et al. Zinc oxide nanoparticles: synthesis, antiseptic activity and toxicity mechanism. Adv Coll Interface Sci. 2017;249:37-52.
- Kaliamurthi S , et al. The relationship between Chlorella sp. and zinc oxide nanoparticles: changes in biochemical, oxygen evolution, and lipid production ability. Proc Biochem. 2019;85:43-50.
- Abdo AM, et al. Green synthesis of Zinc Oxide Nanoparticles (ZnO-NPs) by Pseudomonas aeruginosa and their activity against pathogenic microbes and common house mosquito, Culex pipiens. Materials. 2021;14(22):6983.
- Delfani
, et al. Potent effects of green synthesized zinc nanoparticles against some cariogenic bacteria (Streptococcus mutans and Actinomyces viscosus). Global J Med Pharm Biomed Update. 2022. https://doi.org/ 10.25259/GJMPBU_17_2022. - Khan ST, Musarrat J, Al-Khedhairy AA. Countering drug resistance, infectious diseases, and sepsis using metal and metal oxides nanoparticles: current status. Colloids Surf, B. 2016;146:70-83.
- Norouzi M, et al. Recent advances on nanomaterials-based fluorimetric approaches for microRNAs detection. Mater Sci Eng, C. 2019;104: 110007.
- Yasamineh S, et al. Future Prospects of Natural Polymer-Based Drug Delivery Systems in Combating Lung Diseases. In: Natural Polymeric Materials based Drug Delivery Systems in Lung Diseases. Springer; 2023. p. 465-82.
- Norman, N.C., Chemistry of arsenic, antimony and bismuth. 1997: Springer Science & Business Media.
- Badireddy AR, Chellam S. Antibacterial and antifouling properties of lipophilic bismuth compounds. Adv Chem Res Nova Sci Publ. 2014;21:1-28.
- Shakibaie M, et al. Cytotoxic and antioxidant activity of the biogenic bismuth nanoparticles produced by Delftia sp. SFG Materials Res Bulletin. 2018;104:155-63.
- Karnan T, Samuel S. A novel bio-mimetic approach for the fabrication of Bi2O3 nanoflakes from rambutan (Nephelium lappaceum L.) peel extract and their photocatalytic activity. Ceramics Int. 2016;42(4):4779-87.
- Liu C, et al. Biomolecules-assisted synthesis of degradable bismuth nanoparticles for dual-modal imaging-guided chemo-photothermal therapy. Chem Eng J. 2020;382: 122720.
- Vega-Jiménez A, et al. Bismuth subsalicylate nanoparticles with anaerobic antibacterial activity for dental applications. Nanotechnology. 2017;28(43): 435101.
- Hafeez M , et al. Green synthesis of cobalt oxide nanoparticles for potential biological applications. Mater Res Expr. 2020;7(2): 025019.
- Hao W-J, et al. A new Co (II)-coordination complex: application values against chronic periodontitis through regulating Porphyromonas gingivalis survival genes expression. Inorganic Nano-Metal Chem. 2021;51(11):1507-11.
- Abbaszadeh H, et al. Chronic obstructive pulmonary disease and asthma: mesenchymal stem cells and their extracellular vesicles as potential therapeutic tools. Stem Cell Res Ther. 2022;13(1):1-15.
- Samuel MS, et al. A review on green synthesis of nanoparticles and their diverse biomedical and environmental applications. Catalysts. 2022;12(5):459.
- Abdelhameed RM, El-Shahat M, Emam HE. Employable metal (Ag & Pd)@ MIL-125-NH2@ cellulose acetate film for visible-light driven photocatalysis for reduction of nitro-aromatics. Carbohyd Polym. 2020;247: 116695.
- Chowdhury MA, et al. Green synthesis and characterization of zirconium nanoparticlefor dental implant applications. Heliyon. 2023. https://doi.org/10.1016/j.heliyon.2022.e12711.
- Kasthuri G, Reddy AN, Roopa PM. Application of green synthesized iron nanoparticles for enhanced antimicrobial activity of selected traditional and commonly exploited drug amoxicillin against Streptococcus mutans. Biosci, Biotechnol Res Asia. 2017;14(3):1135-41.
- Ahmadi M. Iron oxide nanoparticles for delivery purposes. In: Nanoengineered Biomaterials for Advanced Drug Delivery. Elsevier; 2020. p. 373-93.
- Porter GC, et al. AgNP/Alginate nanocomposite hydrogel for antimicrobial and antibiofilm applications. Carbohyd Polym. 2021;251: 117017.
- Mahadlek J, Charoenteeraboon J, Phaechamud T. Zinc oxide gels for periodontitis treatment. J Metal Mater Mineral. 2010;20(3):159-63.
- Ahmad W, Jaiswal KK, Soni S. Green synthesis of titanium dioxide (TiO2) nanoparticles by using Mentha arvensis leaves extract and its antimicrobial properties. Inorganic Nano-Metal Chem. 2020;50(10):1032-8.
- Anandarup G, et al. Cu and Cu-Based nanoparticles: synthesis and applications in catalysis. Chem Rev. 2016. https://doi.org/10.1021/acs. chemrev.5b00482.
- Murthy H, et al. Synthesis of green copper nanoparticles using medicinal plant hagenia abyssinica (Brace) JF. Gmel. leaf extract: antimicrobial properties. J Nanomat. 2020. https://doi.org/10.1155/2020/3924081.
- Ahana G , et al. Biogenesis and green synthesis of metal nanoparticles and their pharmacological applications. Plant Sci Today. 2023. https:// doi.org/10.14719/pst.2417.
- AlKahtani RN. The implications and applications of nanotechnology in dentistry: a review. Saudi dental J. 2018;30(2):107-16.
- Hester K, et al. Anticipatory ethics and governance (AEG): towards a future care orientation around nanotechnology. NanoEthics. 2015;9:123-36.
- Uzair B, et al. Green and cost-effective synthesis of metallic nanoparticles by algae: safe methods for translational medicine. Bioengineering. 2020;7(4):129.
- Wongpreecha J, et al. One-pot, large-scale green synthesis of silver nanoparticles-chitosan with enhanced antibacterial activity and low cytotoxicity. Carbohyd Polym. 2018;199:641-8.
- Turunc E, et al. Green synthesis of silver and palladium nanoparticles using Lithodora hispidula (Sm.) Griseb. (Boraginaceae) and application to the electrocatalytic reduction of hydrogen peroxide. Mater Chem Phys. 2017;202:310-9.
- Sana SS, Dogiparthi LK. Green synthesis of silver nanoparticles using Givotia moluccana leaf extract and evaluation of their antimicrobial activity. Mater Lett. 2018;226:47-51.
- Turakhia B, Turakhia P, Shah S. Green synthesis of zero valent iron nanoparticles from Spinacia oleracea (spinach) and its application in waste water treatment. J Adv Res Appl Sci. 2018;5(1):46-51.
- Kora AJ, Rastogi L. Catalytic degradation of anthropogenic dye pollutants using palladium nanoparticles synthesized by gum olibanum, a glucuronoarabinogalactan biopolymer. Ind Crops Prod. 2016;81:1-10.
- Pal K, Chakroborty S, Nath N. Limitations of nanomaterials insights in green chemistry sustainable route: review on novel applications. Green Proc Synt. 2022;11(1):951-64.
- Li C, et al. Gold nanoparticles promote proliferation of human periodontal ligament stem cells and have limited effects on cells differentiation. J Nanomaterials. 2016. https://doi.org/10.1155/2016/1431836.
- Hossain N, Islam MA, Chowdhury MA. Synthesis and characterization of plant extracted silver nanoparticles and advances in dental implant applications. Heliyon. 2022;8:e12313.
- Zorraquín-Peña I, et al. Glutathione-stabilized silver nanoparticles: antibacterial activity against periodontal bacteria, and cytotoxicity and inflammatory response in oral cells. Biomedicines. 2020;8(10):375.
- Franzolin MR, et al. Antimicrobial activity of silver and gold nanoparticles prepared by photoreduction process with leaves and fruit extracts of Plinia cauliflora and Punica granatum. Molecules. 2022. https://doi. org/10.3390/molecules27206860.
- Grande F, Tucci P. Titanium dioxide nanoparticles: a risk for human health? Mini Rev Med Chem. 2016;16(9):762-9.
- Shabatina TI, Vernaya Ol. Hybrid nanosystems of antibiotics with metal nanoparticles-novel antibacterial agents. Molecules. 2023. https://doi. org/10.3390/molecules28041603.
- Tri PN, et al. Antibacterial behavior of hybrid nanoparticles. In: Noble Metal-Metal Oxide Hybrid Nanoparticles. Elsevier; 2019. p. 141-55.
- Yeniyol S, et al. Antibacterial activity of As-annealed TiO2 nanotubes doped with Ag nanoparticles against periodontal pathogens. Bioinorg Chem Appl. 2014. https://doi.org/10.1155/2014/829496.
- Ibrahim L, et al. Estimation of ZnO nanoparticles effect on salivary alp activity in chronic periodontitis patients: in vitro study. Int J Adv Res Biol Sci. 2016;3(4):152-9.
- Schug H, et al. Effect of TiO2 nanoparticles and UV radiation on extracellular enzyme activity of intact heterotrophic biofilms. Environ Sci Technol. 2014;48(19):11620-8.
- Tan X , et al. Near-infrared-enhanced dual enzyme-mimicking
TiO2-x@alginate microspheres with antibactericidal and oxygeneration abilities to treat periodontitis. ACS Appl Mater Interfaces. 2022;15(1):391-406. - Nasiri K, et al. MicroRNAs function in dental stem cells as a promising biomarker and therapeutic target for dental diseases. Mol Diag Ther. 2023. https://doi.org/10.1007/s40291-023-00675-w.
- Wei F, et al. Recoverable peroxidase-like Fe3O4@ MoS2-Ag nanozyme with enhanced antibacterial ability. Chem Eng J. 2021;408: 127240.
- Zhang X, et al. Highly biosafe biomimetic stem cell membranedisguised nanovehicles for cartilage regeneration. Journal of Materials Chemistry B. 2020;8(38):8884-93.
- Guo C, et al. Engineering magnetically induced antibacterial organic/ inorganic hybrid nanoparticles for the treatment of periodontitis. Giant. 2023;13:100145.
- Wang H, et al. Branched AuAg nanoparticles coated by metal-phenolic networks for treating bacteria-induced periodontitis via photothermal antibacterial and immunotherapy. Mater Des. 2022;224: 111401.
Publisher’s Note
Ready to submit your research? Choose BMC and benefit from:
- fast, convenient online submission
- thorough peer review by experienced researchers in your field
- rapid publication on acceptance
- support for research data, including large and complex data types
- gold Open Access which fosters wider collaboration and increased citations
- maximum visibility for your research: over 100 M website views per year
- *Correspondence:
Saman Yasamineh
Yassaman124@gmail.com
Ali Joudaki
Joudakic@gmail.com
Full list of author information is available at the end of the article
