DOI: https://doi.org/10.1038/s42255-024-00988-y
PMID: https://pubmed.ncbi.nlm.nih.gov/38409604
تاريخ النشر: 2024-02-26
تناول النشا المقاوم يسهل فقدان الوزن لدى البشر من خلال إعادة تشكيل ميكروبيوم الأمعاء
تاريخ القبول: 17 يناير 2024
تاريخ النشر على الإنترنت: 26 فبراير 2024
(D) تحقق من التحديثات
الملخص
تشير الأدلة الناشئة إلى أن تعديل ميكروبيوم الأمعاء بواسطة الألياف الغذائية قد يقدم حلولًا للاضطرابات الأيضية. في تجربة عشوائية محكومة بالدواء الوهمي بتصميم متقاطع (ChiCTR-TTRCC-13003333) شملت 37 مشاركًا يعانون من زيادة الوزن أو السمنة، نختبر ما إذا كان النشا المقاوم (RS) كمكمل غذائي يؤثر على النتائج المتعلقة بالسمنة. هنا، نوضح أن مكملات RS لمدة 8 أسابيع يمكن أن تساعد في تحقيق فقدان الوزن (متوسط -2.8 كجم) وتحسين مقاومة الأنسولين لدى الأفراد ذوي الوزن الزائد. ترتبط فوائد RS بتغيرات في تركيب ميكروبيوم الأمعاء. تحمي مكملات بيفيدوبكتيريوم أدوليسنتيس، وهو نوع مرتبط بشكل ملحوظ بتخفيف السمنة لدى المشاركين في الدراسة، الفئران الذكور من السمنة الناتجة عن النظام الغذائي. من الناحية الميكانيكية، تؤدي التغيرات التي يسببها RS في ميكروبيوم الأمعاء إلى تغيير في ملف الأحماض الصفراوية، وتقليل الالتهاب من خلال استعادة الحاجز المعوي، وتثبيط امتصاص الدهون. نوضح أن RS يمكن أن يسهل فقدان الوزن على الأقل جزئيًا من خلال B. أدوليسنتيس وأن ميكروبيوم الأمعاء ضروري لعمل RS.
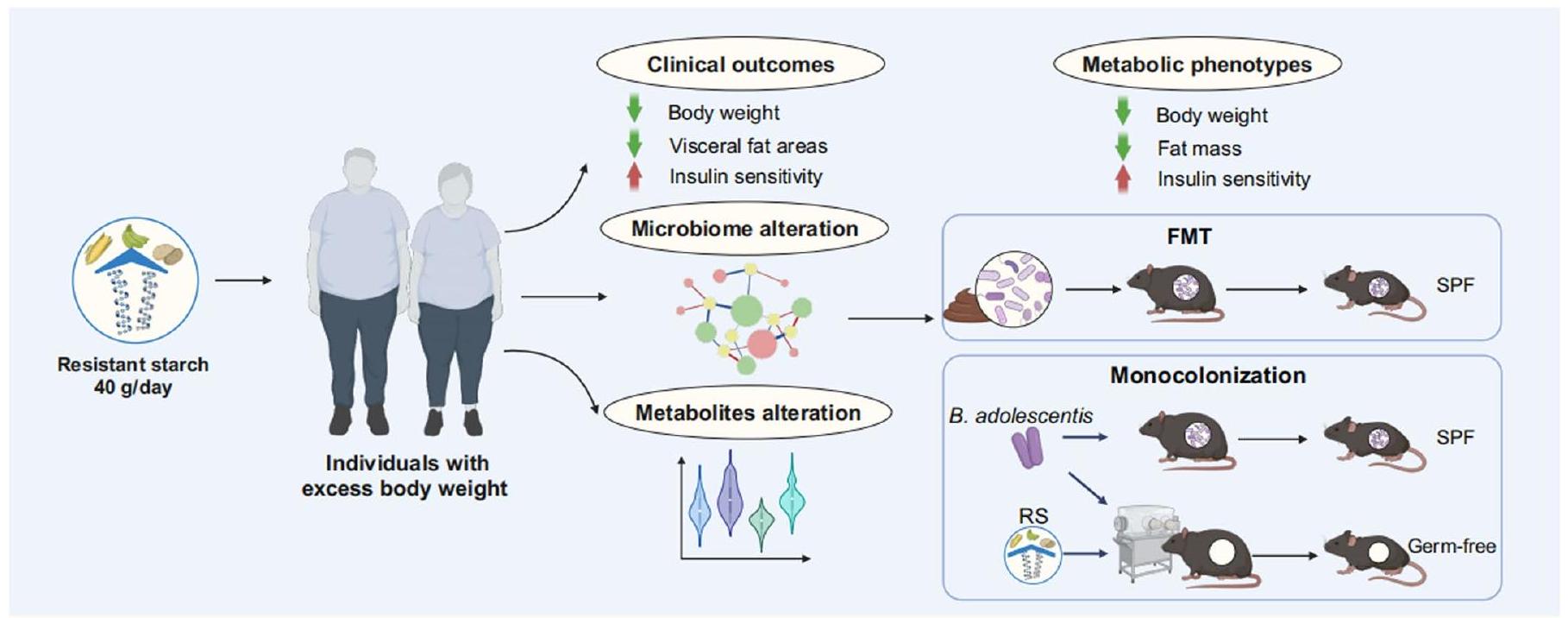
التدخل الغذائي مع FMT يمكن أن يؤدي إلى تغييرات إيجابية في ميكروبيوم المستلمين وتحسين النتائج السريرية
النتائج
يسهل تدخل RS فقدان الوزن
استخدام حديث للمضادات الحيوية أو البروبيوتيك (خلال 3 أسابيع). شملت مدة الدراسة التي استمرت 20 أسبوعًا فترتين من التدخل لمدة 8 أسابيع، واحدة لكل من الذرة عالية الأميلوز (HAM-RS2) (RS،
كانت تدخلات RS أقل بكثير من تلك التي حدثت بعد تدخل CS (الشكل 2h من البيانات الموسعة)؛ ومع ذلك، لم يُحدث تدخل CS أي اختلافات في مستويات الجلوكوز والأنسولين مقارنة بالقيم الأساسية (الشكل 2f,h من البيانات الموسعة). قمنا أيضًا بتقييم حساسية الأنسولين من خلال استخدام مشبك هايبر أنسولينيك-يوغليكي ووجدنا أن معدل ضخ الجلوكوز (GIR) قد زاد بشكل كبير بعد تدخل RS (مع زيادة متوسطة قدرها















| المعلمات السريرية | CSOW | CS 8W | RS OW | RS 8W | قيمة P
|
قيمة P
|
قيمة P
|
قيمة P
|
| مؤشرات مرتبطة بالسمنة | ||||||||
| وزن الجسم (كجم) |
|
|
|
|
0.328 | 0.339 | <0.001 | <0.001 |
| مؤشر كتلة الجسم (BMI)
|
|
|
|
|
0.361 | 0.422 | <0.001 | <0.001 |
| FM (كجم) |
|
|
|
|
0.486 | 0.136 | <0.001 | <0.001 |
| FFM (كجم) |
|
|
|
|
0.999 | 0.999 | 0.011 | 0.029 |
| TBW (كجم) |
|
|
|
|
0.999 | 0.999 | 0.101 | 0.155 |
| نسبة الدهون |
|
|
|
|
0.999 | 0.999 | 0.101 | 0.117 |
| محيط الخصر (سم) |
|
|
|
|
0.731 | 0.999 | <0.001 | <0.001 |
| محيط الورك (سم) |
|
|
|
|
0.999 | 0.372 | <0.001 | <0.001 |
| نسبة الخصر إلى الورك |
|
|
|
|
0.999 | 0.999 | <0.001 | 0.01 |
| VFA (
|
|
|
|
|
0.999 | 0.999 | <0.001 | <0.001 |
| SFA (
|
|
|
|
|
0.999 | 0.999 | <0.001 | 0.004 |
| المعلمات الأنثروبومترية | ||||||||
| العمر (بالسنوات) |
|
|||||||
| الجنس (ذكر:أنثى) | 22:15 | |||||||
| ضغط الدم الانقباضي (مم زئبق) |
|
|
|
|
0.999 | 0.999 | 0.999 | 0.918 |
| ضغط الدم الانبساطي ( مم زئبق ) |
|
|
|
|
0.999 | 0.999 | 0.999 | 0.342 |
| إنزيمات الكبد ووظيفة الكلى | ||||||||
| ALT (
|
16.80 (12.30, 29.00) | ٢٠.٠٠ (١٠.٢٨، ٣٠.٢٥) | 16.00 (12.00، 30.00) | 15.00 (12.00, 22.50) | 0.999 | 0.999 | 0.432 | 0.041 |
| AST (
|
18.60 (17.20، 22.00) | 19.76 (16.03, 24.80) | 19.00 (17.00، 22.50) | 17.00 (14.50، 21.00) | 0.999 | 0.999 | 0.058 | 0.022 |
| GGT (
|
٢٤.٨٠ (١٧.٥٠، ٣٥.٠٠) | 25.20 (18.17, 34.26) | 25.00 (18.00, 36.00) | ٢١.٠٠ (١٦.٠٠، ٣٥.٥٠) | 0.999 | 0.999 | 0.033 | 0.03 |
| خبز
|
|
|
|
|
0.999 | 0.999 | 0.999 | 0.149 |
|
|
|
|
|
|
0.999 | 0.999 | 0.999 | 0.809 |
| ملفات الدهون | ||||||||
| TC (ممول)
|
|
|
|
|
0.999 | 0.999 | 0.008 | 0.146 |
| تي جي (
|
1.09 (0.86, 1.68) | 1.23 (0.80, 1.52) | 1.04 (0.85, 1.64) | 1.01 (0.79، 1.38) | 0.999 | 0.999 | 0.999 | 0.559 |
| HDL-C (مللي مول)
|
|
|
|
|
0.999 | 0.999 | 0.999 | 0.456 |
| LDL-C (مللي مول)
|
|
|
|
|
0.999 | 0.999 | 0.424 | 0.482 |
| السيتوكينات الإفرازية | ||||||||
| A-FABP (
|
٣٥.٤٩ (٣٠.٧١، ٤٤.٨٢) | ٣٦.٨٣ (٢٣.٣٥، ٤٦.٩٩) | ٣٧.٤٧ (٢٩.٣٣، ٤٧.٨١) | 31.12 (23.74, 45.12) | 0.999 | 0.999 | 0.072 | 0.12 |
| أديبونيكتين
|
9.34 (7.49, 13.86) | 9.38 (7.01, 12.39) | 9.21 (7.04, 13.13) | 10.46 (7.38, 13.68) | 0.999 | 0.999 | 0.376 | 0.038 |
| FGF21 (
|
167.61 (99.71, 211.00) | 172.07 (104.63, 237.70) | 188.46 (113.19, 224.07) | 151.74 (51.62, 216.98) | 0.999 | 0.999 | <0.001 | 0.002 |
| عوامل مرتبطة بالالتهاب | ||||||||
| TNF
|
0.70 (0.60، 0.81) | 0.68 (0.55، 0.86) | 0.70 (0.55، 0.82) | 0.66 (0.45، 0.72) | 0.999 | 0.999 | 0.053 | 0.014 |
| IL-1
|
0.18 (0.13، 0.24) | 0.17 (0.10، 0.27) | 0.16 (0.11، 0.26) | 0.11 (0.06، 0.17) | 0.999 | 0.999 | <0.001 | 0.046 |
| MCP-1 (
|
673.56 (535.55, 865.83) | 630.62 (516.20, 768.22) | 626.85 (513.23, 816.09) | 631.97 (498.41, 822.20) | 0.999 | 0.999 | 0.999 | 0.925 |
| IL-10 (
|
1.72 (1.58، 2.07) | 1.62 (1.49، 1.79) | 1.66 (1.52، 1.95) | 1.58 (1.48، 1.91) | 0.999 | 0.999 | 0.999 | 0.146 |
| IL-6 (
|
1.08 (0.65, 1.85) | 1.12 (0.57, 1.64) | 1.08 (0.77, 1.58) | 1.05 (0.71, 1.49) | 0.999 | 0.999 | 0.999 | 0.689 |
 تُعبر كمتوسط
تُعبر كمتوسط

 تم تقييم النتائج بين تدخل RS و CS باستخدام نموذج مختلط خطي تم تعديله حسب ترتيب التدخل.
تم تقييم النتائج بين تدخل RS و CS باستخدام نموذج مختلط خطي تم تعديله حسب ترتيب التدخل.تحسن ملحوظ في حساسية الأنسولين. علاوة على ذلك، لوحظ زيادة كبيرة في مستويات الأديبونيكتين في المصل بعد تدخل RS (الشكل 2i من البيانات الموسعة). بالإضافة إلى ذلك، بعد تدخل RS، لم يكن هناك فرق كبير في إفراز الأنسولين في المرحلة الأولى أو المرحلة الثانية مقارنةً بتدخل CS (الجدول التكميلي 4). تشير جميع هذه النتائج إلى أن تدخل RS لمدة 8 أسابيع قد حسن من تحمل الجلوكوز وحساسية الأنسولين لدى الأفراد ذوي الوزن الزائد.
تمت ملاحظة البروتين-1 (MCP-1) وIL-10 وIL-6 خلال استهلاك RS وCS (الشكل 1i وj والجدول 1). علاوة على ذلك، قمنا بقياس الدهون البرازية لمشاركي الدراسة ووجدنا أن الإخراج اليومي للأحماض الدهنية غير الاستيرية (NEFA) والدهون الثلاثية (TGs) والكوليسترول الكلي (TC) كان أعلى بشكل ملحوظ بعد استهلاك RS مقارنة باستهلاك CS (الشكل 1k). نظرًا لعدم وجود فرق كبير في تناول الدهون خلال استهلاك RS وCS (الجدول التكميلي 1)، تشير هذه النتائج إلى أن تدخل RS قد يقلل من امتصاص الدهون من النظام الغذائي. كانت مستويات أنجيوبوينتين-مثل 4 (ANGPTL4)، وهو ارتباط محتمل بين الأمعاء وعمليات الأيض الدهنية،
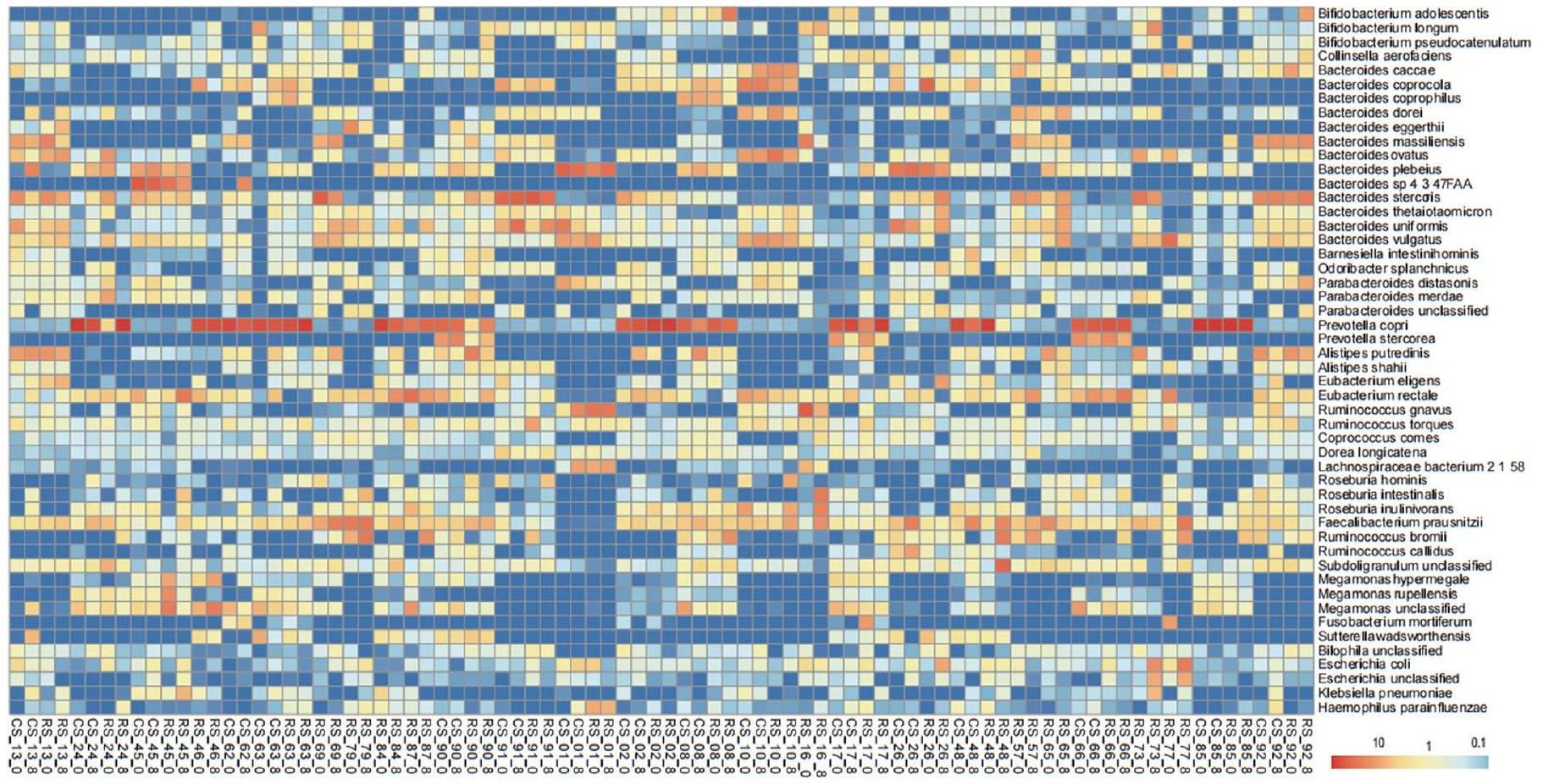
تدخل RS يعيد تشكيل ميكروبيوم الأمعاء
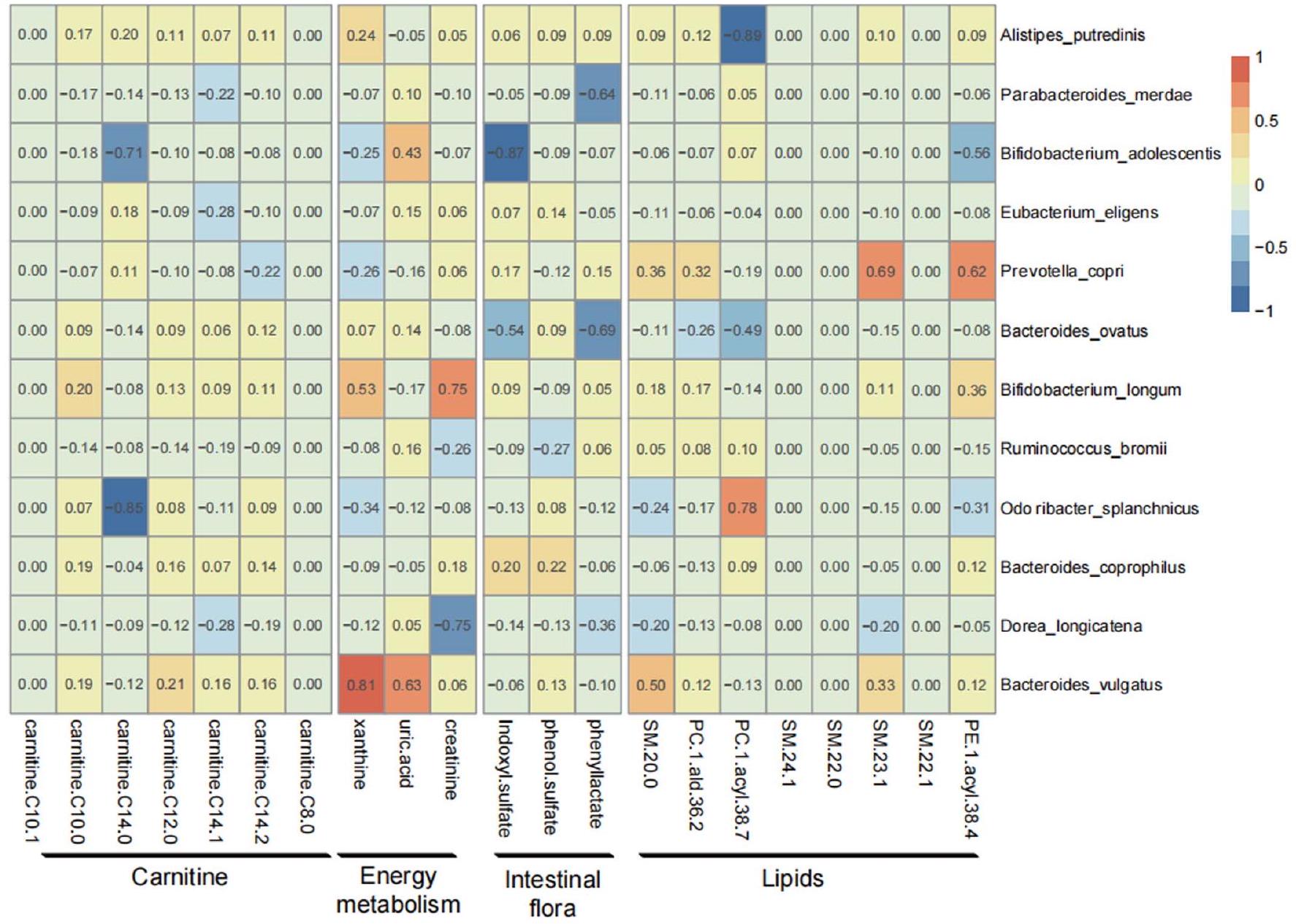
ارتباط ميكروبيوم الأمعاء المتغير بسبب RS مع المستقلبات
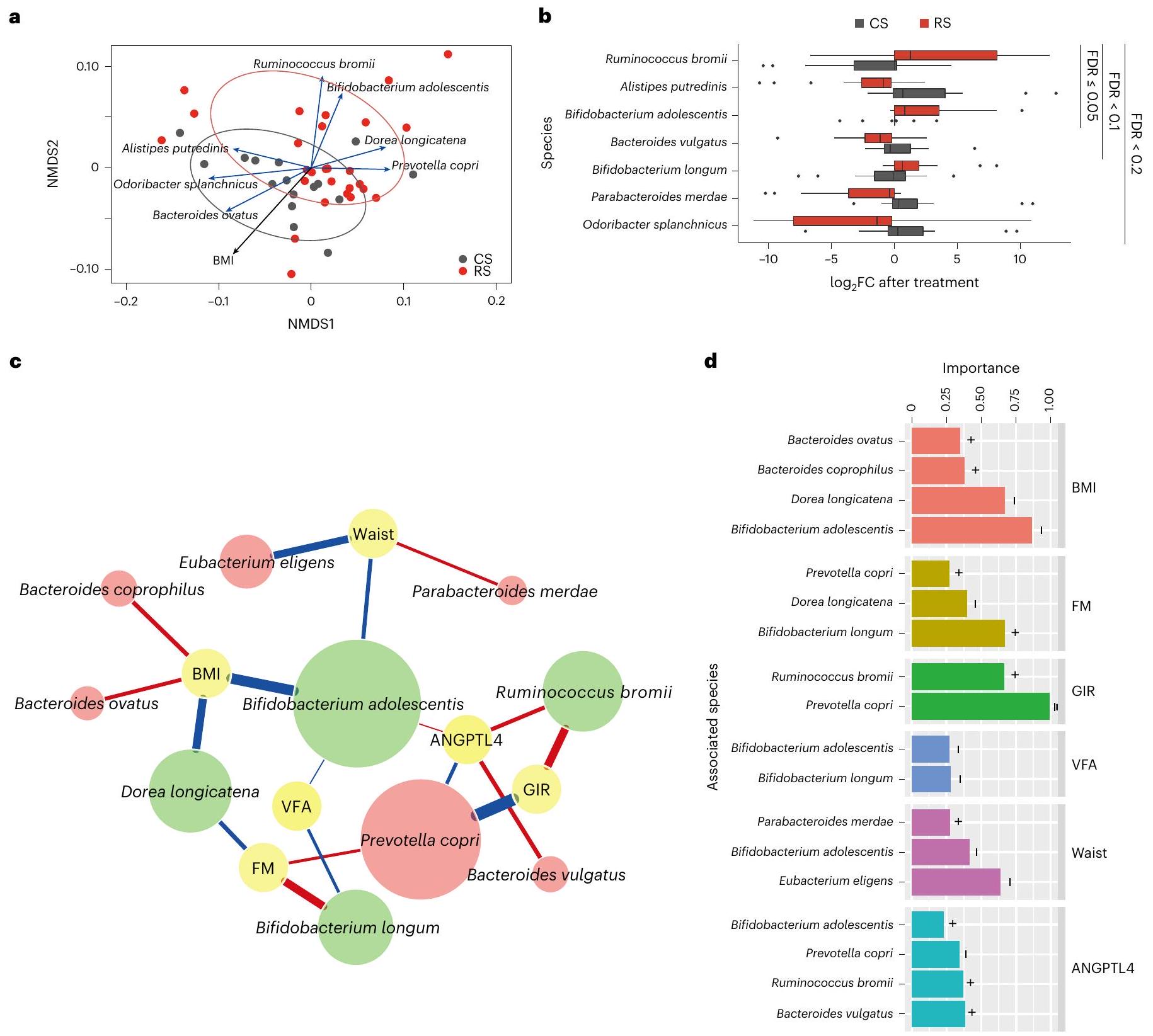
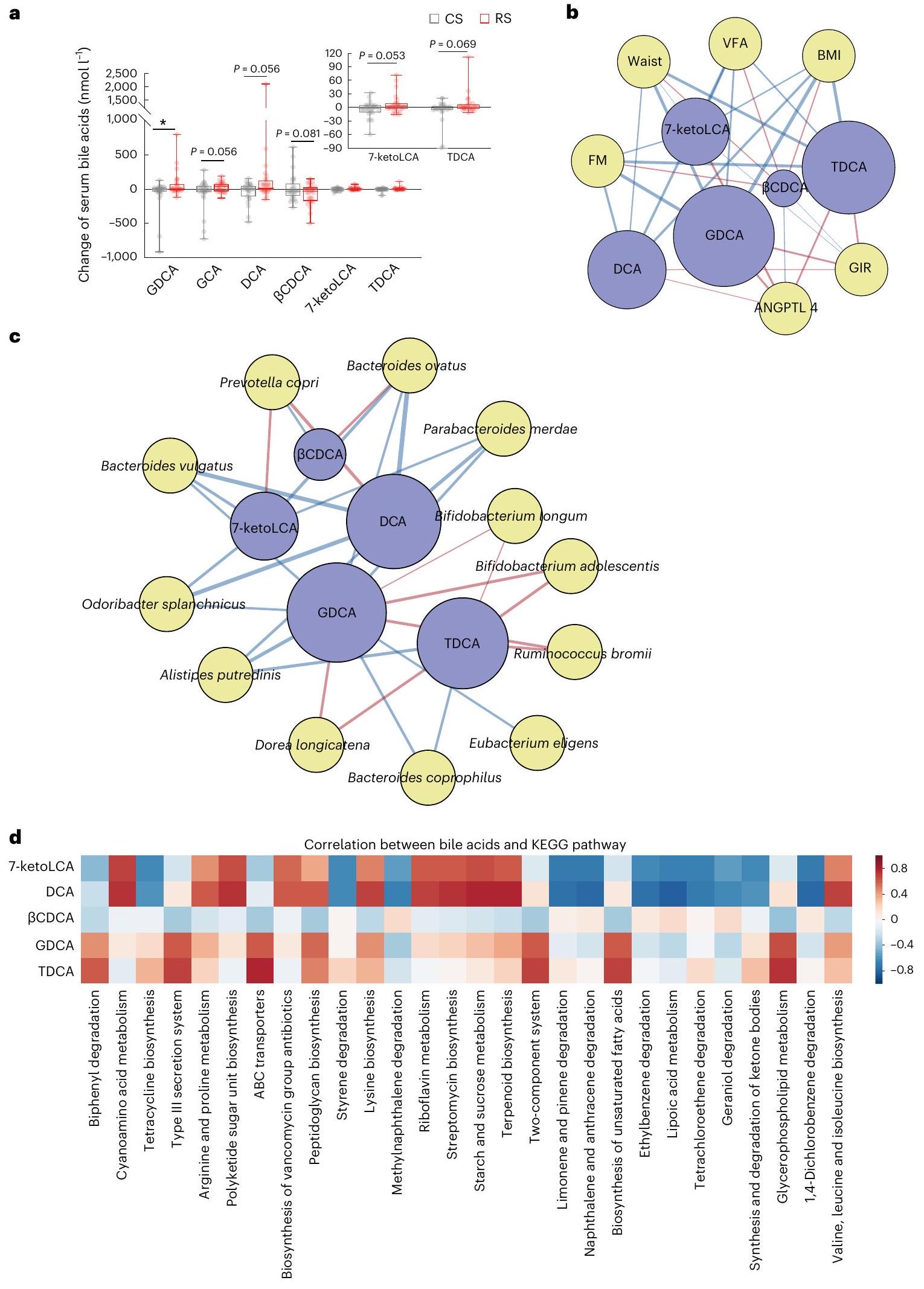
(TDCA) أظهر ميلًا للزيادة، بينما
مرتبطًا سلبًا مع الأنماط الظاهرة المتعلقة بالسمنة، بينما كان مرتبطًا إيجابيًا مع حساسية الأنسولين ومستويات ANGPTL4 (الشكل 3b). كان تغير GDCA وTDCA بعد علاج RS مرتبطًا بشكل كبير وإيجابي بأربعة أنواع، بما في ذلك B. adolescentis وB. longum وDorea longicatena وR. bromii،
بينما كان مرتبطًا سلبًا مع ثمانية أنواع أخرى، بما في ذلك A. putredinis وBacteroides coprophilus وBacteroides ovatus وB. vulgatus وEubacterium eligens وO. splanchnicus وP. merdae وP. copri (الشكل 3c). بالإضافة إلى ذلك، حددنا بعض المسارات الميكروبية المرتبطة بقوة بتغير عدة مستقلبات، بما في ذلك GDCA وTDCA،
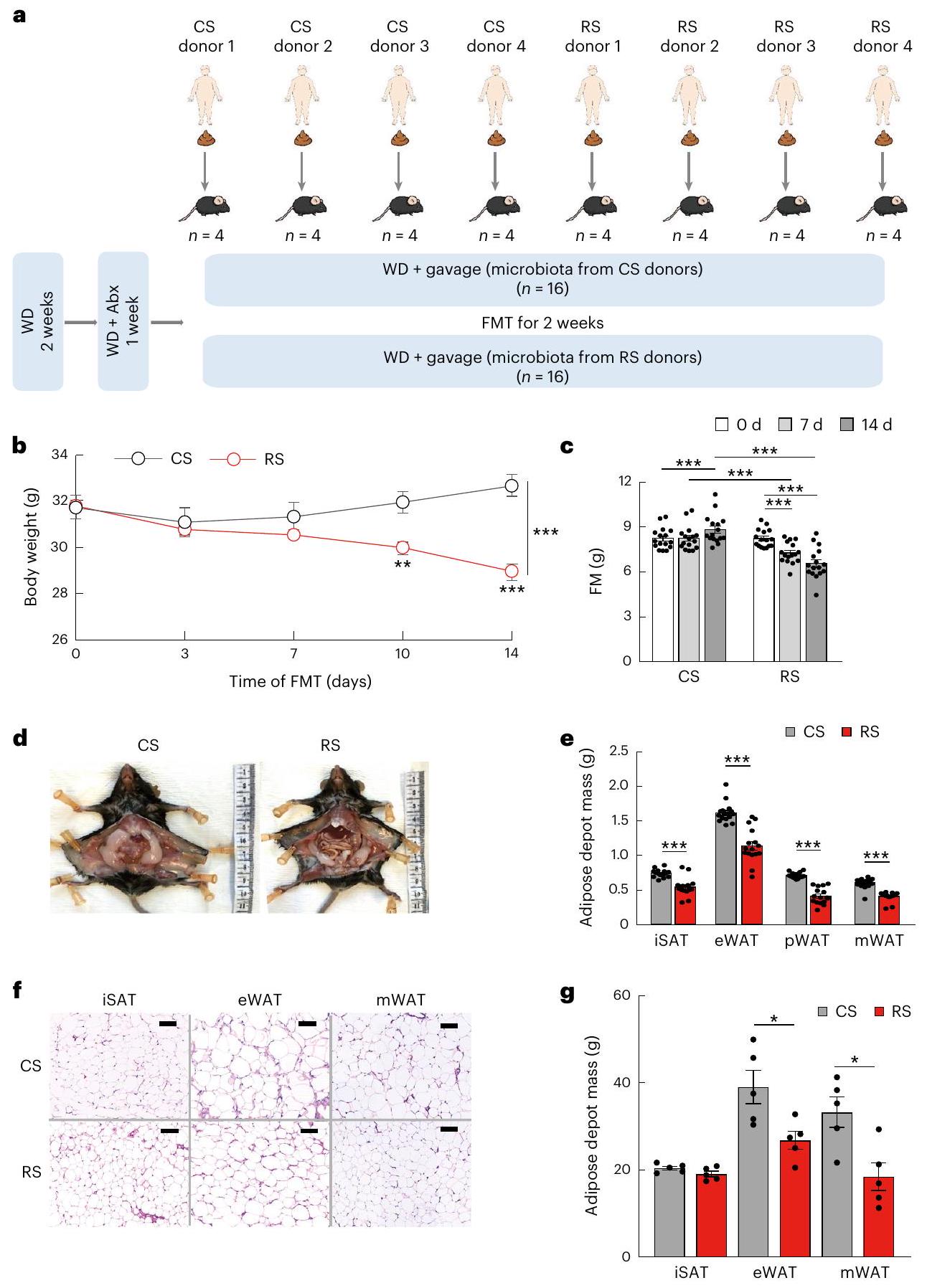
ميكروبات الأمعاء المعاد تشكيلها بواسطة RS تخفف السمنة في الفئران
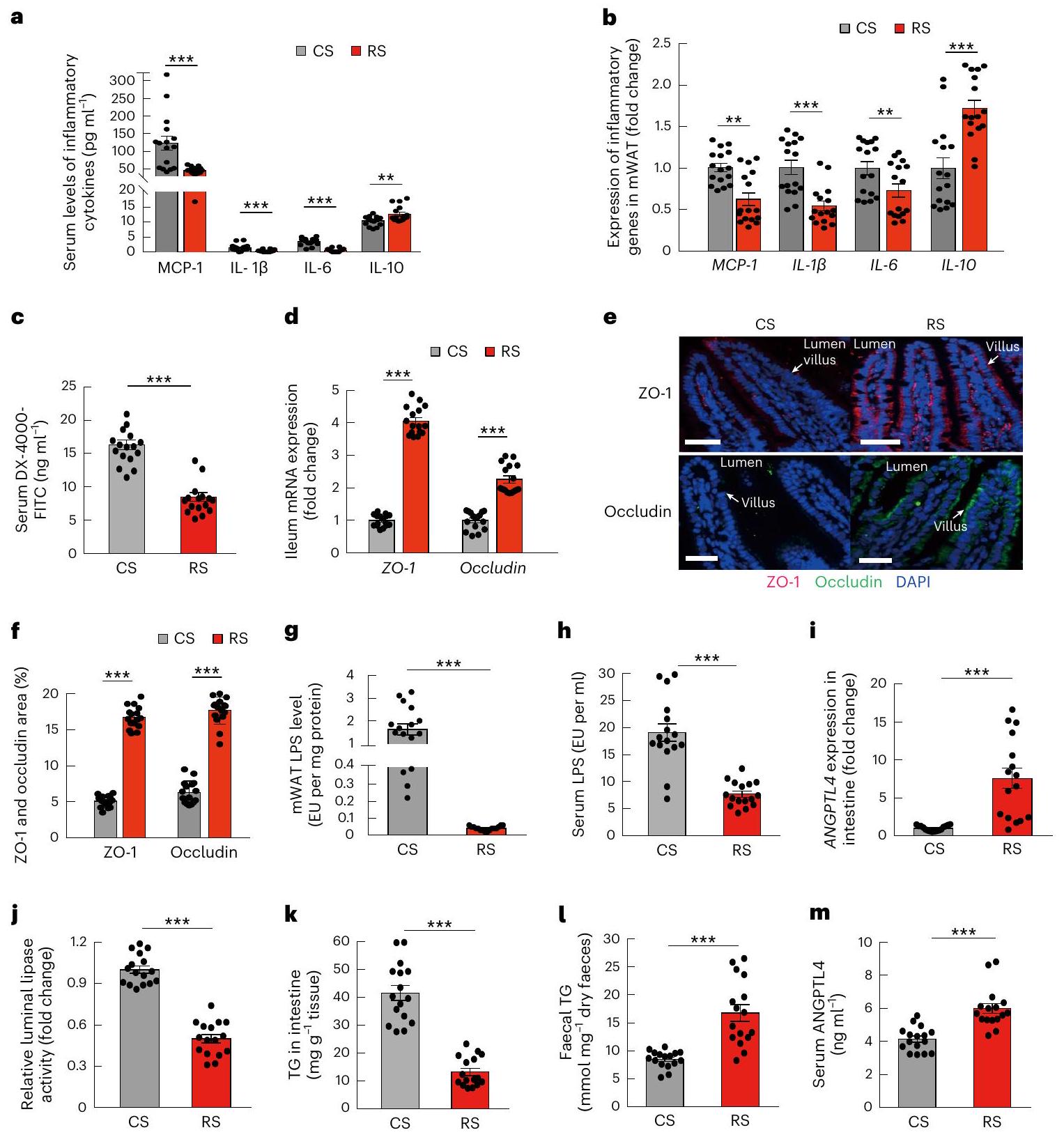
ميكروبات الأمعاء المعاد تشكيلها بواسطة RS تستعيد حاجز الأمعاء
الميكروبيوم المعوي المعدل بواسطة RS يقلل من امتصاص الدهون
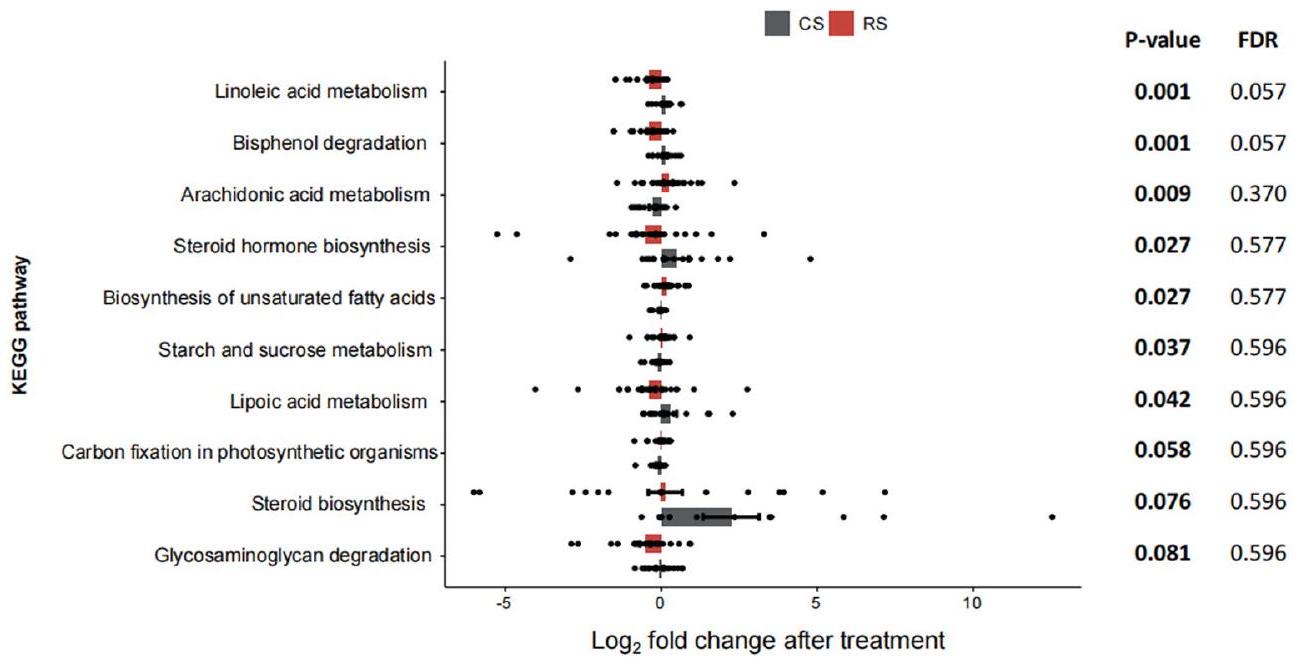
بين أحماض الصفراء والأنماط الظاهرية أو بين أحماض الصفراء والميكروبات. عرض الخط المتصل يعكس قوة الارتباط الخطي الإحصائي (أهمية متوسطة النموذج) بين تغير أحماض الصفراء (تغير مضاعف بعد التدخل) وتغير الأنماط الظاهرية (تغير مضاعف بعد التدخل) أو بين تغير الوفرة (تغير مضاعف بعد التدخل) وتغير أحماض الصفراء (تغير مضاعف بعد التدخل). الأهمية هي مجموع أوزان AIC لنماذج الانحدار الخطي العام التي تحتوي على مثل هذه المتغيرات خلال اختيار النموذج. حجم العقدة لأحماض الصفراء يعكس تأثيرها العام على جميع الأنماط الظاهرية أو الميكروبات. د، تحليل مسار KEGG يظهر العلاقة بين تغير أحماض الصفراء وتغير وفرة مسار KEGG.
(LPL) وأيضًا الليباز البنكرياسي، الذي يعمل كليباز معوي رئيسي
كانت مستويات ANGPTL4 المتداولة مرتفعة بشكل ملحوظ في الفئران المستعمرة بميكروبيوتا RS مقارنة بالفئران المستعمرة بميكروبيوتا CS. تشير هذه النتائج إلى أن التغيرات التي تسببها RS في ميكروبيوتا الأمعاء كانت قادرة على تقليل امتصاص الدهون من خلال تعديل ANGPTL4 المعوي.
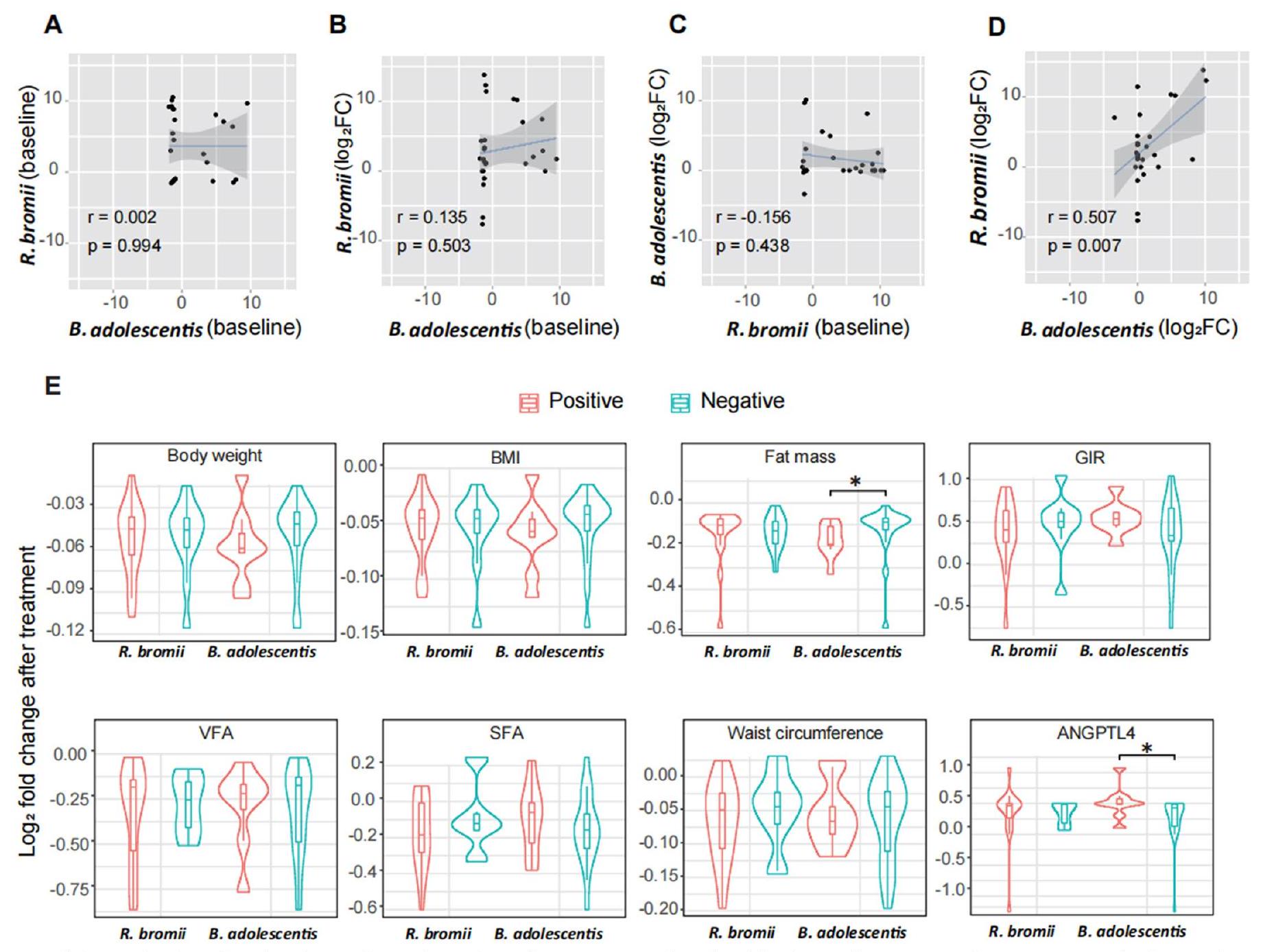
آثار ب. أدوليسنتيس على السمنة
(الشكل 1م). وجدنا أن العلاج بـ B. adolescentis في الفئران زاد من الحساسية لـ FGF21 في الأنسجة الدهنية من خلال قمع مسار LPS-TLR4-NF-кB (بيانات موسعة الشكل 8).
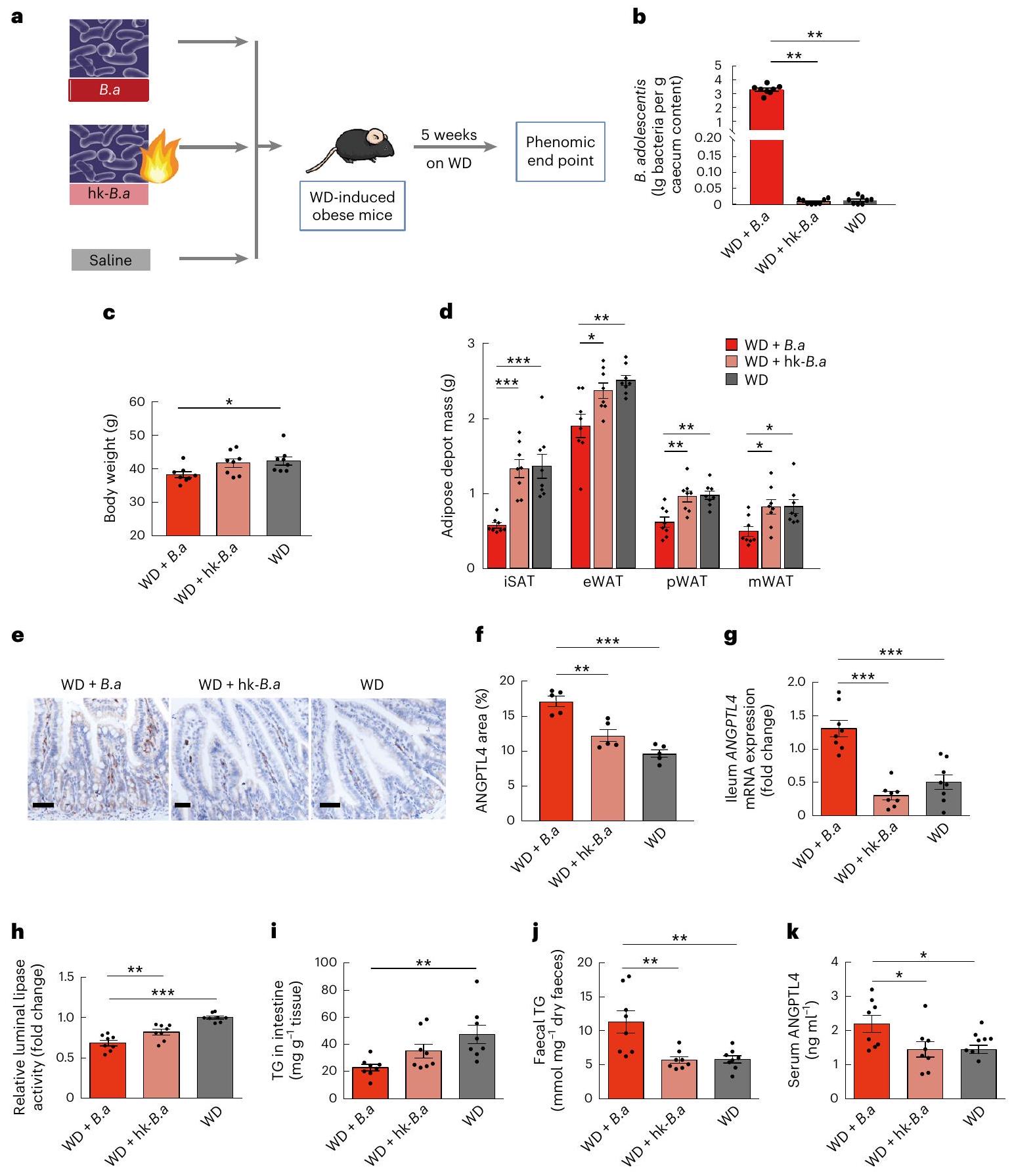
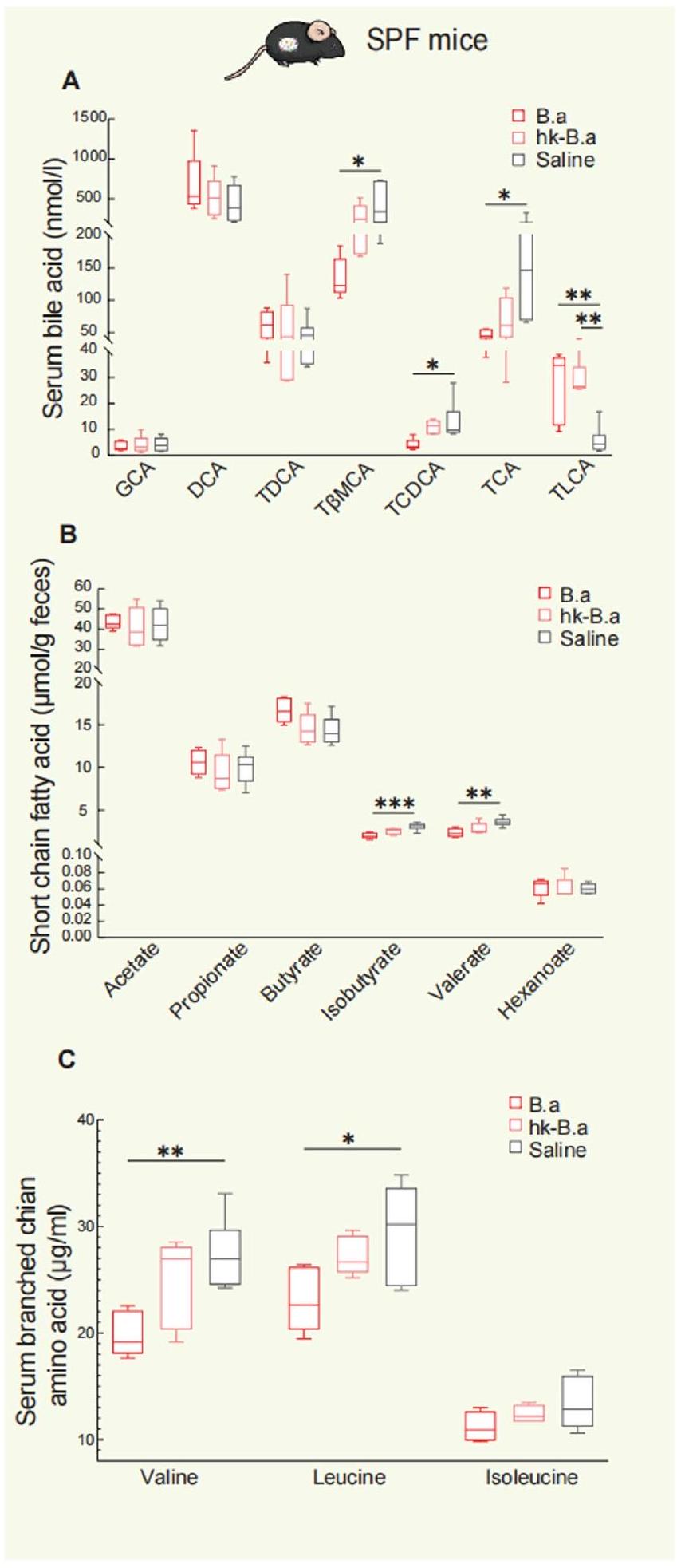
انخفضت مستويات الإيزوبيوتيرات والفاليرات بشكل كبير بعد تدخل ب. أدوليسنتيس (الشكل 9b من البيانات الموسعة). بالإضافة إلى ذلك، انخفضت مستويات الأحماض الأمينية المتفرعة السلسلة (BCAAs) في المصل، بما في ذلك الفالين والليوسين، بشكل كبير بعد
يساعد RS في فقدان الوزن جزئيًا من خلال B. adolescentis
مع PBS أو B. adolescentis الحية لمدة 8 أسابيع. حيث زادت محتويات الأمعاء وسمك اللمعة بشكل ملحوظ بعد تغذية RS، تم استخدام وزن الجسم المقطوع بشكل شائع لتقييم تأثير فقدان الوزن.
نقاش
محتوى النظام الغذائي اليومي مهم لتأثير RS. قدمت دراستنا توصية غذائية فعالة باستخدام RS كمكمل.
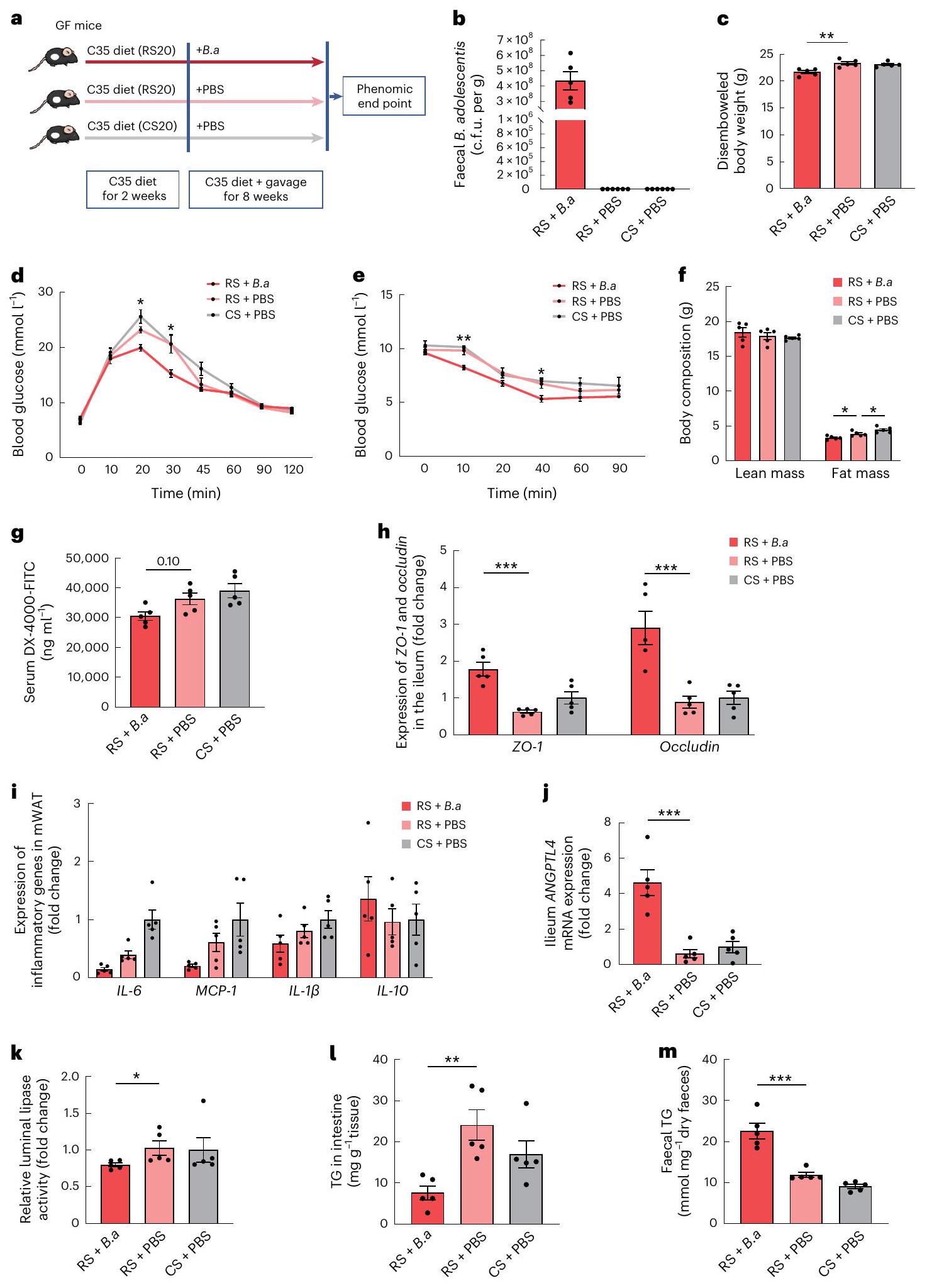
رسم تخطيطي لاستراتيجية مكملات B. adolescentis (B.a). تلقيح فموي لـ B. adolescentis أو PBS في الفئران الخالية من الجراثيم (GF) على أنظمة غذائية مع
قياس تركيزات مصل DX-4000-FITC بعد ساعة من إعطائه عن طريق الفم. h، تعبير ZO-1 و occludin في اللفائفي. i، تعبير الجينات الالتهابية في الماوات. j، مستويات تعبير mRNA لـ ANGPTL4 في اللفائفي. k، نشاط الليباز المعوي النسبي. l، مستويات TG في اللفائفي. m، مستويات TG في البراز. البيانات هي متوسط
لقد حظيت باهتمام كبير فيما يتعلق بميكروبات الأمعاء. أظهرت الفئران الخالية من الجراثيم زيادة في تعبير ANGPTL4 المعوي مقارنة بالفئران التي تربى بشكل تقليدي.
طرق
المشاركون في الدراسة
البروتوكول العام للتجربة السريرية
التقييمات الأنثروبومترية والبيوكيميائية
تجربة MTT
تثبيت الأنسولين العالي-السكر الطبيعي
استخراج وتسلسل الحمض النووي من البراز
تحليل الميتاجينوميات
تم إجراء عدم التشابه في تغيير وفرة الأنواع على مستوى الأنواع، كما هو موضح أعلاه، باستخدام حزمة R VEGAN
تحليل الميتابولوميات لعينات مصل الإنسان
تحليل الميتابولوميات لعينات البراز البشرية
تقييم الدهون البرازية
نموذج الفأر
منشأة حواجز خالية من مسببات الأمراض المحددة في أقفاص ذات تهوية فردية بحد أقصى أربعة فئران لكل قفص، مع وصول حر إلى الطعام والماء تحت دورة ضوء وظلام صارمة مدتها 12 ساعة عند درجة حرارة مضبوطة.
تجربة FMT
سلالة بكتيرية
(سيغما-ألدريتش)، محلول ملحي و
PBS معقم لاهوائي عن طريق التغذية ثلاث مرات في الأسبوع لمدة 8 أسابيع.
, BMS6002؛ IL-6، BMS603-2؛ IL-10، BMS614INST) وFGF21 (Immunodiagnostics Limited، 32180) باستخدام ELISA. تم قياس مستويات LPS في الأنسجة الدهنية البيضاء الميزنتيرية والمصل من خلال اختبار LAL (Hycult Biotechnology، HIT302).
لأحماض SCFA الأخرى. تم إجراء اكتشاف القمة والتكامل باستخدام التحليل الكمي (Agilent). تم استخدام النتائج التي تم قياسها بواسطة منحنى القياس لتحليل الميزات. تم إجراء جميع ملفات الميتابولوميات في الفئران في مختبر CAS الرئيسي لعلوم الفصل الكيميائي.
FGF21 الفأري المعاد تركيبه أو مركبة عبر الوريد عبر الوريد الأجوف السفلي. بعد 15 دقيقة، تم أخذ خزعة دهنية تحت الجلد الثانية لتقييم التعبير الجيني وفوسفاتة Erk1/2.
الفحص النسيجي
نشاط الليباز اللميني
التحليل الغربي
التحليل الإحصائي
ملخص التقرير
توفر البيانات
توفر الشيفرة
References
- Waxman, A. & World Health, A. WHO global strategy on diet, physical activity and health. Food Nutr. Bull. 25, 292-302 (2004).
- Torres-Fuentes, C., Schellekens, H., Dinan, T. G. & Cryan, J. F. The microbiota-gut-brain axis in obesity. Lancet Gastroenterol. Hepatol. 2, 747-756 (2017).
- Backhed, F. et al. The gut microbiota as an environmental factor that regulates fat storage. Proc. Natl Acad. Sci. USA 101, 15718-15723 (2004).
- Turnbaugh, P. J. et al. An obesity-associated gut microbiome with increased capacity for energy harvest. Nature 444, 1027-1031 (2006).
- Kootte, R. S. et al. Improvement of insulin sensitivity after lean donor feces in metabolic syndrome is driven by baseline intestinal microbiota composition. Cell Metab. 26, 611-619 e616 (2017).
- de Groot, P. et al. Donor metabolic characteristics drive effects of faecal microbiota transplantation on recipient insulin sensitivity, energy expenditure and intestinal transit time. Gut 69, 502-512 (2020).
- Carmody, R. N. & Bisanz, J. E. Roles of the gut microbiome in weight management. Nat. Rev. Microbiol. 21, 535-550 (2023).
- Gibson, G. R. et al. Expert consensus document: The International Scientific Association for Probiotics and Prebiotics (ISAPP) consensus statement on the definition and scope of prebiotics. Nat. Rev. Gastroenterol. Hepatol. 14, 491-502 (2017).
- Delannoy-Bruno, O. et al. Evaluating microbiome-directed fibre snacks in gnotobiotic mice and humans. Nature 595, 91-95 (2021).
- Bindels, L. B., Delzenne, N. M., Cani, P. D. & Walter, J. Towards a more comprehensive concept for prebiotics. Nat. Rev. Gastroenterol. Hepatol. 12, 303-310 (2015).
- Englyst, H. N. & Cummings, J. H. Digestion of the polysaccharides of some cereal foods in the human small intestine. Am. J. Clin. Nutr. 42, 778-787 (1985).
- Higgins, J. A. Resistant starch and energy balance: impact on weight loss and maintenance. Crit. Rev. Food Sci. Nutr. 54, 1158-1166 (2014).
- Wali, J. A. et al. Impact of dietary carbohydrate type and protein-carbohydrate interaction on metabolic health. Nat. Metab. 3, 810-828 (2021).
- Robertson, M. D. et al. Insulin-sensitizing effects on muscle and adipose tissue after dietary fiber intake in men and women with metabolic syndrome. J. Clin. Endocrinol. Metab. 97, 3326-3332 (2012).
- Johnston, K. L., Thomas, E. L., Bell, J. D., Frost, G. S. & Robertson, M. D. Resistant starch improves insulin sensitivity in metabolic syndrome. Diabet. Med. 27, 391-397 (2010).
- Maki, K. C. et al. Resistant starch from high-amylose maize increases insulin sensitivity in overweight and obese men. J. Nutr. 142, 717-723 (2012).
- Coate, K. C. & Huggins, K. W. Consumption of a high glycemic index diet increases abdominal adiposity but does not influence adipose tissue pro-oxidant and antioxidant gene expression in C57BL/6 mice. Nutr. Res. 30, 141-150 (2010).
- Charrier, J. A. et al. High fat diet partially attenuates fermentation responses in rats fed resistant starch from high-amylose maize. Obesity 21, 2350-2355 (2013).
- DeMartino, P. & Cockburn, D. W. Resistant starch: impact on the gut microbiome and health. Curr. Opin. Biotechnol. 61, 66-71 (2020).
- Chen, C., Lu, F. C. & Department of Disease Control Ministry of Health, PR China. The guidelines for prevention and control of overweight and obesity in Chinese adults. Biomed. Environ. Sci. 17, 1-36 (2004).
- Jensen, M. D. et al. 2013 AHA/ACC/TOS guideline for the management of overweight and obesity in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and The Obesity Society. Circulation 129, S102-S138 (2014).
- Cox, A. J., West, N. P. & Cripps, A. W. Obesity, inflammation, and the gut microbiota. Lancet Diabetes Endocrinol. 3, 207-215 (2015).
- Martinez-Guryn, K. et al. Small intestine microbiota regulate host digestive and absorptive adaptive responses to dietary lipids. Cell Host Microbe 23, 458-469 (2018).
- Geng, L., Lam, K. S. L. & Xu, A. The therapeutic potential of FGF21 in metabolic diseases: from bench to clinic. Nat. Rev. Endocrinol. 16, 654-667 (2020).
- Baxter, N. T. et al. Dynamics of human gut microbiota and short-chain fatty acids in response to dietary interventions with three fermentable fibers. mBio 10, e02566-18 (2019).
- Kadyan, S., Sharma, A., Arjmandi, B. H., Singh, P. & Nagpal, R. Prebiotic potential of dietary beans and pulses and their resistant starch for aging-associated gut and metabolic health. Nutrients 14, 1726 (2022).
- Vital, M. et al. Metagenomic insights into the degradation of resistant starch by human gut microbiota. Appl. Environ. Microbiol. 84, e01562-18 (2018).
- Krautkramer, K. A., Fan, J. & Backhed, F. Gut microbial metabolites as multi-kingdom intermediates. Nat. Rev. Microbiol. 19, 77-94 (2021).
- Heianza, Y. et al. Changes in gut microbiota-related metabolites and long-term successful weight loss in response to weight-loss diets: the POUNDS Lost trial. Diabetes Care 41, 413-419 (2018).
- Adams, S. H. Emerging perspectives on essential amino acid metabolism in obesity and the insulin-resistant state. Adv. Nutr. 2, 445-456 (2011).
- Foley, M. H., O’Flaherty, S., Barrangou, R. & Theriot, C. M. Bile salt hydrolases: gatekeepers of bile acid metabolism and host-microbiome crosstalk in the gastrointestinal tract. PLoS Pathog. 15, e1007581 (2019).
- Mattijssen, F. et al. Angptl4 serves as an endogenous inhibitor of intestinal lipid digestion. Mol. Metab. 3, 135-144 (2014).
- Higgins, J. A. et al. Resistant starch and exercise independently attenuate weight regain on a high fat diet in a rat model of obesity. Nutr. Metab. 8, 49 (2011).
- Wahlstrom, A., Sayin, S. I., Marschall, H. U. & Backhed, F. Intestinal crosstalk between bile acids and microbiota and its impact on host metabolism. Cell Metab. 24, 41-50 (2016).
- Upadhyaya, B. et al. Impact of dietary resistant starch type 4 on human gut microbiota and immunometabolic functions. Sci. Rep. 6, 28797 (2016).
- Ravussin, Y. et al. Responses of gut microbiota to diet composition and weight loss in lean and obese mice. Obesity 20, 738-747 (2012).
- Zhang, L. et al. Metabolic phenotypes and the gut microbiota in response to dietary resistant starch type 2 in normal-weight subjects: a randomized crossover trial. Sci. Rep. 9, 4736 (2019).
- Bendiks, Z. A., Knudsen, K. E. B., Keenan, M. J. & Marco, M. L. Conserved and variable responses of the gut microbiome to resistant starch type 2. Nutr. Res. 77, 12-28 (2020).
- Golden, J. M. et al. Ursodeoxycholic acid protects against intestinal barrier breakdown by promoting enterocyte migration via EGFR- and COX-2-dependent mechanisms. Am. J. Physiol. Gastrointest. Liver Physiol. 315, G259-G271 (2018).
- Quintero, P. et al. Bile acid supplementation improves established liver steatosis in obese mice independently of glucagon-like peptide-1 secretion. J. Physiol. Biochem. 70, 667-674 (2014).
- Nie, B. et al. Specific bile acids inhibit hepatic fatty acid uptake in mice. Hepatology 56, 1300-1310 (2012).
- Schneider, K. M., Albers, S. & Trautwein, C. Role of bile acids in the gut-liver axis. J. Hepatol. 68, 1083-1085 (2018).
- Ni, Y. et al. Resistant starch decreases intrahepatic triglycerides in patients with NAFLD via gut microbiome alterations. Cell Metab. 35, 1530-1547 (2023).
- Jaskiewicz, J. et al. Catabolism of isobutyrate by colonocytes. Arch. Biochem. Biophys. 327, 265-270 (1996).
- Oliphant, K. & Allen-Vercoe, E. Macronutrient metabolism by the human gut microbiome: major fermentation by-products and their impact on host health. Microbiome 7, 91 (2019).
- Dijk, W. & Kersten, S. Regulation of lipoprotein lipase by Angptl4. Trends Endocrinol. Metab. 25, 146-155 (2014).
- Long, X. et al. Bifidobacterium adolescentis alleviates liver steatosis and steatohepatitis by increasing fibroblast growth factor 21 sensitivity. Front. Endocrinol. 12, 773340 (2021).
- Geng, L. et al. Exercise alleviates obesity-induced metabolic dysfunction via enhancing FGF21 sensitivity in adipose tissues. Cell Rep. 26, 2738-2752 (2019).
- van Baak, M. A. & Mariman, E. C. M. Mechanisms of weight regain after weight loss – the role of adipose tissue. Nat. Rev. Endocrinol. 15, 274-287 (2019).
- Jia, W. et al. Association of serum retinol-binding protein 4 and visceral adiposity in Chinese subjects with and without type 2 diabetes. J. Clin. Endocrinol. Metab. 92, 3224-3229 (2007).
- Li, J. et al. Probiotics modulated gut microbiota suppresses hepatocellular carcinoma growth in mice. Proc. Natl Acad. Sci. USA 113, E1306-E1315 (2016).
- Li, H. & Durbin, R. Fast and accurate short read alignment with Burrows-Wheeler transform. Bioinformatics 25, 1754-1760 (2009).
- Segata, N. et al. Metagenomic microbial community profiling using unique clade-specific marker genes. Nat. Methods 9, 811-814 (2012).
- Dixon, P. VEGAN, a package of
functions for community ecology. J. Vegetation Sci. 14, 927-930 (2003). - Shannon, P. et al. Cytoscape: a software environment for integrated models of biomolecular interaction networks. Genome Res. 13, 2498-2504 (2003).
- Peng, Y., Leung, H. C., Yiu, S. M. & Chin, F. Y. IDBA-UD: a de novo assembler for single-cell and metagenomic sequencing data with highly uneven depth. Bioinformatics 28, 1420-1428 (2012).
- Ni, Y., Li, J. & Panagiotou, G. COMAN: a web server for comprehensive metatranscriptomics analysis. BMC Genomics 17, 622 (2016).
- Zhu, W., Lomsadze, A. & Borodovsky, M. Ab initio gene identification in metagenomic sequences. Nucleic Acids Res. 38, e132 (2010).
- Xie, C. et al. KOBAS 2.0: a web server for annotation and identification of enriched pathways and diseases. Nucleic Acids Res. 39, W316-W322 (2011).
- Rohart, F., Gautier, B., Singh, A. & Le Cao, K. A. mixOmics: an
package for ‘omics feature selection and multiple data integration. PLoS Comput. Biol. 13, e1005752 (2017). - Liu, R. et al. Gut microbiome and serum metabolome alterations in obesity and after weight-loss intervention. Nat. Med. 23, 859-868 (2017).
- Xie, G. et al. Dysregulated hepatic bile acids collaboratively promote liver carcinogenesis. Int J. Cancer 139, 1764-1775 (2016).
- Xie, G. et al. Profiling of serum bile acids in a healthy Chinese population using UPLC-MS/MS. J. Proteome Res. 14, 850-859 (2015).
- Lan, K. et al. Key role for the 12 -hydroxy group in the negative ion fragmentation of unconjugated c24 bile acids. Anal. Chem. 88, 7041-7048 (2016).
- Zhao, L. et al. High throughput and quantitative measurement of microbial metabolome by gas chromatography/mass spectrometry using automated alkyl chloroformate derivatization. Anal. Chem. 89, 5565-5577 (2017).
- Govers, M. J. & Van der Meet, R. Effects of dietary calcium and phosphate on the intestinal interactions between calcium, phosphate, fatty acids, and bile acids. Gut 34, 365-370 (1993).
- Cho, K. D., Han, C. K. & Lee, B. H. Loss of body weight and fat and improved lipid profiles in obese rats fed apple pomace or apple juice concentrate. J. Med. Food 16, 823-830 (2013).
- Wong, C. M. et al. Adropin is a brain membrane-bound protein regulating physical activity via the NB-3/Notch signaling pathway in mice. J. Biol. Chem. 289, 25976-25986 (2014).
- Zhang, Y. et al. Gut microbiome-related effects of berberine and probiotics on type 2 diabetes (the PREMOTE study). Nat. Commun. 11, 5015 (2020).
- Haarman, M. & Knol, J. Quantitative real-time PCR assays to identify and quantify fecal Bifidobacterium species in infants receiving a prebiotic infant formula. Appl. Environ. Microbiol. 71, 2318-2324 (2005).
شكر وتقدير
الأكاديمية الصينية للعلوم (XDB38020200) إلى G.X.; جمعية تعزيز الابتكار للشباب التابعة للأكاديمية الصينية للعلوم (2021186) إلى X. Liu.; وجامعة بوليتكنك هونغ كونغ (POO42740) إلى P.L.
مساهمات المؤلفين
المصالح المتنافسة
معلومات إضافية
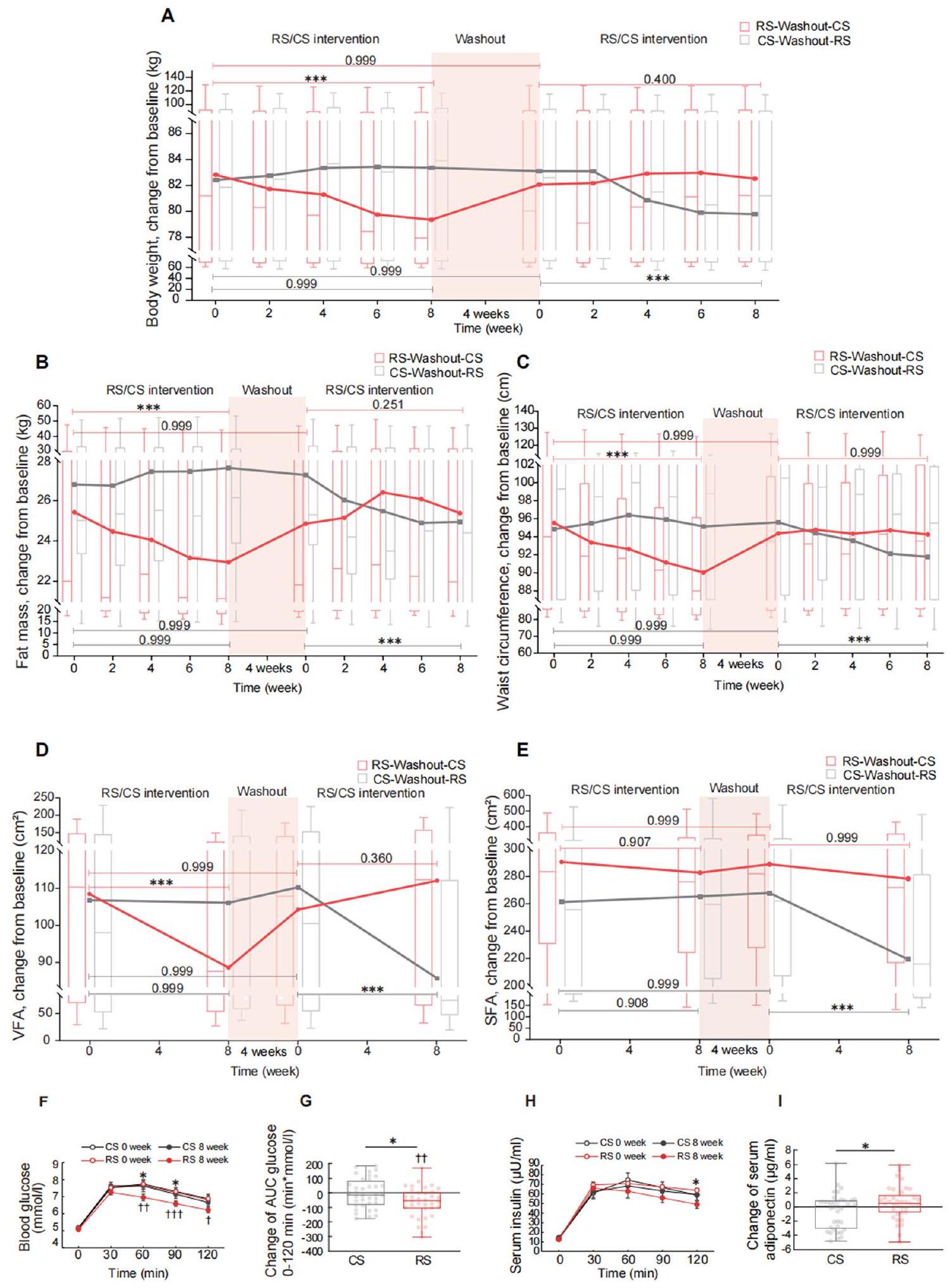
(أ-هـ) مخططات الصندوق (مع الوسيط) تظهر التغيرات الديناميكية في (أ) وزن الجسم، (ب) كتلة الدهون، و(ج) محيط الخصر كل أسبوعين من التدخل، بالإضافة إلى (د) الدهون الحشوية (VFA) و(هـ) منطقة الدهون تحت الجلد (SFA) كل 4 أسابيع من التدخل. الخطوط تربط بين متوسطات النتائج في نقاط زمنية مختلفة. الخط الأفقي يمثل نتائج تحليل النموذج المختلط الخطي متبوعًا باختبار بونفيروني الذي تم إجراؤه لمقارنة النقاط النهائية المتصلة. مجموعة RS-Washout-CS،
(ح) مستوى الأنسولين في المصل. (ط) تغيير مستوى الأديبونيكتين في المصل الذي تم تقييمه بواسطة ELISA في الأشخاص قبل وبعد تدخل RS أو CS لمدة 8 أسابيع.
أ




الملخص
مجموعة RS-Washout-CS باستخدام طريقة مسافة براى-كورتيس. (د) تنوع بيتا لمجموعة CS-Washout-RS باستخدام طريقة مسافة Unifrac الموزونة. (هـ) تنوع بيتا لمجموعة RS-Washout-CS باستخدام طريقة مسافة Unifrac الموزونة. جميع مخططات تنوع بيتا استخدمت التحجيم متعدد الأبعاد غير المترية (NMDS) بناءً على الملف التكويني لوفرة الأنواع. تدعم نتائج ANOSIM القابلية للمقارنة الأساسية للتراكيب الميكروبية.

(أ) قوة الارتباط الخطي (أهمية معيار أكايكي للمعلومات المتوسطة [AIC]) بين تغير وفرة الأنواع (التغير النسبي بعد التدخل) وتغير (التغير النسبي بعد التدخل) للمواد الأيضية الدائرة. الأهمية هي الأوزان المجمعة لمعيار AIC للنماذج الخطية التي تحتوي على هذا المتغير خلال اختيار النموذج. (ب-ز) تغييرات الأحماض الدهنية قصيرة السلسلة في البراز بعد تدخل RS أو CS لمدة 8 أسابيع.
مجموعة). (ب) أسيتات. (ج) بروبيونات. (د) بيوتيرات. (هـ) إيزوبيوتيرات. (و) فاليرات. (ز) هيكسانوات. البيانات معبّر عنها كوسيط مع نطاق ربعي.
تم قياس (أ) الإنفاق، (ب) نسبة تبادل التنفس (RER)، (ج) استهلاك الأكسجين، (د) إنتاج ثاني أكسيد الكربون، (هـ) النشاط، و(و) تناول الطعام باستخدام نظام مراقبة الحيوانات المعملية الشامل في نهاية التجربة. (ز) تم إجراء اختبار تحمل الجلوكوز (GTT) في الفئران المستعمرة بالميكروبيوتا من متبرعي RS أو CS. (ح) تحليل المساحة تحت المنحنى (AUC) لاختبار GTT. (ط) تم قياس مستويات الأديبونيكتين في المصل في نهاية زراعة الميكروبيوتا البرازية.
(ب) مستويات الأحماض الدهنية قصيرة السلسلة في البراز. (ج) مستويات الفالين، الإيزوليوسين، والليوسين في المصل.
(د) مستويات GCA، DCA، T
(هـ) مستويات الأحماض الدهنية قصيرة السلسلة في براز الفئران الخالية من الجراثيم. (و) مستويات الفالين، الإيزوليوسين، والليوسين في مصل الفئران الخالية من الجراثيم. تُعرض البيانات على شكل مخططات صندوقية مع خطوط.


محفظة الطبيعة
المؤلف(المؤلفون) المراسل(ون): هويتنج لي و شينيو ليو
ملخص التقرير
الإحصائيات
يجب أن تُوصف الاختبارات الشائعة فقط بالاسم؛ واصفًا التقنيات الأكثر تعقيدًا في قسم الطرق.
X
وصف كامل للمعلمات الإحصائية بما في ذلك الاتجاه المركزي (مثل المتوسطات) أو تقديرات أساسية أخرى (مثل معامل الانحدار) والتباين (مثل الانحراف المعياري) أو تقديرات عدم اليقين المرتبطة (مثل فترات الثقة)
X لتصميمات هرمية ومعقدة، تحديد المستوى المناسب للاختبارات والتقارير الكاملة عن النتائج
تقديرات أحجام التأثير (مثل حجم تأثير كوهين)
تحتوي مجموعتنا على الإنترنت حول الإحصائيات لعلماء الأحياء على مقالات تتناول العديد من النقاط المذكورة أعلاه.
البرمجيات والشيفرة
تم استخدام برنامج EpiData 3.1 لجمع البيانات وإدخالها وتوثيقها.
بالنسبة للمخطوطات التي تستخدم خوارزميات أو برامج مخصصة تكون مركزية في البحث ولكن لم يتم وصفها بعد في الأدبيات المنشورة، يجب أن تكون البرمجيات متاحة للمحررين والمراجعين. نحن نشجع بشدة على إيداع الشيفرة في مستودع مجتمعي (مثل GitHub). راجع إرشادات مجموعة Nature لتقديم الشيفرة والبرمجيات لمزيد من المعلومات.
بيانات
يجب أن تتضمن جميع المخطوطات بيانًا حول توفر البيانات. يجب أن يوفر هذا البيان المعلومات التالية، حيثما ينطبق:
- رموز الانضمام، معرفات فريدة، أو روابط ويب لمجموعات البيانات المتاحة للجمهور
- وصف لأي قيود على توفر البيانات
- بالنسبة لمجموعات البيانات السريرية أو بيانات الطرف الثالث، يرجى التأكد من أن البيان يتماشى مع سياستنا.
تم إيداعها في أرشيف قراءة التسلسل التابع لمركز المعلومات البيولوجية الوطني تحت معرف الوصول PRJNA414688 وهي متاحة للجمهور اعتبارًا من تاريخ النشر. أي معلومات إضافية مطلوبة لإعادة تحليل البيانات المبلغ عنها في هذه الورقة متاحة من جهة الاتصال الرئيسية ويبينغ جيا.wpjia@sjtu.edu.cnعند الطلب.
البحث الذي يتضمن مشاركين بشريين، بياناتهم، أو مواد بيولوجية
| التقارير عن الجنس والنوع الاجتماعي | كان هناك 37 شخصًا يعانون من زيادة الوزن أو السمنة أكملوا التجربة، بما في ذلك 22 ذكرًا و15 أنثى. |
| التقارير عن العرق أو الإثنية أو غيرها من التجمعات الاجتماعية ذات الصلة | لم يتم إجراء أي تصنيف اجتماعي مُنشأ أو ذي صلة اجتماعية في اختيار المشاركين في الدراسة. |
| خصائص السكان | كان متوسط عمر المشاركين
|
| التوظيف | سيتم تجنيد المشاركين من خلال إعلانات عامة من شنغهاي، الصين، من يوليو 2013 إلى 2016. بمجرد تأكيد الأهلية، سيقوم طبيب بإبلاغ المشارك بالكامل عن التجربة. نظرًا لأن المشاركين قد أشاروا بأنفسهم إلى الدراسة، فقد يكون هذا قد تسبب في انحياز في الاختيار نحو الأشخاص الأكثر صحة. وبالتالي، قد لا يمكن تعميم نتائج الدراسة على جميع السكان الذين يعانون من زيادة الوزن. |
| رقابة الأخلاقيات | تمت الموافقة على الدراسة من قبل لجنة الأخلاقيات في مستشفى الشعب السادس التابع لجامعة شنغهاي جياو تونغ، وفقًا لمبدأ إعلان هلسنكي. |
التقارير المتخصصة في المجال
علوم الحياة العلوم السلوكية والاجتماعية العلوم البيئية والتطورية والبيئية
لنسخة مرجعية من الوثيقة بجميع الأقسام، انظرnature.com/documents/nr-reporting-summary-flat.pdf
تصميم دراسة العلوم الحياتية
| حجم العينة |
|
||
| استثناءات البيانات | لم يتم استبعاد أي بيانات من التحليل. | ||
| التكرار |
|
||
| العشوائية | قام باحث مستقل بإجراء العشوائية وتعيين المشاركين إلى نظام تدخل CS-washout-RS أو RS-washout-CS بنسبة تخصيص من
|
||
| عمى | تم تعبئة RS و CS في أكياس محكمة الإغلاق كانت متطابقة في المظهر، ولم يكن المشاركون والمحققون على علم بمحتويات نشا الدراسة ونظام التوزيع العشوائي خلال فترة التعمية المزدوجة. فقط مصمم البحث كان يعرف نظام التوزيع العشوائي. كان المشاركون والمحققون والموظفون السريريون ومقيّمو النتائج غير مدركين لتسلسل التخصيص خلال جمع البيانات وتحليلها. تم رفع التعمية عندما تم إجراء التحليل البيوانفورماتيكي لاستكشاف الآلية المحتملة التي من خلالها يمنح ميكروبيوم الأمعاء الفوائد الفسيولوجية لـ RS. لم يكن المحققون معميين عن التجارب على الحيوانات حيث كان من الضروري معرفة علاج كل فأر للشخص الذي يتعامل مع الفئران. عند الإمكان، تم إجراء تحليل البيانات بشكل أعمى. |
التقارير عن مواد وأنظمة وطرق محددة
| المواد والأنظمة التجريبية | طرق | ||
| غير متوفر | مشارك في الدراسة | غير متوفر | مشارك في الدراسة |
 |
أجسام مضادة X |  |
تسلسل شريحة الكروماتين |
 |
 |
 |
تدفق الخلايا |
 |
علم الحفريات وعلم الآثار |  |
تصوير الأعصاب باستخدام الرنين المغناطيسي |
 |
|||
 |
البيانات السريرية | ||
 |
البحث ذو الاستخدام المزدوج الذي يثير القلق | ||
 |
 |
||
الأجسام المضادة
| الأجسام المضادة المستخدمة | أجسام مضادة ZO1 (Abcam، ab96587، تخفيف 1:500، أجسام مضادة متعددة النسائل للأرنب لبروتين ZO1)؛ أجسام مضادة أوكلودين (Abcam، ab216327، تخفيف 1:100، أجسام مضادة أحادية النسيلة للأرنب [EPR20992] لأوكلودين)؛ أجسام مضادة ANGPTL4 (Proteintech، 18374-1-AP، تخفيف 1:500، أجسام مضادة متعددة النسائل للأرنب لـ ANGPTL4)؛ أجسام مضادة Erk1/2 (Cell Signaling Technology، 9102، تخفيف 1:1000، أجسام مضادة متعددة النسائل للأرنب لـ Erk1/2)؛ pErk1/2 (Thr202/Tyr204) (Cell Signaling Technology، 9101، تخفيف 1:1000، أجسام مضادة متعددة النسائل للأرنب لـ p-Erk1/2)؛ أجسام مضادة ثانوية Rabbit IgG (H+L) (Thermo، 31460، تخفيف 1:2500). |
| التحقق | تم التحقق من الأجسام المضادة ZO1 و Occludin في مختبرنا (الدورة الدموية 133، 2434-2446، 2016). تم التحقق من الأجسام المضادة Erk1/2 و pErk1/2 في مختبرنا (Front Endocrinol (Lausanne) 30:12:773340، 2021). تم التحقق من جسم ANGPTL4 المضاد على الموقع http://www.ptglab.com/Products/ANGPTL4-Antibody-18374-1-AP.htm#validation. |
الحيوانات وغيرها من الكائنات البحثية
| الحيوانات المخبرية | للتجربة المتعلقة بزراعة البراز، تم تربية ذكور الفئران من سلالة C57BL/6 بعمر عشرة أسابيع في بيئة تقليدية. بالنسبة لإعطاء بكتيريا B. adolescentis، تم تربية ذكور الفئران من سلالة C57BL/6 بعمر ثمانية أسابيع في بيئة تقليدية. تم تربية وصيانة ذكور الفئران الخالية من الجراثيم من سلالة C57BL/6J بعمر خمسة أسابيع في عوازل بلاستيكية خاصة. تم الاحتفاظ بجميع الحيوانات تحت دورات ضوء وظلام لمدة 12 ساعة عند درجة حرارة مضبوطة.
|
| الحيوانات البرية | لم تتضمن الدراسة حيوانات برية. |
| التقارير عن الجنس | نظرًا لأن إناث الفئران من سلالة C57BL/6J يُبلغ عن كونهن أكثر مقاومة للتأثيرات المسببة للسمنة لنظام الغذاء عالي الدهون (Int J Obes (Lond) 46(10):1749-1758، 2022)، تم استخدام ذكور الفئران من سلالة C57BL/6J في هذه الدراسة. |
| عينات تم جمعها من الميدان | لم تتضمن الدراسة عينات تم جمعها من الميدان. |
| رقابة الأخلاقيات | تمت الموافقة على إجراءات التجارب الحيوانية من قبل لجنة استخدام الحيوانات الحية للتعليم والبحث في جامعة هونغ كونغ ولجنة أخلاقيات الحيوانات في مستشفى الشعب السادس في شنغهاي التابع لكلية الطب بجامعة جياو تونغ في شنغهاي. |
البيانات السريرية
يجب أن تتوافق جميع المخطوطات مع إرشادات ICMJE لنشر الأبحاث السريرية ويجب أن تتضمن جميع التقديمات قائمة مراجعة CONSORT مكتملة.
| تسجيل التجارب السريرية | تم تسجيل هذه التجربة في السجل الصيني للتجارب السريرية كـ ChiCTR-TTRCC 13003333. |
| بروتوكول الدراسة | تم إيداع بروتوكول الدراسة المفصل في المنصة العامة لإدارة التجارب السريرية الصينية (Resman) ويمكن العثور عليه في المعلومات التكميلية. |
| جمع البيانات | تم استخدام استمارة جمع البيانات لجمع المعلومات خلال الدراسة. تم تخزين الملفات الأصلية في مستشفى الشعب السادس التابع لجامعة جياو تونغ في شنغهاي. تم إدخال جميع البيانات مرتين بواسطة موظفي الباحثين. بعد التحقق منها واعتبارها صحيحة في مراجعة عمياء، تم قفل قاعدة البيانات، ولا يمكن إجراء أي تعديل. تم تجنيد المشاركين من يوليو 2013 إلى أكتوبر 2016. تم جمع البيانات في المركز السريري للسكري في شنغهاي من يوليو 2013 إلى أكتوبر 2016. |
| النتائج | كانت النتيجة الرئيسية هي تغيير وزن الجسم المقاس باستخدام محلل تكوين الجسم (تانيتا، TBF-410) بعد تدخل RS مقابل تدخل CS، وكانت النتائج الثانوية هي مساحة الدهون تحت الجلد ومساحة الدهون الحشوية التي تم تقييمها باستخدام جهاز التصوير بالرنين المغناطيسي السريري 3.0 تسلا (أرشيفا، نظام فيليبس الطبي)، وتحليل الدهون في الجسم بواسطة محلل تكوين الجسم، ومحيط الخصر بواسطة القياسات الأنثروبومترية، وملفات الدهون بواسطة التقييمات الكيميائية الحيوية، وحساسية الأنسولين بواسطة قفل الهيبرينسولينيك-يوغليكي. |
| مخزونات البذور | تقرير عن مصدر جميع مخزونات البذور أو المواد النباتية الأخرى المستخدمة. إذا كان ذلك مناسبًا، يرجى ذكر مركز مخزون البذور ورقم الفهرس. إذا تم جمع عينات نباتية من الحقل، يرجى وصف موقع الجمع، التاريخ وإجراءات أخذ العينات. | ||
| أنماط جينية نباتية جديدة | وصف الطرق التي تم من خلالها إنتاج جميع الأنماط الجينية النباتية الجديدة. يشمل ذلك تلك التي تم إنشاؤها من خلال الأساليب الجينية المتحولة، وتحرير الجينات، والطفرات المعتمدة على المواد الكيميائية/الإشعاع، والتهجين. بالنسبة لخطوط الجينات المتحولة، وصف طريقة التحويل، وعدد الخطوط المستقلة التي تم تحليلها، والجيل الذي أجريت عليه التجارب. بالنسبة لخطوط تحرير الجينات، وصف المحرر المستخدم، والتسلسل الداخلي المستهدف للتحرير، وتسلسل RNA الدليل المستهدف (إذا كان ذلك مناسبًا) وكيفية عمل المحرر. | ||
| المصادقة |
|
- تظهر قائمة كاملة بالانتماءات في نهاية الورقة.
-البريد الإلكتروني: huarting99@sjtu.edu.cn; liuxy2012@dicp.ac.cn; Gianni.Panagiotou@hki-jena.de; amxu@hku.hk; wpjia@sjtu.edu.cn - مستويات ANGPTL4. م، تغيير في مستويات FGF21 في المصل.
الأفراد ( ) ، الأفراد (e، f، i)، أفراد ( ) و الأفراد ( ) إما لـ RS أو CS. تم استخدام تحليل التباين المشترك (ANCOVA) المعدل بالقيمة الأساسية للمقارنة بين RS و CS في كل زيارة (ب-د). تُعرض البيانات كمتوسط ( فترة الثقة (CI). تُعرض البيانات كوسيط مع النطاق interquartile (IQR) (k). تم استخدام اختبار ويلكوكسون غير المعلمي لتقييم الأهمية بين التدخلين. *** تُعرض البيانات كرسوم بيانية من نوع صندوق وشعيرات مخطط الصندوق، الوسيط والرباعيات؛ الشعيرات، نطاق البيانات. و و للفارق بين المجموعات الذي تم تقييمه بواسطة النموذج المختلط الخطي المعدل حسب ترتيب التدخل. و للتغيير داخل المجموعة بواسطة نموذج خطي مختلط معدل للتدخل يليه اختبار بونفيروني. - (ج) المؤلف(ون) 2024
DOI: https://doi.org/10.1038/s42255-024-00988-y
PMID: https://pubmed.ncbi.nlm.nih.gov/38409604
Publication Date: 2024-02-26
Resistant starch intake facilitates weight loss inhumans by reshaping the gut microbiota
Accepted: 17 January 2024
Published online: 26 February 2024
(D) Check for updates
Abstract
Emerging evidence suggests that modulation of gut microbiota by dietary fibre may offer solutions for metabolic disorders. In a randomized placebo-controlled crossover design trial (ChiCTR-TTRCC-13003333) in 37 participants with overweight or obesity, we test whether resistant starch (RS) as a dietary supplement influences obesity-related outcomes. Here, we show that RS supplementation for 8 weeks can help to achieve weight loss (mean -2.8 kg ) and improve insulin resistance in individuals with excess body weight. The benefits of RS are associated with changes in gut microbiota composition. Supplementation with Bifidobacterium adolescentis, a species that is markedly associated with the alleviation of obesity in the study participants, protects male mice from diet-induced obesity. Mechanistically, the RS-induced changes in the gut microbiota alter the bile acid profile, reduce inflammation by restoring the intestinal barrier and inhibit lipid absorption. We demonstrate that RS can facilitate weight loss at least partially through B. adolescentis and that the gut microbiota is essential for the action of RS.
dietary intervention with FMT could result in favourable alterations in the recipients’ microbiota and improvements in clinical outcomes
Results
RS intervention facilitates weight loss
recent use of antibiotics or probiotic (within 3 weeks). The 20-week study duration included two intervention periods of 8 weeks, with one each for high-amylose maize (HAM-RS2) (RS,
the RS intervention were significantly lower than those after the CS intervention (Extended Data Fig. 2h); however, the CS intervention did not induce any differences in glucose and insulin levels compared with baseline values (Extended Data Fig. 2f,h). We further assessed insulin sensitivity by hyperinsulinemic-euglycemic clamp and found that the glucose infusion rate (GIR) was significantly increased after the RS intervention (with a median increase of















| Clinical parameters | CSOW | CS 8W | RS OW | RS 8W | P value
|
P value
|
P value
|
P value
|
| Obesity-related indicators | ||||||||
| Body weight (kg) |
|
|
|
|
0.328 | 0.339 | <0.001 | <0.001 |
| BMI (
|
|
|
|
|
0.361 | 0.422 | <0.001 | <0.001 |
| FM (kg) |
|
|
|
|
0.486 | 0.136 | <0.001 | <0.001 |
| FFM (kg) |
|
|
|
|
0.999 | 0.999 | 0.011 | 0.029 |
| TBW (kg) |
|
|
|
|
0.999 | 0.999 | 0.101 | 0.155 |
| Fat percentage |
|
|
|
|
0.999 | 0.999 | 0.101 | 0.117 |
| Waist circumference (cm) |
|
|
|
|
0.731 | 0.999 | <0.001 | <0.001 |
| Hip circumference (cm) |
|
|
|
|
0.999 | 0.372 | <0.001 | <0.001 |
| Waist-to-hip ratio |
|
|
|
|
0.999 | 0.999 | <0.001 | 0.01 |
| VFA (
|
|
|
|
|
0.999 | 0.999 | <0.001 | <0.001 |
| SFA (
|
|
|
|
|
0.999 | 0.999 | <0.001 | 0.004 |
| Anthropometric parameters | ||||||||
| Age (years) |
|
|||||||
| Sex (male:female) | 22:15 | |||||||
| SBP (mm Hg) |
|
|
|
|
0.999 | 0.999 | 0.999 | 0.918 |
| DBP ( mm Hg ) |
|
|
|
|
0.999 | 0.999 | 0.999 | 0.342 |
| Liver enzymes and renal function | ||||||||
| ALT (
|
16.80 (12.30, 29.00) | 20.00 (10.28, 30.25) | 16.00 (12.00, 30.00) | 15.00 (12.00, 22.50) | 0.999 | 0.999 | 0.432 | 0.041 |
| AST (
|
18.60 (17.20, 22.00) | 19.76 (16.03, 24.80) | 19.00 (17.00, 22.50) | 17.00 (14.50, 21.00) | 0.999 | 0.999 | 0.058 | 0.022 |
| GGT (
|
24.80 (17.50, 35.00) | 25.20 (18.17, 34.26) | 25.00 (18.00, 36.00) | 21.00 (16.00, 35.50) | 0.999 | 0.999 | 0.033 | 0.03 |
| BUN (
|
|
|
|
|
0.999 | 0.999 | 0.999 | 0.149 |
|
|
|
|
|
|
0.999 | 0.999 | 0.999 | 0.809 |
| Lipid profiles | ||||||||
| TC (mmoll
|
|
|
|
|
0.999 | 0.999 | 0.008 | 0.146 |
| TG (
|
1.09 (0.86, 1.68) | 1.23 (0.80, 1.52) | 1.04 (0.85, 1.64) | 1.01 (0.79, 1.38) | 0.999 | 0.999 | 0.999 | 0.559 |
| HDL-C (mmoll
|
|
|
|
|
0.999 | 0.999 | 0.999 | 0.456 |
| LDL-C (mmoll
|
|
|
|
|
0.999 | 0.999 | 0.424 | 0.482 |
| Secretory cytokines | ||||||||
| A-FABP (
|
35.49 (30.71, 44.82) | 36.83 (23.35, 46.99) | 37.47 (29.33, 47.81) | 31.12 (23.74, 45.12) | 0.999 | 0.999 | 0.072 | 0.12 |
| Adiponectin (
|
9.34 (7.49, 13.86) | 9.38 (7.01, 12.39) | 9.21 (7.04, 13.13) | 10.46 (7.38, 13.68) | 0.999 | 0.999 | 0.376 | 0.038 |
| FGF21 (
|
167.61 (99.71, 211.00) | 172.07 (104.63, 237.70) | 188.46 (113.19, 224.07) | 151.74 (51.62, 216.98) | 0.999 | 0.999 | <0.001 | 0.002 |
| Inflammation-related factors | ||||||||
| TNF
|
0.70 (0.60, 0.81) | 0.68 (0.55, 0.86) | 0.70 (0.55, 0.82) | 0.66 (0.45, 0.72) | 0.999 | 0.999 | 0.053 | 0.014 |
| IL-1
|
0.18 (0.13, 0.24) | 0.17 (0.10, 0.27) | 0.16 (0.11, 0.26) | 0.11 (0.06, 0.17) | 0.999 | 0.999 | <0.001 | 0.046 |
| MCP-1 (
|
673.56 (535.55, 865.83) | 630.62 (516.20, 768.22) | 626.85 (513.23, 816.09) | 631.97 (498.41, 822.20) | 0.999 | 0.999 | 0.999 | 0.925 |
| IL-10 (
|
1.72 (1.58, 2.07) | 1.62 (1.49, 1.79) | 1.66 (1.52, 1.95) | 1.58 (1.48, 1.91) | 0.999 | 0.999 | 0.999 | 0.146 |
| IL-6 (
|
1.08 (0.65,1.85) | 1.12 (0.57,1.64) | 1.08 (0.77,1.58) | 1.05 (0.71,1.49) | 0.999 | 0.999 | 0.999 | 0.689 |
 are expressed as mean
are expressed as mean

 in outcomes between the RS and CS intervention were assessed using a linear mixed model adjusted by intervention order.
in outcomes between the RS and CS intervention were assessed using a linear mixed model adjusted by intervention order.significant improvement in insulin sensitivity. Furthermore, a significant increase in serum adiponectin levels was observed after the RS intervention (Extended Data Fig. 2i). In addition, after RS intervention, neither the first-phase nor the second-phase insulin secretion was significantly different from those after CS intervention (Supplementary Table 4). All these results indicated that the 8-week RS intervention improved glucose tolerance and insulin sensitivity in individuals with excess body weight.
protein-1 (MCP-1), IL-10 and IL-6 were observed during RS and CS consumption (Fig. 1i, j and Table 1). Furthermore, we measured faecal lipids of the study participants and found that the daily excretion of faecal non-esterified fatty acid (NEFA), triglycerides (TGs) and total cholesterol (TC) were significantly higher following RS consumption compared with CS consumption (Fig. 1k). As there was no significant difference in fat intake during the RS and CS consumption (Supplementary Table 1), these results suggested that the RS intervention may decrease lipid absorption from the diet. Circulating levels of angiopoietin-like 4 (ANGPTL4), a potential connection between gut and lipid metabolism
RS intervention reshapes gut microbiota
Association of RS-altered gut microbiota with metabolites

(TDCA) exhibited a tendency to increase, whereas
was negatively correlated with obesity-related phenotypes, whereas positively correlated with insulin sensitivity and ANGPTL4 levels (Fig. 3b). The change of GDCA and TDCA after RS treatment was significantly and positively associated with four species, including B. adolescentis, B. longum, Dorea longicatena and R. bromii,
whereas negatively associated with another eight species, including A. putredinis, Bacteroides coprophilus, Bacteroides ovatus, B. vulgatus, Eubacterium eligens, O. splanchnicus, P. merdae and P. copri (Fig. 3c). Additionally, we identified some microbial pathways strongly associated with the variation of several metabolites, including GDCA, TDCA,
RS-reshaped gut microbiota alleviates obesity in mice
RS-reshaped gut microbiota restores gut barrier
RS-altered gut microbiota reduces lipid absorption
between bile acids and phenotypes or between bile acids and microbes. The width of connecting line reflects the strength of the statistical linear association (model averaged importance) between the variation of bile acids (fold change after intervention) and the variation of the phenotypes (fold change after intervention) or between the abundance variation (fold change after intervention) and the variation of the bile acids (fold change after intervention). The importance is the summed AIC weights of the generalized linear models containing such variables during model selection. The node size of the bile acid reflects its overall influence on all the phenotypes or the microbes. d, KEGG pathway analysis showing the correlation between the variation of bile acids and the variation of KEGG pathway abundance.
(LPL) and also pancreatic lipase, which functions as the principal intestinal lipase
faeces than mice colonized with CS microbiota (Fig. 5k,l). Circulating ANGPTL4 levels were also significantly increased in mice colonized with RS microbiota compared with mice colonized with CS microbiota (Fig. 5m). These results indicated that RS-induced changes in the gut microbiota were able to reduce lipid absorption through modulating intestinal ANGPTL4.


Effects of B. adolescentis on obesity

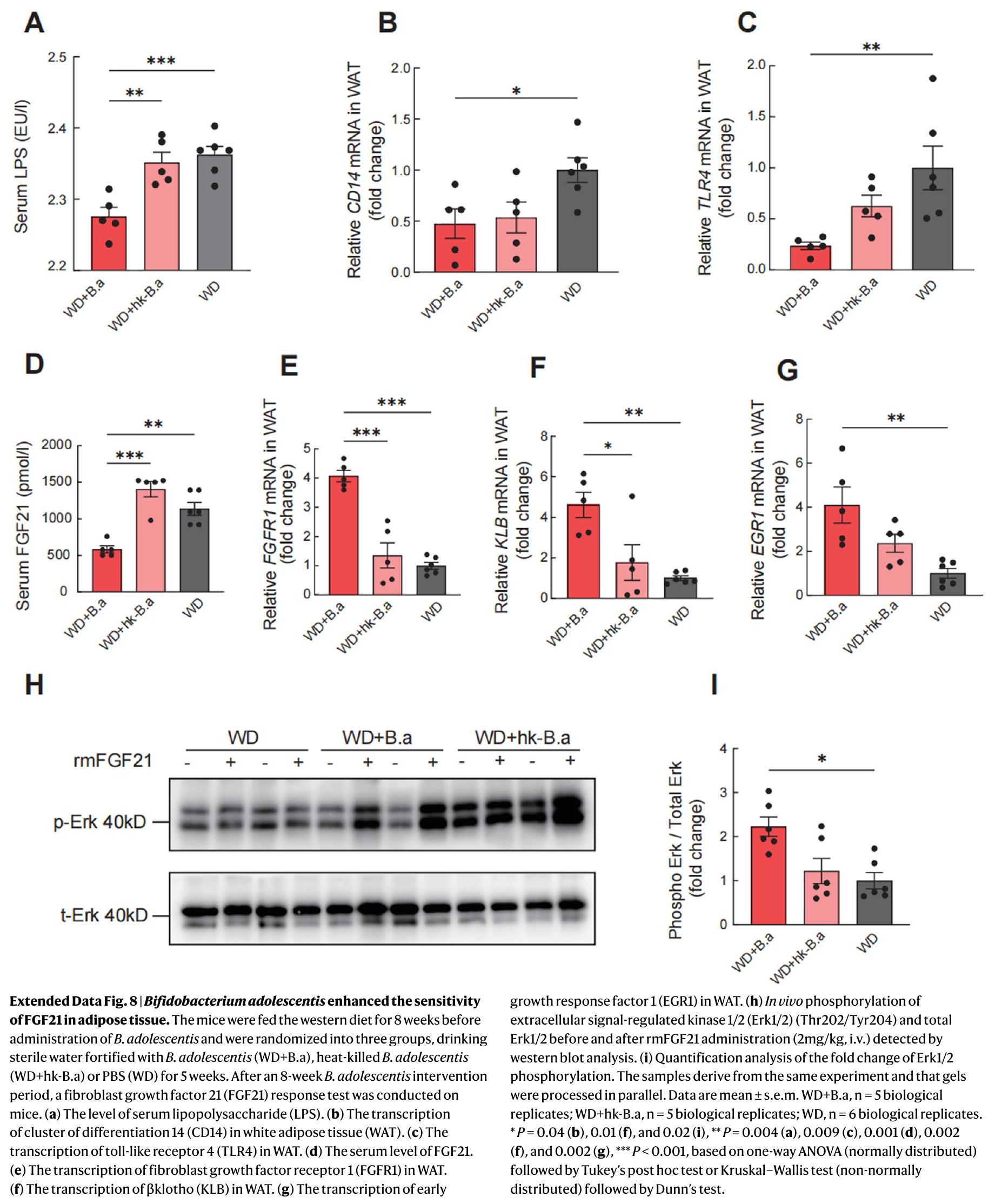
(Fig. 1m). We found that the treatment with B. adolescentis in mice increased the sensitivity to FGF21 in adipose tissue by suppressing the LPS-TLR4-NF-кB pathway (Extended Data Fig. 8).

levels of isobutyrate and valerate also decreased significantly after B. adolescentis intervention (Extended Data Fig. 9b). In addition, the levels of serum branched-chain amino acids (BCAAs), including valine and leucine, significantly decreased after
RS facilitates weight loss partially through B. adolescentis
with PBS or live B. adolescentis for 8 weeks. As intestinal contents and the thickness of the lumen were significantly increased after RS feeding, the disembowelled body weight was commonly used to evaluate the effect of weight loss
Discussion
content in the daily diet is important for the effect of RS. Our study provided an effective dietary recommendation using RS as a supplement (

a, Schematic diagram of B. adolescentis (B.a) supplementation strategy. Orally inoculating B. adolescentis or PBS into germ-free (GF) mice on diets with
measurement of serum concentrations of DX-4000-FITC at 1 h after oral gavage. h, Expression of ZO-1 and occludin in the ileum. i, Expression of inflammatory genes in mWAT. j, mRNA expression levels of ANGPTL4 in the ileum. k, Relative intestinal luminal lipase activity. I, TG levels in the ileum. m, Faecal TG levels. Data are mean
has garnered substantial interest in relation to the gut microbiota. Germ-free mice exhibited elevated intestinal ANGPTL4 expression in compared with mice raised conventionally
Methods
Study participants
General protocol of the clinical trial
Anthropometric and biochemical assessments
MTT experiment
Hyperinsulinemic-euglycemic clamp
Faecal DNA extraction and sequencing
Metagenomics analysis
dissimilarity of species-level abundance fold change, described above, was performed with R package VEGAN
Metabolomics profiling of human serum samples
Metabolomics profiling of human faecal samples
Faecal lipid assessment
Mouse model
a specific-pathogen-free barrier facility in individually ventilated cages with a maximum of four mice per cage, with free access to food and water under a strict 12 -h light-dark cycle at a controlled temperature (
FMT experiment
Bacterial strain
Administration of B. adolescentis
Biochemical and immunological assays in mice
Metabolomics profiling of mice samples
FGF21 response test
Quantitative PCR assays
Histological examination
Luminal lipase activity
Western blotting
Statistical analysis
Reporting summary
Data availability
Code availability
References
- Waxman, A. & World Health, A. WHO global strategy on diet, physical activity and health. Food Nutr. Bull. 25, 292-302 (2004).
- Torres-Fuentes, C., Schellekens, H., Dinan, T. G. & Cryan, J. F. The microbiota-gut-brain axis in obesity. Lancet Gastroenterol. Hepatol. 2, 747-756 (2017).
- Backhed, F. et al. The gut microbiota as an environmental factor that regulates fat storage. Proc. Natl Acad. Sci. USA 101, 15718-15723 (2004).
- Turnbaugh, P. J. et al. An obesity-associated gut microbiome with increased capacity for energy harvest. Nature 444, 1027-1031 (2006).
- Kootte, R. S. et al. Improvement of insulin sensitivity after lean donor feces in metabolic syndrome is driven by baseline intestinal microbiota composition. Cell Metab. 26, 611-619 e616 (2017).
- de Groot, P. et al. Donor metabolic characteristics drive effects of faecal microbiota transplantation on recipient insulin sensitivity, energy expenditure and intestinal transit time. Gut 69, 502-512 (2020).
- Carmody, R. N. & Bisanz, J. E. Roles of the gut microbiome in weight management. Nat. Rev. Microbiol. 21, 535-550 (2023).
- Gibson, G. R. et al. Expert consensus document: The International Scientific Association for Probiotics and Prebiotics (ISAPP) consensus statement on the definition and scope of prebiotics. Nat. Rev. Gastroenterol. Hepatol. 14, 491-502 (2017).
- Delannoy-Bruno, O. et al. Evaluating microbiome-directed fibre snacks in gnotobiotic mice and humans. Nature 595, 91-95 (2021).
- Bindels, L. B., Delzenne, N. M., Cani, P. D. & Walter, J. Towards a more comprehensive concept for prebiotics. Nat. Rev. Gastroenterol. Hepatol. 12, 303-310 (2015).
- Englyst, H. N. & Cummings, J. H. Digestion of the polysaccharides of some cereal foods in the human small intestine. Am. J. Clin. Nutr. 42, 778-787 (1985).
- Higgins, J. A. Resistant starch and energy balance: impact on weight loss and maintenance. Crit. Rev. Food Sci. Nutr. 54, 1158-1166 (2014).
- Wali, J. A. et al. Impact of dietary carbohydrate type and protein-carbohydrate interaction on metabolic health. Nat. Metab. 3, 810-828 (2021).
- Robertson, M. D. et al. Insulin-sensitizing effects on muscle and adipose tissue after dietary fiber intake in men and women with metabolic syndrome. J. Clin. Endocrinol. Metab. 97, 3326-3332 (2012).
- Johnston, K. L., Thomas, E. L., Bell, J. D., Frost, G. S. & Robertson, M. D. Resistant starch improves insulin sensitivity in metabolic syndrome. Diabet. Med. 27, 391-397 (2010).
- Maki, K. C. et al. Resistant starch from high-amylose maize increases insulin sensitivity in overweight and obese men. J. Nutr. 142, 717-723 (2012).
- Coate, K. C. & Huggins, K. W. Consumption of a high glycemic index diet increases abdominal adiposity but does not influence adipose tissue pro-oxidant and antioxidant gene expression in C57BL/6 mice. Nutr. Res. 30, 141-150 (2010).
- Charrier, J. A. et al. High fat diet partially attenuates fermentation responses in rats fed resistant starch from high-amylose maize. Obesity 21, 2350-2355 (2013).
- DeMartino, P. & Cockburn, D. W. Resistant starch: impact on the gut microbiome and health. Curr. Opin. Biotechnol. 61, 66-71 (2020).
- Chen, C., Lu, F. C. & Department of Disease Control Ministry of Health, PR China. The guidelines for prevention and control of overweight and obesity in Chinese adults. Biomed. Environ. Sci. 17, 1-36 (2004).
- Jensen, M. D. et al. 2013 AHA/ACC/TOS guideline for the management of overweight and obesity in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and The Obesity Society. Circulation 129, S102-S138 (2014).
- Cox, A. J., West, N. P. & Cripps, A. W. Obesity, inflammation, and the gut microbiota. Lancet Diabetes Endocrinol. 3, 207-215 (2015).
- Martinez-Guryn, K. et al. Small intestine microbiota regulate host digestive and absorptive adaptive responses to dietary lipids. Cell Host Microbe 23, 458-469 (2018).
- Geng, L., Lam, K. S. L. & Xu, A. The therapeutic potential of FGF21 in metabolic diseases: from bench to clinic. Nat. Rev. Endocrinol. 16, 654-667 (2020).
- Baxter, N. T. et al. Dynamics of human gut microbiota and short-chain fatty acids in response to dietary interventions with three fermentable fibers. mBio 10, e02566-18 (2019).
- Kadyan, S., Sharma, A., Arjmandi, B. H., Singh, P. & Nagpal, R. Prebiotic potential of dietary beans and pulses and their resistant starch for aging-associated gut and metabolic health. Nutrients 14, 1726 (2022).
- Vital, M. et al. Metagenomic insights into the degradation of resistant starch by human gut microbiota. Appl. Environ. Microbiol. 84, e01562-18 (2018).
- Krautkramer, K. A., Fan, J. & Backhed, F. Gut microbial metabolites as multi-kingdom intermediates. Nat. Rev. Microbiol. 19, 77-94 (2021).
- Heianza, Y. et al. Changes in gut microbiota-related metabolites and long-term successful weight loss in response to weight-loss diets: the POUNDS Lost trial. Diabetes Care 41, 413-419 (2018).
- Adams, S. H. Emerging perspectives on essential amino acid metabolism in obesity and the insulin-resistant state. Adv. Nutr. 2, 445-456 (2011).
- Foley, M. H., O’Flaherty, S., Barrangou, R. & Theriot, C. M. Bile salt hydrolases: gatekeepers of bile acid metabolism and host-microbiome crosstalk in the gastrointestinal tract. PLoS Pathog. 15, e1007581 (2019).
- Mattijssen, F. et al. Angptl4 serves as an endogenous inhibitor of intestinal lipid digestion. Mol. Metab. 3, 135-144 (2014).
- Higgins, J. A. et al. Resistant starch and exercise independently attenuate weight regain on a high fat diet in a rat model of obesity. Nutr. Metab. 8, 49 (2011).
- Wahlstrom, A., Sayin, S. I., Marschall, H. U. & Backhed, F. Intestinal crosstalk between bile acids and microbiota and its impact on host metabolism. Cell Metab. 24, 41-50 (2016).
- Upadhyaya, B. et al. Impact of dietary resistant starch type 4 on human gut microbiota and immunometabolic functions. Sci. Rep. 6, 28797 (2016).
- Ravussin, Y. et al. Responses of gut microbiota to diet composition and weight loss in lean and obese mice. Obesity 20, 738-747 (2012).
- Zhang, L. et al. Metabolic phenotypes and the gut microbiota in response to dietary resistant starch type 2 in normal-weight subjects: a randomized crossover trial. Sci. Rep. 9, 4736 (2019).
- Bendiks, Z. A., Knudsen, K. E. B., Keenan, M. J. & Marco, M. L. Conserved and variable responses of the gut microbiome to resistant starch type 2. Nutr. Res. 77, 12-28 (2020).
- Golden, J. M. et al. Ursodeoxycholic acid protects against intestinal barrier breakdown by promoting enterocyte migration via EGFR- and COX-2-dependent mechanisms. Am. J. Physiol. Gastrointest. Liver Physiol. 315, G259-G271 (2018).
- Quintero, P. et al. Bile acid supplementation improves established liver steatosis in obese mice independently of glucagon-like peptide-1 secretion. J. Physiol. Biochem. 70, 667-674 (2014).
- Nie, B. et al. Specific bile acids inhibit hepatic fatty acid uptake in mice. Hepatology 56, 1300-1310 (2012).
- Schneider, K. M., Albers, S. & Trautwein, C. Role of bile acids in the gut-liver axis. J. Hepatol. 68, 1083-1085 (2018).
- Ni, Y. et al. Resistant starch decreases intrahepatic triglycerides in patients with NAFLD via gut microbiome alterations. Cell Metab. 35, 1530-1547 (2023).
- Jaskiewicz, J. et al. Catabolism of isobutyrate by colonocytes. Arch. Biochem. Biophys. 327, 265-270 (1996).
- Oliphant, K. & Allen-Vercoe, E. Macronutrient metabolism by the human gut microbiome: major fermentation by-products and their impact on host health. Microbiome 7, 91 (2019).
- Dijk, W. & Kersten, S. Regulation of lipoprotein lipase by Angptl4. Trends Endocrinol. Metab. 25, 146-155 (2014).
- Long, X. et al. Bifidobacterium adolescentis alleviates liver steatosis and steatohepatitis by increasing fibroblast growth factor 21 sensitivity. Front. Endocrinol. 12, 773340 (2021).
- Geng, L. et al. Exercise alleviates obesity-induced metabolic dysfunction via enhancing FGF21 sensitivity in adipose tissues. Cell Rep. 26, 2738-2752 (2019).
- van Baak, M. A. & Mariman, E. C. M. Mechanisms of weight regain after weight loss – the role of adipose tissue. Nat. Rev. Endocrinol. 15, 274-287 (2019).
- Jia, W. et al. Association of serum retinol-binding protein 4 and visceral adiposity in Chinese subjects with and without type 2 diabetes. J. Clin. Endocrinol. Metab. 92, 3224-3229 (2007).
- Li, J. et al. Probiotics modulated gut microbiota suppresses hepatocellular carcinoma growth in mice. Proc. Natl Acad. Sci. USA 113, E1306-E1315 (2016).
- Li, H. & Durbin, R. Fast and accurate short read alignment with Burrows-Wheeler transform. Bioinformatics 25, 1754-1760 (2009).
- Segata, N. et al. Metagenomic microbial community profiling using unique clade-specific marker genes. Nat. Methods 9, 811-814 (2012).
- Dixon, P. VEGAN, a package of
functions for community ecology. J. Vegetation Sci. 14, 927-930 (2003). - Shannon, P. et al. Cytoscape: a software environment for integrated models of biomolecular interaction networks. Genome Res. 13, 2498-2504 (2003).
- Peng, Y., Leung, H. C., Yiu, S. M. & Chin, F. Y. IDBA-UD: a de novo assembler for single-cell and metagenomic sequencing data with highly uneven depth. Bioinformatics 28, 1420-1428 (2012).
- Ni, Y., Li, J. & Panagiotou, G. COMAN: a web server for comprehensive metatranscriptomics analysis. BMC Genomics 17, 622 (2016).
- Zhu, W., Lomsadze, A. & Borodovsky, M. Ab initio gene identification in metagenomic sequences. Nucleic Acids Res. 38, e132 (2010).
- Xie, C. et al. KOBAS 2.0: a web server for annotation and identification of enriched pathways and diseases. Nucleic Acids Res. 39, W316-W322 (2011).
- Rohart, F., Gautier, B., Singh, A. & Le Cao, K. A. mixOmics: an
package for ‘omics feature selection and multiple data integration. PLoS Comput. Biol. 13, e1005752 (2017). - Liu, R. et al. Gut microbiome and serum metabolome alterations in obesity and after weight-loss intervention. Nat. Med. 23, 859-868 (2017).
- Xie, G. et al. Dysregulated hepatic bile acids collaboratively promote liver carcinogenesis. Int J. Cancer 139, 1764-1775 (2016).
- Xie, G. et al. Profiling of serum bile acids in a healthy Chinese population using UPLC-MS/MS. J. Proteome Res. 14, 850-859 (2015).
- Lan, K. et al. Key role for the 12 -hydroxy group in the negative ion fragmentation of unconjugated c24 bile acids. Anal. Chem. 88, 7041-7048 (2016).
- Zhao, L. et al. High throughput and quantitative measurement of microbial metabolome by gas chromatography/mass spectrometry using automated alkyl chloroformate derivatization. Anal. Chem. 89, 5565-5577 (2017).
- Govers, M. J. & Van der Meet, R. Effects of dietary calcium and phosphate on the intestinal interactions between calcium, phosphate, fatty acids, and bile acids. Gut 34, 365-370 (1993).
- Cho, K. D., Han, C. K. & Lee, B. H. Loss of body weight and fat and improved lipid profiles in obese rats fed apple pomace or apple juice concentrate. J. Med. Food 16, 823-830 (2013).
- Wong, C. M. et al. Adropin is a brain membrane-bound protein regulating physical activity via the NB-3/Notch signaling pathway in mice. J. Biol. Chem. 289, 25976-25986 (2014).
- Zhang, Y. et al. Gut microbiome-related effects of berberine and probiotics on type 2 diabetes (the PREMOTE study). Nat. Commun. 11, 5015 (2020).
- Haarman, M. & Knol, J. Quantitative real-time PCR assays to identify and quantify fecal Bifidobacterium species in infants receiving a prebiotic infant formula. Appl. Environ. Microbiol. 71, 2318-2324 (2005).
Acknowledgements
the Chinese Academy of Sciences (XDB38020200) to G.X.; the Youth Innovation Promotion Association of the Chinese Academy of Sciences (2021186) to X. Liu.; and The Hong Kong Polytechnic University (POO42740) to P.L.
Author contributions
Competing interests
Additional information


(a-e) Boxplots (with median) showing the dynamic changes of (a) body weight, (b) fat mass, and (c) waist circumference at every 2 weeks of intervention, as well as (d) visceral fat (VFA) and (e) subcutaneous fat area (SFA) at every 4 weeks of intervention. Lines connect the means of outcomes at different time pointes. The horizontal line represents the outcomes of the linear mixed model analysis followed by Bonferroni’s test conducted to compare the connected endpoints. RS-Washout-CS group,
(h) Serum insulin. (i) Change of serum adiponectin level evaluated by ELISA in subjects before and after 8 -week RS or CS intervention. For
A





Abstract
RS-Washout-CS group using the Bray-Curtis distance method. (d) Beta-diversity for the CS-Washout-RS group using the weighted-Unifrac distance method. (e) Beta-diversity for the RS-Washout-CS group using the weighted-Unifrac distance method. All the beta-diversity plots used Non-metric multidimensional scaling (NMDS) based on the compositional profile of the species abundance. The ANOSIM results support the baseline comparability of microbial compositions (




(a) The strength of the linear correlation (model averaged Akaike information criterion [AlC] importance) between the species abundance variation (fold change after intervention) and the variation (fold change after intervention) of the circulating metabolites. The importance is the summed AIC weights of the linear models containing such variable during model selection. (b-g) Changes of faecal SCFAs after the 8-week RS or CS intervention (
group). (b) Acetate. (c) Propionate. (d) Butyrate. (e) Isobutyrate. (f) Valerate. (g) Hexanoate. Data are expressed as median with interquartile range.

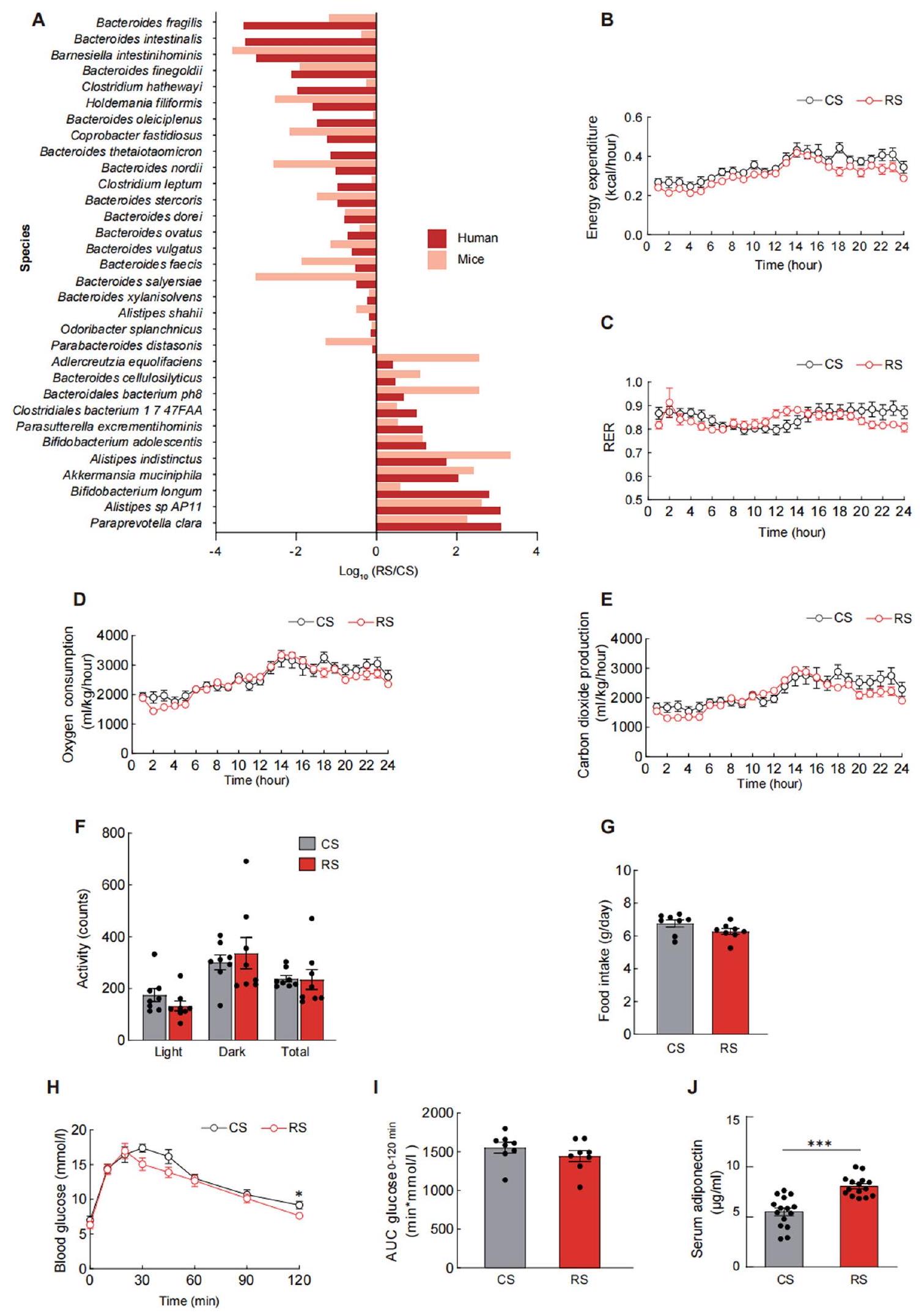
expenditure, (c) respiratory exchange ratio (RER), (d) oxygen consumption, (e) carbon dioxide production, (f) activity, and (g) food intake were measured using the comprehensive laboratory animal monitoring system at the end of the experiment. (h) Glucose tolerance test (GTT) was performed in mice colonized with microbiota from RS or CS donors. (i) Area under the curve (AUC) analysis of GTT. (j) Serum adiponectin levels were measured at the end of faecal microbiota transplantation (


(b) Levels of SCFAs in faeces. (c) Levels of valine, isoleucine, and leucine in serum.
(d) Levels of GCA, DCA, T
(e) Levels of SCFAs in faeces of germ-free mice. (f) Levels of valine, isoleucine, and leucine in serum of germ-free mice. Data are presented as box-and-whisker plots.



natureportfolio
Corresponding author(s): Huating Li and Xinyu Liu
Reporting Summary
Statistics
Only common tests should be described solely by name; describe more complex techniques in the Methods section.
X
A full description of the statistical parameters including central tendency (e.g. means) or other basic estimates (e.g. regression coefficient) AND variation (e.g. standard deviation) or associated estimates of uncertainty (e.g. confidence intervals)
X For hierarchical and complex designs, identification of the appropriate level for tests and full reporting of outcomes
X Estimates of effect sizes (e.g. Cohen’s
Our web collection on statistics for biologists contains articles on many of the points above.
Software and code
Data collection EpiData 3.1 was used for data entry and documentation.
For manuscripts utilizing custom algorithms or software that are central to the research but not yet described in published literature, software must be made available to editors and reviewers. We strongly encourage code deposition in a community repository (e.g. GitHub). See the Nature Portfolio guidelines for submitting code & software for further information.
Data
All manuscripts must include a data availability statement. This statement should provide the following information, where applicable:
- Accession codes, unique identifiers, or web links for publicly available datasets
- A description of any restrictions on data availability
- For clinical datasets or third party data, please ensure that the statement adheres to our policy
deposited in NCBI Sequence Read Archive under accession ID PRJNA414688 and are publicly available as of the date of publication. Any additional information required to reanalyze the data reported in this paper is available from the lead contact Weiping Jia (wpjia@sjtu.edu.cn) upon request.
Research involving human participants, their data, or biological material
| Reporting on sex and gender | There were 37 subjects with overweight or obese who completed the trial, including 22 male and 15 female subjects. |
| Reporting on race, ethnicity, or other socially relevant groupings | No socially constructed or socially relevant categorization was made in the selection of study participants. |
| Population characteristics | The average age of the subjects was
|
| Recruitment | Participants will be recruited by public advertisements from Shanghai, China, from July 2013 to 2016. Once eligibility is confirmed, a physician will fully inform the participant about the experiment. As participants self-referred to the study, this may have caused a selection bias towards healthier persons. Consequently, the study results may not be generalized to the entire population living with excess body weight. |
| Ethics oversight | The study was approved by the Ethics Committee of Shanghai Jiao Tong University Affiliated Sixth People’s Hospital, following the principle of the Declaration of Helsinki. |
Field-specific reporting
Life sciences Behavioural & social sciences Ecological, evolutionary & environmental sciences
For a reference copy of the document with all sections, see nature.com/documents/nr-reporting-summary-flat.pdf
Life sciences study design
| Sample size |
|
||
| Data exclusions | No data were excluded from the analysis. | ||
| Replication |
|
||
| Randomization | An independent researcher performed the randomization and assigned participants to a CS-washout-RS or RS-washout-CS intervention scheme with an allocation ration of
|
||
| Blinding | RS and CS were packaged in sealed bags that were identical in appearance, and participants and investigators were unaware of the contents of the study starch and the randomization scheme during the double-blind period. Only the research designer knew the randomization scheme. Participants, investigators, clinical staff and outcome assessors were blinded to the allocation sequence during data collection and analysis. The blinding was lifted when the bioinformatics analysis were conducted to explore the potential mechanism by which the gut microbiota confers the physiological benefits of RS. The investigators were not blinded to animal experiments as the treatment of each mouse would need to be known to the person handling the mice. When feasible, data analysis was performed blind. |
Reporting for specific materials, systems and methods
| Materials & experimental systems | Methods | ||
| n/a | Involved in the study | n/a | Involved in the study |
 |
X Antibodies |  |
ChIP-seq |
 |
 |
 |
Flow cytometry |
 |
Palaeontology and archaeology |  |
MRI-based neuroimaging |
 |
|||
 |
Clinical data | ||
 |
Dual use research of concern | ||
 |
 |
||
Antibodies
| Antibodies used | ZO1 antibody (Abcam, ab96587, 1:500 dilution, Rabbit polyclonal to ZO1 tight junction protein) ; Occludin antibody (Abcam, ab216327, 1:100 dilution, Rabbit monoclonal [EPR20992] to Occludin); ANGPTL4 antibody (Proteintech, 18374-1-AP, 1: 500 dilution, Rabbit polyclonal to ANGPTL4); Erk1/2 antibody ( Cell Signaling Technology, 9102, 1:1000 dilution, Rabbit polyclonal to Erk1/2), pErk1/2 (Thr202/Tyr204) (Cell Signaling Technology, 9101, 1:1000 dilution, Rabbit polyclonal to p- Erk1/2); Rabbit IgG (H+L) secondary antibody (Thermo, 31460, 1: 2500 dilution). |
| Validation | The ZO1 antibody and Occludin antibody were validated in our laboratory (Circulation 133, 2434-2446, 2016). The Erk1/2 and pErk1/2 antibody were validated in our laboratory (Front Endocrinol (Lausanne) 30:12:773340, 2021). The ANGPTL4 antibody was validated on the website http://www.ptglab.com/Products/ANGPTL4-Antibody-18374-1-AP.htm#validation. |
Animals and other research organisms
| Laboratory animals | For FMT experiment, ten-week-old male C57BL/6 mice were raised in conventional environment. For administrating of B. adolescentis, eight-week-old male C57BL/6 mice were raised in conventional environment. Five-week-old male germ-free male C57BL/6J mice were bred and maintained in special plastic isolators. All animals were kept under 12h light-dark cycles at a controlled temperature (
|
| Wild animals | The study did not involve wild animals. |
| Reporting on sex | As female C57BL/6J mice are reported to be more resistant to the obesogenic effects of HFD (Int J Obes (Lond) 46(10):1749-1758, 2022), male C57BL/6J mice were used in this study. |
| Field-collected samples | The study did not involve samples collected from field. |
| Ethics oversight | Animal experimental procedures were approved by the Committee on the Use of Live Animals for Teaching and Research of the University of Hong Kong and Animal Ethics Committee of the Shanghai Sixth People’s Hospital Affiliated to Shanghai Jiao Tong University School of Medicine. |
Clinical data
All manuscripts should comply with the ICMJE guidelines for publication of clinical research and a completed CONSORT checklist must be included with all submissions.
| Clinical trial registration | This trial was registered at Chinese Clinical Trial Registry as ChiCTR-TTRCC 13003333. |
| Study protocol | The detailed study protocol was deposited in Chinese clinical trial management public platform (Resman) and can be found in Supplementary Information. |
| Data collection | The CRF was used to collect information during the study. Original files were stored in Shanghai Jiao Tong University Affiliated Sixth People’s Hospital. All data were double-entered by researcher staff. After establishing and regarding as correct in blind review, the database was locked, and no alteration can be made. Participants were recruited from July 2013 to October 2016. Data was collected in Shanghai Clinical Center for Diabetes from July 2013 to October 2016. |
| Outcomes | The primary outcome was change of body weight measured with the body composition analyzer (Tanita, TBF-410) after RS intervention vs. CS intervention, and the secondary outcomes were subcutaneous fat area and visceral fat area assessed using the 3.0 T clinical MRI scanner (Archiva, Philips Medical System), body fat analysis by body composition analyzer, waist circumference by anthropometric measurement, lipid profiles by biochemical assessments, and insulin sensitivity by hyperinsulinemic-euglycemic clamp. |
| Seed stocks | Report on the source of all seed stocks or other plant material used. If applicable, state the seed stock centre and catalogue number. If plant specimens were collected from the field, describe the collection location, date and sampling procedures. | ||
| Novel plant genotypes | Describe the methods by which all novel plant genotypes were produced. This includes those generated by transgenic approaches, gene editing, chemical/radiation-based mutagenesis and hybridization. For transgenic lines, describe the transformation method, the number of independent lines analyzed and the generation upon which experiments were performed. For gene-edited lines, describe the editor used, the endogenous sequence targeted for editing, the targeting guide RNA sequence (if applicable) and how the editor | ||
| Authentication |
|
- A full list of affiliations appears at the end of the paper.
-mail: huarting99@sjtu.edu.cn; liuxy2012@dicp.ac.cn; Gianni.Panagiotou@hki-jena.de; amxu@hku.hk; wpjia@sjtu.edu.cn - ANGPTL4 levels. m, Change of serum FGF21 levels.
individuals ( ), individuals (e,f,i), individuals ( ) and individuals ( ) for either RS or CS. Analysis of covariance (ANCOVA) adjusted by baseline value was used for comparison between RS and CS at each visit (b-d). Data are shown as mean ( confidence interval (CI)).*** . Data are shown as median with IQR (k). Nonparametric Wilcoxon rank-sum test was used to evaluate the significance between the two interventions. *** . Data are shown as box-and-whisker plots ( ). Box plot, median and quartiles; whiskers, data range. and and for the between-group difference assessed by the linear mixed model adjusted for intervention order. and for the withingroup change by mixed linear model adjusted for intervention followed by Bonferroni’s test. - (c) The Author(s) 2024
