DOI: https://doi.org/10.1007/s00018-023-05099-7
PMID: https://pubmed.ncbi.nlm.nih.gov/38334836
تاريخ النشر: 2024-02-09
تنظيم التحول الظهاري المعتمد على Wnt/β-catenin في السرطانات البشرية
© المؤلف(ون) 2024
الملخص
الانتقال الخبيث يمثل
ملخص رسومي
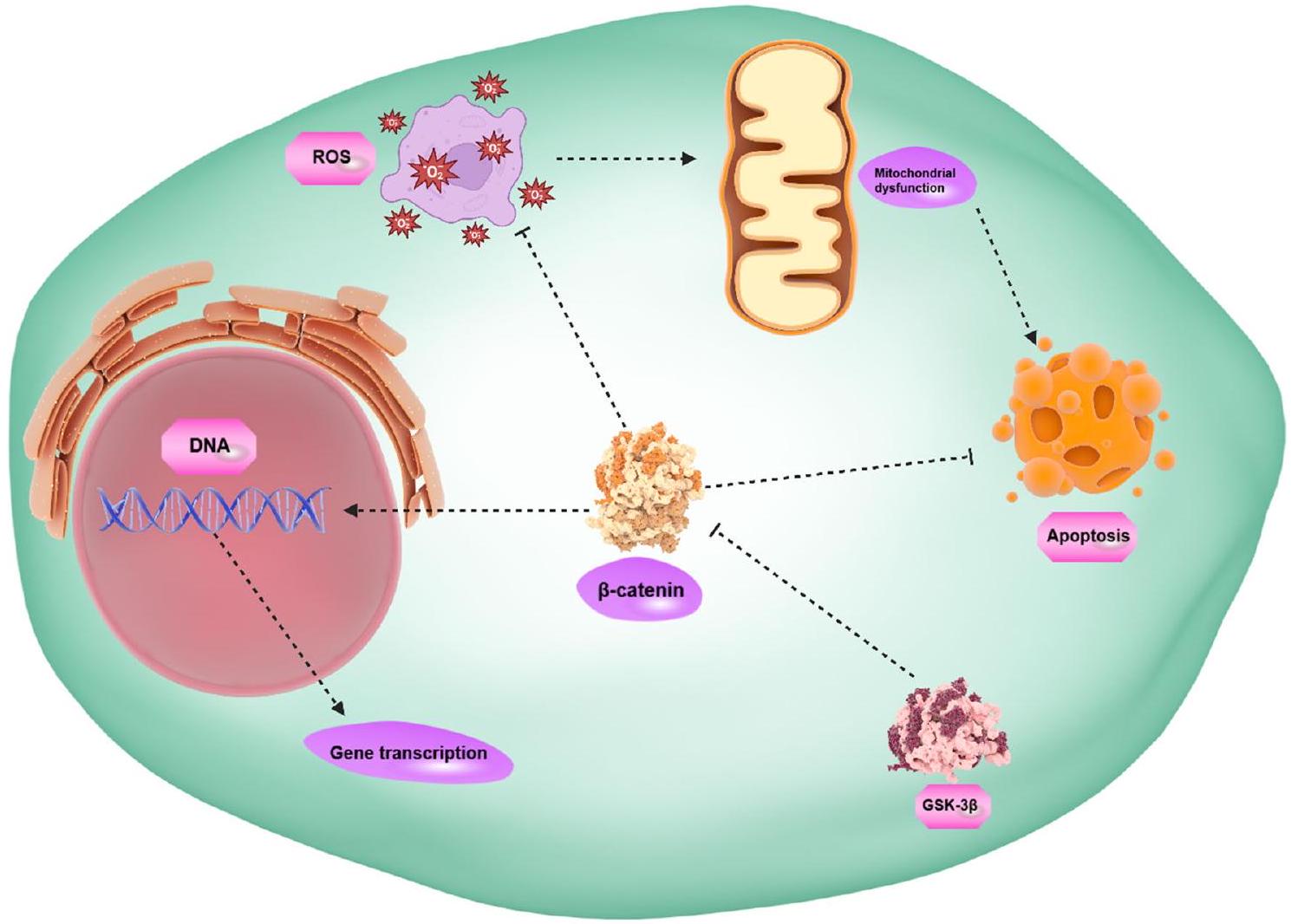
مقدمة
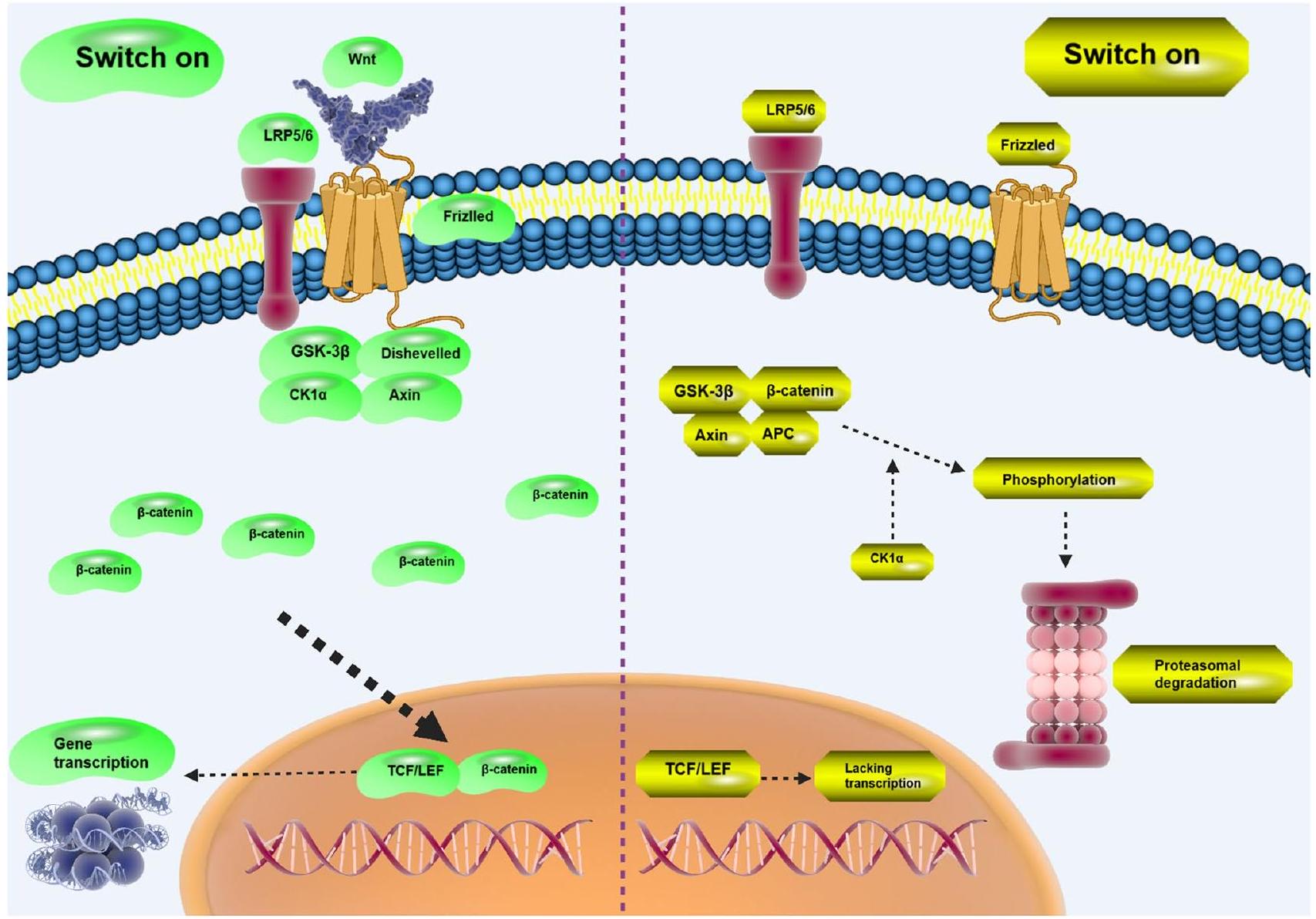
تفاعل مستقبل Wnt مع الروابط مسؤول عن تحفيزه الذي يحسب لنقل معلومات الإشارات الخلوية من البيئة خارج الخلوية إلى الحُجرات داخل الخلوية والأهداف السفلية. يتم التحكم في Wnt بشكل صارم في الخلايا وهو مشارك مهم في العمليات الفسيولوجية بما في ذلك تمايز محور الكائن الحي، وتكوين الأنسجة، وتكوين الدماغ، وصيانة الخلايا الجذعية. أظهرت البيانات المتراكمة ارتباط عدم تنظيم Wnt بتطور الأحداث المرضية. على سطح الخلية، توجد مستقبلات بما في ذلك LRP5/6 وFZD التي يمكن أن تتفاعل مع روابط Wnt لتحفيز بروتين Dishevelled، وهو عضو في معقد مع بروتينات أخرى بما في ذلك GSK-3.
يمكن للوسائط العلوية تحديد تقدم خلايا الورم عبر Wnt/
| سرطان الإنسان | الملف الجزيئي | تسليط الضوء | المراجع. |
| سرطان الحنجرة | ماغب1/وينت | MAGP1 يحفز Wnt/
|
[٣٤] |
| سرطان المعدة | Wnt/GPX4 |
|
[23] |
| سرطان الثدي | WNT | نقص p53 يحفز الالتهاب الجهازي المعتمد على WNT، مما يزيد من تفاقم انتشار الورم. | [35] |
| – | WNT | تستخدم خلايا الورم ذات المناعة العالية تنظيم مسار WNT للتوسط في التهرب المناعي | [٣٦] |
| سرطان الرأس والعنق | CMTM6/ENO-1/Akt/GSK-3
|
CMTM6 يحفز مقاومة السيسبلاتين من خلال تثبيت ENO-1 وزيادة تنظيم Wnt لاحقًا | [37] |
| سرطان القولون | Drp1/Wnt | زيادة تنظيم Drp1 تعزز إعادة برمجة الأيض المعتمدة على الأحماض الدهنية لتسريع تنشيط Wnt | [٣٨] |
| سرطان المعدة | TNFRSF11B/Wnt | TNFRSF11B يعزز Wnt/
|
[39] |
| سرطان القولون والمستقيم | Wnt | يمكن أن يؤدي تطبيق مثبطات MEK إلى تحفيز محور Wnt وزيادة مرونة الخلايا الجذعية | [40] |
| سرطان الثدي | RCC2/Wnt | RCC2 ينظم Wnt لزيادة انتشار السرطان المعتمد على EMT | [41] |
| سرطان الأمعاء | Wnt | بروتوك كبتيد يعزز
|
[42] |
| سرطان المثانة | RSPO3/Wnt | RSPO3 ينظم Wnt وHedgehog لزيادة تكوين الأورام | [43] |
آلية EMT: الجوانب العامة والوظيفة المسرطنة
يمكن ملاحظة تنظيم تنازلي، وزيادة في تعبير الفيمينتين وN-كاديرين خلال فقدان القطبية في الخلايا الظهارية. تتواجد عوامل النسخ المحفزة لعملية التحول الظهاري (EMT-TFs) وتظهر تعبيرًا عاليًا في خلايا الورم مثل TGF-
سرطانات [58]. من الجدير بالذكر، أن تثبيط
Wnt/
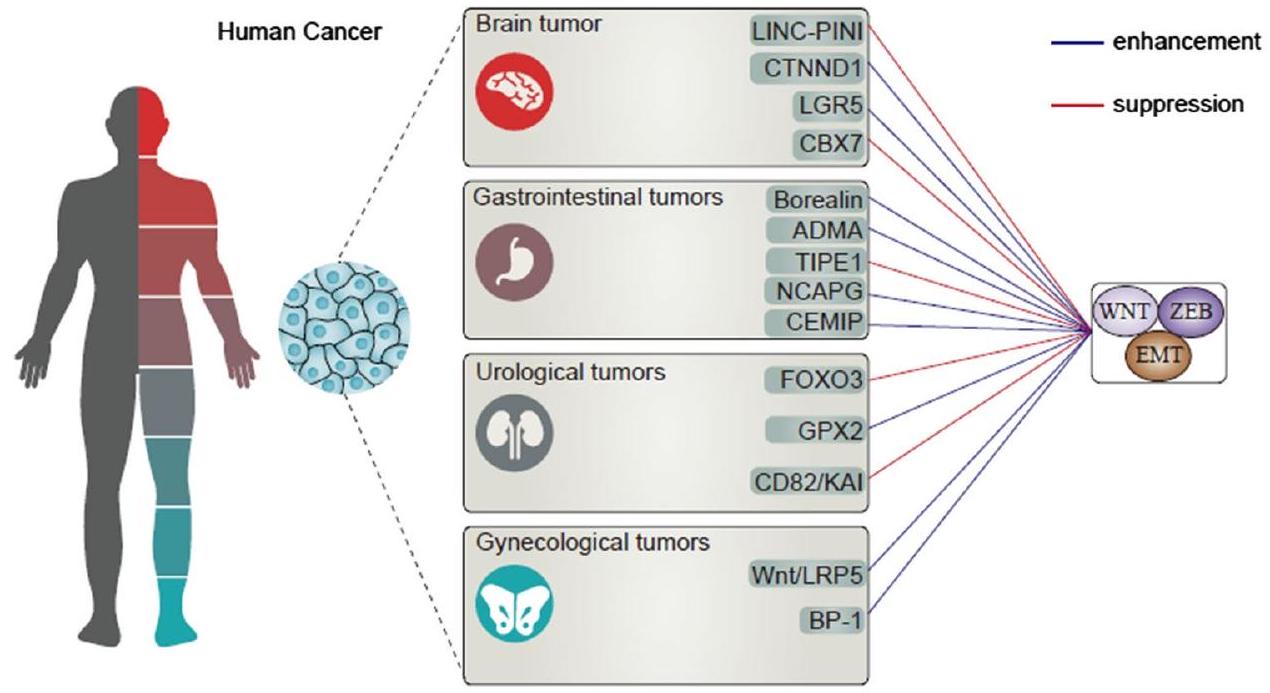
أورام الدماغ
لإعاقة تقدم خلايا GBM، ركزت الدراسات على تقليل العوامل المسؤولة عن تحفيز EMT في السرطانات. على سبيل المثال، عندما ينخفض مستوى تعبير GOLM1 ويتم إسكاته، يحدث كبح لـ Wnt/
أورام الجهاز الهضمي
| سرطان الإنسان | الملف الجزيئي | تسليط الضوء | المراجع. | ||
| سرطان المبيض | إيتس1/درب1/إي إم تي | يزيد Ets1 من مستويات Drp1 لتحفيز التحول الظهاري لتعزيز الانبثاث | [60] | ||
| سرطان بطانة الرحم | نيترين-1 | تثبيط نترين-1 يعيق التكاثر والتحول الظهاري المتوسط | [61] | ||
| سرطان المثانة | CircPTK2/PABPC1/SETDB1 |
|
[62] | ||
| – | RHOJ/EMT | RHOJ يتحكم في مقاومة الأدوية الناتجة عن التحول الظهاري من خلال زيادة الاستجابة للإجهاد التكراري وتحفيز استجابة تلف الحمض النووي. | [63] | ||
| سرطان القولون والمستقيم | دي دي إكس 21 / إم سي إم 5 / إي إم تي | DDX21 يزيد من مستويات MCM5 لتحفيز غزو السرطان المعتمد على EMT | [64] | ||
| سرطان البنكرياس | PYGL | PYGL يحفز إعادة برمجة استقلاب الجلوكوز لتحفيز EMT وتسريع الغزو | [65] | ||
| سرطان الثدي الثلاثي السلبي | TRAIP/EMT | تأثير انخفاض TRAIP يعيق نمو وانتشار خلايا الورم | [66] | ||
| سرطان البنكرياس | STMN2/Wnt | يمكن لـ STMN2 تحفيز التحول الظهاري وزيادة تقدم السرطان من خلال زيادة تنظيم Wnt. | [67] | ||
| سرطان القولون والمستقيم | – | يمكن أن تؤدي توصيل الشيكوينين بواسطة النانو جزيئات إلى إعاقة الانبثاث من خلال تثبيط التحول الظهاري. | [68] |
للوفيات في السكان الصينيين [106، 107]. فيروس التهاب الكبد B (HBV) هو سبب رئيسي لـ HCC في جميع أنحاء العالم ويعود ما يصل إلى
الأورام البولية
سرطانات الدم
تكوين الورم في هذه السرطانات، يجب أن تشارك الدراسات المستقبلية في دور محور Wnt/EMT في تقدم الأورام الدموية. يظهر PLAGL2 زيادة في التعبير في اللمفوما ومن خلال تحفيز محور Wnt/
الأورام النسائية
الجزء المهم يتعلق بدور Wnt/EMT كمحور جديد في تنظيم تقدم سرطان عنق الرحم. يُعتبر APMAP أحد العوامل الرئيسية في نقائل سرطان عنق الرحم، ويحفز EMT من خلال تحفيز إشارة Wnt/
إشارة Wnt/
| مسار | نوع السرطان | ملاحظة | المراجع. |
| TET1/DKK1/EMT | سرطان المبيض | TET1 يثبط التحول الظهاري والانتقال عبر زيادة مستويات DKK1 كمانع لوينت | [132] |
| CRIP1/Wnt/EMT | سرطان المبيض | يحفز CRIP1 محور Wnt/EMT في تعزيز غزو السرطان | [١٣٣] |
| CEBPA/Wnt/EMT | سرطان المبيض | CEBPA يثبط EMT من خلال تقليل Wnt مما يقلل من الغزو | [134] |
| HOXB-AS3/Wnt/EMT | سرطان المبيض | HOXB-AS3 يحفز التحول الظهاري عبر مسار Wnt | [76] |
| HOXC13-AS/
|
سرطان عنق الرحم | HOXC13-AS يحفز التحول الظهاري عبر التوسط
|
[135] |
| CRIP1/Wnt/EMT | سرطان عنق الرحم | CRIP1 يحفز التحول الظهاري عبر تنشيط مسار Wnt | [136] |
| مافي-أ3/وينت/إي إم تي | سرطان عنق الرحم | MAGE-A3 يحفز Wnt في زيادة الغزو وتوسط EMT | [137] |
| SFRP1/2/Wnt/EMT | سرطان عنق الرحم | SFRP1/2 يثبطان التحول الظهاري عبر تقليل تنظيم Wnt | [138] |
| SMYD2/APC2/Wnt/EMT | سرطان القولون والمستقيم | يزيد SMYD2 من تعبير Wnt من خلال تقليل APC2 لتحفيز EMT | [139] |
| CD55/سماد4/
|
سرطان القولون والمستقيم | CD55/Smad4 يثبط
|
[140] |
| HYD-PEP06/Wnt/EMT | سرطان الخلايا الكبدية | HYD-PEP06 يثبط محور Wnt/EMT في تقليل غزو الورم | [141] |
| TNF-
|
سرطان الخلايا الكبدية | TNF-
|
[142] |
| Cx32/Wnt/EMT | سرطان الخلايا الكبدية | انخفاض تعبير Cx32 يؤدي إلى Wnt/EMT | [143] |
| TRIM37/Wnt/EMT | سرطان الخلايا الكبدية | TRIM37 يحفز محور Wnt/EMT في تعزيز تقدم الورم | [144] |
يؤدي إلى مقاومة 5-فلورويوراسيل في ورم القولون. يؤدي معقد الكاديرين-كاتين إلى تحفيز
استهداف ونت/ دوائياً
مستوى التعبير عن
تم اعتبار التدخين (TS) والعدوى الطفيلية والتعرض للإشعاع أو المواد الكيميائية كعوامل محتملة متورطة في تطوره. لقد أظهرت الأدلة المتزايدة وجود ارتباط بين TS وتطور سرطان المثانة. لقد أظهر الكركمين أنه يثبط EMT المثانة ويمنع اكتساب خصائص الخلايا الجذعية في خلايا الورم. يثبط الكركمين مسار Wnt/
تنظيم محور Wnt/EMT في انتشار السرطان بواسطة الجسيمات النانوية: رؤى جديدة
يمكن أن تحسن النانوهياكل من قدرة العلاجات التقليدية في قمع السرطان، حيث تعكس مقاومة الأدوية وتعزز العلاج المناعي. نظرًا لأن Wnt مرتبط بتحفيز EMT، تم تقديم تطبيق الجسيمات النانوية لتنظيم محور Wnt/EMT. تم تقديم هياكل السويروسيد النانوية لعلاج سرطان البروستاتا من خلال زيادة إنتاج ROS والاستماتة. علاوة على ذلك، تؤثر هذه الجسيمات النانوية على نمو وغزو خلايا الورم. إنها تعطل ميزات الخلايا الجذعية بما في ذلك CD33 وCD44. علاوة على ذلك، تؤثر جزيئات السويروسيد النانوية على نشاط TTCF/LEF لقمع
ARN غير المشفر في تنظيم Wnt/
الميكروRNAs
الميكرو RNA-27a هو أحد العوامل التي لا يزال دورها الدقيق في السرطان غير مؤكد، حيث يؤدي امتصاص الميكرو RNA-27a-3p بواسطة circBCAR3 إلى تقدم الورم المريئي [182]، بينما يؤدي انخفاض مستوى الميكرو RNA-27a والميكرو RNA-27b بواسطة circ0000994 إلى تثبيط الورم البنكرياسي [183]، مما يؤكد الوظيفة المزدوجة للميكرو RNA-27a في السرطانات. يظهر الميكرو RNA-135 وظيفة متناقضة مقارنة بالميكرو RNA-27a، ومن خلال تقليل تعبير SMAD3، يقوم الميكرو RNA-135 بتثبيط TGF-
تستمد الإكسوزومات من خلايا ورم الثدي مستويات عالية من miR-7-5p، مما يمكن أن يؤدي إلى تنظيم WNT غير النمطي الذي يقلل من تعبير RYK لصالح فسفرة JNK، مما يؤدي إلى تعزيز بروتين c-Jun ومنع EMT مما يقلل من انتشار السرطان. النقطة المهمة هي أن miRNAs الإكسوزومية يمكن أن تنظم مكونات TME مثل الألياف المرتبطة بالسرطان (CAFs). يظهر miR-146a تركيزًا مرتفعًا في الإكسوزومات المستمدة من خلايا ورم الثدي. من خلال تقليل مستويات TXNIP، يحفز miR-146a Wnt/
ARN غير مشفر طويل
ARNs دائرية
قد تعدل EMT في السرطانات. والأهم من ذلك، يمكن أن تقلل circRNAs من تعبير miRNA من خلال الامتصاص. الهدف العام من القسم الحالي هو تقييم دور circRNAs في تنظيم EMT من خلال استهداف Wnt. يظهر circ-0007059 وظيفة في قمع نمو الورم الرئوي والانتشار، وقدرته على تقليل الانتشار تعود إلى قمع EMT. يقلل hsa-circ-0007059 من تعبير miR-378 ليمنع Wnt.
يمكن تنظيم أكثر من مسار جزيئي في الوقت نفسه بواسطة circ-0067934، ومن الجدير بالذكر أن هذه الدائرة RNA تحفز Wnt/
الخاتمة والملاحظات
| RNA غير مشفر | مسار | آلية العمل | المراجع. |
| miR-621/Wnt/EMT | سرطان القولون والمستقيم | الميكرو RNA-621 يثبط التحول الظهاري عبر تقليل تنظيم Wnt | [219] |
| LINC01315/Wnt/EMT | سرطان القولون والمستقيم | LINC01315 يحفز التحول الظهاري عبر زيادة تنظيم Wnt | [220] |
| CircZFR/miR-3619-5p/Wnt | سرطان الخلايا الكبدية | تقوم إسفنجات CircZFR بامتصاص miR-3619-5p وتحفز مسار Wnt لتعزيز الغزو من خلال تحفيز التحول الظهاري-المتوسط. | [221] |
| miR-194/Wnt/EMT | سرطان الخلايا الكبدية | miR-194 يثبط مسار Wnt لتقليل تقدم خلايا الورم ولمنع التحول الظهاري. | [222] |
| CARLo-7/Wnt/EMT | سرطان المثانة | CARLo-7 يحفز محور Wnt/EMT في زيادة الانبثاث | [٢٢٣] |
| DLX6-AS1/Wnt/EMT | سرطان المثانة | DLX6-AS1 يحاكي محور Wnt/EMT | [224] |
| LSINCT5/NCYM/Wnt/EMT | سرطان المثانة | يتفاعل LSINCT5 مع NCYM لزيادة تعبير Wnt للتوسط في EMT | [225] |
| PlncRNA-1/Wnt/EMT | سرطان القولون والمستقيم | يحفز PlncRNA-1 مسار Wnt مما يزيد من غزو السرطان وتحفيز التحول الظهاري. | [226] |
| ADAMTS9-AS1/Wnt | سرطان القولون والمستقيم | ADAMTS9-AS1 يثبط محور Wnt/EMT في تقليل غزو وانتشار خلايا الورم | [227] |
| الـ RNA الطويل غير المشفر-SRA/Wnt/التحول الظهاري | سرطان بطانة الرحم | SRA يحفز محور Wnt/EMT في زيادة تقدم السرطان | [228] |
| LINC01225/Wnt/EMT | سرطان المعدة | LINC012225 يحفز إشارة Wnt مما يزيد من تقدم السرطان من خلال تحفيز التحول الظهاري. | [229] |
| circ_0003789/Wnt/EMT | سرطان المعدة | يحفز Circ_0003789 محور Wnt/EMT | [230] |
| JPX/miR-33a-5p/Twist1 | سرطان الرئة | تقوم JPX بامتصاص miR-33a-5p لزيادة تعبير Twist1، حيث يقوم Twist1 بتحفيز Wnt ويعزز التحول الظهاري. | [231] |
| miR-516a-3p/Pygo2/Wnt/EMT | سرطان الثدي | miR-516a-3p يثبط محور Pygo2/Wnt في تثبيط EMT | [232] |
| miR-15a-3p/Wnt/EMT | سرطان البروستاتا | miR-15a-3p يثبط محور Wnt/EMT | [233] |
| LncRNA-MIR17HG/miR-17/miR-18a/Wnt/EMT | سرطان القولون | LncRNA-MIR17HG عزز تعبير miR-17 و miR-18a لتحفيز Wnt/EMT | [234] |
| miR-370-3p/Wnt7a/EMT | سرطان المثانة | miR-370-3p يثبط تعبير Wnt7a لتثبيط EMT | [235] |
يمكن تعديل محور Wnt/EMT بواسطة هذه النسخ من RNA غير المشفرة. علاوة على ذلك، فإن المركبات الصيدلانية والهياكل النانوية قادرة على كبح Wnt/EMT في تقليل غزو وانتشار خلايا الورم.
الإعلانات
موافقة الأخلاقيات والموافقة على المشاركة غير قابلة للتطبيق.
الموافقة على النشر غير قابلة للتطبيق.
References
- Aros CJ et al (2020) Distinct spatiotemporally dynamic Wntsecreting niches regulate proximal airway regeneration and aging. Cell Stem Cell 27(3):413-429. e4
- Baarsma H, Königshoff MJT (2017) ‘WNT-er is coming’: WNT signalling in chronic lung diseases. Thorax 72(8):746-759
- Hashimoto S et al (2012)
-Catenin-SOX2 signaling regulates the fate of developing airway epithelium. J Cell Sci 125(4):932-942 - Jung Y-S, Park J-IJE, Medicine M (2020) Wnt signaling in cancer: therapeutic targeting of Wnt signaling beyond
-catenin and the destruction complex. Exp Mol Med 52(2):183-191 - Steinhart Z, Angers SJD (2018) Wnt signaling in development and tissue homeostasis. Development 145(11):dev146589
- Chatterjee A et al (2022) Advances in targeting the WNT/
catenin signaling pathway in cancer. Drug Discovery Today 27(1):82-101 - Moti N et al (2019) Wnt traffic from endoplasmic reticulum to filopodia. PLoS One 14(2):e0212711
- Maeda K et al (2019) The regulation of bone metabolism and disorders by wnt signaling. Int J Mol Sci 20(22):5525
- Gokturk F, Erkoc-Kaya D, Arikoglu H (2021) Juglone can inhibit angiogenesis and metastasis in pancreatic cancer cells by targeting Wnt/beta-catenin signaling. Bratisl Lek Listy 122:132-137
- Sterling JA et al (2011) Advances in the biology of bone metastasis: how the skeleton affects tumor behavior. Bone 48(1):6-15
- Ben-Ghedalia-Peled N, Vago R (2022) Wnt signaling in the development of bone metastasis. Cells 11(23):3934
- Khoon MC (2015) Experimental models of bone metastasis: opportunities for the study of cancer dormancy. Adv Drug Deliv Rev 94:141-150
- Micalizzi DS et al (2010) Epithelial-mesenchymal transition in cancer: parallels between normal development and tumor progression. J Mammary Gland Biol Neoplasia 15(2):117-134
- Cui J et al (2022) Targeting the Wnt signaling pathway for breast cancer bone metastasis therapy. J Mol Med 100(3):373-384
- Logan CY, Nusse R (2004) The Wnt signaling pathway in development and disease. Annu Rev Cell Dev Biol 20:781-810
- Giles RH, Van Es JH, Clevers H (2003) Caught up in a Wnt storm: Wnt signaling in cancer. Biochim Biophys Acta 1653(1):1-24
- Prestwich TC, MacDougald OA (2007) Wnt/
-catenin signaling in adipogenesis and metabolism. Curr Opin Cell Biol 19(6):612-617 - Ross SE et al (2000) Inhibition of adipogenesis by Wnt signaling. Science 289(5481):950-953
- Breuer E-K et al (2019) Potassium channel activity controls breast cancer metastasis by affecting
-catenin signaling. Cell Death Dis 10(3):1-15 - Satriyo PB et al (2019) Cadherin 11 inhibition downregulates
-catenin, deactivates the canonical WNT signalling pathway and suppresses the cancer stem cell-like phenotype of triple negative breast cancer. J Clin Med 8(2):148 - Xi Y, Chen Y (2014) Wnt signaling pathway: implications for therapy in lung cancer and bone metastasis. Cancer Lett 353(1):8-16
- Zhang W et al (2022) KDM1A promotes thyroid cancer progression and maintains stemness through the Wnt/
-catenin signaling pathway. Theranostics 12(4):1500-1517 - Wang Y et al (2022) Wnt/beta-catenin signaling confers ferroptosis resistance by targeting GPX4 in gastric cancer. Cell Death Differ 29(11):2190-2202
- Luo Y et al (2022) Long noncoding RNA LINC01606 protects colon cancer cells from ferroptotic cell death and promotes stemness by SCD1-Wnt/
-catenin-TFE3 feedback loop signalling. Clin Transl Med 12(4):e752 - Ren
et al (2022) The protein kinase activity of NME7 activates Wnt/ -catenin signaling to promote one-carbon metabolism in hepatocellular carcinoma. Cancer Res 82(1):60-74 - Dong S et al (2022) ROS/PI3K/Akt and Wnt/
-catenin signalings activate HIF- -induced metabolic reprogramming to impart 5-fluorouracil resistance in colorectal cancer. J Exp Clin Cancer Res 41(1):15 - Li Y et al (2022) circ-EIF6 encodes EIF6-224aa to promote TNBC progression via stabilizing MYH9 and activating the Wnt/beta-catenin pathway. Mol Ther 30(1):415-430
- Chen B et al (2022) N(7)-methylguanosine tRNA modification promotes tumorigenesis and chemoresistance through WNT/
-catenin pathway in nasopharyngeal carcinoma. Oncogene 41(15):2239-2253 - Xu Q et al (2022) Loss of TET reprograms Wnt signaling through impaired demethylation to promote lung cancer development. Proc Natl Acad Sci U S A 119(6):e2107599119
- Yan R et al (2022) Liquidambaric acid inhibits Wnt/
-catenin signaling and colon cancer via targeting TNF receptor-associated factor 2. Cell Rep 38(5):110319 - Geleta B et al (2022) Targeting Wnt/tenascin C-mediated cross talk between pancreatic cancer cells and stellate cells via activation of the metastasis suppressor NDRG1. J Biol Chem 298(3):101608
- Yamamoto D et al (2022) Characterization of RNF43 frameshift mutations that drive Wnt ligand- and R-spondindependent colon cancer. J Pathol 257(1):39-52
- Yan R et al (2022) Inhibition of DCLK1 sensitizes resistant lung adenocarcinomas to EGFR-TKI through suppression of Wnt
-catenin activity and cancer stemness. Cancer Lett 531:83-97 - Lv F et al (2023) MAGP1 maintains tumorigenicity and angiogenesis of laryngeal cancer by activating Wnt/
-catenin/MMP7 pathway. Carcinogenesis 16:bgad003 - Wellenstein MD et al (2019) Loss of p53 triggers WNTdependent systemic inflammation to drive breast cancer metastasis. Nature 572(7770):538-542
- Takeuchi Y et al (2021) Highly immunogenic cancer cells require activation of the WNT pathway for immunological escape. Sci Immunol 6(65):eabc6424
- Mohapatra P et al (2021) CMTM6 drives cisplatin resistance by regulating Wnt signaling through the ENO-1/AKT/GSK3
axis. JCI Insight 6(4):e143643 - Xiong X et al (2022) Activation of Drp1 promotes fatty acidsinduced metabolic reprograming to potentiate Wnt signaling in colon cancer. Cell Death Differ 29(10):1913-1927
- Luan F et al (2020) TNFRSF11B activates Wnt/
-catenin signaling and promotes gastric cancer progression. Int J Biol Sci 16(11):1956-1971 - Zhan T et al (2019) MEK inhibitors activate Wnt signalling and induce stem cell plasticity in colorectal cancer. Nat Commun 10(1):2197
- Chen Z et al (2019) RCC2 promotes breast cancer progression through regulation of Wnt signaling and inducing EMT. J Cancer 10(27):6837-6847
- Liao H et al (2020) A PROTAC peptide induces durable
-catenin degradation and suppresses Wnt-dependent intestinal cancer. Cell Discov 6:35 - Chen Z et al (2019) RSPO3 promotes the aggressiveness of bladder cancer via Wnt/
-catenin and Hedgehog signaling pathways. Carcinogenesis 40(2):360-369 - Shao Z et al (2022) The role of long noncoding RNAs as regulators of the epithelial-mesenchymal transition process in oral squamous cell carcinoma cells. Front Mol Biosci 9:942636
- Kalluri R, Weinberg RA (2009) The basics of epithelial-mesenchymal transition. J Clin Investig 119(6):1420-1428
- Yang J, Weinberg RA (2008) Epithelial-mesenchymal transition: at the crossroads of development and tumor metastasis. Dev Cell 14(6):818-829
- Lim J, Thiery JP (2012) Epithelial-mesenchymal transitions: insights from development. Development 139(19):3471-3486
- Horejs CM (2016) Basement membrane fragments in the context of the epithelial-to-mesenchymal transition. Eur J Cell Biol 95(11):427-440
- Lamouille S, Xu J, Derynck R (2014) Molecular mechanisms of epithelial-mesenchymal transition. Nat Rev Mol Cell Biol 15(3):178-196
- Dongre A, Weinberg RA (2019) New insights into the mechanisms of epithelial-mesenchymal transition and implications for cancer. Nat Rev Mol Cell Biol 20(2):69-84
- Liu C et al (2022) Hypoxia promotes epithelial-mesenchymal transition in lung cancer cells via regulating the NRF2/miR27a/BUB1 pathway. Clin Transl Oncol 25:510-522
- Du Q et al (2022) Downregulation of iNOS/NO promotes epi-thelial-mesenchymal transition and metastasis in colorectal cancer. Mol Cancer Res 21:102-114
- Liu
et al (2022) PODNL1 promotes cell migration and regulates the epithelial/mesenchymal transition process in bladder cancer. Biochem Biophys Res Commun 620:165-172 - Sahoo SS et al (2022) FOXA2 suppresses endometrial carcinogenesis and epithelial-mesenchymal transition by regulating enhancer activity. J Clin Invest 132(12):e157574
- Yun
et al (2022) NANOG regulates epithelial-mesenchymal transition via AMPK/mTOR signalling pathway in ovarian cancer SKOV-3 and A2780 cells. J Cell Mol Med 26(20):5277-5291 - Deng H, Chen G, Zhang J (2022)
-elemene regulates epi-thelial-mesenchymal transformation and inhibits invasion and metastasis of colorectal cancer cells. J Complement Integr Med 8:e78700 - Tu H et al (2022)
-Patchoulene represses hypoxia-induced proliferation and epithelial-mesenchymal transition of liver cancer cells. Bioengineered 13(5):11907-11922 - Guo Z et al (2023) Molecular profile of metastasis, cell plasticity and EMT in pancreatic cancer: a pre-clinical connection to aggressiveness and drug resistance. Cancer Metastasis Rev. https://doi.org/10.1007/s10555-023-10125-y
- Luan H et al (2022) Fucoxanthin induces apoptosis and reverses epithelial-mesenchymal transition via inhibiting Wnt/
-catenin pathway in lung adenocarcinoma. Discov Oncol 13(1):98 - Ghosh D et al (2023) Ets1 facilitates EMT/invasion through Drp1-mediated mitochondrial fragmentation in ovarian cancer. iScience 26(9):107537
- Cassier PA et al (2023) Netrin-1 blockade inhibits tumour growth and EMT features in endometrial cancer. Nature 620(7973):409-416
- Meng
et al (2023) CircPTK2/PABPC1/SETDB1 axis promotes EMT-mediated tumor metastasis and gemcitabine resistance in bladder cancer. Cancer Lett 554:216023 - Debaugnies M et al (2023) RHOJ controls EMT-associated resistance to chemotherapy. Nature 616(7955):168-175
- Gao H et al (2023) Phase separation of DDX21 promotes colorectal cancer metastasis via MCM5-dependent EMT pathway. Oncogene 42(21):1704-1715
- Ji Q et al (2023) PYGL-mediated glucose metabolism reprogramming promotes EMT phenotype and metastasis of pancreatic cancer. Int J Biol Sci 19(6):1894-1909
- Zheng Y et al (2023) Silencing TRAIP suppresses cell proliferation and migration/invasion of triple negative breast cancer via RB-E2F signaling and EMT. Cancer Gene Ther 30(1):74-84
- Shao M et al (2023) STMN2 overexpression promotes cell proliferation and EMT in pancreatic cancer mediated by WNT/
catenin signaling. Cancer Gene Ther 30(3):472-480 - Long L et al (2023) Regulating lactate-related immunometabolism and EMT reversal for colorectal cancer liver metastases using shikonin targeted delivery. J Exp Clin Cancer Res 42(1):117
- Ohgaki H, Kleihues P (2005) Epidemiology and etiology of gliomas. Acta Neuropathol 109(1):93-108
- Dolecek TA et al (2012) CBTRUS statistical report: primary brain and central nervous system tumors diagnosed in the United States in 2005-2009. Neuro Oncol 14(suppl_5):v1-v49
- Van Meir EG et al (2010) Exciting new advances in neuro-oncology: the avenue to a cure for malignant glioma. CA Cancer J Clin 60(3):166-193
- Carlsson SK, Brothers SP, Wahlestedt C (2014) Emerging treatment strategies for glioblastoma multiforme. EMBO Mol Med 6(11):1359-1370
- Auffinger B et al (2015) The role of glioma stem cells in chemotherapy resistance and glioblastoma multiforme recurrence. Expert Rev Neurother 15(7):741-752
- Zhao L et al (2020) STAT1 determines aggressiveness of glioblastoma both in vivo and in vitro through wnt/
-catenin signalling pathway. Cell Biochem Funct 38(5):630-641 - Zhu H et al (2020) Long noncoding RNA LINC-PINT suppresses cell proliferation, invasion, and EMT by blocking Wnt/
-catenin signaling in glioblastoma. Front Pharmacol 11:586653 - Zhuang XH, Liu Y, Li JL (2019) Overexpression of long noncoding RNA HOXB-AS3 indicates an unfavorable prognosis and promotes tumorigenesis in epithelial ovarian cancer via Wnt/
catenin signaling pathway. Biosci Rep 39(8):BSR20190906 - Ding
et al (2019) GOLM1 silencing inhibits the proliferation and motility of human glioblastoma cells via the Wnt/ -catenin signaling pathway. Brain Res 1717:117-126 - Wu S et al (2019) Silencing expression of PHF14 in glioblastoma promotes apoptosis, mitigates proliferation and invasiveness via Wnt signal pathway. Cancer Cell Int 19:314
- Han L et al (2019) SNHG29 regulates miR-223-3p/CTNND1 axis to promote glioblastoma progression via Wnt/
-catenin signaling pathway. Cancer Cell Int 19:345 - Zhang J et al (2018) LGR5, a novel functional glioma stem cell marker, promotes EMT by activating the Wnt/
-catenin pathway
and predicts poor survival of glioma patients. J Exp Clin Cancer Res 37(1):225 - Nawaz Z et al (2016) Cbx 7 is epigenetically silenced in glioblastoma and inhibits cell migration by targeting YAP/TAZdependent transcription. Sci Rep 6:27753
- Yu T et al (2017) CBX7 is a glioma prognostic marker and induces G1/S arrest via the silencing of CCNE1. Oncotarget 8(16):26637-26647
- Chen L et al (2020) Knockdown of TRIM47 inhibits glioma cell proliferation, migration and invasion through the inactivation of Wnt/
-catenin pathway. Mol Cell Probes 53:101623 - Huang G et al (2022) Methyl-CpG binding protein 2 (MeCP2) as a potential diagnostic and prognostic marker facilitates glioma progression through activation of the Wnt/
-Catenin pathway. World Neurosurg 171:e560-e571 - Ni H et al (2021) The nuclear transporter importin-11 regulates the Wnt/
-catenin pathway and acts as a tumor promoter in glioma. Int J Biol Macromol 176:145-156 - Fitzmaurice C et al (2019) Global, regional, and national cancer incidence, mortality, years of life lost, years lived with disability, and disability-adjusted life-years for 29 cancer groups, 1990 to 2017: a systematic analysis for the global burden of disease study. JAMA Oncol 5(12):1749-1768
- Chen W et al (2016) Cancer statistics in China, 2015. CA Cancer J Clin 66(2):115-132
- Ferlay J et al (2010) Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer 127(12):2893-2917
- Biagioni A et al (2019) Update on gastric cancer treatments and gene therapies. Cancer Metastasis Rev 38(3):537-548
- Guo Q et al (2021) ADMA mediates gastric cancer cell migration and invasion via Wnt/
-catenin signaling pathway. Clin Transl Oncol 23(2):325-334 - Ge Q et al (2020) Zic1 suppresses gastric cancer metastasis by regulating Wnt/
-catenin signaling and epithelial-mesenchymal transition. Faseb j 34(2):2161-2172 - Fayngerts SA et al (2014) TIPE3 is the transfer protein of lipid second messengers that promote cancer. Cancer Cell 26(4):465-478
- Kumar D et al (2004) Expression of SCC-S2, an antiapoptotic molecule, correlates with enhanced proliferation and tumorigenicity of MDA-MB 435 cells. Oncogene 23(2):612-616
- Sun H et al (2008) TIPE2, a negative regulator of innate and adaptive immunity that maintains immune homeostasis. Cell 133(3):415-426
- Zhang Y et al (2012) TIPE2, a novel regulator of immunity, protects against experimental stroke. J Biol Chem 287(39):32546-32555
- Zhang Z et al (2015) TIPE1 induces apoptosis by negatively regulating Rac1 activation in hepatocellular carcinoma cells. Oncogene 34(20):2566-2574
- Liu W et al (2018) TIPE1 suppresses invasion and migration through down-regulating Wnt/
-catenin pathway in gastric cancer. J Cell Mol Med 22(2):1103-1117 - Li S et al (2020) Wnt/
-catenin signaling axis is required for TFEB-mediated gastric cancer metastasis and epithelial-mesenchymal transition. Mol Cancer Res 18(11):1650-1659 - Peng Y et al (2021) MiRNA-20b/SUFU/Wnt axis accelerates gastric cancer cell proliferation, migration and EMT. Heliyon 7(4):e06695
- Sung H et al (2021) Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 71(3):209-249
- Mauri G et al (2019) Early-onset colorectal cancer in young individuals. Mol Oncol 13(2):109-131
- Miller KD et al (2019) Cancer treatment and survivorship statistics, 2019. CA Cancer J Clin 69(5):363-385
- Shi Y et al (2022) NCAPG facilitates colorectal cancer cell proliferation, migration, invasion and epithelial-mesenchymal transition by activating the Wnt/
-catenin signaling pathway. Cancer Cell Int 22(1):119 - Zhang M et al (2018) RHBDD1 promotes colorectal cancer metastasis through the Wnt signaling pathway and its downstream target ZEB1. J Exp Clin Cancer Res 37(1):22
- Liang G et al (2018) Silencing of CEMIP suppresses Wnt/
catenin/Snail signaling transduction and inhibits EMT program of colorectal cancer cells. Acta Histochem 120(1):56-63 - Xing
et al (2019) The prognostic value of major facilitator superfamily domain-containing protein 2A in patients with hepatocellular carcinoma. Aging (Albany NY) 11(19):8474-8483 - Zheng R et al (2017) Estimates of cancer incidence and mortality in China, 2013. Chin J Cancer 36(1):66
- Bhaumik P (2015) Epidemiology of viral hepatitis and liver diseases in India. Euroasian J Hepatogastroenterol 5(1):34-36
- Younossi ZM et al (2015) Association of nonalcoholic fatty liver disease (NAFLD) with hepatocellular carcinoma (HCC) in the United States from 2004 to 2009. Hepatology 62(6):1723-1730
- Liao S et al (2020) Aquaporin 9 inhibits growth and metastasis of hepatocellular carcinoma cells via Wnt/
-catenin pathway. Aging (Albany NY) 12(2):1527-1544 - Chen B et al (2022) Borealin promotes tumor growth and metastasis by activating the Wnt/
-catenin signaling pathway in hepatocellular carcinoma. J Hepatocell Carcinoma 9:171-188 - Sun L et al (2017) Oct4 induces EMT through LEF1/
-catenin dependent WNT signaling pathway in hepatocellular carcinoma. Oncol Lett 13(4):2599-2606 - Center MM et al (2012) International variation in prostate cancer incidence and mortality rates. Eur Urol 61(6):1079-1092
- Taichman RS et al (2007) The evolving biology and treatment of prostate cancer. J Clin Investig 117(9):2351-2361
- Liu H et al (2015) FOXO3a modulates WNT/
-catenin signaling and suppresses epithelial-to-mesenchymal transition in prostate cancer cells. Cell Signal 27(3):510-518 - Yang M et al (2022) GPX2 predicts recurrence-free survival and triggers the Wnt/
-catenin/EMT pathway in prostate cancer. PeerJ 10:e14263 - Sha J et al (2018) PRKAR2B promotes prostate cancer metastasis by activating Wnt/
-catenin and inducing epithelial-mesenchymal transition. J Cell Biochem 119(9):7319-7327 - Lee MS et al (2019) The metastasis suppressor CD82/KAI1 represses the TGF-
(1) and Wnt signalings inducing epithelial-to-mesenchymal transition linked to invasiveness of prostate cancer cells. Prostate 79(12):1400-1411 - Zhou Q et al (2019) EFEMP2 suppresses epithelial-mesenchymal transition via Wnt/
-catenin signaling pathway in human bladder cancer. Int J Biol Sci 15(10):2139-2155 - Zhang P et al (2022) ARL4C Regulates the Progression of Clear Cell Renal Cell Carcinoma by Affecting the Wnt/
-Catenin Signaling Pathway. J Oncol 2022:2724515 - Jin W, Wang X (2022) PLAGL2 promotes the proliferation and migration of diffuse large B-cell lymphoma cells via Wnt/
catenin pathway. Ann Clin Lab Sci 52(3):359-366 - Guo B et al (2021) miR-744-5p inhibits multiple myeloma proliferation, epithelial mesenchymal transformation and glycolysis by targeting SOX12/Wnt/
-catenin signaling. Onco Targets Ther 14:1161-1172 - Siegel RL, Miller KD, Jemal A (2017) Cancer statistics, 2017. CA Cancer J Clin 67(1):7-30
- Vaughan S et al (2011) Rethinking ovarian cancer: recommendations for improving outcomes. Nat Rev Cancer 11(10):719-725
- Hong
et al (2021) Inactivation of Wnt-LRP5 signaling suppresses the proliferation and migration of ovarian cancer cells. Transl Cancer Res 10(5):2277-2285 - Liu
et al (2022) Benzophenone- 1 induced aberrant proliferation and metastasis of ovarian cancer cells via activated ER and Wnt/ -catenin signaling pathways. Environ Pollut 292(Pt B):118370 - Wen J et al (2020) IL-8 promotes cell migration through regulating EMT by activating the Wnt/
-catenin pathway in ovarian cancer. J Cell Mol Med 24(2):1588-1598 - Bray F et al (2018) Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 68(6):394-424
- Zhang J et al (2022) DYNLT3 overexpression induces apoptosis and inhibits cell growth and migration via inhibition of the Wnt pathway and EMT in cervical cancer. Front Oncol 12:889238
- Zhu X et al (2021) APMAP promotes epithelial-mesenchymal transition and metastasis of cervical cancer cells by activating the Wnt/
-catenin pathway. J Cancer 12(20):6265-6273 - Lan C et al (2021) FAM83A promotes the proliferative and invasive abilities of cervical cancer cells via epithelial-mesenchymal transition and the Wnt signaling pathway. J Cancer 12(21):6320-6329
- Duan H et al (2017) TET1 inhibits EMT of ovarian cancer cells through activating Wnt/
-catenin signaling inhibitors DKK1 and SFRP2. Gynecol Oncol 147(2):408-417 - Liu Y et al (2021) Cysteine-rich intestinal protein 1 served as an epithelial ovarian cancer marker via promoting Wnt/
-catenin-mediated EMT and tumour metastasis. Dis Markers 2021:3566749 - Zhang LM et al (2021) CCAAT enhancer binding protein
suppresses proliferation, metastasis, and epithelial-mesenchymal transition of ovarian cancer cells via suppressing the Wnt/ -catenin signaling. Neoplasma 68(3):602-612 - Wang T et al (2021) FTO-stabilized lncRNA HOXC13-AS epigenetically upregulated FZD6 and activated Wnt/
-catenin signaling to drive cervical cancer proliferation, invasion, and EMT. J buon 26(4):1279-1291 - Zhang LZ et al (2018) CRIP1 promotes cell migration, invasion and epithelial-mesenchymal transition of cervical cancer by activating the Wnt/
-catenin signaling pathway. Life Sci 207:420-427 - Gao
et al (2020) Aberrantly enhanced melanoma-associated antigen (MAGE)-A3 expression facilitates cervical cancer cell proliferation and metastasis via actuating Wnt signaling pathway. Biomed Pharmacother 122:109710 - Chung MT et al (2009) SFRP1 and SFRP2 suppress the transformation and invasion abilities of cervical cancer cells through Wnt signal pathway. Gynecol Oncol 112(3):646-653
- Meng F et al (2020) SMYD2 suppresses APC2 expression to activate the Wnt/
-catenin pathway and promotes epithelialmesenchymal transition in colorectal cancer. Am J Cancer Res 10(3):997-1011 - Xiao B et al (2020) Oncolytic adenovirus CD55-Smad4 suppresses cell proliferation, metastasis, and tumor stemness in colorectal cancer by regulating Wnt/
-catenin signaling pathway. Biomedicines 8(12):593 - Tian W et al (2021) HYD-PEP06 suppresses hepatocellular carcinoma metastasis, epithelial-mesenchymal transition and cancer stem cell-like properties by inhibiting PI3K/AKT and WNT/
-catenin signaling activation. Acta Pharm Sin B 11(6):1592-1606 - Chen Y et al (2019) TNF-
derived from M2 tumor-associated macrophages promotes epithelial-mesenchymal transition and cancer stemness through the Wnt/ -catenin pathway in SMMC7721 hepatocellular carcinoma cells. Exp Cell Res 378(1):41-50 - Yang Y et al (2017) Downregulated connexin 32 promotes EMT through the Wnt/
-catenin pathway by targeting Snail expression in hepatocellular carcinoma. Int J Oncol 50(6):1977-1988 - Jiang J et al (2015) Over-expression of TRIM37 promotes cell migration and metastasis in hepatocellular carcinoma by activating Wnt/
-catenin signaling. Biochem Biophys Res Commun 464(4):1120-1127 - Mitra T et al (2018) Stemness and chemoresistance are imparted to the OC cells through TGF
driven EMT. J Cell Biochem 119(7):5775-5787 - Ahmad SM et al (2020) Par-4 activation restrains EMT-induced chemoresistance in PDAC by attenuating MDM-2. Pancreatology 20(8):1698-1710
- Zhao C et al (2020) MicroRNA-128-3p enhances the chemosensitivity of temozolomide in glioblastoma by targeting c-Met and EMT. Sci Rep 10(1):9471
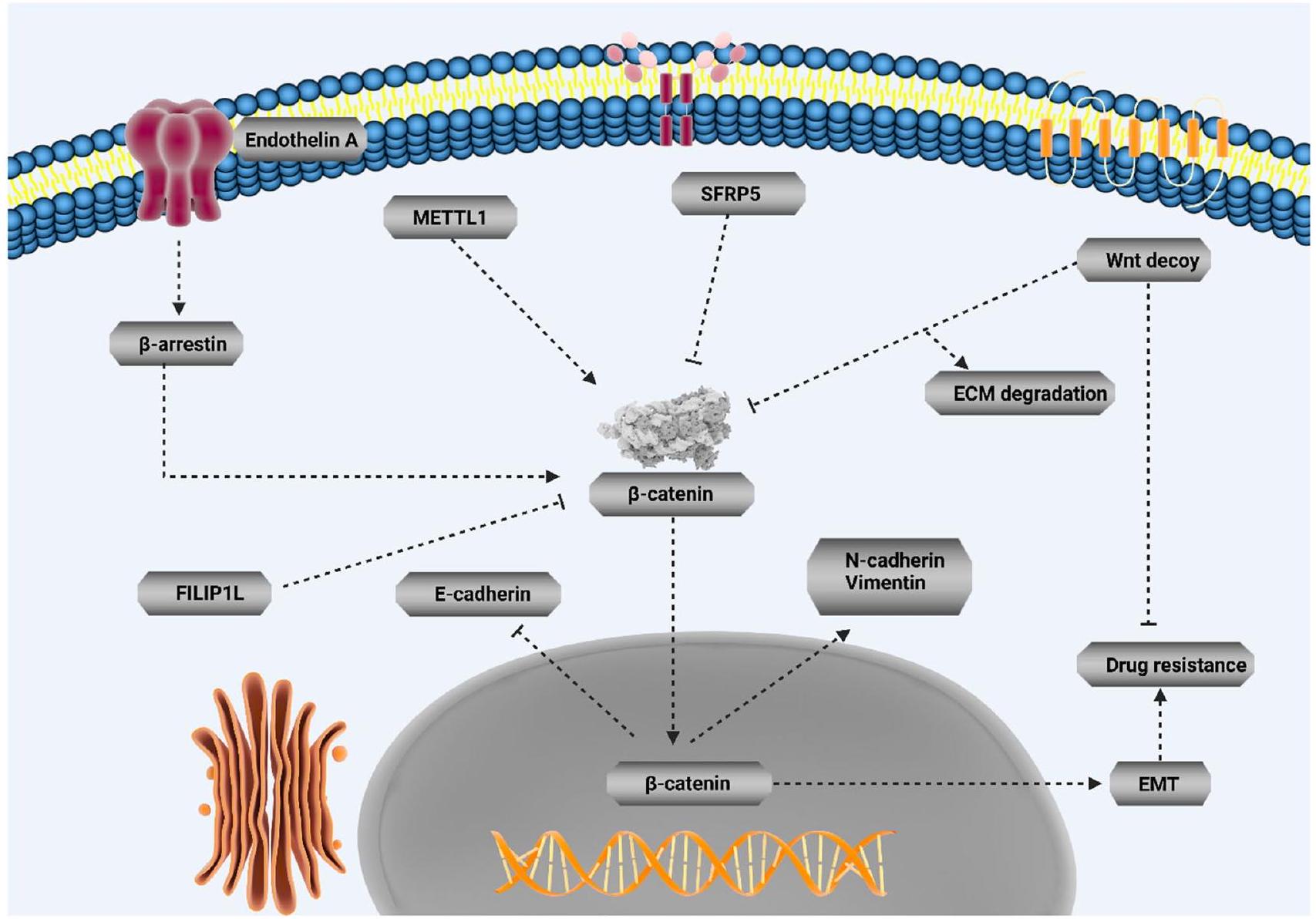
- Rosanò L et al (2014) Endothelin A receptor/
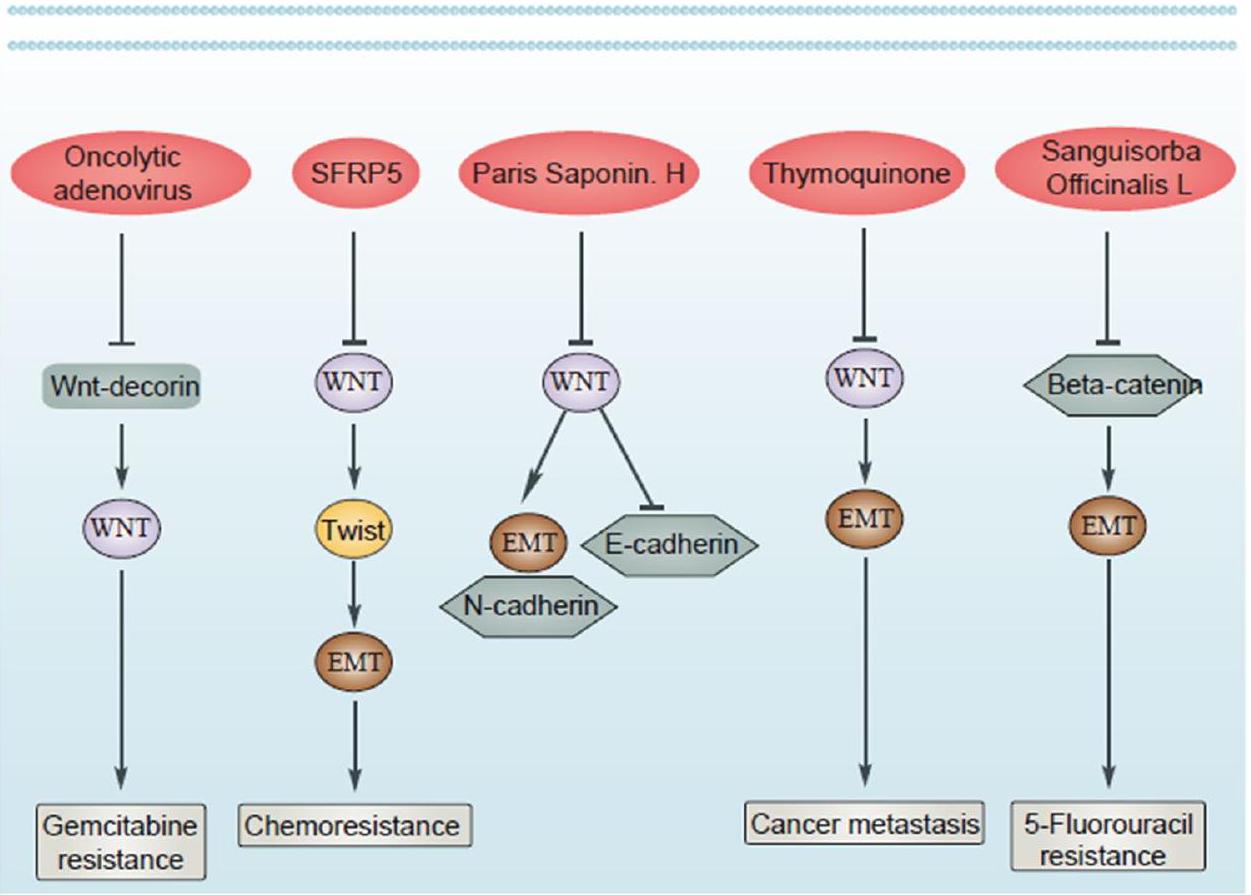
-arrestin signaling to the Wnt pathway renders ovarian cancer cells resistant to chemotherapy. Cancer Res 74(24):7453-7464 - Li Y et al (2019) Oncolytic Ad co-expressing decorin and Wnt decoy receptor overcomes chemoresistance of desmoplastic tumor through degradation of ECM and inhibition of EMT. Cancer Lett 459:15-29
- Su HY et al (2010) Epigenetic silencing of SFRP5 is related to malignant phenotype and chemoresistance of ovarian cancer through Wnt signaling pathway. Int J Cancer 127(3):555-567
- Kwon M et al (2016) Reduced expression of FILIP1L, a novel WNT pathway inhibitor, is associated with poor survival, progression and chemoresistance in ovarian cancer. Oncotarget 7(47):77052-77070
- Zhang W et al (2022) Sanguisorba officinalis L. suppresses 5-fluorouracil-sensitive and-resistant colorectal cancer growth and metastasis via inhibition of the Wnt/
-catenin pathway. Phytomedicine 94:153844 - Xing Y et al (2022) A novel
– (2,4-dinitrophenyl) diazeniumdiolate inhibits hepatocellular carcinoma migration, invasion, and EMT through the Wnt/ -catenin pathway. Toxicol In Vitro 84:105456 - Shalev N et al (2022) Phytocannabinoid compositions from cannabis act synergistically with PARP1 inhibitor against ovarian cancer cells in vitro and affect the Wnt signaling pathway. Molecules 27(21):7523
- Pisanti S et al (2017) Cannabidiol: state of the art and new challenges for therapeutic applications. Pharmacol Ther 175:133-150
- Jo MJ et al (2021) Cannabidiol suppresses angiogenesis and stemness of breast cancer cells by downregulation of hypoxiainducible factors-1
. Cancers 13(22):5667 - Feng P et al (2022) Cannabidiol inhibits invasion and metastasis in colorectal cancer cells by reversing epithelial-mesenchymal transition through the Wnt/
-catenin signaling pathway. J Cancer Res Clin Oncol 149:3587-3598 - Chen T et al (2019) Paris saponin H suppresses human hepatocellular carcinoma (HCC) by inactivation of Wnt/
-catenin pathway in vitro and in vivo. Int J Clin Exp Pathol 12(8):2875-2886 - Wei C et al (2019) Wogonoside inhibits prostate cancer cell growth and metastasis via regulating Wnt/
-catenin pathway and epithelial-mesenchymal transition. Pharmacology 104(5-6):312-319 - Li K et al (2018) Oldhamianoside II inhibits prostate cancer progression via regulation of EMT and the Wnt/
-catenin signaling pathway. Oncol Lett 15(6):9457-9463 - Tsao CW et al (2021) Regulation of carcinogenesis and mediation through Wnt/
-catenin signaling by 3,3′-diindolylmethane in an enzalutamide-resistant prostate cancer cell line. Sci Rep 11(1):1239 - Wu S et al (2018) 2′-Hydroxyflavanone inhibits epithelial-mesenchymal transition, and cell migration and invasion via suppression of the Wnt/
-catenin signaling pathway in prostate cancer. Oncol Rep 40(5):2836-2843 - Effenberger-Neidnicht K, Schobert R (2011) Combinatorial effects of thymoquinone on the anti-cancer activity of doxorubicin. Cancer Chemother Pharmacol 67(4):867-874
- Kruk I et al (2000) The effect of thymol and its derivatives on reactions generating reactive oxygen species. Chemosphere 41(7):1059-1064
- Ahmad A et al (2013) A review on therapeutic potential of Nigella sativa: A miracle herb. Asian Pac J Trop Biomed 3(5):337-352
- Salem ML (2005) Immunomodulatory and therapeutic properties of the Nigella sativa L. seed. Int Immunopharmacol 5(13-14):1749-1770
- Zhang M et al (2020) Thymoquinone suppresses invasion and metastasis in bladder cancer cells by reversing EMT through the Wnt/
-catenin signaling pathway. Chem Biol Interact 320:109022 - Liang Z et al (2015) Inhibition of tobacco smoke-induced bladder MAPK activation and epithelial-mesenchymal transition in mice by curcumin. Int J Clin Exp Pathol 8(5):4503
- Liang Z et al (2017) Curcumin reversed chronic tobacco smoke exposure induced urocystic EMT and acquisition of cancer stem cells properties via Wnt/
-catenin. Cell Death Dis 8(10):e3066 - Cilibrasi C et al (2017) Resveratrol Impairs Glioma Stem Cells Proliferation and Motility by Modulating the Wnt Signaling Pathway. PLoS One 12(1):e0169854
- Fang Q et al (2022)
-ionone inhibits epithelial-mesenchymal transition (EMT) in prostate cancer cells by negatively regulating the Wnt/ -catenin pathway. Front Biosci (Landmark Ed) 27(12):335 - Zhao M et al (2020) Gigantol attenuates the metastasis of human bladder cancer cells, possibly through Wnt/EMT signaling. Onco Targets Ther 13:11337-11346
- Fang RH, Gao W, Zhang L (2023) Targeting drugs to tumours using cell membrane-coated nanoparticles. Nat Rev Clin Oncol 20(1):33-48
- Zeng Y et al (2022) Cell membrane coated-nanoparticles for cancer immunotherapy. Acta Pharm Sin B 12(8):3233-3254
- Gavas S, Quazi S, Karpiński TM (2021) Nanoparticles for cancer therapy: current progress and challenges. Nanoscale Res Lett 16(1):173
- Liang
et al (2023) cRGD-targeted heparin nanoparticles for effective dual drug treatment of cisplatin-resistant ovarian cancer. J Control Release 356:691-701 - Huang
et al (2021) Anticancer activity of sweroside nanoparticles in prostate cancer bone metastasis in PC-3 cells involved in Wnt/ -catenin signaling pathway. J Biomed Nanotechnol 17(10):1960-1971 - Rupaimoole R, Slack FJ (2017) MicroRNA therapeutics: towards a new era for the management of cancer and other diseases. Nat Rev Drug Discov 16(3):203-222
- Anastasiadou E, Jacob LS, Slack FJ (2018) Non-coding RNA networks in cancer. Nat Rev Cancer 18(1):5-18
- Yang F et al (2019) MiR-1246 promotes metastasis and invasion of A549 cells by targeting GSK-3
-mediated Wnt -catenin pathway. Cancer Res Treat 51(4):1420-1429 - Du F et al (2020) KRAS mutation-responsive miR-139-5p inhibits colorectal cancer progression and is repressed by Wnt signaling. Theranostics 10(16):7335-7350
- Xi Y et al (2022) CircBCAR3 accelerates esophageal cancer tumorigenesis and metastasis via sponging miR-27a-3p. Mol Cancer 21(1):145
- Liu J, Yuan W, Gong D (2022) Hsa_circ_0000994 inhibits pancreatic cancer progression by clearing immune-related miR-27a and miR-27b. J Oncol 2022:7274794
- Yang W et al (2020) MiR-135-5p inhibits TGF-
-induced epithe-lial-mesenchymal transition and metastasis by targeting SMAD3 in breast cancer. J Cancer 11(21):6402-6412 - Yang Y et al (2019) MiR-135 suppresses glycolysis and promotes pancreatic cancer cell adaptation to metabolic stress by targeting phosphofructokinase-1. Nat Commun 10(1):809
- Yue H et al (2017) MIR-519d suppresses the gastric cancer epi-thelial-mesenchymal transition via Twist1 and inhibits Wnt/
catenin signaling pathway. Am J Transl Res 9(8):3654-3664 - Han
et al (2022) Knockdown of mediator complex subunit 27 suppresses gastric cancer cell metastasis and angiogenesis via Wnt/ -catenin pathway. Tissue Cell 79:101973 - Sun Y et al (2022) Overexpression of FOXC1 promotes tumor metastasis by activating the Wnt/
-catenin signaling pathway in gastric cancer. Dig Dis Sci 67(8):3742-3752 - Ma B et al (2020) Effects of miR-330-3p on invasion, migration and emt of gastric cancer cells by targeting PRRX1mediated Wnt/
-catenin signaling pathway. Onco Targets Ther 13:3411-3423 - Lin L et al (2022) SOX17 and PAX8 constitute an actionable lineage-survival transcriptional complex in ovarian cancer. Oncogene 41(12):1767-1779
- Wu X et al (2022) miR-200a-3p promoted cell proliferation and metastasis by downregulating SOX17 in non-small cell lung cancer cells. J Biochem Mol Toxicol 36(6):e23037
- Gallo A et al (2012) The majority of microRNAs detectable in serum and saliva is concentrated in exosomes. PLoS One 7(3):e30679
- Zomer A et al (2010) Exosomes: Fit to deliver small RNA. Commun Integr Biol 3(5):447-450
- Paskeh MDA et al (2022) Emerging role of exosomes in cancer progression and tumor microenvironment remodeling. J Hematol Oncol 15(1):83
- Mirzaei S et al (2023) Exosome-mediated miR-200a delivery into TGF-
-treated AGS cells abolished epithelial-mesenchymal transition with normalization of ZEB1, vimentin and Snail1 expression. Environ Res 231:116115 - Record M et al (2014) Exosomes as new vesicular lipid transporters involved in cell-cell communication and various pathophysiologies. Biochim Biophys Acta 1841(1):108-120
- Tyagi A et al (2022) Exosomal miR-4466 from nicotine-activated neutrophils promotes tumor cell stemness and metabolism in lung cancer metastasis. Oncogene 41(22):3079-3092
- Liang Z et al (2022) Downregulation of exosomal miR-7-5p promotes breast cancer migration and invasion by targeting RYK and participating in the atypical WNT signalling pathway. Cell Mol Biol Lett 27(1):88
- Yang SS et al (2020) Breast cancer-derived exosomes regulate cell invasion and metastasis in breast cancer via miR-146a to activate cancer associated fibroblasts in tumor microenvironment. Exp Cell Res 391(2):111983
- Chen M et al (2018) Decreased expression of lncRNA VPS9D1AS1 in gastric cancer and its clinical significance. Cancer Biomark 21(1):23-28
- Bracken CP, Scott HS, Goodall GJ (2016) A network-biology perspective of microRNA function and dysfunction in cancer. Nat Rev Genet 17(12):719-732
- Xue X et al (2016) LncRNA HOTAIR enhances ER signaling and confers tamoxifen resistance in breast cancer. Oncogene 35(21):2746-2755
- Yang XZ et al (2018) LINC01133 as ceRNA inhibits gastric cancer progression by sponging miR-106a-3p to regulate
204. Li X et al (2020) LINC01089 inhibits tumorigenesis and epithe-lial-mesenchymal transition of non-small cell lung cancer via the miR-27a/SFRP1/Wnt/
205. Zhang Y, Li Y (2020) Long non-coding RNA NORAD contributes to the proliferation, invasion and EMT progression of prostate cancer via the miR-30a-5p/RAB11A/WNT/
206. Zhang Y et al (2017) LncRNA HOXD-AS1 promotes epithelial ovarian cancer cells proliferation and invasion by targeting miR
207. Meng S et al (2017) CircRNA: functions and properties of a novel potential biomarker for cancer. Mol Cancer 16(1):1-8
208. Ebbesen KK, Hansen TB, Kjems J (2017) Insights into circular RNA biology. RNA Biol 14(8):1035-1045
209. Yang M et al (2022) EIF4A3-regulated circ_0087429 can reverse EMT and inhibit the progression of cervical cancer via miR-5003-3p-dependent upregulation of OGN expression. J Exp Clin Cancer Res 41(1):165
210. Luo YY et al (2022) Hsa_Circ_0098181 suppresses hepatocellular carcinoma by sponging miR-18a-3p and targeting PPARA. Front Pharmacol 13:819735
211. Gao S et al (2019) Circular RNA hsa_circ_0007059 restrains proliferation and epithelial-mesenchymal transition in lung cancer cells via inhibiting microRNA-378. Life Sci 233:116692
212. Li XY et al (2019) Enhanced expression of circular RNA hsa_ circ_000984 promotes cells proliferation and metastasis in nonsmall cell lung cancer by modulating Wnt/
213. Liu W et al (2022) SP1-mediated up-regulation of lncRNA TUG1 underlines an oncogenic property in colorectal cancer. Cell Death Dis 13(5):433
214. Zhou J et al (2021) Hsa_circ_0001666 suppresses the progression of colorectal cancer through the miR-576-5p/PCDH10 axis. Clin Transl Med 11(11):e565
215. Wang HH, Ma JN, Zhan XR (2021) Circular RNA Circ_0067934 attenuates ferroptosis of thyroid cancer cells by miR-545-3p/ SLC7A11 signaling. Front Endocrinol (Lausanne) 12:670031
216. Yin Y et al (2022) Circ_0067934 reduces JNK phosphorylation through a microRNA-545-3p/PPA1 axis to enhance tumorigenesis and cisplatin resistance in ovarian cancer. Immunopharmacol Immunotoxicol 44(2):261-274
217. Zhao M, Ma W, Ma C (2020) Circ_0067934 promotes non-small cell lung cancer development by regulating miR-1182/KLF8 axis and activating Wnt/
218. Liu R et al (2021) Circ_0082182 promotes oncogenesis and metastasis of colorectal cancer in vitro and in vivo by sponging miR-411 and miR-1205 to activate the Wnt/
219. Chen X et al (2022) MicroRNA-621 functions as a metastasis suppressor in colorectal cancer by directly targeting LEF1 and suppressing Wnt/
220. Liu Y, Zhou WL (2022) LINC01315 accelerates the growth and epithelial-mesenchymal transition of colorectal cancer cells via activating the Wnt/
221. Tan A, Li Q, Chen L (2019) CircZFR promotes hepatocellular carcinoma progression through regulating miR-3619-5p/ CTNNB1 axis and activating Wnt/
222. Tang H et al (2019) MicroRNA-194 inhibits cell invasion and migration in hepatocellular carcinoma through PRC1-mediated inhibition of Wnt/
223. Huang H et al (2020) LncRNA CARLo-7 facilitates proliferation, migration, invasion, and EMT of bladder cancer cells by regulating Wnt/
224. Guo J et al (2019) The lncRNA DLX6-AS1 promoted cell proliferation, invasion, migration and epithelial-to-mesenchymal transition in bladder cancer via modulating Wnt/
225. Zhu X et al (2018) LSINCT5 activates Wnt/
226. Jia GQ et al (2018) Long non-coding RNA PlncRNA-1 promotes cell proliferation and hepatic metastasis in colorectal cancer. J Cell Biochem 119(8):7091-7104
227. Li N et al (2020) Long non-coding RNA ADAMTS9-AS1 suppresses colorectal cancer by inhibiting the Wnt/
228. Park SA et al (2020) Long non-coding RNA steroid receptor activator promotes the progression of endometrial cancer via Wnt/
229. Xu Y et al (2019) Long non-coding RNA LINC01225 promotes proliferation, invasion and migration of gastric cancer via Wnt/
230. Shao Z et al (2020) Circ_0003789 facilitates gastric cancer progression by inducing the epithelial-mesenchymal transition through the Wnt/
231. Pan J et al (2020) lncRNA JPX/miR-33a-5p/Twist1 axis regulates tumorigenesis and metastasis of lung cancer by activating Wnt
232. Chi Y et al (2019) miR-516a-3p inhibits breast cancer cell growth and EMT by blocking the Pygo2/Wnt signalling pathway. J Cell Mol Med 23(9):6295-6307
233. Cui Y et al (2019) miR-15a-3p suppresses prostate cancer cell proliferation and invasion by targeting SLC39A7 via downregulating Wnt/
234. Yuan G et al (2019) LncRNA-MIR17HG mediated upregulation of miR-17 and miR-18a promotes colon cancer progression via activating Wnt/
235. Huang
- Wenhua Xue and Lin Yang have contributed equally to this work.
Milad Ashrafizadeh
dvm.milad1994@gmail.com
Yu Tian
Tian_Yu@ben.edu
Ranran Sun
fccsunrr@zzu.edu.cn
1 Department of Pharmacy, The First Affiliated Hospital of Zhengzhou University, Zhengzhou 450052, Henan, People’s Republic of China2 Department of Hepatobiliary Surgery, Xianyang Central Hospital, Xianyang 712000, Shaanxi, China3 Shanghai Institute of Cardiovascular Diseases, Zhongshan Hospital, Fudan University, Shanghai 200032, China
4 School of Public Health, Benedictine University, Lisle, USA
5 Precision Medicine Center, The First Affiliated Hospital of Zhengzhou University, Zhengzhou, Henan, China - transfer into nucleus and enhance gene transcription. However, lack of Wnt ligand mediates the phosphorylation of
-catenin to enhance its proteasomal degradation
DOI: https://doi.org/10.1007/s00018-023-05099-7
PMID: https://pubmed.ncbi.nlm.nih.gov/38334836
Publication Date: 2024-02-09
Wnt/
© The Author(s) 2024
Abstract
Metastasis accounts for
Graphical abstract

Introduction
[12, 13]. The interaction of Wnt receptor with ligands is responsible for its stimulation accounting for transmission of cell signaling information from extracellular environment to intracellular compartments and downstream targets [14]. Wnt is tightly controlled in cells and is an important participant in physiological processes including organism axis differentiation, tissue formation, brain formation and stem cell maintenance [15, 16]. Accumulating data has shown association of Wnt dysregulation with the development of pathological events [17, 18]. On the cell surface, there are receptors including LRP5/6 and FZD that can interact with Wnt ligands to induce Dishevelled protein, a member of complex with other proteins including GSK-3
upstream mediators can determine progression of tumor cells via Wnt/

| Human cancer | Molecular profile | Highlight | Refs. |
| Laryngeal cancer | MAGP1/Wnt | MAGP1 stimulates Wnt/
|
[34] |
| Gastric cancer | Wnt/GPX4 |
|
[23] |
| Breast cancer | WNT | The p53 deficiency stimulates WNT-mediated systemic inflammation, aggravating tumor metastasis | [35] |
| – | WNT | The high immunogenic tumor cells use WNT pathway upregulation for mediating immune evasion | [36] |
| Head and neck cancer | CMTM6/ENO-1/Akt/GSK-3
|
CMTM6 stimulates cisplatin resistance through stabilization of ENO-1 and subsequent upregulation of Wnt | [37] |
| Colon cancer | Drp1/Wnt | The upregulation of Drp1 enhances the fatty acid-mediated metabolic reprogramming to accelerate Wnt activation | [38] |
| Gastric cancer | TNFRSF11B/Wnt | TNFRSF11B enhances Wnt/
|
[39] |
| Colorectal cancer | Wnt | The application of MEK inhibitors can stimulate Wnt axis and enhance stem cell plasticity | [40] |
| Breast cancer | RCC2/Wnt | RCC2 upregulates Wnt to induce EMT-mediated cancer metastasis | [41] |
| Intestinal cancer | Wnt | PROTAC as a peptide enhances
|
[42] |
| Bladder cancer | RSPO3/Wnt | RSPO3 upregulates Wnt and Hedgehog to increase tumorigenesis | [43] |
EMT mechanism: general aspects and carcinogenic function
down-regulation, and vimentin and N-cadherin upregulation can be observed during loss of polarity in epithelial cells. The EMT-inducing transcription factors (EMT-TFs) are present and demonstrate high expression in tumor cells such as TGF-
cancers [58]. Noteworthy, inhibition of
Wnt/
Brain tumors
to disrupt progression of GBM cells, studies have focused on knock-down of factors responsible for EMT stimulation in cancers. For instance, when expression level of GOLM1 decreases and it is silenced, suppression of Wnt/
Gastrointestinal tumors
| Human cancer | Molecular profile | Highlight | Refs. | ||
| Ovarian cancer | Ets1/Drp1/EMT | Ets1 increases Drp1 levels to induce EMT for enhancing metastasis | [60] | ||
| Endometrial cancer | Netrin-1 | The inhibition of Netrin-1 impairs the proliferation and EMT | [61] | ||
| Bladder cancer | CircPTK2/PABPC1/SETDB1 |
|
[62] | ||
| – | RHOJ/EMT | RHOJ controls the EMT-induced drug resistance through increasing response to replicative stress and stimulation of DNA damage response | [63] | ||
| Colorectal cancer | DDX21/MCM5/EMT | DDX21 increases MCM5 levels to induce EMT-mediated cancer invasion | [64] | ||
| Pancreatic cancer | PYGL | PYGL stimulates the reprogramming in glucose metabolism to induce EMT and accelerate invasion | [65] | ||
| Triple-negative breast cancer | TRAIP/EMT | TRAIP knock-down impairs the growth and metastasis of tumor cells | [66] | ||
| Pancreatic cancer | STMN2/Wnt | STMN2 is able to stimulate EMT and increase cancer progression through Wnt upregulation | [67] | ||
| Colorectal cancer | – | Delivery of shikonin by nanoparticles can impair metastasis through EMT inhibition | [68] |
causes of death in Chinese population [106, 107]. Hepatitis B virus (HBV) is a leading cause of HCC around the world and up to
Urological tumors
Hematological cancers
tumorigenesis in these cancers, future studies should be engaged towards the role of Wnt/EMT axis in hematological tumor progression. PLAGL2 shows upregulation in lymphoma and by inducing Wnt/
Gynecological tumors
the important part is related to role of Wnt/EMT as a novel axis in regulating cervical cancer progression. APMAP is deemed one of the key factors in cervical cancer metastasis, and stimulates EMT through induction of Wnt/
Wnt/
| Pathway | Cancer type | Remark | Refs. |
| TET1/DKK1/EMT | Ovarian cancer | TET1 suppresses EMT and metastasis via increasing levels of DKK1 as Wnt inhibitor | [132] |
| CRIP1/Wnt/EMT | Ovarian cancer | CRIP1 stimulates Wnt/EMT axis in enhancing cancer invasion | [133] |
| CEBPA/Wnt/EMT | Ovarian cancer | CEBPA suppresses EMT via Wnt down-regulation in decreasing invasion | [134] |
| HOXB-AS3/Wnt/EMT | Ovarian cancer | HOXB-AS3 induces EMT via Wnt pathway | [76] |
| HOXC13-AS/
|
Cervical cancer | HOXC13-AS induces EMT via mediating
|
[135] |
| CRIP1/Wnt/EMT | Cervical cancer | CRIP1 induces EMT via triggering Wnt pathway | [136] |
| MAFE-A3/Wnt/EMT | Cervical cancer | MAGE-A3 stimulates Wnt in increasing invasion and mediating EMT | [137] |
| SFRP1/2/Wnt/EMT | Cervical cancer | SFRP1/2 suppress EMT via Wnt down-regulation | [138] |
| SMYD2/APC2/Wnt/EMT | Colorectal cancer | SMYD2 increases Wnt expression vi aAPC2 down-regulation to induce EMT | [139] |
| CD55/Smad4/
|
Colorectal cancer | CD55/Smad4 suppresses
|
[140] |
| HYD-PEP06/Wnt/EMT | Hepatocellular carcinoma | HYD-PEP06 inhibits Wnt/EMT axis in reducing tumor invasion | [141] |
| TNF-
|
Hepatocellular carcinoma | TNF-
|
[142] |
| Cx32/Wnt/EMT | Hepatocellular carcinoma | Low expression of Cx32 leads to Wnt/EMT | [143] |
| TRIM37/Wnt/EMT | Hepatocellular carcinoma | TRIM37 stimulates Wnt/EMT axis in promoting tumor progression | [144] |

it leads to 5-flourouracil resistance in colorectal tumor. The cadherin-catenin complex leads to simulation of
Pharmacological targeting of Wnt/

expression level of
smoke (TS), parasitic infection and radiation or chemical exposure have been considered as possible factors involved in its development. Accumulating evidence has shown an association between TS and development of bladder cancer [168]. Curcumin has been shown to suppress urocystic EMT and prevents acquisition of stemness in tumor cells. Curcumin suppresses Wnt/
Nanoparticle-mediated regulation of Wnt/ EMT axis in cancer metastasis: new visions
nanostructures can improve the ability of conventional therapies in cancer suppression, they reverse drug resistance and augment immunotherapy [173-176]. Since Wnt has been associated with EMT induction, the application of nanoparticles for the regulation of Wnt/EMT axis has been provided. The sweroside nanostructures have been introduced for the treatment of prostate cancer through increasing ROS generation and apoptosis. Moreover, these nanoparticles impair growth and invasion of tumor cells. They disrupt the stem cell features including CD33 and CD44. Moreover, sweroside nanoparticles impair TTCF/LEF activity to suppress
Noncoding RNAs in regulation of Wnt/
microRNAs

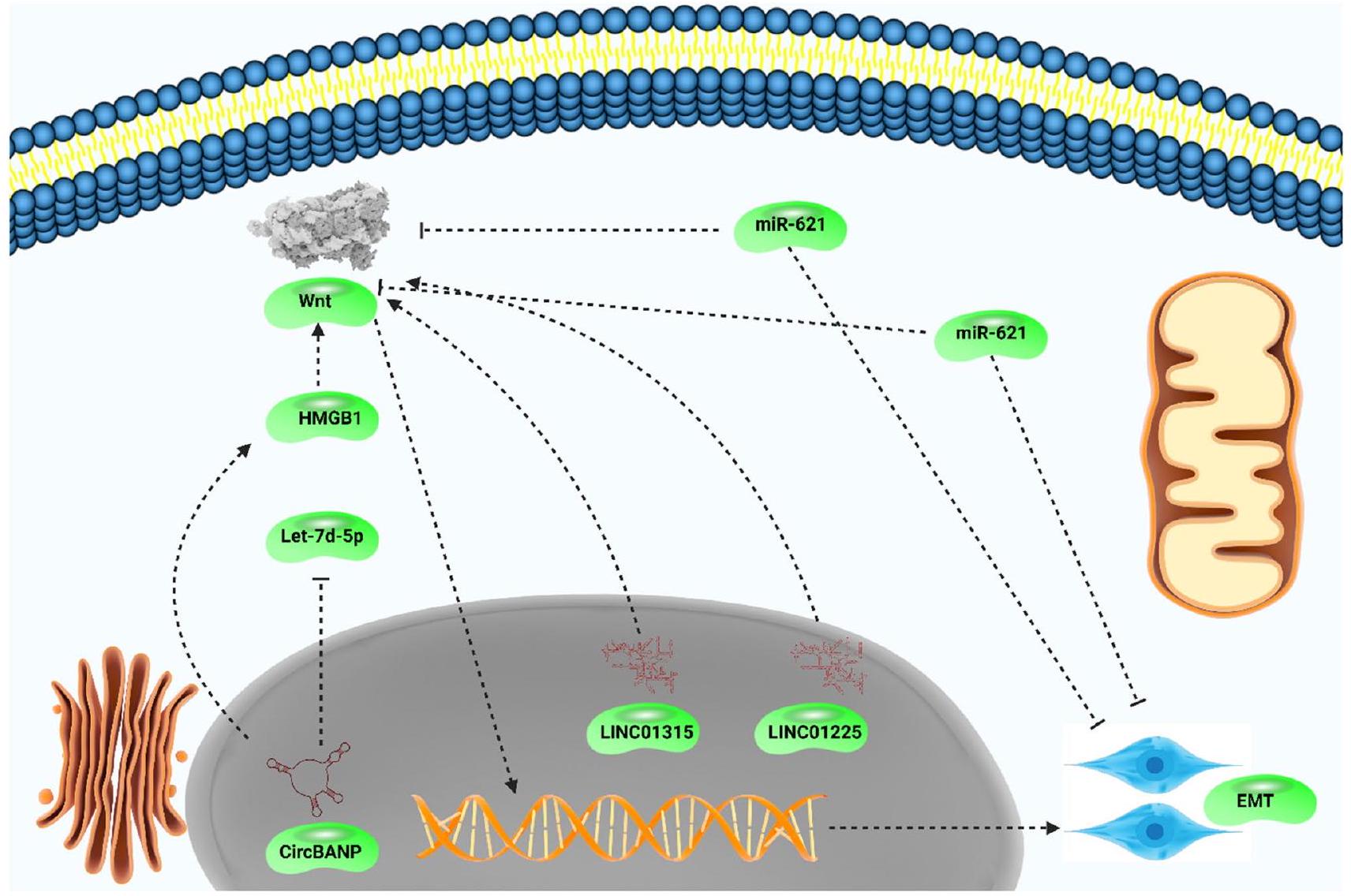
miR-27a is one of the factors that its exact function in cancer is not certain and miR-27a-3p sponging by circBCAR3 results in esophageal tumor progression [182], while down-regulation of miR-27a and miR-27b by circ0000994 results in pancreatic tumor suppression [183], confirming dual function of miR-27a in cancers. miR-135 shows a contrast function compared to miR-27a and by decreasing SMAD3 expression, miR-135 suppresses TGF-
exosomes derived from breast tumor cells have high levels of miR-7-5p, it can lead to the regulation of atypical WNT in which reducing RYK expression to favor JNK phosphorylation, resulting in c-Jun protein enhancement and subsequent EMT inhibition in decreasing cancer metastasis [198]. The catch point is that exosomal miRNAs can regulate TME components such as cancer-associated fibroblasts (CAFs). miR-146a demonstrates enrichment in exosomes derived from breast tumor cells. Through reduction in TXNIP levels, miR-146a induces Wnt/
Long noncoding RNAs
Circular RNAs
may modulate EMT in cancers [209]. More importantly, circRNAs can decrease miRNA expression via sponging [210]. The overall aim of current section is to evaluate role of circRNAs in EMT regulation via targeting Wnt. Circ-0007059 shows function in suppression of lung tumor growth and metastasis, and its ability in decreasing metastasis is due to EMT suppression. The hsa-circ-0007059 decreases miR-378 expression to inhibit Wnt/
than one molecular pathway can be simultaneously regulated by circ-0067934 and notably, this circRNA induces Wnt/
Conclusion and remarks
| Non-coding RNA | Pathway | Action mechanism | Refs. |
| miR-621/Wnt/EMT | Colorectal cancer | miR-621 suppresses EMT via Wnt down-regulation | [219] |
| LINC01315/Wnt/EMT | Colorectal cancer | LINC01315 induces EMT via Wnt upregulation | [220] |
| CircZFR/miR-3619-5p/Wnt | Hepatocellular carcinoma | CircZFR sponges miR-3619-5p and induces Wnt pathway to promote invasion via EMT induction | [221] |
| miR-194/Wnt/EMT | Hepatocellular carcinoma | miR-194 suppresses Wnt pathway to reduce progression of tumor cells and to inhibit EMT | [222] |
| CARLo-7/Wnt/EMT | Bladder cancer | CARLo-7 induces Wnt/EMT axis in increasing metastasis | [223] |
| DLX6-AS1/Wnt/EMT | Bladder cancer | DLX6-AS1 simulates Wnt/EMT axis | [224] |
| LSINCT5/NCYM/Wnt/EMT | Bladder cancer | LSINCT5 interacts with NCYM in increasing Wnt expression to mediate EMT | [225] |
| PlncRNA-1/Wnt/EMT | Colorectal cancer | PlncRNA-1 activates Wnt in increasing cancer invasion and EMT induction | [226] |
| ADAMTS9-AS1/Wnt | Colorectal cancer | ADAMTS9-AS1 suppresses Wnt/EMT axis in reducing invasion and metastasis of tumor cells | [227] |
| LncRNA-SRA/Wnt/EMT | Endometrial cancer | SRA induces Wnt/EMT axis in increasing cancer progression | [228] |
| LINC01225/Wnt/EMT | Gastric cancer | LINC012225 induces Wnt signaling in increasing cancer progression through EMT induction | [229] |
| Circ_0003789/Wnt/EMT | Gastric cancer | Circ_0003789 stimulates Wnt/EMT axis | [230] |
| JPX/miR-33a-5p/Twist1 | Lung cancer | JPX sponges miR-33a-5p to increase Twist1 expression Twist1 induces Wnt and promotes EMT | [231] |
| miR-516a-3p/Pygo2/Wnt/EMT | Breast cancer | miR-516a-3p suppresses Pygo2/Wnt axis in EMT inhibition | [232] |
| miR-15a-3p/Wnt/EMT | Prostate cancer | miR-15a-3p suppresses Wnt/EMT axis | [233] |
| LncRNA-MIR17HG/miR-17/ miR-18a/Wnt/EMT | Colon cancer | LncRNA-MIR17HG promoted miR-17 and miR-18a expression to induce Wnt/EMT | [234] |
| miR-370-3p/Wnt7a/EMT | Bladder cancer | miR-370-3p suppresses Wnt7a expression to suppress EMT | [235] |

non-coding RNAs, Wnt/EMT axis can be modulated by these RNA transcripts. Furthermore, pharmacological compounds and nanostructures are capable of Wnt/EMT suppression in reducing invasion and metastasis of tumor cells.
Declarations
Ethics approval and consent to participate Not applicable.
Consent for publication Not applicable.
References
- Aros CJ et al (2020) Distinct spatiotemporally dynamic Wntsecreting niches regulate proximal airway regeneration and aging. Cell Stem Cell 27(3):413-429. e4
- Baarsma H, Königshoff MJT (2017) ‘WNT-er is coming’: WNT signalling in chronic lung diseases. Thorax 72(8):746-759
- Hashimoto S et al (2012)
-Catenin-SOX2 signaling regulates the fate of developing airway epithelium. J Cell Sci 125(4):932-942 - Jung Y-S, Park J-IJE, Medicine M (2020) Wnt signaling in cancer: therapeutic targeting of Wnt signaling beyond
-catenin and the destruction complex. Exp Mol Med 52(2):183-191 - Steinhart Z, Angers SJD (2018) Wnt signaling in development and tissue homeostasis. Development 145(11):dev146589
- Chatterjee A et al (2022) Advances in targeting the WNT/
catenin signaling pathway in cancer. Drug Discovery Today 27(1):82-101 - Moti N et al (2019) Wnt traffic from endoplasmic reticulum to filopodia. PLoS One 14(2):e0212711
- Maeda K et al (2019) The regulation of bone metabolism and disorders by wnt signaling. Int J Mol Sci 20(22):5525
- Gokturk F, Erkoc-Kaya D, Arikoglu H (2021) Juglone can inhibit angiogenesis and metastasis in pancreatic cancer cells by targeting Wnt/beta-catenin signaling. Bratisl Lek Listy 122:132-137
- Sterling JA et al (2011) Advances in the biology of bone metastasis: how the skeleton affects tumor behavior. Bone 48(1):6-15
- Ben-Ghedalia-Peled N, Vago R (2022) Wnt signaling in the development of bone metastasis. Cells 11(23):3934
- Khoon MC (2015) Experimental models of bone metastasis: opportunities for the study of cancer dormancy. Adv Drug Deliv Rev 94:141-150
- Micalizzi DS et al (2010) Epithelial-mesenchymal transition in cancer: parallels between normal development and tumor progression. J Mammary Gland Biol Neoplasia 15(2):117-134
- Cui J et al (2022) Targeting the Wnt signaling pathway for breast cancer bone metastasis therapy. J Mol Med 100(3):373-384
- Logan CY, Nusse R (2004) The Wnt signaling pathway in development and disease. Annu Rev Cell Dev Biol 20:781-810
- Giles RH, Van Es JH, Clevers H (2003) Caught up in a Wnt storm: Wnt signaling in cancer. Biochim Biophys Acta 1653(1):1-24
- Prestwich TC, MacDougald OA (2007) Wnt/
-catenin signaling in adipogenesis and metabolism. Curr Opin Cell Biol 19(6):612-617 - Ross SE et al (2000) Inhibition of adipogenesis by Wnt signaling. Science 289(5481):950-953
- Breuer E-K et al (2019) Potassium channel activity controls breast cancer metastasis by affecting
-catenin signaling. Cell Death Dis 10(3):1-15 - Satriyo PB et al (2019) Cadherin 11 inhibition downregulates
-catenin, deactivates the canonical WNT signalling pathway and suppresses the cancer stem cell-like phenotype of triple negative breast cancer. J Clin Med 8(2):148 - Xi Y, Chen Y (2014) Wnt signaling pathway: implications for therapy in lung cancer and bone metastasis. Cancer Lett 353(1):8-16
- Zhang W et al (2022) KDM1A promotes thyroid cancer progression and maintains stemness through the Wnt/
-catenin signaling pathway. Theranostics 12(4):1500-1517 - Wang Y et al (2022) Wnt/beta-catenin signaling confers ferroptosis resistance by targeting GPX4 in gastric cancer. Cell Death Differ 29(11):2190-2202
- Luo Y et al (2022) Long noncoding RNA LINC01606 protects colon cancer cells from ferroptotic cell death and promotes stemness by SCD1-Wnt/
-catenin-TFE3 feedback loop signalling. Clin Transl Med 12(4):e752 - Ren
et al (2022) The protein kinase activity of NME7 activates Wnt/ -catenin signaling to promote one-carbon metabolism in hepatocellular carcinoma. Cancer Res 82(1):60-74 - Dong S et al (2022) ROS/PI3K/Akt and Wnt/
-catenin signalings activate HIF- -induced metabolic reprogramming to impart 5-fluorouracil resistance in colorectal cancer. J Exp Clin Cancer Res 41(1):15 - Li Y et al (2022) circ-EIF6 encodes EIF6-224aa to promote TNBC progression via stabilizing MYH9 and activating the Wnt/beta-catenin pathway. Mol Ther 30(1):415-430
- Chen B et al (2022) N(7)-methylguanosine tRNA modification promotes tumorigenesis and chemoresistance through WNT/
-catenin pathway in nasopharyngeal carcinoma. Oncogene 41(15):2239-2253 - Xu Q et al (2022) Loss of TET reprograms Wnt signaling through impaired demethylation to promote lung cancer development. Proc Natl Acad Sci U S A 119(6):e2107599119
- Yan R et al (2022) Liquidambaric acid inhibits Wnt/
-catenin signaling and colon cancer via targeting TNF receptor-associated factor 2. Cell Rep 38(5):110319 - Geleta B et al (2022) Targeting Wnt/tenascin C-mediated cross talk between pancreatic cancer cells and stellate cells via activation of the metastasis suppressor NDRG1. J Biol Chem 298(3):101608
- Yamamoto D et al (2022) Characterization of RNF43 frameshift mutations that drive Wnt ligand- and R-spondindependent colon cancer. J Pathol 257(1):39-52
- Yan R et al (2022) Inhibition of DCLK1 sensitizes resistant lung adenocarcinomas to EGFR-TKI through suppression of Wnt
-catenin activity and cancer stemness. Cancer Lett 531:83-97 - Lv F et al (2023) MAGP1 maintains tumorigenicity and angiogenesis of laryngeal cancer by activating Wnt/
-catenin/MMP7 pathway. Carcinogenesis 16:bgad003 - Wellenstein MD et al (2019) Loss of p53 triggers WNTdependent systemic inflammation to drive breast cancer metastasis. Nature 572(7770):538-542
- Takeuchi Y et al (2021) Highly immunogenic cancer cells require activation of the WNT pathway for immunological escape. Sci Immunol 6(65):eabc6424
- Mohapatra P et al (2021) CMTM6 drives cisplatin resistance by regulating Wnt signaling through the ENO-1/AKT/GSK3
axis. JCI Insight 6(4):e143643 - Xiong X et al (2022) Activation of Drp1 promotes fatty acidsinduced metabolic reprograming to potentiate Wnt signaling in colon cancer. Cell Death Differ 29(10):1913-1927
- Luan F et al (2020) TNFRSF11B activates Wnt/
-catenin signaling and promotes gastric cancer progression. Int J Biol Sci 16(11):1956-1971 - Zhan T et al (2019) MEK inhibitors activate Wnt signalling and induce stem cell plasticity in colorectal cancer. Nat Commun 10(1):2197
- Chen Z et al (2019) RCC2 promotes breast cancer progression through regulation of Wnt signaling and inducing EMT. J Cancer 10(27):6837-6847
- Liao H et al (2020) A PROTAC peptide induces durable
-catenin degradation and suppresses Wnt-dependent intestinal cancer. Cell Discov 6:35 - Chen Z et al (2019) RSPO3 promotes the aggressiveness of bladder cancer via Wnt/
-catenin and Hedgehog signaling pathways. Carcinogenesis 40(2):360-369 - Shao Z et al (2022) The role of long noncoding RNAs as regulators of the epithelial-mesenchymal transition process in oral squamous cell carcinoma cells. Front Mol Biosci 9:942636
- Kalluri R, Weinberg RA (2009) The basics of epithelial-mesenchymal transition. J Clin Investig 119(6):1420-1428
- Yang J, Weinberg RA (2008) Epithelial-mesenchymal transition: at the crossroads of development and tumor metastasis. Dev Cell 14(6):818-829
- Lim J, Thiery JP (2012) Epithelial-mesenchymal transitions: insights from development. Development 139(19):3471-3486
- Horejs CM (2016) Basement membrane fragments in the context of the epithelial-to-mesenchymal transition. Eur J Cell Biol 95(11):427-440
- Lamouille S, Xu J, Derynck R (2014) Molecular mechanisms of epithelial-mesenchymal transition. Nat Rev Mol Cell Biol 15(3):178-196
- Dongre A, Weinberg RA (2019) New insights into the mechanisms of epithelial-mesenchymal transition and implications for cancer. Nat Rev Mol Cell Biol 20(2):69-84
- Liu C et al (2022) Hypoxia promotes epithelial-mesenchymal transition in lung cancer cells via regulating the NRF2/miR27a/BUB1 pathway. Clin Transl Oncol 25:510-522
- Du Q et al (2022) Downregulation of iNOS/NO promotes epi-thelial-mesenchymal transition and metastasis in colorectal cancer. Mol Cancer Res 21:102-114
- Liu
et al (2022) PODNL1 promotes cell migration and regulates the epithelial/mesenchymal transition process in bladder cancer. Biochem Biophys Res Commun 620:165-172 - Sahoo SS et al (2022) FOXA2 suppresses endometrial carcinogenesis and epithelial-mesenchymal transition by regulating enhancer activity. J Clin Invest 132(12):e157574
- Yun
et al (2022) NANOG regulates epithelial-mesenchymal transition via AMPK/mTOR signalling pathway in ovarian cancer SKOV-3 and A2780 cells. J Cell Mol Med 26(20):5277-5291 - Deng H, Chen G, Zhang J (2022)
-elemene regulates epi-thelial-mesenchymal transformation and inhibits invasion and metastasis of colorectal cancer cells. J Complement Integr Med 8:e78700 - Tu H et al (2022)
-Patchoulene represses hypoxia-induced proliferation and epithelial-mesenchymal transition of liver cancer cells. Bioengineered 13(5):11907-11922 - Guo Z et al (2023) Molecular profile of metastasis, cell plasticity and EMT in pancreatic cancer: a pre-clinical connection to aggressiveness and drug resistance. Cancer Metastasis Rev. https://doi.org/10.1007/s10555-023-10125-y
- Luan H et al (2022) Fucoxanthin induces apoptosis and reverses epithelial-mesenchymal transition via inhibiting Wnt/
-catenin pathway in lung adenocarcinoma. Discov Oncol 13(1):98 - Ghosh D et al (2023) Ets1 facilitates EMT/invasion through Drp1-mediated mitochondrial fragmentation in ovarian cancer. iScience 26(9):107537
- Cassier PA et al (2023) Netrin-1 blockade inhibits tumour growth and EMT features in endometrial cancer. Nature 620(7973):409-416
- Meng
et al (2023) CircPTK2/PABPC1/SETDB1 axis promotes EMT-mediated tumor metastasis and gemcitabine resistance in bladder cancer. Cancer Lett 554:216023 - Debaugnies M et al (2023) RHOJ controls EMT-associated resistance to chemotherapy. Nature 616(7955):168-175
- Gao H et al (2023) Phase separation of DDX21 promotes colorectal cancer metastasis via MCM5-dependent EMT pathway. Oncogene 42(21):1704-1715
- Ji Q et al (2023) PYGL-mediated glucose metabolism reprogramming promotes EMT phenotype and metastasis of pancreatic cancer. Int J Biol Sci 19(6):1894-1909
- Zheng Y et al (2023) Silencing TRAIP suppresses cell proliferation and migration/invasion of triple negative breast cancer via RB-E2F signaling and EMT. Cancer Gene Ther 30(1):74-84
- Shao M et al (2023) STMN2 overexpression promotes cell proliferation and EMT in pancreatic cancer mediated by WNT/
catenin signaling. Cancer Gene Ther 30(3):472-480 - Long L et al (2023) Regulating lactate-related immunometabolism and EMT reversal for colorectal cancer liver metastases using shikonin targeted delivery. J Exp Clin Cancer Res 42(1):117
- Ohgaki H, Kleihues P (2005) Epidemiology and etiology of gliomas. Acta Neuropathol 109(1):93-108
- Dolecek TA et al (2012) CBTRUS statistical report: primary brain and central nervous system tumors diagnosed in the United States in 2005-2009. Neuro Oncol 14(suppl_5):v1-v49
- Van Meir EG et al (2010) Exciting new advances in neuro-oncology: the avenue to a cure for malignant glioma. CA Cancer J Clin 60(3):166-193
- Carlsson SK, Brothers SP, Wahlestedt C (2014) Emerging treatment strategies for glioblastoma multiforme. EMBO Mol Med 6(11):1359-1370
- Auffinger B et al (2015) The role of glioma stem cells in chemotherapy resistance and glioblastoma multiforme recurrence. Expert Rev Neurother 15(7):741-752
- Zhao L et al (2020) STAT1 determines aggressiveness of glioblastoma both in vivo and in vitro through wnt/
-catenin signalling pathway. Cell Biochem Funct 38(5):630-641 - Zhu H et al (2020) Long noncoding RNA LINC-PINT suppresses cell proliferation, invasion, and EMT by blocking Wnt/
-catenin signaling in glioblastoma. Front Pharmacol 11:586653 - Zhuang XH, Liu Y, Li JL (2019) Overexpression of long noncoding RNA HOXB-AS3 indicates an unfavorable prognosis and promotes tumorigenesis in epithelial ovarian cancer via Wnt/
catenin signaling pathway. Biosci Rep 39(8):BSR20190906 - Ding
et al (2019) GOLM1 silencing inhibits the proliferation and motility of human glioblastoma cells via the Wnt/ -catenin signaling pathway. Brain Res 1717:117-126 - Wu S et al (2019) Silencing expression of PHF14 in glioblastoma promotes apoptosis, mitigates proliferation and invasiveness via Wnt signal pathway. Cancer Cell Int 19:314
- Han L et al (2019) SNHG29 regulates miR-223-3p/CTNND1 axis to promote glioblastoma progression via Wnt/
-catenin signaling pathway. Cancer Cell Int 19:345 - Zhang J et al (2018) LGR5, a novel functional glioma stem cell marker, promotes EMT by activating the Wnt/
-catenin pathway
and predicts poor survival of glioma patients. J Exp Clin Cancer Res 37(1):225 - Nawaz Z et al (2016) Cbx 7 is epigenetically silenced in glioblastoma and inhibits cell migration by targeting YAP/TAZdependent transcription. Sci Rep 6:27753
- Yu T et al (2017) CBX7 is a glioma prognostic marker and induces G1/S arrest via the silencing of CCNE1. Oncotarget 8(16):26637-26647
- Chen L et al (2020) Knockdown of TRIM47 inhibits glioma cell proliferation, migration and invasion through the inactivation of Wnt/
-catenin pathway. Mol Cell Probes 53:101623 - Huang G et al (2022) Methyl-CpG binding protein 2 (MeCP2) as a potential diagnostic and prognostic marker facilitates glioma progression through activation of the Wnt/
-Catenin pathway. World Neurosurg 171:e560-e571 - Ni H et al (2021) The nuclear transporter importin-11 regulates the Wnt/
-catenin pathway and acts as a tumor promoter in glioma. Int J Biol Macromol 176:145-156 - Fitzmaurice C et al (2019) Global, regional, and national cancer incidence, mortality, years of life lost, years lived with disability, and disability-adjusted life-years for 29 cancer groups, 1990 to 2017: a systematic analysis for the global burden of disease study. JAMA Oncol 5(12):1749-1768
- Chen W et al (2016) Cancer statistics in China, 2015. CA Cancer J Clin 66(2):115-132
- Ferlay J et al (2010) Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer 127(12):2893-2917
- Biagioni A et al (2019) Update on gastric cancer treatments and gene therapies. Cancer Metastasis Rev 38(3):537-548
- Guo Q et al (2021) ADMA mediates gastric cancer cell migration and invasion via Wnt/
-catenin signaling pathway. Clin Transl Oncol 23(2):325-334 - Ge Q et al (2020) Zic1 suppresses gastric cancer metastasis by regulating Wnt/
-catenin signaling and epithelial-mesenchymal transition. Faseb j 34(2):2161-2172 - Fayngerts SA et al (2014) TIPE3 is the transfer protein of lipid second messengers that promote cancer. Cancer Cell 26(4):465-478
- Kumar D et al (2004) Expression of SCC-S2, an antiapoptotic molecule, correlates with enhanced proliferation and tumorigenicity of MDA-MB 435 cells. Oncogene 23(2):612-616
- Sun H et al (2008) TIPE2, a negative regulator of innate and adaptive immunity that maintains immune homeostasis. Cell 133(3):415-426
- Zhang Y et al (2012) TIPE2, a novel regulator of immunity, protects against experimental stroke. J Biol Chem 287(39):32546-32555
- Zhang Z et al (2015) TIPE1 induces apoptosis by negatively regulating Rac1 activation in hepatocellular carcinoma cells. Oncogene 34(20):2566-2574
- Liu W et al (2018) TIPE1 suppresses invasion and migration through down-regulating Wnt/
-catenin pathway in gastric cancer. J Cell Mol Med 22(2):1103-1117 - Li S et al (2020) Wnt/
-catenin signaling axis is required for TFEB-mediated gastric cancer metastasis and epithelial-mesenchymal transition. Mol Cancer Res 18(11):1650-1659 - Peng Y et al (2021) MiRNA-20b/SUFU/Wnt axis accelerates gastric cancer cell proliferation, migration and EMT. Heliyon 7(4):e06695
- Sung H et al (2021) Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 71(3):209-249
- Mauri G et al (2019) Early-onset colorectal cancer in young individuals. Mol Oncol 13(2):109-131
- Miller KD et al (2019) Cancer treatment and survivorship statistics, 2019. CA Cancer J Clin 69(5):363-385
- Shi Y et al (2022) NCAPG facilitates colorectal cancer cell proliferation, migration, invasion and epithelial-mesenchymal transition by activating the Wnt/
-catenin signaling pathway. Cancer Cell Int 22(1):119 - Zhang M et al (2018) RHBDD1 promotes colorectal cancer metastasis through the Wnt signaling pathway and its downstream target ZEB1. J Exp Clin Cancer Res 37(1):22
- Liang G et al (2018) Silencing of CEMIP suppresses Wnt/
catenin/Snail signaling transduction and inhibits EMT program of colorectal cancer cells. Acta Histochem 120(1):56-63 - Xing
et al (2019) The prognostic value of major facilitator superfamily domain-containing protein 2A in patients with hepatocellular carcinoma. Aging (Albany NY) 11(19):8474-8483 - Zheng R et al (2017) Estimates of cancer incidence and mortality in China, 2013. Chin J Cancer 36(1):66
- Bhaumik P (2015) Epidemiology of viral hepatitis and liver diseases in India. Euroasian J Hepatogastroenterol 5(1):34-36
- Younossi ZM et al (2015) Association of nonalcoholic fatty liver disease (NAFLD) with hepatocellular carcinoma (HCC) in the United States from 2004 to 2009. Hepatology 62(6):1723-1730
- Liao S et al (2020) Aquaporin 9 inhibits growth and metastasis of hepatocellular carcinoma cells via Wnt/
-catenin pathway. Aging (Albany NY) 12(2):1527-1544 - Chen B et al (2022) Borealin promotes tumor growth and metastasis by activating the Wnt/
-catenin signaling pathway in hepatocellular carcinoma. J Hepatocell Carcinoma 9:171-188 - Sun L et al (2017) Oct4 induces EMT through LEF1/
-catenin dependent WNT signaling pathway in hepatocellular carcinoma. Oncol Lett 13(4):2599-2606 - Center MM et al (2012) International variation in prostate cancer incidence and mortality rates. Eur Urol 61(6):1079-1092
- Taichman RS et al (2007) The evolving biology and treatment of prostate cancer. J Clin Investig 117(9):2351-2361
- Liu H et al (2015) FOXO3a modulates WNT/
-catenin signaling and suppresses epithelial-to-mesenchymal transition in prostate cancer cells. Cell Signal 27(3):510-518 - Yang M et al (2022) GPX2 predicts recurrence-free survival and triggers the Wnt/
-catenin/EMT pathway in prostate cancer. PeerJ 10:e14263 - Sha J et al (2018) PRKAR2B promotes prostate cancer metastasis by activating Wnt/
-catenin and inducing epithelial-mesenchymal transition. J Cell Biochem 119(9):7319-7327 - Lee MS et al (2019) The metastasis suppressor CD82/KAI1 represses the TGF-
(1) and Wnt signalings inducing epithelial-to-mesenchymal transition linked to invasiveness of prostate cancer cells. Prostate 79(12):1400-1411 - Zhou Q et al (2019) EFEMP2 suppresses epithelial-mesenchymal transition via Wnt/
-catenin signaling pathway in human bladder cancer. Int J Biol Sci 15(10):2139-2155 - Zhang P et al (2022) ARL4C Regulates the Progression of Clear Cell Renal Cell Carcinoma by Affecting the Wnt/
-Catenin Signaling Pathway. J Oncol 2022:2724515 - Jin W, Wang X (2022) PLAGL2 promotes the proliferation and migration of diffuse large B-cell lymphoma cells via Wnt/
catenin pathway. Ann Clin Lab Sci 52(3):359-366 - Guo B et al (2021) miR-744-5p inhibits multiple myeloma proliferation, epithelial mesenchymal transformation and glycolysis by targeting SOX12/Wnt/
-catenin signaling. Onco Targets Ther 14:1161-1172 - Siegel RL, Miller KD, Jemal A (2017) Cancer statistics, 2017. CA Cancer J Clin 67(1):7-30
- Vaughan S et al (2011) Rethinking ovarian cancer: recommendations for improving outcomes. Nat Rev Cancer 11(10):719-725
- Hong
et al (2021) Inactivation of Wnt-LRP5 signaling suppresses the proliferation and migration of ovarian cancer cells. Transl Cancer Res 10(5):2277-2285 - Liu
et al (2022) Benzophenone- 1 induced aberrant proliferation and metastasis of ovarian cancer cells via activated ER and Wnt/ -catenin signaling pathways. Environ Pollut 292(Pt B):118370 - Wen J et al (2020) IL-8 promotes cell migration through regulating EMT by activating the Wnt/
-catenin pathway in ovarian cancer. J Cell Mol Med 24(2):1588-1598 - Bray F et al (2018) Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 68(6):394-424
- Zhang J et al (2022) DYNLT3 overexpression induces apoptosis and inhibits cell growth and migration via inhibition of the Wnt pathway and EMT in cervical cancer. Front Oncol 12:889238
- Zhu X et al (2021) APMAP promotes epithelial-mesenchymal transition and metastasis of cervical cancer cells by activating the Wnt/
-catenin pathway. J Cancer 12(20):6265-6273 - Lan C et al (2021) FAM83A promotes the proliferative and invasive abilities of cervical cancer cells via epithelial-mesenchymal transition and the Wnt signaling pathway. J Cancer 12(21):6320-6329
- Duan H et al (2017) TET1 inhibits EMT of ovarian cancer cells through activating Wnt/
-catenin signaling inhibitors DKK1 and SFRP2. Gynecol Oncol 147(2):408-417 - Liu Y et al (2021) Cysteine-rich intestinal protein 1 served as an epithelial ovarian cancer marker via promoting Wnt/
-catenin-mediated EMT and tumour metastasis. Dis Markers 2021:3566749 - Zhang LM et al (2021) CCAAT enhancer binding protein
suppresses proliferation, metastasis, and epithelial-mesenchymal transition of ovarian cancer cells via suppressing the Wnt/ -catenin signaling. Neoplasma 68(3):602-612 - Wang T et al (2021) FTO-stabilized lncRNA HOXC13-AS epigenetically upregulated FZD6 and activated Wnt/
-catenin signaling to drive cervical cancer proliferation, invasion, and EMT. J buon 26(4):1279-1291 - Zhang LZ et al (2018) CRIP1 promotes cell migration, invasion and epithelial-mesenchymal transition of cervical cancer by activating the Wnt/
-catenin signaling pathway. Life Sci 207:420-427 - Gao
et al (2020) Aberrantly enhanced melanoma-associated antigen (MAGE)-A3 expression facilitates cervical cancer cell proliferation and metastasis via actuating Wnt signaling pathway. Biomed Pharmacother 122:109710 - Chung MT et al (2009) SFRP1 and SFRP2 suppress the transformation and invasion abilities of cervical cancer cells through Wnt signal pathway. Gynecol Oncol 112(3):646-653
- Meng F et al (2020) SMYD2 suppresses APC2 expression to activate the Wnt/
-catenin pathway and promotes epithelialmesenchymal transition in colorectal cancer. Am J Cancer Res 10(3):997-1011 - Xiao B et al (2020) Oncolytic adenovirus CD55-Smad4 suppresses cell proliferation, metastasis, and tumor stemness in colorectal cancer by regulating Wnt/
-catenin signaling pathway. Biomedicines 8(12):593 - Tian W et al (2021) HYD-PEP06 suppresses hepatocellular carcinoma metastasis, epithelial-mesenchymal transition and cancer stem cell-like properties by inhibiting PI3K/AKT and WNT/
-catenin signaling activation. Acta Pharm Sin B 11(6):1592-1606 - Chen Y et al (2019) TNF-
derived from M2 tumor-associated macrophages promotes epithelial-mesenchymal transition and cancer stemness through the Wnt/ -catenin pathway in SMMC7721 hepatocellular carcinoma cells. Exp Cell Res 378(1):41-50 - Yang Y et al (2017) Downregulated connexin 32 promotes EMT through the Wnt/
-catenin pathway by targeting Snail expression in hepatocellular carcinoma. Int J Oncol 50(6):1977-1988 - Jiang J et al (2015) Over-expression of TRIM37 promotes cell migration and metastasis in hepatocellular carcinoma by activating Wnt/
-catenin signaling. Biochem Biophys Res Commun 464(4):1120-1127 - Mitra T et al (2018) Stemness and chemoresistance are imparted to the OC cells through TGF
driven EMT. J Cell Biochem 119(7):5775-5787 - Ahmad SM et al (2020) Par-4 activation restrains EMT-induced chemoresistance in PDAC by attenuating MDM-2. Pancreatology 20(8):1698-1710
- Zhao C et al (2020) MicroRNA-128-3p enhances the chemosensitivity of temozolomide in glioblastoma by targeting c-Met and EMT. Sci Rep 10(1):9471
- Rosanò L et al (2014) Endothelin A receptor/
-arrestin signaling to the Wnt pathway renders ovarian cancer cells resistant to chemotherapy. Cancer Res 74(24):7453-7464 - Li Y et al (2019) Oncolytic Ad co-expressing decorin and Wnt decoy receptor overcomes chemoresistance of desmoplastic tumor through degradation of ECM and inhibition of EMT. Cancer Lett 459:15-29
- Su HY et al (2010) Epigenetic silencing of SFRP5 is related to malignant phenotype and chemoresistance of ovarian cancer through Wnt signaling pathway. Int J Cancer 127(3):555-567
- Kwon M et al (2016) Reduced expression of FILIP1L, a novel WNT pathway inhibitor, is associated with poor survival, progression and chemoresistance in ovarian cancer. Oncotarget 7(47):77052-77070
- Zhang W et al (2022) Sanguisorba officinalis L. suppresses 5-fluorouracil-sensitive and-resistant colorectal cancer growth and metastasis via inhibition of the Wnt/
-catenin pathway. Phytomedicine 94:153844 - Xing Y et al (2022) A novel
– (2,4-dinitrophenyl) diazeniumdiolate inhibits hepatocellular carcinoma migration, invasion, and EMT through the Wnt/ -catenin pathway. Toxicol In Vitro 84:105456 - Shalev N et al (2022) Phytocannabinoid compositions from cannabis act synergistically with PARP1 inhibitor against ovarian cancer cells in vitro and affect the Wnt signaling pathway. Molecules 27(21):7523
- Pisanti S et al (2017) Cannabidiol: state of the art and new challenges for therapeutic applications. Pharmacol Ther 175:133-150
- Jo MJ et al (2021) Cannabidiol suppresses angiogenesis and stemness of breast cancer cells by downregulation of hypoxiainducible factors-1
. Cancers 13(22):5667 - Feng P et al (2022) Cannabidiol inhibits invasion and metastasis in colorectal cancer cells by reversing epithelial-mesenchymal transition through the Wnt/
-catenin signaling pathway. J Cancer Res Clin Oncol 149:3587-3598 - Chen T et al (2019) Paris saponin H suppresses human hepatocellular carcinoma (HCC) by inactivation of Wnt/
-catenin pathway in vitro and in vivo. Int J Clin Exp Pathol 12(8):2875-2886 - Wei C et al (2019) Wogonoside inhibits prostate cancer cell growth and metastasis via regulating Wnt/
-catenin pathway and epithelial-mesenchymal transition. Pharmacology 104(5-6):312-319 - Li K et al (2018) Oldhamianoside II inhibits prostate cancer progression via regulation of EMT and the Wnt/
-catenin signaling pathway. Oncol Lett 15(6):9457-9463 - Tsao CW et al (2021) Regulation of carcinogenesis and mediation through Wnt/
-catenin signaling by 3,3′-diindolylmethane in an enzalutamide-resistant prostate cancer cell line. Sci Rep 11(1):1239 - Wu S et al (2018) 2′-Hydroxyflavanone inhibits epithelial-mesenchymal transition, and cell migration and invasion via suppression of the Wnt/
-catenin signaling pathway in prostate cancer. Oncol Rep 40(5):2836-2843 - Effenberger-Neidnicht K, Schobert R (2011) Combinatorial effects of thymoquinone on the anti-cancer activity of doxorubicin. Cancer Chemother Pharmacol 67(4):867-874
- Kruk I et al (2000) The effect of thymol and its derivatives on reactions generating reactive oxygen species. Chemosphere 41(7):1059-1064
- Ahmad A et al (2013) A review on therapeutic potential of Nigella sativa: A miracle herb. Asian Pac J Trop Biomed 3(5):337-352
- Salem ML (2005) Immunomodulatory and therapeutic properties of the Nigella sativa L. seed. Int Immunopharmacol 5(13-14):1749-1770
- Zhang M et al (2020) Thymoquinone suppresses invasion and metastasis in bladder cancer cells by reversing EMT through the Wnt/
-catenin signaling pathway. Chem Biol Interact 320:109022 - Liang Z et al (2015) Inhibition of tobacco smoke-induced bladder MAPK activation and epithelial-mesenchymal transition in mice by curcumin. Int J Clin Exp Pathol 8(5):4503
- Liang Z et al (2017) Curcumin reversed chronic tobacco smoke exposure induced urocystic EMT and acquisition of cancer stem cells properties via Wnt/
-catenin. Cell Death Dis 8(10):e3066 - Cilibrasi C et al (2017) Resveratrol Impairs Glioma Stem Cells Proliferation and Motility by Modulating the Wnt Signaling Pathway. PLoS One 12(1):e0169854
- Fang Q et al (2022)
-ionone inhibits epithelial-mesenchymal transition (EMT) in prostate cancer cells by negatively regulating the Wnt/ -catenin pathway. Front Biosci (Landmark Ed) 27(12):335 - Zhao M et al (2020) Gigantol attenuates the metastasis of human bladder cancer cells, possibly through Wnt/EMT signaling. Onco Targets Ther 13:11337-11346
- Fang RH, Gao W, Zhang L (2023) Targeting drugs to tumours using cell membrane-coated nanoparticles. Nat Rev Clin Oncol 20(1):33-48
- Zeng Y et al (2022) Cell membrane coated-nanoparticles for cancer immunotherapy. Acta Pharm Sin B 12(8):3233-3254
- Gavas S, Quazi S, Karpiński TM (2021) Nanoparticles for cancer therapy: current progress and challenges. Nanoscale Res Lett 16(1):173
- Liang
et al (2023) cRGD-targeted heparin nanoparticles for effective dual drug treatment of cisplatin-resistant ovarian cancer. J Control Release 356:691-701 - Huang
et al (2021) Anticancer activity of sweroside nanoparticles in prostate cancer bone metastasis in PC-3 cells involved in Wnt/ -catenin signaling pathway. J Biomed Nanotechnol 17(10):1960-1971 - Rupaimoole R, Slack FJ (2017) MicroRNA therapeutics: towards a new era for the management of cancer and other diseases. Nat Rev Drug Discov 16(3):203-222
- Anastasiadou E, Jacob LS, Slack FJ (2018) Non-coding RNA networks in cancer. Nat Rev Cancer 18(1):5-18
- Yang F et al (2019) MiR-1246 promotes metastasis and invasion of A549 cells by targeting GSK-3
-mediated Wnt -catenin pathway. Cancer Res Treat 51(4):1420-1429 - Du F et al (2020) KRAS mutation-responsive miR-139-5p inhibits colorectal cancer progression and is repressed by Wnt signaling. Theranostics 10(16):7335-7350
- Xi Y et al (2022) CircBCAR3 accelerates esophageal cancer tumorigenesis and metastasis via sponging miR-27a-3p. Mol Cancer 21(1):145
- Liu J, Yuan W, Gong D (2022) Hsa_circ_0000994 inhibits pancreatic cancer progression by clearing immune-related miR-27a and miR-27b. J Oncol 2022:7274794
- Yang W et al (2020) MiR-135-5p inhibits TGF-
-induced epithe-lial-mesenchymal transition and metastasis by targeting SMAD3 in breast cancer. J Cancer 11(21):6402-6412 - Yang Y et al (2019) MiR-135 suppresses glycolysis and promotes pancreatic cancer cell adaptation to metabolic stress by targeting phosphofructokinase-1. Nat Commun 10(1):809
- Yue H et al (2017) MIR-519d suppresses the gastric cancer epi-thelial-mesenchymal transition via Twist1 and inhibits Wnt/
catenin signaling pathway. Am J Transl Res 9(8):3654-3664 - Han
et al (2022) Knockdown of mediator complex subunit 27 suppresses gastric cancer cell metastasis and angiogenesis via Wnt/ -catenin pathway. Tissue Cell 79:101973 - Sun Y et al (2022) Overexpression of FOXC1 promotes tumor metastasis by activating the Wnt/
-catenin signaling pathway in gastric cancer. Dig Dis Sci 67(8):3742-3752 - Ma B et al (2020) Effects of miR-330-3p on invasion, migration and emt of gastric cancer cells by targeting PRRX1mediated Wnt/
-catenin signaling pathway. Onco Targets Ther 13:3411-3423 - Lin L et al (2022) SOX17 and PAX8 constitute an actionable lineage-survival transcriptional complex in ovarian cancer. Oncogene 41(12):1767-1779
- Wu X et al (2022) miR-200a-3p promoted cell proliferation and metastasis by downregulating SOX17 in non-small cell lung cancer cells. J Biochem Mol Toxicol 36(6):e23037
- Gallo A et al (2012) The majority of microRNAs detectable in serum and saliva is concentrated in exosomes. PLoS One 7(3):e30679
- Zomer A et al (2010) Exosomes: Fit to deliver small RNA. Commun Integr Biol 3(5):447-450
- Paskeh MDA et al (2022) Emerging role of exosomes in cancer progression and tumor microenvironment remodeling. J Hematol Oncol 15(1):83
- Mirzaei S et al (2023) Exosome-mediated miR-200a delivery into TGF-
-treated AGS cells abolished epithelial-mesenchymal transition with normalization of ZEB1, vimentin and Snail1 expression. Environ Res 231:116115 - Record M et al (2014) Exosomes as new vesicular lipid transporters involved in cell-cell communication and various pathophysiologies. Biochim Biophys Acta 1841(1):108-120
- Tyagi A et al (2022) Exosomal miR-4466 from nicotine-activated neutrophils promotes tumor cell stemness and metabolism in lung cancer metastasis. Oncogene 41(22):3079-3092
- Liang Z et al (2022) Downregulation of exosomal miR-7-5p promotes breast cancer migration and invasion by targeting RYK and participating in the atypical WNT signalling pathway. Cell Mol Biol Lett 27(1):88
- Yang SS et al (2020) Breast cancer-derived exosomes regulate cell invasion and metastasis in breast cancer via miR-146a to activate cancer associated fibroblasts in tumor microenvironment. Exp Cell Res 391(2):111983
- Chen M et al (2018) Decreased expression of lncRNA VPS9D1AS1 in gastric cancer and its clinical significance. Cancer Biomark 21(1):23-28
- Bracken CP, Scott HS, Goodall GJ (2016) A network-biology perspective of microRNA function and dysfunction in cancer. Nat Rev Genet 17(12):719-732
- Xue X et al (2016) LncRNA HOTAIR enhances ER signaling and confers tamoxifen resistance in breast cancer. Oncogene 35(21):2746-2755
- Yang XZ et al (2018) LINC01133 as ceRNA inhibits gastric cancer progression by sponging miR-106a-3p to regulate
204. Li X et al (2020) LINC01089 inhibits tumorigenesis and epithe-lial-mesenchymal transition of non-small cell lung cancer via the miR-27a/SFRP1/Wnt/
205. Zhang Y, Li Y (2020) Long non-coding RNA NORAD contributes to the proliferation, invasion and EMT progression of prostate cancer via the miR-30a-5p/RAB11A/WNT/
206. Zhang Y et al (2017) LncRNA HOXD-AS1 promotes epithelial ovarian cancer cells proliferation and invasion by targeting miR
207. Meng S et al (2017) CircRNA: functions and properties of a novel potential biomarker for cancer. Mol Cancer 16(1):1-8
208. Ebbesen KK, Hansen TB, Kjems J (2017) Insights into circular RNA biology. RNA Biol 14(8):1035-1045
209. Yang M et al (2022) EIF4A3-regulated circ_0087429 can reverse EMT and inhibit the progression of cervical cancer via miR-5003-3p-dependent upregulation of OGN expression. J Exp Clin Cancer Res 41(1):165
210. Luo YY et al (2022) Hsa_Circ_0098181 suppresses hepatocellular carcinoma by sponging miR-18a-3p and targeting PPARA. Front Pharmacol 13:819735
211. Gao S et al (2019) Circular RNA hsa_circ_0007059 restrains proliferation and epithelial-mesenchymal transition in lung cancer cells via inhibiting microRNA-378. Life Sci 233:116692
212. Li XY et al (2019) Enhanced expression of circular RNA hsa_ circ_000984 promotes cells proliferation and metastasis in nonsmall cell lung cancer by modulating Wnt/
213. Liu W et al (2022) SP1-mediated up-regulation of lncRNA TUG1 underlines an oncogenic property in colorectal cancer. Cell Death Dis 13(5):433
214. Zhou J et al (2021) Hsa_circ_0001666 suppresses the progression of colorectal cancer through the miR-576-5p/PCDH10 axis. Clin Transl Med 11(11):e565
215. Wang HH, Ma JN, Zhan XR (2021) Circular RNA Circ_0067934 attenuates ferroptosis of thyroid cancer cells by miR-545-3p/ SLC7A11 signaling. Front Endocrinol (Lausanne) 12:670031
216. Yin Y et al (2022) Circ_0067934 reduces JNK phosphorylation through a microRNA-545-3p/PPA1 axis to enhance tumorigenesis and cisplatin resistance in ovarian cancer. Immunopharmacol Immunotoxicol 44(2):261-274
217. Zhao M, Ma W, Ma C (2020) Circ_0067934 promotes non-small cell lung cancer development by regulating miR-1182/KLF8 axis and activating Wnt/
218. Liu R et al (2021) Circ_0082182 promotes oncogenesis and metastasis of colorectal cancer in vitro and in vivo by sponging miR-411 and miR-1205 to activate the Wnt/
219. Chen X et al (2022) MicroRNA-621 functions as a metastasis suppressor in colorectal cancer by directly targeting LEF1 and suppressing Wnt/
220. Liu Y, Zhou WL (2022) LINC01315 accelerates the growth and epithelial-mesenchymal transition of colorectal cancer cells via activating the Wnt/
221. Tan A, Li Q, Chen L (2019) CircZFR promotes hepatocellular carcinoma progression through regulating miR-3619-5p/ CTNNB1 axis and activating Wnt/
222. Tang H et al (2019) MicroRNA-194 inhibits cell invasion and migration in hepatocellular carcinoma through PRC1-mediated inhibition of Wnt/
223. Huang H et al (2020) LncRNA CARLo-7 facilitates proliferation, migration, invasion, and EMT of bladder cancer cells by regulating Wnt/
224. Guo J et al (2019) The lncRNA DLX6-AS1 promoted cell proliferation, invasion, migration and epithelial-to-mesenchymal transition in bladder cancer via modulating Wnt/
225. Zhu X et al (2018) LSINCT5 activates Wnt/
226. Jia GQ et al (2018) Long non-coding RNA PlncRNA-1 promotes cell proliferation and hepatic metastasis in colorectal cancer. J Cell Biochem 119(8):7091-7104
227. Li N et al (2020) Long non-coding RNA ADAMTS9-AS1 suppresses colorectal cancer by inhibiting the Wnt/
228. Park SA et al (2020) Long non-coding RNA steroid receptor activator promotes the progression of endometrial cancer via Wnt/
229. Xu Y et al (2019) Long non-coding RNA LINC01225 promotes proliferation, invasion and migration of gastric cancer via Wnt/
230. Shao Z et al (2020) Circ_0003789 facilitates gastric cancer progression by inducing the epithelial-mesenchymal transition through the Wnt/
231. Pan J et al (2020) lncRNA JPX/miR-33a-5p/Twist1 axis regulates tumorigenesis and metastasis of lung cancer by activating Wnt
232. Chi Y et al (2019) miR-516a-3p inhibits breast cancer cell growth and EMT by blocking the Pygo2/Wnt signalling pathway. J Cell Mol Med 23(9):6295-6307
233. Cui Y et al (2019) miR-15a-3p suppresses prostate cancer cell proliferation and invasion by targeting SLC39A7 via downregulating Wnt/
234. Yuan G et al (2019) LncRNA-MIR17HG mediated upregulation of miR-17 and miR-18a promotes colon cancer progression via activating Wnt/
235. Huang
- Wenhua Xue and Lin Yang have contributed equally to this work.
Milad Ashrafizadeh
dvm.milad1994@gmail.com
Yu Tian
Tian_Yu@ben.edu
Ranran Sun
fccsunrr@zzu.edu.cn
1 Department of Pharmacy, The First Affiliated Hospital of Zhengzhou University, Zhengzhou 450052, Henan, People’s Republic of China2 Department of Hepatobiliary Surgery, Xianyang Central Hospital, Xianyang 712000, Shaanxi, China3 Shanghai Institute of Cardiovascular Diseases, Zhongshan Hospital, Fudan University, Shanghai 200032, China
4 School of Public Health, Benedictine University, Lisle, USA
5 Precision Medicine Center, The First Affiliated Hospital of Zhengzhou University, Zhengzhou, Henan, China - transfer into nucleus and enhance gene transcription. However, lack of Wnt ligand mediates the phosphorylation of
-catenin to enhance its proteasomal degradation
