المجلة: The Lancet، المجلد: 403، العدد: 10426
DOI: https://doi.org/10.1016/s0140-6736(23)02511-4
PMID: https://pubmed.ncbi.nlm.nih.gov/38310910
تاريخ النشر: 2024-02-01
DOI: https://doi.org/10.1016/s0140-6736(23)02511-4
PMID: https://pubmed.ncbi.nlm.nih.gov/38310910
تاريخ النشر: 2024-02-01
سلامة وفعالية مرشح لقاح الملاريا R21/Matrix-M لدى الأطفال الأفارقة: تجربة متعددة المراكز، مزدوجة التعمية، عشوائية، من المرحلة الثالثة
الملخص
ملخص الخلفية مؤخرًا، وجدنا أن لقاح الملاريا الجديد، R21/Matrix-M، كان لديه أكثر من
طرق قمنا بإجراء تجربة عشوائية مزدوجة التعمية من المرحلة 3 للقاح الملاريا R21/Matrix-M عبر خمسة مواقع في أربع دول أفريقية ذات كثافات موسمية مختلفة من انتقال الملاريا. تم تسجيل الأطفال (تتراوح أعمارهم بين 5-36 شهرًا) وتوزيعهم عشوائيًا (2:1) لتلقي
النتائج من 26 أبريل 2021 إلى 12 يناير 2022، وافق 5477 طفلًا على الخضوع للفحص، منهم تم تخصيص 1705 بشكل عشوائي لمجموعة اللقاح الضابطة و3434 لمجموعة R21/Matrix-M؛ تلقى 4878 مشاركًا الجرعة الأولى من اللقاح. تم تضمين 3103 مشاركًا في مجموعة R21/Matrix-M و1541 مشاركًا في مجموعة التحكم في التحليل المعدل وفقًا للبروتوكول (2412 [
تمت معالجة R21/Matrix-M بشكل جيد وقدمت فعالية عالية ضد الملاريا السريرية لدى الأطفال الأفارقة. هذه اللقاح منخفض التكلفة وذو فعالية عالية مرخص بالفعل من قبل عدة دول أفريقية، وقد حصل مؤخرًا على توصية سياسة من منظمة الصحة العالمية وتأهيل مسبق، مما يوفر إمدادات على نطاق واسع للمساعدة في تقليل العبء الكبير للملاريا في أفريقيا جنوب الصحراء.
تمويل معهد سيروم في الهند، وصندوق ويلكوم، والمعهد الوطني البريطاني للبحوث الصحية، ومركز أبحاث أكسفورد الحيوية، وOpen Philanthropy.
حقوق الطبع والنشر © 2024 المؤلف(ون). نُشر بواسطة إلزيفير المحدودة. هذه مقالة مفتوحة الوصول بموجب ترخيص CC BY-NC.
لانست 2024؛ 403: 533-44
نُشر على الإنترنت
1 فبراير 2024
https://doi.org/10.1016/س0140-6736(23)02511-4
انظر التعليق الصفحة 504
*ساهموا بالتساوي ككتاب ثانٍ مشتركين
§أعضاء مجموعة تجربة المرحلة الثالثة R21/Matrix-M مدرجون في نهاية المقال
نُشر على الإنترنت
1 فبراير 2024
https://doi.org/10.1016/س0140-6736(23)02511-4
انظر التعليق الصفحة 504
*ساهموا بالتساوي ككتاب ثانٍ مشتركين
§أعضاء مجموعة تجربة المرحلة الثالثة R21/Matrix-M مدرجون في نهاية المقال
مركز اللقاحات السريرية والطب الاستوائي، معهد جينر، جامعة أكسفورد ومركز أبحاث أكسفورد الحيوية التابع للمعهد الوطني لأبحاث الصحة، أكسفورد، المملكة المتحدة (م. س. داتو دكتوراه، ف. راموس لوبيز ماجستير، س. ويستون ماجستير، أ. لوري دكتوراه، ر. روبرتس ماجستير، البروفيسور أ. ف. س. هيل زميل في الجمعية الملكية)؛ وحدة البحث السريري في بوجوني-ويلسوبوغو، مركز أبحاث وتدريب الملاريا، جامعة العلوم والتقنيات والتكنولوجيا في باماكو، باماكو، مالي (أ. ديكو دكتوراه، د. إيسياكا دكتوراه)؛ وحدة البحث السريري في نانورو، معهد البحث في علوم الصحة، نانورو، بوركينا فاسو (هـ. تينتو دكتوراه، هـ. م. ناتاما دكتوراه، د. سالو دكتوراه، أ. م. سومي دكتور في الطب)؛ معهد العلوم والتقنيات (INSTech)، بوبو-ديولاسو، بوركينا فاسو (ج. ب. ويدراوغو دكتور في الطب، ي. د. كومباوري دكتور في الطب)؛ مركز أبحاث الطب الجغرافي الساحلي التابع لمعهد أبحاث الطب في كينيا (KEMRI-CGMRC)، كيلفي، كينيا (م. هاملوبا دكتور في الطب، س. أوميندا ماجستير في الطب، ب. بيجون دكتوراه)؛ مركز الطب الاستوائي والصحة العالمية، نوفيلد
مقالات
البحث في السياق
الأدلة قبل هذه الدراسة
RTS,S/AS01 (Mosquirix؛ غلاكسو سميث كلاين) هو أول لقاح ضد الملاريا موصى به من قبل منظمة الصحة العالمية للاستخدام في الأطفال الذين تتراوح أعمارهم بين 5-17 شهرًا في بيئات ذات انتقال معتدل إلى مرتفع. من المخطط أن يبدأ النشر في عام 2024 بعد أن دعم برنامج تنفيذ لقاح الملاريا ملف سلامة مناسب في ثلاث دول أفريقية. بحثنا في قاعدة بيانات PubMed من بداية قاعدة البيانات حتى 20 سبتمبر 2023، عن مقالات منشورة باستخدام مصطلحات البحث “لقاح الملاريا” و”التجربة السريرية” و”المرحلة الثالثة” و”الفعالية”. لم يتم تطبيق أي قيود لغوية. في تجربة كبيرة من المرحلة الثالثة، كان لقاح RTS,S/AS01 ضد الملاريا له فعالية لقاح بنسبة 56% (95% CI 51-60) في الأطفال الذين تتراوح أعمارهم بين 5-17 شهرًا على مدى 12 شهرًا بعد إعطاء الجرعات الثلاثة الأولية. بعد 12 شهرًا من جرعة التعزيز، التي تم إعطاؤها بعد 18 شهرًا من السلسلة الأولية، كانت فعالية اللقاح على مدى 30 شهرًا هي
القيمة المضافة لهذه الدراسة
تظهر هذه التجربة السريرية من المرحلة الثالثة فعالية عالية للقاح على مدى عام واحد مع نظام جرعات ثلاثي من R21/Matrix-M في 4644 طفلًا تتراوح أعمارهم بين 5-36 شهرًا مع كل من الموسمي
(75% [95% CI 71-79]) ونوع دائم يعتمد على العمر (قياسي؛
(75% [95% CI 71-79]) ونوع دائم يعتمد على العمر (قياسي؛
تداعيات جميع الأدلة المتاحة
تدعم نتائج هذه التجربة نتائج تجربة أصغر، أحادية البلد، من المرحلة 2ب، التي أظهرت فعالية اللقاح بأكثر من
مقدمة
في السنوات الأخيرة، توقف التقدم في تقليل الملاريا، مع أكثر من 220 مليون حالة و620000 وفاة سنويًا.
في التجربة السريرية المرحلة 3 من RTS,S/AS01،
في التجربة السريرية المرحلة 3 من RTS,S/AS01،
R21 هو جزيء شبيه بالفيروس يتكون من التكرارات المركزية لـ Asn-Ala-Asn-Pro (NANP) والنهاية C.
تسلسل بروتين السركومسبوروزويت المدمج مع مستضد سطح فيروس التهاب الكبد B (HBsAg). يختلف R21 عن RTS,S حيث أن جميع، بدلاً من
تسلسل بروتين السركومسبوروزويت المدمج مع مستضد سطح فيروس التهاب الكبد B (HBsAg). يختلف R21 عن RTS,S حيث أن جميع، بدلاً من
طرق
تصميم الدراسة والمشاركون
تم إجراء هذه التجربة العشوائية المزدوجة التعمية من المرحلة 3 في موقعين موسميين (وحدة البحث السريري في نانورو، نانورو، بوركينا فاسو ومركز أبحاث وتدريب الملاريا، باماكو وبوغوني، مالي) وثلاثة مواقع معيارية دائمة (أي حيث يحدث انتقال الملاريا على مدار السنة وحيث تم استخدام جدول زمني لإعطاء اللقاح بناءً على العمر) (معهد العلوم والتقنيات، داند، بوركينا فاسو؛ مركز أبحاث الطب الجغرافي في معهد كينيا للبحوث الطبية، كيلفي، كينيا؛ ومعهد إيفاكارا الصحي، باجامويو، تنزانيا). تم اختيار هذه المراكز لضمان إجراء تقييم اللقاح في مناطق ذات انتقال مرتفع ومنخفض، وأيضًا في مناطق دائمة وموسمية لانتقال الملاريا عبر منطقة جنوب الصحراء الكبرى في إفريقيا.
كانت الدراسة تخطط لتسجيل 4800 مشارك عبر جميع المواقع، مع 1200 مشارك لكل موقع، باستثناء كيلفي وباغامويو حيث كان العدد 600 لكل موقع، والتي تم دمجها لتحقيق قوة إحصائية كافية كشرق إفريقيا في التحليل الرئيسي لفعالية المواقع المحددة. كانت السلسلة الأساسية من التطعيمات تتكون من ثلاث تطعيمات، بفاصل 4 أسابيع، تليها تطعيمة معززة بعد حوالي 12 شهرًا من التطعيمة الثالثة. في المواقع الموسمية، تم إعطاء السلسلة الأساسية من التطعيمات قبل موسم الملاريا، مع إعطاء التطعيمة المعززة بعد 12 شهرًا قبل موسم الملاريا التالي. في المواقع القياسية، تم إعطاء السلسلة الأساسية في أي وقت من السنة، مع إعطاء التطعيمة المعززة بعد 12 شهرًا.
يتم تقييم السلامة والاستجابة المناعية وفعالية اللقاح على مدى 24 شهرًا، مع تقييم نقطة النهاية الأساسية للفعالية بعد 12 شهرًا من سلسلة التطعيمات الأساسية. يتضمن ذلك جمع الأحداث السلبية المطلوبة على مدى 7 أيام بعد التطعيم وأخذ عينات من الدم في نقاط زمنية محددة مسبقًا. تم جمع البيانات حول الرش المتبقي الداخلي، واستخدام الشبكات المعالجة بالمبيدات الحشرية بشكل كافٍ (مصنفة حسب وجود أو عدم وجود ثقوب)، وعدد الجولات والجرعات من الوقاية الكيميائية من الملاريا الموسمية التي تناولها المشارك خلال موسم الملاريا في المناطق التي يُوصى فيها بهذه السياسة.
تم تحديد قوائم الأطفال المؤهلين من قواعد بيانات المراقبة المحلية والتوعية المجتمعية. تم دعوة مقدمي الرعاية الذين أبدوا اهتمامًا لزيارة الفحص. قبل الفحص، قدم الآباء أو الأوصياء على المشاركين موافقة مكتوبة أو بصمة إبهام، والتي تم التحقق منها شفهيًا في كل زيارة دراسية. تم استخدام معايير الإدراج التالية: المشاركون الذين تتراوح أعمارهم بين 5-36 شهرًا في وقت تلقيهم أول لقاح، تم الحصول على موافقة مستنيرة موقعة وشاهدة من الوالد أو الوصي، اعتقد الباحث أن الآباء أو الأوصياء يمكنهم وسيقومون بالامتثال لمتطلبات البروتوكول إذا تم تسجيل الطفل في الدراسة، واحتفظ المشارك في منطقة الدراسة طوال مدة التجربة. تضمنت معايير الاستبعاد وجود حالات مرضية مصاحبة كبيرة وتلقي لقاح آخر ضد الملاريا.
لقاح. يمكن العثور على التفاصيل الكاملة لمعايير الأهلية في البروتوكول (الملحق الصفحات 87-174). كان هناك حد أدنى من الفاصل الزمني لمدة أسبوعين بين إعطاء لقاح الدراسة وأي لقاح من البرنامج الموسع للتطعيم. تمت الموافقة على التجربة من قبل جميع لجان الأخلاقيات المحلية والسلطات التنظيمية، بالإضافة إلى لجان الأخلاقيات في جامعة أكسفورد (أكسفورد، المملكة المتحدة) وكلية لندن للصحة العامة والطب الاستوائي (لندن، المملكة المتحدة)، مع تنسيق داعم من منتدى تنظيم اللقاحات الأفريقي. مزيد من التفاصيل موجودة في الملحق (ص 13).
كانت الدراسة تخطط لتسجيل 4800 مشارك عبر جميع المواقع، مع 1200 مشارك لكل موقع، باستثناء كيلفي وباغامويو حيث كان العدد 600 لكل موقع، والتي تم دمجها لتحقيق قوة إحصائية كافية كشرق إفريقيا في التحليل الرئيسي لفعالية المواقع المحددة. كانت السلسلة الأساسية من التطعيمات تتكون من ثلاث تطعيمات، بفاصل 4 أسابيع، تليها تطعيمة معززة بعد حوالي 12 شهرًا من التطعيمة الثالثة. في المواقع الموسمية، تم إعطاء السلسلة الأساسية من التطعيمات قبل موسم الملاريا، مع إعطاء التطعيمة المعززة بعد 12 شهرًا قبل موسم الملاريا التالي. في المواقع القياسية، تم إعطاء السلسلة الأساسية في أي وقت من السنة، مع إعطاء التطعيمة المعززة بعد 12 شهرًا.
يتم تقييم السلامة والاستجابة المناعية وفعالية اللقاح على مدى 24 شهرًا، مع تقييم نقطة النهاية الأساسية للفعالية بعد 12 شهرًا من سلسلة التطعيمات الأساسية. يتضمن ذلك جمع الأحداث السلبية المطلوبة على مدى 7 أيام بعد التطعيم وأخذ عينات من الدم في نقاط زمنية محددة مسبقًا. تم جمع البيانات حول الرش المتبقي الداخلي، واستخدام الشبكات المعالجة بالمبيدات الحشرية بشكل كافٍ (مصنفة حسب وجود أو عدم وجود ثقوب)، وعدد الجولات والجرعات من الوقاية الكيميائية من الملاريا الموسمية التي تناولها المشارك خلال موسم الملاريا في المناطق التي يُوصى فيها بهذه السياسة.
تم تحديد قوائم الأطفال المؤهلين من قواعد بيانات المراقبة المحلية والتوعية المجتمعية. تم دعوة مقدمي الرعاية الذين أبدوا اهتمامًا لزيارة الفحص. قبل الفحص، قدم الآباء أو الأوصياء على المشاركين موافقة مكتوبة أو بصمة إبهام، والتي تم التحقق منها شفهيًا في كل زيارة دراسية. تم استخدام معايير الإدراج التالية: المشاركون الذين تتراوح أعمارهم بين 5-36 شهرًا في وقت تلقيهم أول لقاح، تم الحصول على موافقة مستنيرة موقعة وشاهدة من الوالد أو الوصي، اعتقد الباحث أن الآباء أو الأوصياء يمكنهم وسيقومون بالامتثال لمتطلبات البروتوكول إذا تم تسجيل الطفل في الدراسة، واحتفظ المشارك في منطقة الدراسة طوال مدة التجربة. تضمنت معايير الاستبعاد وجود حالات مرضية مصاحبة كبيرة وتلقي لقاح آخر ضد الملاريا.
لقاح. يمكن العثور على التفاصيل الكاملة لمعايير الأهلية في البروتوكول (الملحق الصفحات 87-174). كان هناك حد أدنى من الفاصل الزمني لمدة أسبوعين بين إعطاء لقاح الدراسة وأي لقاح من البرنامج الموسع للتطعيم. تمت الموافقة على التجربة من قبل جميع لجان الأخلاقيات المحلية والسلطات التنظيمية، بالإضافة إلى لجان الأخلاقيات في جامعة أكسفورد (أكسفورد، المملكة المتحدة) وكلية لندن للصحة العامة والطب الاستوائي (لندن، المملكة المتحدة)، مع تنسيق داعم من منتدى تنظيم اللقاحات الأفريقي. مزيد من التفاصيل موجودة في الملحق (ص 13).
العشوائية والتعتيم
تم تعيين الأطفال الذين تتراوح أعمارهم بين 5-36 شهرًا والذين استوفوا معايير الأهلية بشكل عشوائي
تمت عملية العشوائية باستخدام نظام استجابة تفاعلي إلكتروني عبر الويب (DiagnoSearch Life، ثان، الهند). تم تصنيف العشوائية حسب موقع التجربة (موسمي أو قياسي)، والعوامل المربكة المحتملة، بما في ذلك العمر (5-12 شهرًا، 13-24 شهرًا، أو 25-36 شهرًا) والجنس (ذكر أو أنثى)، باستخدام العشوائية الكتلية مع أحجام كتل متغيرة.
تم إعداد لقاحات الملاريا والسيطرة من قبل الصيادلة باستخدام نفس نوع الحقنة، بنفس الحجم، وكانت بنفس اللون والاتساق. تم إخفاء محتويات الحقنة بعلامة غير شفافة. كانت التجربة مزدوجة التعمية: كان المشاركون، وعائلاتهم، وجميع الباحثين، وفرق المختبر، والفريق المحلي للدراسة جميعهم غير مدركين للعلاج.
تمت عملية العشوائية باستخدام نظام استجابة تفاعلي إلكتروني عبر الويب (DiagnoSearch Life، ثان، الهند). تم تصنيف العشوائية حسب موقع التجربة (موسمي أو قياسي)، والعوامل المربكة المحتملة، بما في ذلك العمر (5-12 شهرًا، 13-24 شهرًا، أو 25-36 شهرًا) والجنس (ذكر أو أنثى)، باستخدام العشوائية الكتلية مع أحجام كتل متغيرة.
تم إعداد لقاحات الملاريا والسيطرة من قبل الصيادلة باستخدام نفس نوع الحقنة، بنفس الحجم، وكانت بنفس اللون والاتساق. تم إخفاء محتويات الحقنة بعلامة غير شفافة. كانت التجربة مزدوجة التعمية: كان المشاركون، وعائلاتهم، وجميع الباحثين، وفرق المختبر، والفريق المحلي للدراسة جميعهم غير مدركين للعلاج.
الإجراءات
تلقى المشاركون R21 (معهد مصل الهند) كتركيبة من زجاجتين: تم خلط R21 مباشرة قبل الإعطاء مع المعزز اللقاحي القائم على السابونين Matrix-M (نوفافاكس AB، أوبسالا، السويد). جرعة من
تم إعطاء جميع اللقاحات بجرعة 0.5 مل عن طريق الحقن العضلي في الفخذ أو عضلة الدالية.
في يوم التطعيم، إذا كان لدى أي مشارك حمى تبلغ 37.5 درجة مئوية أو أعلى، تم تأجيل التطعيم وتم تقييمهم سريرياً وإدارتهم بشكل مناسب. إذا كان هناك حاجة لإجراء فحص دم وكان إيجابياً لوجود طفيليات البلازموديوم، تم علاج المشارك من الملاريا وفقاً للإرشادات المحلية قبل تلقيه التطعيم في الدراسة.
يتم جمع الأحداث السلبية الخطيرة والأحداث السلبية ذات الاهتمام الخاص طوال مدة التجربة لجميع المشاركين. تم جمع جميع الأحداث السلبية غير المرغوب فيها على مدار 28 يومًا بعد كل تطعيم لجميع المشاركين. تم استخدام الحكم السريري من قبل الأطباء المعالجين المجهولين في الموقع لتقييم العلاقة السببية للأحداث السلبية وأي ارتباط باللقاح.
تم إعطاء جميع اللقاحات بجرعة 0.5 مل عن طريق الحقن العضلي في الفخذ أو عضلة الدالية.
في يوم التطعيم، إذا كان لدى أي مشارك حمى تبلغ 37.5 درجة مئوية أو أعلى، تم تأجيل التطعيم وتم تقييمهم سريرياً وإدارتهم بشكل مناسب. إذا كان هناك حاجة لإجراء فحص دم وكان إيجابياً لوجود طفيليات البلازموديوم، تم علاج المشارك من الملاريا وفقاً للإرشادات المحلية قبل تلقيه التطعيم في الدراسة.
يتم جمع الأحداث السلبية الخطيرة والأحداث السلبية ذات الاهتمام الخاص طوال مدة التجربة لجميع المشاركين. تم جمع جميع الأحداث السلبية غير المرغوب فيها على مدار 28 يومًا بعد كل تطعيم لجميع المشاركين. تم استخدام الحكم السريري من قبل الأطباء المعالجين المجهولين في الموقع لتقييم العلاقة السببية للأحداث السلبية وأي ارتباط باللقاح.
تم جمع بيانات أمان إضافية في الأول
تم تقييم شدة الأعراض باستخدام طرق موحدة (الملحق الصفحات 160-161) وتمت مراقبة جميع الأحداث السلبية حتى الحل.
بعد التطعيم الثالث، تم زيارة المشاركين من قبل العاملين الميدانيين تقريبًا كل 8 أسابيع حتى 12 شهرًا بعد التطعيم الثالث. خلال هذه الزيارات، تم سؤال مقدمي الرعاية للمشاركين عما إذا كان قد حدث أي حدث طبي قد يكون حدثًا ضارًا خطيرًا منذ الزيارة الأخيرة وتم تسجيل هذه المعلومات. إذا كانت التقييمات السريرية مطلوبة، تم إحالة المشارك إلى عيادة موقع التجربة أو أقرب مرفق صحي مجتمعي. يوجد جدول مفصل للزيارات في البروتوكول (الملحق الصفحات 136-137).
تم إجراء تحليلات مؤقتة لتسهيل مراجعات لجنة مراقبة سلامة البيانات بعد الانتهاء من السلسلة الأساسية من ثلاث تطعيمات. تم إجراء مراجعات إضافية بعد إعطاء التطعيمات المعززة. كما تم تزويد لجنة مراقبة سلامة البيانات بتقارير عن الأحداث السلبية الخطيرة عند حدوثها بالإضافة إلى قوائم شهرية.
تم نصح مقدمي الرعاية للمشاركين بزيارة مرفق الصحة المجتمعية المحلي لإجراء مراجعة سريرية إذا كان لدى طفلهم أي مرض أو درجة حرارة.
تم تقييم شدة الأعراض باستخدام طرق موحدة (الملحق الصفحات 160-161) وتمت مراقبة جميع الأحداث السلبية حتى الحل.
بعد التطعيم الثالث، تم زيارة المشاركين من قبل العاملين الميدانيين تقريبًا كل 8 أسابيع حتى 12 شهرًا بعد التطعيم الثالث. خلال هذه الزيارات، تم سؤال مقدمي الرعاية للمشاركين عما إذا كان قد حدث أي حدث طبي قد يكون حدثًا ضارًا خطيرًا منذ الزيارة الأخيرة وتم تسجيل هذه المعلومات. إذا كانت التقييمات السريرية مطلوبة، تم إحالة المشارك إلى عيادة موقع التجربة أو أقرب مرفق صحي مجتمعي. يوجد جدول مفصل للزيارات في البروتوكول (الملحق الصفحات 136-137).
تم إجراء تحليلات مؤقتة لتسهيل مراجعات لجنة مراقبة سلامة البيانات بعد الانتهاء من السلسلة الأساسية من ثلاث تطعيمات. تم إجراء مراجعات إضافية بعد إعطاء التطعيمات المعززة. كما تم تزويد لجنة مراقبة سلامة البيانات بتقارير عن الأحداث السلبية الخطيرة عند حدوثها بالإضافة إلى قوائم شهرية.
تم نصح مقدمي الرعاية للمشاركين بزيارة مرفق الصحة المجتمعية المحلي لإجراء مراجعة سريرية إذا كان لدى طفلهم أي مرض أو درجة حرارة.
تم قياس الأجسام المضادة من نوع IgG ضد بولي ببتيد يحتوي على ست تكرارات من تسلسل منطقة NANP المركزية في الأول
النتائج
الهدف الأساسي هو تقييم الفعالية الوقائية لـ R21/Matrix-M من 14 يومًا بعد التطعيم الثالث حتى 12 شهرًا بعد الانتهاء من السلسلة الأولية في مواقع موسمية ومعيارية بشكل منفصل كنقاط نهاية مشتركة.
تم تقييم السلامة والتفاعل المناعي لـ R21/Matrix-M أيضًا وفقًا لنظام التطعيم (الموسمي أو القياسي) في الشهر الذي يلي كل تطعيم.
كانت الأهداف الثانوية فعالية R21/Matrix-M في جميع المواقع مجتمعة، بعد التطعيمات المعززة، ضد عدة حالات ملاريا، ضد الملاريا الشديدة، حدوث فقر الدم الشديد، دخول المستشفى بسبب الملاريا، والحالات غير العرضية.
تم تقييم المناعية الخلطية لـ R21/Matrix-M من خلال قياس عناوين الأجسام المضادة لتكرار NANP المركزي.
يمكن العثور على مزيد من التفاصيل حول جميع النتائج في البروتوكول وخطة التحليل الإحصائي (الملحق الصفحات 59-85).
تم تقييم السلامة والتفاعل المناعي لـ R21/Matrix-M أيضًا وفقًا لنظام التطعيم (الموسمي أو القياسي) في الشهر الذي يلي كل تطعيم.
كانت الأهداف الثانوية فعالية R21/Matrix-M في جميع المواقع مجتمعة، بعد التطعيمات المعززة، ضد عدة حالات ملاريا، ضد الملاريا الشديدة، حدوث فقر الدم الشديد، دخول المستشفى بسبب الملاريا، والحالات غير العرضية.
تم تقييم المناعية الخلطية لـ R21/Matrix-M من خلال قياس عناوين الأجسام المضادة لتكرار NANP المركزي.
يمكن العثور على مزيد من التفاصيل حول جميع النتائج في البروتوكول وخطة التحليل الإحصائي (الملحق الصفحات 59-85).
التحليل الإحصائي
تم تحديد حجم العينة الإجمالي بناءً على الهدف المتمثل في توفير بيانات السلامة لما لا يقل عن 3000 مشارك في مجموعة لقاح الملاريا (R21/Matrix-M): تم تسجيل 3200 مشارك بالإضافة إلى 1600 مشارك في مجموعة التحكم. تم تجنيد نصف هؤلاء المشاركين في موقعين موسميين ونصفهم في ثلاثة مواقع قياسية.
في المواقع الموسمية، كانت نسبة الحدوث المتوقعة 0.58 حالة لكل طفل في السنة بين 800 مشارك من مجموعة التحكم، والتي، مع متابعة لمدة 12 شهرًا، ستعطي أكثر من
كانت التحليلات الأساسية لفعالية اللقاح قائمة على متابعة لمدة 12 شهرًا، وسكان معدلين وفقًا للبروتوكول، والذي شمل جميع المشاركين الذين تلقوا ثلاث جرعات من اللقاح الصحيح مع فترة بين الجرعة الأولى والثانية تتراوح بين 3-6 أسابيع، والفترة بين الجرعة الثانية والثالثة من
في المواقع الموسمية، كانت نسبة الحدوث المتوقعة 0.58 حالة لكل طفل في السنة بين 800 مشارك من مجموعة التحكم، والتي، مع متابعة لمدة 12 شهرًا، ستعطي أكثر من
كانت التحليلات الأساسية لفعالية اللقاح قائمة على متابعة لمدة 12 شهرًا، وسكان معدلين وفقًا للبروتوكول، والذي شمل جميع المشاركين الذين تلقوا ثلاث جرعات من اللقاح الصحيح مع فترة بين الجرعة الأولى والثانية تتراوح بين 3-6 أسابيع، والفترة بين الجرعة الثانية والثالثة من
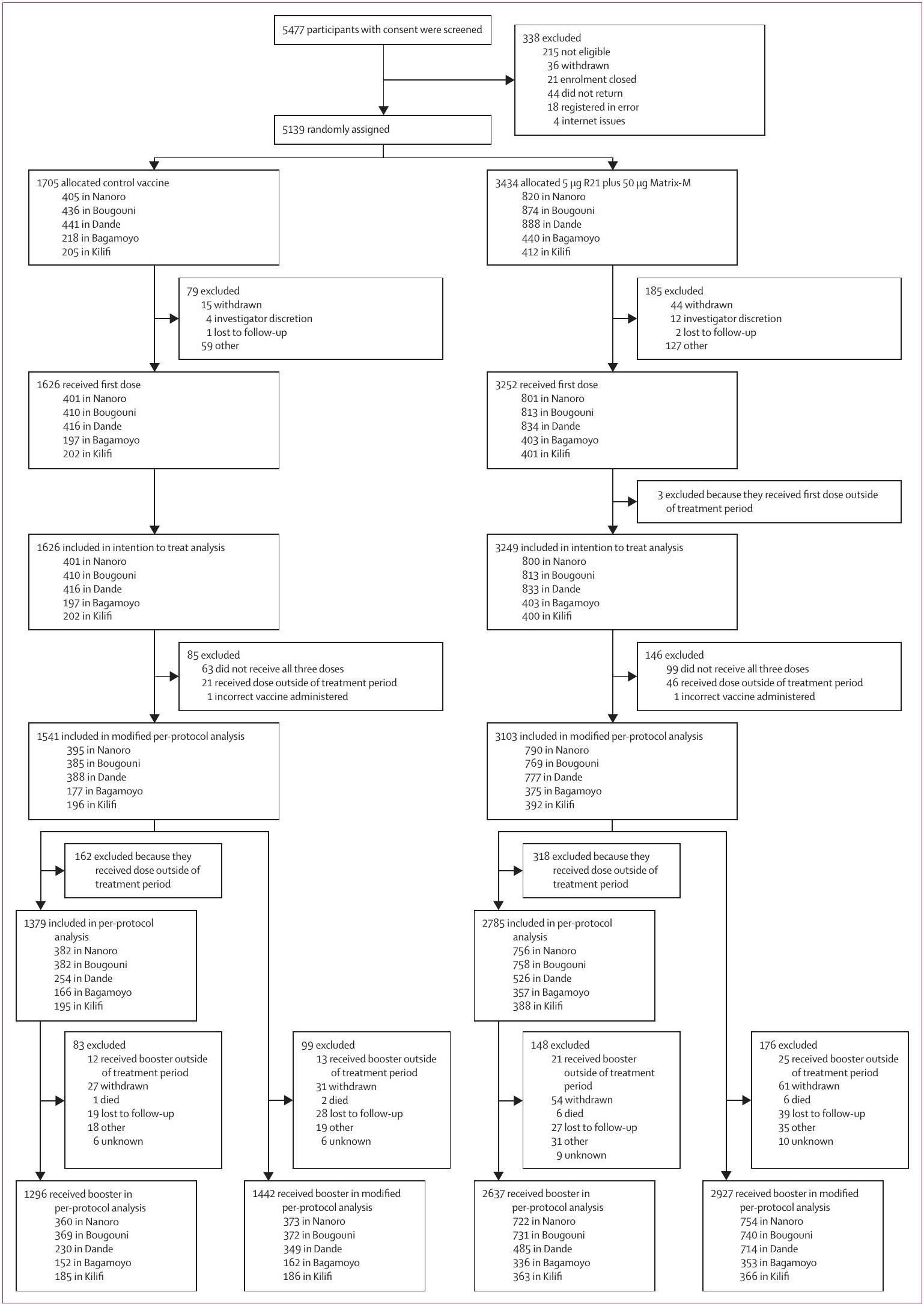
الشكل 1: ملف التجربة كان عمر المشاركين من 5 إلى 36 شهرًا عند التسجيل. كان التسجيل في يوم التطعيم الأول. 4800 مشارك (
الجرعة. تم تقديم التحليلات على أساس البروتوكول وعلى مجموعة النية المعدلة للعلاج في الملحق (الصفحات 17-49). كانت مجموعة البروتوكول كما كانت مجموعة البروتوكول المعدلة باستثناء أنه يجب أن يتم تلقي اللقاح الثالث بين 3-6 أسابيع بعد اللقاح الثاني. شملت مجموعة النية المعدلة للعلاج جميع المشاركين بغض النظر عن اللقاح الذي تلقوه، طالما أنهم تلقوا جرعة واحدة على الأقل من لقاح الدراسة في السنة الأولى من الدراسة. في المواقع الموسمية، وصل المتابعة إلى 18 شهرًا (6 أشهر بعد الجرعة المعززة) لجميع المشاركين، وتم تقديم التحليلات في كل من 18 شهرًا ومن 13-18 شهرًا (6 أشهر بعد الجرعة المعززة).
بالنسبة لتحليلات الملاريا السريرية في مجموعات البروتوكول المعدل والبروتوكول، بدأ المتابعة بعد 14 يومًا من التطعيم الثالث وانتهت عند 12 شهرًا من المتابعة، عندما تم إعطاء الجرعة المعززة، أو تاريخ انسحاب الدراسة، أيهما حدث أولاً. بالنسبة لتحليل النية المعدلة للعلاج، بدأت المتابعة بعد 14 يومًا من تلقي آخر تطعيم في السلسلة الأولية وانتهت بنفس المعايير المطبقة على مجموعة البروتوكول المعدل. كانت التحليل الأساسي هو الوقت حتى أول حلقة من الملاريا السريرية وتم تحليله بواسطة تحليل كوكس مع تصنيف حسب موقع الدراسة (موسمي أو قياسي). تم تحليل تحليل ثانوي لمعدل جميع حلقات الملاريا السريرية (المتعددة) بواسطة كوكس.
| R21/Matrix-M (
|
تحكم (
|
الإجمالي (
|
|
| جنس | |||
| ذكر | 1607/3103 (51.8%) | 805/1541 (52.2%) | 2412/4644 (51.9%) |
| أنثى | 1496/3103 (48.2%) | 736/1541 (47.8%) | ٢٢٣٢/٤٦٤٤ (٤٨.١٪) |
| العمر، بالأشهر |
|
|
|
| الوزن، كجم | 9.7 (2.0) | 9.6 (2.1) | 9.7 (2.0) |
| الوزن بالنسبة للعمر* | |||
| طبيعي (WAZ>-2) | 2634/3102 (84.9%) | 1292/1538 (84.0%) | ٣٩٢٦/٤٦٤٠ (٨٤.٦٪) |
| نقص الوزن (WAZ-3 إلى -2) | 413/3102 (13.3%) | 202/1538 (13.1%) | 615/4640 (13.3%) |
| نقص وزن شديد (WAZ<-3) | 55/3102 (1.7%) | 44/1538 (2.9%) | 99/4640 (2.1%) |
| استخدام شبكة السرير في اليوم 70* | |||
| لا يوجد شبكة سرير كافية | 92/3096 (2.9%) | 52/1535 (3.4%) | 144/4631 (3.1%) |
| شبكة سرير كافية | 3006/3096 (97.1%) | 1483/1535 (96.6%) | 4489/4631 (96.9%) |
| عدد جولات الوقاية الكيميائية من الملاريا الموسمية في عام 2021 | |||
| غير مؤهل للوقاية الكيميائية من الملاريا الموسمية | 767/3103 (24.7%) | 373/1541 (24•2%) | 1140/4644 (24.6%) |
| 0 | 68/3103 (2.2%) | 38/1541 (2.5%) | 106/4644 (2.3%) |
| 1 | 430/3103 (13.9%) | 201/1541 (13%) | 631/4644 (13.6%) |
| 2 | 357/3103 (11.5%) | 166/1541 (10.8%) | 523/4644 (11.3%) |
| ٣ | 354/3103 (11.4%) | 214/1541 (13.9%) | 568/4644 (12.2%) |
| 4+ | 1127/3103 (36.3%) | 549/1541 (35.6%) | 1676/4644 (36.1%) |
البيانات هي
الجدول 1: الخصائص الأساسية للمشاركين في مجموعة البروتوكول المعدلة
الانحدار، مع خطأ قياسي قوي لأخذ في الاعتبار الحلقات المتعددة في نفس الطفل. التحليلات المعدلة لعوامل التشويش مثل الجنس (ذكر أو أنثى)، العمر عند التوزيع العشوائي (
تم حساب فعالية اللقاح كواحد ناقص نسبة المخاطر (HR). تم تقديم رسومات كابلان-ماير لوقت حدوث أول حلقة ملاريا ومخططات نيلسون-ألين للخطر التراكمي لجميع حلقات الملاريا. تم تقديم التحليلات مقسمة حسب موقع الدراسة وحسب العمر.
تم تقدير فعالية اللقاح ضد الملاريا الشديدة بنفس الطريقة. تم تحليل العدوى بالملاريا غير العرضية عند 12 شهرًا و18 شهرًا باستخدام نموذج لوغاريتمي ثنائي الحدين، مع تضمين المجموعة العشوائية كمتغير مشترك. تم إجراء هذا التحليل أيضًا مع ضبط العوامل المربكة التي تم وصفها سابقًا. لتقييم ما إذا كانت فعالية اللقاح قد تراجعت على مدار 12 شهرًا ووفقًا للإدارة الموسمية أو القياسية للقاح، تم إجراء تحليل فعالية بعد الحدث على فترات مدتها 3 أشهر في المواقع الموسمية والقياسية.
للحفاظ على التعتيم خلال المتابعة المستمرة، تم إجراء التحليلات بواسطة إحصائيين خارجيين عن فرق التجارب السريرية.
تم إجراء جميع التحليلات الإحصائية باستخدام برنامج Stata الإصدار 17. هذه الدراسة مسجلة فيClinicalTrials.govرقم NCT04704830.
الانحدار، مع خطأ قياسي قوي لأخذ في الاعتبار الحلقات المتعددة في نفس الطفل. التحليلات المعدلة لعوامل التشويش مثل الجنس (ذكر أو أنثى)، العمر عند التوزيع العشوائي (
تم حساب فعالية اللقاح كواحد ناقص نسبة المخاطر (HR). تم تقديم رسومات كابلان-ماير لوقت حدوث أول حلقة ملاريا ومخططات نيلسون-ألين للخطر التراكمي لجميع حلقات الملاريا. تم تقديم التحليلات مقسمة حسب موقع الدراسة وحسب العمر.
تم تقدير فعالية اللقاح ضد الملاريا الشديدة بنفس الطريقة. تم تحليل العدوى بالملاريا غير العرضية عند 12 شهرًا و18 شهرًا باستخدام نموذج لوغاريتمي ثنائي الحدين، مع تضمين المجموعة العشوائية كمتغير مشترك. تم إجراء هذا التحليل أيضًا مع ضبط العوامل المربكة التي تم وصفها سابقًا. لتقييم ما إذا كانت فعالية اللقاح قد تراجعت على مدار 12 شهرًا ووفقًا للإدارة الموسمية أو القياسية للقاح، تم إجراء تحليل فعالية بعد الحدث على فترات مدتها 3 أشهر في المواقع الموسمية والقياسية.
للحفاظ على التعتيم خلال المتابعة المستمرة، تم إجراء التحليلات بواسطة إحصائيين خارجيين عن فرق التجارب السريرية.
تم إجراء جميع التحليلات الإحصائية باستخدام برنامج Stata الإصدار 17. هذه الدراسة مسجلة فيClinicalTrials.govرقم NCT04704830.
دور مصدر التمويل
راجع معهد سيروم في الهند، الممول الرئيسي للدراسة، البيانات من الدراسة والمخطوطة النهائية قبل التقديم، لكن المؤلفين الأكاديميين احتفظوا بالتحكم التحريري. لم يكن للممولين للدراسة أي دور في تصميم الدراسة، جمع البيانات، تحليل البيانات، تفسير البيانات، أو كتابة التقرير.
النتائج
من 14 أبريل 2021 إلى 12 يناير 2022، وافق 5477 طفلًا تتراوح أعمارهم بين 5 و36 شهرًا على الخضوع للفحص، من بينهم تم تخصيص 5139 بشكل عشوائي للقاح التحكم.
في مجموعة البروتوكول المعدلة، عند تقييم الهدف الأساسي في المواقع الموسمية، كان لدى 708 مشاركين حلقة من الملاريا السريرية وفقًا لتعريف الحالة الأساسي، مقارنة بـ 383 مشاركًا في المواقع القياسية. عند مقارنة مجموعة لقاح الملاريا مع مجموعة التحكم، كانت فعالية اللقاح 75% (95% CI 71-79؛
في موقع داند، عند تقييم الفرق في الفعالية بين الذين كانت لديهم فترة تتراوح بين 3-6 أسابيع والذين كانت لديهم فترة تتراوح بين 7-16 أسبوعًا بين الجرعة الثانية والثالثة، لم يكن هناك فرق ذو دلالة إحصائية في فعالية اللقاح.
بدمج جميع المواقع، كان لدى 1091 مشاركًا حلقة من الملاريا السريرية وفقًا لتعريف الحالة الأساسي. كانت هذه الحالات في 464 (
عند النظر في عدة حالات من الملاريا، تم إظهار تقديرات مماثلة لفعالية اللقاح:
لتقييم ما إذا كانت فعالية اللقاح قد تراجعت على مدار 12 شهرًا وما إذا كان هناك فرق وفقًا لإدارة اللقاح الموسمي أو القياسي,
تم إجراء تحليل فعالية بعد الحدث على فترات مدتها 3 أشهر في المواقع الموسمية والمعيارية. انخفضت الفعالية على مدار السنة الأولى، من
تم إجراء تحليل فعالية بعد الحدث على فترات مدتها 3 أشهر في المواقع الموسمية والمعيارية. انخفضت الفعالية على مدار السنة الأولى، من
تستهدف التجارب الميدانية لفعالية لقاح الملاريا عمومًا الأطفال الذين تتراوح أعمارهم بين
عند تقييم الهدف الرئيسي وفقًا للتعريف الثانوي للحالة، الذي شمل حالات الملاريا السريرية مع وجود طفيليات أكثر من 0 طفيلي لكل
تلقى جميع المشاركين جرعة معززة من نفس اللقاح الذي تم إعطاؤه كجزء من سلسلة التطعيمات الأساسية بعد 12 شهرًا من تلقيهم الجرعة الثالثة من اللقاح. عند تقييم الوقت حتى حدوث أول حلقة سريرية للملاريا بعد 18 شهرًا من سلسلة التطعيمات الأساسية، وفقًا للأساسي
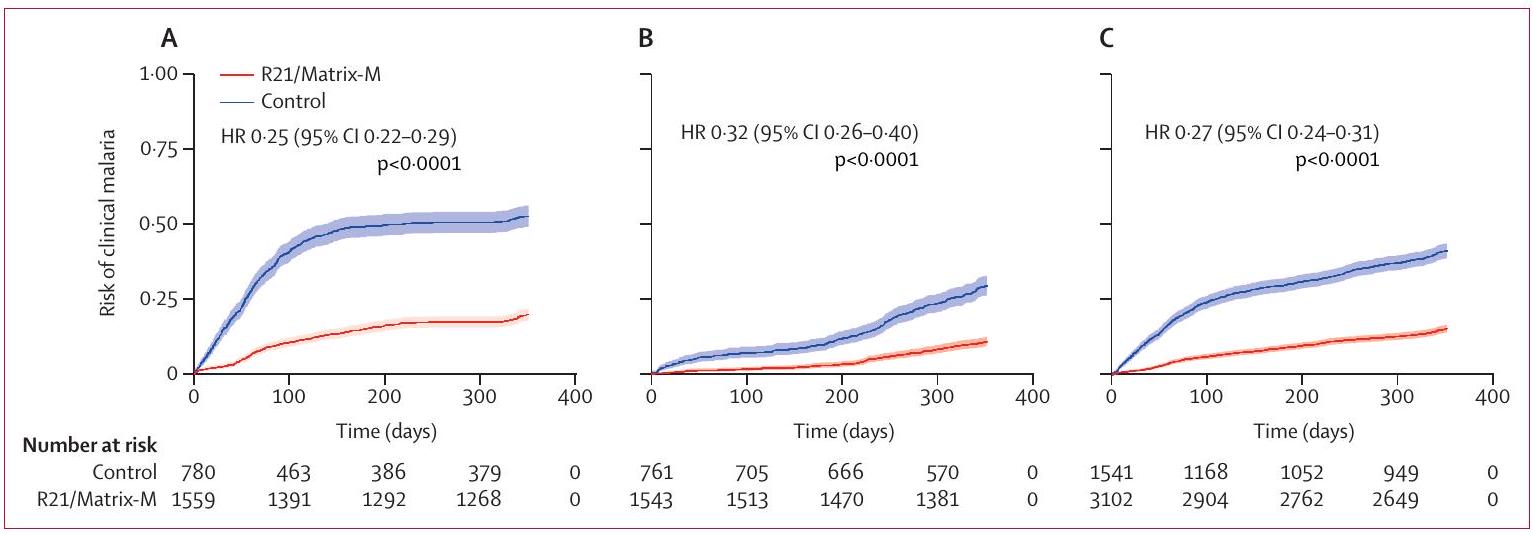
الشكل 2: تقديرات كابلان-ماير للوقت حتى أول حلقة من الملاريا السريرية في السكان المعدلين وفقًا للبروتوكول في المواقع الموسمية (A)، المواقع القياسية (B)، وجميع المواقع (C)
تبدأ البيانات من 14 يومًا بعد التطعيم الثالث في السلسلة الأولية حتى 12 شهرًا. كانت المواقع الموسمية بوجوني ونانورو؛ والمواقع القياسية كانت داندي ومواقع شرق إفريقيا باجامويو وكيلفي.
تبدأ البيانات من 14 يومًا بعد التطعيم الثالث في السلسلة الأولية حتى 12 شهرًا. كانت المواقع الموسمية بوجوني ونانورو؛ والمواقع القياسية كانت داندي ومواقع شرق إفريقيا باجامويو وكيلفي.
مقالات
| عدد المشاركين | المشاركون الذين لديهم 0 حلقة | المشاركون الذين لديهم حلقة واحدة | المشاركون الذين لديهم حلقتان | المشاركون الذين لديهم 3 أو أكثر من الحلقات | معدل (الأحداث/سنوات الطفل) | فعالية اللقاح غير المعدلة (95% فترة الثقة) | قيمة p | فعالية اللقاح المعدلة* (فترة الثقة 95%) | قيمة p | |
| الوقت حتى أول حلقة سريرية للملاريا | ||||||||||
| جميع المواقع | ||||||||||
| تحكم | 1541 | .. | .. | .. | .. | 0.59 (627/1061.2) | 1 (مرجع) | .. | 1 (مرجع) | .. |
| R21/Matrix-M | 3102 | .. | .. | .. | .. | 0.17 (464/2681.4) | 0.73 (0.69-0.76) | <0.0001 | 0.73 (0.70-0.76) | <0.0001 |
| المواقع الموسمية | ||||||||||
| تحكم | 780 | .. | .. | .. | .. | 0.95 (407/428.4) | 1 (مرجع) | .. | 1 (مرجع) | .. |
| R21/Matrix-M | 1559 | .. | .. | .. | .. | 0.24 (301/1275.4) | 0.75 (0.71-0.78) | <0.0001 | 0.75 (0.71-0.79) | <0.0001 |
| المواقع القياسية | ||||||||||
| تحكم | 761 | .. | .. | .. | .. | 0.35 (220/632.8) | 1 (مرجع) | .. | 1 (مرجع) | .. |
| R21/Matrix-M | 1543 | .. | .. | .” | .. | 0.12 (163/1406.0) | 0.68 (0.60-0.74) | <0.0001 | 0.68 (0.61-0.74) | <0.0001 |
| موقع نانورو | ||||||||||
| تحكم | 395 | .. | .. | .. | .. | 1.70 (275/161.8) | 1 (مرجع) | .. | 1 (مرجع) | .. |
| R21/Matrix-M | ٧٩٠ | .. | .. | .. | .. | 0.40 (239/598.9) | 0.73 (0.68-0.77) | <0.0001 | 0.73 (0.68-0.78) | <0.0001 |
| موقع بوجوني | ||||||||||
| تحكم | 385 | .. | .. | .. | .. |
|
1 (مرجع) | .. | 1 (مرجع) | .. |
| R21/Matrix-M | 769 | .. | .. | .. | .. | 0.09 (62/676.5) | 0.80 (0.73-0.85) | <0.0001 | 0.80 (0.73-0.85) | <0.0001 |
| موقع داند | ||||||||||
| تحكم | ٣٨٨ | .. | .. | .. | .. | 0.44 (139/313.9) | 1 (مرجع) | .. | 1 (مرجع) | .. |
| R21/Matrix-M | ٧٧٦ | .. | .. | .. | .. | 0.12 (84/717.9) | 0.74 (0.66-0.80) | <0.0001 | 0.74 (0.66-0.80) | <0.0001 |
| موقع باجامويو | ||||||||||
| تحكم | ١٧٧ | .. | .. | .. | .. | 0.24 (36/150.4) | 1 (مرجع) | .. | 1 (مرجع) | .. |
| R21/Matrix-M | 375 | .. | .. | .. | .. | 0.12 (40/335.9) | 0.52 (0.24-0.69) | 0.0016 | 0.53 (0.25-0.70) | 0.0013 |
| موقع كيلفي | ||||||||||
| تحكم | 196 | .. | .. | .. | .. | 0.27 (45/168.5) | 1 (مرجع) | .. | 1 (مرجع) | .. |
| R21/Matrix-M | ٣٩٢ | .. | .. | .. | .. | 0.11 (39/352.2) | 0.59 (0.37-0.73) | <0.0001 | 0.60 (0.39-0.74) | <0.0001 |
| المواقع الشرقية الأفريقية (باجامويو وكيلفي) | ||||||||||
| تحكم | 373 | .. | .. | .. | .. | 0.25 (81/318.9) | 1 (مرجع) | .. | 1 (مرجع) | .. |
| R21/Matrix-M | 767 | .. | .. | .. | .. | 0.11 (79/688.1) | 0.56 (0.40-0.68) | <0.0001 | 0.57 (0.41-0.68) | <0.0001 |
| الوقت لجميع حالات الملاريا السريرية | ||||||||||
| جميع المواقع | ||||||||||
| تحكم | 1541 | 914 (59.3%) | 341 (22.1%) | 139 (9.0%) | 147 (9.5%) | 0.81 (1174/1455•1) | 1 | .. | 1 | .. |
| R21/Matrix-M | ٣١٠٢ | 2639 (85.1) | 335 (10.8%) | 88 (2.8%) | 41 (1.3%) | 0.22 (652/2922.4) | 0.72 (0.69-0.75) | <0.0001 | 0.72 (0.69-0.75) | <0.0001 |
| المواقع الموسمية | ||||||||||
| تحكم | 780 | 373 (47.8%) | 184 (23.6%) | 101 (12.9%) | ١٢٢ (١٥.٦٪) | 1.16 (852/731.5) | 1 | .. | 1 | .. |
| R21/Matrix-M | 1559 | 1258 (80.7%) | 211 (13.5%) | 60 (3.8%) | 30 (1.9%) | 0.30 (435/1460.0) | 0.74 (0.71-0.78) | <0.0001 | 0.75 (0.71-0.78) | <0.0001 |
| المواقع القياسية | ||||||||||
| تحكم | 761 | 541 (71.1%) | 157 (20.6%) | ٣٨ (٥.٠٪) | 25 (3.3%) | 0.45 (322/723.5) | 1 | .. | 1 | .. |
| R21/Matrix-M | 1543 | 1381 (89.4%) | 124 (8.0%) | 28 (1.8%) | 11 (0.7%) | 0.15 (217/1462.4) | 0.67 (0.59-0.73) | <0.0001 | 0.67 (0.59-0.73) | <0.0001 |
| موقع نانورو | ||||||||||
| تحكم | 395 | 120 (30.4%) | 100 (25.3%) | 73 (18.5%) | 102 (25.8%) | 1.73 (642/371.3) | 1 | .. | 1 | .. |
| R21/Matrix-M | 790 | ٥٥١ (٦٩.٧٪) | 161 (20.4%) | 49 (6.2%) | ٢٩ (٣.٧٪) | 0.48 (360/744.3) | 0.72 (0.67-0.76) | <0.0001 | 0.72 (0.67-0.76) | <0.0001 |
| موقع بوجوني | ||||||||||
| تحكم | 385 | 253 (65.7%) | 84 (21.8%) | 28 (7.3%) | 20 (5.2%) | 0.58 (210/360.2) | 1 | .. | 1 | .. |
| R21/Matrix-M | 769 | 707 (91.9%) | 50 (6.5%) | 11 (1.4%) | 1 (0.1%) | 0.10 (75/715.7) | 0.82 (0.76-0.87) | <0.0001 | 0.82 (0.75-0.86) | <0.0001 |
| موقع داند | ||||||||||
| تحكم | 388 | 249 (64.2%) | 102 (26.3%) | 24 (6.2%) | 13 (3.4%) |
|
1 | .. | 1 | .. |
| R21/Matrix-M | ٧٧٦ | 693 (89.2%) | 71 (9.1%) | 9 (1.2%) | 4 (0.5%) | 0.14 (103/742.0) | 0.74 (0.65-0.80) | <0.0001 | 0.73 (0.65-0.80) | <0.0001 |
| موقع باجامويو | ||||||||||
| تحكم | ١٧٧ | 141 (79.7%) | 25 (14.1%) | 4 (2.3%) | 7 (4.0%) | 0.35 (58/167.3) | 1 | .. | 1 | .. |
| R21/Matrix-M | 375 | 335 (89.3%) | 27 (7.2%) | 11 (2.9%) | 2 (0.5%) | 0.16 (56/354.5) | 0.54 (0.26-0.72) | 0.0016 | 0.54 (0.26-0.71) | 0.0014 |
| (الجدول 2 يستمر في الصفحة التالية) | ||||||||||
| عدد المشاركين | المشاركون الذين لديهم 0 حلقة | المشاركون الذين لديهم حلقة واحدة | المشاركون الذين لديهم حلقتان | المشاركون الذين لديهم 3 أو أكثر من الحلقات | معدل (الأحداث/سنوات الطفل) | فعالية اللقاح غير المعدلة (95% فترة الثقة) | قيمة p | فعالية اللقاح المعدلة* (فترة الثقة 95%) | قيمة p | |
| (متابعة من الصفحة السابقة) | ||||||||||
| موقع كيلفي | ||||||||||
| تحكم | 196 | 151 (77.0%) | 30 (15.3%) | 10 (5.1%) | 5 (2.6%) | 0.37 (69/185.0) | 1 | .. | 1 | .. |
| R21/Matrix-M | ٣٩٢ | 353 (90.1%) | ٢٦ (٦.٦٪) | 8 (2.0%) | 5 (1.3%) | 0.16 (58/365.8) | 0.57 (0.32-0.73) | 0.0003 | 0.58 (0.34-0.73) | 0.0002 |
| المواقع في شرق إفريقيا (باجامويو وكيلفي) | ||||||||||
| تحكم | 373 | 292 (78.3%) | 55 (14.7%) | 14 (3.8%) | 12 (3.2%) |
|
1 | .. | 1 | .. |
| R21/Matrix-M | 767 | 688 (89.7%) | 53 (6.9%) | 19 (2.5%) | 7 (0.9%) |
|
0.56 (0.39-0.68) | <0.0001 | 0.56 (0.39-0.68) | <0.0001 |
كان التعريف الأساسي للحالة هو وجود درجة حرارة إبطية
الجدول 2: الوقت حتى حدوث أول حلقة ملاريا وجميع حلقات الملاريا السريرية وفقًا للتعريف الأساسي للحالة من 14 يومًا بعد التطعيم الثالث إلى 12 شهرًا في السكان المعدلين حسب البروتوكول.
| التحكم (الأحداث/سنوات الطفولة) | R21/Matrix-M (الأحداث/ سنوات الطفل) | فعالية اللقاح (95% فترة الثقة) | قيمة p | فعالية اللقاح المعدلة حسب العمر (95% فترة الثقة) | قيمة p | |
| المواقع الموسمية | ||||||
| 1-3 أشهر |
|
0.47 (181/388.9) | 0.80 (0.76-0.84) | <0.0001 | 0.80 (0.76-0.84) | <0.0001 |
| 4-6 أشهر |
|
|
0.74 (0.67-0.80) | <0.0001 | 0.74 (0.67-0.80) | <0.0001 |
| 7-9 أشهر | 0.35 (68/192•6) |
|
0.45 (0.21-0.62) | 0.0012 | 0.45 (0.21-0.61) | 0.0014 |
| 10-12 شهر |
|
|
0.67 (0.55-0.76) | <0.0001 | 0.67 (0.55-0.76) | <0.0001 |
| المواقع القياسية | ||||||
| 1-3 أشهر |
|
0.06 (24/384.4) | 0.79 (0.64-0.87) | <0.0001 | 0.79 (0.64-0.87) | <0.0001 |
| 4-6 أشهر |
|
0.06 (23/382.8) | 0.68 (0.44-0.82) | 0.0001 | 0.68 (0.44-0.82) | 0.0001 |
| 7-9 أشهر |
|
|
0.64 (0.50-0.74) | <0.0001 | 0.64 (0.51-0.74) | <0.0001 |
| 10-12 شهر |
|
|
0.63 (0.50-0.73) | <0.0001 | 0.63 (0.50-0.73) | <0.0001 |
| لم يحدث فرق كبير في معدل التغير في فعالية اللقاح على مدى 12 شهرًا بين المواقع الموسمية والمواقع القياسية.
|
||||||
| الجدول 3: معدل الحدوث لكل سنة طفل معرضة للخطر وفعالية اللقاح لجميع حالات الملاريا السريرية وفقًا للتعريف الأساسي للحالة بعد التطعيم بثلاث جرعات خلال فترات الدراسة التي تمتد لثلاثة أشهر في السكان المعدلين وفقًا للبروتوكول. | ||||||
تعريف الحالة، كانت فعالية اللقاح 74% (95% فترة الثقة 70-77؛
في عمر 12 شهرًا، في مجموعة البروتوكول المعدلة، كان هناك فقط 12 حالة من الملاريا الشديدة (خمسة حالات في المواقع الموسمية وسبع حالات في المواقع القياسية) وفقًا لتعريف الحالة الأساسي، مما أدى إلى عدم كفاية القوة لتقييم فعالية اللقاح ضد الملاريا الشديدة. كانت فعالية اللقاح ضد الملاريا الشديدة
في عمر 12 شهرًا، في مجموعة البروتوكول المعدلة، كان هناك فقط 12 حالة من الملاريا الشديدة (خمسة حالات في المواقع الموسمية وسبع حالات في المواقع القياسية) وفقًا لتعريف الحالة الأساسي، مما أدى إلى عدم كفاية القوة لتقييم فعالية اللقاح ضد الملاريا الشديدة. كانت فعالية اللقاح ضد الملاريا الشديدة
أظهرت أفلام الدم العرضية بعد 12 شهرًا من السلسلة الأولية وجود طفيليات دموية بدون أعراض كانت أعلى بشكل ملحوظ في مجموعة التحكم، حيث كان هناك 73 (5.1%) من 1436 مشاركًا لديهم طفيليات دموية بدون حمى، مقارنةً بـ
لقاح R21/Matrix-M، عند إعطائه كالسلسلة الأساسية مع لقاح معزز، أظهر عددًا أكبر بكثير من الأحداث السلبية المحلية والنظامية المطلوبة خلال 7 أيام من التطعيم مقارنةً بلقاح التحكم.
حدث شائع من الآثار الجانبية النظامية (754 [46.7%] من 1615 مشاركًا في مجموعة R21/Matrix-M و201 [25.1%] من 802 مشارك في مجموعة التحكم الذين عانوا من حدث واحد على الأقل) في كلا المجموعتين (الملحق الصفحات 50-51). كان عدد الآثار الجانبية غير المرغوب فيها متقاربًا بين مجموعتي اللقاح، وكذلك وفقًا لتوزيع الجنس والعمر (الملحق الصفحة 52). كانت هناك آثار جانبية أقل بعد التطعيم المعزز.
تم الإبلاغ عن 141 حدثًا ضارًا خطيرًا في 129 مشاركًا، حيث تم تقييم ستة من هذه الأحداث على أنها مرتبطة باللقاح بشكل محتمل أو محتمل أو مؤكد (الملحق ص 53). كانت هذه الأحداث الستة جميعها نوبات حمى تحدث خلال يومين من التطعيم. حدثت أربع من هذه الأحداث خلال السلسلة الأولية من التطعيمات وحدثت اثنتان منها بعد التطعيم المعزز. كانت خمس من هذه النوبات في مجموعة R21/Matrix-M وواحدة في مجموعة التحكم، جميعها خلال 7 أيام من التطعيم.
لقاح R21/Matrix-M، عند إعطائه كالسلسلة الأساسية مع لقاح معزز، أظهر عددًا أكبر بكثير من الأحداث السلبية المحلية والنظامية المطلوبة خلال 7 أيام من التطعيم مقارنةً بلقاح التحكم.
حدث شائع من الآثار الجانبية النظامية (754 [46.7%] من 1615 مشاركًا في مجموعة R21/Matrix-M و201 [25.1%] من 802 مشارك في مجموعة التحكم الذين عانوا من حدث واحد على الأقل) في كلا المجموعتين (الملحق الصفحات 50-51). كان عدد الآثار الجانبية غير المرغوب فيها متقاربًا بين مجموعتي اللقاح، وكذلك وفقًا لتوزيع الجنس والعمر (الملحق الصفحة 52). كانت هناك آثار جانبية أقل بعد التطعيم المعزز.
تم الإبلاغ عن 141 حدثًا ضارًا خطيرًا في 129 مشاركًا، حيث تم تقييم ستة من هذه الأحداث على أنها مرتبطة باللقاح بشكل محتمل أو محتمل أو مؤكد (الملحق ص 53). كانت هذه الأحداث الستة جميعها نوبات حمى تحدث خلال يومين من التطعيم. حدثت أربع من هذه الأحداث خلال السلسلة الأولية من التطعيمات وحدثت اثنتان منها بعد التطعيم المعزز. كانت خمس من هذه النوبات في مجموعة R21/Matrix-M وواحدة في مجموعة التحكم، جميعها خلال 7 أيام من التطعيم.
| المواقع الموسمية | المواقع القياسية | إجمالي المواقع | ||||
| R21/Matrix-M | تحكم | R21/Matrix-M | تحكم | R21/Matrix-M | تحكم | |
| فئة العمر من 5 إلى 17 شهرًا | ||||||
| إجمالي السكان | ٧٨٨ | ٣٩٩ | 722 | ٣٧٢ | 1510 | ٧٧١ |
| على الأقل حدث سلبي خطير واحد | 28 (3.6%) | 11 (2.8%) | ٢٩ (٤.٠٪) | 12 (3.2%) | 57 (3.8%) | 23 (3.0%) |
| على الأقل حدث سلبي خطير واحد باستثناء الملاريا | 25 (3.2%) | 10 (2.5%) | 27 (3.7%) | 11 (3.0%) | 52 (3.4%) | 21 (2.7%) |
| فئة العمر من 18 إلى 36 شهرًا | ||||||
| إجمالي السكان | 826 | ٤١٢ | 916 | ٤٤٣ | 1742 | 855 |
| على الأقل حدث سلبي خطير واحد | 11 (1.3%) | 8 (1.9%) | 20 (2.2%) | 10 (2.3%) | 31 (1.8%) | 18 (2.1%) |
| على الأقل حدث سلبي خطير واحد باستثناء الملاريا | 9 (1.1%) | 6 (1.5%) | 16 (1.7%) | 7 (1.6%) | 25 (1.4%) | 13 (1.5%) |
الجدول 4: الأحداث السلبية الخطيرة في مجموعة النية المعدلة للعلاج (أي مشارك تلقى جرعة)
تم الإبلاغ عن 20 حدثًا ضارًا ذا اهتمام خاص خلال فترة الدراسة حتى الآن. كانت هذه الأحداث 16 نوبة صرع حراري، وحالتين من التهاب السحايا، وحالتين من الملاريا الدماغية. كانت الحالتان من التهاب السحايا في مجموعة R21/Matrix-M وكان هناك حالة واحدة من الملاريا الدماغية في كل مجموعة. تم اعتبار ستة من هذه الأحداث الضارة الـ 20 (جميعها نوبات صرع حراري) مرتبطة على الأرجح باللقاحات المستخدمة في الدراسة (الملحق ص 53).
تم قياس IgG المحدد لـ NANP في 1456 مشاركًا بعد 28 يومًا من الجرعة الثالثة من لقاح R21/Matrix-M. لوحظت مستويات أعلى من الأجسام المضادة في المواقع الموسمية مقارنة بالمواقع القياسية.
نقاش
في هذه التجربة السريرية من المرحلة الثالثة للقاح الملاريا R21/Matrix-M، تُظهر التحليلات الأولية فعالية اللقاح ضد الملاريا السريرية بـ
عند تحليل الفعالية في فترات مدتها 3 أشهر على مدار الأشهر الـ 12 الأولى، كان هناك انخفاض في الفعالية، لكنها ظلت فوق
تختلف هذه التجربة من المرحلة الثالثة عن جميع التجارب السابقة للقاحات الملاريا من خلال تقييم
تختلف هذه التجربة من المرحلة الثالثة عن جميع التجارب السابقة للقاحات الملاريا من خلال تقييم
تتوافق نتائجنا مع البيانات من تجربة المرحلة 2ب التي اكتملت مؤخرًا في موقع نانورو الموسمي.
حيث كانت فعالية اللقاح
أظهرت نتائج فحص الدم العرضي لدينا بعد 12 شهرًا و18 شهرًا انخفاضًا كبيرًا في معدلات الطفيليات لدى المشاركين في مجموعة R21/Matrix-M مقارنةً بأولئك في مجموعة التحكم. تشير هذه النتيجة إلى أن لقاح R21/Matrix-M قد لا يقلل فقط بشكل كبير من عدد حالات الملاريا السريرية، ولكن يمكن أن يساهم أيضًا في البرامج التي تهدف إلى تقليل انتقال الملاريا عند استخدامه مع تدخلات أخرى، خاصة إذا تم نشره عبر نطاق عمر أوسع.
كما هو متوقع مع لقاحات الطفولة، كانت الألم والحمى أكثر الأحداث السلبية شيوعًا، ولكن بشكل عام، أبلغ عدد قليل من المشاركين عن هذه الأحداث بعد كل جرعة من اللقاح. كانت معظم الأحداث السلبية خفيفة إلى متوسطة في الشدة. لم يتم ملاحظة أي اتجاهات مقلقة مع الأحداث السلبية غير المطلوبة أو الأحداث السلبية الخطيرة، مع عدم وجود عدم توازن كبير في الوفيات وفقًا للجنس أو مجموعة اللقاح. تم ملاحظة خمس نوبات تشنج حراري بعد 11000 جرعة من R21/Matrix-M مع واحدة في مجموعة التحكم، مما يعطي معدل نوبة إضافية واحدة لكل 3700 جرعة من R21/Matrix-M تم إعطاؤها، ولكن لم يتم ملاحظة فرق ذو دلالة إحصائية مقارنةً بلقاح داء الكلب.
كانت هذه الدراسة لها بعض القيود. لم يكن التجربة مصممة لتقييم فعالية اللقاح ضد الملاريا السريرية في المواقع الفردية ولا الفعالية ضد الوفيات أو الملاريا الشديدة عبر جميع المواقع. ومع ذلك، فإن تقدير النقطة لفعالية اللقاح ضد الملاريا الشديدة مشابه لذلك ضد الملاريا السريرية في السنة الأولى. كان هناك أيضًا فعالية أعلى قليلاً في المواقع الموسمية مقارنةً بالمواقع القياسية. قد ترتبط هذه النتيجة جزئيًا بتوقيت الحلقات المختلفة في هذه المواقع: في المواقع الموسمية،
في هذه التجربة من المرحلة 3، تم متابعة المشاركين لمدة 18 شهرًا في المواقع الموسمية ولا تزال التجربة جارية. مع لقاحات الملاريا، هناك عدم يقين
حول متانة الحماية وستكون البيانات الإضافية مفيدة لتوضيح هذه الشكوك. تشير المعدلات المنخفضة لانخفاض عناوين الأجسام المضادة والفعالية المحفوظة جيدًا على مدار السنة الثانية والثالثة في تجربة المرحلة 2 ب إلى أن الفعالية قد تُحافظ بشكل جيد مع R21/Matrix-M.
بالإضافة إلى الفعالية العالية، فإن ميزة أخرى مهمة لـ R21/Matrix-M هي أن القدرة الأولية على التوريد يجب أن تكون في حدود 100-200 مليون جرعة سنويًا، بتكلفة تقل عن 4 دولارات أمريكية لكل جرعة للوكالات الصحية العامة. يجب أن يسمح ذلك في النهاية لمعظم السكان المستهدفين من الأطفال الأفارقة الصغار بالوصول إلى هذا اللقاح. كان هناك طلب كبير على لقاحات الملاريا من أكثر من 20 دولة في العام الماضي. وقد وافقت غانا ونيجيريا وبوركينا فاسو بالفعل على استخدام R21/Matrix-M في النطاق العمري الموسع من 5-36 شهرًا، وقد حصل اللقاح مؤخرًا على توصية سياسة من منظمة الصحة العالمية وتأهيل مسبق.
بشكل عام، يمكن نشر R21/Matrix-M على نطاق واسع ويكون إضافة مهمة جدًا للمساعدة في منع الملاريا. على الرغم من أن التقدم في تقليل عبء هذه المرض الطفيلي قد توقف على مدى السنوات الخمس الماضية، فإن هذا اللقاح منخفض التكلفة، الذي سيكون متاحًا قريبًا على نطاق يزيد عن 100 مليون جرعة سنويًا، لديه القدرة على إحياء التقدم في مكافحة الملاريا.
حيث كانت فعالية اللقاح
أظهرت نتائج فحص الدم العرضي لدينا بعد 12 شهرًا و18 شهرًا انخفاضًا كبيرًا في معدلات الطفيليات لدى المشاركين في مجموعة R21/Matrix-M مقارنةً بأولئك في مجموعة التحكم. تشير هذه النتيجة إلى أن لقاح R21/Matrix-M قد لا يقلل فقط بشكل كبير من عدد حالات الملاريا السريرية، ولكن يمكن أن يساهم أيضًا في البرامج التي تهدف إلى تقليل انتقال الملاريا عند استخدامه مع تدخلات أخرى، خاصة إذا تم نشره عبر نطاق عمر أوسع.
كما هو متوقع مع لقاحات الطفولة، كانت الألم والحمى أكثر الأحداث السلبية شيوعًا، ولكن بشكل عام، أبلغ عدد قليل من المشاركين عن هذه الأحداث بعد كل جرعة من اللقاح. كانت معظم الأحداث السلبية خفيفة إلى متوسطة في الشدة. لم يتم ملاحظة أي اتجاهات مقلقة مع الأحداث السلبية غير المطلوبة أو الأحداث السلبية الخطيرة، مع عدم وجود عدم توازن كبير في الوفيات وفقًا للجنس أو مجموعة اللقاح. تم ملاحظة خمس نوبات تشنج حراري بعد 11000 جرعة من R21/Matrix-M مع واحدة في مجموعة التحكم، مما يعطي معدل نوبة إضافية واحدة لكل 3700 جرعة من R21/Matrix-M تم إعطاؤها، ولكن لم يتم ملاحظة فرق ذو دلالة إحصائية مقارنةً بلقاح داء الكلب.
كانت هذه الدراسة لها بعض القيود. لم يكن التجربة مصممة لتقييم فعالية اللقاح ضد الملاريا السريرية في المواقع الفردية ولا الفعالية ضد الوفيات أو الملاريا الشديدة عبر جميع المواقع. ومع ذلك، فإن تقدير النقطة لفعالية اللقاح ضد الملاريا الشديدة مشابه لذلك ضد الملاريا السريرية في السنة الأولى. كان هناك أيضًا فعالية أعلى قليلاً في المواقع الموسمية مقارنةً بالمواقع القياسية. قد ترتبط هذه النتيجة جزئيًا بتوقيت الحلقات المختلفة في هذه المواقع: في المواقع الموسمية،
في هذه التجربة من المرحلة 3، تم متابعة المشاركين لمدة 18 شهرًا في المواقع الموسمية ولا تزال التجربة جارية. مع لقاحات الملاريا، هناك عدم يقين
حول متانة الحماية وستكون البيانات الإضافية مفيدة لتوضيح هذه الشكوك. تشير المعدلات المنخفضة لانخفاض عناوين الأجسام المضادة والفعالية المحفوظة جيدًا على مدار السنة الثانية والثالثة في تجربة المرحلة 2 ب إلى أن الفعالية قد تُحافظ بشكل جيد مع R21/Matrix-M.
بالإضافة إلى الفعالية العالية، فإن ميزة أخرى مهمة لـ R21/Matrix-M هي أن القدرة الأولية على التوريد يجب أن تكون في حدود 100-200 مليون جرعة سنويًا، بتكلفة تقل عن 4 دولارات أمريكية لكل جرعة للوكالات الصحية العامة. يجب أن يسمح ذلك في النهاية لمعظم السكان المستهدفين من الأطفال الأفارقة الصغار بالوصول إلى هذا اللقاح. كان هناك طلب كبير على لقاحات الملاريا من أكثر من 20 دولة في العام الماضي. وقد وافقت غانا ونيجيريا وبوركينا فاسو بالفعل على استخدام R21/Matrix-M في النطاق العمري الموسع من 5-36 شهرًا، وقد حصل اللقاح مؤخرًا على توصية سياسة من منظمة الصحة العالمية وتأهيل مسبق.
بشكل عام، يمكن نشر R21/Matrix-M على نطاق واسع ويكون إضافة مهمة جدًا للمساعدة في منع الملاريا. على الرغم من أن التقدم في تقليل عبء هذه المرض الطفيلي قد توقف على مدى السنوات الخمس الماضية، فإن هذا اللقاح منخفض التكلفة، الذي سيكون متاحًا قريبًا على نطاق يزيد عن 100 مليون جرعة سنويًا، لديه القدرة على إحياء التقدم في مكافحة الملاريا.
المساهمون
قام AVSH وMSD بتصميم التجربة وAVSH هو الباحث الرئيسي. ساهم AVSH وMSD وAD وMH وAO وJ-BO وHT وHMN وBMG وDC وKJE في بروتوكول وتصميم الدراسة. كان AD وMH وAO وJ-BO وHT هم الباحثون الرئيسيون في مواقع الدراسة. قاد KJE الدراسات المخبرية للاستجابات المناعية. قام EB وJB بإجراء التحليل الإحصائي. كان SB وPSK وHR وUS وSG مسؤولين عن تصنيع اللقاح والمساعدات. قاد MSD وAVSH وEB وJB إعداد التقرير. قدم AL الدعم والإرشادات التنظيمية. ساهم AD وMH وHMN وMC وYDC وDI وDS وSO وAMS وAO وJ-BO وHT وPB وMSD وAVSH وKJE وFRL وLS وRR وSW في تنفيذ الدراسة. قام EB وJB وMSD وAVSH بالوصول إلى البيانات والتحقق منها. كان لدى جميع المؤلفين وصول كامل إلى جميع البيانات في الدراسة وكان لديهم المسؤولية النهائية عن القرار بتقديمها للنشر.
إعلان المصالح
تم ذكر AVSH وKJE كالمخترعين المشاركين في طلبات براءات الاختراع المتعلقة بـ R21 وقد يستفيدان من أي تدفق إيرادات. كان KJE موظفًا في جامعة أكسفورد (أكسفورد، المملكة المتحدة) في وقت هذا العمل وهو الآن موظف في غلاكسو سميث كلاين. يمتلك KJE أسهم مقيدة في مجموعة شركات غلاكسو سميث كلاين. US وSB وPSK وHR وSG هم موظفون في معهد مصل الهند، المطور المشارك للقاح R21/Matrix-M. جميع المؤلفين الآخرين يعلنون عدم وجود مصالح متنافسة.
مشاركة البيانات
تم توفير بروتوكول الدراسة في الملحق. ستتوفر بيانات المشاركين المجهولة عند الانتهاء من التجربة، بناءً على الطلبات الموجهة إلى المؤلف المقابل. سيتم مراجعة المقترحات والموافقة عليها من قبل الراعي والباحثين والمتعاونين بناءً على الجدارة العلمية. بعد الموافقة على الاقتراح، يمكن مشاركة البيانات من خلال منصة آمنة عبر الإنترنت بعد توقيع اتفاقية وصول البيانات. ستتوفر جميع البيانات لمدة لا تقل عن 5 سنوات من نهاية التجربة.
شكر وتقدير
نود أن نشكر جميع المشاركين في التجربة ومقدمي الرعاية لهم، والسلطات المحلية في منطقة الصحة، وجميع المستشفيات المعنية،
المقالات
وجميع موظفي البحث في معهد إيفاكارا الصحي، باجامويو؛ معهد العلوم والتقنيات، داند؛ معهد الأبحاث الطبية الكينية مركز الأبحاث الطبية الجغرافية – الساحل، كيلفي؛ مركز أبحاث وتدريب الملاريا، باماكو؛ وحدة البحث السريري في نانورو، نانورو؛ وDiagnoSearch Life Sciences، ثان، الهند لإدارة البيانات واليقظة الدوائية. يود المؤلفون أن يشكروا باراج ناغاركار وبراديب سينغ من معهد مصل الهند على الدعم التنظيمي؛ ونوفافاكس، وبشكل خاص لو فريس، غريغ غلين، وجيني رايمر، على دعمهم لهذا المشروع من خلال توفير مساعد Matrix-M لاستخدامنا. نحن ممتنون لأعضاء مجلس مراقبة البيانات والسلامة (بلايز جينتون، سامبا سو، بريان أنغوس، فرانسيسكا ليتل، كريم مانجي، وكوادوو أنساه كورام) وللجنة الاستشارية المستقلة للتشخيص (جين أتشان، توماس جيان، ومحمد أفولابي) وللمراقبين المحليين للسلامة في كل موقع (عبد العزيز ديكيتي، ويليام كابوري، سينكاى-لاجوم أيميه كيسو، ناهيا سليم مسعود، ونيماء متوري). تم تمويل التجربة بشكل رئيسي من قبل معهد مصل الهند مع تمويل إضافي لمواقع التجارب من Open Philanthropy وتلقيت أيضًا تمويلًا من مؤسسة ويلكوم ومركز أبحاث الصحة الوطنية في أكسفورد.
References
1 WHO. World malaria report 2022. Geneva: World Health Organization, 2022.
2 RTS,S Clinical Trials Partnership. Efficacy and safety of RTS,S/AS01 malaria vaccine with or without a booster dose in infants and children in Africa: final results of a phase 3, individually randomised, controlled trial. Lancet 2015; 386: 31-45.
3 WHO. Full evidence report on the RTS.S.AS01 malaria vaccine. 2021. https://cdn.who.int/media/docs/default-source/ immunization/mvip/full-evidence-report-on-the-rtss-as01-malaria-vaccine-for-sage-mpag-(sept2021).pdf (accessed Dec 22, 2023).
2 RTS,S Clinical Trials Partnership. Efficacy and safety of RTS,S/AS01 malaria vaccine with or without a booster dose in infants and children in Africa: final results of a phase 3, individually randomised, controlled trial. Lancet 2015; 386: 31-45.
3 WHO. Full evidence report on the RTS.S.AS01 malaria vaccine. 2021. https://cdn.who.int/media/docs/default-source/ immunization/mvip/full-evidence-report-on-the-rtss-as01-malaria-vaccine-for-sage-mpag-(sept2021).pdf (accessed Dec 22, 2023).
4 WHO. First malaria vaccine supply allocations May 2023. 2023. https://cdn.who.int/media/docs/default-source/immunization/ mvip/first_malaria_vaccine_allocation_explained_may2023. pdf?sfvrsn=248c4624_3 (accessed Dec 22, 2023).
5 WHO. Framework for the allocation of limited malaria vaccine supply. 2022. https://www.who.int/publications/m/item/ framework-for-allocation-of-limited-malaria-vaccine-supply (accessed Dec 22, 2023).
6 Collins KA, Brod F, Snaith R, et al. Ultra-low dose immunization and multi-component vaccination strategies enhance protection against malaria in mice. Sci Rep 2021; 11: 10792.
7 Collins KA, Snaith R, Cottingham MG, Gilbert SC, Hill AVS. Enhancing protective immunity to malaria with a highly immunogenic virus-like particle vaccine. Sci Rep 2017; 7: 46621.
8 Venkatraman N, Tiono AB, Bowyer G, et al. Phase I assessments of first-in-human administration of a novel malaria anti-sporozoite vaccine candidate, R21 in matrix-M adjuvant, in UK and Burkinabe volunteers. medRxiv 2019; published online Oct 18. https://www. medrxiv.org/content/10.1101/19009282v1.full (preprint).
9 Venkatraman NBG, Edwards N, et al. High level efficacy in humans of a next-generation Plasmodium falciparum anti-sporozoite vaccine: R21 in Matrix-M (TM) adjuvant. AmJ TropMed Hyg 2017; 97: 594.
10 Datoo MS, Natama HM, Somé A, et al. Efficacy and immunogenicity of R21/Matrix-M vaccine against clinical malaria after 2 years’ follow-up in children in Burkina Faso: a phase 1/2b randomised controlled trial. Lancet Infect Dis 2022; 22: 1728-36.
11 Datoo MS, Natama MH, Somé A, et al. Efficacy of a low-dose candidate malaria vaccine, R21 in adjuvant Matrix-M, with seasonal administration to children in Burkina Faso: a randomised controlled trial. Lancet 2021; 397: 1809-18.
5 WHO. Framework for the allocation of limited malaria vaccine supply. 2022. https://www.who.int/publications/m/item/ framework-for-allocation-of-limited-malaria-vaccine-supply (accessed Dec 22, 2023).
6 Collins KA, Brod F, Snaith R, et al. Ultra-low dose immunization and multi-component vaccination strategies enhance protection against malaria in mice. Sci Rep 2021; 11: 10792.
7 Collins KA, Snaith R, Cottingham MG, Gilbert SC, Hill AVS. Enhancing protective immunity to malaria with a highly immunogenic virus-like particle vaccine. Sci Rep 2017; 7: 46621.
8 Venkatraman N, Tiono AB, Bowyer G, et al. Phase I assessments of first-in-human administration of a novel malaria anti-sporozoite vaccine candidate, R21 in matrix-M adjuvant, in UK and Burkinabe volunteers. medRxiv 2019; published online Oct 18. https://www. medrxiv.org/content/10.1101/19009282v1.full (preprint).
9 Venkatraman NBG, Edwards N, et al. High level efficacy in humans of a next-generation Plasmodium falciparum anti-sporozoite vaccine: R21 in Matrix-M (TM) adjuvant. AmJ TropMed Hyg 2017; 97: 594.
10 Datoo MS, Natama HM, Somé A, et al. Efficacy and immunogenicity of R21/Matrix-M vaccine against clinical malaria after 2 years’ follow-up in children in Burkina Faso: a phase 1/2b randomised controlled trial. Lancet Infect Dis 2022; 22: 1728-36.
11 Datoo MS, Natama MH, Somé A, et al. Efficacy of a low-dose candidate malaria vaccine, R21 in adjuvant Matrix-M, with seasonal administration to children in Burkina Faso: a randomised controlled trial. Lancet 2021; 397: 1809-18.
Journal: The Lancet, Volume: 403, Issue: 10426
DOI: https://doi.org/10.1016/s0140-6736(23)02511-4
PMID: https://pubmed.ncbi.nlm.nih.gov/38310910
Publication Date: 2024-02-01
DOI: https://doi.org/10.1016/s0140-6736(23)02511-4
PMID: https://pubmed.ncbi.nlm.nih.gov/38310910
Publication Date: 2024-02-01
Safety and efficacy of malaria vaccine candidate R21/Matrix-M in African children: a multicentre, doubleblind, randomised, phase 3 trial
Abstract
Summary Background Recently, we found that a new malaria vaccine, R21/Matrix-M, had over
Methods We did a double-blind, randomised, phase 3 trial of the R21/Matrix-M malaria vaccine across five sites in four African countries with differing malaria transmission intensities and seasonality. Children (aged 5-36 months) were enrolled and randomly assigned (2:1) to receive
Findings From April 26, 2021, to Jan 12, 2022, 5477 children consented to be screened, of whom 1705 were randomly assigned to control vaccine and 3434 to R21/Matrix-M; 4878 participants received the first dose of vaccine. 3103 participants in the R21/Matrix-M group and 1541 participants in the control group were included in the modified per-protocol analysis ( 2412 [
Interpretation R21/Matrix-M was well tolerated and offered high efficacy against clinical malaria in African children. This low-cost, high-efficacy vaccine is already licensed by several African countries, and recently received a WHO policy recommendation and prequalification, offering large-scale supply to help reduce the great burden of malaria in subSaharan Africa.
Funding The Serum Institute of India, the Wellcome Trust, the UK National Institute for Health Research Oxford Biomedical Research Centre, and Open Philanthropy.
Copyright © 2024 The Author(s). Published by Elsevier Ltd. This is an Open Access article under the CC BY-NC license.
Lancet 2024; 403: 533-44
Published Online
February 1, 2024
https://doi.org/10.1016/ S0140-6736(23)02511-4
See Comment page 504
*Contributed equally as joint second authors
§Members of the R21/Matrix-M Phase 3 Trial Group are listed at the end of the Article
Published Online
February 1, 2024
https://doi.org/10.1016/ S0140-6736(23)02511-4
See Comment page 504
*Contributed equally as joint second authors
§Members of the R21/Matrix-M Phase 3 Trial Group are listed at the end of the Article
Centre for Clinical Vaccinology and Tropical Medicine, The Jenner Institute, University of Oxford and the NIHR Oxford Biomedical Research Centre, Oxford, UK (M S Datoo DPhil, F Ramos Lopez MSc, S Weston MSc, A Lawrie PhD, R Roberts MSc, Prof A V S Hill FRS); Clinical Research Unit of BougouniOuelessebougou, Malaria Research and Training Centre, University of Sciences, Techniques, and Technologies of Bamako, Bamako, Mali (A Dicko PhD, D Issiaka PhD); Unité de Recherche Clinique de Nanoro, Institut de Recherche en Sciences de la Santé, Nanoro, Burkina Faso (H Tinto PhD, H M Natama PhD, D Salou PhD, A M Some MD); Institut des Sciences et Techniques (INSTech), Bobo-Dioulasso, Burkina Faso (J-B Ouédraogo MD, Y D Compaore MD); Kenya Medical Research Institute Centre for Geographical Medicine Research-Coast (KEMRI-CGMRC), Kilifi, Kenya (M Hamaluba MD, S Omenda MBChB, P Bejon PhD); Centre for Tropical Medicine & Global Health, Nuffield
Articles
Research in context
Evidence before this study
RTS,S/AS01 (Mosquirix; GlaxoSmithKline) is the first malaria vaccine recommended by WHO for use in children aged 5-17 months in moderate-to-high transmission settings. Deployment is planned to start in 2024 after the Malaria Vaccine Implementation Programme supported a suitable safety profile in three African countries. We searched PubMed from database inception to Sept 20,2023, for published articles using the search terms “malaria vaccine” AND “clinical trial” AND “phase III” AND “efficacy”. No language restrictions were applied. In a large phase 3 trial, RTS,S/AS01 malaria vaccine had a vaccine efficacy of 56% (95% CI 51-60) in children aged 5-17 months over 12 months after administration of the initial three doses. At 12 months after a booster dose, administered 18 months after the primary series, vaccine efficacy over 30 months was
Added value of this study
This phase 3 licensure trial shows high vaccine efficacy over 1 year with a three-dose regimen of R21/Matrix-M in 4644 children aged 5-36 months with both seasonal
(75% [95% CI 71-79]) and age-based perennial (standard;
(75% [95% CI 71-79]) and age-based perennial (standard;
Implications of all the available evidence
The findings of this trial support the findings of a smaller, singlecountry, phase 2b trial, which showed vaccine efficacy of more than
Introduction
In recent years, progress in reducing malaria has stalled, with more than 220 million cases and 620000 deaths annually.
In the phase 3 trial of RTS,S/AS01,
In the phase 3 trial of RTS,S/AS01,
R21 is a virus-like particle comprising the central repeats of Asn-Ala-Asn-Pro (NANP) and C-terminal
sequence of circumsporozoite protein fused to the hepatitis B surface antigen (HBsAg). R21 differs from RTS,S as all, rather than
sequence of circumsporozoite protein fused to the hepatitis B surface antigen (HBsAg). R21 differs from RTS,S as all, rather than
Methods
Study design and participants
This double-blind, randomised, phase 3 trial was conducted at two seasonal sites (l’Unité de Recherche Clinique de Nanoro, Nanoro, Burkina Faso and the Malaria Research and Training Centre, Bamako and Bougouni, Mali) and three perennial standard (ie, where malaria transmission occurs throughout the year and where an age-based vaccine administration schedule was used) sites (l’Institut des Sciences et Techniques, Dande, Burkina Faso; the Kenya Medical Research Institute Centre for Geographical Medicine Research-Coastt, Kilifi, Kenya; and the Ifakara Health Institute, Bagamoyo, Tanzania). These centres were chosen to ensure that vaccine assessment took place in areas of high and low, and both perennial and seasonal, malaria transmission across sub-Saharan Africa.
The study planned to enrol 4800 participants across all sites, with 1200 per site, except for Kilifi and Bagamoyo with 600 per site, which were combined for adequate statistical power as East Africa in the main analysis of site-specific efficacy. The primary series of vaccinations consisted of three vaccinations, 4 weeks apart, followed by a booster vaccination approximately 12 months after the third vaccination. At the seasonal sites, the primary series of vaccinations were administered before the malaria season, with the booster vaccination administered 12 months later and before the subsequent malaria season. At the standard sites, the primary series was administered at any time of year, with the booster vaccination administered 12 months later.
Safety, immunogenicity, and vaccine efficacy are being assessed over 24 months, with the primary efficacy endpoint assessed at 12 months after the primary series of vaccinations. This involves collection of solicited adverse events across 7 days after vaccination and blood sampling at prespecified timepoints. Data were collected on indoor residual spraying, adequate insecticide-treated net use (categorised by the presence or absence of holes), and the number of rounds and doses of seasonal malaria chemoprevention taken by the participant during the malaria season in areas where this is recommended policy.
Lists of eligible children were identified from local surveillance databases and community sensitisation. Caregivers who expressed interest were invited to a screening visit. Before screening, parents or guardians of participants provided written or thumb-printed consent, which was verbally re-checked at every study visit. The following inclusion criteria were used: participants aged 5-36 months at the time of their first vaccination, signed and witnessed informed consent was obtained from the parent or guardian, the investigator believed that the parents or guardians can and will comply with the requirements of the protocol if the child is enrolled in the study, and the participant remained in the study area for the duration of the trial. Exclusion criteria included substantial comorbidities and receipt of another malaria
vaccine. Full details of the eligibility criteria can be found in the protocol (appendix pp 87-174). There was a minimum 2-week interval between administration of the study vaccine and any Expanded Programme on Immunisation vaccine. The trial was approved by all the local ethics committees and regulatory authorities, as well as the ethics committees at the University of Oxford (Oxford, UK) and The London School of Hygiene & Tropical Medicine (London, UK), with supportive coordination by the African Vaccine Regulatory Forum. Further details are in the appendix (p 13).
The study planned to enrol 4800 participants across all sites, with 1200 per site, except for Kilifi and Bagamoyo with 600 per site, which were combined for adequate statistical power as East Africa in the main analysis of site-specific efficacy. The primary series of vaccinations consisted of three vaccinations, 4 weeks apart, followed by a booster vaccination approximately 12 months after the third vaccination. At the seasonal sites, the primary series of vaccinations were administered before the malaria season, with the booster vaccination administered 12 months later and before the subsequent malaria season. At the standard sites, the primary series was administered at any time of year, with the booster vaccination administered 12 months later.
Safety, immunogenicity, and vaccine efficacy are being assessed over 24 months, with the primary efficacy endpoint assessed at 12 months after the primary series of vaccinations. This involves collection of solicited adverse events across 7 days after vaccination and blood sampling at prespecified timepoints. Data were collected on indoor residual spraying, adequate insecticide-treated net use (categorised by the presence or absence of holes), and the number of rounds and doses of seasonal malaria chemoprevention taken by the participant during the malaria season in areas where this is recommended policy.
Lists of eligible children were identified from local surveillance databases and community sensitisation. Caregivers who expressed interest were invited to a screening visit. Before screening, parents or guardians of participants provided written or thumb-printed consent, which was verbally re-checked at every study visit. The following inclusion criteria were used: participants aged 5-36 months at the time of their first vaccination, signed and witnessed informed consent was obtained from the parent or guardian, the investigator believed that the parents or guardians can and will comply with the requirements of the protocol if the child is enrolled in the study, and the participant remained in the study area for the duration of the trial. Exclusion criteria included substantial comorbidities and receipt of another malaria
vaccine. Full details of the eligibility criteria can be found in the protocol (appendix pp 87-174). There was a minimum 2-week interval between administration of the study vaccine and any Expanded Programme on Immunisation vaccine. The trial was approved by all the local ethics committees and regulatory authorities, as well as the ethics committees at the University of Oxford (Oxford, UK) and The London School of Hygiene & Tropical Medicine (London, UK), with supportive coordination by the African Vaccine Regulatory Forum. Further details are in the appendix (p 13).
Randomisation and masking
Children aged 5-36 months who fulfilled the eligibility criteria were randomly assigned (
Randomisation was done using an electronic interactive web response system (DiagnoSearch Life, Thane, India). Randomisation was stratified by trial site (seasonal or standard), and potential confounders, including age (5-12 months, 13-24 months, or 25-36 months) and sex (male or female), using block randomisation with variable block sizes.
Malaria and control vaccines were prepared by the pharmacists using the same type of syringe, the same volume, and they were the same colour and consistency. The contents of the syringe were masked with an opaque label. The trial was double-blinded: participants, their families, all investigators, the laboratory teams, and the local study team were all masked to treatment.
Randomisation was done using an electronic interactive web response system (DiagnoSearch Life, Thane, India). Randomisation was stratified by trial site (seasonal or standard), and potential confounders, including age (5-12 months, 13-24 months, or 25-36 months) and sex (male or female), using block randomisation with variable block sizes.
Malaria and control vaccines were prepared by the pharmacists using the same type of syringe, the same volume, and they were the same colour and consistency. The contents of the syringe were masked with an opaque label. The trial was double-blinded: participants, their families, all investigators, the laboratory teams, and the local study team were all masked to treatment.
Procedures
Participants received R21 (Serum Institute of India) as a two-vial formulation: R21 was mixed immediately before administration with the saponin-based vaccine adjuvant Matrix-M (Novavax AB, Uppsala, Sweden). A dose of
All vaccines were administered as a 0.5 mL dose intramuscularly into the thigh or deltoid muscle.
On the day of vaccination, if any participant had a fever of 37.5 degrees C or higher, vaccination was deferred and they were assessed clinically and appropriately managed. If a blood film was indicated and was positive for Plasmodium spp, the participant was treated for malaria in accordance with local guidelines before having a study vaccination.
Serious adverse events and adverse events of special interest are being collected for the duration of the trial in all participants. All unsolicited adverse events were collected across 28 days after each vaccination in all participants. Clinical judgement by masked site study clinicians was used to assess causality of adverse events and any association with vaccine.
All vaccines were administered as a 0.5 mL dose intramuscularly into the thigh or deltoid muscle.
On the day of vaccination, if any participant had a fever of 37.5 degrees C or higher, vaccination was deferred and they were assessed clinically and appropriately managed. If a blood film was indicated and was positive for Plasmodium spp, the participant was treated for malaria in accordance with local guidelines before having a study vaccination.
Serious adverse events and adverse events of special interest are being collected for the duration of the trial in all participants. All unsolicited adverse events were collected across 28 days after each vaccination in all participants. Clinical judgement by masked site study clinicians was used to assess causality of adverse events and any association with vaccine.
Additional safety data were collected in the first
Intensity of symptoms was evaluated using standardised methods (appendix pp 160-161) and all adverse events were monitored until resolution.
After the third vaccination, participants were visited by field workers approximately every 8 weeks until 12 months after the third vaccination. During these visits, the participants’ caregivers were asked whether any medical event that might be a serious adverse event had occurred since the last visit and this information was recorded. If clinical assessment was required, the participant was referred to the trial site clinic or the nearest community health facility. A detailed schedule of visits is in the protocol (appendix pp 136-137).
Interim analyses were performed to facilitate data safety monitoring board reviews after completion of the primary series of three vaccinations. Further reviews were held after administration of the booster vaccinations. The data safety monitoring board were also provided with reports of serious adverse events when they occurred as well as monthly line listings.
Caregivers of participants were advised to attend their local community health facility for clinical review if their child had any illness or a temperature (
Intensity of symptoms was evaluated using standardised methods (appendix pp 160-161) and all adverse events were monitored until resolution.
After the third vaccination, participants were visited by field workers approximately every 8 weeks until 12 months after the third vaccination. During these visits, the participants’ caregivers were asked whether any medical event that might be a serious adverse event had occurred since the last visit and this information was recorded. If clinical assessment was required, the participant was referred to the trial site clinic or the nearest community health facility. A detailed schedule of visits is in the protocol (appendix pp 136-137).
Interim analyses were performed to facilitate data safety monitoring board reviews after completion of the primary series of three vaccinations. Further reviews were held after administration of the booster vaccinations. The data safety monitoring board were also provided with reports of serious adverse events when they occurred as well as monthly line listings.
Caregivers of participants were advised to attend their local community health facility for clinical review if their child had any illness or a temperature (
IgG antibodies against a polypeptide of six repeats of the central NANP region sequence were measured in the first
Outcomes
The primary objective assessed protective efficacy of R21/ Matrix-M from 14 days after third vaccination to 12 months after completion of the primary series at seasonal and standard sites separately as co-primary endpoints.
Safety and reactogenicity of R21/Matrix-M were also assessed according to either vaccination regimen (seasonal or standard) in the month after each vaccination.
Secondary objectives were efficacy of R21/Matrix-M at all sites combined, after booster vaccinations, against multiple malaria episodes, against severe malaria, incident severe anaemia, malaria-related hospital admission, and asymptomatic
Humoral immunogenicity of R21/Matrix-M was evaluated by measuring antibody titres to the central NANP repeat.
Further details of all outcomes can be found in the protocol and statistical analysis plan (appendix pp 59-85).
Safety and reactogenicity of R21/Matrix-M were also assessed according to either vaccination regimen (seasonal or standard) in the month after each vaccination.
Secondary objectives were efficacy of R21/Matrix-M at all sites combined, after booster vaccinations, against multiple malaria episodes, against severe malaria, incident severe anaemia, malaria-related hospital admission, and asymptomatic
Humoral immunogenicity of R21/Matrix-M was evaluated by measuring antibody titres to the central NANP repeat.
Further details of all outcomes can be found in the protocol and statistical analysis plan (appendix pp 59-85).
Statistical analysis
The total sample size was determined by the objective of providing safety data for at least 3000 participants in the malaria vaccine (R21/Matrix-M) group: 3200 were enrolled alongside 1600 control participants. Half of these participants were recruited in the two seasonal sites and half in the three standard sites.
At the seasonal sites, the expected incidence rate was 0.58 cases per child per year among the 800 control participants which, with 12 months’ follow-up, would give more than
Primary analyses of vaccine efficacy were based on 12 months of follow-up, and a modified per-protocol population, which included all participants who received three doses of the correct vaccine with an interval between the first and second doses of 3-6 weeks, and the interval between the second and third doses of
At the seasonal sites, the expected incidence rate was 0.58 cases per child per year among the 800 control participants which, with 12 months’ follow-up, would give more than
Primary analyses of vaccine efficacy were based on 12 months of follow-up, and a modified per-protocol population, which included all participants who received three doses of the correct vaccine with an interval between the first and second doses of 3-6 weeks, and the interval between the second and third doses of

Figure 1: Trial profile Participants were aged 5-36 months at enrolment. Enrolment was the day of first vaccination. 4800 participants (
dose. Analyses on a per-protocol and a modified intention-to-treat population are presented in the appendix (pp 17-49). The per-protocol population were as the modified per-protocol population except the third vaccine must have been received between 3-6 weeks after the second vaccine. The modified intention-to-treat population included all participants regardless of which vaccine they received, as long as they received at least one dose of a study vaccine in the first year of the study. At seasonal sites, follow-up reached 18 months ( 6 months after booster) for all participants, and analyses at both 18 months and from 13-18 months ( 6 months after booster) are presented.
For analyses of clinical malaria in the modified perprotocol and per-protocol populations, follow-up started 14 days after the third vaccination and finished at 12 months’ follow-up, when the booster was given, or the date of study withdrawal, whichever occurred first. For the modified intention-to-treat analysis, follow-up started 14 days after the final primary series vaccination was received and finished with the same criteria applied to the modified per-protocol population. The primary analysis was time to first episode of clinical malaria and was analysed by Cox regression stratified by study site (seasonal or standard). A secondary analysis of rate of all (multiple) clinical malaria episodes was analysed by Cox
| R21/Matrix-M (
|
Control (
|
Total (
|
|
| Sex | |||
| Male | 1607/3103 (51.8%) | 805/1541 (52.2%) | 2412/4644 (51.9%) |
| Female | 1496/3103 (48.2%) | 736/1541 (47.8%) | 2232/4644 (48.1%) |
| Age, months |
|
|
|
| Weight, kg | 9.7 (2.0) | 9.6 (2.1) | 9.7 (2.0) |
| Weight for age* | |||
| Normal (WAZ>-2) | 2634/3102 (84.9%) | 1292/1538 (84.0%) | 3926/4640 (84.6%) |
| Underweight (WAZ-3 to -2) | 413/3102 (13.3%) | 202/1538 (13.1%) | 615/4640 (13.3%) |
| Severely underweight (WAZ<-3) | 55/3102 (1.7%) | 44/1538 (2.9%) | 99/4640 (2•1%) |
| Use of bed net at day 70* | |||
| No adequate bed net | 92/3096 (2.9%) | 52/1535 (3.4%) | 144/4631 (3.1%) |
| Adequate bed net | 3006/3096 (97.1%) | 1483/1535 (96.6%) | 4489/4631 (96.9%) |
| Number of rounds of seasonal malaria chemoprevention in 2021 | |||
| Not eligible for seasonal malaria chemoprevention | 767/3103 (24.7%) | 373/1541 (24•2%) | 1140/4644 (24.6%) |
| 0 | 68/3103 (2.2%) | 38/1541 (2.5%) | 106/4644 (2.3%) |
| 1 | 430/3103 (13.9%) | 201/1541 (13%) | 631/4644 (13.6%) |
| 2 | 357/3103 (11.5%) | 166/1541 (10.8%) | 523/4644 (11.3%) |
| 3 | 354/3103 (11.4%) | 214/1541 (13.9%) | 568/4644 (12.2%) |
| 4+ | 1127/3103 (36•3%) | 549/1541 (35.6%) | 1676/4644 (36•1%) |
Data are
Table 1: Baseline characteristics of participants in the modified per-protocol population
regression, with a robust standard error to account for multiple episodes in the same child. Analyses adjusted for confounding factors of sex (male or female), age at randomisation (
Vaccine efficacy was calculated as 1 minus the hazard ratio (HR). Kaplan-Meier graphs of time to first malaria episode and Nelson-Aalen plots of cumulative hazard of all malaria episodes were presented. Analyses stratified by study site and by age are presented.
Vaccine efficacy against severe malaria was estimated in the same way. Asymptomatic malaria infection at 12 months and 18 months were analysed using a log binomial model, including the randomised group as a covariate. This analysis was also done adjusting for the confounding factors previously described. To assess whether vaccine efficacy waned over the course of 12 months and according to seasonal or standard vaccine administration, a post-hoc efficacy analysis in 3-month periods at seasonal and standard sites was performed.
To maintain masking for the ongoing follow-up, analyses were performed by statisticians external to the clinical trial teams.
All statistical analyses were performed using Stata version 17. This study is registered on ClinicalTrials.gov, NCT04704830.
regression, with a robust standard error to account for multiple episodes in the same child. Analyses adjusted for confounding factors of sex (male or female), age at randomisation (
Vaccine efficacy was calculated as 1 minus the hazard ratio (HR). Kaplan-Meier graphs of time to first malaria episode and Nelson-Aalen plots of cumulative hazard of all malaria episodes were presented. Analyses stratified by study site and by age are presented.
Vaccine efficacy against severe malaria was estimated in the same way. Asymptomatic malaria infection at 12 months and 18 months were analysed using a log binomial model, including the randomised group as a covariate. This analysis was also done adjusting for the confounding factors previously described. To assess whether vaccine efficacy waned over the course of 12 months and according to seasonal or standard vaccine administration, a post-hoc efficacy analysis in 3-month periods at seasonal and standard sites was performed.
To maintain masking for the ongoing follow-up, analyses were performed by statisticians external to the clinical trial teams.
All statistical analyses were performed using Stata version 17. This study is registered on ClinicalTrials.gov, NCT04704830.
Role of the funding source
Serum Institute of India, the major study funder, reviewed the data from the study and the final manuscript before submission, but the academic authors retained editorial control. The funders of the study had no role in the study design, data collection, data analysis, data interpretation, or writing of the report.
Results
From April 14, 2021, to Jan 12, 2022, 5477 children aged 5-36 months consented to be screened, of whom 5139 were randomly assigned to control vaccine (
In the modified per-protocol population, when evaluating the primary objective at the seasonal sites, 708 participants had an episode of clinical malaria according to the primary case definition, compared with 383 participants at the standard sites. Comparing the malaria vaccine group with the control group, vaccine efficacy was 75% (95% CI 71-79;
At the Dande site, when evaluating the difference in efficacy between those who had a 3-6 week interval and those who had a 7-16 week interval between the second and third dose, there was no significant difference in vaccine efficacy (
Combining all the sites, 1091 participants had an episode of clinical malaria according to the primary case definition. These cases were in 464 (
When considering multiple episodes of malaria, similar estimates of vaccine efficacy were shown:
To assess whether vaccine efficacy waned over the course of 12 months and whether there was a difference according to seasonal or standard vaccine administration,
a post-hoc efficacy analysis in 3-month periods at seasonal and standard sites was done. Efficacy declined over the first year, from
a post-hoc efficacy analysis in 3-month periods at seasonal and standard sites was done. Efficacy declined over the first year, from
The target age group for malaria vaccine field efficacy trials has generally been children aged
When assessing the primary objective according to the secondary case definition, which included clinical malaria cases with a parasitaemia of more than 0 parasites per
All participants received a booster dose of the same vaccine administered as their primary series at 12 months after their third vaccine. When evaluating the time to first clinical malaria episode at 18 months after the primary series of vaccinations, according to the primary

Figure 2: Kaplan-Meier estimates of the time to first episode of clinical malaria in the modified per-protocol population at seasonal sites (A), standard sites (B), and all sites (C)
Data begin from 14 days after the third vaccination in the primary series to 12 months. Seasonal sites were Bougouni and Nanoro; and standard sites were Dande and the East Africa sites Bagamoyo and Kilifi.
Data begin from 14 days after the third vaccination in the primary series to 12 months. Seasonal sites were Bougouni and Nanoro; and standard sites were Dande and the East Africa sites Bagamoyo and Kilifi.
Articles
| Number of participants | Participants with 0 episodes | Participants with 1 episode | Participants with 2 episodes | Participants with 3+ episodes | Rate (events/childyears) | Unadjusted vaccine efficacy (95% CI) | p value | Adjusted* vaccine efficacy (95% CI) | p value | |
| Time to first clinical malaria episode | ||||||||||
| All sites | ||||||||||
| Control | 1541 | .. | .. | .. | .. | 0.59 (627/1061.2) | 1 (ref) | .. | 1 (ref) | .. |
| R21/Matrix-M | 3102 | .. | .. | .. | .. | 0.17 (464/2681.4) | 0.73 (0.69-0.76) | <0.0001 | 0.73 (0.70-0.76) | <0.0001 |
| Seasonal sites | ||||||||||
| Control | 780 | .. | .. | .. | .. | 0.95 (407/428.4) | 1 (ref) | .. | 1 (ref) | .. |
| R21/Matrix-M | 1559 | .. | .. | .. | .. | 0.24 (301/1275.4) | 0.75 (0.71-0.78) | <0.0001 | 0.75 (0.71-0.79) | <0.0001 |
| Standard sites | ||||||||||
| Control | 761 | .. | .. | .. | .. | 0.35 (220/632.8) | 1 (ref) | .. | 1 (ref) | .. |
| R21/Matrix-M | 1543 | .. | .. | .” | .. | 0.12 (163/1406.0) | 0.68 (0.60-0.74) | <0.0001 | 0.68 (0.61-0.74) | <0.0001 |
| Nanoro site | ||||||||||
| Control | 395 | .. | .. | .. | .. | 1.70 (275/161.8) | 1 (ref) | .. | 1 (ref) | .. |
| R21/Matrix-M | 790 | .. | .. | .. | .. | 0.40 (239/598.9) | 0.73 (0.68-0.77) | <0.0001 | 0.73 (0.68-0.78) | <0.0001 |
| Bougouni site | ||||||||||
| Control | 385 | .. | .. | .. | .. |
|
1 (ref) | .. | 1 (ref) | .. |
| R21/Matrix-M | 769 | .. | .. | .. | .. | 0.09 (62/676.5) | 0.80 (0.73-0.85) | <0.0001 | 0.80 (0.73-0.85) | <0.0001 |
| Dande site | ||||||||||
| Control | 388 | .. | .. | .. | .. | 0.44 (139/313.9) | 1 (ref) | .. | 1 (ref) | .. |
| R21/Matrix-M | 776 | .. | .. | .. | .. | 0.12 (84/717.9) | 0.74 (0.66-0.80) | <0.0001 | 0.74 (0.66-0.80) | <0.0001 |
| Bagamoyo site | ||||||||||
| Control | 177 | .. | .. | .. | .. | 0.24 (36/150.4) | 1 (ref) | .. | 1 (ref) | .. |
| R21/Matrix-M | 375 | .. | .. | .. | .. | 0.12 (40/335.9) | 0.52 (0.24-0.69) | 0.0016 | 0.53 (0.25-0.70) | 0.0013 |
| Kilifi site | ||||||||||
| Control | 196 | .. | .. | .. | .. | 0.27 (45/168.5) | 1 (ref) | .. | 1 (ref) | .. |
| R21/Matrix-M | 392 | .. | .. | .. | .. | 0.11 (39/352.2) | 0.59 (0.37-0.73) | <0.0001 | 0.60 (0.39-0.74) | <0.0001 |
| Eastern African sites (Bagamoyo and Kilifi) | ||||||||||
| Control | 373 | .. | .. | .. | .. | 0.25 (81/318.9) | 1 (ref) | .. | 1 (ref) | .. |
| R21/Matrix-M | 767 | .. | .. | .. | .. | 0.11 (79/688.1) | 0.56 (0.40-0.68) | <0.0001 | 0.57 (0.41-0.68) | <0.0001 |
| Time to all clinical malaria episodes | ||||||||||
| All sites | ||||||||||
| Control | 1541 | 914 (59.3%) | 341 (22.1%) | 139 (9.0%) | 147 (9.5%) | 0.81 (1174/1455•1) | 1 | .. | 1 | .. |
| R21/Matrix-M | 3102 | 2639 (85.1) | 335 (10.8%) | 88 (2.8%) | 41 (1.3%) | 0.22 (652/2922.4) | 0.72 (0.69-0.75) | <0.0001 | 0.72 (0.69-0.75) | <0.0001 |
| Seasonal sites | ||||||||||
| Control | 780 | 373 (47.8%) | 184 (23.6%) | 101 (12.9%) | 122 (15.6%) | 1.16 (852/731.5) | 1 | .. | 1 | .. |
| R21/Matrix-M | 1559 | 1258 (80.7%) | 211 (13.5%) | 60 (3.8%) | 30 (1.9%) | 0.30 (435/1460.0) | 0.74 (0.71-0.78) | <0.0001 | 0.75 (0.71-0.78) | <0.0001 |
| Standard sites | ||||||||||
| Control | 761 | 541 (71.1%) | 157 (20.6%) | 38 (5.0%) | 25 (3.3%) | 0.45 (322/723.5) | 1 | .. | 1 | .. |
| R21/Matrix-M | 1543 | 1381 (89.4%) | 124 (8.0%) | 28 (1.8%) | 11 (0.7%) | 0.15 (217/1462.4) | 0.67 (0.59-0.73) | <0.0001 | 0.67 (0.59-0.73) | <0.0001 |
| Nanoro site | ||||||||||
| Control | 395 | 120 (30.4%) | 100 (25.3%) | 73 (18.5%) | 102 (25.8%) | 1.73 (642/371.3) | 1 | .. | 1 | .. |
| R21/Matrix-M | 790 | 551 (69.7%) | 161 (20.4%) | 49 (6.2%) | 29 (3.7%) | 0.48 (360/744.3) | 0.72 (0.67-0.76) | <0.0001 | 0.72 (0.67-0.76) | <0.0001 |
| Bougouni site | ||||||||||
| Control | 385 | 253 (65.7%) | 84 (21.8%) | 28 (7.3%) | 20 (5.2%) | 0.58 (210/360.2) | 1 | .. | 1 | .. |
| R21/Matrix-M | 769 | 707 (91.9%) | 50 (6.5%) | 11 (1.4%) | 1 (0.1%) | 0.10 (75/715.7) | 0.82 (0.76-0.87) | <0.0001 | 0.82 (0.75-0.86) | <0.0001 |
| Dande site | ||||||||||
| Control | 388 | 249 (64.2%) | 102 (26.3%) | 24 (6.2%) | 13 (3.4%) |
|
1 | .. | 1 | .. |
| R21/Matrix-M | 776 | 693 (89.2%) | 71 (9.1%) | 9 (1.2%) | 4 (0.5%) | 0.14 (103/742.0) | 0.74 (0.65-0.80) | <0.0001 | 0.73 (0.65-0.80) | <0.0001 |
| Bagamoyo site | ||||||||||
| Control | 177 | 141 (79.7%) | 25 (14.1%) | 4 (2.3%) | 7 (4.0%) | 0.35 (58/167.3) | 1 | .. | 1 | .. |
| R21/Matrix-M | 375 | 335 (89.3%) | 27 (7.2%) | 11 (2.9%) | 2 (0.5%) | 0.16 (56/354.5) | 0.54 (0.26-0.72) | 0.0016 | 0.54 (0.26-0.71) | 0.0014 |
| (Table 2 continues on next page) | ||||||||||
| Number of participants | Participants with 0 episodes | Participants with 1 episode | Participants with 2 episodes | Participants with 3+ episodes | Rate (events/childyears) | Unadjusted vaccine efficacy (95% CI) | p value | Adjusted* vaccine efficacy (95% CI) | p value | |
| (Continued from previous page) | ||||||||||
| Kilifi site | ||||||||||
| Control | 196 | 151 (77.0%) | 30 (15.3%) | 10 (5.1%) | 5 (2.6%) | 0.37 (69/185.0) | 1 | .. | 1 | .. |
| R21/Matrix-M | 392 | 353 (90.1%) | 26 (6.6%) | 8 (2.0%) | 5 (1.3%) | 0.16 (58/365.8) | 0.57 (0.32-0.73) | 0.0003 | 0.58 (0.34-0.73) | 0.0002 |
| East African sites (Bagamoyo and Kilifi) | ||||||||||
| Control | 373 | 292 (78.3%) | 55 (14.7%) | 14 (3.8%) | 12 (3.2%) |
|
1 | .. | 1 | .. |
| R21/Matrix-M | 767 | 688 (89.7%) | 53 (6.9%) | 19 (2.5%) | 7 (0.9%) |
|
0.56 (0.39-0.68) | <0.0001 | 0.56 (0.39-0.68) | <0.0001 |
The primary case definition was the presence of an axillary temperature
Table 2: Time to first malaria episode and all clinical malaria episodes according to the primary case definition from 14 days after the third vaccination to 12 months in the modified per-protocol population
| Control (events/childyears) | R21/Matrix-M (events/ child-years) | Vaccine efficacy (95% CI) | p value | Age-adjusted vaccine efficacy (95% CI) | p value | |
| Seasonal sites | ||||||
| 1-3 months |
|
0.47 (181/388.9) | 0.80 (0.76-0.84) | <0.0001 | 0.80 (0.76-0.84) | <0.0001 |
| 4-6 months |
|
|
0.74 (0.67-0.80) | <0.0001 | 0.74 (0.67-0.80) | <0.0001 |
| 7-9 months | 0.35 (68/192•6) |
|
0.45 (0.21-0.62) | 0.0012 | 0.45 (0.21-0.61) | 0.0014 |
| 10-12 months |
|
|
0.67 (0.55-0.76) | <0.0001 | 0.67 (0.55-0.76) | <0.0001 |
| Standard sites | ||||||
| 1-3 months |
|
0.06 (24/384.4) | 0.79 (0.64-0.87) | <0.0001 | 0.79 (0.64-0.87) | <0.0001 |
| 4-6 months |
|
0.06 (23/382.8) | 0.68 (0.44-0.82) | 0.0001 | 0.68 (0.44-0.82) | 0.0001 |
| 7-9 months |
|
|
0.64 (0.50-0.74) | <0.0001 | 0.64 (0.51-0.74) | <0.0001 |
| 10-12 months |
|
|
0.63 (0.50-0.73) | <0.0001 | 0.63 (0.50-0.73) | <0.0001 |
| No significant difference in rate of change in vaccine efficacy over 12 months occurred between seasonal and standard sites (
|
||||||
| Table 3: Incidence per child-years at risk and vaccine efficacy of all episodes of clinical malaria according to the primary case definition after vaccination with three doses by 3-month study periods in the modified per-protocol population | ||||||
case definition, vaccine efficacy was 74% (95% CI 70-77;
At 12 months, in the modified per-protocol population, there had been only 12 episodes of severe malaria (five cases at the seasonal sites and seven cases at the standard sites) according to the primary case definition, resulting in insufficient power to assess vaccine efficacy against severe malaria. Vaccine efficacy against severe malaria was
At 12 months, in the modified per-protocol population, there had been only 12 episodes of severe malaria (five cases at the seasonal sites and seven cases at the standard sites) according to the primary case definition, resulting in insufficient power to assess vaccine efficacy against severe malaria. Vaccine efficacy against severe malaria was
Cross-sectional blood films at 12 months after the primary series showed asymptomatic parasitaemia that was significantly higher in the control group, with 73 (5.1%) of 1436 participants having parasitaemia without fever, compared with
The R21/Matrix-M vaccine, when given as the primary series with a booster vaccination, showed a significantly higher number of local and systemic solicited adverse events within 7 days of vaccinations compared with the control vaccine (
common systemic adverse event (754 [46.7%] of 1615 participants in the R21/Matrix-M group and 201 [25.1%] of 802 participants in the control group experiencing at least one event) with both groups (appendix pp 50-51). The number of unsolicited adverse events were comparable between both vaccine groups, as well as according to sex and age distribution (appendix p 52). There were fewer adverse events after the booster vaccination.
141 serious adverse events in 129 participants were reported, with six of these being assessed as possibly, probably, or definitely related to vaccination (appendix p 53). These six events were all febrile convulsions occurring within 2 days of a vaccination. Four of these events occurred during the primary series of vaccinations and two of these were after the booster vaccination. Five of these febrile convulsions were in the R21/Matrix-M group and one was in the control group, all within 7 days of a vaccination (
The R21/Matrix-M vaccine, when given as the primary series with a booster vaccination, showed a significantly higher number of local and systemic solicited adverse events within 7 days of vaccinations compared with the control vaccine (
common systemic adverse event (754 [46.7%] of 1615 participants in the R21/Matrix-M group and 201 [25.1%] of 802 participants in the control group experiencing at least one event) with both groups (appendix pp 50-51). The number of unsolicited adverse events were comparable between both vaccine groups, as well as according to sex and age distribution (appendix p 52). There were fewer adverse events after the booster vaccination.
141 serious adverse events in 129 participants were reported, with six of these being assessed as possibly, probably, or definitely related to vaccination (appendix p 53). These six events were all febrile convulsions occurring within 2 days of a vaccination. Four of these events occurred during the primary series of vaccinations and two of these were after the booster vaccination. Five of these febrile convulsions were in the R21/Matrix-M group and one was in the control group, all within 7 days of a vaccination (
| Seasonal sites | Standard sites | Total sites | ||||
| R21/Matrix-M | Control | R21/Matrix-M | Control | R21/Matrix-M | Control | |
| 5-17 month age group | ||||||
| Total population | 788 | 399 | 722 | 372 | 1510 | 771 |
| At least one serious adverse event | 28 (3.6%) | 11 (2.8%) | 29 (4.0%) | 12 (3.2%) | 57 (3.8%) | 23 (3.0%) |
| At least one serious adverse event excluding malaria | 25 (3.2%) | 10 (2.5%) | 27 (3.7%) | 11 (3.0%) | 52 (3.4%) | 21 (2.7%) |
| 18-36 month age group | ||||||
| Total population | 826 | 412 | 916 | 443 | 1742 | 855 |
| At least one serious adverse event | 11 (1.3%) | 8 (1.9%) | 20 (2.2%) | 10 (2.3%) | 31 (1.8%) | 18 (2.1%) |
| At least one serious adverse event excluding malaria | 9 (1.1%) | 6 (1.5%) | 16 (1.7%) | 7 (1.6%) | 25 (1.4%) | 13 (1.5%) |
Table 4: Serious adverse events in the modified intention-to treat population (any participant who received a dose)
In total, 20 adverse events of special interest were reported over the course of the study to date. These were 16 febrile convulsions, two cases of meningitis, and two cases of cerebral malaria. Both cases of meningitis were in the R21/Matrix-M group and there was one case of cerebral malaria in each group. Six of these 20 adverse events of special interest (all febrile convulsions) were considered likely related to study vaccines (appendix p 53).
NANP-specific IgG was measured in 1456 participants 28 days after their third dose of R21/Matrix-M vaccine. Higher antibody titres were observed at seasonal sites compared with standard sites (
Discussion
In this phase 3 licensure trial of the R21/Matrix-M malaria vaccine, the primary analysis shows vaccine efficacy against clinical malaria of
When analysing efficacy in 3 -month periods over the first 12 months, there was a decline in efficacy, but it remained at over
This phase 3 trial differs from all previous malaria vaccine trials by evaluating the
This phase 3 trial differs from all previous malaria vaccine trials by evaluating the
Our findings are consistent with data from a recently completed phase 2b trial at the Nanoro seasonal site,
where vaccine efficacy was
Our cross-sectional blood film results at 12 months and 18 months showed significantly reduced parasite rates in participants in the R21/Matrix-M group compared with those in the control group. This finding suggests that the R21/Matrix-M vaccine might not only substantially decrease the number of clinical malaria cases, but could also contribute to programmes to reduce malaria transmission when used with other interventions, particularly if deployed across a wider age range.
As expected with childhood vaccines, pain and fever were the most common adverse events but, overall, low numbers of participants reported these events after each vaccine dose. Most adverse events were mild to moderate in severity. There were no concerning trends observed with unsolicited adverse events or serious adverse events, with no significant imbalance in deaths according to sex or vaccine group. Five febrile convulsions after 11000 doses of R21/Matrix-M were noted with one in the controls, giving a rate of one additional episode per 3700 R21/Matrix-M doses administered, but a statistically significant difference from rabies vaccination was not observed.
This study had some limitations. The trial was not powered to assess vaccine efficacy against clinical malaria at individual sites nor efficacy against mortality or severe malaria across all sites. However, the point estimate of vaccine efficacy against severe malaria is similar to the that against clinical malaria in the first year. There was also somewhat higher efficacy at the seasonal sites compared with standard sites. This finding might partly relate to the different timing of episodes at these sites: at seasonal sites,
In this phase 3 trial, participants have been followed up for 18 months at the seasonal sites and the trial is still ongoing. With malaria vaccines, there are uncertainties
over durability of protection and further data will be helpful to elucidate these uncertainties. The low rate of decline of antibody titres and well maintained efficacy over the second year and third year in the phase 2 b trial suggest that efficacy might be well maintained with R21/Matrix-M.
In addition to high efficacy, a further important advantage of R21/Matrix-M is that initial supply capacity should be of the order of 100-200 million doses annually, with a cost of less than US$4 per dose to public health agencies. This should potentially allow most of the target population of young African children to have access to this vaccine. There has been substantial demand for malaria vaccines from over 20 countries in the past year. Ghana, Nigeria, and Burkina Faso have already approved R21/Matrix-M for use in the expanded age range of 5-36 months, and the vaccine recently received a WHO policy recommendation and prequalification.
Overall, R21/Matrix-M could be widely deployed and a very important addition to help to prevent malaria. Although progress in reducing the burden of this parasitic disease has stalled over the past 5 years, this low-cost vaccine, soon to be available at a scale of over 100 million doses a year, has the potential to reinvigorate progress in the fight against malaria.
where vaccine efficacy was
Our cross-sectional blood film results at 12 months and 18 months showed significantly reduced parasite rates in participants in the R21/Matrix-M group compared with those in the control group. This finding suggests that the R21/Matrix-M vaccine might not only substantially decrease the number of clinical malaria cases, but could also contribute to programmes to reduce malaria transmission when used with other interventions, particularly if deployed across a wider age range.
As expected with childhood vaccines, pain and fever were the most common adverse events but, overall, low numbers of participants reported these events after each vaccine dose. Most adverse events were mild to moderate in severity. There were no concerning trends observed with unsolicited adverse events or serious adverse events, with no significant imbalance in deaths according to sex or vaccine group. Five febrile convulsions after 11000 doses of R21/Matrix-M were noted with one in the controls, giving a rate of one additional episode per 3700 R21/Matrix-M doses administered, but a statistically significant difference from rabies vaccination was not observed.
This study had some limitations. The trial was not powered to assess vaccine efficacy against clinical malaria at individual sites nor efficacy against mortality or severe malaria across all sites. However, the point estimate of vaccine efficacy against severe malaria is similar to the that against clinical malaria in the first year. There was also somewhat higher efficacy at the seasonal sites compared with standard sites. This finding might partly relate to the different timing of episodes at these sites: at seasonal sites,
In this phase 3 trial, participants have been followed up for 18 months at the seasonal sites and the trial is still ongoing. With malaria vaccines, there are uncertainties
over durability of protection and further data will be helpful to elucidate these uncertainties. The low rate of decline of antibody titres and well maintained efficacy over the second year and third year in the phase 2 b trial suggest that efficacy might be well maintained with R21/Matrix-M.
In addition to high efficacy, a further important advantage of R21/Matrix-M is that initial supply capacity should be of the order of 100-200 million doses annually, with a cost of less than US$4 per dose to public health agencies. This should potentially allow most of the target population of young African children to have access to this vaccine. There has been substantial demand for malaria vaccines from over 20 countries in the past year. Ghana, Nigeria, and Burkina Faso have already approved R21/Matrix-M for use in the expanded age range of 5-36 months, and the vaccine recently received a WHO policy recommendation and prequalification.
Overall, R21/Matrix-M could be widely deployed and a very important addition to help to prevent malaria. Although progress in reducing the burden of this parasitic disease has stalled over the past 5 years, this low-cost vaccine, soon to be available at a scale of over 100 million doses a year, has the potential to reinvigorate progress in the fight against malaria.
Contributors
AVSH and MSD conceived and designed the trial and AVSH is the chief investigator. AVSH, MSD, AD, MH, AO, J-BO, HT, HMN, BMG, DC, and KJE contributed to the protocol and design of the study. AD, MH, AO, J-BO, and HT were the study site principal investigators. KJE led laboratory studies of immune responses. EB and JB did the statistical analysis. SB, PSK, HR, US, and SG were responsible for vaccine and adjuvant manufacturing and provision. MSD, AVSH, EB, and JB led on the preparation of the report. AL provided regulatory support and guidance. AD, MH, HMN, MC, YDC, DI, DS, SO, AMS, AO, J-BO, HT, PB, MSD, AVSH, KJE, FRL, LS, RR, and SW contributed to the implementation of the study. EB, JB, MSD, and AVSH have accessed and verified the data. All authors had full access to all the data in the study and had final responsibility for the decision to submit for publication.
Declaration of interests
AVSH and KJE are named as co-inventors on patent applications related to R21 and might benefit from any royalty stream. KJE was an employee of the University of Oxford (Oxford, UK) at the time of this work and is now an employee of GlaxoSmithKline. KJE holds restricted shares in the GlaxoSmithKline group of companies. US, SB, PSK, HR, and SG are employees of the Serum Institute of India, co-developer of the R21/Matrix-M vaccine. All other authors declare no competing interests.
Data sharing
The study protocol is provided in the appendix. Anonymised participant data will be made available when the trial is complete, upon requests directed to the corresponding author. Proposals will be reviewed and approved by the sponsor, investigators, and collaborators based on scientific merit. After approval of a proposal, data can be shared through a secure online platform after signing a data access agreement. All data will be made available for a minimum of 5 years from the end of the trial.
Acknowledgments
We would like to thank all the participants in the trial and their caregivers, the local Health District authorities, all the hospitals involved,
Articles
and all the research staff at Ifakara Health Institute, Bagamoyo; Institut des Sciences et Techniques, Dande; Kenyan Medical Research InstituteCentre for Geographical Medical Research-Coast, Kilifi; Malaria Research and Training Centre, Bamako; Unité de Recherche Clinique de Nanoro, Nanoro; and DiagnoSearch Life Sciences, Thane, India for data management and pharmacovigilance. The authors would like to thank Parag Nagarkar and Pradeep Singh of the Serum Institute of India for regulatory support; and Novavax, and specifically Lou Fries, Greg Glenn, and Jenny Reimer, for their support of this project by supplying Matrix-M adjuvant for our use. We are grateful to the members of the Data and Safety Monitoring Board (Blaise Genton, Samba Sow, Brian Angus, Francesca Little, Karim Manji, and Kwadwo Ansah Koram) and to the Independent Diagnosis Advisory Panel (Jane Achan, Thomas Gyan, and Muhammed Afolabi) and to the local safety monitors for each site (Abdoul Aziz Diakité, William Kaboré, Senkaye-Lagom Aimée Kissou, Nahya Salim Masoud, and Neema Mturi). The trial was mainly funded by the Serum Institute of India with additional funding to trial sites from Open Philanthropy and also recevied funding from the Wellcome Trust and the UK National Institute for Health Research Oxford Biomedical Research Centre.
References
1 WHO. World malaria report 2022. Geneva: World Health Organization, 2022.
2 RTS,S Clinical Trials Partnership. Efficacy and safety of RTS,S/AS01 malaria vaccine with or without a booster dose in infants and children in Africa: final results of a phase 3, individually randomised, controlled trial. Lancet 2015; 386: 31-45.
3 WHO. Full evidence report on the RTS.S.AS01 malaria vaccine. 2021. https://cdn.who.int/media/docs/default-source/ immunization/mvip/full-evidence-report-on-the-rtss-as01-malaria-vaccine-for-sage-mpag-(sept2021).pdf (accessed Dec 22, 2023).
2 RTS,S Clinical Trials Partnership. Efficacy and safety of RTS,S/AS01 malaria vaccine with or without a booster dose in infants and children in Africa: final results of a phase 3, individually randomised, controlled trial. Lancet 2015; 386: 31-45.
3 WHO. Full evidence report on the RTS.S.AS01 malaria vaccine. 2021. https://cdn.who.int/media/docs/default-source/ immunization/mvip/full-evidence-report-on-the-rtss-as01-malaria-vaccine-for-sage-mpag-(sept2021).pdf (accessed Dec 22, 2023).
4 WHO. First malaria vaccine supply allocations May 2023. 2023. https://cdn.who.int/media/docs/default-source/immunization/ mvip/first_malaria_vaccine_allocation_explained_may2023. pdf?sfvrsn=248c4624_3 (accessed Dec 22, 2023).
5 WHO. Framework for the allocation of limited malaria vaccine supply. 2022. https://www.who.int/publications/m/item/ framework-for-allocation-of-limited-malaria-vaccine-supply (accessed Dec 22, 2023).
6 Collins KA, Brod F, Snaith R, et al. Ultra-low dose immunization and multi-component vaccination strategies enhance protection against malaria in mice. Sci Rep 2021; 11: 10792.
7 Collins KA, Snaith R, Cottingham MG, Gilbert SC, Hill AVS. Enhancing protective immunity to malaria with a highly immunogenic virus-like particle vaccine. Sci Rep 2017; 7: 46621.
8 Venkatraman N, Tiono AB, Bowyer G, et al. Phase I assessments of first-in-human administration of a novel malaria anti-sporozoite vaccine candidate, R21 in matrix-M adjuvant, in UK and Burkinabe volunteers. medRxiv 2019; published online Oct 18. https://www. medrxiv.org/content/10.1101/19009282v1.full (preprint).
9 Venkatraman NBG, Edwards N, et al. High level efficacy in humans of a next-generation Plasmodium falciparum anti-sporozoite vaccine: R21 in Matrix-M (TM) adjuvant. AmJ TropMed Hyg 2017; 97: 594.
10 Datoo MS, Natama HM, Somé A, et al. Efficacy and immunogenicity of R21/Matrix-M vaccine against clinical malaria after 2 years’ follow-up in children in Burkina Faso: a phase 1/2b randomised controlled trial. Lancet Infect Dis 2022; 22: 1728-36.
11 Datoo MS, Natama MH, Somé A, et al. Efficacy of a low-dose candidate malaria vaccine, R21 in adjuvant Matrix-M, with seasonal administration to children in Burkina Faso: a randomised controlled trial. Lancet 2021; 397: 1809-18.
5 WHO. Framework for the allocation of limited malaria vaccine supply. 2022. https://www.who.int/publications/m/item/ framework-for-allocation-of-limited-malaria-vaccine-supply (accessed Dec 22, 2023).
6 Collins KA, Brod F, Snaith R, et al. Ultra-low dose immunization and multi-component vaccination strategies enhance protection against malaria in mice. Sci Rep 2021; 11: 10792.
7 Collins KA, Snaith R, Cottingham MG, Gilbert SC, Hill AVS. Enhancing protective immunity to malaria with a highly immunogenic virus-like particle vaccine. Sci Rep 2017; 7: 46621.
8 Venkatraman N, Tiono AB, Bowyer G, et al. Phase I assessments of first-in-human administration of a novel malaria anti-sporozoite vaccine candidate, R21 in matrix-M adjuvant, in UK and Burkinabe volunteers. medRxiv 2019; published online Oct 18. https://www. medrxiv.org/content/10.1101/19009282v1.full (preprint).
9 Venkatraman NBG, Edwards N, et al. High level efficacy in humans of a next-generation Plasmodium falciparum anti-sporozoite vaccine: R21 in Matrix-M (TM) adjuvant. AmJ TropMed Hyg 2017; 97: 594.
10 Datoo MS, Natama HM, Somé A, et al. Efficacy and immunogenicity of R21/Matrix-M vaccine against clinical malaria after 2 years’ follow-up in children in Burkina Faso: a phase 1/2b randomised controlled trial. Lancet Infect Dis 2022; 22: 1728-36.
11 Datoo MS, Natama MH, Somé A, et al. Efficacy of a low-dose candidate malaria vaccine, R21 in adjuvant Matrix-M, with seasonal administration to children in Burkina Faso: a randomised controlled trial. Lancet 2021; 397: 1809-18.
