DOI: https://doi.org/10.1186/s12929-024-00994-y
PMID: https://pubmed.ncbi.nlm.nih.gov/38221607
تاريخ النشر: 2024-01-14
نماذج زراعة الخلايا ثلاثية الأبعاد المعتمدة على الهياكل في أبحاث السرطان
الملخص
ظهرت زراعات الخلايا ثلاثية الأبعاد (3D) كأدوات قيمة في أبحاث السرطان، حيث تقدم مزايا كبيرة مقارنة بأنظمة زراعة الخلايا ثنائية الأبعاد التقليدية (2D). في زراعات الخلايا ثلاثية الأبعاد، تنمو خلايا السرطان في بيئة تحاكي بشكل أقرب العمارة ثلاثية الأبعاد وتعقيد الأورام في الجسم. لقد أحدث هذا النهج ثورة في أبحاث السرطان من خلال توفير تمثيل أكثر دقة للبيئة الدقيقة للورم (TME) وتمكين دراسة سلوك الورم واستجابته للعلاجات في سياق أكثر ملاءمة فسيولوجيًا. واحدة من الفوائد الرئيسية لزراعة الخلايا ثلاثية الأبعاد في أبحاث السرطان هي القدرة على إعادة إنتاج التفاعلات المعقدة بين خلايا السرطان والستروما المحيطة بها. تتكون الأورام ليس فقط من خلايا السرطان ولكن أيضًا من أنواع خلايا أخرى متنوعة، بما في ذلك خلايا الستروما، وخلايا المناعة، والأوعية الدموية. هذه النماذج تربط بين زراعات الخلايا ثنائية الأبعاد التقليدية ونماذج الحيوانات، مما يوفر بديلاً فعالاً من حيث التكلفة، وقابل للتوسع، وأخلاقي للبحث قبل السريري. مع تقدم هذا المجال، من المتوقع أن تلعب زراعات الخلايا ثلاثية الأبعاد دورًا محوريًا في فهم بيولوجيا السرطان وتسريع تطوير علاجات فعالة لمكافحة السرطان. يسلط هذا المقال الاستعراضي الضوء على المزايا الرئيسية لزراعات الخلايا ثلاثية الأبعاد، والتقدم في تقنيات الزراعة الأكثر شيوعًا القائمة على السقالات، والأدبيات ذات الصلة حول تطبيقاتها في أبحاث السرطان، والتحديات المستمرة.
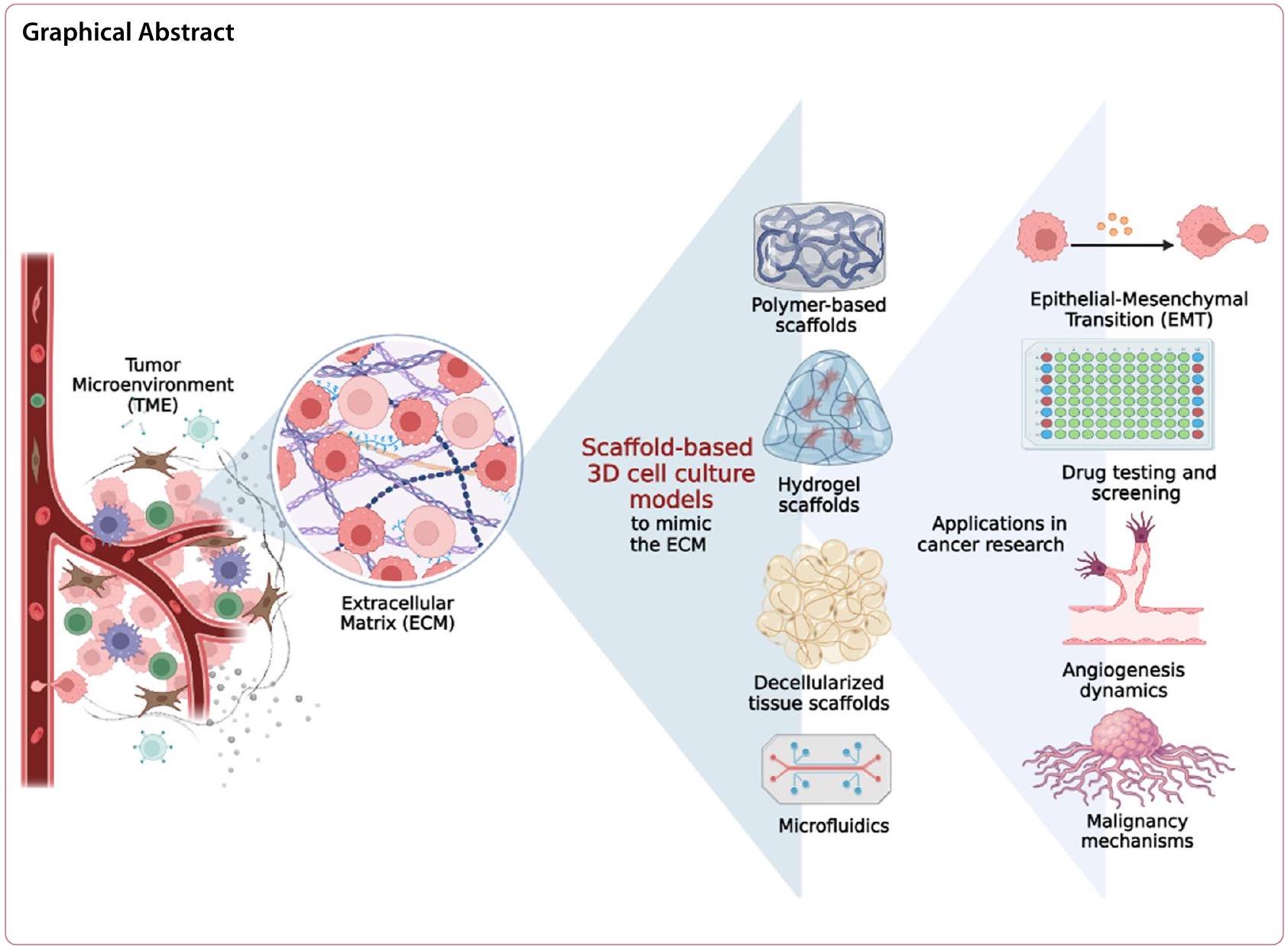
المقدمة
طرق العلاج، وتطوير أدوات تشخيصية أكثر تطورًا، وفهم الآليات الجينية والجزيئية المعنية في تطوره وتقدمه [3].
الأهمية الفسيولوجية لزراعات الخلايا ثلاثية الأبعاد بالنسبة للمصفوفة خارج الخلية
الحالة الأيضية الخلوية. من الجدير بالذكر أن الخلايا المزروعة في المصفوفة خارج الخلية للورم أظهرت مستويات مرتفعة من NADH الحرة، مما يشير إلى زيادة في معدل التحلل الجليكولي مقارنة بتلك المزروعة في المصفوفة خارج الخلية الطبيعية. تؤكد هذه النتائج التأثير الكبير للمصفوفة خارج الخلية على نمو خلايا السرطان والأوعية الدموية المصاحبة (مثل زيادة طول الأوعية، وزيادة تغايرية الأوعية). يمكن أن تُعزى التغيرات في تركيبة المصفوفة خارج الخلية للورم، مثل زيادة ترسيب وتداخل ألياف الكولاجين، إلى التواصل بين خلايا الورم وخلايا الستروما المرتبطة بالورم.
| نوع السرطان | نموذج الثقافة ثلاثي الأبعاد (نوع الخلية) | |||
| سرطان الرئة |
|
|||
| ورم دبقي متعدد الأشكال |
|
|||
| سرطان الثدي |
|
|||
| سرطان البنكرياس |
|
|||
| سرطان المبيض |
|
|||
| سرطان القولون |
|
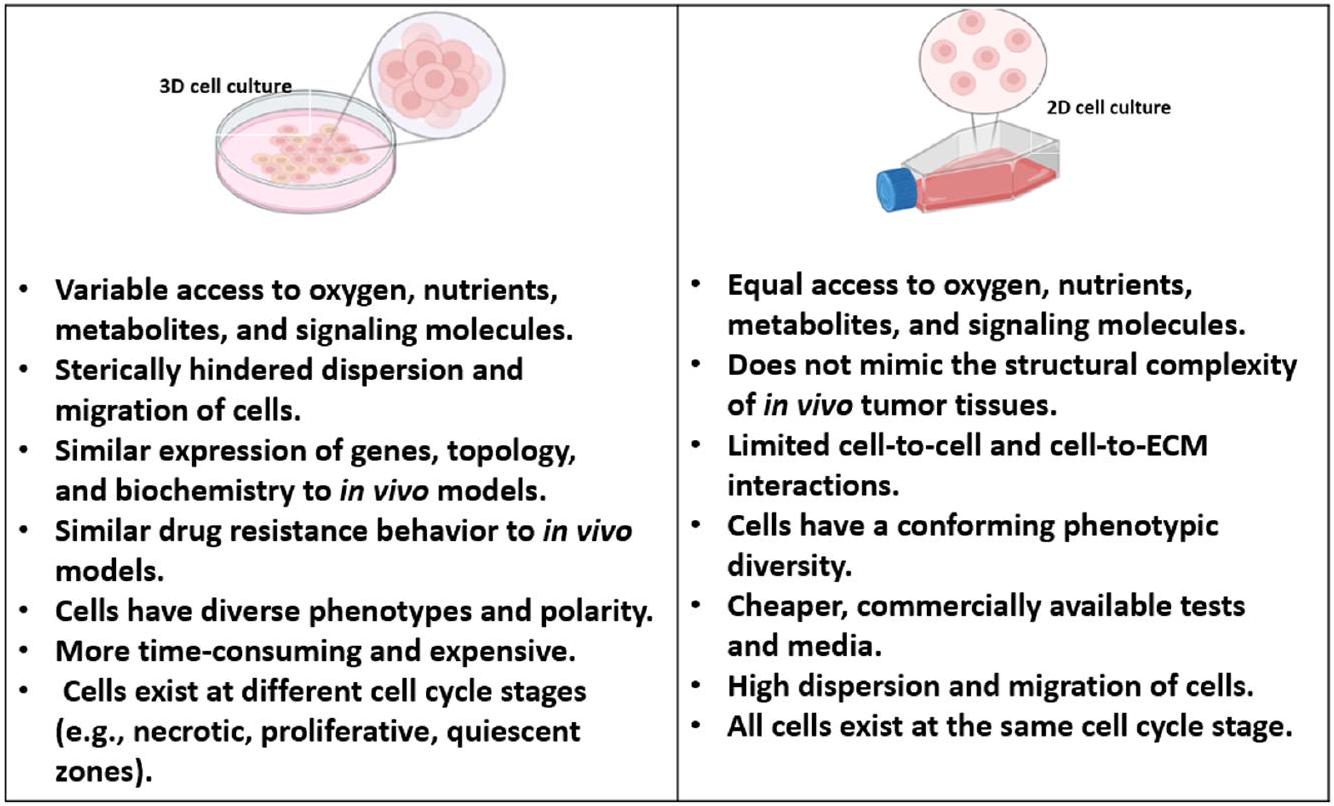
تُلخص الشكل 1 الخصائص الرئيسية لزراعة الخلايا ثنائية وثلاثية الأبعاد. إن الانتقال إلى زراعة الخلايا ثلاثية الأبعاد هو تقدم كبير في البحث المختبري، حيث يوفر نموذجًا أكثر ملاءمة من الناحية الفسيولوجية لدراسة الخلايا.
العمليات والأمراض. بينما لا تزال بعض التحديات بحاجة إلى معالجة، فإن مزايا الثقافة ثلاثية الأبعاد تفوق قيود الثقافة ثنائية الأبعاد. مع استمرار تطور التكنولوجيا، من المحتمل أن تصبح الثقافة ثلاثية الأبعاد أداة حاسمة بشكل متزايد في أبحاث السرطان وحقول العلوم الطبية الحيوية الأخرى.
مصادر الخلايا وتنوع الثقافة ثلاثية الأبعاد
خزان من خلايا الإنسان، قادر على التطور إلى أي نوع من الخلايا المطلوبة للتطبيقات العلاجية. خلايا الجذع المستحثة متعددة القدرات (HiPSCs) ذات صلة خاصة في أبحاث السرطان (الجدول 3) [47]. وبالتالي، فإن عملية إعادة البرمجة التي روج لها شينيا ياماناكا قد فتحت آفاقًا جديدة لتقدم علم السرطان، واكتشاف الأدوية، والطب التجديدي في علاج السرطان. أخيرًا، خلايا الجذع البالغة أو الجسدية هي خلايا محددة الأنسجة، تعكس خصائص أصلها، وتثير مخاوف أخلاقية أقل لأنها مشتقة من أنسجة بالغة. ومع ذلك، فإن لديها قدرة محدودة على التمايز وعمرًا محدودًا في الثقافة. يؤثر اختيار مصدر الخلايا بشكل كبير على التركيب والسلوك في الثقافة ثلاثية الأبعاد. خلايا الجذع و iPSCs، المعروفة بتعدد قدراتها، تقدم تباينًا متأصلًا بسبب قدرتها على التمايز إلى أنواع مختلفة من الخلايا [45، 46].
| نوع النموذج | ميزات | المزايا | العيوب | |||||||
| زراعة الخلايا ثنائية الأبعاد | تشمل الخلايا المزروعة في طبقة مسطحة ثنائية الأبعاد، عادةً على أطباق الزرع. | بروتوكولات راسخة. نمو الخلايا وانقسامها بسرعة. بسيطة وفعالة من حيث التكلفة. سهلة التلاعب والتحليل. مناسبة للفحص عالي الإنتاجية. | تمثيل مبسط للغاية لظروف داخل الجسم. يفتقر إلى تفاعلات الخلايا مع بعضها البعض وتفاعلات الخلايا مع المصفوفة. شكل مسطح، مما قد يغير الاستجابات الخلوية. | |||||||
| زراعة الخلايا ثلاثية الأبعاد | تمثيل ترتيب ثلاثي الأبعاد للخلايا يحاكي التعقيد المكاني للبيئات الحية. يمكن أن تكون هذه الأنظمة خالية من الدعائم أو قائمة على الدعائم، حيث يتم زراعة الخلايا في الدعائم أو المصفوفات، مما يسمح بالتفاعلات التي تعيد تمثيل الظروف الفسيولوجية بشكل أفضل. | تحسين توقع استجابة الأدوية. يسمح بدراسة البيئة المجهرية للورم ويسهل التحقيق في تباين الأورام. | تباين في البروتوكولات والمنهجيات. قابلية محدودة للتوسع في الاختبارات عالية الإنتاجية. | |||||||
| الأنسجة والأعضاء | يتضمن زراعة الخلايا في تكوينات تحاكي بنية ووظيفة أعضاء أو أجزاء تشريحية محددة. توفر هذه الأنظمة بيئة أكثر تعقيدًا وشمولية من الخلايا الفردية، مما يسمح بتمثيل أقرب للظروف داخل الجسم. من خلال تنظيم الخلايا في هياكل تشبه الأعضاء أو الأنسجة، يمكن للباحثين دراسة التفاعلات بين أنواع الخلايا المختلفة واكتساب رؤى حول الاستجابات الخاصة بالأعضاء تجاه السرطان وعلاجاته. |
|
|
|||||||
| الحيوانات | نماذج الحيوانات، مثل الفئران أو الجرذان، هي كائنات حية تُستخدم لدراسة السرطان. |
|
|
|||||||
| المرضى | تشمل أنظمة نماذج المرضى في أبحاث السرطان استخدام عينات مستمدة مباشرة من المرضى. يمكن أن تشمل هذه النماذج زراعة الأورام المستمدة من المرضى (PDX) أو الأعضاء المصغرة أو نماذج مخصصة أخرى. تهدف هذه الأنظمة إلى التقاط الخصائص الفريدة لأورام المرضى الأفراد، مما يسمح بإجراء دراسات أكثر تخصيصًا وملاءمة لكل مريض. |
|
|
إن الاستجابات المحددة الغامضة، في حين أن التماثل المفرط قد يبسط بشكل مفرط تمثيل بيئة الأنسجة الدقيقة. لذلك، فإن فهمًا دقيقًا لمصدر الخلايا أمر ضروري لتكييف نماذج زراعة الخلايا ثلاثية الأبعاد لتعكس بدقة تعقيدات الأنسجة والأعضاء الفعلية.
تقنيات قائمة على السقالات لزراعة الخلايا ثلاثية الأبعاد
| الخلايا المستخدمة في زراعة الخلايا في المختبر | فضائل | عيوب | الدراسات ذات الصلة | |||||
| الخلايا الجذعية |
|
تتمتع خلايا الجذع البالغة أو الجسدية بإمكانات تمايز أكثر تقييدًا من خلايا الجذع متعددة القدرات، مما يحد من مرونتها في نمذجة الأنسجة المتنوعة. | خلايا جذعية من المايلوما [48]. خلايا جذعية من الميلانوما [49]. خلايا جذعية من سرطان الثدي [50]. | |||||
| خلايا جذعية متعددة القدرات المستحثة (iPSCs) | تسمح الطبيعة متعددة القدرات لخلايا HiPSCs بإنشاء نماذج في المختبر تعكس خصائص خلايا السرطان بشكل وثيق، مما يوفر رؤى قيمة حول تطور السرطان وتقدمه. |
|
|
|||||
| خلايا أولية |
|
|
خلايا سرطان الثدي الأولية [56]. خلايا سرطان البروستاتا الأولية [57]. خلايا الورم الدبقي الأولية [58]. |
إلى فحص النماذج القائمة على الدعائم لزراعة الخلايا ثلاثية الأبعاد. تعتبر الدعائم مكونات أساسية في أنظمة زراعة الخلايا ثلاثية الأبعاد، حيث توفر بيئة ثلاثية الأبعاد لنمو الخلايا وتفاعلها مع بعضها البعض ومع محيطها [61، 62]. يمكن تصنيف المواد الحيوية المستخدمة في مثل هذه النماذج إلى المجموعات الرئيسية التالية: دعائم بوليمرية، هيدروجيل، دعائم أنسجة غير خلوية، ودعائم هجينة (مثل دمج أجهزة ميكروفلويديك). تلخص الجداول 4 و 5 مزايا وقيود تقنيات زراعة الخلايا ثلاثية الأبعاد الخالية من الدعائم والقائمة على الدعائم على التوالي.
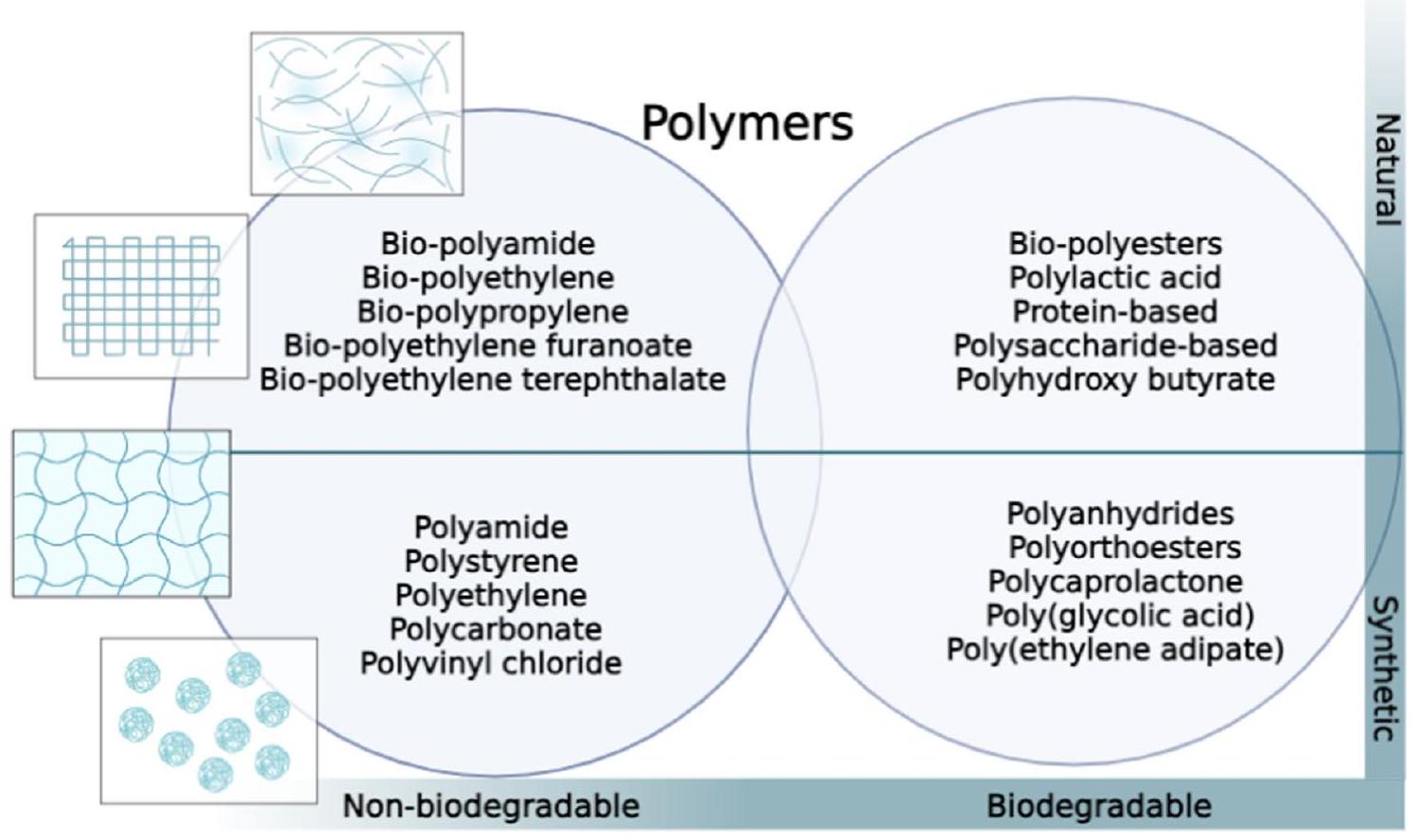
دعائم قائمة على البوليمر
| تقنية خالية من الدعائم | الوصف | المزايا | القيود | المراجع | |||||||||||||
| الأشكال المعلقة أو الأشكال المعلقة المربوطة | تُعرف أيضًا بالأشكال المعلقة المربوطة. يتم تعليق الخلايا في قطرة من الوسط التي تُعلق من سطح. توفر القطرة بيئة ثلاثية الأبعاد لنمو الخلايا وتشكيل الأشكال. لا تتطلب الأشكال المربوطة دعامة أو مصفوفة لدعم الخلايا. عادةً، يمكن الحفاظ عليها لمدة 10 إلى 14 يومًا. |
|
|
[63-67] | |||||||||||||
| الأشكال غير الملتصقة أو الأشكال ذات الالتصاق المنخفض جدًا | تُعرف أيضًا باختبار تشكيل كرات الورم متعددة الخلايا. تشكل الخلايا كرات ورمية من خلال آليات نمو مستقلة عن التثبيت. عادةً، يمكن الحفاظ على هذه الكرات لمدة تصل إلى 7 أيام. |
|
|
[68-71] | |||||||||||||
| الطباعة الحيوية الخالية من الدعائم | تشمل الطباعة المباشرة لتجمعات الخلايا أو الخلايا الفردية دون استخدام دعامة خارجية. في هذه الطريقة، يتم طباعة الخلايا بطريقة تسمح لها بالتجمع الذاتي والتفاعل مع الخلايا المجاورة، مما يشكل هياكل تشبه الأنسجة ثلاثية الأبعاد دون الحاجة إلى دعامة داعمة. عادةً، يمكن الحفاظ عليها لمدة 2 إلى 4 أيام. |
|
|
[72-77] | |||||||||||||
| الرفع المغناطيسي | إنها طريقة جديدة نسبيًا خالية من الدعائم لزراعة الخلايا ثلاثية الأبعاد. في هذه الطريقة، يتم خلط الخلايا مع جزيئات نانوية مغناطيسية ويتم رفعها باستخدام مجال مغناطيسي. بينما تطفو الخلايا، تتجمع وتشكل هياكل ثلاثية الأبعاد. يسمح الرفع المغناطيسي بإنشاء هياكل ثلاثية الأبعاد معقدة. عادةً، يمكن الحفاظ على زراعة الخلايا لأكثر من 7 أيام. |
|
|
[78-83] | |||||||||||||
| الميكروفلويديات الخالية من الدعائم | تعزز بيئات زراعة الخلايا ثلاثية الأبعاد دون مصفوفات داعمة، مثل الهيدروجيل أو الدعائم. تخلق هذه الأجهزة بيئات ميكروية محكومة داخل قنوات ميكروفلويدية لتسهيل تجمع وتنظيم الخلايا السرطانية ذاتيًا، مما يعزز تشكيل هياكل ثلاثية الأبعاد، بما في ذلك الأشكال أو الأعضاء. |
|
|
[٨٤، ٨٥] |
من ناحية أخرى، تتكون الدعائم المعتمدة على البوليسكاريد من سلاسل طويلة من جزيئات السكر (مثل الكيتوزان وحمض الهيالورونيك). إنها متوافقة حيوياً وقابلة للتحلل البيولوجي، وغالباً ما يمكن تعديلها لضبط خصائصها الفيزيائية والبيولوجية. طور آريا وآخرون [97] نموذج زراعة خلايا ثلاثي الأبعاد باستخدام دعامة من الكيتوزان، وهو بوليمر طبيعي مشتق من الكيتين، لدراسة سلوك سرطان الثدي. تم ربط الدعامة مع الجينيبين، وهو رابط طبيعي، لتعزيز استقرارها. وجدت الدراسة أن دعامة الكيتوزان-جيلاتين (GC) وفرت بيئة مناسبة لنمو خلايا سرطان الثدي MCF-7، حيث أظهرت الخلايا التصاقاً جيداً وتكاثراً. كما دعمت الدعامة تشكيل تجمعات خلوية، والتي تمثل ظروف الورم في الجسم الحي بشكل أفضل مقارنة بالزراعات ثنائية الأبعاد. الدراسة
خلصت الدراسة إلى أن الهيكل الداعم من الكيتوزان/الجيلاتين يمكن أن يكون مفيدًا لدراسة سرطان الثدي في المختبر، حيث يوفر نموذجًا أكثر ملاءمة من الناحية الفسيولوجية مقارنة بالثقافات التقليدية ثنائية الأبعاد. لقد أظهرت هياكل GC أنها تدعم تشكيل الأورام الصغيرة التي تحاكي الأورام التي تنمو في الجسم، مما يجعلها نموذجًا محسنًا للأورام في المختبر. تم استخدام هذه الهياكل بنجاح لدراسة سرطان الرئة، بالإضافة إلى أنواع أخرى من السرطان، مثل سرطان الثدي، وسرطان عنق الرحم، وسرطان العظام. لقد أظهرت هذه الهياكل ملفات تعبير جيني مشابهة لتلك الموجودة في الأورام التي تنمو في الجسم، مما يشير إلى إمكانياتها لدراسة تقدم السرطان واختبار الأدوية للأورام الصلبة. كما أظهرت هياكل GC أنها تحسن من القدرة التنبؤية للدراسات قبل السريرية وتعزز من الترجمة السريرية للعلاجات. بشكل عام، توفر هياكل GC أداة قيمة لدراسة تطور الأورام وتقييم فعالية الأدوية المضادة للسرطان في بيئة المختبر.
| نوع السقالة | وصف | المزايا | القيود | المراجع | ||||||
| بوليمرات طبيعية | إنها مشتقة من مصادر طبيعية مثل الكولاجين، الفيبرين، أو الألجينات. هذه الهياكل تحاكي المصفوفة خارج الخلوية الأصلية وتوفر بيئة ميكروية ملائمة لنمو الخلايا. |
|
|
[٨٦، ٨٧] | ||||||
| بوليمرات قابلة للتحلل الاصطناعي | تم تصنيعها باستخدام مواد قابلة للتحلل الحيوي صناعية مثل بولي كابرو لاكتون (PCL) أو بولي (حمض اللاكتيك-حمض الجليكوليك) (PLGA). توفر هذه الهياكل تحكمًا دقيقًا في خصائصها ويمكن تخصيصها لتلبية متطلبات محددة. |
|
|
[88] | ||||||
| الهلاميات المائية | يتكون من شبكة ثلاثية الأبعاد من سلاسل البوليمر المحبة للماء القادرة على الاحتفاظ بكميات كبيرة من الماء. توفر بيئة رطبة وناعمة لنمو الخلايا. |
|
|
[89] | ||||||
| أنسجة خالية من الخلايا | يتضمن ذلك إزالة المكونات الخلوية من الأنسجة الأصلية، مما يترك وراءه هيكل ECM والجزيئات النشطة حيوياً. توفر هذه الهياكل بيئة تشبه إلى حد كبير البيئة الميكروية للأنسجة الأصلية. |
|
|
[90] |
| نوع السقالة | وصف | المزايا | القيود | المراجع | |||
| الميكروفلويديات المعتمدة على السقالات | تُزرع الخلايا داخل قنوات ميكروسكوبية توفر بيئة ميكروية محكومة لنمو الخلايا في هيكل محمل بالخلايا. | – يمكن إنشاء تحكم دقيق في الزمان والمكان على ظروف زراعة الخلايا (مثل تدفق السوائل، التدرجات الكيميائية، وتوصيل الأكسجين والمواد الغذائية). – يمكن أن تحاكي واجهات الأنسجة. |
|
[91,92] |
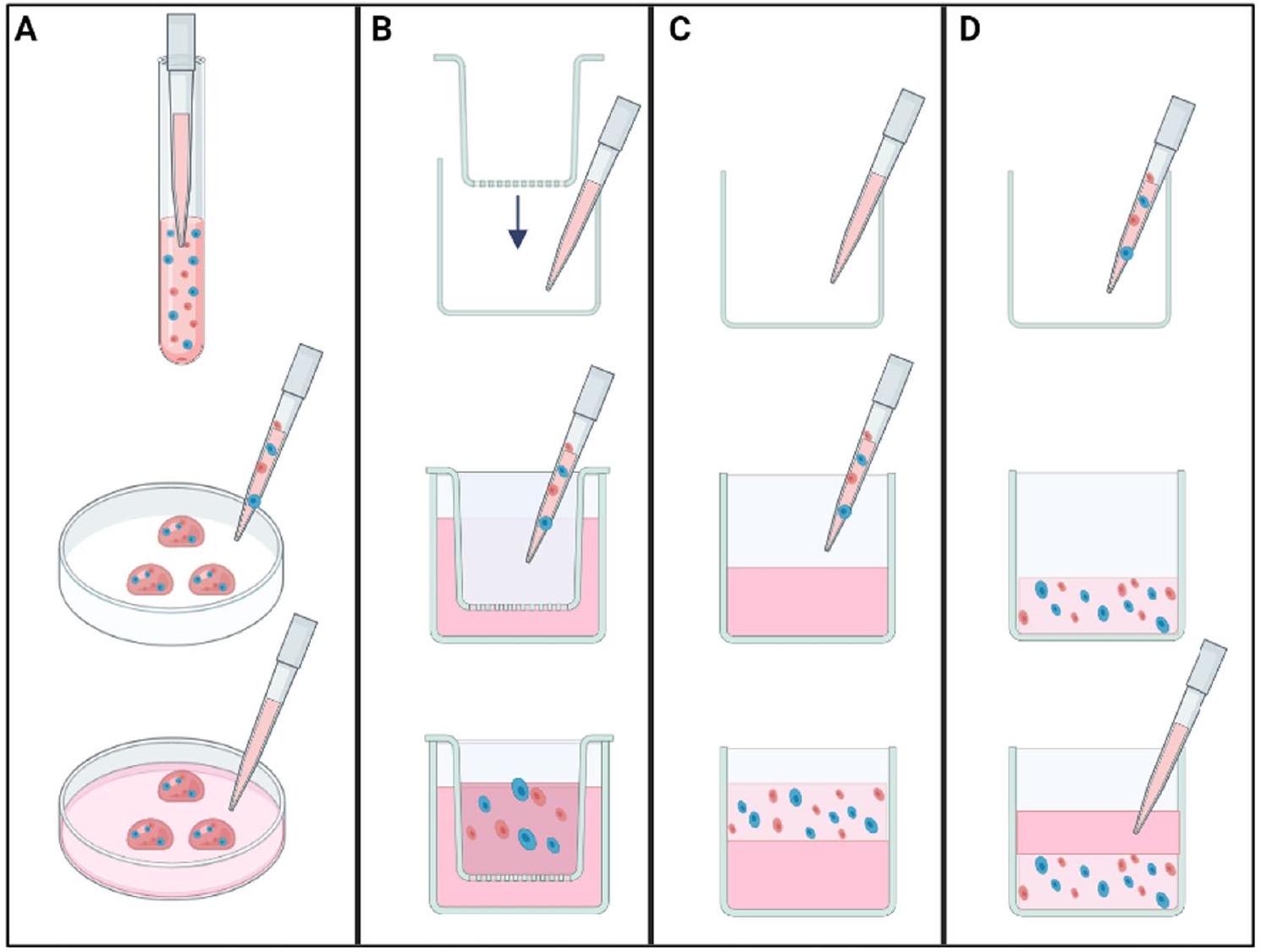
زراعة الدعامات. في الوقت نفسه، كانت تعبيره مرتفعًا بشكل ملحوظ داخل الأورام المستمدة من دعامات PLGA المحملة بخلايا MDA-MB-231. تشير هذه النتيجة إلى أن مجموعة خلايا السرطان داخل الدعامات أظهرت تكاثرًا سريعًا عند تضمينها في الأنسجة الثديية الأصلية.
دعائم الهيدروجيل
هيكل ثلاثي الأبعاد بسيط ومعزول. توضح الشكل 3B تقنية الآبار المضافة، التي تتكون من إضافات مسامية لحمل خليط الخلايا والهيدروجيل بينما يتم إضافة وسط زراعة الخلايا إلى البئر المحيط بالإضافة. تخلق هذه الفجوة بيئة تفاضلية، مما يسمح بتبادل المغذيات مع الحفاظ على ثقافة ثلاثية الأبعاد متميزة داخل الإضافة. ستتشكل كريات غير متجانسة في النهاية في قاع الإضافة بسبب الجاذبية وتفاعلات الخلايا. يمكن استخدام مثل هذا النموذج لدراسة غزو الخلايا أو هجراتها عن طريق وضع خليط الخلايا والهيدروجيل على جانب واحد من غشاء قابل للاختراق والمواد الكيميائية الجاذبة على الجانب الآخر. تتضمن طريقة دعم قاع الهلام (انظر الشكل 3C) إنشاء طبقة سميكة من الهيدروجيل في قاع بئر الزراعة، يتم وضع تعليق الخلايا فوقها. على سبيل المثال، يمكن استخدام هذه الطريقة لتضمين الخلايا داخل هياكل هيدروجيل ذات مسام كبيرة، مثل AlgiMatrix.
نظرًا لخصائصها القابلة للتعديل، تقدم الهيدروجيل الاصطناعية فوائد ملحوظة في ثقافة الخلايا ثلاثية الأبعاد. ببتيد RADA16-I هو ببتيد يتجمع ذاتيًا مستمد من جزء من زيوت، وهو بروتين يرتبط بـ Z-DNA بيد اليسار تم اكتشافه في الأصل في الخميرة. لقد ظهر هذا الببتيد كمادة نانوية جديدة بسبب قدرته على تشكيل هياكل نانوية. وبالتالي، توفر هذه الهياكل إطارًا داعمًا يعزز نمو الخلايا ويعزز بيئة ثلاثية الأبعاد ملائمة لثقافة الخلايا.
يمكن تعديل تسلسل الببتيد لدمج مجموعات وظيفية محددة، مما يتيح ضبط الخصائص الميكانيكية والكيميائية والبيولوجية للهيكل الناتج. هذه المرونة الرائعة تمكن من التخصيص لتتناسب بدقة مع المتطلبات الفريدة للخلايا المزروعة أو الأهداف التجريبية المقصودة. هذه الهياكل، التي يبلغ قطرها حوالي 10 نانومتر، مدفوعة بمتبقيات مشحونة إيجابيًا وسلبيًا من خلال تفاعلات أيونية مكملة. عند إذابتها في الماء، يشكل ببتيد RADA16-I هيدروجيل مستقر (شبكات ألياف نانوية بحجم مسام حوالي
هيالورونيداز. يسمح الاستجابة للجلوتاثيون بالتحلل استجابةً للبيئة المؤكسدة، والتي غالبًا ما تتعطل في خلايا السرطان. في الوقت نفسه، تجعل استجابة الهيالورونيداز الهيدروجيل حساسًا لإنزيم يتم تنظيمه عادةً في خلايا السرطان الغازية. بشكل ملحوظ، أظهرت خلايا MCF-7 المزروعة في هيدروجيل HA زيادة في التعبير عن عامل نمو بطانة الأوعية الدموية (VEGF)، والإنترلوكين-8 (IL-8)، وعامل نمو الألياف الأساسية (bFGF) مقارنةً بنظيراتها المزروعة ثنائية الأبعاد. هذه الجزيئات هي وسطاء رئيسيون في تكوين الأوعية الدموية والالتهاب في السرطان، مما يشير إلى أن بيئة هيدروجيل HA تحاكي بشكل أفضل الظروف التي تعزز هذه العمليات في الأورام. بالإضافة إلى ذلك، أظهرت الخلايا المزروعة في الهيدروجيل قدرات معززة على الهجرة والغزو، وهي سمات رئيسية لخلايا السرطان العدوانية. دعمت الدراسات في الجسم هذه النتائج وأكدت القدرة الورمية المتفوقة لخلايا MCF-7 المزروعة في هيدروجيل HA مقارنةً بتلك المزروعة في 2D. من المتوقع أن تكون نتائج هذا البحث
لها آثار بعيدة المدى على كل من دراسة سرطان الثدي في المختبر وتطوير استراتيجيات علاجية فعالة.
أيدت دراسة أخرى أجراها وانغ وزملاؤه [108] أن مستوى الميثاكريليشن أثر بشكل كبير على الميكروستركشر للهيدروجيل، والخصائص الميكانيكية، وقدرته على امتصاص السوائل والتحلل. عرض الهيدروجيل المكرر، الذي تم تصنيعه من خلال الربط الضوئي لحمض الهيالورونيك الميثاكريل، هيكلًا مساميًا عاليًا، ونسبة انتفاخ متوازنة عالية، وخصائص ميكانيكية مناسبة، وعملية تحلل تستجيب للهيالورونيداز. وُجد أن هيدروجيل حمض الهيالورونيك يعزز نمو وتكاثر خلايا MCF-7، التي شكلت تجمعات داخل الهيدروجيل. بالإضافة إلى ذلك، أظهرت خلايا MCF-7 المزروعة في بيئة ثلاثية الأبعاد زيادة في تعبير VEGF وbFGF وinterleukin-8، وقدرات متزايدة على الغزو وتكوين الأورام مقارنة بنظيراتها المزروعة في بيئة ثنائية الأبعاد. وبالتالي، أثبت هيدروجيل حمض الهيالورونيك أنه بديل موثوق لبناء نماذج الأورام. الجيلاتين الميثاكريلي (GelMA) هو مادة حيوية طبيعية أخرى تُستخدم بشكل شائع في هياكل الهيدروجيل ثلاثية الأبعاد في أبحاث السرطان. يتم اشتقاق GelMA من الجيلاتين، وهو بروتين طبيعي يتم الحصول عليه من مصادر غنية بالكولاجين. يتم تعديله عن طريق إضافة مجموعات ميثاكريلويل التي تمكنه من الخضوع للربط الضوئي عند تعرضه للأشعة فوق البنفسجية (UV). تتيح هذه الخاصية لـ GelMA تشكيل شبكات هيدروجيل مستقرة، مما يجعله مناسبًا لإنشاء هياكل ثلاثية الأبعاد تحاكي بيئة الورم الدقيقة (TME). تجعل الخصائص الميكانيكية والبيوكيميائية القابلة للتعديل لهيدروجيل GelMA، والتوافق الحيوي، والقدرة على دعم نمو الخلايا منها أدوات قيمة لدراسة سلوك خلايا السرطان، وغزو الورم، واختبار الأدوية، وغيرها من جوانب أبحاث السرطان. طور كيم وزملاؤه [109] نموذج زراعة خلايا ثلاثي الأبعاد للمثانة من خلال استخدام مصفوفة خلوية جديدة ومفاعل حيوي. تم استخدام GelMA كهيكل ثلاثي الأبعاد لزراعة خلايا سرطان المثانة، مع ارتفاع هيكل مثالي يبلغ 0.08 مم ووقت ربط يبلغ 120 ثانية [110]. بعد ذلك، تم زراعة خلايا 5637 وT24 في بيئات ثنائية وثلاثية الأبعاد وتعرضت لعلاجات دوائية باستخدام الراباميسين وبكتيريا كالميت-غرين (BCG). وُجد أن نموذج زراعة خلايا سرطان المثانة ثلاثي الأبعاد أظهر عملية إنشاء أسرع وثباتًا أكبر مقارنة بالنموذج ثنائي الأبعاد. علاوة على ذلك، أظهرت خلايا السرطان المزروعة في بيئة ثلاثية الأبعاد مقاومة متزايدة للأدوية وحساسية منخفضة مقارنة بالخلايا المزروعة في بيئة ثنائية الأبعاد. بالإضافة إلى ذلك، لاحظ الباحثون تفاعل الخلايا مع بعضها البعض ونشاطًا قاعديًا في النموذج ثلاثي الأبعاد، مما يشبه البيئة داخل الجسم.
على نفس المنوال، قام آريا وآخرون [111] بالتحقيق في ملاءمة هلاميات GelMA كنظم زراعة ثلاثية الأبعاد في المختبر لنمذجة الخصائص الرئيسية للانتقال.
تقدم سرطان الثدي، تحديدًا الغزارة والاستجابة للعلاج الكيميائي. تم ضبط الخصائص الميكانيكية والشكلية للهيدروجيل من خلال تغيير نسبة GelMA المستخدمة. أظهرت اختبارات الضغط أن صلابة
or الضغط. في الجيلاتين الأكثر صلابة، أدت الهياكل المضغوطة إلى تكوين كريات أصغر مقارنة بالتروية وحدها، بينما لم يكن للضغط تأثير كبير في الجيلاتين الأكثر ليونة. أظهر التلوين المناعي تعبير البروتينات المرتبطة بالانتقال العظمي داخل الكريات، بما في ذلك الأوستيوپونتين، وبروتين هرمون الغدة الجار درقية، والفبرونكتين. كان علامة التكاثر Ki67 موجودة في جميع الكريات في اليوم الرابع. اختلفت شدة تلوين Ki67 اعتمادًا على ظروف الثقافة وصلابة الجيلاتين. وأبرزت الحساسية الميكانيكية لخلايا سرطان الثدي 4T1 وأظهرت كيف يمكن أن تؤثر المحفزات الميكانيكية على تكاثرها وتعبير البروتينات داخل المواد اللينة التي تحاكي الخصائص الميكانيكية لنخاع العظام. وأكدت النتائج على دور البيئة الميكانيكية في العظام لكل من نماذج السرطان في الجسم الحي وفي المختبر.
من خلال صلابة الركيزة وسلوك الخلايا، يمكن للباحثين تطوير نماذج في المختبر أكثر واقعية تعكس بشكل أفضل البيئة الدقيقة للأورام الصلبة. يمكن أن تعزز هذه النماذج فهمنا لتطور السرطان وتساعد في تطوير العلاجات المستهدفة من خلال السماح بالتحقيق في تفاعلات الخلايا مع بعضها البعض وتفاعلات الخلايا مع المصفوفة في بيئة أكثر دقة.
هياكل الأنسجة الخالية من الخلايا
يمكن أن تعزز تقنيات مثل الميكروفلويديات أو أنظمة الأعضاء على شريحة الوظائف والأهمية لنماذج الأنسجة الخالية من الخلايا.
تساهم في فهمنا لسرطان القولون والمستقيم وبيولوجيا النقائل. توفر هذه النماذج، إلى جانب نماذج أخرى، رؤى قيمة حول التفاعل المعقد بين خلايا الورم والمصفوفة خارج الخلوية، مما يمهد الطريق لاكتشاف أهداف علاجية جديدة وتطوير استراتيجيات علاج شخصية للنقائل البريتونية.
مسارات. درس الباحثون الفروق في التنظيم فوق المجهري وتكوين ECM المشتق من الخلايا الميلانية (NGM-ECM) و ECM المشتق من الميلانوما (MV3-ECM). تم الكشف عن مستويات أعلى من التيناسين-C واللامينين وتعبير أقل عن الفيبرو نكتين في MV3-ECM. علاوة على ذلك، خضعت الخلايا البطانية المزروعة في MV3-ECM لتحولات شكلية وأظهرت زيادة في الالتصاق والحركة والنمو وتكوين الأنابيب. أدت التفاعلات بين الخلايا البطانية والمصفوفة الخلوية المنزوعة إلى تنشيط إشارة الإنتغرين، مما أدى إلى فسفرة كيناز الالتصاق البؤري (FAK) وارتباطه بـ Src (وهو بروتين غير مستقبل).
| طريقة | وكلاء أو تقنيات | وصف | المزايا | العيوب |
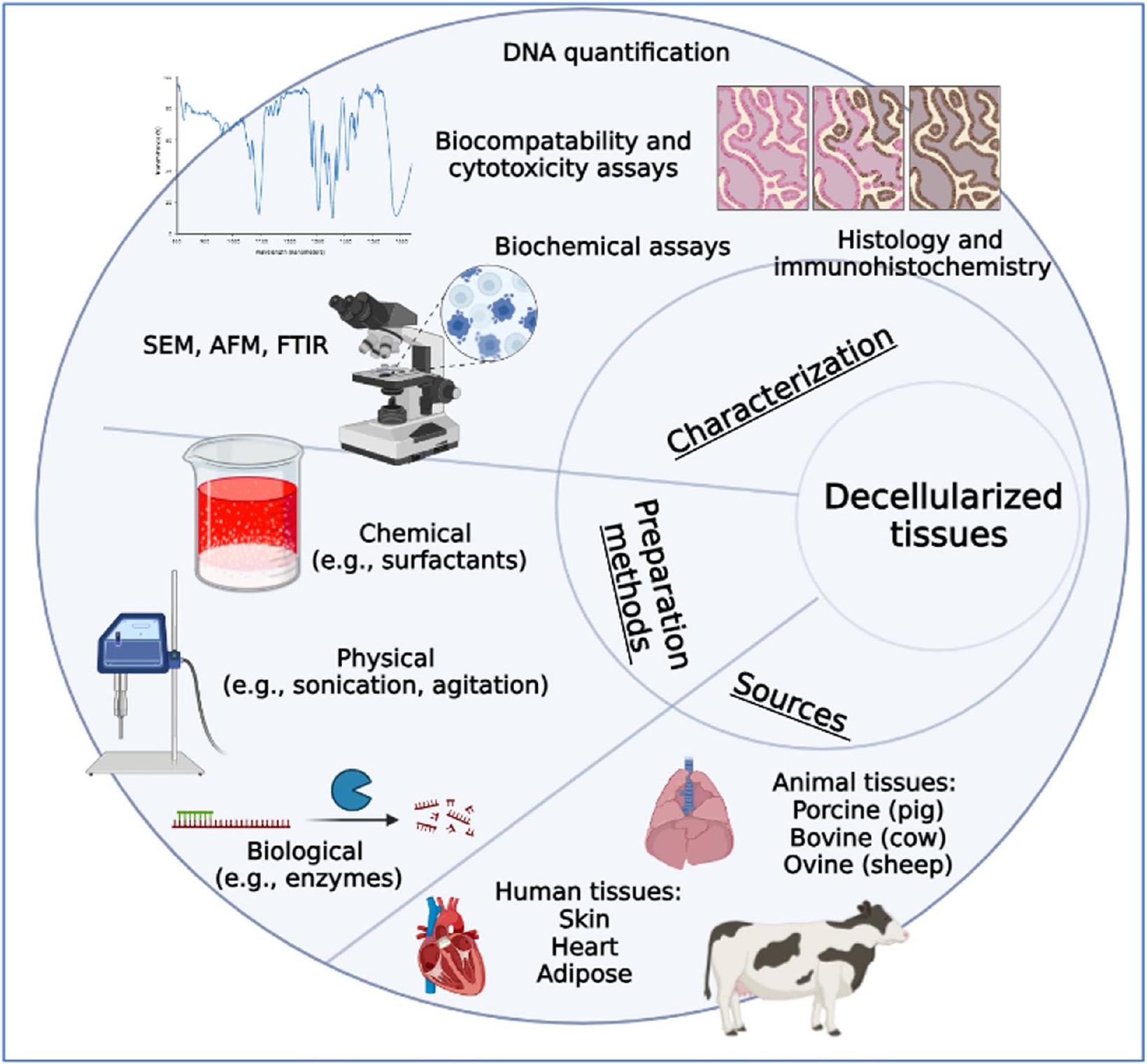
| طرق كيميائية | سلفات الدوديلي الصوديوم (SDS)، تريتون X-100، ديوكسيكولات الصوديوم. | يتضمن استخدام مجموعة متنوعة من العوامل الكيميائية التي تعطل أغشية الخلايا وتذيب البروتينات الخلوية، مما يسهل إطلاق المكونات الخلوية من الأنسجة مع الحفاظ على المصفوفة خارج الخلوية. | نسبيًا بسيط إزالة المواد الخلوية بكفاءة. | يجب تحسين اختيار العوامل الكيميائية وتركيزها بعناية لتجنب إتلاف المصفوفة خارج الخلوية والتأثير على سلامتها الهيكلية والوظيفية. |
| طرق فيزيائية | دورات التجمد والذوبان، الاهتزاز، الصوتنة، القوى الهيدروديناميكية. | تشمل القوى الميكانيكية أو العلاجات الفيزيائية لإزالة المكونات الخلوية. على سبيل المثال، تتسبب دورات التجميد والذوبان في تمزق أغشية الخلايا وإطلاق المحتويات الخلوية، بينما تستخدم طرق التحريك التحريك الميكانيكي أو الاهتزاز لإزاحة الخلايا من سطح الأنسجة. | لا تتطلب عوامل كيميائية قد تؤثر على تركيبة ECM. | قد يكون من الصعب إزالة جميع بقايا الخلايا تمامًا، بما في ذلك البروتينات داخل الخلايا والأحماض النووية. |
| طرق بيولوجية | نوكلياز (DNase، RNase) لتحطيم الأحماض النووية، بروتياز (مثل التربسين أو الكولاجيناز) لتفكيك البروتينات، وجليكوزيداز لإزالة الجليكوزامينوجليكان. | استخدم الإنزيمات لتفكيك المكونات الخلوية بشكل انتقائي، مما يسهل إزالة الخلايا. | تقدم انتقائية في إزالة المكونات الخلوية ويمكن تخصيصها لتناسب أنسجة معينة أو تركيبات المصفوفة خارج الخلوية. | يتطلب تحسين دقيق لتركيزات الإنزيمات، وأوقات الحضانة، ودرجة الحرارة لضمان إزالة الخلايا بكفاءة مع الحفاظ على سلامة مصفوفة extracellular. |
الهياكل الهجينة
أداء خطوط خلايا الساركوما العظمية البشرية (MG63 و SAOS-2) وخلايا السركومة الجذعية الغنية ضمن هذه النماذج المعقدة لزراعة الخلايا ثلاثية الأبعاد. تم استخدام تقنية التألق المناعي وتقنيات توصيف أخرى لتقييم استجابة خطوط خلايا الساركوما العظمية وخلايا السركومة الجذعية للهياكل البيولوجية المقلدة. أظهرت النتائج التكوين الناجح للكرات السركومية، وهي كريات مستقرة غنية بخلايا السركومة الجذعية، بحد أدنى من القطر
بيئة العظام الدقيقة. هذه النتائج أساسية لتطوير استراتيجيات علاجية مستهدفة ضد نقائل سرطان البروستاتا في العظام. أجرى باي وزملاؤه [142] دراسة قاموا فيها بإدماج أكسيد الجرافين (GO) في بوليمر مشترك من حمض الأكريليك-ج-حمض البولي لاكتيك (PAA-g-PLLA) لإنشاء هيكل استجابة للتحفيز. هذا الهيكل، المدمج مع PCL وحمض الجامبوغ (GA)، أظهر استجابة انتقائية تجاه الأورام وأظهر تراكمًا كبيرًا لـ GO/GA في خلايا سرطان الثدي (خلايا MCF-7) في ظروف حمضية (pH 6.8)، بينما أظهر تأثيرًا ضئيلًا على الخلايا الطبيعية (خلايا MCF-10A) عند pH الفسيولوجي (pH 7.4). كشفت الدراسة أيضًا أن الاستخدام التآزري للتحويل الضوئي الحراري المستجيب لـ pH كان أكثر فعالية في تثبيط نمو الورم مقارنة بالعلاجات المستقلة. أظهرت التجارب الحية تثبيطًا ملحوظًا للورم (تخفيض بنسبة 99% خلال 21 يومًا) من خلال تفتت أنسجة الورم، والتنكس، والتثبيط العام للورم عند العلاج بهياكل GO-GA المدمجة مع العلاج الضوئي الحراري، مقارنة بالمجموعات الضابطة أو تلك المعالجة إما بهياكل GO-GA أو الإشعاع تحت الأحمر القريب (NIR) بمفرده.
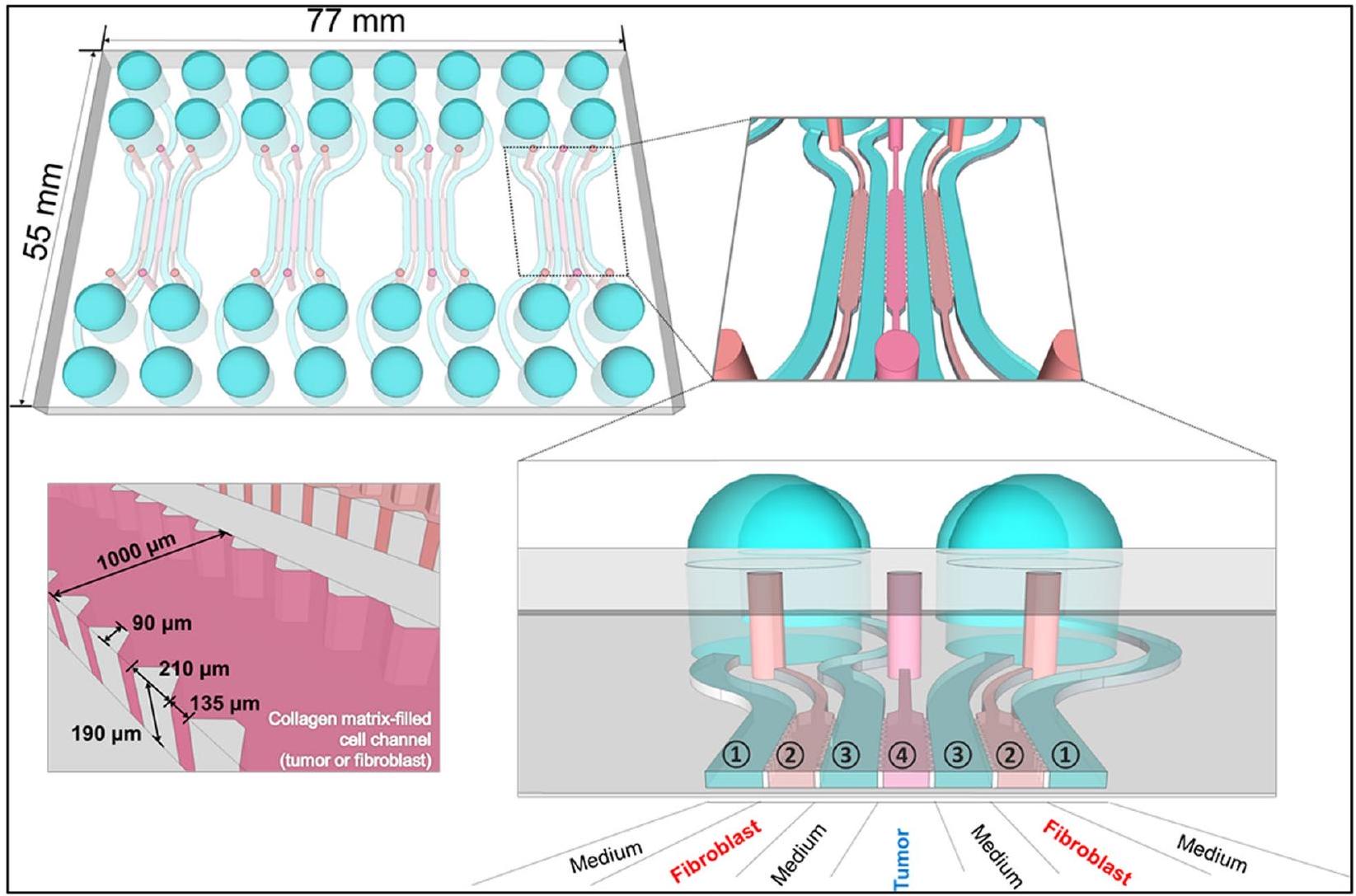
توفر الميكروفلويديات منصة متعددة الاستخدامات لزراعة الخلايا ثلاثية الأبعاد، حيث تقدم كل من الأساليب المعتمدة على الدعائم والأساليب الخالية من الدعائم. يمكن للباحثين تخصيص المنصة لتناسب المتطلبات المحددة لتجاربهم، سواء كانت تتضمن دعائم محملة بالخلايا أو تجمع الخلايا لتشكيل كتل كروية أو عضيات. يسمح الإعداد الميكروفلويدي بالتحكم الدقيق في البيئة الدقيقة، بما في ذلك تدفق المغذيات والأكسجين، فضلاً عن القدرة على إدخال تدرجات من جزيئات محددة. استخدم لي وآخرون [143] الطباعة اللينة لتصنيع لوحة قنوات ميكروفلويدية مكونة من 7 قنوات باستخدام بولي ديميثيل سيليكون (PDMS). داخل قنوات منفصلة، تم زراعة خلايا سرطان البنكرياس PANC-1 وخلايا النجمية البنكرياسية (PSCs) داخل مصفوفة الكولاجين I. لاحظت الدراسة تشكيل كتل كروية ثلاثية الأبعاد بواسطة خلايا PANC-1 خلال خمسة أيام. ومن المثير للاهتمام، أن وجود PSCs المزروعة معًا أدى إلى زيادة عدد الكتل الكروية، مما يشير إلى تأثير محتمل لـ PSCs على نمو الورم. في إعداد الزراعة المشتركة، أظهرت PSCs تعبيرًا مرتفعًا عن
كشفت عن تفاعل معقد بين خلايا PANC-1 وخلايا PSCs داخل البيئة المجهرية للورم. ومع ذلك، أظهر الجمع بين الجيمسيتابين والباكليتاكسيل وعدًا في التغلب على المقاومة وكبح نمو الورم. إن تداعيات هذه النتائج مهمة لفهم التفاعل المعقد بين خلايا الورم والخلايا الداعمة المحيطة بها داخل البيئة المجهرية للورم. تلعب تفاعلات الورم والدعامة دورًا حاسمًا في تقدم السرطان واستجابة العلاج. يسمح استخدام نماذج الزراعة المشتركة ثلاثية الأبعاد المعتمدة على الميكروفلويديك للباحثين بإعادة تمثيل الظروف داخل الجسم بشكل أفضل، مما يوفر تمثيلًا أكثر دقة لسلوك الورم واستجابات العلاج.
| الهيدروجيل (الأصل) | نوع السرطان/خط الخلايا | الهدف (الأهداف) | النتائج | المراجع | |||
| هلام الأجاروز (طبيعي) | سرطان البروستاتا/ PC3، DU145 | لمقارنة تعبير العلامات الرئيسية لعملية التحول الظهاري (أي، E-cadherin، N-cadherin، الأكتين العضلي الأملس (a-SMA)، الفيمنتين، Snail، Slug، Twist، و Zeb1) في زراعة الخلايا ثنائية الأبعاد مقابل ثلاثية الأبعاد. | – لوحظت اختلافات كبيرة في الشكل والظواهر بين الخلايا المزروعة في طبقات ثنائية الأبعاد مقابل الكريات ثلاثية الأبعاد. – انخفاض تعبير علامات النمط الظاهري الميزانشيمي في الثقافة ثلاثية الأبعاد. | [125] | |||
| الكولاجين الأول (طبيعي) | ورم الأرومة العصبية / SH-SY5Y | لمقارنة آليات النمو وتعبير الجينات لخلايا الورم العصبي البشري SHSY5Y في الثقافات ثنائية الأبعاد مقابل الثقافات ثلاثية الأبعاد. |
|
[126] | |||
| الكولاجين الأول (طبيعي) | سرطان المبيض/ OV-2008 | لإعادة تلخيص بنية المصفوفة خارج الخلوية في ورم صلب والتحقيق في حركة الخلايا وقدرتها على الغزو واستجابتها للعلاج الكيميائي. |
|
[127] | |||
| ماتريجيل (طبيعي) | سرطان البنكرياس/ MCW670 | لإنشاء منصة ثلاثية الأبعاد لزراعة الأعضاء المستمدة من مرضى سرطان البنكرياس. | – سمح النموذج بالتحقيق الدقيق في تفاعلات الورم-الستروما وتفاعلات الورم-المناعة في نظام الأورغانويد. – لوحظ تنشيط يعتمد على الوقت للألياف السرطانية. | [128] | |||
| ماتريجيل (طبيعي) | سرطان المعدة / BGC-823 | لتقييم التأثيرات العلاجية للبروتينات المؤتلفة (مثل، مضاد EGFR ومضاد EGFR-iRGD) بالاشتراك مع العلاج الكيميائي (مثل، دوكسوروبيسين) على امتصاص الدواء وفعاليته في كريات الورم متعددة الخلايا. |
|
[129] | |||
| ماتريجيل (طبيعي) | أوستيوساكروما / MG-63 | للتحقيق في تأثيرات ترتيب الخلايا المتنوع في نموذج زراعة الخلايا ثلاثي الأبعاد. |
|
[130] |
| الهيدروجيل (الأصل) | نوع السرطان/خط الخلايا | الهدف (الأهداف) | النتائج | المراجع | |||
| ألياف الحرير تسار (طبيعي) | سرطان الكبد/ HEPG2 و HepR21 | لتقييم فعالية مصفوفة الفيبروين من حرير التيسار كشبكة ثقافة ثلاثية الأبعاد لخلايا سرطان الكبد. |
|
[131] | |||
| الخلايا في الجل في الورق (CiGiP) (اصطناعي) | سرطان الرئة/ A549 | لدراسة حساسية الأيض للخلايا تجاه الإشعاع المؤين باستخدام نموذج ثلاثي الأبعاد جديد قائم على الورق. أنشأ النموذج تدرجًا متناقصًا من الأكسجين والمواد المغذية عبر أكوام الورق، حيث كانت الخلايا العليا معرضة لبيئة غنية بالأكسجين. في المقابل، كانت الخلايا السفلية معرضة لظروف نقص الأكسجين. |
|
[132] | |||
| motifs ربط الإنتغرين الخلوية (ببتيدات RGD (اصطناعية) | سرطان المبيض / KLK4-7 | لتطوير نموذج ثلاثي الأبعاد يحاكي تكاثر الخلايا، استجابات البقاء، والتفاعلات مع الإنتغرينات في البيئة المجاورة للورم. | – أظهرت النتائج أن العلاج المشترك بين باكليتاكسيل وKLK/MAPK أظهر تأثيرات أكثر وضوحًا من العلاج الكيميائي بمفرده. | [١٣٣] | |||
| ببتيد RADA16-I (اصطناعي) | سرطان المبيض الظهاري / A2780، A2780/DDP، و SK-OV-3 | لتقييم فعالية سقالة الألياف النانوية كمضيف لزراعة الخلايا ثلاثية الأبعاد وتأثير المادة على التصاق الخلايا، الشكل، الهجرة، والحساسية للأدوية. |
|
[105] | |||
| مصفوفة الأنسجة الخالية من الخلايا | نوع السرطان/ خط الخلايا | الهدف (الأهداف) | الحكام | ||||
| الغشاء المخاطي والطبقة تحت المخاطية للأمعاء الدقيقة | سرطان الرئة / HCC827 و A549 | لإنشاء نموذج ثلاثي الأبعاد يتيح خيارات قراءة متعددة، لمراقبة التغيرات في إشارات الخلايا، والتكاثر، والموت الخلوي استجابةً للأدوية. |
|
| الجدول 7 (مستمر) | |||||||
| مصفوفة الأنسجة غير الخلوية | نوع السرطان/ خط الخلايا | الهدف (الأهداف) | النتائج | الحكام | |||
| الأنسجة الدهنية | سرطان الثدي / MCF-7، SKBR3، BT474 | لإنشاء هيكل ثلاثي الأبعاد يشبه بيئة سرطان الثدي. |
|
[135] | |||
| نسيج الدهون في الجرذ | غليوبلاستوما/T98G؛ هيرباتوما بشري/Hep3B؛ أدينوكارسينوما القولون/WiDr | لتحقيق سلوك الخلايا في خطوط خلايا السرطان المختلفة في المختبر باستخدام منصة مستمدة من الأنسجة الدهنية غير الخلوية. |
|
[136] | |||
| نسيج سرطان القولون والمستقيم وطبقة المخاط الصحية للقولون | سرطان القولون والمستقيم / خلايا HT29 و HCT116 | لإنشاء نموذج ثلاثي الأبعاد مشتق من المرضى يمكن استخدامه لتقييم الأدوية في سرطان القولون. |
|
[137] | |||
| الجدول 7 (مستمر) | ||||||||||
| مصفوفة الأنسجة المنزوعة الخلايا | نوع السرطان/ خط الخلايا | الهدف (الأهداف) | النتائج | الحكام | ||||||
| أنسجة الكبد السليمة والمصابة بالتشمع | سرطان الخلايا الكبدية / خلايا HCC | لفحص وتحديد الخصائص المميزة لبيئة المصفوفة خارج الخلوية للكبد البشري المصاب بالتشمع، والتي تعزز تطور سرطان الكبد الخلوي. |
|
[138] | ||||||
| نسيج لسان الحيوان | سرطان الخلايا الحرشفية في اللسان / CAL27 | لتقييم جدوى استخدام مصفوفة الأنسجة الخلوية المنزوعة من اللسان في أبحاث سرطان الخلايا الحرشفية في اللسان وتجديد اللسان. | – لوحظ غنى كبير في إشارات الإنتجرين في مصفوفة extracellular للسان. بالإضافة إلى تأثيره على بقاء الخلايا وتكاثرها، كانت لمصفوفة extracellular للسان أيضًا تأثيرات منسقة على التفاعلات بين الخلايا والمصفوفة extracellular والخلايا المجاورة، مما يؤثر على نمط ومدى حركة الخلايا. | [139] | ||||||
| مصفوفة الأنسجة الخالية من الخلايا | نوع السرطان/ خط الخلايا | الهدف (الأهداف) | النتائج | الحكام | ||||
| نسيج صدر الخنزير | سرطان الثدي / MCF-7 و hAMSCs | لإنشاء هياكل ثدي خالية من الخلايا غنية بالجليكوزامينوجليكان (GAGs) والكولاجين. |
|
[140] | ||||
| مصفوفة الأنسجة الخالية من الخلايا | نوع السرطان/خط الخلايا | الهدف (الأهداف) | النتائج | المراجع | ||||
| الغشاء المخاطي والطبقة تحت المخاطية للأمعاء الدقيقة | سرطان الرئة / HCC827 و A549 | لإنشاء نموذج ثلاثي الأبعاد يتيح خيارات قراءة متعددة، لمراقبة التغيرات في إشارات الخلايا، والتكاثر، والموت الخلوي استجابةً للأدوية. |
|
[134] | ||||
| الأنسجة الدهنية | سرطان الثدي / MCF-7، SKBR3، BT474 | لإنشاء هيكل ثلاثي الأبعاد يشبه بيئة سرطان الثدي. |
|
[135] | ||||
| نسيج الدهون في الجرذ | غليوبلاستوما/T98G؛ ورم الكبد البشري/ Hep3B؛ أدينوكارسينوما القولون/ WiDr | لتحقيق سلوك الخلايا في خطوط خلايا السرطان المختلفة في المختبر باستخدام منصة مستمدة من الأنسجة الدهنية غير الخلوية. |
|
[136] |
| مصفوفة الأنسجة المنزوعة الخلايا | نوع السرطان/خط الخلايا | الهدف (الأهداف) | النتائج | المراجع | ||||||
| نسيج سرطان القولون والمستقيم وطبقة المخاط الصحية للقولون | سرطان القولون والمستقيم / خلايا HT29 و HCT116 | لإنشاء نموذج ثلاثي الأبعاد مشتق من المرضى يمكن استخدامه لتقييم الأدوية في سرطان القولون. |
|
[137] | ||||||
| أنسجة الكبد السليمة والمصابة بالتشمع | سرطان الخلايا الكبدية / خلايا HCC | لفحص وتحديد الخصائص المميزة لبيئة المصفوفة خارج الخلوية للكبد البشري المصاب بالتشمع، والتي تعزز تطور سرطان الكبد الخلوي. |
|
[138] |
| مصفوفة الأنسجة غير الخلوية | نوع السرطان/خط الخلايا | الهدف (الأهداف) | النتائج | ||
| نسيج لسان الحيوان | سرطان الخلايا الحرشفية في اللسان / CAL27 | لتقييم جدوى استخدام مصفوفة الأنسجة الخلوية المنزوعة من اللسان في أبحاث سرطان الخلايا الحرشفية في اللسان وتجديد اللسان. | – لوحظ إثراء كبير في إشارات الإنتجرين [139] في مصفوفة extracellular للسان. بالإضافة إلى تأثيره على بقاء الخلايا وتكاثرها، فإن مصفوفة extracellular للسان أثرت أيضًا بشكل منسق على التفاعلات بين الخلايا والمصفوفة extracellular والخلايا المجاورة، مما يؤثر على نمط ومدى حركة الخلايا. | ||
| نسيج صدر الخنزير | سرطان الثدي / MCF-7 و hAMSCs | لإنشاء هياكل ثدي خالية من الخلايا غنية بالجليكوزامينوجليكان (GAGs) والكولاجين. |
|
التحديات وآفاق المستقبل
| طريقة تصنيع الأجهزة الميكروفلويدية | نوع السرطان/خط الخلايا | الهدف (الأهداف) | النتائج | المراجع | ||
| الطباعة الضوئية القياسية | سرطان الثدي / MDA-MB-231 | لإنشاء مصفوفة تحفز البيئة المجهرية للورم. |
|
[84] | ||
| الطباعة الضوئية القياسية | سرطان الرئة / SPCA-1 و HFL1 | لتطوير زراعة خلايا ثلاثية الأبعاد في جهاز ميكروفلويديك يسمح بالاختبار المتوازي لمختلف العلاجات الكيميائية. |
|
[85] | ||
| الطباعة الضوئية الناعمة | سرطان الثدي / MCF-7 | لإنشاء نموذج ثلاثي الأبعاد باستخدام هياكل الهيدروجيل في آبار دقيقة، ولتقييم الفعالية العلاجية، والتوزيع، واختراق دوكسوروبيسين في زراعة الخلايا ثلاثية الأبعاد. |
|
[146] | ||
| أكسدة البلازما ذات الضغط المنخفض | سرطان الرئة/ H292 | لتقييم المؤشر العلاجي للأجسام المضادة المضادة لمستقبلات EGFR سيتوكسيماب باستخدام اختبار زراعة الأنسجة البشرية. | -إن دمج نموذج ورمي مع نموذج مصغر من جلد الإنسان الوظيفي أنشأ منصة اختبار مثالية لتقييم فعالية مثبطات EGFR وعلاجات واعدة أخرى في مجال الأورام. | [147] | ||
| الطباعة الضوئية متعددة الطبقات | سرطان المبيض عالي الدرجة / OVCAR-8، FTSEC | لإنتاج جهاز ميكروفلويدي مصمم خصيصًا لعزل الإكسوزومات من عينات مصل المرضى والخلايا المزروعة. | -يمكن أن يسهل المقياس المجهري تحديد وعزل العلامات الحيوية المستمدة من الإكسوزومات، والتي يمكن استخدامها في اختبارات الكشف المبكر عن سرطان المبيض الحليمي عالي الدرجة. | [148] |
علاوة على ذلك، تعتبر إمكانية الوصول إلى الأكسجين اعتبارًا حاسمًا في طرق زراعة الخلايا ثلاثية الأبعاد، وتنوعه داخل هذه البيئات يمثل تحديًا كبيرًا في تكرار الظروف الفسيولوجية والحصول على نتائج تجريبية دقيقة. غالبًا ما تواجه الخلايا الموجودة في داخل الهياكل ثلاثية الأبعاد، مثل الكريات، توفرًا محدودًا من الأكسجين بسبب عوامل البيئة الدقيقة (أي، تتطور الكريات الورمية بشكل طبيعي إلى مناطق ناقصة الأكسجين بسبب التوعية غير المنتظمة في الأورام) وحواجز الانتشار (مثل، الخلايا المعبأة بكثافة، المصفوفات خارج الخلية، هياكل الدعم) [153]. مع تكاثر الخلايا وتشكيلها لهياكل ثلاثية الأبعاد، تزداد الحاجة إلى الأكسجين بسبب الحجم الأكبر الذي يجب أن يقطعه الأكسجين. يصبح انتشار الأكسجين من وسط الزراعة المحيط معوقًا بشكل متزايد مع زيادة المسافة من سطح الزراعة إلى داخل الهيكل ثلاثي الأبعاد. وهذا يؤدي إلى تدرج في الأكسجين، حيث تمتلك الخلايا القريبة من المحيط كمية كافية من الأكسجين، ولكن تلك الموجودة في القلب تواجه نقصًا في الأكسجين، مما يؤدي إلى نقص الأكسجين. غالبًا ما تظهر خلايا القلب الناقصة الأكسجين تعبيرًا جينيًا متغيرًا، وتكاثرًا منخفضًا، وتغيرات في المسارات الأيضية عندما تدخل في حالة سكون وتتوقف عن الدورة عندما تُحرم من الأكسجين والمواد الغذائية. تجعل هذه النشاطات المنخفضة منها مقاومة نسبيًا للأدوية الساكنة التي تستهدف بشكل أساسي الخلايا التي تنقسم بنشاط، مما يؤدي إلى زيادة مقاومة الأدوية، كما هو الحال غالبًا في الأورام الصلبة [154، 155]. يمكن استخدام المجهر الضوئي المجهري لرؤية الخلايا الساكنة عن طريق وسمها بنظير نوكليوزيد، مما يسمح بتحديد كميتها وتمييزها عن الخلايا التي تنقسم بنشاط
الخلايا. يتم تخفيف هذا النظير في الخلايا التي تنقسم بنشاط. ومع ذلك، فإنه يبقى محتفظًا به في خلايا السرطان الساكنة وغير المنقسمة، مما يوفر أداة قيمة لتمييزها عن الخلايا المحيطة التي تنقسم بنشاط [156]. من خلال الاستفادة من هذه الخاصية للكريات ثلاثية الأبعاد، فإنها تقدم طرقًا محتملة لتطوير علاجات جديدة تستهدف خلايا السرطان المقاومة للأدوية الساكنة المضادة للسرطان. قام وينزل وآخرون [157] بزراعة خلايا سرطان الثدي T47D في زراعات ثلاثية الأبعاد واستخدموا التصوير المجهري التداخلي لتمييز الخلايا داخل القلب الداخلي عن تلك الموجودة في القلب الخارجي المحيط. أظهرت الخلايا في القلب الداخلي، التي تعاني من وصول محدود إلى الأكسجين والمواد الغذائية، نشاطًا أيضيًا منخفضًا مقارنة بنظيراتها في القلب الخارجي. من خلال فحص مكتبات الجزيئات الصغيرة ضد هذه الزراعات ثلاثية الأبعاد، حدد المؤلفون تسعة مركبات تستهدف وتقتل خلايا سرطان القلب الداخلي بشكل انتقائي بينما تترك الخلايا الخارجية الأكثر انقسامًا. أثرت الأدوية المحددة بشكل أساسي على مسار سلسلة التنفس، مما يتماشى مع النشاط الأيضي المتغير للخلايا التي تعاني من نقص الأكسجين والتي تنتقل من الأيض الهوائي إلى الأيض اللاهوائي. وبالتالي، فإن المركبات التي تستهدف خلايا السرطان الساكنة بشكل انتقائي حسنت بشكل كبير من فعالية الأدوية الساكنة المضادة للسرطان المستخدمة عادة. بدلاً من ذلك، يمكن استخدام أجهزة ميكروفلويديك التي تمكن من إنشاء تدرجات أكسجين محكومة داخل الزراعات، ودمج مواد قابلة لاختراق الأكسجين، وإضافة مركبات تطلق الأكسجين لتوفير توزيع أكثر تجانسًا للأكسجين في المختبر. ومع ذلك، من المهم الاعتراف بأن هذه الاستراتيجيات قد لا تعيد إنتاج تعقيد تدرجات الأكسجين في الأنسجة الحقيقية بالكامل [158]. قدم بويز وآخرون [159] تصميمًا وتوصيفًا لجهاز معياري استغل خصائص نفاذية الغاز من السيليكون لإنشاء تدرجات أكسجين داخل المناطق المحتوية على خلايا. تم بناء الجهاز المجهري عن طريق تكديس صفائح الأكريليك المطبوعة بالليزر وصفائح مطاط السيليكون، حيث لم يسهل السيليكون فقط تشكيل تدرجات الأكسجين ولكن أيضًا عمل كحاجز، يفصل الغازات المتدفقة عن وسط زراعة الخلايا لمنع التبخر أو تكوين الفقاعات خلال فترات الحضانة الممتدة. قدمت مكونات الأكريليك استقرارًا هيكليًا، مما يضمن بيئة زراعة معقمة. باستخدام أفلام استشعار الأكسجين، يمكن تحقيق تدرجات ذات نطاقات وزوايا مختلفة في الجهاز المجهري عن طريق ضبط تركيبة الغازات المتدفقة عبر عناصر السيليكون. علاوة على ذلك، أظهرت تجربة قائمة على الخلايا أن الاستجابات الخلوية لنقص الأكسجين كانت متناسبة مباشرة مع توتر الأكسجين الذي تم إنشاؤه داخل النظام، مما يثبت الفعالية.
دعائم الهيدروجيل القابلة للتحلل دمج روابط قابلة للكسر و/أو مكونات قابلة للتفكيك في الهيكل البوليمري أو دمج مكونات ECM القابلة للتحلل بشكل طبيعي مثل حمض الهيالورونيك، واللامينين، والفبرونيكتين، والكولاجين [160]. ومع ذلك، فإن تقنيات التفكيك التقليدية تثبت أنها غير فعالة بشكل ملحوظ وتتأثر بالتعقيدات الهيكلية الفطرية لنظام الزراعة. يعتبر التحلل الإنزيمي، على سبيل المثال بواسطة الكولاجيناز، طريقة مستخدمة على نطاق واسع لاسترجاع الخلايا من دعائم زراعة الخلايا ثلاثية الأبعاد المعتمدة على الكولاجين. يتم اختيار الإنزيم ليتناسب مع نوع الكولاجين المحدد في الدعامة. خلال الحضانة، يقوم الكولاجيناز بتفكيك ألياف الكولاجين إنزيميًا، مما يحرر الخلايا التي كانت مدمجة أو ملتصقة بهذه الألياف. بمجرد أن يتم تفكيك الكولاجين، يتم جمع الخلايا كتعليق في وسط الزراعة [161]. عادةً ما يتم إجراء تقييمات لسلامة الخلايا ووظيفتها للحفاظ على صحة الخلايا ووظيفتها. بينما يعتبر استخدام التحلل الإنزيمي لدعائم زراعة الخلايا ثلاثية الأبعاد شائعًا، إلا أنه يظل نهجًا معقدًا مرتبطًا بعدة قيود. من المهم عدم التقليل من تأثير الكولاجيناز أو الإنزيمات الأخرى على سلامة الخلايا ووظيفتها. إن تحسين وقت الهضم وتركيز الإنزيم بعناية أمر ضروري لتحقيق توازن بين تفكيك الدعامة بكفاءة والحفاظ على جودة الخلايا [162]. بالإضافة إلى ذلك، فإن التغيرات المحتملة في نمط الخلايا أثناء الهضم تمثل مصدر قلق كبير، مما يتطلب مراقبة دقيقة لمعايير الهضم. في الدعائم ثلاثية الأبعاد المعقدة، وخاصة تلك ذات الهياكل المعقدة، قد يكون التحلل الإنزيمي أقل فعالية، مما يدفع الباحثين لاستكشاف طرق استرجاع بديلة أو تعديل عملية الهضم. كما تلعب الاعتبارات الأخلاقية دورًا، خاصة عند العمل مع خلايا مشتقة من البشر أو الحيوانات، مما يثير القلق بشأن استخدام إنزيمات مثل الكولاجيناز. الالتزام بالإرشادات الأخلاقية واللوائح المؤسسية أمر حاسم للحفاظ على ممارسات البحث المسؤولة والأخلاقية.
تظهر الطريقة المعتمدة على NFC إنتاجًا مشابهًا للـ EV لكل خلية، مما يوفر قابلية التوسع، ويحافظ على نمط الخلية وسلامتها، ويزيد من بساطة التشغيل، مما يؤدي في النهاية إلى زيادة إنتاجية الـ EV. تعتمد طريقة أخرى على التحلل الذي تسببه الخلايا للهياكل الهلامية، حيث تقوم الخلايا الحية بتفكيك الهيكل الهلامي بنشاط. تعتبر هذه الآلية التحليلية ذات صلة خاصة في هندسة الأنسجة والطب التجديدي. عندما يتم احتواء الخلايا داخل هيكل هلامي، يمكنها إفراز إنزيمات وجزيئات أخرى تتفاعل مع مكوناته، مما يؤدي إلى تحلله التدريجي. مع تكاثر الخلايا وإعادة تشكيل بيئتها الدقيقة، قد تقوم بتغيير خصائص الهيكل وفي النهاية تسهل تحلله. تسمح هذه العملية الديناميكية بالإفراج المنظم عن الخلايا وعوامل النمو وغيرها من المواد الحيوية النشطة داخل الهلام، مما يجعلها تقنية قيمة لتطبيقات توصيل الأدوية.
بعض الفحوصات البيوكيميائية المتطورة جيدًا لأنظمة ثلاثية الأبعاد. تميل الخلايا إلى التجمع في كتل كثيفة و/أو كبيرة مع مرور الوقت، حتى في الدعائم المسامية الكبيرة، مما يسبب قيودًا في الانتشار عند إجراء فحوصات التوصيف في الموقع. تنشأ القيود بسبب عرقلة الانتشار وحصر الغازات والمواد المغذية والنفايات والمواد الكيميائية داخل النظام، بالإضافة إلى التحديات عند قياس وتطبيع البيانات بين الثقافات البيولوجية المقلدة المختلفة. على سبيل المثال، أظهر توتي وآخرون أن تقييم ثقافة خلايا سرطان البنكرياس في دعائم من رغوة البولي يوريثان المسامية الكبيرة باستخدام اختبار 3-(4،5-ثنائي ميثيل ثيازول-2-يل)-5-(3-كربوكسي ميثوكسي فينيل)-2-(4-سلفوفينيل)-2H-تيترازوليوم (MTS) أظهر اختلافات طفيفة بين ظروف الدعائم المختلفة (مثل طلاءات ECM على الدعائم). ومع ذلك، كشفت عملية القطع، والتلوين المناعي، والتصوير عن تمايز أوضح في تكاثر الخلايا، والشكل، والنمو بين الظروف. وبالمثل، فشل اختبار 3-(4،5-ثنائي ميثيل ثيازول-2-يل)-2،5-ثنائي فينيل-2H-تيترازوليوم بروميد (MTT) في التقاط الاختلافات في حيوية خلايا البنكرياس المزروعة في دعائم البولي يوريثان بعد فحص الأدوية والإشعاع، والتي تم إدراكها باستخدام المجهر المتقدم والتصوير. لذلك، من الضروري أن يأخذ الباحثون في الاعتبار بعناية النهج التحليلي المناسب الذي يتماشى مع أهداف دراستهم قبل البدء في تحليل أي ثقافات ثلاثية الأبعاد. كما يجب أن يكونوا على دراية بأن بعض الأساليب الكلاسيكية المعتمدة المستخدمة في الثقافات ثنائية الأبعاد قد لا تكون قابلة للتطبيق مباشرة في البيئات ثلاثية الأبعاد، كما أظهر حمدي وآخرون أنه من غير الممكن استخراج الخلايا من الكتل الكروية لاختبارات تشكيل المستعمرات، والتي تستخدم لتطوير منحنيات البقاء بعد العلاج. وبالتالي، اقترح الباحثون قراءات التوصيف في الموقع، والتي هي جديدة و/أو مختلفة عن بروتوكولات الثقافة ثنائية الأبعاد الحالية.
مكانيًا وزمانيًا داخل الكُرَيَّات، مما يجعل من الصعب تتبع وتفسير التغيرات في تعبير العلامات على مر الزمن. بالإضافة إلى ذلك، في الكُرَيَّات الأكبر، قد لا تخترق علامات الخلايا الجذعية بشكل فعال قلب الكُرَيَّة، مما يحد من القدرة على تقييم مجموعة الخلايا الجذعية في المناطق الداخلية. يمكن للباحثين استخدام عدة استراتيجيات للتغلب على هذه التحديات واستخدام علامات الخلايا الجذعية بفعالية في ثقافات الكُرَيَّات ثلاثية الأبعاد. تتضمن طريقة بديلة دمج الخلايا الجذعية وعلامات خلوية أخرى لفهم أفضل للتكوين الخلوي داخل الكُرَيَّة. يمكن أن تساعد هذه الطريقة متعددة العلامات في التخفيف من المشكلات المتعلقة بتنوع العلامات. علاوة على ذلك، يمكن أن توفر تقنيات التصوير الحي، مثل المجهر الضوئي المجهري، رؤى في الوقت الحقيقي حول ديناميات تعبير العلامات داخل الكُرَيَّات. يعد التحكم في حجم الكُرَيَّات استراتيجية أخرى لتعزيز اختراق العلامات والوصول إلى الخلايا الداخلية. يسمح استخدام تقنيات الميكروفلويديك بتنظيم دقيق لحجم الكُرَيَّات، مما يضمن اختراقًا فعالًا للعلامات في جميع مناطق الكُرَيَّة. بالإضافة إلى ذلك، تمكّن طرق تحليل الخلايا الفردية، مثل تسلسل RNA للخلايا الفردية والتحليل البروتيني، من توصيف الخلايا الفردية داخل الكُرَيَّات. يمكن أن تحدد هذه الطريقة أنماط التعبير الجيني أو البروتيني الفريدة وتسلط الضوء على سلوك مجموعات الخلايا الجذعية. استراتيجية قيمة أخرى هي إنشاء كُرَيَّات مع مراسلين جينيين للخلايا الجذعية، والتي تنتج إشارات فلورية أو مضيئة في الخلايا الجذعية، مما يجعلها أكثر وضوحًا وقابلية للتتبع. أخيرًا، يمكن أن يساعد تقليد مكان الخلايا الجذعية أو البيئة الدقيقة ضمن ظروف الثقافة ثلاثية الأبعاد في الحفاظ على خصائص الخلايا الجذعية وتعبير العلامات في الكُرَيَّات.
لقد تم إحراز تقدم كبير في إنشاء هياكل ديناميكية يمكن أن تستجيب أو توجه الخلايا المقيمة. على سبيل المثال، أثبتت الهلاميات الحرارية مثل بولي-نيسوبروبيل أكريلاميد (pNIPAm) فعاليتها في جمع تجمعات الخلايا. علاوة على ذلك، ساهم دمج تقنيات المقياس المجهري لزراعة الخلايا مع تصاميم الهلاميات القابلة للتكيف في تسهيل العديد من التحقيقات. تشمل هذه التحقيقات دراسة هجرة الخلايا داخل الهلاميات الميكروفلويدية وإقامة منصات فحص عالية الإنتاجية لاستكشاف التفاعلات بين الخلايا والمواد. ومن الجدير بالذكر أن مجال الميكانيوبولوجيا مهتم بمجموعة متنوعة من الهلاميات الديناميكية ميكانيكياً التي يمكن أن تتصلب أو تطرى أو تنتقل بشكل عكسي بين هذه الحالات لدراسة استجابات الخلايا. توفر هذه الركائز الديناميكية وسيلة لفحص كيفية تأثير الإشارات الميكانيكية على سلوك الخلايا، مشابهة لدراسة العوامل القابلة للذوبان على مدى عقود. كما تتقدم التقنيات لإدخال التباين وأنواع الخلايا المتعددة داخل الهياكل ثلاثية الأبعاد. يشمل ذلك طرقاً مبتكرة حيث تعمل الهلاميات كحبر حيوي لطباعة الخلايا، إما طبقة تلو الأخرى من قاعدة ثنائية الأبعاد أو مباشرة داخل فضاء ثلاثي الأبعاد محاط بهلام آخر. مع تقدم هذه المنصات، من المتوقع أن تصبح أكثر سهولة في الوصول. في هذه الأثناء، يبقى من الضروري الحفاظ على حوار مفتوح وتعاوني بين علماء الخلايا وعلماء المواد والمهندسين. ستضمن هذه الجهود التعاونية أن تكون الجيل القادم من أنظمة زراعة الخلايا ثلاثية الأبعاد المعتمدة على الهياكل مجهزة جيدًا لمواجهة التحديات الكبيرة التي تطرحها التعقيدات البيولوجية والتقنية المتزايدة.
الخاتمة
يمكن أن تمكّن الإفراج المنظم عن الأدوية وعوامل النمو، مما يسهل فحص الأدوية وتطوير العلاجات المستهدفة. علاوة على ذلك، توفر الهيدروجيل توافقًا حيويًا عاليًا ويمكن تفعيله بإشارات حيوية لتوجيه سلوك الخلايا وتكوين الأنسجة. في أبحاث السرطان، توفر الهيدروجيل منصة للتحقيق في تأثير الإشارات الميكانيكية على نمو الورم، وتسلل خلايا المناعة، وتكوين الأوعية الدموية. بالإضافة إلى ذلك، فإن سهولة دمج أنواع خلايا متعددة داخل الهيدروجيل يمكّن من دراسة تفاعلات الورم مع النسيج المحيط. وبالمثل، تحتفظ الدعائم النسيجية غير الخلوية بتكوين ECM الأصلي، والتضاريس، والخصائص الميكانيكية، مما يحاكي عن كثب البيئة الدقيقة الطبيعية للورم. نتيجة لذلك، يمكن أن تظهر خلايا السرطان المزروعة في الدعائم النسيجية غير الخلوية سلوكيات ورمية أكثر دقة، بما في ذلك الغزو وتكوين الأوعية. علاوة على ذلك، يمكن أن تُشتق هذه الدعائم من أنسجة محددة للمرضى، مما يمكّن من اتباع نهج الطب الشخصي ويحسن من قابلية التنبؤ باستجابة الأدوية. أخيرًا، توفر الدعائم الهجينة التي تدمج قنوات ميكروفلويديك مزايا فريدة لأبحاث السرطان. من خلال دمج زراعة الخلايا ثلاثية الأبعاد مع الميكروفلويديك، يمكن للباحثين دراسة تكوين الأوعية الدموية في الورم، والانتقال، واختراق الأدوية بطريقة أكثر ملاءمة فسيولوجيًا. علاوة على ذلك، يمكن أن تسهل الميكروفلويديك الفحص عالي الإنتاجية للأدوية المضادة للسرطان، مما يمكّن من اختبار سريع وفعال من حيث التكلفة للعلاجات المحتملة.
شكر وتقدير
مساهمات المؤلفين
توفر البيانات
الإعلانات
المصالح المتنافسة
تفاصيل المؤلف
نُشر على الإنترنت: 14 يناير 2024
References
- Siegel RL, Miller KD, Fuchs HE, Jemal A. Cancer Statistics, 2021. CA Cancer J Clin. 2021;71(1):7-33.
- Grønning T. History of cancer. In: Colditz GA, editor. The sage encyclopedia of cancer and society. 2nd ed. CA: SAGE Publications, Inc.; 2015. p. 549-54.
- Guimarães* I dos S, Daltoé* RD, Herlinger AL, Madeira KP, LadislauT, Valadão IC, Junior PCML, Fernandes Teixeira S, Amorim GM, Santos DZ dos, Demuth KR, Rangel LBA. Conventional Cancer Treatment. Cancer Treatment-Conventional and Innovative Approaches. 2013; Available from: https://www.intechopen.com/chapters/42057.
- De Vita VT. The evolution of therapeutic research in cancer. N Engl J Med. 2010;298(16):907-10.
- Loessner D, Holzapfel BM, Clements JA. Engineered microenvironments provide new insights into ovarian and prostate cancer progression and drug responses. Adv Drug Deliv Rev. 2014;15(79):193-213.
- Xu X, Farach-Carson MC, Jia X. Three-dimensional in vitro tumor models for cancer research and drug evaluation. Biotechnol Adv. 2014;32(7):1256-68.
- Pickup MW, Mouw JK, Weaver VM. The extracellular matrix modulates the hallmarks of cancer. EMBO Rep. 2014;15(12):1243-53.
- Brassart-Pasco S, Brézillon S, Brassart B, Ramont L, Oudart JB, Monboisse JC. Tumor microenvironment: extracellular matrix alterations influence tumor progression. Front Oncol. 2020;10:397.
- Nazemi M, Rainero E. Cross-talk between the tumor microenvironment, extracellular matrix, and cell metabolism in cancer. Front Oncol. 2020;10.
- Jackson HW, Defamie V, Waterhouse P, Khokha R. TIMPs: versatile extracellular regulators in cancer. Nat Rev Cancer. 2017;17(1):38-53.
- Li J, Xu R. Obesity-associated ECM remodeling in cancer progression. Cancers (Basel). 2022;14(22):5684.
- Popovic A, Tartare-Deckert S. Role of extracellular matrix architecture and signaling in melanoma therapeutic resistance. Front Oncol. 2022;12.
- Gordon-Weeks A, Yuzhalin AE. Cancer extracellular matrix proteins regulate tumour immunity. Cancers (Basel). 2020;12(11):1-25.
- Romero-López M, Trinh AL, Sobrino A, Hatch MMS, Keating MT, Fimbres C, Lewis DE, Gershon PD, Botvinick EL, Digman M, Lowengrub JS, Hughes CCW. Recapitulating the human tumor microenvironment: colon tumor-derived extracellular matrix promotes angiogenesis and tumor cell growth. Biomaterials. 2017;116:118-29.
- Brown Y, Hua S, Tanwar PS. Extracellular matrix in high-grade serous ovarian cancer: advances in understanding of carcinogenesis and cancer biology. Matrix Biol. 2023;118:16-46.
- Frantz C, Stewart KM, Weaver VM. The extracellular matrix at a glance. J Cell Sci. 2010;123(Pt 24):4195-200.
- Langhans SA. Three-dimensional in vitro cell culture models in drug discovery and drug repositioning. Front Pharmacol. 2018;9(JAN):6.
- Rozario T, DeSimone DW. The extracellular matrix in development and morphogenesis: a dynamic view. Dev Biol. 2010;341(1):126-40.
- Luca AC, Mersch S, Deenen R, Schmidt S, Messner I, Schäfer KL, Baldus SE, Huckenbeck W, Piekorz RP, Knoefel WT, Krieg A, Stoecklein NH. Impact of the 3D microenvironment on phenotype, gene expression, and EGFR inhibition of colorectal cancer cell lines. PLoS ONE. 2013;8(3):e59689.
- Li L, Zhao Q, Kong W. Extracellular matrix remodeling and cardiac fibrosis. Matrix Biol. 2018;1(68-69):490-506.
- Kiss DL, Windus LCE, Avery VM. Chemokine receptor expression on integrin-mediated stellate projections of prostate cancer cells in 3D culture. Cytokine. 2013;64(1):122-30.
- Urbanczyk M, Layland SL, Schenke-Layland K. The role of extracellular matrix in biomechanics and its impact on bioengineering of cells and 3D tissues. Matrix Biol. 2020;1(85-86):1-14.
- Harunaga JS, Yamada KM. Cell-matrix adhesions in 3D. Matrix Biol. 2011;30(7-8):363-8.
- Schmitz A, Fischer SC, Mattheyer C, Pampaloni F, Stelzer EHK. Multiscale image analysis reveals structural heterogeneity of the cell microenvironment in homotypic spheroids. Sci Rep. 2017;7(1):1-13.
- Imamura Y, Mukohara T, Shimono Y, Funakoshi Y, Chayahara N, Toyoda M, Kiyota N, Takao S, Kono S, Nakatsura T, Minami H. Comparison of
26. Loessner D, Stok KS, Lutolf MP, Hutmacher DW, Clements JA, Rizzi SC. Bioengineered 3D platform to explore cell-ECM interactions and drug resistance of epithelial ovarian cancer cells. Biomaterials. 2010;31(32):8494-506.
27. Zhou CH, Yang SF, Li PQ. Human lung cancer cell line SPC-A1 contains cells with characteristics of cancer stem cells. Neoplasma. 2012;59(6):685-92.
28. Gamerith G, Rainer J, Huber JM, Hackl H, Trajanoski Z, Koeck S, Lorenz E, Kern J, Kofler R, Kelm JM, Zwierzina H, Amann A, Gamerith G, Rainer J, Huber JM, HackI H, Trajanoski Z, Koeck S, Lorenz E, Kern J, Kofler R, Kelm JM, Zwierzina H, Amann A. 3D-cultivation of NSCLC cell lines induce gene expression alterations of key cancer-associated pathways and mimic in-vivo conditions. Oncotarget. 2017;8(68):112647-61.
29. Jiang R, Huang J, Sun X, Chu X, Wang F, Zhou J, Fan Q, Pang L. Construction of in vitro 3-D model for lung cancer-cell metastasis study. BMC Cancer. 2022;22(1):1-9. https://doi.org/10.1186/s12885-022-09546-9.
30. Chong YK, Toh TB, Zaiden N, Poonepalli A, Leong SH, Ong CEL, Yu Y, Tan PB, See SJ, Ng WH, Ng I, Hande MP, Kon OL, Ang BT, Tang C. Cryopreservation of neurospheres derived from human glioblastoma multiforme. Stem Cells. 2009;27(1):29.
31. Panchalingam K, Paramchuk W, Hothi P, Shah N, Hood L, Foltz G, Behie LA, Panchalingam K, Paramchuk W, Hothi P, Shah N, Hood L, Foltz G, Behie LA. Large-scale production of human glioblastoma-derived cancer stem cell tissue in suspension bioreactors to facilitate the development of novel oncolytic therapeutics. Cancer Stem Cells-The Cutting Edge. 2011;475-502.
32. Sutherland RM, Inch WR, McCredie JA, Kruuv J. A multi-component radiation survival curve using an in vitro tumour model. Int J Radiat Biol Relat Stud Phys Chem Med. 1970;18(5):491-5.
33. Youn BS, Sen A, Behie LA, Girgis-Gabardo A, Hassell JA. Scale-up of breast cancer stem cell aggregate cultures to suspension bioreactors. Biotechnol Prog. 2006;22(3):801-10. https://doi.org/10.1021/bp050 430z.
34. Kuo CT, Chiang CL, Chang CH, Liu HK, Huang GS, Huang RYJ, Lee H, Huang CS, Wo AM. Modeling of cancer metastasis and drug resistance via biomimetic nano-cilia and microfluidics. Biomaterials. 2014;35(5):1562-71.
35. Ware MJ, Keshishian V, Law JJ, Ho JC, Favela CA, Rees P, Smith B, Mohammad S, Hwang RF, Rajapakshe K, Coarfa C, Huang S, Edwards DP, Corr SJ, Godin B, Curley SA. Generation of an in vitro 3D PDAC stroma rich spheroid model. Biomaterials. 2016;108:129-42.
36. Rice AJ, Cortes E, Lachowski D, Cheung BCH, Karim SA, Morton JP, Del Río Hernández A. Matrix stiffness induces epithelial-mesenchymal transition and promotes chemoresistance in pancreatic cancer cells. Oncogenesis. 2017;6(7):e352.
37. Kuo CT, Chiang CL, Huang RYJ, Lee H, Wo AM. Configurable 2D and 3D spheroid tissue cultures on bioengineered surfaces with acquisition of epithelial-mesenchymal transition characteristics. NPG Asia Mater. 2012;4(9):e27.
38. Michy T, Massias T, Bernard C, Vanwonterghem L, Henry M, Guidetti M, Royal G, Coll JL, Texier I, Josserand V, Hurbin A. Verteporfin-loaded lipid nanoparticles improve ovarian cancer photodynamic therapy in vitro and in vivo. Cancers. 2019;11(11):1760.
39. Hirst J, Pathak HB, Hyter S, Pessetto ZY, Ly T, Graw S, Koestler DC, Krieg AJ, Roby KF, Godwin AK. Licofelone enhances the efficacy of paclitaxel in ovarian cancer by reversing drug resistance and tumor stem-like properties. Cancer Res. 2018;78(15):4370-85. https://doi.org/10.1158/ 0008-5472.CAN-17-3993.
40. Goodwin TJ, Milburn Jessup J, Wolf DA. Morphologic differentiation of colon carcinoma cell lines HT-29 and HT-29KM in rotating-wall vessels. In Vitro Cell Dev Biol. 1992;28A(1):47-60.
41. Dainiak MB, Savina IN, Musolino I, Kumar A, Mattiasson B, Galaev IY. Biomimetic macroporous hydrogel scaffolds in a high-throughput screening format for cell-based assays. Biotechnol Prog. 2008;24(6):1373-83.
42. Chandrasekaran S, Deng H, Fang Y. PTEN deletion potentiates invasion of colorectal cancer spheroidal cells through 3D Matrigel. Integr Biol (Camb). 2015;7(3):324-34.
43. Poornima K, Francis AP, Hoda M, Eladl MA, Subramanian S, Veeraraghavan VP, El-Sherbiny M, Asseri SM, Hussamuldin ABA, Surapaneni KM, Mony U, Rajagopalan R. Implications of three-dimensional cell culture in cancer therapeutic research. Front Oncol. 2022;12.
44. Gunti S, Hoke ATK, Vu KP, London NR. Organoid and spheroid tumor models: techniques and applications. Cancers (Basel). 2021;13(4):1-18.
45. Lovitt CJ, Shelper TB, Avery VM. Advanced cell culture techniques for cancer drug discovery. Biology. 2014;3(2):345-67.
46. Zeilinger K, Freyer N, Damm G, Seehofer D, Knöspel F. Cell sources for in vitro human liver cell culture models. Exp Biol Med (Maywood). 2016;241(15):1684-98.
47. Eglen RM, Reisine T. Human iPS cell-derived patient tissues and 3D cell culture part 2: spheroids, organoids, and disease modeling. SLAS Technol. 2019;24(1):18-27.
48. Su J, Zhang L, Zhang W, Choi DS, Wen J, Jiang B, Chang CC, Zhou X. Targeting the biophysical properties of the myeloma initiating cell niches: a pharmaceutical synergism analysis using multi-scale agent-based modeling. PLoS ONE. 2014;9(1):e85059.
49. Valyi-Nagy K, Kormos B, Ali M, Shukla D, Valyi-Nagy T. Stem cell marker CD271 is expressed by vasculogenic mimicry-forming uveal melanoma cells in three-dimensional cultures. Mol Vis. 2012;18:588.
50. Lombardo Y, Filipovicá A, Molyneux G, Periyasamy M, Giamas G, Hu Y, Trivedi PS, Wang J, Yaguë E, Michel L, Coombes RC. Nicastrin regulates breast cancer stem cell properties and tumor growth in vitro and in vivo. Proc Natl Acad Sci U S A. 2012;109(41):16558-63.
51. Sgodda M, Dai Z, Zweigerdt R, Sharma AD, Ott M, Cantz T. A scalable approach for the generation of human pluripotent stem cell-derived hepatic organoids with sensitive hepatotoxicity features. Stem Cells Dev. 2017;26(20):1490-504.
52. Meier F, Freyer N, Brzeszczynska J, Knöspel F, Armstrong L, Lako M, Greuel S, Damm G, Ludwig-Schwellinger E, Deschl U, Ross JA, Beilmann M, Zeilinger K. Hepatic differentiation of human iPSCs in different 3D models: a comparative study. Int J Mol Med. 2017;40(6):1759.
53. Weng KC, Kurokawa YK, Hajek BS, Paladin JA, Shirure VS, George SC. Human induced pluripotent stem-cardiac-endothelial-tumor-on-achip to assess anticancer efficacy and cardiotoxicity. Tissue Eng Part C Methods. 2020;26(1):44-55. https://doi.org/10.1089/ten.tec.2019.0248.
54. Liu S, Fang C, Zhong C, Li J, Xiao Q. Recent advances in pluripotent stem cell-derived cardiac organoids and heart-on-chip applications for studying anti-cancer drug-induced cardiotoxicity. Cell Biol Toxicol. 2023;39:2527.
55. Han R, Sun Q, Wu J, Zheng P, Zhao G. Sodium butyrate upregulates miR203 expression to exert anti-proliferation effect on colorectal cancer cells. Cell Physiol Biochem. 2016;39(5):1919-29.
56. Fontoura JC, Viezzer C, dos Santos FG, Ligabue RA, Weinlich R, Puga RD, Antonow D, Severino P, Bonorino C. Comparison of 2D and 3D cell culture models for cell growth, gene expression and drug resistance. Mater Sci Eng, C. 2020;1(107): 110264.
57. Ingram M, Techy GB, Saroufeem R, Yazan O, Narayan KS, Goodwin TJ, Spaulding GF. Three-dimensional growth patterns of various human tumor cell lines in simulated microgravity of a NASA bioreactor. In Vitro Cell Dev Biol Anim. 1997;33(6):459-66.
58. Lv D, Yu SC, Ping YF, Wu H, Zhao X, Zhang H, Cui Y, Chen B, Zhang X, Dai J, Bian XW, Yao XH. A three-dimensional collagen scaffold cell culture system for screening anti-glioma therapeutics. Oncotarget. 2016;7(35):56904.
59. Spill F, Reynolds DS, Kamm RD, Zaman MH. Impact of the physical microenvironment on tumor progression and metastasis. Curr Opin Biotechnol. 2016;40:41-8.
60. Ravi M, Paramesh V, Kaviya SR, Anuradha E, Paul Solomon FD. 3D cell culture systems: advantages and applications. J Cell Physiol. 2015;230(1):16-26. https://doi.org/10.1002/jcp.24683.
61. Campuzano S, Pelling AE. Scaffolds for 3D cell culture and cellular agriculture applications derived from non-animal sources. Front Sustain Food Syst. 2019;17(3):38.
62. Hippler M, Lemma ED, Bertels S, Blasco E, Barner-Kowollik C, Wegener M, Bastmeyer M. 3D scaffolds to study basic cell biology. Adv Mater. 2019. https://doi.org/10.1002/adma.201808110.
63. Cavo M, Delle Cave D, D’Amone E, Gigli G, Lonardo E, del Mercato LL. A synergic approach to enhance long-term culture and manipulation of MiaPaCa-2 pancreatic cancer spheroids. Sci Rep. 2020;10(1).
64. Ware MJ, Colbert K, Keshishian V, Ho J, Corr SJ, Curley SA, Godin B. Generation of homogenous three-dimensional pancreatic cancer cell spheroids using an improved hanging drop technique. Tissue Eng Part C Methods. 2016;22(4):312-21.
65. Foty R. A simple hanging drop cell culture protocol for generation of
66. Timmins NE, Nielsen LK. Generation of multicellular tumor spheroids by the hanging-drop method. Methods Mol Med. 2007;140:141-51.
67. Zhao L, Xiu J, Liu Y, Zhang T, Pan W, Zheng X, Zhang X. A 3D printed hanging drop dripper for tumor spheroids analysis without recovery. Sci Rep. 2019;9(1):1-14.
68. Gao W, Wu D, Wang Y, Wang Z, Zou C, Dai Y, Ng CF, Teoh JYC, Chan FL. Development of a novel and economical agar-based non-adherent three-dimensional culture method for enrichment of cancer stemlike cells. Stem Cell Res Ther. 2018;9(1):243. https://doi.org/10.1186/ s13287-018-0987-x.
69. Madoux F, Tanner A, Vessels M, Willetts L, Hou S, Scampavia L, Spicer TP. A 1536-well 3D viability assay to assess the cytotoxic effect of drugs on spheroids. SLAS Discov. 2017;22(5):516-24.
70. Khawar IA, Park JK, Jung ES, Lee MA, Chang S, Kuh HJ. Three dimensional mixed-cell spheroids mimic stroma-mediated chemoresistance and invasive migration in hepatocellular carcinoma. Neoplasia. 2018;20(8):800-12.
71. Song Y, Kim JS, Choi EK, Kim J, Kim KM, Seo HR, Song Y, Kim JS, Kyung Choi E, Kim J, Mo Kim K, Ran Seo H. TGF-
72. Ma L, Li Y, Wu Y, Aazmi A, Zhang B, Zhou H, Yang H. The construction of in vitro tumor models based on 3D bioprinting. Biodes Manuf. 2020;3(3):227-36.
73. Xie M, Gao Q, Fu J, Chen Z, He Y. Bioprinting of novel 3D tumor array chip for drug screening. Biodes Manuf. 2020;3(3):175-88.
74. Datta P, Dey M, Ataie Z, Unutmaz D, Ozbolat IT. 3D bioprinting for reconstituting the cancer microenvironment. NPJ Precis Oncol. 2020;4(1).
75. LaBarge W, Morales A, Pretorius D, Kahn-Krell AM, Kannappan R, Zhang J. Scaffold-free bioprinter utilizing layer-by-layer printing of cellular spheroids. Micromachines (Basel). 2019;10(9):570.
76. Khoshnood N, Zamanian A. A comprehensive review on scaffold-free bioinks for bioprinting. Bioprinting. 2020;1(19): e00088.
77. Norotte C, Marga FS, Niklason LE, Forgacs G. Scaffold-free vascular tissue engineering using bioprinting. Biomaterials. 2009;30(30):5910-7.
78. Anil-Inevi M, Delikoyun K, Mese G, Tekin HC, Ozcivici E. Magnetic levitation assisted biofabrication, culture, and manipulation of 3D cellular structures using a ring magnet based setup. Biotechnol Bioeng. 2021;118(12):4771-85.
79. Anil-Inevi M, Yaman S, Yildiz AA, Mese G, Yalcin-Ozuysal O, Tekin HC, Ozcivici E. Biofabrication of in situ self assembled 3D cell cultures in a weightlessness environment generated using magnetic levitation. Sci Rep. 2018;8(1).
80. Türker E, Demirçak N, Arslan-Yildiz A. Correction: scaffold-free threedimensional cell culturing using magnetic levitation. Biomater Sci. 2018;6(7):1996.
81. Haisler WL, Timm DM, Gage JA, Tseng H, Killian TC, Souza GR. Three-dimensional cell culturing by magnetic levitation. Nat Protoc. 2013;8(10):1940-9.
82. Jaganathan H, Gage J, Leonard F, Srinivasan S, Souza GR, Dave B, Godin B. Three-dimensional in vitro co-culture model of breast tumor using magnetic levitation. Sci Rep. 2014;4.
83. Caleffi JT, Aal MCE, de Gallindo H, Caxali GH, Crulhas BP, Ribeiro AO, Souza GR, Delella FK. Magnetic 3D cell culture: state of the art and current advances. Life Sci. 2021;286:120028.
84. Rogers M, Sobolik T, Schaffer DK, Samson PC, Johnson AC, Owens P, Codreanu SG, Sherrod SD, McLean JA, Wikswo JP, Richmond A. Engineered microfluidic bioreactor for examining the three-dimensional breast tumor microenvironment. Biomicrofluidics. 2018;12(3):34102.
85. Xu Z, Gao Y, Hao Y, Li E, Wang Y, Zhang J, Wang W, Gao Z, Wang Q. Application of a microfluidic chip-based 3D co-culture to test drug sensitivity for individualized treatment of lung cancer. Biomaterials. 2013;34(16):4109-17.
86. Ruedinger F, Lavrentieva A, Blume C, Pepelanova I, Scheper T. Hydrogels for 3D mammalian cell culture: a starting guide for laboratory practice. Appl Microbiol Biotechnol. 2015;99(2):623-36.
87. Zhang N, Milleret V, Thompson-Steckel G, Huang NP, Vörös J, Simona
88. Rijal G, Bathula C, Li W. Application of synthetic polymeric scaffolds in breast cancer 3D tissue cultures and animal tumor models. Int J Biomater. 2017;2017:9.
89. Unnikrishnan K, Thomas LV, Ram Kumar RM. Advancement of scaffoldbased 3D cellular models in cancer tissue engineering: an update. Front Oncol. 2021;11.
90. van Tienderen GS, Conboy J, Muntz I, Willemse J, Tieleman J, Monfils K, Schurink IJ, Demmers JAA, Doukas M, Koenderink GH, van der Laan LJW, Verstegen MMA. Tumor decellularization reveals proteomic and mechanical characteristics of the extracellular matrix of primary liver cancer. Biomater Adv. 2023;1(146): 213289.
91. Li X, Valadez AV, Zuo P, Nie Z. Microfluidic 3D cell culture: potential application for tissue-based bioassays. Bioanalysis. 2012;4(12):1509.
92. Zhong Q, Ding H, Gao B, He Z, Gu Z. Advances of microfluidics in biomedical engineering. Adv Mater Technol. 2019;4(6).
93. Santos SC, Custódio CA, Mano JF. Human protein-based porous scaffolds as platforms for xeno-free 3D cell culture. Adv Healthc Mater. 2022;11(12).
94. Afewerki S, Sheikhi A, Kannan S, Ahadian S, Khademhosseini A. Gelatin-polysaccharide composite scaffolds for 3D cell culture and tissue engineering: Towards natural therapeutics. Bioeng Transl Med. 2018;4(1):96-115.
95. Chen L, Xiao Z, Meng Y, Zhao Y, Han J, Su G, Chen B, Dai J. The enhancement of cancer stem cell properties of MCF-7 cells in 3D collagen scaffolds for modeling of cancer and anti-cancer drugs. Biomaterials. 2012;33(5):1437-44.
96. McGrath J, Panzica L, Ransom R, Withers HG, Gelman IH. Identification of genes regulating breast cancer dormancy in 3D bone endosteal niche cultures. Mol Cancer Res. 2019;17(4):860-9.
97. Arya N, Sardana V, Saxena M, Rangarajan A, Katti DS. Recapitulating tumour microenvironment in chitosan-gelatin three-dimensional scaffolds: an improved in vitro tumour model. J R Soc Interface. 2012;9(77):3288-302.
98. Bassi G, Panseri S, Dozio SM, Sandri M, Campodoni E, Dapporto M, Sprio S, Tampieri A, Montesi M. Scaffold-based 3D cellular models mimicking the heterogeneity of osteosarcoma stem cell niche. Sci Rep. 2020;10(1):22294.
99. Kievit FM, Wang K, Erickson AE, Lan Levengood SK, Ellenbogen RG, Zhang M. Modeling the tumor microenvironment using chitosanalginate scaffolds to control the stem-like state of glioblastoma cells. Biomater Sci. 2016;4(4):610.
100. Li W, Hu X, Wang S, Xing Y, Wang H, Nie Y, Liu T, Song K. Multiple comparisons of three different sources of biomaterials in the application of tumor tissue engineering in vitro and in vivo. Int J Biol Macromol. 2019;130:166-76.
101. Palomeras S, Rabionet M, Ferrer I, Sarrats A, Garcia-Romeu ML, Puig T, Ciurana J. Breast cancer stem cell culture and enrichment using Poly(
102. Pradhan S, Clary JM, Seliktar D, Lipke EA. A three-dimensional spheroidal cancer model based on PEG-fibrinogen hydrogel microspheres. Biomaterials. 2017;1(115):141-54.
103. Godugu C, Patel AR, Desai U, Andey T, Sams A, Singh M. AlgiMatrix
104. Andersen T, Auk-Emblem P, Dornish M. 3D cell culture in alginate hydrogels. Microarrays. 2015;4(2):133-61.
105. Yang Z, Zhao X. A 3D model of ovarian cancer cell lines on peptide nanofiber scaffold to explore the cell-scaffold interaction and chemotherapeutic resistance of anticancer drugs. Int J Nanomed. 2011;6:310.
106. Song H, Cai GH, Liang J, Ao DS, Wang H, Yang ZH. Three-dimensional culture and clinical drug responses of a highly metastatic human ovarian cancer HO-8910PM cells in nanofibrous microenvironments of three hydrogel biomaterials. J Nanobiotechnol. 2020;18(1):90.
107. Suo A, Xu W, Wang Y, Sun T, Ji L, Qian J. Dual-degradable and injectable hyaluronic acid hydrogel mimicking extracellular matrix for 3D culture of breast cancer MCF-7 cells. Carbohydr Polym. 2019;211:336-48.
108. Wang J, Xu W, Qian J, Wang Y, Hou G, Suo A. Photo-crosslinked hyaluronic acid hydrogel as a biomimic extracellular matrix to recapitulate in vivo features of breast cancer cells. Colloids Surf B Biointerfaces. 2022;209:112159.
109. Kim MJ, Chi BH, Yoo JJ, Ju YM, Whang YM, Chang IH. Structure establishment of three-dimensional (3D) cell culture printing model for bladder cancer. PLoS ONE. 2019;14(10):e0223689.
110. Loessner D, Meinert C, Kaemmerer E, Martine LC, Yue K, Levett PA, Klein TJ, Melchels FPW, Khademhosseini A, Hutmacher DW. Functionalization, preparation and use of cell-laden gelatin methacryloyl-based hydrogels as modular tissue culture platforms. Nat Protoc. 2016;11(4):727-46.
111. Arya AD, Hallur PM, Karkisaval AG, Gudipati A, Rajendiran S, Dhavale V, Ramachandran B, Jayaprakash A, Gundiah N, Chaubey A. Gelatin methacrylate hydrogels as biomimetic three-dimensional matrixes for modeling breast cancer invasion and chemoresponse in vitro. ACS Appl Mater Interfaces. 2016;8(34):22005-17.
112. Curtis KJ, Schiavi J, Mc Garrigle MJ, Kumar V, McNamara LM, Niebur GL. Mechanical stimuli and matrix properties modulate cancer spheroid growth in three-dimensional gelatin culture. J R Soc Interface. 2020;17(173):20200568.
113. Cavo M, Fato M, Peñuela L, Beltrame F, Raiteri R, Scaglione S. Microenvironment complexity and matrix stiffness regulate breast cancer cell activity in a 3D in vitro model. Sci Rep. 2016;6(1):1-13.
114. VandenHeuvel SN, Farris HA, Noltensmeyer DA, Roy S, Donehoo DA, Kopetz S, Haricharan S, Walsh AJ, Raghavan S. Decellularized organ biomatrices facilitate quantifiable in vitro 3D cancer metastasis models. Soft Matter. 2022;18(31):5791-806.
115. Landberg G, Fitzpatrick P, Isakson P, Jonasson E, Karlsson J, Larsson E, Svanström A, Rafnsdottir S, Persson E, Gustafsson A, Andersson D, Rosendahl J, Petronis S, Ranji P, Gregersson P, Magnusson Y, Håkansson J, Ståhlberg A. Patient-derived scaffolds uncover breast cancer promoting properties of the microenvironment. Biomaterials. 2020;1(235): 119705.
116. Zhang
117. D’angelo E, Natarajan D, Sensi F, Ajayi O, Fassan M, Mammano E, Pilati P, Pavan P, Bresolin S, Preziosi M, Miquel R, Zen Y, Chokshi S, Menon K, Heaton N, Spolverato G, Piccoli M, Williams R, Urbani L, Agostini M. Patientderived scaffolds of colorectal cancer metastases as an organotypic 3D model of the liver metastatic microenvironment. Cancers (Basel). 2020;12(2):364.
118. Varinelli L, Guaglio M, Brich S, Zanutto S, Belfiore A, Zanardi F, lannelli F, Oldani A, Costa E, Chighizola M, Lorenc E, Minardi SP, Fortuzzi S, Filugelli M, Garzone G, Pisati F, Vecchi M, Pruneri G, Kusamura S, Baratti D, Cattaneo L, Parazzoli D, Podestà A, Milione M, Deraco M, Pierotti MA, Gariboldi M. Decellularized extracellular matrix as scaffold for cancer organoid cultures of colorectal peritoneal metastases. J Mol Cell Biol. 2023;14(11).
119. Tian X, Werner ME, Roche KC, Hanson AD, Foote HP, Yu SK, Warner SB, Copp JA, Lara H, Wauthier EL, Caster JM, Herring LE, Zhang L, Tepper JE, Hsu DS, Zhang T, Reid LM, Wang AZ. Organ-specific metastases obtained by culturing colorectal cancer cells on tissue-specific decellularized scaffolds. Nat Biomed Eng. 2018;2(6):443-52.
120. Li H, Dai W, Xia X, Wang R, Zhao J, Han L, Mo S, Xiang W, Du L, Zhu G, Xie J, Yu J, Liu N, Huang M, Zhu J, Cai G. Modeling tumor development and metastasis using paired organoids derived from patients with colorectal cancer liver metastases. J Hematol Oncol. 2020;13(1):1-6. https://doi. org/10.1186/s13045-020-00957-4.
121. Parkinson GT, Salerno S, Ranji P, Håkansson J, Bogestål Y, Wettergren Y, Ståhlberg A, Bexe Lindskog E, Landberg G. Patient-derived scaffolds as a model of colorectal cancer. Cancer Med. 2021;10(3):867-82.
122. Jian M, Ren L, Ren L, He G, He G, Lin Q, Lin Q, Tang W, Tang W, Chen Y, Chen J, Chen J, Liu T, Ji M, Ji M, Wei Y, Wei Y, Chang W, Chang W, Xu J, Xu J. A novel patient-derived organoids-based xenografts model for preclinical drug response testing in patients with colorectal liver metastases. J Transl Med. 2020;18(1):1-17. https://doi.org/10.1186/ s12967-020-02407-8.
123. Pinto
124. Helal-Neto E, Brandão-Costa RM, Saldanha-Gama R, Ribeiro-Pereira C, Midlej V, Benchimol M, Morandi V, Barja-Fidalgo C. Priming endothelial cells with a melanoma-derived extracellular matrix triggers the activation of avß3/VEGFR2 axis. J Cell Physiol. 2016;231(11):2464-73.
125. Fontana F, Raimondi M, Marzagalli M, Sommariva M, Limonta P, Gagliano N. Epithelial-to-mesenchymal transition markers and CD44 isoforms are differently expressed in 2D and 3D cell cultures of prostate cancer cells. Cells. 2019;8(2):143.
126. Li GN, Livi LL, Gourd CM, Deweerd ES, Hoffman-Kim D. Genomic and morphological changes of neuroblastoma cells in response to threedimensional matrices. Tissue Eng. 2007;13(5):1035-47.
127. Sarwar M, Sykes PH, Chitcholtan K, Evans JJ. Collagen I dysregulation is pivotal for ovarian cancer progression. Tissue Cell. 2022;74.
128. Tsai S, McOlash L, Palen K, Johnson B, Duris C, Yang Q, Dwinell MB, Hunt
129. Sha H, Zou Z, Xin K, Bian X, Cai X, Lu W, Chen J, Chen G, Huang L, Blair AM, Cao P, Liu B. Tumor-penetrating peptide fused EGFR single-domain antibody enhances cancer drug penetration into 3D multicellular spheroids and facilitates effective gastric cancer therapy. J Control Release. 2015;28(200):188-200.
130. Monteiro MV, Gaspar VM, Ferreira LP, Mano JF. Hydrogel 3D in vitro tumor models for screening cell aggregation mediated drug response. Biomater Sci. 2020;8(7):1855-64.
131. Kundu B, Saha P, Datta K, Kundu SC. A silk fibroin based hepatocarcinoma model and the assessment of the drug response in hyaluronan-binding protein 1 overexpressed HepG2 cells. Biomaterials. 2013;34(37):9462-74.
132. Simon KA, Mosadegh B, Minn KT, Lockett MR, Mohammady MR, Boucher DM, Hall AB, Hillier SM, Udagawa T, Eustace BK, Whitesides GM. Metabolic response of lung cancer cells to radiation in a paper-based 3D cell culture system. Biomaterials. 2016;1(95):47-59.
133. Loessner D, Rizzi SC, Stok KS, Fuehrmann T, Hollier B, Magdolen V, Hutmacher DW, Clements JA. A bioengineered 3D ovarian cancer model for the assessment of peptidase-mediated enhancement of spheroid growth and intraperitoneal spread. Biomaterials. 2013;34(30):7389-400.
134. Stratmann AT, Fecher D, Wangorsch G, Göttlich C, Walles T, Walles H, Dandekar T, Dandekar G, Nietzer SL. Establishment of a human 3D lung cancer model based on a biological tissue matrix combined with a Boolean in silico model. Mol Oncol. 2014;8(2):351-65. https://doi.org/ 10.1016/j.molonc.2013.11.009.
135. Dunne LW, Huang Z, Meng W, Fan X, Zhang N, Zhang Q, An Z. Human decellularized adipose tissue scaffold as a model for breast cancer cell growth and drug treatments. Biomaterials. 2014;35(18):4940-9.
136. Çetin EA. Investigation of the viability of different cancer cells on decelIularized adipose tissue. Celal Bayar Univ J Sci. 2023;19(2):113-9.
137. Sensi F, D’angelo E, Piccoli M, Pavan P, Mastrotto F, Caliceti P, Biccari A, Corallo D, Urbani L, Fassan M, Spolverato G, Riello P, Pucciarelli S, Agostini M. Recellularized colorectal cancer patient-derived scaffolds as in vitro pre-clinical 3D model for drug screening. Cancers (Basel). 2020;12(3).
138. Mazza G, Telese A, Al-Akkad W, Frenguelli L, Levi A, Marrali M, Longato L, Thanapirom K, Vilia MG, Lombardi B, Crowley C, Crawford M, Karsdal MA, Leeming DJ, Marrone G, Bottcher K, Robinson B, Del Rio HA, Tamburrino D, Spoletini G, Malago M, Hall AR, Godovac-Zimmermann J, Luong TV, De Coppi P, Pinzani M, Rombouts K. Cirrhotic human liver extracellular matrix 3D scaffolds promote smad-dependent TGF-
139. Zhao L, Huang L, Yu S, Zheng J, Wang H, Zhang Y. Decellularized tongue tissue as an in vitro model for studying tongue cancer and tongue regeneration. Acta Biomater. 2017;58:122-35.
140. Blanco-Fernandez B, Rey-Vinolas S, Bağcl G, Rubi-Sans G, Otero J, Navajas D, Perez-Amodio S, Engel E. Bioprinting decellularized breast tissue
for the development of three-dimensional breast cancer models. ACS Appl Mater Interfaces. 2022;14(26):29467-82. https://doi.org/10.1021/ acsami.2c00920.
141. Molla MDS, Katti DR, Katti KS. An in vitro model of prostate cancer bone metastasis for highly metastatic and non-metastatic prostate cancer using nanoclay bone-mimetic scaffolds. Springer Link. 2019;4(21):120713. https://doi.org/10.1557/adv.2018.682.
142. Bai G, Yuan P, Cai B, Qiu X, Jin R, Liu S, Li Y, Chen X. Stimuli-responsive scaffold for breast cancer treatment combining accurate photothermal therapy and adipose tissue regeneration. Adv Funct Mater. 2019. https://doi.org/10.1002/adfm.201904401.
143. Lee JH, Kim SK, Khawar IA, Jeong SY, Chung S, Kuh HJ. Microfluidic co-culture of pancreatic tumor spheroids with stellate cells as a novel 3D model for investigation of stroma-mediated cell motility and drug resistance. J Exp Clin Cancer Res. 2018;37(1):1-12. https://doi.org/10. 1186/s13046-017-0654-6.
144. Chen Y, Sun W, Kang L, Wang Y, Zhang M, Zhang H, Hu P. Microfluidic co-culture of liver tumor spheroids with stellate cells for the investigation of drug resistance and intercellular interactions. Analyst. 2019;144(14):4233-40.
145. Jeong SY, Lee JH, Shin Y, Chung S, Kuh HJ. Co-culture of tumor spheroids and fibroblasts in a collagen matrix-incorporated microfluidic chip mimics reciprocal activation in solid tumor microenvironment. PLoS ONE. 2016;11(7):e0159013.
146. Shin CS, Kwak B, Han B, Park K. Development of an in vitro 3D tumor model to study therapeutic efficiency of an anticancer drug. Mol Pharm. 2013;10(6):2167-75. https://doi.org/10.1021/mp300595a.
147. Hübner J, Raschke M, Rütschle I, Gräßle S, Hasenberg T, Schirrmann K, Lorenz A, Schnurre S, Lauster R, Maschmeyer I, Steger-Hartmann T, Marx U. Simultaneous evaluation of anti-EGFR-induced tumour and adverse skin effects in a microfluidic human 3D co-culture model. Sci Rep. 2018;8(1):1-12.
148. Dorayappan KDP, Gardner ML, Hisey CL, Zingarelli RA, Smith BQ, Lightfoot MDS, Gogna R, Flannery MM, Hays J, Hansford DJ, Freitas MA, Yu L, Cohn DE, Selvendiran K. A microfluidic chip enables isolation of exosomes and establishment of their protein profiles and associated signaling pathways in ovarian cancer. Cancer Res. 2019;79(13):3503-13.
149. Booij TH, Price LS, Danen EHJ. 3D cell-based assays for drug screens: challenges in imaging, image analysis, and high-content analysis. SLAS Discovery. 2019;24(6):615-27.
150. Eskes C, Boström AC, Bowe G, Coecke S, Hartung T, Hendriks G, Pamies D, Piton A, Rovida C. Good cell culture practices & in vitro toxicology. Toxicol In Vitro. 2017;1(45):272-7.
151. Coecke S, Balls M, Bowe G, Davis J, Gstraunthaler G, Hartung T, Hay R, Merten OW, Price A, Schechtman L, Stacey G, Stokes W. Guidance on good cell culture practice: a report of the Second ECVAM Task Force on good cell culture practice. Altern Lab Anim. 2005;33(3):261-87.
152. Kasendra M, Troutt M, Broda T, Bacon WC, Wang TC, Niland JC, Helmrath MA. The engineered gut: use of stem cells and tissue engineering to study physiological mechanisms and disease processes: intestinal organoids: roadmap to the clinic. Am J Physiol Gastrointest Liver Physiol. 2021;321(1):G1.
153. Al-Ani A, Toms D, Kondro D, Thundathil J, Yu Y, Ungrin M. Oxygenation in cell culture: critical parameters for reproducibility are routinely not reported. PLoS ONE. 2018;13(10):e0204269.
154. Blatchley MR, Hall F, Ntekoumes D, Cho H, Kailash V, Vazquez-Duhalt R, Gerecht S. Discretizing three-dimensional oxygen gradients to modulate and investigate cellular processes. Adv Sci. 2021;8(14):2100190. https://doi.org/10.1002/advs. 202100190.
155. Martinez NJ, Titus SA, Wagner AK, Simeonov A. High-throughput fluorescence imaging approaches for drug discovery using in vitro and in vivo three-dimensional models. Expert Opin Drug Discov. 2015;10(12):1347-61.
156. Robertson FM, Ogasawara MA, Ye Z, Chu K, Pickei R, Debeb BG, Woodward WA, Hittelman WN, Cristofanilli M, Barsky SH. Imaging and analysis of 3D tumor spheroids enriched for a cancer stem cell phenotype. J Biomol Screen. 2010;15(7):820-9.
157. Wenzel C, Riefke B, Gründemann S, Krebs A, Christian S, Prinz F, Osterland M, Golfier S, Räse S, Ansari N, Esner M, Bickle M, Pampaloni F, Mattheyer C, Stelzer EH, Parczyk K, Prechtl S, Steigemann P. 3D high-content
screening for the identification of compounds that target cells in dormant tumor spheroid regions. Exp Cell Res. 2014;323(1):131-43.
158. Palacio-Castañeda V, Velthuijs N, Le Gac S, Verdurmen WPR. Oxygen control: the often overlooked but essential piece to create better in vitro systems. Lab Chip. 2022;22(6):1068-92.
159. Boyce MW, Simke WC, Kenney RM, Lockett MR. Generating linear oxygen gradients across 3D cell cultures with block-layered oxygen controlled chips (BLOCCs). Anal Methods. 2020;12(1):18.
160. Li Y, Yang HY, Lee DS. Biodegradable and injectable hydrogels in biomedical applications. Biomacromol. 2022;23(3):609-18. https://doi.org/ 10.1021/acs.biomac.1c01552.
161. Osaki T, Sivathanu V, Kamm RD. Engineered 3D vascular and neuronal networks in a microfluidic platform. Sci Rep. 2018;8(1):1-13.
162. Virumbrales-Muñoz M, Ayuso JM, Lacueva A, Randelovic T, Livingston MK, Beebe DJ, Oliván S, Pereboom D, Doblare M, Fernández L, Ochoa I. Enabling cell recovery from 3D cell culture microfluidic devices for tumour microenvironment biomarker profiling. Sci Rep. 2019;9(1):1-14.
163. Kyykallio H, Faria AVS, Hartmann R, Capra J, Rilla K, Siljander PRM. A quick pipeline for the isolation of 3D cell culture-derived extracellular vesicles. J Extracell Vesicles. 2022;11(10).
164. Hubbell JA. Materials as morphogenetic guides in tissue engineering. Curr Opin Biotechnol. 2003;14(5):551-8.
165. Bartnikowski M, Bartnikowski NJ, Woodruff MA, Schrobback K, Klein TJ. Protective effects of reactive functional groups on chondrocytes in photocrosslinkable hydrogel systems. Acta Biomater. 2015;1(27):66-76.
166. El-Sherbiny IM, Yacoub MH. Hydrogel scaffolds for tissue engineering: progress and challenges. Glob Cardiol Sci Pract. 2013;2013(3):316.
167. Bryant SJ, Nuttelman CR, Anseth KS. Cytocompatibility of UV and visible light photoinitiating systems on cultured NIH/3T3 fibroblasts in vitro. J Biomater Sci Polym Ed. 2000;11(5):439-57.
168. Liu S, Borjigin T, Schmitt M, Morlet-Savary F, Xiao P, Lalevée J. Highperformance photoinitiating systems for LED-induced photopolymerization. Polymers (Basel). 2023;15(2):342.
169. Fang Y, Eglen RM. Three-dimensional cell cultures in drug discovery and development. SLAS Discovery. 2017;22(5):456-72. https://doi.org/10. 1177/1087057117696795.
170. Sirenko O, Mitlo T, Hesley J, Luke S, Owens W, Cromwell EF. High-content assays for characterizing the viability and morphology of 3d cancer spheroid cultures. Assay Drug Dev Technol. 2015;13(7):402-14. https:// doi.org/10.1089/adt.2015.655.
171. Zustiak SP, Boukari H, Leach JB. Solute diffusion and interactions in cross-linked poly(ethylene glycol) hydrogels studied by Fluorescence Correlation Spectroscopy. Soft Matter. 2010;6(15):3609-18.
172. Shanbhag S, Woo Lee J, Kotov N. Diffusion in three-dimensionally ordered scaffolds with inverted colloidal crystal geometry. Biomaterials. 2005;26(27):5581-5.
173. Totti S, Allenby MC, Dos Santos SB, Mantalaris A, Velliou EG. A 3D bioinspired highly porous polymeric scaffolding system for in vitro simulation of pancreatic ductal adenocarcinoma. RSC Adv. 2018;8(37):20928-40.
174. Gupta P, Totti S, Pérez-Mancera PA, Dyke E, Nisbet A, Schettino G, Webb R, Velliou EG. Chemoradiotherapy screening in a novel biomimetic polymer based pancreatic cancer model. RSC Adv. 2019;9(71):41649-63.
175. Hamdi DH, Barbieri S, Chevalier F, Groetz JE, Legendre F, Demoor M, Galera P, Lefaix JL, Saintigny Y. In vitro engineering of human 3D chondrosarcoma: a preclinical model relevant for investigations of radiation quality impact. BMC Cancer. 2015;15(1):1-14. https://doi.org/10.1186/ s12885-015-1590-5.
176. Okere B, Alviano F, Costa R, Quaglino D, Ricci F, Dominici M, Paolucci P, Bonsi L, lughetti L. In vitro differentiation of human amniotic epithelial cells into insulinproducing 3D spheroids. Int J Immunopathol Pharmacol. 2015;28(3):390-402.
177. Paris F, Marrazzo P, Pizzuti V, Marchionni C, Rossi M, Michelotti M, Petrovic B, Ciani E, Simonazzi G, Pession A, Bonsi L, Alviano F. Characterization of perinatal stem cell spheroids for the development of cell therapy strategy. Bioengineering. 2023;10(2):189.
178. Kim W, Park E, Yoo HS, Park J, Jung YM, Park JH. Recent advances in monitoring stem cell status and differentiation using nano-biosensing technologies. Nanomaterials. 2022;12(17):2934.
179. Burdick JA, Vunjak-Novakovic G. Engineered microenvironments for controlled stem cell differentiation. Tissue Eng Part A. 2009;15(2):205-19.
180. De León SE, Pupovac A, McArthur SL. Three-Dimensional (3D) cell culture monitoring: opportunities and challenges for impedance spectroscopy. Biotechnol Bioeng. 2020;117(4):1230-40. https://doi.org/ 10.1002/bit.27270.
181. Sirenko O, Hancock MK, Hesley J, Hong D, Cohen A, Gentry J, Carlson CB, Mann DA. Phenotypic characterization of toxic compound effects on liver spheroids derived from ipsc using confocal imaging and threedimensional image analysis. Assay Drug Dev Technol. 2016;14(7):38194. https://doi.org/10.1089/adt.2016.729.
182. Jensen
183. Ajjarapu SM, Tiwari A, Kumar S. Applications and utility of threedimensional in vitro cell culture for therapeutics. Future Pharmacol. 2023;3(1):213-28.
184. Basu A, Dydowiczová A, Trosko JE, Bláha L, Babica P. Ready to go 3D? A semi-automated protocol for microwell spheroid arrays to increase scalability and throughput of 3D cell culture testing. Toxicol Mech Methods. 2020;30(8):590-604. https://doi.org/10.1080/15376516.2020.1800881.
185. Burdick JA, Murphy WL. Moving from static to dynamic complexity in hydrogel design. Nat Commun. 2012;3(1):1-8.
186. Nash ME, Healy D, Carroll WM, Elvira C, Rochev YA. Cell and cell sheet recovery from pNIPAm coatings; motivation and history to present day approaches. J Mater Chem. 2012;22(37):19376-89.
187. Abuwatfa WH, Awad NS, Pitt WG, Husseini GA. Thermosensitive polymers and thermo-responsive liposomal drug delivery systems. Polymers. 2022;14(5):925.
188. Young EWK, Beebe DJ. Fundamentals of microfluidic cell culture in controlled microenvironments. Chem Soc Rev. 2010;39(3):1036-48.
189. Guvendiren M, Burdick JA. Stiffening hydrogels to probe short- and long-term cellular responses to dynamic mechanics. Nat Commun. 2012;3.
190. Highley CB , Rodell CB , Burdick JA. Direct 3D printing of shear-thinning hydrogels into self-healing hydrogels. Adv Mater. 2015;27(34):5075-9.
191. Malda J, Visser J, Melchels FP, Jüngst T, Hennink WE, Dhert WJA, Groll J, Hutmacher DW. 25th anniversary article: engineering hydrogels for biofabrication. Adv Mater. 2013;25(36):5011-28.
ملاحظة الناشر
- *المراسلات:
غالب أ. حسيني ghusseini@aus.edu
قائمة كاملة بمعلومات المؤلف متاحة في نهاية المقال
DOI: https://doi.org/10.1186/s12929-024-00994-y
PMID: https://pubmed.ncbi.nlm.nih.gov/38221607
Publication Date: 2024-01-14
Scaffold-based 3D cell culture models in cancer research
Abstract
Three-dimensional(3D)cell cultures have emerged as valuable tools in cancer research,offering significant advantages over traditional two-dimensional(2D)cell culture systems.In 3D cell cultures,cancer cells are grown in an environment that more closely mimics the 3D architecture and complexity of in vivo tumors.This approach has revolutionized cancer research by providing a more accurate representation of the tumor microenvironment (TME)and enabling the study of tumor behavior and response to therapies in a more physiologically relevant con- text.One of the key benefits of 3D cell culture in cancer research is the ability to recapitulate the complex interac- tions between cancer cells and their surrounding stroma.Tumors consist not only of cancer cells but also various other cell types,including stromal cells,immune cells,and blood vessels.These models bridge traditional 2D cell cultures and animal models,offering a cost-effective,scalable,and ethical alternative for preclinical research.As the field advances,3D cell cultures are poised to play a pivotal role in understanding cancer biology and accelerat- ing the development of effective anticancer therapies.This review article highlights the key advantages of 3D cell cultures,progress in the most common scaffold-based culturing techniques,pertinent literature on their applications in cancer research,and the ongoing challenges.

Introduction
modalities, developing more sophisticated diagnostic tools, and understanding the genetic and molecular mechanisms involved in its development and progression [3].
Physiological relevance of 3D cell cultures to the ECM
cellular metabolic state. Notably, cells seeded in tumor ECM exhibited elevated levels of free NADH, indicating an increased glycolytic rate compared to those seeded in normal ECM. These findings underscore the substantial influence of ECM on cancer cell growth and the accompanying vasculature (e.g., increased vessel length, increased vascular heterogeneity). Alterations in the composition of tumor ECM, such as augmented deposition and crosslinking of collagen fibers, can be attributed to communication between tumor cells and tumor-associated stromal cells.
| Cancer type | 3D culture model (cell type) | |||
| Lung cancer |
|
|||
| Glioblastoma |
|
|||
| Breast cancer |
|
|||
| Pancreatic cancer |
|
|||
| Ovarian cancer |
|
|||
| Colon cancer |
|
Figure 1 summarizes the main characteristics of 2D and 3D cell cultures. The shift to 3D cell culture is a significant advancement in laboratory research, as it provides a more physiologically relevant model for studying cellular
processes and disease. While some challenges remain to be addressed, the advantages of 3D culture outweigh the limitations of 2D culture. As technology continues to evolve, 3D culture is likely to become an increasingly crucial tool in cancer research and other fields of biomedical science.

Cell sources and 3D culture heterogeneity
reservoir of human cells, capable of developing into any cell type required for therapeutic applications. Humaninduced pluripotent Stem Cells (HiPSCs) are particularly relevant in cancer research (Table 3) [47]. Thus, the reprogramming process pioneered by Shinya Yamanaka has opened new avenues for advancing cancer biology, drug discovery, and regenerative medicine in cancer treatment. Lastly, adult or somatic stem cells are tissuespecific, mirroring the characteristics of their origin, and present fewer ethical concerns as they are derived from adult tissues. However, they have limited differentiation potential and a finite lifespan in culture. The selection of the cell source significantly influences the composition and behavior of the 3D culture. Stem cells and iPSCs, known for their pluripotency, introduce an inherent heterogeneity due to their ability to differentiate into various cell types [45, 46].
| Model type | Features | Advantages | Disadvantages | |||||||
| 2D cell culture | Involve cells grown in a flat, 2D layer, typically on culture dishes. | Well-established protocols. Rapid cell growth and division. Simple and cost-effective. Easy to manipulate and analyze. Suitable for high-throughput screening. | Oversimplified representation of in vivo conditions. Lacks cell-cell and cell-matrix interactions. Flat morphology, which may alter cellular responses. | |||||||
| 3D cell culture | Represent a 3D arrangement of cells that mimics the spatial complexity of in vivo environments. These systems can be scaffold-free or scaffold-based, where cells are cultivated in scaffolds or matrices, allowing interactions that better replicate physiological conditions. | Enhanced drug response prediction. Allows for studying the TME facilitates investigation of tumor heterogeneity. | Variability in protocols and methodologies. Limited scalability for high-throughput assays. | |||||||
| Tissues and organs | Involve the cultivation of cells in configurations that mimic the structure and function of specific organs or anatomical parts. These systems provide a more complex and holistic environment than individual cells, allowing for a closer representation of in vivo conditions. By organizing cells into structures resembling organs or tissues, researchers can study interactions between different cell types and gain insights into the organ-specific responses to cancer and its treatments. |
|
|
|||||||
| Animals | Animal models, such as mice or rats, are living organisms used to study cancer. |
|
|
|||||||
| Patients | Patient model systems in cancer research involve using samples derived directly from patients. This can include patientderived xenografts (PDX), organoids, or other personalized models. These systems aim to capture the unique characteristics of individual patients’ tumors, allowing for more tailored and patientspecific studies. |
|
|
obscure specific responses, while too much homogeneity might oversimplify the representation of the tissue microenvironment. Therefore, a nuanced understanding of the cellular source is essential for tailoring 3D cell culture models to accurately reflect the intricacies of actual tissues and organs.
Scaffold-based techniques for 3D cell culture
| Cells used in in vitro cell culture | Merits | Demerits | Relevant studies | |||||
| Stem cells |
|
Adult or somatic stem cells have a more restricted differentiation potential than pluripotent stem cells, limiting their versatility in modeling diverse tissues. | Myeloma stem cells [48]. Melanoma stem cells [49]. Breast cancer stem cells [50]. | |||||
| Induced Pluripotent Stem Cells (iPSCs) | The pluripotent nature of HiPSCs allows the creation of in vitro models that closely mirror the characteristics of cancer cells, providing valuable insights into cancer development and progression. |
|
|
|||||
| Primary cells |
|
|
Primary breast cancer cells [56]. primary prostate cancer cells [57]. primary glioblastoma cells [58]. |
to the examination of scaffold-based models of 3D cell cultures. Scaffolds are essential components in 3D cell culture systems, as they provide a 3D environment for cells to grow and interact with each other and their surroundings [61, 62]. Biomaterials employed in such models can be categorized into the following primary groups: polymer scaffolds, hydrogels, decellularized tissue scaffolds, and hybrid scaffolds (e.g., incorporating microfluidic devices). Tables 4 and 5 summarize the advantages and limitations of commonly used scaffold-free and scaf-fold-based 3D cell culture techniques, respectively.
Polymer-based scaffolds
| Non-scaffold-based technique | Description | Advantages | Limitations | References | |||||||||||||
| Anchored spheroids or hanging-drop spheroids | They are also known as hanging-drop spheroids. Cells are suspended in a droplet of media that is hung from a surface. The droplet provides a 3D environment for cells to grow and form spheroids. Anchored spheroids do not require a scaffold or matrix to support the cells. Typically, they can be maintained for 10 to 14 days. |
|
|
[63-67] | |||||||||||||
| Non-adherent or ultra-low attachment spheroids | It is also known as a multicellular tumor sphere formation assay. Cells form tumor spheres through anchorage-independent growth mechanisms. Typically, these spheres can be maintained for up to 7 days. |
|
|
[68-71] | |||||||||||||
| Scaffold-free bioprinting | Involves the direct printing of cell aggregates or individual cells without using an external scaffold. In this method, the cells are printed in a way that allows them to self-assemble and interact with neighboring cells, forming 3D tissue-like structures without the need for a supporting scaffold. Typically, they can be maintained for 2 to 4 days. |
|
|
[72-77] | |||||||||||||
| Magnetic levitation | It is a relatively new scaffold-free method for 3D cell culture. In this method, cells are mixed with magnetic nanoparticles and levitated using a magnetic field. As the cells levitate, they aggregate and form 3D structures. Magnetic levitation allows for the creation of complex 3D structures. Typically. The cell culture can be maintained for more than 7 days. |
|
|
[78-83] | |||||||||||||
| Scaffold-free microfluidics | Fosters 3D cell culture environments without supporting matrices, such as hydrogels or scaffolds. These devices create controlled microenvironments within microfluidic channels to facilitate the aggregation and self-organization of cancer cells, promoting the formation of 3D structures, including spheroids or organoids. |
|
|
[84, 85] |
On the other hand, polysaccharide-based scaffolds are composed of long chains of sugar molecules (e.g., chitosan and hyaluronic acid). They are biocompatible, biodegradable, and can often be modified to adjust their physical and biological properties. Arya et al. [97] developed a 3D cell culture model using a chitosan scaffold, a natural polymer derived from chitin, to study breast cancer behavior. The scaffold was cross-linked with genipin, a natural cross-linker, to enhance its stability. The study found that the chitosan-gelatin (GC) scaffold provided a suitable environment for the growth of MCF-7 breast cancer cells, with the cells showing good adhesion and proliferation. The scaffold also supported the formation of cell clusters, which are more representative of in vivo tumor conditions compared to 2D cultures. The study
concluded that the chitosan/gelatin scaffold could be useful for studying breast cancer in vitro, providing a more physiologically relevant model than traditional 2D cultures. GC scaffolds have been shown to support the formation of tumoroids that mimic tumors grown in vivo, making them an improved in vitro tumor model. These scaffolds have been successfully used to study lung cancer, as well as other types of cancer, such as breast, cervix, and bone [98]. These scaffolds have demonstrated gene-expression profiles similar to tumors grown in vivo, indicating their potential for studying cancer progression and drug screening for solid tumors [99]. The GC scaffolds have also been shown to improve the predictivity of preclinical studies and enhance the clinical translation of therapies [100]. Overall, the GC scaffolds provide a valuable tool for studying tumor development and evaluating the efficacy of anti-cancer drugs in an in vitro setting.
| Scaffold type | Description | Advantages | Limitations | References | ||||||
| Natural polymers | They are derived from natural sources such as collagen, fibrin, or alginate. These scaffolds mimic the native ECM and provide a favorable microenvironment for cell growth. |
|
|
[86,87] | ||||||
| Synthetic degradable polymers | They are fabricated using synthetic biodegradable materials such as polycaprolactone (PCL) or poly(lactic-co-glycolic acid) (PLGA). These scaffolds offer precise control over their properties and can be tailored to specific requirements. |
|
|
[88] | ||||||
| Hydrogels | Composed of a 3D network of hydrophilic polymer chains capable of retaining large amounts of water. They provide a hydrated and soft environment for cell growth. |
|
|
[89] | ||||||
| Decellularized tissues | It involves the removal of cellular components from native tissues, leaving behind the ECM structure and bioactive molecules. These scaffolds provide an environment that closely resembles the native tissue microenvironment. |
|
|
[90] |
| Scaffold type | Description | Advantages | Limitations | References | |||
| Scaffold-based microfluidics | Cells are cultured within microscale channels that provide a controlled microenvironment for cell growth in a cell-laden scaffold. | – Can create precise spatial and temporal control over cell culture conditions (e.g., fluid flow, chemical gradients, and oxygen and nutrient delivery). – Can mimic tissue interfaces. |
|
[91,92] |

scaffold implants. At the same time, its expression was significantly high within the tumors derived from the MDA-MB-231 cell-laden PLGA scaffolds. This finding suggested that the cancer cell population within the scaffolds exhibited rapid proliferation when embedded in the native breast tissues.
Hydrogel scaffolds
simple and isolated 3D structure. Figure 3B illustrates the insert wells technique, which consists of porous inserts to hold the cell-hydrogel mixture while cell culture media is added to the well surrounding the insert. This separation creates a differential environment, allowing for nutrient exchange while maintaining a distinct 3D culture within the insert. Heterogeneous spheroids will eventually form on the insert bottom due to gravitational pull and cellcell interactions. Such a model can be used to study cell invasion or migration by placing the cell-hydrogel mixture on one side of a permeable membrane and chemoattractants on the other. The gel-bottom support method (see Fig. 3C) involves creating a thick layer of hydrogel at the bottom of a culture well, on top of which the cell suspension is placed. For instance, this method can be used for embedding cells within macroporous hydrogel scaffolds, such as AlgiMatrix
Due to their adjustable properties, synthetic hydrogels offer notable benefits in 3D cell culture. The RADA16-I peptide is a self-assembling peptide derived from a segment of Zuotin, a left-handed Z-DNA-binding protein originally discovered in yeast. This peptide has emerged as a novel nano-biomaterial due to its ability to form nanofiber scaffolds. Consequently, these scaffolds provide a supportive framework that promotes cell growth and fosters a conducive 3D milieu for cell culture. The
peptide sequence can be modified to incorporate specific functional groups, thus fine-tuning the mechanical, chemical, and biological attributes of the resultant scaffold. This remarkable flexibility enables customization to align precisely with the unique demands of the cultured cells or the intended experimental objectives. These scaffolds, which are about 10 nm in diameter, are driven by positively and negatively charged residues through complementary ionic interactions. When dissolved in water, the RADA16-I peptide forms a stable hydrogel (nanofiber networks with pore sizes of about

hyaluronidase. The glutathione responsiveness allows for degradation in response to the redox environment, which is often disturbed in cancer cells. Meanwhile, responsiveness of hyaluronidase makes the hydrogels sensitive to an enzyme that is typically upregulated in invasive cancer cells. Significantly, the HA hydrogel-cultured MCF-7 cells displayed upregulated expression of vascular endothelial growth factor (VEGF), interleukin-8 (IL-8), and basic fibroblast growth factor (bFGF) compared to their 2D cultured counterparts. These molecules are key mediators of angiogenesis and inflammation in cancer, suggesting that the HA hydrogel environment better replicates the conditions that promote these processes in tumors. Besides, the hydrogel-cultured cells exhibited enhanced migration and invasion abilities, which are key hallmarks of aggressive cancer cells. In vivo studies supported these results and confirmed the superior tumorigenic capacity of the MCF-7 cells cultured in HA hydrogels compared to those cultured in 2D. The outcomes of this research
are anticipated to have far-reaching implications for both the in vitro study of breast cancer and the development of effective therapeutic strategies.
Another investigation by Wang et al. [108] supported that the level of methacrylation significantly influenced the hydrogel’s microstructure, mechanical characteristics, and capacity for liquid absorption and degradation. The refined hydrogel, synthesized through the photocrosslinking of methacrylated HA, displayed a highly porous structure, a high equilibrium swelling ratio, appropriate mechanical properties, and a degradation process responsive to hyaluronidase. It was found that the HA hydrogel promoted the growth and proliferation of MCF-7 cells, which formed aggregates within the hydrogel. In addition, 3D-cultured MCF-7 cells showed an increased expression of VEGF, bFGF, and interleu-kin-8, and enhanced invasion and tumorigenesis capabilities compared to their 2D-cultured counterparts. As such, the HA hydrogel has proven to be a dependable alternative for constructing tumor models. Gelatin methacryloyl (GelMA) is another commonly used natural biomaterial for 3D hydrogel scaffolds in cancer research. GelMA is derived from gelatin, a natural protein obtained from collagen-rich sources. It is modified by adding methacryloyl groups that enable it to undergo photocrosslinking when exposed to ultraviolet (UV) light. This property allows GelMA to form stable hydrogel networks, making it suitable for creating 3D scaffolds that mimic the tumor microenvironment (TME). The tunable mechanical and biochemical properties of GelMA hydrogels, biocompatibility, and ability to support cell growth make them valuable tools for studying cancer cell behavior, tumor invasion, drug screening, and other aspects of cancer research. Kim et al. [109] developed a 3D cell culture model for the bladder by employing a novel acellular matrix and bioreactor. GelMA was utilized as a 3D scaffold for the bladder cancer cell culture, with an optimal scaffold height of 0.08 mm and a crosslinking time of 120 s [110]. Subsequently, 5637 and T24 cells were cultured in 2D and 3D environments and subjected to rapamycin and Bacillus Calmette-Guérin (BCG) drug treatments. It was found that the 3D bladder cancer cell culture model exhibited a faster establishment process and greater stability when compared to the 2D model. Moreover, the 3D-cultured cancer cells demonstrated heightened drug resistance and reduced sensitivity compared to the 2D-cultured cells. Additionally, the researchers observed cell-to-cell interaction and basal activity in the 3D model, closely resembling the in vivo environment.
Along the same lines, Arya et al. [111] investigated the suitability of GelMA hydrogels as in vitro 3D culture systems for modeling key characteristics of metastatic
progression in breast cancer, specifically invasiveness and chemo-responsiveness. The mechanical and morphological properties of the hydrogels were tuned by varying the percentage of GelMA used. Compression testing revealed that the stiffness of
or compression. In the stiffer gelatin, compressed constructs resulted in smaller spheroids compared to perfusion alone, while compression had no significant effect in the softer gelatin. The immunostaining revealed the expression of proteins associated with bone metastasis within the spheroids, including osteopontin, parathyroid hormone-related protein, and fibronectin. The proliferative marker Ki67 was present in all spheroids on day 4. The intensity of Ki67 staining varied depending on the culture conditions and gelatin stiffness. It highlighted the mechanical sensitivity of 4T1 breast cancer cells and demonstrated how mechanical stimuli can impact their proliferation and protein expression within soft materials that mimic the mechanical properties of bone marrow. The findings emphasized the role of the mechanical environment in the bone for both in vivo and in vitro models of cancer metastasis.
substrate stiffness and cellular behavior, researchers can develop more realistic in vitro models that better mimic the microenvironment of solid tumors. These models can advance our understanding of cancer development and aid in the development of targeted therapies by allowing for the investigation of cell-cell and cell-matrix interactions in a more accurate setting.
Decellularized tissue scaffolds
technologies, such as microfluidics or organ-on-a-chip systems, can further enhance the functionality and relevance of decellularized tissue models.
contribute to our comprehension of colorectal cancer and PM biology. These models, alongside others [119122], offer valuable insights into the intricate interplay between tumor cells and the ECM, paving the way for the potential discovery of novel therapeutic targets and the development of personalized treatment strategies for peritoneal metastases.

pathways. The researchers studied the differences in the ultrastructural organization and composition of mel-anocyte-derived ECM (NGM-ECM) and melanomaderived (MV3-ECM). Higher levels of tenascin-C and laminin and lower fibronectin expression were detected in MV3-ECM. Moreover, endothelial cells cultured in the MV3-ECM underwent morphological transformations and exhibited increased adhesion, mobility, growth, and tubulogenesis. The interaction between the endothelial cells and decellularized matrix induced integrin signaling activation, resulting in focal adhesion kinase (FAK) phosphorylation and its association with Src (a non-receptor
| Method | Agents or techniques | Description | Advantages | Disadvantages |
| Chemical methods | Sodium dodecyl sulfate (SDS), Triton X-100, sodium deoxycholate. | Involve the use of various chemical agents which disrupt cell membranes and solubilize cellular proteins, facilitating the release of cellular components from tissues while preserving the ECM. | Relatively straightforward Efficiently remove cellular material. | The choice of chemical agents and their concentration must be carefully optimized to avoid damaging the ECM and compromising its structural and functional integrity. |
| Physical methods | Freeze-thaw cycles, agitation, sonication, hydrodynamic forces. | Involve mechanical forces or physical treatments to remove cellular components. For example, freeze-thaw cycles cause cell membranes to rupture and cellular contents to be released, while agitation methods utilize mechanical stirring or shaking to dislodge cells from the tissue surface. | Do not require chemical agents that may affect the ECM composition. | Can be challenging to completely remove all cellular remnants, including intracellular proteins and nucleic acids. |
| Biological methods | Nucleases (DNase, RNase) to degrade nucleic acids, proteases (such as trypsin or collagenase) to break down proteins, and glycosidases to remove glycosaminoglycans. | Utilize enzymes to selectively degrade celIular components, facilitating cell removal. | Offer selectivity in cellular component removal and can be tailored to specific tissues or ECM compositions. | Careful optimization of enzymatic concentrations, incubation times, and temperature is necessary to ensure efficient cell removal while preserving the integrity of the ECM. |
Hybrid scaffolds
performance of human osteosarcoma cell lines (MG63 and SAOS-2) and enriched CSCs within these complex 3D cell culture models. Immunofluorescence and other characterization techniques were employed to evaluate the response of the osteosarcoma cell lines and CSCs to the biomimetic scaffolds. The results demonstrated the successful formation of sarcospheres, which are stable spheroids enriched with CSCs, with a minimum diameter of
bone microenvironment. These findings are essential for developing targeted therapeutic strategies against prostate cancer bone metastasis. Bai et al. [142] conducted a study in which they incorporated graphene oxide (GO) onto a copolymer of polyacrylic acid-g-polylactic acid (PAA-g-PLLA) to create a stimuli-responsive scaffold. This scaffold, combined with PCL and gambogic acid (GA), exhibited a selective response towards tumors and demonstrated a significant accumulation of GO/GA in vitro breast tumor cells (MCF-7 cells) under acidic conditions ( pH 6.8 ), while showing minimal impact on normal cells (MCF-10A cells) at physiological pH ( pH 7.4). The study further revealed that the synergistic use of pH-responsive photo-thermal conversion was more effective in inhibiting tumor growth than independent treatments. In vivo experiments showed remarkable tumor suppression (99% reduction within 21 days) through tumor tissue disintegration, degeneration, and overall tumor suppression when treated with GO-GA scaffolds combined with photo-thermal therapy, in comparison to control groups or those treated with either GO-GA scaffolds or near-infrared (NIR) irradiation alone.
Microfluidics provide a versatile platform for 3D cell culture, offering both scaffold-based and scaffold-free approaches. Researchers can tailor the platform to suit the specific requirements of their experiments, whether involving cell-laden scaffolds or the aggregation of cells to form spheroids or organoids. The microfluidic setup allows for precise control over the microenvironment, including the flow of nutrients and oxygen, as well as the ability to introduce gradients of specific molecules. Lee et al. [143] utilized soft lithography to fabricate a 7-channel microchannel plate using poly-dimethylsiloxane (PDMS). Within separate channels, PANC-1 pancreatic cancer cells and pancreatic stellate cells (PSCs) were cultured within a collagen I matrix. The study observed the formation of 3D tumor spheroids by PANC-1 cells within five days. Intriguingly, the presence of co-cultured PSCs resulted in an increased number of spheroids, suggesting a potential influence of PSCs on tumor growth. In the co-culture setup, PSCs exhibited heightened expression of
revealed a complex interplay between PANC-1 cells and PSCs within the TME. Nonetheless, the combination of gemcitabine and paclitaxel showed promise to overcome resistance and inhibit tumor growth. The implications of these findings are significant for understanding the complex interplay between tumor cells and the surrounding stromal cells within the TME. Tumor-stroma interactions play a critical role in cancer progression and therapy response. Using microfluidic-based 3D co-culture models allows researchers to better recapitulate the in vivo conditions, providing a more accurate representation of tumor behavior and therapeutic responses.
| Hydrogel (Origin) | Caner type/cell line(s) | Objective(s) | Findings | References | |||
| Agarose-gel (Natural) | Prostate cancer/ PC3, DU145 | To compare the expression of the major EMT markers (i.e., E-cadherin, N-cadherin, a-smooth muscle actin (a-SMA), vimentin, Snail, Slug, Twist, and Zeb1) in 2D vs. 3D cell cultures. | – Significant morphological and phenotypical differences were observed between cells grown in 2D monolayers vs. 3D spheroids. – Low expression of mesenchymal phenotype markers in the 3D culture. | [125] | |||
| Collagen I (Natural) | Neuroblastoma/ SH-SY5Y | To compare growth mechanisms and gene expression of human neuroblastoma SHSY5Y cells in 2D vs. 3D cultures. |
|
[126] | |||
| Collagen I (Natural) | Ovarian cancer/ OV-2008 | To recapitulate the architecture of the ECM in a solid tumor and investigate the motility and invasion capability of cells and their chemoresponsiveness. |
|
[127] | |||
| Matrigel (Natural) | Pancreatic cancer/ MCW670 | To establish a patient-derived pancreatic cancer organoid co-culture 3D platform. | -The model allowed for accurate investigation of tumor-stroma and tumor-immune interactions in the organoid system. – Time-dependent activation of cancer fibroblasts was observed. | [128] | |||
| Matrigel (Natural) | Gastric cancer/ BGC-823 | To evaluate the therapeutic effects of recombinant proteins (i.e., anti-EGFR and anti-EGFR-iRGD) in combination with chemotherapy (i.e., doxorubicin) on the drug uptake and efficacy in multicellular tumor spheroids. |
|
[129] | |||
| Matrigel (Natural) | Osteosarcoma/ MG-63 | To investigate the effects of varying cellular arrangement in a 3D cell culture model. |
|
[130] |
| Hydrogel (Origin) | Caner type/cell line(s) | Objective(s) | Findings | References | |||
| Tasar silk fibroin (Natural) | Hepatocarcinoma/ HEPG2 and HepR21 | To evaluate the effectiveness of the tasar silk fibroin scaffold as a 3D culture matrix for hepatic cancer cells. |
|
[131] | |||
| Cells-in-Gels-in-Paper (CiGiP) (Synthetic) | Lung cancer/ A549 | To study the metabolic sensitivity of cells to ionizing radiation using a novel paperbased 3D model. The model created a decreasing gradient of oxygen and nutrients down the paper stacks, where the topmost cells were exposed to an oxygen-rich environment. In contrast, the bottom cells were exposed to oxygen-deficient conditions. |
|
[132] | |||
| Cell integrin-binding motifs (RGD peptides (Synthetic) | Ovarian cancer/ KLK4-7 | To develop a 3D model that mimics cell proliferation, survival responses, and interactions with integrins in the TME. | – Results showed that combination therapy of paclitaxel with KLK/MAPK showed more pronounced effects than chemotherapy alone. | [133] | |||
| RADA16-I peptide (Synthetic) | Epithelial ovarian cancer/ A2780, A2780/DDP, and SK-OV-3 | To evaluate the efficacy of the nanofiber scaffold as a 3D cell culture host and the effect of the material on cell adhesion, morphology, migration, and sensitivity to drugs. |
|
[105] | |||
| Decellularized tissue matrix | Caner type/ cell line(s) | Objective(s) | Refs | ||||
| Small intestinal submucosa and mucosa | Lung cancer/ HCC827 and A549 | To create a 3D model that allows for multiple read-out options, to monitor changes in cell signaling, proliferation, and apoptosis in response to drugs. |
|
| Table 7 (continued) | |||||||
| Decellularized tissue matrix | Caner type/ cell line(s) | Objective(s) | Findings | Refs | |||
| Adipose tissue | Breast cancer/ MCF-7, SKBR3, BT474 | To establish a 3D scaffold that resembles the breast cancer microenvironment. |
|
[135] | |||
| Rat adipose tissue | glioblastoma/T98G; human hepatoma/ Hep3B; colon adenocarcinoma/WiDr | to investigate the cellular behavior of various cancer cell lines in vitro using a platform derived from decellularized adipose tissue. |
|
[136] | |||
| Colorectal cancer tissue and healthy colon mucosa | Colorectal cancer/ HT29 and HCT116 cells | To establish a patient-derived 3D preclinical model that can be used for drug evaluation in colorectal cancer. |
|
[137] | |||
| Table 7 (continued) | ||||||||||
| Decellularized tissue matrix | Caner type/ cell line(s) | Objective(s) | Findings | Refs | ||||||
| Healthy and cirrhotic liver tissues | hepatocellular carcinoma/ HCC cells | To examine and identify the distinct characteristics of the cirrhotic human liver ECM microenvironment, which promotes the development of hepatocellular carcinoma. |
|
[138] | ||||||
| Animal tongue tissue | tongue squamous cell carcinoma/ CAL27 | To evaluate the feasibility of using decellularized tongue ECM for tongue squamous cell carcinoma research and tongue regeneration. | – A significant enrichment of integrin signaling in tongue ECM was observed. In addition to its impact on cell survival and proliferation, the tongue ECM also exerted coordinated effects on the interactions between cells and the ECM and neighboring cells, influencing the mode and extent of cell movement. | [139] | ||||||
| Decellularized tissue matrix | Caner type/ cell line(s) | Objective(s) | Findings | Refs | ||||
| Porcine breast tissue | Breast cancer/ MCF-7 and hAMSCs | To establish decellularized breast scaffolds rich in glycosaminoglycans (GAGs) and collagen. |
|
[140] | ||||
| Decellularized tissue matrix | Caner type/cell line(s) | Objective(s) | Findings | References | ||||
| Small intestinal submucosa and mucosa | Lung cancer/ HCC827 and A549 | To create a 3D model that allows for multiple read-out options, to monitor changes in cell signaling, proliferation, and apoptosis in response to drugs. |
|
[134] | ||||
| Adipose tissue | Breast cancer/ MCF-7, SKBR3, BT474 | To establish a 3D scaffold that resembles the breast cancer microenvironment. |
|
[135] | ||||
| Rat adipose tissue | glioblastoma/T98G; human hepatoma/ Hep3B; colon adenocarcinoma/ WiDr | to investigate the cellular behavior of various cancer cell lines in vitro using a platform derived from decellularized adipose tissue. |
|
[136] |
| Decellularized tissue matrix | Caner type/cell line(s) | Objective(s) | Findings | References | ||||||
| Colorectal cancer tissue and healthy colon mucosa | Colorectal cancer/ HT29 and HCT116 cells | To establish a patient-derived 3D preclinical model that can be used for drug evaluation in colorectal cancer. |
|
[137] | ||||||
| Healthy and cirrhotic liver tissues | hepatocellular carcinoma/ HCC cells | To examine and identify the distinct characteristics of the cirrhotic human liver ECM microenvironment, which promotes the development of hepatocellular carcinoma. |
|
[138] |
| Decellularized tissue matrix | Caner type/cell line(s) | Objective(s) | Findings | ||
| Animal tongue tissue | tongue squamous cell carcinoma/ CAL27 | To evaluate the feasibility of using decellularized tongue ECM for tongue squamous cell carcinoma research and tongue regeneration. | – A significant enrichment of integrin [139] signaling in tongue ECM was observed. In addition to its impact on cell survival and proliferation, the tongue ECM also exerted coordinated effects on the interactions between cells and the ECM and neighboring cells, influencing the mode and extent of cell movement. | ||
| Porcine breast tissue | Breast cancer/ MCF-7 and hAMSCs | To establish decellularized breast scaffolds rich in glycosaminoglycans (GAGs) and collagen. |
|

Challenges and future prospectives
| Microfluidic device fabrication method | Caner type/cell line(s) | Objective(s) | Findings | References | ||
| Standard photolithography | Breast cancer/ MDA-MB-231 | To create a matrix stimulating the TME. |
|
[84] | ||
| Standard photolithography | Lung cancer/ SPCA-1 and HFL1 | To develop 3D cell culture in a microfluidic device that would allow for parallel testing of different chemotherapeutics. |
|
[85] | ||
| Soft photolithography | Breast cancer/ MCF-7 | To establish a 3D model using hydrogel scaffolding in microwells, and to evaluate therapeutic effectiveness, distribution, and penetration of doxorubicin in the 3D cell culture. |
|
[146] | ||
| Low-pressure plasma oxidation | Lung cancer/ H292 | To evaluate the therapeutic index of anti-EGFR-antibody cetuximab using human-skin co-culture assay. | -The integration of a metastatic with a scaled-down model of a functional human skin created an optimal test platform for assessing the effectiveness of EGFR inhibitors and other promising treatments in the field of oncology. | [147] | ||
| Multilayer photolithography | High-grade ovarian cancer/ OVCAR-8, FTSEC | To produce a custom-designed microfluidic device for the isolation of exosomes from patient serum samples and cultured cells. | -The microscale can facilitate the identification and isolation of exosome-derived biomarkers, which TME can be utilized in assays for the early detection of high-grade serous ovarian cancer. | [148] |
Moreover, oxygen accessibility is a critical consideration in 3D cell culture methods, and its heterogeneity within these environments poses a significant challenge in replicating physiological conditions and obtaining accurate experimental results. Cells located in the interior of 3D structures, such as spheroids, often encounter limited oxygen availability due to microenvironmental factors (i.e., tumor spheroids naturally develop hypoxic regions due to irregular vascularization in tumors) and diffusion barriers (e.g., densely packed cells, ECM, scaffolding matrices) [153]. As cells proliferate and form 3D structures, the demand for oxygen increases due to the larger volume that oxygen must traverse. Oxygen diffusion from the surrounding culture medium becomes progressively hindered as the distance from the culture surface to the interior of the 3D structure increases. This results in an oxygen gradient, where cells near the periphery have sufficient oxygen, but those in the core encounter oxygen deficiency, leading to hypoxia. Hypoxic core cells often exhibit altered gene expression, reduced proliferation, and changes in metabolic pathways as they enter a dormant state and cease cycling when deprived of oxygen and nutrients. This reduced activity renders them relatively resistant to cytostatic drugs that predominantly target actively dividing cells, leading to increased drug resistance, as is often observed in solid tumors [154, 155]. Confocal microscopy can be used to visualize dormant cells by labeling them with a nucleoside analog, allowing for their quantification and distinction from actively
proliferating cells. This analog gets diluted in actively dividing cells. Still, it remains retained in quiescent, non-dividing cancer cells, thus providing a valuable tool for distinguishing them from the surrounding actively proliferating cells [156]. Leveraging this characteristic of 3D spheroids, they offer potential avenues for developing novel therapeutics targeting cancer cells resistant to cytostatic anticancer drugs. Wenzel et al. [157] cultivated T47D breast cancer cells in 3D cultures and used confocal imaging to differentiate cells within the inner core from those in the surrounding outer core. Cells in the inner core, experiencing limited access to oxygen and nutrients, exhibited reduced metabolic activity compared to their counterparts in the outer core. Through screening small molecule libraries against these 3D cultures, the authors identified nine compounds that selectively targeted and killed the inner core cancer cells while sparing the more actively proliferating outer cells. The identified drugs primarily affected the respiratory chain pathway, aligning with the altered metabolic activity of oxygendeprived cells transitioning from aerobic to anaerobic metabolism. Hence, compounds selectively targeting dormant cancer cells significantly improved the effectiveness of commonly employed cytostatic anticancer drugs. Alternatively, the use of microfluidic devices that enable the creation of controlled oxygen gradients within cultures, the incorporation of oxygen-permeable materials, and the addition of oxygen-releasing compounds to provide a more uniform distribution of oxygen in vitro. However, it is important to acknowledge that these strategies may not fully replicate the complexity of oxygen gradients in real tissues [158]. Boyce et al. [159] presented the design and characterization of a modular device that capitalized on the gas-permeable properties of silicone to create oxygen gradients within cell-containing regions. The microfabricated device was constructed by stacking laser-cut acrylic and silicone rubber sheets, where the silicone not only facilitated oxygen gradient formation but also served as a barrier, separating the flowing gases from the cell culture medium to prevent evaporation or bubble formation during extended incubation periods. The acrylic components provided structural stability, ensuring a sterile culture environment. Using oxygen-sensing films, gradients with varying ranges and steepness in the microdevice can be achieved by adjusting the composition of gases flowing through the silicone elements. Furthermore, a cell-based reporter assay illustrated that cellular responses to hypoxia were directly proportional to the oxygen tension established within the system, proving efficacy.
degradable hydrogel scaffolds involves integrating breakable crosslinks and/or cleavable components into the polymer structure or incorporating naturally biodegradable ECM constituents such as hyaluronic acid, laminin, fibronectin, and collagen [160]. Yet, traditional dissociation techniques prove to be notably inefficient and are influenced by the inherent structural complexities of the culture system. Enzymatic degradation, for example by collagenase, is a widely employed method for retrieving cells from 3D cell culture collagen-based scaffolds. The enzyme is selected to match the specific collagen type in the scaffold. During incubation, collagenase enzymatically cleaves the collagen fibers, releasing cells that were embedded or adhered to these fibers. Once the collagen has been broken down, the cells are collected as a suspension in the culture medium [161]. Cell viability and functionality assessments are typically performed to maintain the cells’ health and functionality. While using enzymatic degradation for 3D cell culture scaffolds is common, it remains an intricate approach associated with several limitations. It is important not to underestimate the impact of collagenase or other enzymes on cell viability and functionality. Careful optimization of digestion time and enzyme concentration is essential to balance efficient scaffold degradation and preserving cell quality [162]. Additionally, potential changes in cell phenotype during digestion are a significant concern, necessitating diligent monitoring of digestion parameters. In complex 3D scaffolds, particularly those with intricate structures, enzymatic digestion may be less effective, prompting researchers to explore alternative retrieval methods or adapt the digestion process. Ethical considerations also come into play, especially when working with human or animal-derived cells, raising concerns about using enzymes like collagenase. Adherence to ethical guidelines and institutional regulations is crucial for maintaining responsible and ethical research practices.
plates, the NFC-based approach demonstrated similar EV production per cell, offering scalability, preserved cell phenotype and integrity, and greater operational simplicity, ultimately leading to higher EV yields. Another approach is based on cell-mediated degradation of hydrogel scaffolds, where living cells actively break down the hydrogel structure [164]. This degradation mechanism is particularly relevant in tissue engineering and regenerative medicine. When cells are encapsulated within a hydrogel scaffold, they can secrete enzymes and other molecules that interact with its components, leading to its gradual breakdown. As cells proliferate and remodel their microenvironment, they may alter the scaffold’s properties and eventually facilitate its degradation. This dynamic process allows for the controlled release of cells, growth factors, and other bioactive substances within the hydrogel, making it a valuable technique for drug delivery applications.
some well-developed biochemical assays to 3D systems. Cells tend to aggregate into dense and/or large clusters over time, even in macroporous scaffolds, causing diffusional limitations when carrying out in situ characterization assays. Limitations arise due to the impeded diffusion and confinement of gases, nutrients, waste, and reagents within the system, compounded by challenges when quantifying and normalizing data between different biomimetic cultures [170-172]. For instance, Totti et al. [173] demonstrated that assessing a culture of pancreatic cancer cells in macroporous polyurethane foam-type scaffolds with the 3-(4,5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium (MTS) assay showed minimal differences between various scaffold conditions (e.g., ECM coatings on the scaffolds). However, sectioning, immunostaining, and imaging revealed clearer cell proliferation, morphology, and growth distinctions between the conditions. Likewise, the 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl2 H -tetrazolium bromide (MTT) assay failed in capturing the differences in pancreatic cells’ viability cultured in polyurethane scaffolds after drug and irradiation screening, which were realized using advanced microscopy and imaging [174]. Hence, it is crucial for researchers to carefully consider the appropriate analytical approach that aligns with their study objectives before commencing the analysis of any 3D cultures. Also, they must be aware that some of the classical gold-standard approaches used in 2D cultures may not be directly applicable in 3D settings, as Hamdi et al. [175] showed that it is unfeasible to extract cells from spheroids for colony formation assays, which are used for developing post-treatment survival curves. Consequently, the researchers suggested in situ characterization readouts, which are novel and/or different from the existing 2D culture protocols.
spatially and temporally within the spheroid, making it complex to track and interpret changes in marker expression over time. Additionally, in larger spheroids, stem cell markers may not effectively penetrate the core of the spheroid, limiting the ability to assess the stem cell population in the inner regions [176, 177]. Researchers can employ several strategies to overcome these challenges and effectively use stem cell markers in 3D spheroid cultures [178, 179]. An alternative method involves combining stem cells and other cellular markers to better understand the cellular composition within the spheroid. This multi-marker approach can help mitigate the issues related to marker heterogeneity. Moreover, live imaging techniques, such as confocal microscopy, can provide real-time insights into the dynamics of marker expression within spheroids. Controlling the size of spheroids is another strategy to enhance marker penetration and access to the innermost cells. Utilizing microfluidic techniques allows for the accurate regulation of spheroid size, ensuring effective penetration of markers throughout all regions of the spheroid [178, 179]. Additionally, singlecell analysis methods, such as single-cell RNA sequencing and proteomic analysis, enable the characterization of individual cells within spheroids. This approach can identify unique gene or protein expression patterns and shed light on the behavior of stem cell populations. Another valuable strategy is creating spheroids with genetically encoded stem cell reporters, which produce fluorescent or luminescent signals in stem cells, making them more visible and trackable. Lastly, mimicking the stem cell niche or microenvironment within 3D culture conditions can help maintain stemness and marker expression in spheroids [179].
Significant strides have been made in creating dynamic scaffolds that can respond to or guide resident cells [185]. For example, thermoresponsive hydrogels like poly-Nisopropylacrylamide (pNIPAm) have been proven effective for cell population harvesting [186, 187]. Moreover, the fusion of microscale technologies for cell culture with adaptable hydrogel designs has facilitated various investigations. These include investigating cell migration within microfluidic hydrogels and establishing high-throughput screening platforms to explore interactions between cells and materials [188]. Notably, the mechanobiology field is intrigued by various mechanically dynamic hydrogels that can either stiffen, soften, or reversibly transition between these states to examine cellular responses. These dynamic substrates offer a means to scrutinize how mechanical cues influence cell behavior, similar to the study of soluble factors over decades [189]. Techniques for introducing heterogeneity and multiple cell types within 3D constructs are also advancing. This includes innovative methods where hydrogels serve as bio-inks to print cells, either layer-by-layer from a 2D base or directly within a 3D space enclosed by another hydrogel. As these platforms progress, they are expected to become more widely accessible [190, 191]. In the interim, it remains crucial to maintain an open and collaborative dialogue between cell biologists, materials scientists, and engineers. This collaborative effort will ensure that the next generation of scaffold-based 3D cell culturing systems is well-equipped to address the significant challenges posed by the increasing biological and technical complexities.
Conclusion
can enable the controlled release of drugs and growth factors, facilitating drug screening and targeted therapy development. Furthermore, hydrogels offer high biocompatibility and can be functionalized with bioactive signals to direct cell behavior and tissue formation. In cancer research, hydrogels provide a platform to investigate the effect of mechanical cues on tumor growth, immune cell infiltration, and angiogenesis. Additionally, the ease of incorporating multiple cell types within hydrogels enables the study of tumor-stroma interactions. Likewise, decellularized tissue scaffolds retain native ECM composition, topography, and mechanical properties, closely mimicking the natural tumor microenvironment. As a result, cancer cells cultured in decellularized tissue scaffolds can exhibit more accurate tumor behaviors, including invasion and angiogenesis. Moreover, these scaffolds can be derived from patient-specific tissues, enabling personalized medicine approaches and improving the predictability of drug responses. Lastly, hybrid scaffolds that integrate microfluidic channels offer unique advantages for cancer research. By combining 3D cell culture with microfluidics, researchers can study tumor angiogenesis, metastasis, and drug penetration in a more physiologically relevant manner. Furthermore, microfluidics can facilitate high-throughput screening of anticancer drugs, enabling rapid and cost-effective testing of potential therapies.
Acknowledgements
Author contributions
Data availability
Declarations
Competing interests
Author details
Published online: 14 January 2024
References
- Siegel RL, Miller KD, Fuchs HE, Jemal A. Cancer Statistics, 2021. CA Cancer J Clin. 2021;71(1):7-33.
- Grønning T. History of cancer. In: Colditz GA, editor. The sage encyclopedia of cancer and society. 2nd ed. CA: SAGE Publications, Inc.; 2015. p. 549-54.
- Guimarães* I dos S, Daltoé* RD, Herlinger AL, Madeira KP, LadislauT, Valadão IC, Junior PCML, Fernandes Teixeira S, Amorim GM, Santos DZ dos, Demuth KR, Rangel LBA. Conventional Cancer Treatment. Cancer Treatment-Conventional and Innovative Approaches. 2013; Available from: https://www.intechopen.com/chapters/42057.
- De Vita VT. The evolution of therapeutic research in cancer. N Engl J Med. 2010;298(16):907-10.
- Loessner D, Holzapfel BM, Clements JA. Engineered microenvironments provide new insights into ovarian and prostate cancer progression and drug responses. Adv Drug Deliv Rev. 2014;15(79):193-213.
- Xu X, Farach-Carson MC, Jia X. Three-dimensional in vitro tumor models for cancer research and drug evaluation. Biotechnol Adv. 2014;32(7):1256-68.
- Pickup MW, Mouw JK, Weaver VM. The extracellular matrix modulates the hallmarks of cancer. EMBO Rep. 2014;15(12):1243-53.
- Brassart-Pasco S, Brézillon S, Brassart B, Ramont L, Oudart JB, Monboisse JC. Tumor microenvironment: extracellular matrix alterations influence tumor progression. Front Oncol. 2020;10:397.
- Nazemi M, Rainero E. Cross-talk between the tumor microenvironment, extracellular matrix, and cell metabolism in cancer. Front Oncol. 2020;10.
- Jackson HW, Defamie V, Waterhouse P, Khokha R. TIMPs: versatile extracellular regulators in cancer. Nat Rev Cancer. 2017;17(1):38-53.
- Li J, Xu R. Obesity-associated ECM remodeling in cancer progression. Cancers (Basel). 2022;14(22):5684.
- Popovic A, Tartare-Deckert S. Role of extracellular matrix architecture and signaling in melanoma therapeutic resistance. Front Oncol. 2022;12.
- Gordon-Weeks A, Yuzhalin AE. Cancer extracellular matrix proteins regulate tumour immunity. Cancers (Basel). 2020;12(11):1-25.
- Romero-López M, Trinh AL, Sobrino A, Hatch MMS, Keating MT, Fimbres C, Lewis DE, Gershon PD, Botvinick EL, Digman M, Lowengrub JS, Hughes CCW. Recapitulating the human tumor microenvironment: colon tumor-derived extracellular matrix promotes angiogenesis and tumor cell growth. Biomaterials. 2017;116:118-29.
- Brown Y, Hua S, Tanwar PS. Extracellular matrix in high-grade serous ovarian cancer: advances in understanding of carcinogenesis and cancer biology. Matrix Biol. 2023;118:16-46.
- Frantz C, Stewart KM, Weaver VM. The extracellular matrix at a glance. J Cell Sci. 2010;123(Pt 24):4195-200.
- Langhans SA. Three-dimensional in vitro cell culture models in drug discovery and drug repositioning. Front Pharmacol. 2018;9(JAN):6.
- Rozario T, DeSimone DW. The extracellular matrix in development and morphogenesis: a dynamic view. Dev Biol. 2010;341(1):126-40.
- Luca AC, Mersch S, Deenen R, Schmidt S, Messner I, Schäfer KL, Baldus SE, Huckenbeck W, Piekorz RP, Knoefel WT, Krieg A, Stoecklein NH. Impact of the 3D microenvironment on phenotype, gene expression, and EGFR inhibition of colorectal cancer cell lines. PLoS ONE. 2013;8(3):e59689.
- Li L, Zhao Q, Kong W. Extracellular matrix remodeling and cardiac fibrosis. Matrix Biol. 2018;1(68-69):490-506.
- Kiss DL, Windus LCE, Avery VM. Chemokine receptor expression on integrin-mediated stellate projections of prostate cancer cells in 3D culture. Cytokine. 2013;64(1):122-30.
- Urbanczyk M, Layland SL, Schenke-Layland K. The role of extracellular matrix in biomechanics and its impact on bioengineering of cells and 3D tissues. Matrix Biol. 2020;1(85-86):1-14.
- Harunaga JS, Yamada KM. Cell-matrix adhesions in 3D. Matrix Biol. 2011;30(7-8):363-8.
- Schmitz A, Fischer SC, Mattheyer C, Pampaloni F, Stelzer EHK. Multiscale image analysis reveals structural heterogeneity of the cell microenvironment in homotypic spheroids. Sci Rep. 2017;7(1):1-13.
- Imamura Y, Mukohara T, Shimono Y, Funakoshi Y, Chayahara N, Toyoda M, Kiyota N, Takao S, Kono S, Nakatsura T, Minami H. Comparison of
26. Loessner D, Stok KS, Lutolf MP, Hutmacher DW, Clements JA, Rizzi SC. Bioengineered 3D platform to explore cell-ECM interactions and drug resistance of epithelial ovarian cancer cells. Biomaterials. 2010;31(32):8494-506.
27. Zhou CH, Yang SF, Li PQ. Human lung cancer cell line SPC-A1 contains cells with characteristics of cancer stem cells. Neoplasma. 2012;59(6):685-92.
28. Gamerith G, Rainer J, Huber JM, Hackl H, Trajanoski Z, Koeck S, Lorenz E, Kern J, Kofler R, Kelm JM, Zwierzina H, Amann A, Gamerith G, Rainer J, Huber JM, HackI H, Trajanoski Z, Koeck S, Lorenz E, Kern J, Kofler R, Kelm JM, Zwierzina H, Amann A. 3D-cultivation of NSCLC cell lines induce gene expression alterations of key cancer-associated pathways and mimic in-vivo conditions. Oncotarget. 2017;8(68):112647-61.
29. Jiang R, Huang J, Sun X, Chu X, Wang F, Zhou J, Fan Q, Pang L. Construction of in vitro 3-D model for lung cancer-cell metastasis study. BMC Cancer. 2022;22(1):1-9. https://doi.org/10.1186/s12885-022-09546-9.
30. Chong YK, Toh TB, Zaiden N, Poonepalli A, Leong SH, Ong CEL, Yu Y, Tan PB, See SJ, Ng WH, Ng I, Hande MP, Kon OL, Ang BT, Tang C. Cryopreservation of neurospheres derived from human glioblastoma multiforme. Stem Cells. 2009;27(1):29.
31. Panchalingam K, Paramchuk W, Hothi P, Shah N, Hood L, Foltz G, Behie LA, Panchalingam K, Paramchuk W, Hothi P, Shah N, Hood L, Foltz G, Behie LA. Large-scale production of human glioblastoma-derived cancer stem cell tissue in suspension bioreactors to facilitate the development of novel oncolytic therapeutics. Cancer Stem Cells-The Cutting Edge. 2011;475-502.
32. Sutherland RM, Inch WR, McCredie JA, Kruuv J. A multi-component radiation survival curve using an in vitro tumour model. Int J Radiat Biol Relat Stud Phys Chem Med. 1970;18(5):491-5.
33. Youn BS, Sen A, Behie LA, Girgis-Gabardo A, Hassell JA. Scale-up of breast cancer stem cell aggregate cultures to suspension bioreactors. Biotechnol Prog. 2006;22(3):801-10. https://doi.org/10.1021/bp050 430z.
34. Kuo CT, Chiang CL, Chang CH, Liu HK, Huang GS, Huang RYJ, Lee H, Huang CS, Wo AM. Modeling of cancer metastasis and drug resistance via biomimetic nano-cilia and microfluidics. Biomaterials. 2014;35(5):1562-71.
35. Ware MJ, Keshishian V, Law JJ, Ho JC, Favela CA, Rees P, Smith B, Mohammad S, Hwang RF, Rajapakshe K, Coarfa C, Huang S, Edwards DP, Corr SJ, Godin B, Curley SA. Generation of an in vitro 3D PDAC stroma rich spheroid model. Biomaterials. 2016;108:129-42.
36. Rice AJ, Cortes E, Lachowski D, Cheung BCH, Karim SA, Morton JP, Del Río Hernández A. Matrix stiffness induces epithelial-mesenchymal transition and promotes chemoresistance in pancreatic cancer cells. Oncogenesis. 2017;6(7):e352.
37. Kuo CT, Chiang CL, Huang RYJ, Lee H, Wo AM. Configurable 2D and 3D spheroid tissue cultures on bioengineered surfaces with acquisition of epithelial-mesenchymal transition characteristics. NPG Asia Mater. 2012;4(9):e27.
38. Michy T, Massias T, Bernard C, Vanwonterghem L, Henry M, Guidetti M, Royal G, Coll JL, Texier I, Josserand V, Hurbin A. Verteporfin-loaded lipid nanoparticles improve ovarian cancer photodynamic therapy in vitro and in vivo. Cancers. 2019;11(11):1760.
39. Hirst J, Pathak HB, Hyter S, Pessetto ZY, Ly T, Graw S, Koestler DC, Krieg AJ, Roby KF, Godwin AK. Licofelone enhances the efficacy of paclitaxel in ovarian cancer by reversing drug resistance and tumor stem-like properties. Cancer Res. 2018;78(15):4370-85. https://doi.org/10.1158/ 0008-5472.CAN-17-3993.
40. Goodwin TJ, Milburn Jessup J, Wolf DA. Morphologic differentiation of colon carcinoma cell lines HT-29 and HT-29KM in rotating-wall vessels. In Vitro Cell Dev Biol. 1992;28A(1):47-60.
41. Dainiak MB, Savina IN, Musolino I, Kumar A, Mattiasson B, Galaev IY. Biomimetic macroporous hydrogel scaffolds in a high-throughput screening format for cell-based assays. Biotechnol Prog. 2008;24(6):1373-83.
42. Chandrasekaran S, Deng H, Fang Y. PTEN deletion potentiates invasion of colorectal cancer spheroidal cells through 3D Matrigel. Integr Biol (Camb). 2015;7(3):324-34.
43. Poornima K, Francis AP, Hoda M, Eladl MA, Subramanian S, Veeraraghavan VP, El-Sherbiny M, Asseri SM, Hussamuldin ABA, Surapaneni KM, Mony U, Rajagopalan R. Implications of three-dimensional cell culture in cancer therapeutic research. Front Oncol. 2022;12.
44. Gunti S, Hoke ATK, Vu KP, London NR. Organoid and spheroid tumor models: techniques and applications. Cancers (Basel). 2021;13(4):1-18.
45. Lovitt CJ, Shelper TB, Avery VM. Advanced cell culture techniques for cancer drug discovery. Biology. 2014;3(2):345-67.
46. Zeilinger K, Freyer N, Damm G, Seehofer D, Knöspel F. Cell sources for in vitro human liver cell culture models. Exp Biol Med (Maywood). 2016;241(15):1684-98.
47. Eglen RM, Reisine T. Human iPS cell-derived patient tissues and 3D cell culture part 2: spheroids, organoids, and disease modeling. SLAS Technol. 2019;24(1):18-27.
48. Su J, Zhang L, Zhang W, Choi DS, Wen J, Jiang B, Chang CC, Zhou X. Targeting the biophysical properties of the myeloma initiating cell niches: a pharmaceutical synergism analysis using multi-scale agent-based modeling. PLoS ONE. 2014;9(1):e85059.
49. Valyi-Nagy K, Kormos B, Ali M, Shukla D, Valyi-Nagy T. Stem cell marker CD271 is expressed by vasculogenic mimicry-forming uveal melanoma cells in three-dimensional cultures. Mol Vis. 2012;18:588.
50. Lombardo Y, Filipovicá A, Molyneux G, Periyasamy M, Giamas G, Hu Y, Trivedi PS, Wang J, Yaguë E, Michel L, Coombes RC. Nicastrin regulates breast cancer stem cell properties and tumor growth in vitro and in vivo. Proc Natl Acad Sci U S A. 2012;109(41):16558-63.
51. Sgodda M, Dai Z, Zweigerdt R, Sharma AD, Ott M, Cantz T. A scalable approach for the generation of human pluripotent stem cell-derived hepatic organoids with sensitive hepatotoxicity features. Stem Cells Dev. 2017;26(20):1490-504.
52. Meier F, Freyer N, Brzeszczynska J, Knöspel F, Armstrong L, Lako M, Greuel S, Damm G, Ludwig-Schwellinger E, Deschl U, Ross JA, Beilmann M, Zeilinger K. Hepatic differentiation of human iPSCs in different 3D models: a comparative study. Int J Mol Med. 2017;40(6):1759.
53. Weng KC, Kurokawa YK, Hajek BS, Paladin JA, Shirure VS, George SC. Human induced pluripotent stem-cardiac-endothelial-tumor-on-achip to assess anticancer efficacy and cardiotoxicity. Tissue Eng Part C Methods. 2020;26(1):44-55. https://doi.org/10.1089/ten.tec.2019.0248.
54. Liu S, Fang C, Zhong C, Li J, Xiao Q. Recent advances in pluripotent stem cell-derived cardiac organoids and heart-on-chip applications for studying anti-cancer drug-induced cardiotoxicity. Cell Biol Toxicol. 2023;39:2527.
55. Han R, Sun Q, Wu J, Zheng P, Zhao G. Sodium butyrate upregulates miR203 expression to exert anti-proliferation effect on colorectal cancer cells. Cell Physiol Biochem. 2016;39(5):1919-29.
56. Fontoura JC, Viezzer C, dos Santos FG, Ligabue RA, Weinlich R, Puga RD, Antonow D, Severino P, Bonorino C. Comparison of 2D and 3D cell culture models for cell growth, gene expression and drug resistance. Mater Sci Eng, C. 2020;1(107): 110264.
57. Ingram M, Techy GB, Saroufeem R, Yazan O, Narayan KS, Goodwin TJ, Spaulding GF. Three-dimensional growth patterns of various human tumor cell lines in simulated microgravity of a NASA bioreactor. In Vitro Cell Dev Biol Anim. 1997;33(6):459-66.
58. Lv D, Yu SC, Ping YF, Wu H, Zhao X, Zhang H, Cui Y, Chen B, Zhang X, Dai J, Bian XW, Yao XH. A three-dimensional collagen scaffold cell culture system for screening anti-glioma therapeutics. Oncotarget. 2016;7(35):56904.
59. Spill F, Reynolds DS, Kamm RD, Zaman MH. Impact of the physical microenvironment on tumor progression and metastasis. Curr Opin Biotechnol. 2016;40:41-8.
60. Ravi M, Paramesh V, Kaviya SR, Anuradha E, Paul Solomon FD. 3D cell culture systems: advantages and applications. J Cell Physiol. 2015;230(1):16-26. https://doi.org/10.1002/jcp.24683.
61. Campuzano S, Pelling AE. Scaffolds for 3D cell culture and cellular agriculture applications derived from non-animal sources. Front Sustain Food Syst. 2019;17(3):38.
62. Hippler M, Lemma ED, Bertels S, Blasco E, Barner-Kowollik C, Wegener M, Bastmeyer M. 3D scaffolds to study basic cell biology. Adv Mater. 2019. https://doi.org/10.1002/adma.201808110.
63. Cavo M, Delle Cave D, D’Amone E, Gigli G, Lonardo E, del Mercato LL. A synergic approach to enhance long-term culture and manipulation of MiaPaCa-2 pancreatic cancer spheroids. Sci Rep. 2020;10(1).
64. Ware MJ, Colbert K, Keshishian V, Ho J, Corr SJ, Curley SA, Godin B. Generation of homogenous three-dimensional pancreatic cancer cell spheroids using an improved hanging drop technique. Tissue Eng Part C Methods. 2016;22(4):312-21.
65. Foty R. A simple hanging drop cell culture protocol for generation of
66. Timmins NE, Nielsen LK. Generation of multicellular tumor spheroids by the hanging-drop method. Methods Mol Med. 2007;140:141-51.
67. Zhao L, Xiu J, Liu Y, Zhang T, Pan W, Zheng X, Zhang X. A 3D printed hanging drop dripper for tumor spheroids analysis without recovery. Sci Rep. 2019;9(1):1-14.
68. Gao W, Wu D, Wang Y, Wang Z, Zou C, Dai Y, Ng CF, Teoh JYC, Chan FL. Development of a novel and economical agar-based non-adherent three-dimensional culture method for enrichment of cancer stemlike cells. Stem Cell Res Ther. 2018;9(1):243. https://doi.org/10.1186/ s13287-018-0987-x.
69. Madoux F, Tanner A, Vessels M, Willetts L, Hou S, Scampavia L, Spicer TP. A 1536-well 3D viability assay to assess the cytotoxic effect of drugs on spheroids. SLAS Discov. 2017;22(5):516-24.
70. Khawar IA, Park JK, Jung ES, Lee MA, Chang S, Kuh HJ. Three dimensional mixed-cell spheroids mimic stroma-mediated chemoresistance and invasive migration in hepatocellular carcinoma. Neoplasia. 2018;20(8):800-12.
71. Song Y, Kim JS, Choi EK, Kim J, Kim KM, Seo HR, Song Y, Kim JS, Kyung Choi E, Kim J, Mo Kim K, Ran Seo H. TGF-
72. Ma L, Li Y, Wu Y, Aazmi A, Zhang B, Zhou H, Yang H. The construction of in vitro tumor models based on 3D bioprinting. Biodes Manuf. 2020;3(3):227-36.
73. Xie M, Gao Q, Fu J, Chen Z, He Y. Bioprinting of novel 3D tumor array chip for drug screening. Biodes Manuf. 2020;3(3):175-88.
74. Datta P, Dey M, Ataie Z, Unutmaz D, Ozbolat IT. 3D bioprinting for reconstituting the cancer microenvironment. NPJ Precis Oncol. 2020;4(1).
75. LaBarge W, Morales A, Pretorius D, Kahn-Krell AM, Kannappan R, Zhang J. Scaffold-free bioprinter utilizing layer-by-layer printing of cellular spheroids. Micromachines (Basel). 2019;10(9):570.
76. Khoshnood N, Zamanian A. A comprehensive review on scaffold-free bioinks for bioprinting. Bioprinting. 2020;1(19): e00088.
77. Norotte C, Marga FS, Niklason LE, Forgacs G. Scaffold-free vascular tissue engineering using bioprinting. Biomaterials. 2009;30(30):5910-7.
78. Anil-Inevi M, Delikoyun K, Mese G, Tekin HC, Ozcivici E. Magnetic levitation assisted biofabrication, culture, and manipulation of 3D cellular structures using a ring magnet based setup. Biotechnol Bioeng. 2021;118(12):4771-85.
79. Anil-Inevi M, Yaman S, Yildiz AA, Mese G, Yalcin-Ozuysal O, Tekin HC, Ozcivici E. Biofabrication of in situ self assembled 3D cell cultures in a weightlessness environment generated using magnetic levitation. Sci Rep. 2018;8(1).
80. Türker E, Demirçak N, Arslan-Yildiz A. Correction: scaffold-free threedimensional cell culturing using magnetic levitation. Biomater Sci. 2018;6(7):1996.
81. Haisler WL, Timm DM, Gage JA, Tseng H, Killian TC, Souza GR. Three-dimensional cell culturing by magnetic levitation. Nat Protoc. 2013;8(10):1940-9.
82. Jaganathan H, Gage J, Leonard F, Srinivasan S, Souza GR, Dave B, Godin B. Three-dimensional in vitro co-culture model of breast tumor using magnetic levitation. Sci Rep. 2014;4.
83. Caleffi JT, Aal MCE, de Gallindo H, Caxali GH, Crulhas BP, Ribeiro AO, Souza GR, Delella FK. Magnetic 3D cell culture: state of the art and current advances. Life Sci. 2021;286:120028.
84. Rogers M, Sobolik T, Schaffer DK, Samson PC, Johnson AC, Owens P, Codreanu SG, Sherrod SD, McLean JA, Wikswo JP, Richmond A. Engineered microfluidic bioreactor for examining the three-dimensional breast tumor microenvironment. Biomicrofluidics. 2018;12(3):34102.
85. Xu Z, Gao Y, Hao Y, Li E, Wang Y, Zhang J, Wang W, Gao Z, Wang Q. Application of a microfluidic chip-based 3D co-culture to test drug sensitivity for individualized treatment of lung cancer. Biomaterials. 2013;34(16):4109-17.
86. Ruedinger F, Lavrentieva A, Blume C, Pepelanova I, Scheper T. Hydrogels for 3D mammalian cell culture: a starting guide for laboratory practice. Appl Microbiol Biotechnol. 2015;99(2):623-36.
87. Zhang N, Milleret V, Thompson-Steckel G, Huang NP, Vörös J, Simona
88. Rijal G, Bathula C, Li W. Application of synthetic polymeric scaffolds in breast cancer 3D tissue cultures and animal tumor models. Int J Biomater. 2017;2017:9.
89. Unnikrishnan K, Thomas LV, Ram Kumar RM. Advancement of scaffoldbased 3D cellular models in cancer tissue engineering: an update. Front Oncol. 2021;11.
90. van Tienderen GS, Conboy J, Muntz I, Willemse J, Tieleman J, Monfils K, Schurink IJ, Demmers JAA, Doukas M, Koenderink GH, van der Laan LJW, Verstegen MMA. Tumor decellularization reveals proteomic and mechanical characteristics of the extracellular matrix of primary liver cancer. Biomater Adv. 2023;1(146): 213289.
91. Li X, Valadez AV, Zuo P, Nie Z. Microfluidic 3D cell culture: potential application for tissue-based bioassays. Bioanalysis. 2012;4(12):1509.
92. Zhong Q, Ding H, Gao B, He Z, Gu Z. Advances of microfluidics in biomedical engineering. Adv Mater Technol. 2019;4(6).
93. Santos SC, Custódio CA, Mano JF. Human protein-based porous scaffolds as platforms for xeno-free 3D cell culture. Adv Healthc Mater. 2022;11(12).
94. Afewerki S, Sheikhi A, Kannan S, Ahadian S, Khademhosseini A. Gelatin-polysaccharide composite scaffolds for 3D cell culture and tissue engineering: Towards natural therapeutics. Bioeng Transl Med. 2018;4(1):96-115.
95. Chen L, Xiao Z, Meng Y, Zhao Y, Han J, Su G, Chen B, Dai J. The enhancement of cancer stem cell properties of MCF-7 cells in 3D collagen scaffolds for modeling of cancer and anti-cancer drugs. Biomaterials. 2012;33(5):1437-44.
96. McGrath J, Panzica L, Ransom R, Withers HG, Gelman IH. Identification of genes regulating breast cancer dormancy in 3D bone endosteal niche cultures. Mol Cancer Res. 2019;17(4):860-9.
97. Arya N, Sardana V, Saxena M, Rangarajan A, Katti DS. Recapitulating tumour microenvironment in chitosan-gelatin three-dimensional scaffolds: an improved in vitro tumour model. J R Soc Interface. 2012;9(77):3288-302.
98. Bassi G, Panseri S, Dozio SM, Sandri M, Campodoni E, Dapporto M, Sprio S, Tampieri A, Montesi M. Scaffold-based 3D cellular models mimicking the heterogeneity of osteosarcoma stem cell niche. Sci Rep. 2020;10(1):22294.
99. Kievit FM, Wang K, Erickson AE, Lan Levengood SK, Ellenbogen RG, Zhang M. Modeling the tumor microenvironment using chitosanalginate scaffolds to control the stem-like state of glioblastoma cells. Biomater Sci. 2016;4(4):610.
100. Li W, Hu X, Wang S, Xing Y, Wang H, Nie Y, Liu T, Song K. Multiple comparisons of three different sources of biomaterials in the application of tumor tissue engineering in vitro and in vivo. Int J Biol Macromol. 2019;130:166-76.
101. Palomeras S, Rabionet M, Ferrer I, Sarrats A, Garcia-Romeu ML, Puig T, Ciurana J. Breast cancer stem cell culture and enrichment using Poly(
102. Pradhan S, Clary JM, Seliktar D, Lipke EA. A three-dimensional spheroidal cancer model based on PEG-fibrinogen hydrogel microspheres. Biomaterials. 2017;1(115):141-54.
103. Godugu C, Patel AR, Desai U, Andey T, Sams A, Singh M. AlgiMatrix
104. Andersen T, Auk-Emblem P, Dornish M. 3D cell culture in alginate hydrogels. Microarrays. 2015;4(2):133-61.
105. Yang Z, Zhao X. A 3D model of ovarian cancer cell lines on peptide nanofiber scaffold to explore the cell-scaffold interaction and chemotherapeutic resistance of anticancer drugs. Int J Nanomed. 2011;6:310.
106. Song H, Cai GH, Liang J, Ao DS, Wang H, Yang ZH. Three-dimensional culture and clinical drug responses of a highly metastatic human ovarian cancer HO-8910PM cells in nanofibrous microenvironments of three hydrogel biomaterials. J Nanobiotechnol. 2020;18(1):90.
107. Suo A, Xu W, Wang Y, Sun T, Ji L, Qian J. Dual-degradable and injectable hyaluronic acid hydrogel mimicking extracellular matrix for 3D culture of breast cancer MCF-7 cells. Carbohydr Polym. 2019;211:336-48.
108. Wang J, Xu W, Qian J, Wang Y, Hou G, Suo A. Photo-crosslinked hyaluronic acid hydrogel as a biomimic extracellular matrix to recapitulate in vivo features of breast cancer cells. Colloids Surf B Biointerfaces. 2022;209:112159.
109. Kim MJ, Chi BH, Yoo JJ, Ju YM, Whang YM, Chang IH. Structure establishment of three-dimensional (3D) cell culture printing model for bladder cancer. PLoS ONE. 2019;14(10):e0223689.
110. Loessner D, Meinert C, Kaemmerer E, Martine LC, Yue K, Levett PA, Klein TJ, Melchels FPW, Khademhosseini A, Hutmacher DW. Functionalization, preparation and use of cell-laden gelatin methacryloyl-based hydrogels as modular tissue culture platforms. Nat Protoc. 2016;11(4):727-46.
111. Arya AD, Hallur PM, Karkisaval AG, Gudipati A, Rajendiran S, Dhavale V, Ramachandran B, Jayaprakash A, Gundiah N, Chaubey A. Gelatin methacrylate hydrogels as biomimetic three-dimensional matrixes for modeling breast cancer invasion and chemoresponse in vitro. ACS Appl Mater Interfaces. 2016;8(34):22005-17.
112. Curtis KJ, Schiavi J, Mc Garrigle MJ, Kumar V, McNamara LM, Niebur GL. Mechanical stimuli and matrix properties modulate cancer spheroid growth in three-dimensional gelatin culture. J R Soc Interface. 2020;17(173):20200568.
113. Cavo M, Fato M, Peñuela L, Beltrame F, Raiteri R, Scaglione S. Microenvironment complexity and matrix stiffness regulate breast cancer cell activity in a 3D in vitro model. Sci Rep. 2016;6(1):1-13.
114. VandenHeuvel SN, Farris HA, Noltensmeyer DA, Roy S, Donehoo DA, Kopetz S, Haricharan S, Walsh AJ, Raghavan S. Decellularized organ biomatrices facilitate quantifiable in vitro 3D cancer metastasis models. Soft Matter. 2022;18(31):5791-806.
115. Landberg G, Fitzpatrick P, Isakson P, Jonasson E, Karlsson J, Larsson E, Svanström A, Rafnsdottir S, Persson E, Gustafsson A, Andersson D, Rosendahl J, Petronis S, Ranji P, Gregersson P, Magnusson Y, Håkansson J, Ståhlberg A. Patient-derived scaffolds uncover breast cancer promoting properties of the microenvironment. Biomaterials. 2020;1(235): 119705.
116. Zhang
117. D’angelo E, Natarajan D, Sensi F, Ajayi O, Fassan M, Mammano E, Pilati P, Pavan P, Bresolin S, Preziosi M, Miquel R, Zen Y, Chokshi S, Menon K, Heaton N, Spolverato G, Piccoli M, Williams R, Urbani L, Agostini M. Patientderived scaffolds of colorectal cancer metastases as an organotypic 3D model of the liver metastatic microenvironment. Cancers (Basel). 2020;12(2):364.
118. Varinelli L, Guaglio M, Brich S, Zanutto S, Belfiore A, Zanardi F, lannelli F, Oldani A, Costa E, Chighizola M, Lorenc E, Minardi SP, Fortuzzi S, Filugelli M, Garzone G, Pisati F, Vecchi M, Pruneri G, Kusamura S, Baratti D, Cattaneo L, Parazzoli D, Podestà A, Milione M, Deraco M, Pierotti MA, Gariboldi M. Decellularized extracellular matrix as scaffold for cancer organoid cultures of colorectal peritoneal metastases. J Mol Cell Biol. 2023;14(11).
119. Tian X, Werner ME, Roche KC, Hanson AD, Foote HP, Yu SK, Warner SB, Copp JA, Lara H, Wauthier EL, Caster JM, Herring LE, Zhang L, Tepper JE, Hsu DS, Zhang T, Reid LM, Wang AZ. Organ-specific metastases obtained by culturing colorectal cancer cells on tissue-specific decellularized scaffolds. Nat Biomed Eng. 2018;2(6):443-52.
120. Li H, Dai W, Xia X, Wang R, Zhao J, Han L, Mo S, Xiang W, Du L, Zhu G, Xie J, Yu J, Liu N, Huang M, Zhu J, Cai G. Modeling tumor development and metastasis using paired organoids derived from patients with colorectal cancer liver metastases. J Hematol Oncol. 2020;13(1):1-6. https://doi. org/10.1186/s13045-020-00957-4.
121. Parkinson GT, Salerno S, Ranji P, Håkansson J, Bogestål Y, Wettergren Y, Ståhlberg A, Bexe Lindskog E, Landberg G. Patient-derived scaffolds as a model of colorectal cancer. Cancer Med. 2021;10(3):867-82.
122. Jian M, Ren L, Ren L, He G, He G, Lin Q, Lin Q, Tang W, Tang W, Chen Y, Chen J, Chen J, Liu T, Ji M, Ji M, Wei Y, Wei Y, Chang W, Chang W, Xu J, Xu J. A novel patient-derived organoids-based xenografts model for preclinical drug response testing in patients with colorectal liver metastases. J Transl Med. 2020;18(1):1-17. https://doi.org/10.1186/ s12967-020-02407-8.
123. Pinto
124. Helal-Neto E, Brandão-Costa RM, Saldanha-Gama R, Ribeiro-Pereira C, Midlej V, Benchimol M, Morandi V, Barja-Fidalgo C. Priming endothelial cells with a melanoma-derived extracellular matrix triggers the activation of avß3/VEGFR2 axis. J Cell Physiol. 2016;231(11):2464-73.
125. Fontana F, Raimondi M, Marzagalli M, Sommariva M, Limonta P, Gagliano N. Epithelial-to-mesenchymal transition markers and CD44 isoforms are differently expressed in 2D and 3D cell cultures of prostate cancer cells. Cells. 2019;8(2):143.
126. Li GN, Livi LL, Gourd CM, Deweerd ES, Hoffman-Kim D. Genomic and morphological changes of neuroblastoma cells in response to threedimensional matrices. Tissue Eng. 2007;13(5):1035-47.
127. Sarwar M, Sykes PH, Chitcholtan K, Evans JJ. Collagen I dysregulation is pivotal for ovarian cancer progression. Tissue Cell. 2022;74.
128. Tsai S, McOlash L, Palen K, Johnson B, Duris C, Yang Q, Dwinell MB, Hunt
129. Sha H, Zou Z, Xin K, Bian X, Cai X, Lu W, Chen J, Chen G, Huang L, Blair AM, Cao P, Liu B. Tumor-penetrating peptide fused EGFR single-domain antibody enhances cancer drug penetration into 3D multicellular spheroids and facilitates effective gastric cancer therapy. J Control Release. 2015;28(200):188-200.
130. Monteiro MV, Gaspar VM, Ferreira LP, Mano JF. Hydrogel 3D in vitro tumor models for screening cell aggregation mediated drug response. Biomater Sci. 2020;8(7):1855-64.
131. Kundu B, Saha P, Datta K, Kundu SC. A silk fibroin based hepatocarcinoma model and the assessment of the drug response in hyaluronan-binding protein 1 overexpressed HepG2 cells. Biomaterials. 2013;34(37):9462-74.
132. Simon KA, Mosadegh B, Minn KT, Lockett MR, Mohammady MR, Boucher DM, Hall AB, Hillier SM, Udagawa T, Eustace BK, Whitesides GM. Metabolic response of lung cancer cells to radiation in a paper-based 3D cell culture system. Biomaterials. 2016;1(95):47-59.
133. Loessner D, Rizzi SC, Stok KS, Fuehrmann T, Hollier B, Magdolen V, Hutmacher DW, Clements JA. A bioengineered 3D ovarian cancer model for the assessment of peptidase-mediated enhancement of spheroid growth and intraperitoneal spread. Biomaterials. 2013;34(30):7389-400.
134. Stratmann AT, Fecher D, Wangorsch G, Göttlich C, Walles T, Walles H, Dandekar T, Dandekar G, Nietzer SL. Establishment of a human 3D lung cancer model based on a biological tissue matrix combined with a Boolean in silico model. Mol Oncol. 2014;8(2):351-65. https://doi.org/ 10.1016/j.molonc.2013.11.009.
135. Dunne LW, Huang Z, Meng W, Fan X, Zhang N, Zhang Q, An Z. Human decellularized adipose tissue scaffold as a model for breast cancer cell growth and drug treatments. Biomaterials. 2014;35(18):4940-9.
136. Çetin EA. Investigation of the viability of different cancer cells on decelIularized adipose tissue. Celal Bayar Univ J Sci. 2023;19(2):113-9.
137. Sensi F, D’angelo E, Piccoli M, Pavan P, Mastrotto F, Caliceti P, Biccari A, Corallo D, Urbani L, Fassan M, Spolverato G, Riello P, Pucciarelli S, Agostini M. Recellularized colorectal cancer patient-derived scaffolds as in vitro pre-clinical 3D model for drug screening. Cancers (Basel). 2020;12(3).
138. Mazza G, Telese A, Al-Akkad W, Frenguelli L, Levi A, Marrali M, Longato L, Thanapirom K, Vilia MG, Lombardi B, Crowley C, Crawford M, Karsdal MA, Leeming DJ, Marrone G, Bottcher K, Robinson B, Del Rio HA, Tamburrino D, Spoletini G, Malago M, Hall AR, Godovac-Zimmermann J, Luong TV, De Coppi P, Pinzani M, Rombouts K. Cirrhotic human liver extracellular matrix 3D scaffolds promote smad-dependent TGF-
139. Zhao L, Huang L, Yu S, Zheng J, Wang H, Zhang Y. Decellularized tongue tissue as an in vitro model for studying tongue cancer and tongue regeneration. Acta Biomater. 2017;58:122-35.
140. Blanco-Fernandez B, Rey-Vinolas S, Bağcl G, Rubi-Sans G, Otero J, Navajas D, Perez-Amodio S, Engel E. Bioprinting decellularized breast tissue
for the development of three-dimensional breast cancer models. ACS Appl Mater Interfaces. 2022;14(26):29467-82. https://doi.org/10.1021/ acsami.2c00920.
141. Molla MDS, Katti DR, Katti KS. An in vitro model of prostate cancer bone metastasis for highly metastatic and non-metastatic prostate cancer using nanoclay bone-mimetic scaffolds. Springer Link. 2019;4(21):120713. https://doi.org/10.1557/adv.2018.682.
142. Bai G, Yuan P, Cai B, Qiu X, Jin R, Liu S, Li Y, Chen X. Stimuli-responsive scaffold for breast cancer treatment combining accurate photothermal therapy and adipose tissue regeneration. Adv Funct Mater. 2019. https://doi.org/10.1002/adfm.201904401.
143. Lee JH, Kim SK, Khawar IA, Jeong SY, Chung S, Kuh HJ. Microfluidic co-culture of pancreatic tumor spheroids with stellate cells as a novel 3D model for investigation of stroma-mediated cell motility and drug resistance. J Exp Clin Cancer Res. 2018;37(1):1-12. https://doi.org/10. 1186/s13046-017-0654-6.
144. Chen Y, Sun W, Kang L, Wang Y, Zhang M, Zhang H, Hu P. Microfluidic co-culture of liver tumor spheroids with stellate cells for the investigation of drug resistance and intercellular interactions. Analyst. 2019;144(14):4233-40.
145. Jeong SY, Lee JH, Shin Y, Chung S, Kuh HJ. Co-culture of tumor spheroids and fibroblasts in a collagen matrix-incorporated microfluidic chip mimics reciprocal activation in solid tumor microenvironment. PLoS ONE. 2016;11(7):e0159013.
146. Shin CS, Kwak B, Han B, Park K. Development of an in vitro 3D tumor model to study therapeutic efficiency of an anticancer drug. Mol Pharm. 2013;10(6):2167-75. https://doi.org/10.1021/mp300595a.
147. Hübner J, Raschke M, Rütschle I, Gräßle S, Hasenberg T, Schirrmann K, Lorenz A, Schnurre S, Lauster R, Maschmeyer I, Steger-Hartmann T, Marx U. Simultaneous evaluation of anti-EGFR-induced tumour and adverse skin effects in a microfluidic human 3D co-culture model. Sci Rep. 2018;8(1):1-12.
148. Dorayappan KDP, Gardner ML, Hisey CL, Zingarelli RA, Smith BQ, Lightfoot MDS, Gogna R, Flannery MM, Hays J, Hansford DJ, Freitas MA, Yu L, Cohn DE, Selvendiran K. A microfluidic chip enables isolation of exosomes and establishment of their protein profiles and associated signaling pathways in ovarian cancer. Cancer Res. 2019;79(13):3503-13.
149. Booij TH, Price LS, Danen EHJ. 3D cell-based assays for drug screens: challenges in imaging, image analysis, and high-content analysis. SLAS Discovery. 2019;24(6):615-27.
150. Eskes C, Boström AC, Bowe G, Coecke S, Hartung T, Hendriks G, Pamies D, Piton A, Rovida C. Good cell culture practices & in vitro toxicology. Toxicol In Vitro. 2017;1(45):272-7.
151. Coecke S, Balls M, Bowe G, Davis J, Gstraunthaler G, Hartung T, Hay R, Merten OW, Price A, Schechtman L, Stacey G, Stokes W. Guidance on good cell culture practice: a report of the Second ECVAM Task Force on good cell culture practice. Altern Lab Anim. 2005;33(3):261-87.
152. Kasendra M, Troutt M, Broda T, Bacon WC, Wang TC, Niland JC, Helmrath MA. The engineered gut: use of stem cells and tissue engineering to study physiological mechanisms and disease processes: intestinal organoids: roadmap to the clinic. Am J Physiol Gastrointest Liver Physiol. 2021;321(1):G1.
153. Al-Ani A, Toms D, Kondro D, Thundathil J, Yu Y, Ungrin M. Oxygenation in cell culture: critical parameters for reproducibility are routinely not reported. PLoS ONE. 2018;13(10):e0204269.
154. Blatchley MR, Hall F, Ntekoumes D, Cho H, Kailash V, Vazquez-Duhalt R, Gerecht S. Discretizing three-dimensional oxygen gradients to modulate and investigate cellular processes. Adv Sci. 2021;8(14):2100190. https://doi.org/10.1002/advs. 202100190.
155. Martinez NJ, Titus SA, Wagner AK, Simeonov A. High-throughput fluorescence imaging approaches for drug discovery using in vitro and in vivo three-dimensional models. Expert Opin Drug Discov. 2015;10(12):1347-61.
156. Robertson FM, Ogasawara MA, Ye Z, Chu K, Pickei R, Debeb BG, Woodward WA, Hittelman WN, Cristofanilli M, Barsky SH. Imaging and analysis of 3D tumor spheroids enriched for a cancer stem cell phenotype. J Biomol Screen. 2010;15(7):820-9.
157. Wenzel C, Riefke B, Gründemann S, Krebs A, Christian S, Prinz F, Osterland M, Golfier S, Räse S, Ansari N, Esner M, Bickle M, Pampaloni F, Mattheyer C, Stelzer EH, Parczyk K, Prechtl S, Steigemann P. 3D high-content
screening for the identification of compounds that target cells in dormant tumor spheroid regions. Exp Cell Res. 2014;323(1):131-43.
158. Palacio-Castañeda V, Velthuijs N, Le Gac S, Verdurmen WPR. Oxygen control: the often overlooked but essential piece to create better in vitro systems. Lab Chip. 2022;22(6):1068-92.
159. Boyce MW, Simke WC, Kenney RM, Lockett MR. Generating linear oxygen gradients across 3D cell cultures with block-layered oxygen controlled chips (BLOCCs). Anal Methods. 2020;12(1):18.
160. Li Y, Yang HY, Lee DS. Biodegradable and injectable hydrogels in biomedical applications. Biomacromol. 2022;23(3):609-18. https://doi.org/ 10.1021/acs.biomac.1c01552.
161. Osaki T, Sivathanu V, Kamm RD. Engineered 3D vascular and neuronal networks in a microfluidic platform. Sci Rep. 2018;8(1):1-13.
162. Virumbrales-Muñoz M, Ayuso JM, Lacueva A, Randelovic T, Livingston MK, Beebe DJ, Oliván S, Pereboom D, Doblare M, Fernández L, Ochoa I. Enabling cell recovery from 3D cell culture microfluidic devices for tumour microenvironment biomarker profiling. Sci Rep. 2019;9(1):1-14.
163. Kyykallio H, Faria AVS, Hartmann R, Capra J, Rilla K, Siljander PRM. A quick pipeline for the isolation of 3D cell culture-derived extracellular vesicles. J Extracell Vesicles. 2022;11(10).
164. Hubbell JA. Materials as morphogenetic guides in tissue engineering. Curr Opin Biotechnol. 2003;14(5):551-8.
165. Bartnikowski M, Bartnikowski NJ, Woodruff MA, Schrobback K, Klein TJ. Protective effects of reactive functional groups on chondrocytes in photocrosslinkable hydrogel systems. Acta Biomater. 2015;1(27):66-76.
166. El-Sherbiny IM, Yacoub MH. Hydrogel scaffolds for tissue engineering: progress and challenges. Glob Cardiol Sci Pract. 2013;2013(3):316.
167. Bryant SJ, Nuttelman CR, Anseth KS. Cytocompatibility of UV and visible light photoinitiating systems on cultured NIH/3T3 fibroblasts in vitro. J Biomater Sci Polym Ed. 2000;11(5):439-57.
168. Liu S, Borjigin T, Schmitt M, Morlet-Savary F, Xiao P, Lalevée J. Highperformance photoinitiating systems for LED-induced photopolymerization. Polymers (Basel). 2023;15(2):342.
169. Fang Y, Eglen RM. Three-dimensional cell cultures in drug discovery and development. SLAS Discovery. 2017;22(5):456-72. https://doi.org/10. 1177/1087057117696795.
170. Sirenko O, Mitlo T, Hesley J, Luke S, Owens W, Cromwell EF. High-content assays for characterizing the viability and morphology of 3d cancer spheroid cultures. Assay Drug Dev Technol. 2015;13(7):402-14. https:// doi.org/10.1089/adt.2015.655.
171. Zustiak SP, Boukari H, Leach JB. Solute diffusion and interactions in cross-linked poly(ethylene glycol) hydrogels studied by Fluorescence Correlation Spectroscopy. Soft Matter. 2010;6(15):3609-18.
172. Shanbhag S, Woo Lee J, Kotov N. Diffusion in three-dimensionally ordered scaffolds with inverted colloidal crystal geometry. Biomaterials. 2005;26(27):5581-5.
173. Totti S, Allenby MC, Dos Santos SB, Mantalaris A, Velliou EG. A 3D bioinspired highly porous polymeric scaffolding system for in vitro simulation of pancreatic ductal adenocarcinoma. RSC Adv. 2018;8(37):20928-40.
174. Gupta P, Totti S, Pérez-Mancera PA, Dyke E, Nisbet A, Schettino G, Webb R, Velliou EG. Chemoradiotherapy screening in a novel biomimetic polymer based pancreatic cancer model. RSC Adv. 2019;9(71):41649-63.
175. Hamdi DH, Barbieri S, Chevalier F, Groetz JE, Legendre F, Demoor M, Galera P, Lefaix JL, Saintigny Y. In vitro engineering of human 3D chondrosarcoma: a preclinical model relevant for investigations of radiation quality impact. BMC Cancer. 2015;15(1):1-14. https://doi.org/10.1186/ s12885-015-1590-5.
176. Okere B, Alviano F, Costa R, Quaglino D, Ricci F, Dominici M, Paolucci P, Bonsi L, lughetti L. In vitro differentiation of human amniotic epithelial cells into insulinproducing 3D spheroids. Int J Immunopathol Pharmacol. 2015;28(3):390-402.
177. Paris F, Marrazzo P, Pizzuti V, Marchionni C, Rossi M, Michelotti M, Petrovic B, Ciani E, Simonazzi G, Pession A, Bonsi L, Alviano F. Characterization of perinatal stem cell spheroids for the development of cell therapy strategy. Bioengineering. 2023;10(2):189.
178. Kim W, Park E, Yoo HS, Park J, Jung YM, Park JH. Recent advances in monitoring stem cell status and differentiation using nano-biosensing technologies. Nanomaterials. 2022;12(17):2934.
179. Burdick JA, Vunjak-Novakovic G. Engineered microenvironments for controlled stem cell differentiation. Tissue Eng Part A. 2009;15(2):205-19.
180. De León SE, Pupovac A, McArthur SL. Three-Dimensional (3D) cell culture monitoring: opportunities and challenges for impedance spectroscopy. Biotechnol Bioeng. 2020;117(4):1230-40. https://doi.org/ 10.1002/bit.27270.
181. Sirenko O, Hancock MK, Hesley J, Hong D, Cohen A, Gentry J, Carlson CB, Mann DA. Phenotypic characterization of toxic compound effects on liver spheroids derived from ipsc using confocal imaging and threedimensional image analysis. Assay Drug Dev Technol. 2016;14(7):38194. https://doi.org/10.1089/adt.2016.729.
182. Jensen
183. Ajjarapu SM, Tiwari A, Kumar S. Applications and utility of threedimensional in vitro cell culture for therapeutics. Future Pharmacol. 2023;3(1):213-28.
184. Basu A, Dydowiczová A, Trosko JE, Bláha L, Babica P. Ready to go 3D? A semi-automated protocol for microwell spheroid arrays to increase scalability and throughput of 3D cell culture testing. Toxicol Mech Methods. 2020;30(8):590-604. https://doi.org/10.1080/15376516.2020.1800881.
185. Burdick JA, Murphy WL. Moving from static to dynamic complexity in hydrogel design. Nat Commun. 2012;3(1):1-8.
186. Nash ME, Healy D, Carroll WM, Elvira C, Rochev YA. Cell and cell sheet recovery from pNIPAm coatings; motivation and history to present day approaches. J Mater Chem. 2012;22(37):19376-89.
187. Abuwatfa WH, Awad NS, Pitt WG, Husseini GA. Thermosensitive polymers and thermo-responsive liposomal drug delivery systems. Polymers. 2022;14(5):925.
188. Young EWK, Beebe DJ. Fundamentals of microfluidic cell culture in controlled microenvironments. Chem Soc Rev. 2010;39(3):1036-48.
189. Guvendiren M, Burdick JA. Stiffening hydrogels to probe short- and long-term cellular responses to dynamic mechanics. Nat Commun. 2012;3.
190. Highley CB , Rodell CB , Burdick JA. Direct 3D printing of shear-thinning hydrogels into self-healing hydrogels. Adv Mater. 2015;27(34):5075-9.
191. Malda J, Visser J, Melchels FP, Jüngst T, Hennink WE, Dhert WJA, Groll J, Hutmacher DW. 25th anniversary article: engineering hydrogels for biofabrication. Adv Mater. 2013;25(36):5011-28.
Publisher’s Note
- *Correspondence:
Ghaleb A.Husseini ghusseini@aus.edu
Full list of author information is available at the end of the article
