DOI: https://doi.org/10.1186/s42826-024-00194-7
PMID: https://pubmed.ncbi.nlm.nih.gov/38409070
تاريخ النشر: 2024-02-26
التغيرات المرتبطة بالعمر في الملفات الدموية والبيوكيميائية لجرذان ويستار
الملخص
الخلفية: تُستخدم جرذان ويستار على نطاق واسع كنموذج لتقييم السمية والفعالية في الأبحاث قبل السريرية. تعتبر البيانات المخبرية الدموية والبيوكيميائية ضرورية لتقييم التغيرات المحددة في الملف الفسيولوجي والوظيفي للحيوانات المخبرية. كان الهدف من هذا العمل هو إنشاء قيم مرجعية دموية وبيوكيميائية لجرذان ويستار (هان) في فترات عمرية مختلفة. تم استخدام جرذان ويستار الذكور والإناث (
الخلفية
أيض البروتينات الدهنية، وتنظيم الجلوكوز، ووظائف الأعضاء الأيضية الرئيسية مثل الكبد والكلى. يمكن أن تشير الانحرافات عن النطاق الطبيعي في هذه المعلمات إلى وجود مرض [6]. تشير العديد من الدراسات إلى أن الشيخوخة مرتبطة بتغيرات في المعلمات الدموية والبيوكيميائية التي تشير إلى حالة الأنظمة الفسيولوجية الرئيسية في الجسم في جرذان ويستار [7].
يؤثر العمر المتزايد بشكل كبير على وزن جسم القوارض، وهناك علاقة مباشرة بين المعلمات الدموية والكيمياء السريرية بما في ذلك حجم الدم، الناتج القلبي وحجم السكتة [8]. أفاد باحثون من عدة دول عن قيم مرجعية مختلفة لجرذان ويستار [7، 9-12]. يمكن أن تتأثر هذه القيم بالعديد من العوامل، مثل العمر، الجنس، التغذية، سكن الحيوانات، إيقاع الساعة البيولوجية، النشاط اليومي، الضغط، الدورة الجنسية، إلخ. توفر المعرفة حول القيم الدموية والكيمياء السريرية الطبيعية في مراحل مختلفة من حياة الجرذان دليلًا قيمًا للباحثين [13]. كان هدفنا في هذه الدراسة هو المساهمة في الدراسات البحثية من خلال التحقيق في الملفات الدموية والبيوكيميائية لجرذان ويستار التي تم تربيتها في مركز زيدوس للأبحاث تحت ظروف قياسية. لذا، باستخدام بيانات من سنوات من المراقبة الصحية الروتينية لمستعمرات التربية، أنشأنا بيانات مرجعية حسب العمر للمعلمات الدموية والبيوكيميائية لكلا الجنسين. ستكون هذه مجموعة بيانات مرجعية مفيدة لتقييم المعلمات الدموية والكيمياء السريرية في الدراسات غير السريرية.
الطرق
رعاية الحيوانات وبيان الأخلاقيات
اختيار الحيوانات
الحيوانات. تم جمع البيانات من 660 حيوانًا، والتي تشمل 110 حيوانًا لكل جنس لثلاث فترات عمرية.
جمع العينات
اختبارات معلمات علم الدم والكيمياء الحيوية
التحليل الإحصائي
| المعلمات | ذكر | أنثى | ||||||
| ن | متوسط
|
الوسيط | نطاق المرجعية | ن | يعني
|
الوسيط | نطاق المرجع | |
| WBC
|
١٠٦ |
|
5.10 | 2.45-9.55 | ١٠٤ |
|
٤.٤٩ | 2.88-8.17 |
| RBC (
|
١٠٧ |
|
6.62 | 5.86-7.35 | ١٠٣ |
|
6.82 | 5.97-7.69 |
| HGB (غرام/ديسيلتر) | ١٠٨ |
|
١٣.٢٠ | 11.57-14.63 | ١٠٥ |
|
١٣.٥٠ | 12.10-14.70 |
| HCT (%) | ١٠٩ |
|
٤١.٣٠ | ٣٥.٨٥-٤٧.٧٥ | ١٠٥ |
|
٤٢.٩٠ | ٣٧.٥٧-٤٨.١٠ |
| MCV
|
١٠٨ |
|
63.95 | 55.41-68.58 | ١٠٢ |
|
63.25 | ٥٥.٣٧-٦٨.٢٧ |
| MCH
|
١٠٨ |
|
٢٠.٠٠ | 17.96-22.03 | 100 |
|
19.50 | 18.25-21.55 |
| MCHC
|
١٠٩ |
|
31.50 | ٢٩.٣٨-٣٣.٨٣ | ١٠٤ |
|
31.45 | ٢٩.٤٩-٣٤.٣٥ |
| PLT (
|
99 |
|
762.0 | 467.5-1004.5 | 99 |
|
٧٥٤.٠ | 562.5-1009.0 |
| نيو
|
١٠٦ |
|
٨.٨٠ | ٤.٢٧-١٥.٥٩ | ١٠١ |
|
9.40 | 4.61-15.05 |
| نسبة اللمف | ١٠٧ |
|
85.50 | 76.84-92.01 | 100 |
|
84.85 | 78.21-92.14 |
| مونو % | ١٠٤ |
|
2.41 | 0.21-5.99 | ١٠٤ |
|
2.98 | 0.32-7.54 |
| إيوس
|
١٠٤ |
|
0.69 | 0.25-1.72 | ١٠١ |
|
0.94 | 0.34-2.08 |
| باسو
|
١٠٩ |
|
1.64 | 0.1-4.17 | ١٠٦ |
|
1.41 | 0.10-3.47 |
النتائج
تأثير العمر والجنس على المعايير الدموية
كان لدى الفئران الذكور عدد كريات الدم البيضاء و MCH أعلى بشكل ملحوظ مقارنة بالفئران الإناث. كان لدى الفئران الإناث عدد كريات الدم الحمراء، والهيموجلوبين، والهيماتوكريت، ونسبة الإيوزينوفيل أعلى بشكل ملحوظ مقارنة بالفئران الذكور (الشكل 1). لم يتم العثور على فروق ذات دلالة إحصائية بين الفئران الذكور والإناث في قيم MCV و MCHC و PLT و NEU% و LYMPH% و MONO% و BASO%. تم تلخيص بيانات الفئران ويستار التي تتراوح أعمارها بين 10-14 أسبوعًا في الجدول 3 كمتوسط، والانحراف المعياري، والوسيط، ونطاق المرجع. كان لدى الفئران الذكور عدد كريات الدم البيضاء أعلى بشكل ملحوظ،
| المعلمات | ذكر | أنثى | ||||||
| ن | يعني
|
الوسيط | نطاق المرجع | ن | يعني
|
الوسيط | نطاق المرجع | |
| WBC (
|
١٠١ |
|
٦.٦١ | 4.03-9.50 | ١٠٣ |
|
٤.١٨ | 2.23-6.50 |
| RBC (
|
١٠٤ |
|
7.65 | 6.73-8.57 | ١٠٧ |
|
7.31 | 6.42-8.21 |
| HGB
|
١٠٤ |
|
١٤.٢٠ | 12.7-15.38 | ١٠٥ |
|
١٣.٧٠ | 12.50-15.14 |
| HCT (%) | ١٠٣ |
|
44.60 | ٤٠.٢٤-٤٩.٣٨ | ١٠٧ |
|
٤٣.٥٠ | ٣٧.٣٨-٤٧.٨٩ |
| MCV
|
95 |
|
٥٨.٨٠ | 51.84-63.96 | ١٠٣ |
|
٥٩.٧٠ | 51.94-63.70 |
|
|
99 |
|
18.30 | 17.05-20.15 | ١٠٦ |
|
18.70 | 17.27-20.20 |
| MCHC (غرام/ديسيلتر) | ١٠٢ |
|
31.60 | ٢٩.٧٦-٣٤.٠٠ | ١٠٣ |
|
31.60 | ٢٩.٦٠-٣٤.٣٨ |
| PLT (
|
97 |
|
676.0 | 463.95-947.4 | 99 |
|
681.0 | 487.0-951.0 |
| نيو
|
98 |
|
١٣.٤٠ | 7.75-20.71 | ١٠٦ |
|
15.25 | 7.90-26.99 |
| ليمف
|
100 |
|
79.55 | ٥٨.٤٠-٨٨.١٥ | ١٠٦ |
|
٧٦.٨٥ | 65.50-89.03 |
| مونوا % | ١٠٣ |
|
3.19 | 0.22-7.75 | ١٠٧ |
|
3.17 | 0.32-8.24 |
| نسبة EOS % | 96 |
|
1.01 | 0.33-2.089 | 99 |
|
1.29 | 0.51-2.73 |
| باسو
|
١٠٣ |
|
1.93 | 0.1-5.01 | ١٠٧ |
|
1.48 | 0.07-3.77 |
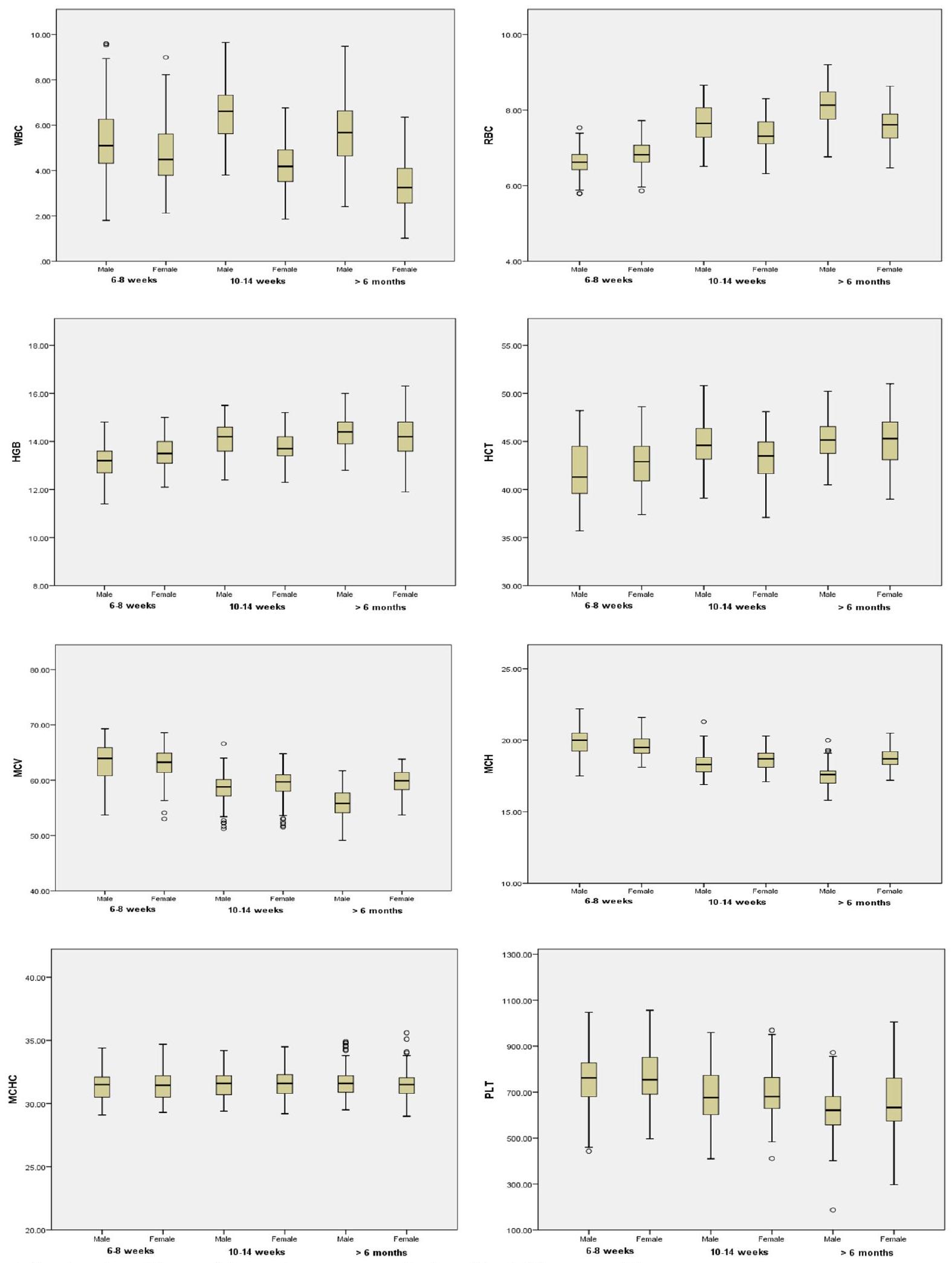
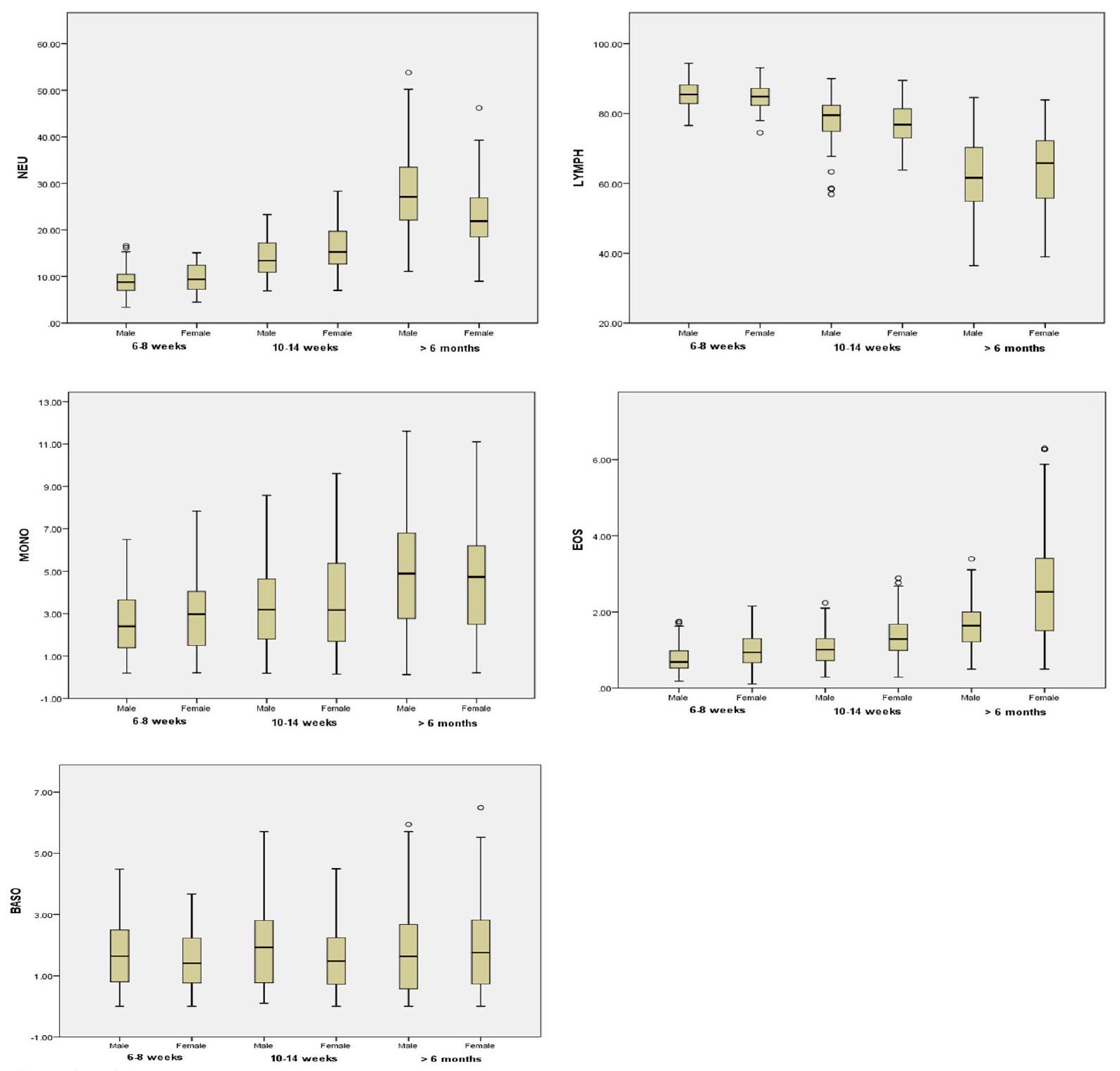
تُعرض التغيرات المرتبطة بالعمر في المعايير الدموية في الشكل 2 لكلا الجنسين. MCHC و
ومع ذلك، كانت نسبة BASO% أعلى بشكل ملحوظ في الإناث من
| المعلمات | ذكر | أنثى | ||||||
| ن | يعني
|
الوسيط | نطاق المرجع | ن | معدل
|
الوسيط | نطاق المرجعية | |
| “WBC (
|
١٠٩ |
|
5.67 | 3.06-8.51 | ١٠٦ |
|
3.25 | 1.80-6.03 |
| RBC (
|
١٠٩ |
|
8.13 | 7.21-9.12 | ١٠٦ |
|
7.61 | 6.71-8.62 |
| HGB (غرام/ديسيلتر) | ١٠٩ |
|
١٤.٤٠ | 12.80-15.80 | ١٠٧ |
|
١٤.٢٠ | 12.64-16.06 |
| HCT (%) | ١٠٤ |
|
٤٥.١٥ | 40.50-49.81 | ١٠٧ |
|
٤٥.٣٠ | ٣٩.٣٤-٥٠.٨٣ |
| MCV
|
١٠٥ |
|
٥٥.٨٠ | ٤٩.٢٠-٦٠.٦١ | ١٠٢ |
|
٥٩.٩٠ | ٥٣.٨٧-٦٣.٤٣ |
| MCH
|
١٠٤ |
|
17.60 | 16.13-19.30 | ١٠٦ |
|
18.70 | 17.60-20.23 |
| MCHC
|
١٠٤ |
|
31.60 | ٢٩.٥٦-٣٤.٨٠ | ١٠٣ |
|
31.50 | ٢٩.٥٠-٣٤.٥٠ |
| PLT
|
97 |
|
621.00 | ٤١٢.٢٥-٨٤٩.٢٥ | 98 |
|
٦٣٣٫٠٠ | ٣٧٧.٦٣-٩٦٣.٨٣ |
| نيو % | ١٠٧ |
|
27.10 | 14.82-47.40 | 97 |
|
٢١.٩٠ | 9.80-39.21 |
| ليمف
|
١٠٩ |
|
٦١.٦٠ | ٤٠.٠٨-٧٩.٢٥ | ١٠٧ |
|
65.80 | 40.20-83.27 |
| مونوا % | ١٠٨ |
|
٤.٩٠ | 0.19-10.98 | 100 |
|
٤.٧٤ | 0.38-9.96 |
| إيوس
|
98 |
|
1.64 | 0.70-3.09 | ١٠١ |
|
2.53 | 0.62-6.27 |
| باسو
|
١٠٢ |
|
1.635 | 0-5.58 | 97 |
|
1.76 | 0-5.49 |
| المعلمات | ذكر | أنثى | ||||||
| ن | متوسط
|
الوسيط | نطاق المرجع | ن | يعني
|
الوسيط | نطاق المرجعية | |
| GLU (ملغ/دل) | ١٠٨ |
|
٥١.٢٠ | 16.64-85.76 | ١٠٤ |
|
63.65 | ٣٤.٤٣-١٠٤.٤٦ |
| أست
|
١٠٣ |
|
141.70 | ٩٤.٣٤-٢٢٨.٢٨ | ١٠٩ |
|
١٤٠.٦٠ | 82.53-230.75 |
| ALT
|
١٠٩ |
|
٣١.٣٠ | 19.78-50.55 | ١١٠ |
|
٢٨.٥٠ | 17.79-39.53 |
| ALP
|
١٠٨ |
|
٢٤٢٫٠٠ | ١٣٧.٣٥-٤٣٧.٤١ | ١٠٥ |
|
١٣٠.٤٠ | 70.89-250.46 |
| TBIL (ملغ/دل) | 87 |
|
0.15 | 0.02-0.31 | 85 |
|
0.15 | 0.05-0.26 |
| تي بي
|
١٠٨ |
|
٦.٠٠ | 5.27-6.53 | ١٠٦ |
|
6.15 | 5.57-6.73 |
| أل بي
|
١١٠ |
|
٣.٦٠ | 3.2-4.62 | ١١٠ |
|
3.80 | 3.38-4.9 |
| اليوريا (ملغ/دل) | 100 |
|
٢٨.٥٥ | 13.57-42.56 | 97 |
|
٣٩.٤٠ | 21.75-58.81 |
| كريا
|
١١٠ |
|
0.51 | 0.21-0.68 | ١١٠ |
|
0.56 | 0.24-0.75 |
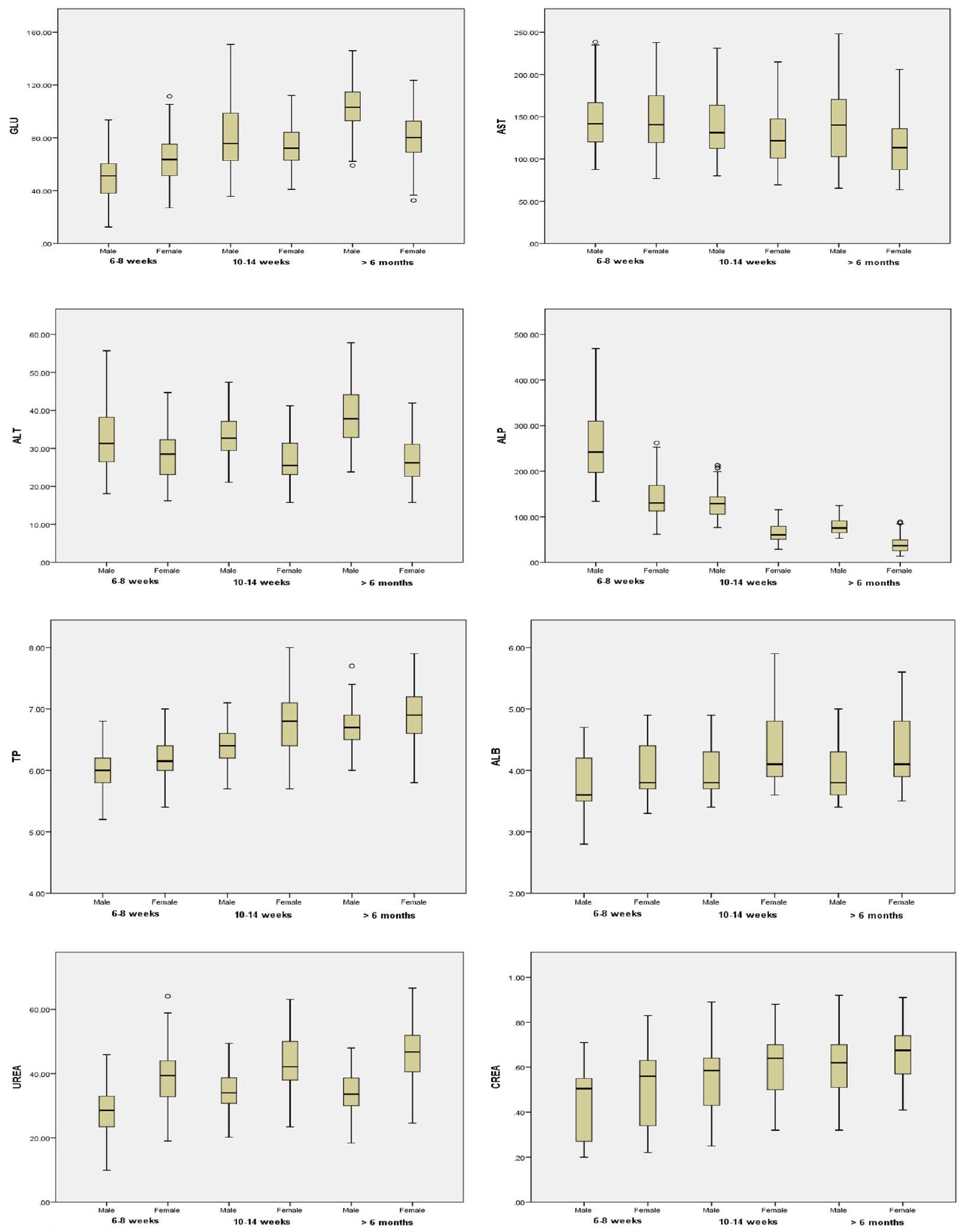
تأثير العمر والجنس على المعايير البيوكيميائية
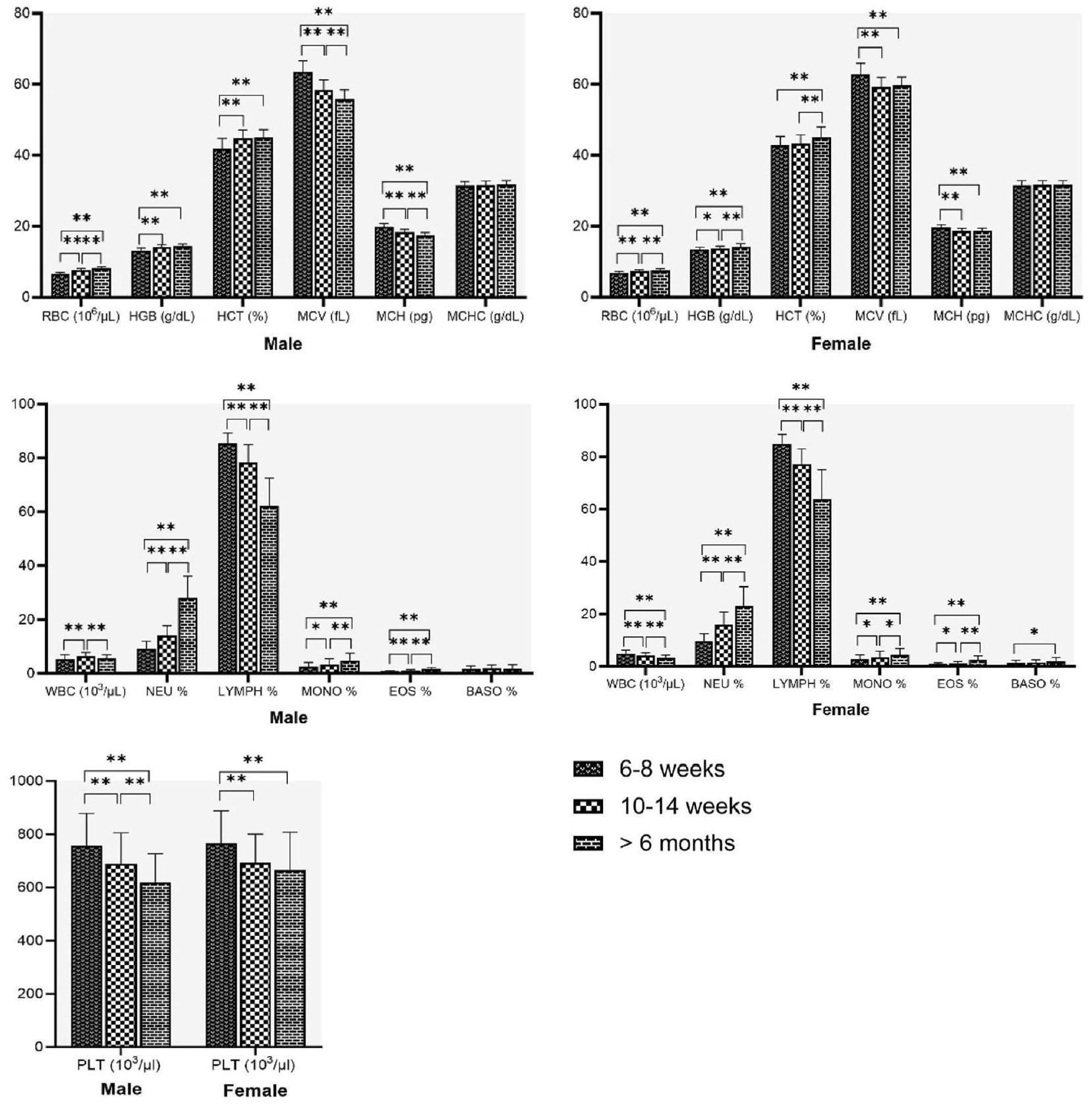
أعلى في
| المعلمات | ذكر | أنثى | ||||||
| ن | متوسط
|
الوسيط | نطاق المرجعية | ن | متوسط
|
الوسيط | نطاق المرجع | |
| GLU (ملغم/دل) | ١٠٧ |
|
٧٥.٧٠ | ٣٩.٥٥-١٣٧.٠٦ | ١٠٤ |
|
72.20 | ٤٣.٤٨-١١١.١٨ |
| أست
|
١٠٦ |
|
131.25 | ٨٥.٧١-٢١٣.٣٣ | ١٠٤ |
|
121.70 | 72.94-204.13 |
| ALT
|
١٠٧ |
|
٣٢.٧٠ | 22.68-45.64 | ١٠٩ |
|
٢٥.٥٠ | 16.53-37.95 |
| ALP
|
١٠٢ |
|
١٢٩٫٠٠ | 81.16-209.65 | ١٠٦ |
|
60.30 | ٣٦.٤٧-١٠٨.٥٢ |
| TBIL (ملغ/دل) | 90 |
|
0.15 | 0.02-0.42 | 91 |
|
0.15 | 0.05-0.29 |
| تي بي
|
١٠٣ |
|
٦.٤٠ | 5.76-6.94 | ١١٠ |
|
٦.٨٠ | 5.78-7.9 |
| أل بي
|
١٠٨ |
|
3.80 | 3.4-4.8 | ١١٠ |
|
٤.١٠ | 3.7-5.6 |
| اليوريا (ملغ/دل) | 95 |
|
٣٤.٠٠ | 21.74-48.2 | 98 |
|
42.15 | ٢٣.٧٥-٦٠.٧٤ |
| كريا
|
١٠٨ |
|
0.59 | 0.3-0.78 | ١١٠ |
|
0.64 | 0.35-0.87 |
| المعلمات | ذكر | أنثى | ||||||
| ن | معدل
|
الوسيط | نطاق المرجع | ن | متوسط
|
الوسيط | نطاق المرجعية | |
| GLU (ملغ/دل) | ١٠٦ |
|
١٠٣.٢٠ | 63.75-143.63 | ١٠٨ |
|
80.20 | ٣٥.٥٧-١٢٢.٩٩ |
| أست
|
١٠٩ |
|
١٤٠.٢٠ | 75.2-215.58 | ١٠٩ |
|
١١٣.٥٠ | 67.33-198.43 |
| ALT (وحدة/لتر) | ١٠٢ |
|
٣٧.٨٠ | 25.65-54.16 | 99 |
|
٢٦.٢٠ | 17.05-40.95 |
| ALP
|
١٠٩ |
|
٧٥.٤٠ | 54.23-117.5 | ١٠٣ |
|
٣٦.٥٠ | 14.34-86.4 |
| البليروبين الكلي (ملغ/دل) | 92 |
|
0.15 | 0.02-0.28 | 82 |
|
0.16 | 0.08-0.24 |
| تي بي
|
١٠٦ |
|
6.70 | 6.07-7.4 | ١٠٩ |
|
٦.٩٠ | 6.16-7.83 |
| أل بي
|
١١٠ |
|
3.80 | 3.48-4.9 | ١١٠ |
|
٤.١٠ | 3.58-5.4 |
| اليوريا (ملغ/دل) | 99 |
|
٣٣.٦٠ | 20.5-46.7 | ٩٨ |
|
٤٦.٧٥ | ٢٩.٨٥-٦٣.١٦ |
| كريا
|
١١٠ |
|
0.62 | 0.34-0.9 | ١٠٨ |
|
0.68 | 0.41-0.89 |
نقاش
يتطلب إنشاء بيانات تاريخية مرتبطة بالعمر للمختبر. وبالتالي، قمنا بتوصيف بيانات الجرذان ويستار من 6 إلى 8 أسابيع إلى أكثر من 6 أشهر من العمر، وهي الفئة العمرية التي تُستخدم غالبًا في التجارب مع الجرذان الذكور والإناث.
| المعلمات | اختصارات | وحدات | طريقة التحليل |
| إجمالي عدد الكريات البيضاء | WBC |
|
تشتت ضوء الليزر |
| عدد كريات الدم الحمراء | RBC |
|
تشتت الضوء – جهاز قياس الخلايا البصرية |
| تركيز الهيموغلوبين | HGB | غرام/ديسيلتر | طرق الهيموغلوبين الخالية من السيانيد |
| الهيماتوكريت | HCT | % | محسوب |
| حجم الكريات الحمر المتوسط | MCV | ف ل | كشف ارتفاع النبض التراكمي |
| الهيموغلوبين الوسيط الكروي | MCH | بي جي | محسوب |
| تركيز الهيموغلوبين الجزيئي المتوسط | MCHC | غرام لكل ديسيلتر | محسوب |
| صفائح دموية | PLT |
|
تشتت الضوء – السيتومتر الضوئي |
| العدلة | نيو | % | تدفق الخلايا |
| لمفاوية | ليمف | % | تدفق الخلايا |
| وحيدة النواة | مونو | % | تدفق الخلايا |
| الحمضات | إيوس | % | تدفق الخلايا |
| الحمضات القاعدية | باسو | % | تدفق الخلايا |
| جلوكوز | جل | ملغم/دل | طريقة الهكسوكيناز |
| أسبارتات أمينوترانسفيراز | AST | U/L | طريقة IFCC |
| إنزيم الألانين أمينوترانسفيراز | التبديل | U/L | |
| الفوسفاتاز القلوي | ALP | U/L | |
| البيليروبين الكلي | تي بي آي إل | ملغم/دل | طريقة الدياز الملون |
| إجمالي البروتين | تي بي |
|
طريقة البيوريت الملونة |
| ألبومين | ألبي |
|
طريقة بروموكريسول الأخضر |
| يوريا | يوريا | ملغم/دل | الطريقة الحركية |
| كرياتينين | كريا | ملغم/دل | طريقة جافي |
يُذكر أن الشيخوخة تسبب زيادة في زمن النزيف وانخفاض في عدد الصفائح الدموية. وقد لوحظت نتيجة مشابهة في تجاربنا حيث أظهرنا انخفاضًا في عدد الصفائح الدموية مع زيادة العمر. كما لاحظنا عددًا أعلى من الصفائح الدموية في الإناث مقارنة بالذكور، وهي نتيجة مشابهة تم الإبلاغ عنها في البشر. أظهر الذكور عدد كريات دم بيضاء أعلى بشكل ملحوظ من الإناث. تنخفض كريات الدم البيضاء تدريجيًا في الإناث مع تقدم العمر، وهو ما لم يُلاحظ في الذكور. زادت قيم NEU% وMONO% وEOS% مع تقدم العمر، بينما انخفضت قيمة LYMPH% مع تقدم العمر في كلا الجنسين. كانت النتائج متوافقة مع الدراسات على الفئران من نوع ويستار.



دوينغ
뚜전
الاستنتاجات
ستكون القيم مفيدة في دراسات الاضطرابات المتعلقة بالشيخوخة، وعلم الأدوية السليمة أو دراسات السموم باستخدام فأر ويستار كنموذج، بالإضافة إلى تقليل عدد الفئران في مجموعة التحكم في مشاريع البحث المستقبلية إلى حد ما.
الاختصارات
حمض الإيثيلين ثنائي الأمين رباعي الأسيتيك ثنائي البوتاسيوم (EDTA)
لجنة الأخلاقيات المؤسسية للحيوانات في IAEC
شكر وتقدير
مساهمات المؤلفين
التمويل
توفر البيانات والمواد
الإعلانات
المصالح المتنافسة
فبراير 2024
تم النشر على الإنترنت: 26 فبراير 2024
References
- Bryda EC. The mighty mouse: the impact of rodents on advances in biomedical research. Mo Med. 2013;110(3):207-11.
- Jacob HJ. Functional genomics and rat models. Genome Res. 1999;9(11):1013-6.
- Colvin M, Christos T . A stochastic programming approach for clinical trial planning in new drug development. Comput Chem Eng. 2008;32(11):2626-42.
- Petterino C, Argentino-Storino A. Clinical chemistry and haematology historical data in control Sprague-Dawley rats from pre-clinical toxicity studies. Exp Toxicol Pathol. 2006;57(3):213-9.
- Haschek-Hock WM, Rousseaux CG, Wallig MA, Bolon B. NEW: Haschek and Rousseaux’s Handbook of Toxicologic Pathology, Volume 1: Principles and Practice of Toxicologic Pathology. 4th ed. 2021. Int J Toxicol. 2022;41(3):253-4.
- Everds NE. Evaluation of clinical pathology data: correlating changes with other study data. Toxicol Pathol. 2015;43(1):90-7.
- Boehm O, Zur B, Koch A, Tran N, Freyenhagen R, Hartmann M, et al. Clinical chemistry reference database for Wistar rats and C57/BL6 mice. Biol Chem. 2007;388(5):547-54.
- Jin YR, Han XH, Zhang YH, Lee JJ, Lim Y, Chung JH, et al. Antiplatelet activity of hesperetin, a bioflavonoid, is mainly mediated by inhibition of PLCgamma2 phosphorylation and cyclooxygenase-1 activity. Atherosclerosis. 2007;194(1):144-52.
- Carvalho GD, Masseno AP, Zanini MS, Zanini SF, Porfírio LC, Machado JP, et al. Clinical evaluation of laboratory rats (Rattus novergicus Wistar Strain): sanitary, biological and physiological parameters. Rev Ceres. 2009;56(1):51-7.
- Ihedioha JI, Noel-Uneke OA, Ihedioha TE. Reference values for the serum lipid profile of albino rats of varied ages and sexes. Comp Clin Pathol. 2013;22:93-9.
- Jacob Filho W, Lima CC, Paunksnis MRR, Silva AA, Perilhão MS, Caldeira M, et al. Reference database of hematological parameters for growing and aging rats. Aging Male. 2018;21(2):145-8.
- de Kort M, Weber K, Wimmer B, Wilutzky K, Neuenhahn P, Allingham P, et al. Historical control data for hematology parameters obtained from toxicity studies performed on different Wistar rat strains: acceptable value ranges, definition of severity degrees, and vehicle effects. Toxicol Res App. 2020. https://doi.org/10.1177/2397847320931484.
- Dantas JA, Ambiel CR, Cuman RKN, Baroni S, Bersani-Amado CA. Reference values of some physiological parameters of rats from central vivarium of the State University of Maringa. Parana Acta Sci Health Sci. 2006;2:165-70.
- Dixon WJ. Processing data for outliers. Biometrics. 1953;9(1):74-9.
- Reed AH, Henry RJ, Mason WB. Influence of statistical method used on the resulting estimate of normal range. Clin Chem. 1971;17(4):275-84.
- CLSI. Defining, establishing, and verifying reference intervals in the Clinical Laboratory; Approved Guideline-3rd ed. CLSI document EP28-A3c. Wayne PA: Clinical and Laboratory Standards Institute; 2008.
- Friedrichs KR, Harr KE, Freeman KP, Szladovits B, Walton RM, Barnhart KF, et al. ASVCP reference interval guidelines: determination of de novo
reference intervals in veterinary species and other related topics. Vet Clin Pathol. 2012;41(4):441-53. - Haley T. Retrospective analysis of control animal data: The rat. Clin Toxicol. 1978;12(2):249-63.
- Ringler H, Dabich L. Hematology and clinical biochemistry. In: Backer HJ, Lindsey JR, Weisbroth SH, editors. The laboratory rat. New York: Academic Press; 1979. p. 105-8.
- Andreollo NA, Santos EF, Araújo MR, Lopes LR. Rat’s age versus human’s age: What is the relationship? Arq Bras Cir Dig. 2012;25(1):49-51.
- Jackson SJ, Andrews N, Ball D, Bellantuono I, Gray J, Hachoumi L, et al. Does age matter? The impact of rodent age on study outcomes. Lab Anim. 2017;51(2):160-9.
- Giknis MLA, Clifford CB. Clinical laboratory parameter for Crl:WI(Han). Charles River Laboratories. 2008. http://www.criver.com/files/pdfs/rms/ wistarhan/rm_rm_r_wistar_han_clin_lab_parameters_08.aspx
- Kampfmann I, Bauer NB, Johannes S, Moritz A. Differences in hematologic variables in rats of the same strain but different origin. Vet Clin Pathol. 2012;41(2):228-34.
- Liberati TA, Sansone SR, Feuston MH. Hematology and clinical chemistry values in pregnant Wistar Hannover rats compared with nonmated controls. Vet Clin Pathol. 2004;33(2):68-73.
- Özturk B, Çiftçi İ, Ecer B, Gökyaprak SM, Eryavuz OD. Biochemical and hematological profiles of wistar rats at the Selcuk University experimental medicine research and application center. Eurasian J Vet Sci. 2021;37(4):259-64.
- Jones Cl. Platelet function and ageing. Mamm Genome. 2016;27(7-8):358-66.
- Qiao R, Yang S, Yao B, Wang H, Zhang J, Shang H. Complete blood count reference intervals and age and sex-related trends of North China Han population. Clin Chem Lab Med. 2014;52(7):1025-32.
- Samaneka WP, Mandozana G, Tinago W, Nhando N, Mgodi NM, BwakuraDangarembizi MF, et al. Adult hematology and clinical chemistry laboratory reference ranges in a Zimbabwean population. PLoS ONE. 2016;11(11): e0165821.
- Teixeira MA, Chaguri L, Carissimi AA, Souza NL, Mori CMC, Gomes VMW, et al. Hematological and biochemical profiles of rats (Rattus norvegicus) kept under microenvironmental ventilation system. Braz J Vet Res Anim Sci. 2008;37(5):342-7.
- Wolford ST, Schroer RA, Gohs FX, Gallo PP. Reference range data base for serum chemistry and hematology values in laboratory animals. J Toxicol Environ Health. 1986;18(2):161-88.
- Nistiar F, Racz O, Lukacinova A, Hubkova B, Novakova J, Lovasova E, et al. Age dependency on some physiological and biochemical parameters of male Wistar rats in controlled environment. J Environ Sci Health A Tox Hazard Subst Environ Eng. 2012;47(9):1224-33.
- Díaz A, López-Grueso R, Gambini J, Monleón D, Mas-Bargues C, Abdelaziz KM, et al. Sex Differences in age-associated type 2 diabetes in rats-role of estrogens and oxidative stress. Oxid Med Cell Longev. 2019;2019:6734836.
- Nordström A, Hadrévi J, Olsson T, Franks PW, Nordström P. Higher prevalence of type 2 diabetes in men than in women is associated with differences in visceral fat mass. J Clin Endocrinol Metab. 2016;101(10):3740-6.
ملاحظة الناشر
- *المراسلة:
سورش باتيل
suresh.g.patel@zyduslife.com
1 منشأة البحث الحيواني، مركز زيدوس للأبحاث، شركة زيدوس ليفساينس المحدودة، أحمد آباد، الهند
قسم علم الأدوية وعلم السموم، مركز زيدوس للأبحاث، شركة زيدوس ليفساينس المحدودة، أحمد آباد، الهند - *المعلمات الهامة عند
المعلمات ذات الدلالة الإحصائية عند
المقارنة الإحصائية بناءً على اختبار غير بارامتري
DOI: https://doi.org/10.1186/s42826-024-00194-7
PMID: https://pubmed.ncbi.nlm.nih.gov/38409070
Publication Date: 2024-02-26
Age-related changes in hematological and biochemical profiles of Wistar rats
Abstract
Background Wistar rats are extensively used as the model for assessing toxicity and efficacy in preclinical research. Hematological and biochemical laboratory data are essential for evaluating specific variations in the physiological and functional profile of a laboratory animal. Establishing hematological and biochemical reference values for Wistar (han) rats at various age intervals was the goal of this work. Male and female Wistar rats (
Background
lipoprotein metabolism, glucose regulation, and functions of major metabolic organs like liver and kidney. A deviation from the normal range in these parameters can indicate the presence of pathology [6]. Many studies indicate that aging is associated with changes in hematological and biochemical parameters that are indicative of the status of major physiological systems of the body in Wistar rats [7].
Growing age has a significant impact on rodent body weight, and there is a direct relationship between hematological and clinical chemistry parameters including blood volume, cardiac output and stroke volume [8]. Researchers from several nations have reported various reference values for Wistar rats [7, 9-12]. These values can be affected by many factors, such as age, sex, nutrition, animal housing, circadian rhythm, daily activity, stress, sexual cycle etc. Knowledge about the normal hematological and clinical chemistry values in various phases of rat life provides a valuable guide to researchers [13]. Our aim in this study was to contribute to research studies by investigating the hematological and biochemical profiles of Wistar rats reared at Zydus Research Centre under standard conditions. So, using data from years of routine health monitoring of breeding colonies, we have established age-wise reference data of hematology and biochemical parameters for both sexes. These would be a useful reference data set for the evaluation of hematology and clinical chemistry parameters in non-clinical studies.
Methods
Animal care and ethical statement
Selection of animals
animals. The data was collected from 660 animals, which includes 110 animals per sex for three age intervals.
Sample collection
Hematology and biochemistry parameter tests
Statistical analysis
| Parameters | Male | Female | ||||||
| n | Mean
|
Median | Reference range | n | Mean
|
Median | Reference range | |
| WBC
|
106 |
|
5.10 | 2.45-9.55 | 104 |
|
4.49 | 2.88-8.17 |
| RBC (
|
107 |
|
6.62 | 5.86-7.35 | 103 |
|
6.82 | 5.97-7.69 |
| HGB (g/dL) | 108 |
|
13.20 | 11.57-14.63 | 105 |
|
13.50 | 12.10-14.70 |
| HCT (%) | 109 |
|
41.30 | 35.85-47.75 | 105 |
|
42.90 | 37.57-48.10 |
| MCV
|
108 |
|
63.95 | 55.41-68.58 | 102 |
|
63.25 | 55.37-68.27 |
| MCH
|
108 |
|
20.00 | 17.96-22.03 | 100 |
|
19.50 | 18.25-21.55 |
| MCHC
|
109 |
|
31.50 | 29.38-33.83 | 104 |
|
31.45 | 29.49-34.35 |
| PLT (
|
99 |
|
762.0 | 467.5-1004.5 | 99 |
|
754.0 | 562.5-1009.0 |
| NEU
|
106 |
|
8.80 | 4.27-15.59 | 101 |
|
9.40 | 4.61-15.05 |
| LYMPH % | 107 |
|
85.50 | 76.84-92.01 | 100 |
|
84.85 | 78.21-92.14 |
| MONO % | 104 |
|
2.41 | 0.21-5.99 | 104 |
|
2.98 | 0.32-7.54 |
| EOS
|
104 |
|
0.69 | 0.25-1.72 | 101 |
|
0.94 | 0.34-2.08 |
| BASO
|
109 |
|
1.64 | 0.1-4.17 | 106 |
|
1.41 | 0.10-3.47 |
Results
Effect of age and sex on hematological parameters
rats had significantly higher WBC and MCH compared to female rats. Female rats had significantly higher RBC, HGB, HCT, and EOS% compared to male rats (Fig. 1). No significant differences between male and female rats were found in MCV, MCHC, PLT, NEU%, LYMPH%, MONO% and BASO% values. In 10-14 weeks old Wistar rats data are summarized in Table 3 as mean, SD, median and reference range. Male rats had significantly higher WBC,
| Parameters | Male | Female | ||||||
| n | Mean
|
Median | Reference range | n | Mean
|
Median | Reference range | |
| WBC (
|
101 |
|
6.61 | 4.03-9.50 | 103 |
|
4.18 | 2.23-6.50 |
| RBC (
|
104 |
|
7.65 | 6.73-8.57 | 107 |
|
7.31 | 6.42-8.21 |
| HGB
|
104 |
|
14.20 | 12.7-15.38 | 105 |
|
13.70 | 12.50-15.14 |
| HCT (%) | 103 |
|
44.60 | 40.24-49.38 | 107 |
|
43.50 | 37.38-47.89 |
| MCV
|
95 |
|
58.80 | 51.84-63.96 | 103 |
|
59.70 | 51.94-63.70 |
|
|
99 |
|
18.30 | 17.05-20.15 | 106 |
|
18.70 | 17.27-20.20 |
| MCHC (g/dL) | 102 |
|
31.60 | 29.76-34.00 | 103 |
|
31.60 | 29.60-34.38 |
| PLT (
|
97 |
|
676.0 | 463.95-947.4 | 99 |
|
681.0 | 487.0-951.0 |
| NEU
|
98 |
|
13.40 | 7.75-20.71 | 106 |
|
15.25 | 7.90-26.99 |
| LYMPH
|
100 |
|
79.55 | 58.40-88.15 | 106 |
|
76.85 | 65.50-89.03 |
| MONO % | 103 |
|
3.19 | 0.22-7.75 | 107 |
|
3.17 | 0.32-8.24 |
| EOS % | 96 |
|
1.01 | 0.33-2.089 | 99 |
|
1.29 | 0.51-2.73 |
| BASO
|
103 |
|
1.93 | 0.1-5.01 | 107 |
|
1.48 | 0.07-3.77 |


Age-related changes in hematological parameters are presented in Fig. 2 for both sexes. MCHC and
however, BASO% was significantly higher in females of
| Parameters | Male | Female | ||||||
| n | Mean
|
Median | Reference range | n | Mean
|
Median | Reference range | |
| WBC (
|
109 |
|
5.67 | 3.06-8.51 | 106 |
|
3.25 | 1.80-6.03 |
| RBC (
|
109 |
|
8.13 | 7.21-9.12 | 106 |
|
7.61 | 6.71-8.62 |
| HGB (g/dL) | 109 |
|
14.40 | 12.80-15.80 | 107 |
|
14.20 | 12.64-16.06 |
| HCT (%) | 104 |
|
45.15 | 40.50-49.81 | 107 |
|
45.30 | 39.34-50.83 |
| MCV
|
105 |
|
55.80 | 49.20-60.61 | 102 |
|
59.90 | 53.87-63.43 |
| MCH
|
104 |
|
17.60 | 16.13-19.30 | 106 |
|
18.70 | 17.60-20.23 |
| MCHC
|
104 |
|
31.60 | 29.56-34.80 | 103 |
|
31.50 | 29.50-34.50 |
| PLT
|
97 |
|
621.00 | 412.25-849.25 | 98 |
|
633.00 | 377.63-963.83 |
| NEU % | 107 |
|
27.10 | 14.82-47.40 | 97 |
|
21.90 | 9.80-39.21 |
| LYMPH
|
109 |
|
61.60 | 40.08-79.25 | 107 |
|
65.80 | 40.20-83.27 |
| MONO % | 108 |
|
4.90 | 0.19-10.98 | 100 |
|
4.74 | 0.38-9.96 |
| EOS
|
98 |
|
1.64 | 0.70-3.09 | 101 |
|
2.53 | 0.62-6.27 |
| BASO
|
102 |
|
1.635 | 0-5.58 | 97 |
|
1.76 | 0-5.49 |
| Parameters | Male | Female | ||||||
| n | Mean
|
Median | Reference range | n | Mean
|
Median | Reference range | |
| GLU (mg/dL) | 108 |
|
51.20 | 16.64-85.76 | 104 |
|
63.65 | 34.43-104.46 |
| AST
|
103 |
|
141.70 | 94.34-228.28 | 109 |
|
140.60 | 82.53-230.75 |
| ALT
|
109 |
|
31.30 | 19.78-50.55 | 110 |
|
28.50 | 17.79-39.53 |
| ALP
|
108 |
|
242.00 | 137.35-437.41 | 105 |
|
130.40 | 70.89-250.46 |
| TBIL (mg/dL) | 87 |
|
0.15 | 0.02-0.31 | 85 |
|
0.15 | 0.05-0.26 |
| TP
|
108 |
|
6.00 | 5.27-6.53 | 106 |
|
6.15 | 5.57-6.73 |
| ALB
|
110 |
|
3.60 | 3.2-4.62 | 110 |
|
3.80 | 3.38-4.9 |
| UREA (mg/dL) | 100 |
|
28.55 | 13.57-42.56 | 97 |
|
39.40 | 21.75-58.81 |
| CREA
|
110 |
|
0.51 | 0.21-0.68 | 110 |
|
0.56 | 0.24-0.75 |
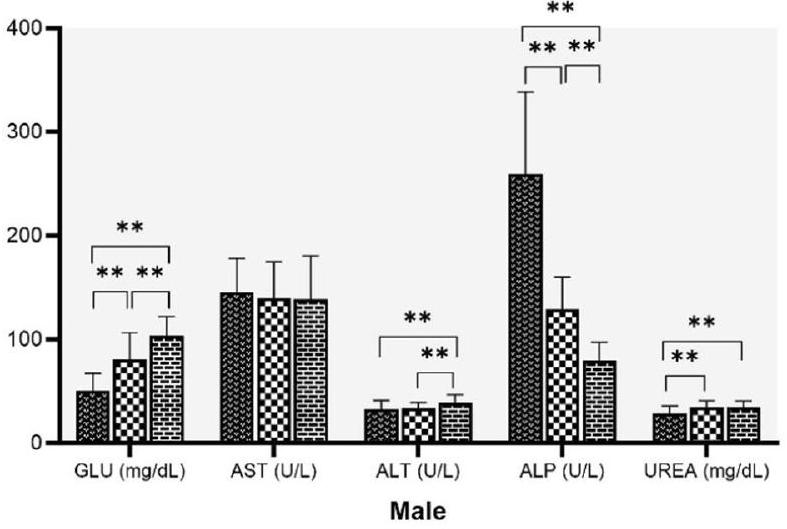
Effect of age and sex on biochemical parameters

higher in

| Parameters | Male | Female | ||||||
| n | Mean
|
Median | Reference range | n | Mean
|
Median | Reference range | |
| GLU (mg/dL) | 107 |
|
75.70 | 39.55-137.06 | 104 |
|
72.20 | 43.48-111.18 |
| AST
|
106 |
|
131.25 | 85.71-213.33 | 104 |
|
121.70 | 72.94-204.13 |
| ALT
|
107 |
|
32.70 | 22.68-45.64 | 109 |
|
25.50 | 16.53-37.95 |
| ALP
|
102 |
|
129.00 | 81.16-209.65 | 106 |
|
60.30 | 36.47-108.52 |
| TBIL (mg/dL) | 90 |
|
0.15 | 0.02-0.42 | 91 |
|
0.15 | 0.05-0.29 |
| TP
|
103 |
|
6.40 | 5.76-6.94 | 110 |
|
6.80 | 5.78-7.9 |
| ALB
|
108 |
|
3.80 | 3.4-4.8 | 110 |
|
4.10 | 3.7-5.6 |
| UREA (mg/dL) | 95 |
|
34.00 | 21.74-48.2 | 98 |
|
42.15 | 23.75-60.74 |
| CREA
|
108 |
|
0.59 | 0.3-0.78 | 110 |
|
0.64 | 0.35-0.87 |
| Parameters | Male | Female | ||||||
| n | Mean
|
Median | Reference range | n | Mean
|
Median | Reference range | |
| GLU (mg/dL) | 106 |
|
103.20 | 63.75-143.63 | 108 |
|
80.20 | 35.57-122.99 |
| AST
|
109 |
|
140.20 | 75.2-215.58 | 109 |
|
113.50 | 67.33-198.43 |
| ALT (U/L) | 102 |
|
37.80 | 25.65-54.16 | 99 |
|
26.20 | 17.05-40.95 |
| ALP
|
109 |
|
75.40 | 54.23-117.5 | 103 |
|
36.50 | 14.34-86.4 |
| TBIL (mg/dL) | 92 |
|
0.15 | 0.02-0.28 | 82 |
|
0.16 | 0.08-0.24 |
| TP
|
106 |
|
6.70 | 6.07-7.4 | 109 |
|
6.90 | 6.16-7.83 |
| ALB
|
110 |
|
3.80 | 3.48-4.9 | 110 |
|
4.10 | 3.58-5.4 |
| UREA (mg/dL) | 99 |
|
33.60 | 20.5-46.7 | 98 |
|
46.75 | 29.85-63.16 |
| CREA
|
110 |
|
0.62 | 0.34-0.9 | 108 |
|
0.68 | 0.41-0.89 |
Discussion
specific use [21]. The establishment of age-related historical data is required for the laboratory. Thus, we have characterized the Wistar rat data from 6 to 8 weeks to more than 6 months of age, the age group that is mostly used in experiments with male and female rats.
| Parameters | Abbreviations | Units | Method of analysis |
| Total leukocyte count | WBC |
|
Laser light scatter |
| Erythrocyte count | RBC |
|
Light scattering—Optical Cytometer |
| Hemoglobin concentration | HGB | g/dL | Cyanide-free hemoglobin Methods |
| Hematocrit | HCT | % | calculated |
| Mean corpuscular volume | MCV | fL | Cumulative pulse Height Detection |
| Mean corpuscular hemoglobin | MCH | Pg | Calculated |
| Mean corpuscular hemoglobin concentration | MCHC | g/dl | Calculated |
| Platelet | PLT |
|
Light Scattering—Optical Cytometer |
| Neutrophil | NEU | % | Flow cytometry |
| Lymphocyte | LYMP | % | Flow cytometry |
| Monocyte | MONO | % | Flow cytometry |
| Eosinophil | EOS | % | Flow cytometry |
| Basophil | BASO | % | Flow cytometry |
| Glucose | GLU | mg/dL | Hexokinase method |
| Aspartate aminotransferase | AST | U/L | IFCC method |
| Alanine aminotransferase | ALT | U/L | |
| Alkaline phosphatase | ALP | U/L | |
| Total bilirubin | TBIL | mg/dL | Colorimetric Diazo method |
| Total protein | TP |
|
Colorimetric Biuret method |
| Albumin | ALB |
|
Bromocresol Green method |
| Urea | UREA | mg/dL | Kinetic method |
| Creatinine | CREA | mg/dL | Jaffe method |
It is reported that aging causes an increase in bleeding time and a decrease in PLT count [26]. Similar finding was observed in our experiments showing a decrease in PLT count with increasing age. We also observed a higher PLT count in females than males, a similar finding reported in humans [27,28]. Males showed a significantly higher WBC than females. WBC progressively decreases in females with age, which is not observed in males. NEU%, MONO% and EOS% values increased with age, whereas LYMPH% decreased with age in both sexes. The findings were in agreement with studies in Wistar rats [11, 12, 23].




둥영
뚜전
Conclusions
values would be useful in studies of aging-related disorders, safety pharmacology or toxicology studies using Wistar rat as a model, as well as to reduce to some extent the number of rats in the control group of future research projects.
Abbreviations
EDTA Dipotassium ethylenediaminetetraacetic acid
IAEC Institutional Animal Ethics Committee
Acknowledgements
Author contributions
Funding
Availability of data and materials
Declarations
Competing interests
February 2024
Published online: 26 February 2024
References
- Bryda EC. The mighty mouse: the impact of rodents on advances in biomedical research. Mo Med. 2013;110(3):207-11.
- Jacob HJ. Functional genomics and rat models. Genome Res. 1999;9(11):1013-6.
- Colvin M, Christos T . A stochastic programming approach for clinical trial planning in new drug development. Comput Chem Eng. 2008;32(11):2626-42.
- Petterino C, Argentino-Storino A. Clinical chemistry and haematology historical data in control Sprague-Dawley rats from pre-clinical toxicity studies. Exp Toxicol Pathol. 2006;57(3):213-9.
- Haschek-Hock WM, Rousseaux CG, Wallig MA, Bolon B. NEW: Haschek and Rousseaux’s Handbook of Toxicologic Pathology, Volume 1: Principles and Practice of Toxicologic Pathology. 4th ed. 2021. Int J Toxicol. 2022;41(3):253-4.
- Everds NE. Evaluation of clinical pathology data: correlating changes with other study data. Toxicol Pathol. 2015;43(1):90-7.
- Boehm O, Zur B, Koch A, Tran N, Freyenhagen R, Hartmann M, et al. Clinical chemistry reference database for Wistar rats and C57/BL6 mice. Biol Chem. 2007;388(5):547-54.
- Jin YR, Han XH, Zhang YH, Lee JJ, Lim Y, Chung JH, et al. Antiplatelet activity of hesperetin, a bioflavonoid, is mainly mediated by inhibition of PLCgamma2 phosphorylation and cyclooxygenase-1 activity. Atherosclerosis. 2007;194(1):144-52.
- Carvalho GD, Masseno AP, Zanini MS, Zanini SF, Porfírio LC, Machado JP, et al. Clinical evaluation of laboratory rats (Rattus novergicus Wistar Strain): sanitary, biological and physiological parameters. Rev Ceres. 2009;56(1):51-7.
- Ihedioha JI, Noel-Uneke OA, Ihedioha TE. Reference values for the serum lipid profile of albino rats of varied ages and sexes. Comp Clin Pathol. 2013;22:93-9.
- Jacob Filho W, Lima CC, Paunksnis MRR, Silva AA, Perilhão MS, Caldeira M, et al. Reference database of hematological parameters for growing and aging rats. Aging Male. 2018;21(2):145-8.
- de Kort M, Weber K, Wimmer B, Wilutzky K, Neuenhahn P, Allingham P, et al. Historical control data for hematology parameters obtained from toxicity studies performed on different Wistar rat strains: acceptable value ranges, definition of severity degrees, and vehicle effects. Toxicol Res App. 2020. https://doi.org/10.1177/2397847320931484.
- Dantas JA, Ambiel CR, Cuman RKN, Baroni S, Bersani-Amado CA. Reference values of some physiological parameters of rats from central vivarium of the State University of Maringa. Parana Acta Sci Health Sci. 2006;2:165-70.
- Dixon WJ. Processing data for outliers. Biometrics. 1953;9(1):74-9.
- Reed AH, Henry RJ, Mason WB. Influence of statistical method used on the resulting estimate of normal range. Clin Chem. 1971;17(4):275-84.
- CLSI. Defining, establishing, and verifying reference intervals in the Clinical Laboratory; Approved Guideline-3rd ed. CLSI document EP28-A3c. Wayne PA: Clinical and Laboratory Standards Institute; 2008.
- Friedrichs KR, Harr KE, Freeman KP, Szladovits B, Walton RM, Barnhart KF, et al. ASVCP reference interval guidelines: determination of de novo
reference intervals in veterinary species and other related topics. Vet Clin Pathol. 2012;41(4):441-53. - Haley T. Retrospective analysis of control animal data: The rat. Clin Toxicol. 1978;12(2):249-63.
- Ringler H, Dabich L. Hematology and clinical biochemistry. In: Backer HJ, Lindsey JR, Weisbroth SH, editors. The laboratory rat. New York: Academic Press; 1979. p. 105-8.
- Andreollo NA, Santos EF, Araújo MR, Lopes LR. Rat’s age versus human’s age: What is the relationship? Arq Bras Cir Dig. 2012;25(1):49-51.
- Jackson SJ, Andrews N, Ball D, Bellantuono I, Gray J, Hachoumi L, et al. Does age matter? The impact of rodent age on study outcomes. Lab Anim. 2017;51(2):160-9.
- Giknis MLA, Clifford CB. Clinical laboratory parameter for Crl:WI(Han). Charles River Laboratories. 2008. http://www.criver.com/files/pdfs/rms/ wistarhan/rm_rm_r_wistar_han_clin_lab_parameters_08.aspx
- Kampfmann I, Bauer NB, Johannes S, Moritz A. Differences in hematologic variables in rats of the same strain but different origin. Vet Clin Pathol. 2012;41(2):228-34.
- Liberati TA, Sansone SR, Feuston MH. Hematology and clinical chemistry values in pregnant Wistar Hannover rats compared with nonmated controls. Vet Clin Pathol. 2004;33(2):68-73.
- Özturk B, Çiftçi İ, Ecer B, Gökyaprak SM, Eryavuz OD. Biochemical and hematological profiles of wistar rats at the Selcuk University experimental medicine research and application center. Eurasian J Vet Sci. 2021;37(4):259-64.
- Jones Cl. Platelet function and ageing. Mamm Genome. 2016;27(7-8):358-66.
- Qiao R, Yang S, Yao B, Wang H, Zhang J, Shang H. Complete blood count reference intervals and age and sex-related trends of North China Han population. Clin Chem Lab Med. 2014;52(7):1025-32.
- Samaneka WP, Mandozana G, Tinago W, Nhando N, Mgodi NM, BwakuraDangarembizi MF, et al. Adult hematology and clinical chemistry laboratory reference ranges in a Zimbabwean population. PLoS ONE. 2016;11(11): e0165821.
- Teixeira MA, Chaguri L, Carissimi AA, Souza NL, Mori CMC, Gomes VMW, et al. Hematological and biochemical profiles of rats (Rattus norvegicus) kept under microenvironmental ventilation system. Braz J Vet Res Anim Sci. 2008;37(5):342-7.
- Wolford ST, Schroer RA, Gohs FX, Gallo PP. Reference range data base for serum chemistry and hematology values in laboratory animals. J Toxicol Environ Health. 1986;18(2):161-88.
- Nistiar F, Racz O, Lukacinova A, Hubkova B, Novakova J, Lovasova E, et al. Age dependency on some physiological and biochemical parameters of male Wistar rats in controlled environment. J Environ Sci Health A Tox Hazard Subst Environ Eng. 2012;47(9):1224-33.
- Díaz A, López-Grueso R, Gambini J, Monleón D, Mas-Bargues C, Abdelaziz KM, et al. Sex Differences in age-associated type 2 diabetes in rats-role of estrogens and oxidative stress. Oxid Med Cell Longev. 2019;2019:6734836.
- Nordström A, Hadrévi J, Olsson T, Franks PW, Nordström P. Higher prevalence of type 2 diabetes in men than in women is associated with differences in visceral fat mass. J Clin Endocrinol Metab. 2016;101(10):3740-6.
Publisher’s Note
- *Correspondence:
Suresh Patel
suresh.g.patel@zyduslife.com
1 Animal Research Facility, Zydus Research Centre, Zydus Lifesciences Ltd., Ahmedabad, India
Department of Pharmacology and Toxicology, Zydus Research Centre, Zydus Lifesciences Ltd., Ahmedabad, India - *Significant parameters at
Statistically significant parameters at
Statistical comparison based on nonparametric test
