DOI: https://doi.org/10.1038/s41591-024-03023-5
PMID: https://pubmed.ncbi.nlm.nih.gov/38839897
تاريخ النشر: 2024-06-05
العلاج الجيني الثنائي في الأطفال المصابين بالصمم المتنحي الجسدي 9: نتائج تجربة ذات ذراع واحدة
تم القبول: 29 أبريل 2024
نُشر على الإنترنت: 5 يونيو 2024
(د) التحقق من التحديثات
الملخص
تظهر قائمة المؤلفين وانتماءاتهم في نهاية الورقة. تعتبر العلاج الجيني نهجًا واعدًا للصمم الوراثي. لقد أظهرنا مؤخرًا أن العلاج الجيني أحادي الجانب باستخدام فيروس AAV1-hOTOF مع نوع فيروس مرتبط بالعدوى (AAV) من النوع 1 الذي يحمل جين OTOF البشري آمن ويرتبط بتحسينات وظيفية لدى المرضى الذين يعانون من الصمم المتنحي الجسدي 9 (DFNB9). تم تعديل البروتوكول بعد ذلك والموافقة عليه للسماح بإدارة العلاج الجيني الثنائي. هنا نبلغ عن تحليل مؤقت للتجربة ذات الذراع الواحدة التي تحقق في سلامة وفعالية العلاج الثنائي في خمسة مرضى أطفال يعانون من DFNB9. كانت النقطة النهائية الأساسية هي سمية الجرعة المحدودة بعد 6 أسابيع، وكانت النقطة النهائية الثانوية تشمل السلامة (الأحداث السلبية) والفعالية (وظيفة السمع وإدراك الكلام). لم تحدث أي سمية جرعة محدودة أو حدث سلبي خطير. حدث ما مجموعه 36 حدثًا سلبيًا. كانت أكثر الأحداث السلبية شيوعًا هي زيادة عدد اللمفاويات (6 من 36) وزيادة مستويات الكوليسترول (6 من 36). استعاد جميع المرضى السمع الثنائي. كان متوسط عتبة استجابة جذع الدماغ السمعي في الأذن اليمنى (اليسرى) هو
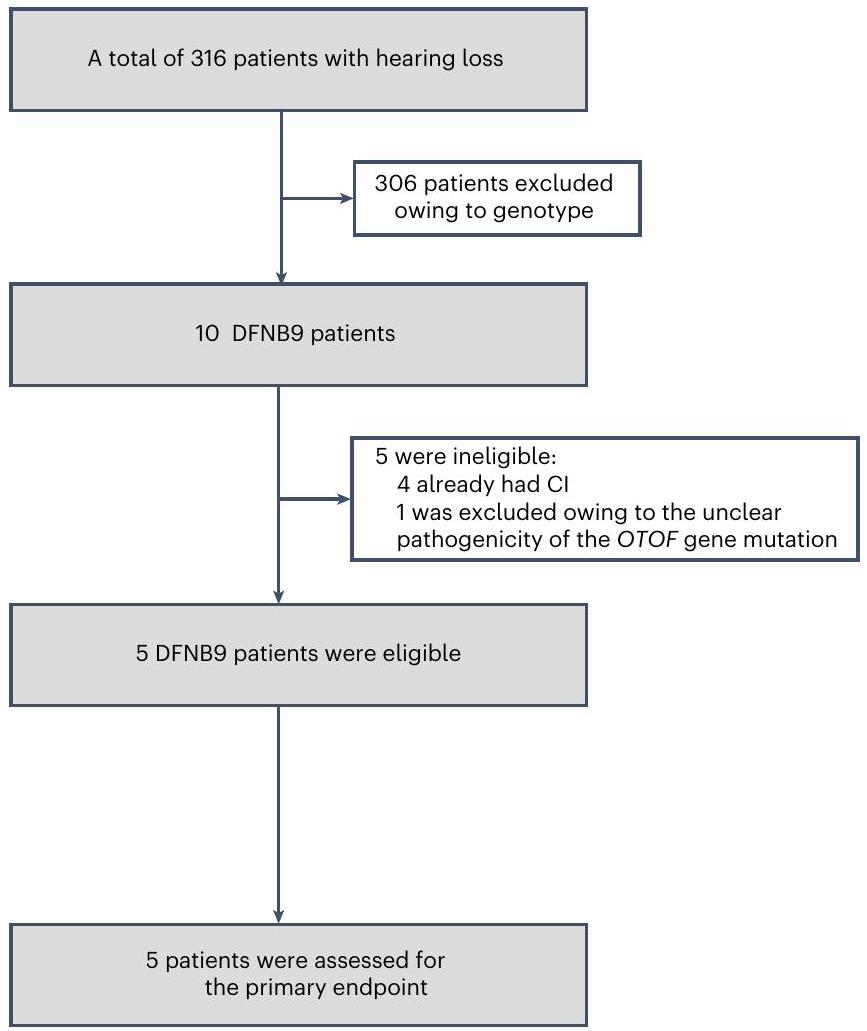
النتائج
المرضى
النتيجة الرئيسية
فعالية
| المريض 1 | المريض 2 | المريض 3 | المريض 4 | المريض 5 | |
| جنس | أنثى | ذكر | ذكر | أنثى | ذكر |
| العمر (بالسنوات) | 11.0 | 1.2 | 2.6 | 3.1 | 2.8 |
| طفرات في OTOF
|
|||||
| الطفرة 1 | c.3723G>A (p.Trp1241*) | c.1498C>T (p.Arg500*) | c.2405_2565del (p.Leu802Glnfs*37) | c.5000C>A (p.Ala1667Asp) | ج.
|
| الطفرة 2 | c.2215-1G>C | c.5989del (p.Ala1997Hisfs*68) | c.5566C>T (p.Arg1856Trp) | c.4030C>T (p.Arg1344*) | c.2610_2615dupGCTCTT (p.Leu870_Leu871dup) |
| عتبة ABR (ديسيبل)
|
|||||
| الأذن اليسرى | >95 | >95 | >95 | >95 | >95 |
| الأذن اليمنى | >95 | >95 | >95 | >95 | >95 |
| عتبة ASSR (ديسيبل)
|
|||||
| الأذن اليسرى | ١٠٣ | 81 | 100 | ١٠٦ | ٨٨ |
| الأذن اليمنى | ١٠٣ | 79 | 100 | ١٠٦ | 85 |
 أقصى مستوى لشدة الصوت.
أقصى مستوى لشدة الصوت.مفرد المقاطع، ثنائي المقاطع والجملة كانت كلها
السلامة
مريض 1

| مايس أو آي تي-مايس | قبعة | سيدي | موس | SSQ-P | ||||
| خطاب | مكاني | صفات أخرى | ||||||
| المريض 1 | خط الأساس | 1 | 0 | 1 | 0 | 0.3 | 0 | 0 |
| 6 أسابيع | ٨ | 1 | 1 | 0 | ٥.٠ | 0 | 0 | |
| 13 أسبوعًا | 17 | 1 | 1 | 2 | 7.8 | 1.7 | 2.5 | |
| 26 أسبوعًا | ٢٨ | ٤ | 1 | ٧ | 7.8 | 2.8 | 5.0 | |
| المريض 2 | خط الأساس | 0 | 0 | 1 | 0 | 0 | 0 | 0 |
| 6 أسابيع | 12 | 2 | 1 | 2 | ٣.٣ | 3.3 | 0.6 | |
| 13 أسبوعًا | 30 | ٤ | 1 | ٤ | 3.3 | 3.3 | 3.8 | |
| 26 أسبوعًا | ٣٥ | ٥ | 2 | 9 | ٦.٧ | 5.3 | 8.5 | |
| المريض 3 | خط الأساس | 0 | 0 | 1 | 0 | 0 | 0 | 0 |
| 6 أسابيع | 21 | 1 | 1 | 2 | 3.9 | 1.7 | 2.5 | |
| 13 أسبوعًا | 32 | 2 | 1 | ٤ | ٥.٠ | ٤.٢ | ٥.٦ | |
| 26 أسبوعًا | ٣٥ | ٥ | 2 | 15 | 7.3 | ٨.٠ | 8.5 | |
| المريض 4 | خط الأساس | 2 | 0 | 1 | 2 | 0.3 | 0 | 0 |
| 6 أسابيع | 9 | 2 | 1 | ٤ | 1.9 | 0.8 | 3.6 | |
| 13 أسبوعًا | 16 | ٤ | 1 | ٧ | 3.6 | 5.8 | ٤.٥ | |
| المريض 5 | خط الأساس | 2 | 0 | 1 | 0 | 0.2 | 0 | 0 |
| 6 أسابيع | 31 | ٣ | 2 | ٧ | 7.4 | 7.0 | ٥.٦ | |
| 13 أسبوعًا | ٢٩ | ٤ | ٢ | ٧ | ٧.٦ | 7.2 | 6.6 | |
كانت المسابح التي تحتوي على خلايا الدم المحيطية الوحيدة النواة (PBMCs) المأخوذة من كل مريض بعد 6 أسابيع من العلاج الجيني ثنائي الأذن AAV1-hOTOF سلبية (الشكل البياني الموسع 5)
نقاش
| عدد الفعاليات | درجة | عدد المرضى | |
| أي AE | ٣٦ | ٥ | |
| زيادة في عدد اللمفاويات | ٦ | 2 | ٤ |
| انخفاض عدد اللمفاويات | 1 | 1 | 1 |
| انخفاض عدد العدلات | 1 | 2 | 1 |
| انخفاض مستويات الهيموغلوبين | 2 | 1 | 2 |
| زيادة مستويات اللاكتات ديهيدروجيناز | ٥ | 1 | ٤ |
| ارتفاع مستويات الدهون الثلاثية | 2 | 2 | 1 |
| زيادة مستويات الكوليسترول | ٥ | 1 | ٤ |
| زيادة مستويات الكوليسترول | 1 | ٢ | 1 |
| انخفاض مستويات الفيبرينوجين | 1 | 1 | 1 |
| زيادة مستويات الكرياتين فوسفو كيناز | 1 | 1 | 1 |
| انخفاض مستويات الهبتوجلوبين | 2 | 1 | 2 |
| بروتينوريا | 2 | 1 | 1 |
| بيلة دموية | ٣ | 1 | 2 |
| حمى | 2 | 1 | 1 |
| قيء | 1 | 1 | 1 |
| فرط سكر الدم | 1 | 1 | 1 |
نظرًا لزيادة الحمل الفيروسي. كانت السبب الدقيق للحمى في المريض 2 غير معروف. قد يكون ناتجًا عن الإنفلونزا، حيث لم تُلاحظ أي أعراض أو شذوذات مصاحبة أخرى، باستثناء السعال الخفيف وارتفاع عدد اللمفاويات. تشير هذه النتائج إلى أن العلاج الجيني الثنائي الأذنين باستخدام AAV1-hOTOF كان آمنًا نسبيًا في مرضى DFNB9 من خلال جراحة لمرة واحدة.
المحتوى عبر الإنترنت
References
- WHO. Deafness and hearing loss. https://www.who.int/ news-room/fact-sheets/detail/deafness-and-hearing-loss (WHO, 2O24).
- Morton, C. C. & Nance, W. E. Newborn hearing screening-a silent revolution. N. Engl. J. Med. 354, 2151-2164 (2006).
- GBD 2017 Disease and Injury Incidence and Prevalence Collaborators. Global, regional, and national incidence, prevalence, and years lived with disability for 354 diseases and injuries for 195 countries and territories, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet 392, 1789-1858 (2018).
- Roux, I. et al. Otoferlin, defective in a human deafness form, is essential for exocytosis at the auditory ribbon synapse. Cell 127, 277-289 (2006).
- Yasunaga, S. et al. A mutation in OTOF, encoding otoferlin, a FER-1-like protein, causes DFNB9, a nonsyndromic form of deafness. Nat. Genet. 21, 363-369 (1999).
- Sloan-Heggen, C. M. et al. Comprehensive genetic testing in the clinical evaluation of 1119 patients with hearing loss. Hum. Genet. 135, 441-450 (2016).
- Rodríguez-Ballesteros, M. et al. A multicenter study on the prevalence and spectrum of mutations in the otoferlin gene (OTOF) in subjects with nonsyndromic hearing impairment and auditory neuropathy. Hum. Mutat. 29, 823-831 (2008).
- Iwasa, Y. I. et al. OTOF mutation analysis with massively parallel DNA sequencing in 2,265 Japanese sensorineural hearing loss patients. PLoS ONE 14, e0215932 (2019).
- Choi, B. Y. et al. Identities and frequencies of mutations of the otoferlin gene (OTOF) causing DFNB9 deafness in Pakistan. Clin. Genet. 75, 237-243 (2009).
- Zhang, L. et al. Preclinical evaluation of the efficacy and safety of AAV1-hOTOF in mice and nonhuman primates. Mol. Ther. Methods Clin. Dev. 31, 101154 (2023).
- Lv, J. et al. AAV1-hOTOF gene therapy for autosomal recessive deafness 9: a single-arm trial. Lancet https://doi.org/10.1016/ S0140-6736(23)02874-X (2024).
- Ma, N., Morris, S. & Kitterick, P. T. Benefits to speech perception in noise from the binaural integration of electric and acoustic signals in simulated unilateral deafness. Ear Hear. 37, 248-259 (2016).
- Dunn, C. C., Tyler, R. S., Oakley, S., Gantz, B. J. & Noble, W. Comparison of speech recognition and localization performance in bilateral and unilateral cochlear implant users matched on duration of deafness and age at implantation. Ear Hear. 29, 352-359 (2008).
- Calcedo, R., Vandenberghe, L. H., Gao, G., Lin, J. & Wilson, J. M. Worldwide epidemiology of neutralizing antibodies to adeno-associated viruses. J. Infect. Dis. 199, 381-390 (2009).
- Verdera, H. C., Kuranda, K. & Mingozzi, F. AAV vector immunogenicity in humans: a long journey to successful gene transfer. Mol. Ther. 28, 723-746 (2020).
- George, L. A. et al. Hemophilia B gene therapy with a high-specific-activity factor IX variant. N. Engl. J. Med. 377, 2215-2227 (2017).
- Manno, C. S. et al. Successful transduction of liver in hemophilia by AAV-Factor IX and limitations imposed by the host immune response. Nat. Med. 12, 342-347 (2006).
- Halbert, C. L. et al. Transduction by adeno-associated virus vectors in the rabbit airway: efficiency, persistence, and readministration. J. Virol. 71, 5932-5941 (1997).
- Greenberg, B. et al. Prevalence of AAV1 neutralizing antibodies and consequences for a clinical trial of gene transfer for advanced heart failure. Gene Ther. 23, 313-319 (2016).
- Sheffield, S. W., Wheeler, H. J., Brungart, D. S. & Bernstein, J. G. W. The effect of sound localization on auditory-only and audiovisual speech recognition in a simulated multitalker environment. Trends Hear. https://doi.org/10.1177/23312165231186040 (2023).
(c) The Author(s) 2024
طرق
تصميم الدراسة والمرضى
معايير إدراج المرضى.
(2) يمكن للمشاركين التواصل بشكل جيد مع الباحثين والامتثال للمتطلبات بمساعدة الأوصياء. يمكن للأطفال الصغار الذين لا يمتلكون مهارات لغوية ناضجة التعاون والامتثال للمتطلبات بمساعدة الأوصياء.
(3) فهم صحيح للتجربة وتوقع مناسب للفوائد.
(4)
(5) تم تحديد تشخيص DFNB9 للصمم الخلقي بناءً على الأعراض السريرية وتحليل طفرات الجينات لوجود طفرات OTOF متماثلة الزيجوت أو ثنائية الأليل في OTOF.
(6) معيار الإدراج السمعي: فقدان سمع شديد إلى كامل (
(7) يفي المشاركون بمتطلبات الجراحة الأذنية. يتم استبعاد المشاركين الذين يعانون من تشوهات الأذن الوسطى والداخلية، أو اضطرابات تطور العصب الدهليزي القوقعي، أو التهاب الأذن وما إلى ذلك، والتي تم تحديدها من خلال التصوير المقطعي المحوسب (CT) و/أو التصوير بالرنين المغناطيسي (MRI) خلال 3 أشهر أو أثناء الفحص.
معايير استبعاد المرضى.
(2) أنواع أخرى من الصمم التي لا تناسب الجراحة الأذنية، مثل الصمم التوصيلي، الصمم المختلط، متلازمة التشوهات الناتجة عن خلل أو تشوه الأذن الوسطى والداخلية، وعيوب العصب الدهليزي أو العصب القوقعي التي تم تحديدها من خلال التصوير المقطعي أو التصوير بالرنين المغناطيسي خلال 3 أشهر.
(3) أمراض أذنية موجودة مسبقًا قد تتداخل مع تفسير نقاط نهاية الدراسة، مثل التهاب الأذن الوسطى الحاد المزمن، مرض منيير، ورم العصب السمعي أو فقدان السمع المفاجئ غير المتعافي.
(4) تاريخ من تعاطي المخدرات، أي علاج دوائي سمي للأذن (مثل الأمينوغليكوزيدات، سيسبلاتين أو مدرات البول الحلقي) خلال 6 أشهر، علاج مضاد للفيروسات أو علاج مناعي خلال 3 أشهر، أو تطعيم خلال شهر واحد.
(5) تاريخ من نقص المناعة المعقد أو زراعة الأعضاء.
(6) المرضى الذين يعانون من أمراض جهازية شديدة أو عدوى بكتيرية أو فيروسية نشطة، مثل السل الرئوي، عدوى التهاب الكبد B أو C النشطة، عدوى الهربس النطاقي النشطة، التهاب البنكرياس، فشل الكلى أو قرحات الجهاز الهضمي.
(7) المرضى الذين لديهم موانع للجراحة أو التخدير معتمدة من الجراح أو طبيب التخدير أو المفوض، مثل الحساسية تجاه دواء الدراسة وحادث وعائي قلبي أو دماغي حدث خلال الأشهر الستة الماضية، بما في ذلك احتشاء عضلة القلب، فشل القلب، الذبحة الصدرية، حادث وعائي دماغي أو نوبة إقفارية عابرة.
(8) المشاركة حاليًا في أو التخطيط للمشاركة في تجربة سريرية أخرى تتعلق بدواء أو جهاز خلال عام واحد، أو خلال 5 نصف أعمار بعد آخر جرعة في تجربة سريرية أخرى.
(9) زراعة أذنين ثنائية (على سبيل المثال، زراعة القوقعة).
(10) مع >1:2,000 من الأجسام المضادة المحايدة ضد غلاف AAV1.
(11) أمراض خلقية شديدة أخرى.
(12) تاريخ واضح من الاضطرابات العصبية أو النفسية، بما في ذلك الصرع أو الخرف.
(13) المرضى الذين يحتاجون إلى مضادات التخثر طويلة الأمد ولا يمكن إيقافها على المدى القصير.
(14) تاريخ من العلاج الإشعاعي والعلاج الكيميائي.
(15) حالات أخرى يعتبرها الباحثون غير مناسبة للمشاركة في الدراسة السريرية الحالية.
تعديل البروتوكول
تعديلات البروتوكول.
(2) تم توسيع عدد المرضى المسجلين (من 2-3 حالات إلى
(3) إضافة مجموعة جرعة استكشافية بديلة (
(4) إضافة خيار الحقن المزدوج (بما في ذلك الحقن الثنائي).
(5) لتقييم الكلام، إزالة طريقة صن شيبين وإضافة مقياس تقييم الأداء السمعي (CAP) وSIR.
(6) إضافة مؤشرات إضافية (أي، تصوير الوظائف الضوئية بالأشعة تحت الحمراء القريبة، تخطيط الدماغ الكهربائي، اختبار الموسيقى، ومقاييس النمو والتطور).
(7) ضبط نقاط المتابعة لعملية التنظير الأذني ووظيفة التوازن.
(8) أضف نقاط زمنية للمتابعة لجمع الدم.
نقاط النهاية
علاج الدراسة السريرية
إنتاج وتسليم AAV1-hOTOF
حمل تسلسل AK، تسلسل مستقبل الربط، الـ
كشف الأجسام المضادة المعادلة ضد AAV1
إنترفيرون-
كشف الحمض النووي الناقل
إيه بي آر
ASSR
DPOAE
الإدراك السمعي والكلامي
تحديد موقع مصدر الصوت
تم قياس تحديد المصدر أيضًا باستخدام برنامج I-CAST (الإصدار 5.05.03)
التحليل الإحصائي
ملخص التقرير
توفر البيانات
References
- World Health Organization. World report on hearing. https://iris. who.int/handle/10665/339913 (WHO, 2021).
- Robbins, A. M., Renshaw, J. J. & Berry, S. W. Evaluating meaningful auditory integration in profoundly hearing-impaired children. Am. J. Otol. 12, 144-150 (1991).
- Archbold, S., Lutman, M. E. & Nikolopoulos, T. Categories of auditory performance: inter-user reliability. Br. J. Audiol. 32, 7-12 (1998).
- McDaniel, D. M. & Cox, R. M. Evaluation of the speech intelligibility rating (SIR) test for hearing aid comparisons. J. Speech Hear. Res. 35, 686-693 (1992).
- Robbins, A. M. & Osberger, M. J. Meaningful Use of Speech Scale (MUSS) (Indiana Univ. School of Medicine, 1990).
- Fu, Q. J., Zhu, M. & Wang, X. Development and validation of the Mandarin speech perception test. J. Acoust. Soc. Am. 129, EL267-73 (2011).
- Tao, D. et al. Melodic pitch perception and lexical tone perception in Mandarin-speaking cochlear implant users. Ear Hear. 36, 102-10 (2015).
- Pennini, P. T. M. & Almeida, K. Speech, Spatial and Qualities of Hearing Scale in assessing the benefit in hearing aid users. CoDAS 33, e20190196 (2021).
- Galvin, K. L. & Noble, W. Adaptation of the speech, spatial, and qualities of hearing scale for use with children, parents, and teachers. Cochlear Implants Int. 14, 135-141 (2013).
- Chan, J. C. et al. Evaluation of binaural functions in bilateral cochlear implant users. Int. J. Audio. 47, 296-310 (2008).
- Liu, Y. W. et al. Effect of tinnitus and duration of deafness on sound localization and speech recognition in noise in patients with single-sided deafness. Trends Hear. 22, https://doi. org/10.1177/2331216518813802 (2018).
- Chandrasekhar, S. S. et al. Clinical practice guideline: sudden hearing loss (update). Otolaryngol. Head. Neck Surg. 161, S1-S45 (2019).
شكر وتقدير
مساهمات المؤلفين
ساهم Y.S. و W.W. و B.C. و H.W. و J.L. و L.Z. و J.W. في الجراحة. ساهم X.C. و M.S. و C.X. في إدراك الكلام. أعد X.C. و Q.C. الفيديوهات. ساهم L.G. و S.Y. و D.W. و H.T. في تحديد جينات المرضى. ساهم Y.Y. في الاختبارات السمعية. عالج M.X. و Z.W. و Y.Z. و L.H. عينات الدم. قدم Y.S. و Z.-Y.C. و H.W. و Y.C. و J.L. و X.C. و D.W. و B.Z. و S.H. و Z.G. مراجعة نقدية للورقة. قدم C.C. و L.J. و J.Z. الدعم الفني.
المصالح المتنافسة
معلومات إضافية






مريض 1


المريض 5




المريض 2




في معظم الترددات عند 13 أسبوعًا. كانت نسبة الإشارة إلى الضوضاء (SNR) في DPOAE لدى المريض 5 مستقرة عند بعض الترددات في 4 أسابيع، لكنها انخفضت عند بعض الترددات في 6 أسابيع وأظهرت تعافيًا إلى حد ما عند 13 أسبوعًا. SNR: نسبة الإشارة إلى الضوضاء. DPOAE: انبعاث الصوت الناتج عن المنتج المشوه.
أ
المريض 1
الخط الأساسي
6 أسابيع




المريض 2

6 أسابيع



المريض 4









أ
المريض 1
الخط الأساسي
6 أسابيع
المريض 2
الخط الأساسي
6 أسابيع








المريض 1





البيانات الموسعة الجدول 1 | تفسير متغير OTOF في المرضى
| مريض | تغيير الحمض النووي | تغيير الأحماض الأمينية | معايير ACMG | تصنيف ACMG |
| المريض 1 | ج.
|
p.Trp1241* | PVS1+PM2_دعم+PM3+P |
|
| P4 | ||||
| c.2215-1G>C | – | PVS1+PM2_دعم+PM3+P |
|
|
| P4 | ||||
| المريض 2 | c.1498C>T | ب.Arg500* | PVS1+PM2_دعم+PM3+P | P |
| P4 | ||||
| c.5989del | p.Ala1997Hisfs*68 | PM2_دعم+PM3+PVS1_معتدل+PP4 | LP | |
| المريض 3 | حذف c.2405_2565 | p.Leu802Glnfs*37 | PVS1+PM2_دعم+PP4 |
|
| c.5566C>T | ب.Arg1856Trp | LP | ||
| PM2_دعم+PM3_قوي+P P3+PM5_دعم+PP4 | ||||
| المريض 4 | 5000 درجة مئوية
|
ب.ألا1667أسب | PM2_دعم+PM3_قوي+P
|
|
| c.4030C
|
ب.Arg1344* | PVS1+PM2_دعم+PP1+PP |
|
|
| ٤ | ||||
| المريض 5 | ج.
|
p.Glu1733Lys | PM2_دعم+PM3_قوي+P P1_قوي+PP3_متوسط+PP4 |
|
| c.2610_2615du pGCTCTT | p.Leu870_Leu871dup | PM2_دعم+PM3+PM4+PP |
|
|
| ٤ |
البيانات الموسعة الجدول 2 | إدراك الكلام وتحديد مصدر الصوت في المريض 1
| مقطع صوتي واحد (%) | ثنائي المقاطع (%) | الجملة (%) | صوت البيئة (%) | نغمة (%) | النسبة المئوية الأولية | النهائي (%) | جذر متوسط مربع الخطأ الثنائي
|
RMSE أحادي الجانب (المتوسط
|
|
| المريض 1 | |||||||||
| خط الأساس | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
|
ND |
| 6 أسابيع | 0 | 0 | 0 | 31.3 | ٢٥.٠ | ٢٥.٠ | ٢٥.٠ |
|
ND |
| 13 أسبوعًا | 0 | 0 | 0 | ٢٨.٢ | 12.6 | 31.3 | 12.5 |
|
|
| 26 أسبوعًا | 2.0 | 1.4 | 0 | 31.3 | 31.3 | 20.8 | 20.8 |
|
|
البيانات الموسعة الجدول 3 | الاستجابات المناعية وإفراز الناقل
| المريض 1 | المريض 2 | المريض 3 | المريض 4 | المريض 5 | |
| تحييد | |||||
| أجسام مضادة | |||||
| خط الأساس | <1:5 | <1:5 | <1:5 | <1:5 | <1:5 |
| 6 أسابيع | 1:1215 | 1:1215 | 1:1215 | 1:1215 | 1:1215 |
| دي إن إيه المتجه | |||||
| خط الأساس | سلبي § | سلبي | سلبي | سلبي | سلبي |
| 7 أيام | سلبي | سلبي | سلبي | سلبي | سلبي |
محفظة الطبيعة
ملخص التقرير
الإحصائيات
يجب أن تُوصف الاختبارات الشائعة فقط بالاسم؛ واصفًا التقنيات الأكثر تعقيدًا في قسم الطرق.
وصف كامل للمعلمات الإحصائية بما في ذلك الاتجاه المركزي (مثل المتوسطات) أو تقديرات أساسية أخرى (مثل معامل الانحدار) والتباين (مثل الانحراف المعياري) أو تقديرات عدم اليقين المرتبطة (مثل فترات الثقة)
تحتوي مجموعتنا على الإنترنت حول الإحصائيات لعلماء الأحياء على مقالات تتناول العديد من النقاط المذكورة أعلاه.
البرمجيات والشيفرة

بيانات
يجب أن تتضمن جميع المخطوطات بيانًا عن توفر البيانات. يجب أن يوفر هذا البيان المعلومات التالية، حيثما ينطبق:
- رموز الانضمام، معرفات فريدة، أو روابط ويب لمجموعات البيانات المتاحة للجمهور
- وصف لأي قيود على توفر البيانات
- بالنسبة لمجموعات البيانات السريرية أو بيانات الطرف الثالث، يرجى التأكد من أن البيان يتماشى مع سياستنا.
البحث الذي يتضمن مشاركين بشريين، بياناتهم، أو مواد بيولوجية
يمكن للمرضى الوصول إلى معلومات التسجيل من خلال الإعلانات المنشورة في المستشفى، والاستفسارات خلال الاستشارة، ومنصات الوسائط المتعددة. تم فحص المرضى وتسجيلهم بناءً على الأنماط الجينية، واختبارات السمع والمعايير ذات الصلة للإدراج/الاستبعاد في البداية. تم الحصول على موافقات خطية مستنيرة من الآباء أو الأوصياء القانونيين للأطفال قبل التسجيل. تم تسجيل خمسة مرضى من DFNB9 مع طفرات ثنائية الأليل في جين OTOF في موقع الدراسة. تم تقديم معايير الإدراج/الاستبعاد الكاملة في المخطوطة وبروتوكول التجربة. لا يوجد انحياز للاختيار الذاتي أو انحيازات أخرى.
التقارير المتخصصة في المجال
علوم الحياة
لنسخة مرجعية من الوثيقة بجميع الأقسام، انظرnature.com/documents/nr-reporting-summary-flat.pdf
تصميم دراسة العلوم الحياتية
| حجم العينة | نظرًا لأن DFNB9 هو مرض نادر، فإن عدد مرضى DFNB9 محدود. بعد العلاج الجيني الثنائي، لم تحدث أي سمية محدودة بالجرعة أو أحداث سلبية خطيرة. خضع المرضى، الذين وُلِدوا صمًا تمامًا، لاستعادة السمع الثنائي، مع تحسين في إدراك الكلام وتحديد مصدر الصوت. كانت الفعالية قوية. كان حجم العينة في الدراسة مستندًا إلى إمكانية التسجيل، وليس استنادًا إلى اعتبارات إحصائية. |
| استبعاد البيانات | لم يتم استبعاد أي بيانات من التحليلات. |
| التكرار | قمنا بتكرار التجارب ذات الصلة على إجمالي 5 مرضى. تم حقن AAV1-hOTOF في 5 مرضى. تم تقييم الأهداف الأولية والثانوية من خلال التحليلات البيوكيميائية، واختبارات السمع، والاستبيانات والاختبارات ذات الصلة في 5 مرضى. كانت كل عينة تم تحليلها عينة فريدة. تم تكرار النتائج التجريبية. تم إجراء اختبارات لإدراك الكلام وتحديد مصدر الصوت في مريض واحد. |
| التوزيع العشوائي | التجربة غير عشوائية. تم إجراء تحليل البيانات بين ما قبل وما بعد العلاج الجيني. |
| مُعَمي | كانت هذه التجربة تجربة ذات ذراع واحدة. لا ينطبق التعمية على هذه الدراسة. |
تصميم دراسة العلوم السلوكية والاجتماعية
| وصف الدراسة | وصف بإيجاز نوع الدراسة بما في ذلك ما إذا كانت البيانات كمية أو نوعية أو مختلطة (مثل: دراسة نوعية مقطعية، دراسة تجريبية كمية، دراسة حالة مختلطة). |
| عينة البحث | حدد عينة البحث (مثل: طلاب الجامعات في هارفارد، القرويين في الهند الريفية) وقدم معلومات ديموغرافية ذات صلة (مثل: العمر، الجنس) وأشر إلى ما إذا كانت العينة تمثل المجتمع. قدم مبررات لعينة الدراسة المختارة. بالنسبة للدراسات التي تتضمن مجموعات بيانات موجودة، يرجى وصف مجموعة البيانات والمصدر. |
| استراتيجية أخذ العينات | وصف إجراء أخذ العينات (مثل: عشوائي، كرة الثلج، طبقي، ملائم). وصف الأساليب الإحصائية التي تم استخدامها لتحديد حجم العينة مسبقًا أو إذا لم يتم إجراء حساب لحجم العينة، وصف كيف تم اختيار أحجام العينات وقدم مبررًا لسبب كفاية هذه الأحجام. بالنسبة للبيانات النوعية، يرجى الإشارة إلى ما إذا تم النظر في تشبع البيانات، وما هي المعايير المستخدمة لتحديد أنه لم يكن هناك حاجة لمزيد من أخذ العينات. |
| جمع البيانات | قدم تفاصيل حول إجراء جمع البيانات، بما في ذلك الأدوات أو الأجهزة المستخدمة لتسجيل البيانات (مثل القلم والورق، الكمبيوتر، جهاز تتبع العين، معدات الفيديو أو الصوت) وما إذا كان هناك أي شخص حاضر بخلاف المشاركين والباحث، وما إذا كان الباحث غير مدرك للحالة التجريبية و/أو فرضية الدراسة أثناء جمع البيانات. |
| توقيت | حدد تواريخ بدء وانتهاء جمع البيانات. إذا كان هناك فجوة بين فترات الجمع، اذكر التواريخ لكل مجموعة عينة. |
| استثناءات البيانات | إذا لم يتم استبعاد أي بيانات من التحليلات، يرجى ذكر ذلك.
|
| عدم المشاركة | حدد عدد المشاركين الذين انسحبوا/رفضوا المشاركة والأسباب المقدمة أو قدم معدل الاستجابة أو اذكر أنه لم ينسحب أي مشارك/يرفض المشاركة. |
| التوزيع العشوائي | إذا لم يتم تخصيص المشاركين في مجموعات تجريبية، يرجى ذكر ذلك أو وصف كيفية تخصيص المشاركين في المجموعات، وإذا لم يكن التخصيص عشوائيًا، يرجى وصف كيفية التحكم في المتغيرات المشتركة. |
تصميم دراسة العلوم البيئية والتطورية والبيئية
|
وصف الدراسة بإيجاز. بالنسبة للبيانات الكمية، تشمل عوامل العلاج والتفاعلات، هيكل التصميم (مثل: تصميم عاملي، متداخل، هرمي)، طبيعة وعدد الوحدات التجريبية والتكرارات. | ||
| وصف عينة البحث (مثل مجموعة من طيور الدوري المنزلي المعلّمة، جميع نباتات ستينوسيريوس ثوربيري داخل نصب أنبوب الصبار الوطني)، وقدم مبررًا لاختيار العينة. عند الاقتضاء، وصف تصنيفات الكائنات، المصدر، الجنس، نطاق العمر وأي تعديلات. اذكر أي مجموعة سكانية من المفترض أن تمثلها العينة عند الاقتضاء. بالنسبة للدراسات التي تتضمن مجموعات بيانات موجودة، وصف البيانات ومصدرها. | |||
| استراتيجية أخذ العينات | يرجى ملاحظة إجراء أخذ العينات. وصف الطرق الإحصائية التي تم استخدامها لتحديد حجم العينة مسبقًا أو إذا لم يتم إجراء حساب لحجم العينة، وصف كيف تم اختيار أحجام العينات وتقديم مبرر لسبب كفاية هذه الأحجام. | ||
| جمع البيانات | وصف إجراء جمع البيانات، بما في ذلك من قام بتسجيل البيانات وكيف. | ||
| التوقيت والمقياس المكاني | حدد تواريخ بدء وانتهاء جمع البيانات، مع الإشارة إلى تكرار ومدة أخذ العينات وتقديم مبرر لهذه الخيارات. إذا كان هناك فجوة بين فترات الجمع، اذكر التواريخ لكل مجموعة عينة. حدد النطاق المكاني الذي تم أخذ البيانات منه. | ||
| استبعاد البيانات | إذا لم يتم استبعاد أي بيانات من التحليلات، يرجى ذكر ذلك أو إذا تم استبعاد بيانات، يرجى وصف الاستبعادات والمبررات وراءها، مع الإشارة إلى ما إذا كانت معايير الاستبعاد قد تم تحديدها مسبقًا. | ||
| إعادة الإنتاج | وصف التدابير المتخذة للتحقق من قابلية تكرار النتائج التجريبية. لكل تجربة، اذكر ما إذا كانت هناك أي محاولات لتكرار التجربة قد فشلت أو اذكر أن جميع المحاولات لتكرار التجربة كانت ناجحة. | ||
| العشوائية | وصف كيفية تخصيص العينات/الكائنات/المشاركين إلى مجموعات. إذا لم يكن التخصيص عشوائيًا، فاشرح كيف تم التحكم في المتغيرات المشتركة. إذا لم يكن هذا ذا صلة بدراستك، فاشرح لماذا. | ||
| مُعَمي | وصف مدى استخدام التعمية أثناء جمع البيانات وتحليلها. إذا لم يكن من الممكن استخدام التعمية، يرجى وصف السبب أو شرح لماذا لم تكن التعمية ذات صلة بدراستك. | ||
| العمل الميداني، الجمع والنقل | |||
| ظروف الميدان | وصف ظروف الدراسة للعمل الميداني، مع تقديم المعايير ذات الصلة (مثل: درجة الحرارة، هطول الأمطار). | ||
| الموقع | حدد موقع العينة أو التجربة، مع تقديم المعلمات ذات الصلة (مثل: خط العرض وخط الطول، الارتفاع، عمق الماء). | ||
| الوصول والاستيراد/التصدير | وصف الجهود التي بذلتها للوصول إلى المواطن وجمع واستيراد/تصدير عيناتك بطريقة مسؤولة وامتثالًا للقوانين المحلية والوطنية والدولية، مع الإشارة إلى أي تصاريح تم الحصول عليها (اذكر اسم الجهة المصدرة، تاريخ الإصدار، وأي معلومات تعريفية). | ||
| الاضطراب | وصف أي اضطراب ناتج عن الدراسة وكيف تم تقليله. | ||
| التقارير عن مواد وأنظمة وأساليب محددة | |||
| المواد والأنظمة التجريبية | الأساليب | ||
| غير متاح | مشارك في الدراسة | غير متاح | مشارك في الدراسة |
|
|
 |
 |
|
|
|
خطوط خلايا حقيقية النواة |  |
|
 |
|
 |
|
 |
|
||
|
|
 |
||
 |
|
||
 |
|
||
الأجسام المضادة
| الأجسام المضادة المستخدمة | الأجسام المضادة المضادة للبشر CD3 mAb (CD3-2) (MABTECH، الرمز: 3605-1S)؛ الأجسام المضادة المضادة للبشر IFN-
|
| التحقق | ELISpot Pro: IFN- البشري
|
خطوط خلايا حقيقية النواة
| مصدر خط الخلايا | خلايا HEK293FT (NANJING COBIOER BIOSCIENCES CO., LTD.) |
| التحقق | تم التحقق من صحة خط خلايا HEK293FT من خلال تحليل STR (NANJING COBIOER BIOSCIENCES CO., LTD.). |
| تلوث الميكوبلازما | تم تأكيد سلبية الخلايا لتلوث الميكوبلازما. |
| خطوط تم التعرف عليها بشكل خاطئ بشكل شائع (انظر سجل ICLAC) | لم يتم استخدام أي خطوط تم التعرف عليها بشكل خاطئ بشكل شائع في هذه الدراسة. |
علم الحفريات وعلم الآثار
| أصل العينة | قدم معلومات عن أصل العينات ووصف التصاريح التي تم الحصول عليها للعمل (بما في ذلك اسم الجهة المصدرة، تاريخ الإصدار، وأي معلومات تعريفية). يجب أن تشمل التصاريح الجمع، وعند الاقتضاء، التصدير. |
| إيداع العينة | حدد أين تم إيداع العينات للسماح بالوصول الحر من قبل باحثين آخرين. |
| طرق التأريخ | إذا تم تقديم تواريخ جديدة، وصف كيف تم الحصول عليها (مثل الجمع، التخزين، معالجة العينة والقياس)، أين تم الحصول عليها (أي اسم المختبر)، برنامج المعايرة وبروتوكول ضمان الجودة أو اذكر أنه لم يتم تقديم تواريخ جديدة. |
الإشراف الأخلاقي
حدد المنظمة (المنظمات) التي وافقت أو قدمت إرشادات حول بروتوكول الدراسة، أو اذكر أنه لم يكن هناك حاجة لموافقة أخلاقية أو إرشادات واشرح لماذا.
الحيوانات وغيرها من الكائنات البحثية
| الحيوانات المخبرية | بالنسبة للحيوانات المخبرية، أبلغ عن النوع والسلالة والعمر أو اذكر أن الدراسة لم تشمل حيوانات مخبرية. |
| الحيوانات البرية | قدم تفاصيل عن الحيوانات التي تم ملاحظتها في أو تم اصطيادها في الميدان؛ أبلغ عن النوع والعمر حيثما كان ذلك ممكنًا. وصف كيف تم اصطياد الحيوانات ونقلها وماذا حدث للحيوانات المحتجزة بعد الدراسة (إذا تم قتلها، اشرح لماذا ووصف الطريقة؛ إذا تم إطلاق سراحها، اذكر أين ومتى) أو اذكر أن الدراسة لم تشمل حيوانات برية. |
| الإبلاغ عن الجنس | حدد ما إذا كانت النتائج تنطبق على جنس واحد فقط؛ وصف ما إذا كان الجنس قد تم أخذه في الاعتبار في تصميم الدراسة، والأساليب المستخدمة لتحديد الجنس. |
الإبلاغ عن الجنس
عينات تم جمعها من الميدان
الإشراف الأخلاقي
البيانات السريرية
معلومات السياسة حول الدراسات السريرية
بروتوكول الدراسة
جمع البيانات
تم تقديم بروتوكول التجربة الكامل في المعلومات التكميلية.
البحث المثير للقلق
معلومات السياسة حول البحث المثير للقلق
المخاطر
نعم
التجارب المثيرة للقلق
النباتات
| مخزونات البذور | لم يتم استخدام أي نبات في هذه التجربة. | ||||
| أنماط نباتية جديدة | لم يتم استخدام أي نبات في هذه التجربة. | ||||
| التحقق | لم يتم استخدام أي نبات في هذه التجربة. | ||||
| ChIP-seq | |||||
| إيداع البيانات |
|||||
|
بالنسبة لوثائق “التقديم الأولي” أو “الإصدار المنقح”، قدم روابط وصول للمراجعين. بالنسبة لوثيقة “التقديم النهائي” الخاصة بك، قدم رابطًا للبيانات المودعة. | ||||
| قدم قائمة بجميع الملفات المتاحة في تقديم قاعدة البيانات. | |||||
| قدم رابطًا لجلسة متصفح الجينوم مجهولة الهوية لوثائق “التقديم الأولي” و”الإصدار المنقح” فقط، لتمكين المراجعة من قبل الأقران. اكتب “لم يعد ينطبق” لوثائق “التقديم النهائي”. | |||||
| المنهجية | |||||
|
وصف التكرارات التجريبية، مع تحديد العدد والنوع واتفاق التكرار. | ||||
| وصف عمق التسلسل لكل تجربة، مع تقديم العدد الإجمالي للقراءات، والقراءات المخصصة بشكل فريد، وطول القراءات وما إذا كانت مزدوجة أو مفردة. | |||||
| الأجسام المضادة | وصف الأجسام المضادة المستخدمة في تجارب ChIP-seq؛ إذا كان ذلك مناسبًا، قدم اسم المورد، ورقم الكتالوج، واسم النسخة، ورقم الدفعة. | ||||
|
حدد برنامج سطر الأوامر والمعلمات المستخدمة في رسم الخرائط للقراءات واستدعاء القمة، بما في ذلك ملفات ChIP، والتحكم، والفهرس المستخدمة. | ||||
| وصف الطرق المستخدمة لضمان جودة البيانات بالتفصيل الكامل، بما في ذلك عدد القمم عند FDR 5% وما فوق 5 أضعاف من الغنى. | |||||
| وصف البرمجيات المستخدمة لجمع وتحليل بيانات ChIP-seq. بالنسبة للكود المخصص الذي تم إيداعه في مستودع مجتمعي، قدم تفاصيل الوصول. | |||||
|
|||||
| المنهجية | |||||
| تحضير العينة | وصف تحضير العينة، مع توضيح المصدر البيولوجي للخلايا وأي خطوات معالجة الأنسجة المستخدمة. | ||||
| الأداة | حدد الأداة المستخدمة لجمع البيانات، مع تحديد العلامة التجارية ورقم الطراز. | ||||
| البرمجيات | وصف البرمجيات المستخدمة لجمع وتحليل بيانات تدفق السيتومتر. بالنسبة للكود المخصص الذي تم إيداعه في مستودع مجتمعي، قدم تفاصيل الوصول. | ||||
وفرة تجمع الخلايا
استراتيجية التصفية
تصوير الرنين المغناطيسي
تصميم التجربة
| نوع التصميم | حدد المهمة أو حالة الراحة؛ تصميم متعلق بالحدث أو تصميم كتلة. |
| مواصفات التصميم | حدد عدد الكتل، والتجارب أو الوحدات التجريبية لكل جلسة و/أو موضوع، وحدد طول كل تجربة أو كتلة (إذا كانت التجارب محجوزة) والفترة بين التجارب. |
| مقاييس الأداء السلوكي | حدد عدد و/أو نوع المتغيرات المسجلة (مثل الضغط على الزر الصحيح، ووقت الاستجابة) وما هي الإحصائيات المستخدمة لتحديد أن الموضوعات كانت تؤدي المهمة كما هو متوقع (مثل المتوسط، النطاق، و/أو الانحراف المعياري عبر الموضوعات). |
الاكتساب
نوع التصوير
معلمات التسلسل والتصوير
منطقة الاكتساب
حدد: وظيفي، هيكلي، انتشاري، تدفق.
حدد بالتسلا
حدد نوع تسلسل النبض (صدى التدرج، صدى الدوران، إلخ)، نوع التصوير (EPI، حلزوني، إلخ)، مجال الرؤية، حجم المصفوفة، سمك الشريحة، الاتجاه وزاوية TE/TR/الانعكاس.
المعالجة المسبقة
| برمجيات المعالجة المسبقة | قدم تفاصيل حول إصدار البرمجيات ورقم المراجعة والمعلمات المحددة (النموذج/الوظائف، استخراج الدماغ، التقسيم، حجم نواة التنعيم، إلخ). |
| التطبيع | إذا تم تطبيع/توحيد البيانات، وصف النهج (النهج): حدد خطيًا أو غير خطي وحدد أنواع الصور المستخدمة للتحويل أو أشر إلى أن البيانات لم يتم تطبيعها واشرح السبب وراء عدم التطبيع. |
| قالب التطبيع | وصف القالب المستخدم للتطبيع/التحويل، مع تحديد مساحة الموضوع أو مساحة المجموعة الموحدة (مثل Talairach الأصلية، MNI305، ICBM152) أو أشر إلى أن البيانات لم يتم تطبيعها. |
| إزالة الضوضاء والفن | وصف إجراءاتك لإزالة الفن والضوضاء الهيكلية، مع تحديد معلمات الحركة، وإشارات الأنسجة والإشارات الفسيولوجية (معدل ضربات القلب، التنفس). |
| تصفية الحجم | حدد برمجياتك و/أو طريقتك ومعايير تصفية الحجم، واذكر مدى هذه التصفية. |
النمذجة الإحصائية والاستدلال
| نوع النموذج والإعدادات | حدد النوع (متغير أحادي الكتلة، متعدد المتغيرات، RSA، تنبؤي، إلخ) ووصف التفاصيل الأساسية للنموذج على المستويين الأول والثاني (مثل الثابت، العشوائي أو التأثيرات المختلطة؛ الانجراف أو الارتباط الذاتي). | ||
| التأثيرات المختبرة | حدد التأثير الدقيق من حيث شروط المهمة أو المحفز بدلاً من المفاهيم النفسية وأشر إلى ما إذا تم استخدام ANOVA أو التصاميم العاملية. | ||
| حدد نوع التحليل: |
|
||
|
حدد على مستوى الفوكسل أو مستوى العنقود وقدم جميع المعلمات ذات الصلة لطرق مستوى العنقود. | ||
| تصحيح | وصف نوع التصحيح وكيف يتم الحصول عليه للمقارنات المتعددة (مثل FWE، FDR، التبديل أو مونت كارلو). |
النماذج والتحليل
n/a متورط في الدراسة
الاتصال الوظيفي و/أو الفعال
تحليل الرسم البياني
النمذجة متعددة المتغيرات أو التحليل التنبؤي
قدم مقاييس الاعتماد المستخدمة وتفاصيل النموذج (مثل الارتباط بيرسون، الارتباط الجزئي، المعلومات المتبادلة).
قدم المتغير التابع ومقياس الاتصال، مع تحديد الرسم البياني الموزون أو الرسم البياني الثنائي، على مستوى الموضوع أو المجموعة، والملخصات العالمية و/أو العقد المستخدمة (مثل معامل التجميع، الكفاءة، إلخ).
حدد المتغيرات المستقلة، واستخراج الميزات وتقليل الأبعاد، والنموذج، وقياسات التدريب والتقييم.
- البريد الإلكتروني: wwuqing@eent.shmu.edu.cn; zheng-yi_chen@meei.harvard.edu; hwli@shmu.edu.cn; yilai_shu@fudan.edu.cn
معهد ENT وقسم الأنف والأذن والحنجرة بمستشفى العيون والأنف والأذن، جامعة فودان، شنغهاي، الصين. مختبر NHC الرئيسي لطب السمع، جامعة فودان، شنغهاي، الصين. معاهد العلوم الطبية الحيوية، جامعة فودان، شنغهاي، الصين. المختبر الرئيسي للدولة لعلم الأعصاب الطبي ومركز MOE للعلوم العصبية، جامعة فودان، شنغهاي، الصين. قسم الأنف والأذن والحنجرة، المستشفى الثاني التابع، كلية الطب هينغيانغ، جامعة جنوب الصين، هينغيانغ، هونان، الصين. معهد شنغهاي لإعادة تأهيل الأطفال الاستثنائيين، شنغهاي، الصين. شركة شنغهاي Refreshgene Therapeutics المحدودة، شنغهاي، الصين. قسم الأنف والأذن والحنجرة—جراحة الرأس والعنق، برنامج الدراسات العليا في علوم وتكنولوجيا الكلام والسمع وبرنامج العلوم العصبية، كلية الطب بجامعة هارفارد، بوسطن، MA، الولايات المتحدة الأمريكية. مختبر إيتون-بيبودي، Massachusetts Eye and Ear، بوسطن، MA، الولايات المتحدة الأمريكية. ساهم هؤلاء المؤلفون بالتساوي: هوي وانغ، يوشين تشين، جون لو، شياوتينغ تشينغ، تشي كاو. - البريد الإلكتروني: wwuqing@eent.shmu.edu.cn; zheng-yi_chen@meei.harvard.edu; hwli@shmu.edu.cn; yilai_shu@fudan.edu.cn
- معرف النسخة: NM_001287489.2. ACMG، الكلية الأمريكية للوراثة الطبية وعلم الجينوم؛
, مسبب؛ , محتمل أن يكون مسببًا.
DOI: https://doi.org/10.1038/s41591-024-03023-5
PMID: https://pubmed.ncbi.nlm.nih.gov/38839897
Publication Date: 2024-06-05
Bilateral gene therapy in children with autosomal recessive deafness 9:single-arm trial results
Accepted: 29 April 2024
Published online: 5 June 2024
(D) Check for updates
Abstract
A list of authors and their affiliations appears at the end of the paper Gene therapy is a promising approach for hereditary deafness. We recently showed that unilateral AAV1-hOTOF gene therapy with dual adeno-associated virus (AAV) serotype 1 carrying human OTOF transgene is safe and associated with functional improvements in patients with autosomal recessive deafness 9 (DFNB9). The protocol was subsequently amended and approved to allow bilateral gene therapy administration. Here we report an interim analysis of the single-arm trial investigating the safety and efficacy of binaural therapy in five pediatric patients with DFNB9. The primary endpoint was dose-limiting toxicity at 6 weeks, and the secondary endpoint included safety (adverse events) and efficacy (auditory function and speech perception). No dose-limiting toxicity or serious adverse event occurred. A total of 36 adverse events occurred. The most common adverse events were increased lymphocyte counts (6 out of 36) and increased cholesterol levels (6 out of 36). All patients had bilateral hearing restoration. The average auditory brainstem response threshold in the right (left) ear was
Results
Patients
Primary outcome
Efficacy

| Patient 1 | Patient 2 | Patient 3 | Patient 4 | Patient 5 | |
| Sex | Female | Male | Male | Female | Male |
| Age (years) | 11.0 | 1.2 | 2.6 | 3.1 | 2.8 |
| Mutations in OTOF
|
|||||
| Mutation 1 | c.3723G>A (p.Trp1241*) | c.1498C>T (p.Arg500*) | c.2405_2565del (p.Leu802Glnfs*37) | c.5000C>A (p.Ala1667Asp) | c.
|
| Mutation 2 | c.2215-1G>C | c.5989del (p.Ala1997Hisfs*68) | c.5566C>T (p.Arg1856Trp) | c.4030C>T (p.Arg1344*) | c.2610_2615dupGCTCTT (p.Leu870_Leu871dup) |
| ABR threshold (dB)
|
|||||
| Left ear | >95 | >95 | >95 | >95 | >95 |
| Right ear | >95 | >95 | >95 | >95 | >95 |
| ASSR threshold (dB)
|
|||||
| Left ear | 103 | 81 | 100 | 106 | 88 |
| Right ear | 103 | 79 | 100 | 106 | 85 |
 maximum sound intensity level.
maximum sound intensity level.monosyllable, disyllable and sentence was all
Safety
a Patient 1

| MAIS or IT-MAIS | CAP | SIR | MUSS | SSQ-P | ||||
| Speech | Spatial | Other qualities | ||||||
| Patient 1 | Baseline | 1 | 0 | 1 | 0 | 0.3 | 0 | 0 |
| 6 weeks | 8 | 1 | 1 | 0 | 5.0 | 0 | 0 | |
| 13 weeks | 17 | 1 | 1 | 2 | 7.8 | 1.7 | 2.5 | |
| 26 weeks | 28 | 4 | 1 | 7 | 7.8 | 2.8 | 5.0 | |
| Patient 2 | Baseline | 0 | 0 | 1 | 0 | 0 | 0 | 0 |
| 6 weeks | 12 | 2 | 1 | 2 | 3.3 | 3.3 | 0.6 | |
| 13 weeks | 30 | 4 | 1 | 4 | 3.3 | 3.3 | 3.8 | |
| 26 weeks | 35 | 5 | 2 | 9 | 6.7 | 5.3 | 8.5 | |
| Patient 3 | Baseline | 0 | 0 | 1 | 0 | 0 | 0 | 0 |
| 6 weeks | 21 | 1 | 1 | 2 | 3.9 | 1.7 | 2.5 | |
| 13 weeks | 32 | 2 | 1 | 4 | 5.0 | 4.2 | 5.6 | |
| 26 weeks | 35 | 5 | 2 | 15 | 7.3 | 8.0 | 8.5 | |
| Patient 4 | Baseline | 2 | 0 | 1 | 2 | 0.3 | 0 | 0 |
| 6 weeks | 9 | 2 | 1 | 4 | 1.9 | 0.8 | 3.6 | |
| 13 weeks | 16 | 4 | 1 | 7 | 3.6 | 5.8 | 4.5 | |
| Patient 5 | Baseline | 2 | 0 | 1 | 0 | 0.2 | 0 | 0 |
| 6 weeks | 31 | 3 | 2 | 7 | 7.4 | 7.0 | 5.6 | |
| 13 weeks | 29 | 4 | 2 | 7 | 7.6 | 7.2 | 6.6 | |
pools with peripheral blood mononuclear cells (PBMCs) drawn from each patient at 6 weeks after AAV1-hOTOF binaural gene therapy were negative (Extended Data Fig. 5)
Discussion
| Number of events | Grade | Number of patients | |
| Any AE | 36 | 5 | |
| Increased lymphocyte counts | 6 | 2 | 4 |
| Decreased lymphocyte counts | 1 | 1 | 1 |
| Decreased neutrophil counts | 1 | 2 | 1 |
| Decreased hemoglobin levels | 2 | 1 | 2 |
| Increased lactate dehydrogenase levels | 5 | 1 | 4 |
| Increased triglyceride levels | 2 | 2 | 1 |
| Increased cholesterol levels | 5 | 1 | 4 |
| Increased cholesterol levels | 1 | 2 | 1 |
| Decreased fibrinogen levels | 1 | 1 | 1 |
| Increased creatine phosphokinase levels | 1 | 1 | 1 |
| Decreased haptoglobin levels | 2 | 1 | 2 |
| Proteinuria | 2 | 1 | 1 |
| Hematuresis | 3 | 1 | 2 |
| Fever | 2 | 1 | 1 |
| Emesis | 1 | 1 | 1 |
| Hyperglycemia | 1 | 1 | 1 |
owing to an increase in the viral load. The exact cause of fever in patient 2 was unknown. It might have been caused by influenza, as no other concomitant symptoms or abnormalities were observed, except mild cough and elevated lymphocyte counts. These results indicate that binaural gene therapy of AAV1-hOTOF was relatively safe in DFNB9 patients via one-time surgery.
Online content
References
- WHO. Deafness and hearing loss. https://www.who.int/ news-room/fact-sheets/detail/deafness-and-hearing-loss (WHO, 2O24).
- Morton, C. C. & Nance, W. E. Newborn hearing screening-a silent revolution. N. Engl. J. Med. 354, 2151-2164 (2006).
- GBD 2017 Disease and Injury Incidence and Prevalence Collaborators. Global, regional, and national incidence, prevalence, and years lived with disability for 354 diseases and injuries for 195 countries and territories, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet 392, 1789-1858 (2018).
- Roux, I. et al. Otoferlin, defective in a human deafness form, is essential for exocytosis at the auditory ribbon synapse. Cell 127, 277-289 (2006).
- Yasunaga, S. et al. A mutation in OTOF, encoding otoferlin, a FER-1-like protein, causes DFNB9, a nonsyndromic form of deafness. Nat. Genet. 21, 363-369 (1999).
- Sloan-Heggen, C. M. et al. Comprehensive genetic testing in the clinical evaluation of 1119 patients with hearing loss. Hum. Genet. 135, 441-450 (2016).
- Rodríguez-Ballesteros, M. et al. A multicenter study on the prevalence and spectrum of mutations in the otoferlin gene (OTOF) in subjects with nonsyndromic hearing impairment and auditory neuropathy. Hum. Mutat. 29, 823-831 (2008).
- Iwasa, Y. I. et al. OTOF mutation analysis with massively parallel DNA sequencing in 2,265 Japanese sensorineural hearing loss patients. PLoS ONE 14, e0215932 (2019).
- Choi, B. Y. et al. Identities and frequencies of mutations of the otoferlin gene (OTOF) causing DFNB9 deafness in Pakistan. Clin. Genet. 75, 237-243 (2009).
- Zhang, L. et al. Preclinical evaluation of the efficacy and safety of AAV1-hOTOF in mice and nonhuman primates. Mol. Ther. Methods Clin. Dev. 31, 101154 (2023).
- Lv, J. et al. AAV1-hOTOF gene therapy for autosomal recessive deafness 9: a single-arm trial. Lancet https://doi.org/10.1016/ S0140-6736(23)02874-X (2024).
- Ma, N., Morris, S. & Kitterick, P. T. Benefits to speech perception in noise from the binaural integration of electric and acoustic signals in simulated unilateral deafness. Ear Hear. 37, 248-259 (2016).
- Dunn, C. C., Tyler, R. S., Oakley, S., Gantz, B. J. & Noble, W. Comparison of speech recognition and localization performance in bilateral and unilateral cochlear implant users matched on duration of deafness and age at implantation. Ear Hear. 29, 352-359 (2008).
- Calcedo, R., Vandenberghe, L. H., Gao, G., Lin, J. & Wilson, J. M. Worldwide epidemiology of neutralizing antibodies to adeno-associated viruses. J. Infect. Dis. 199, 381-390 (2009).
- Verdera, H. C., Kuranda, K. & Mingozzi, F. AAV vector immunogenicity in humans: a long journey to successful gene transfer. Mol. Ther. 28, 723-746 (2020).
- George, L. A. et al. Hemophilia B gene therapy with a high-specific-activity factor IX variant. N. Engl. J. Med. 377, 2215-2227 (2017).
- Manno, C. S. et al. Successful transduction of liver in hemophilia by AAV-Factor IX and limitations imposed by the host immune response. Nat. Med. 12, 342-347 (2006).
- Halbert, C. L. et al. Transduction by adeno-associated virus vectors in the rabbit airway: efficiency, persistence, and readministration. J. Virol. 71, 5932-5941 (1997).
- Greenberg, B. et al. Prevalence of AAV1 neutralizing antibodies and consequences for a clinical trial of gene transfer for advanced heart failure. Gene Ther. 23, 313-319 (2016).
- Sheffield, S. W., Wheeler, H. J., Brungart, D. S. & Bernstein, J. G. W. The effect of sound localization on auditory-only and audiovisual speech recognition in a simulated multitalker environment. Trends Hear. https://doi.org/10.1177/23312165231186040 (2023).
(c) The Author(s) 2024
Methods
Study design and patients
Patient inclusion criteria.
(2) Participants are able to communicate well with the researchers and comply with the requirements with the help of guardians. Young children without mature language skills could cooperate and comply with the requirements with the help of guardians.
(3) A proper understanding of the trial and an appropriate expectation of the benefits.
(4)
(5) A diagnosis of DFNB9 congenital deafness was determined based on the clinical symptoms and gene mutation analysis for the presence of either OTOF homozygous or biallelic mutations in OTOF.
(6) Audiological inclusion criterion: severe-to-complete hearing loss (
(7) Participants satisfy the requirements for otologic surgery. Participants with middle-inner ear deformity, vestibular-cochlear nerve development abnormality, ear inflammation and so on, determined through computed tomography (CT) and/or magnetic resonance imaging (MRI) within 3 months or during screening, are excluded.
Patient exclusion criteria.
(2) Other types of deafness that are not suitable for otologic surgery, such as conductive deafness, mixed deafness, malformation syndrome caused by middle-inner ear dysplasia or malformation, and abnormalities of the vestibular nerve or cochlear nerve determined through CT or MRI scan within 3 months.
(3) Preexisting otologic diseases that may interfere with the interpretation of study endpoints, such as acute-chronic otitis media, Meniere’s disease, acoustic neuroma or unrecovered sudden deafness.
(4) A history of substance abuse, any ototoxic drug treatment (such as aminoglycosides, cisplatin or loop diuretics) within 6 months, antiviral therapy or immunotherapy within 3 months, or vaccination within 1 month.
(5) A history of complex immunodeficiency or organ transplantation.
(6) Patients with severe systemic disease or active bacterial or viral infection, such as pulmonary tuberculosis, active hepatitis B or C infection, active herpes zoster infection, pancreatitis, renal failure or gastrointestinal ulcers.
(7) Patients with contraindications to surgery or anesthesia certified by the surgeon, anesthesiologist or designee, such as an allergy to the study medication and a cardiovascular or cerebrovascular accident that occurred within the past 6 months, including myocardial infarction, heart failure, angina pectoris, cerebrovascular accident or transient ischemic attack.
(8) Currently participating in or planning to participate in another clinical trial involving a drug or device within 1 year, or within 5 half-lives after the last dosing in another clinical trial.
(9) Bilateral ear implants (for example, cochlear implants).
(10) With >1:2,000 neutralizing antibodies against the AAV1 capsid.
(11) Other severe congenital diseases.
(12) A clear history of neurological or psychiatric disorders, including epilepsy or dementia.
(13) Patients who require long-term anticoagulants and cannot be interrupted in the short term.
(14) A history of radiotherapy and chemotherapy.
(15) Other conditions that investigators do not consider appropriate for participating in the present clinical study.
Protocol amendment
Protocol amendments.
(2) The number of enrolled patients was expanded (from 2-3 cases to
(3) Add an alternative exploratory dose group (
(4) Add the option of double injection (including bilateral injection).
(5) For evaluation of speech, remove Sun Xibin’s method and add the Auditory Performance Rating Scale (CAP) and SIR.
(6) Add additional indicators (that is, near-infrared light functional imaging, electroencephalogram, music test, and growth and development scales).
(7) Adjust follow-up timepoints for otoscopy and vestibular function.
(8) Add follow-up timepoints for blood collection.
Endpoints
Clinical study treatment
Production and delivery of AAV1-hOTOF
carried an AK sequence, a splicing acceptor sequence, the
Detection of anti-AAV1 neutralizing antibody
IFN-
Detection of vector DNA
ABR
ASSR
DPOAE
Auditory and speech perception
Sound source localization
source localization was also measured using I-CAST software (version 5.05.03)
Statistical analysis
Reporting summary
Data availability
References
- World Health Organization. World report on hearing. https://iris. who.int/handle/10665/339913 (WHO, 2021).
- Robbins, A. M., Renshaw, J. J. & Berry, S. W. Evaluating meaningful auditory integration in profoundly hearing-impaired children. Am. J. Otol. 12, 144-150 (1991).
- Archbold, S., Lutman, M. E. & Nikolopoulos, T. Categories of auditory performance: inter-user reliability. Br. J. Audiol. 32, 7-12 (1998).
- McDaniel, D. M. & Cox, R. M. Evaluation of the speech intelligibility rating (SIR) test for hearing aid comparisons. J. Speech Hear. Res. 35, 686-693 (1992).
- Robbins, A. M. & Osberger, M. J. Meaningful Use of Speech Scale (MUSS) (Indiana Univ. School of Medicine, 1990).
- Fu, Q. J., Zhu, M. & Wang, X. Development and validation of the Mandarin speech perception test. J. Acoust. Soc. Am. 129, EL267-73 (2011).
- Tao, D. et al. Melodic pitch perception and lexical tone perception in Mandarin-speaking cochlear implant users. Ear Hear. 36, 102-10 (2015).
- Pennini, P. T. M. & Almeida, K. Speech, Spatial and Qualities of Hearing Scale in assessing the benefit in hearing aid users. CoDAS 33, e20190196 (2021).
- Galvin, K. L. & Noble, W. Adaptation of the speech, spatial, and qualities of hearing scale for use with children, parents, and teachers. Cochlear Implants Int. 14, 135-141 (2013).
- Chan, J. C. et al. Evaluation of binaural functions in bilateral cochlear implant users. Int. J. Audio. 47, 296-310 (2008).
- Liu, Y. W. et al. Effect of tinnitus and duration of deafness on sound localization and speech recognition in noise in patients with single-sided deafness. Trends Hear. 22, https://doi. org/10.1177/2331216518813802 (2018).
- Chandrasekhar, S. S. et al. Clinical practice guideline: sudden hearing loss (update). Otolaryngol. Head. Neck Surg. 161, S1-S45 (2019).
Acknowledgements
Author contributions
data. Y.S., W.W., B.C., H.W., J.L., L.Z. and J.W. contributed to surgery. X.C., M.S. and C.X. contributed to speech perception. X.C. and Q.C. prepared the videos. L.G., S.Y., D.W. and H.T. contributed to patients’ genotyping. Y.Y. contributed to audiometric tests. M.X., Z.W., Y.Z. and L.H. processed the blood samples. Y.S., Z.-Y.C., H.W., Y.C., J.L., X.C., D.W., B.Z., S.H. and Z.G. provided critical revision of the paper. C.C., L.J. and J.Z. provided technical support.
Competing interests
Additional information






A Patient 1


E Patient 5




B Patient 2




at most frequencies at 13 weeks. e, The SNR of DPOAE in patient 5 was stable at some frequencies at 4 weeks, but it decreased at some frequencies at 6 weeks and showed recovery to some extent at 13 weeks. SNR: signal-to-noise ratio. DPOAE: distortion product otoacoustic emission.
A
Patient 1
Baseline
6 weeks




B Patient 2

6 weeks



D Patient 4









A
Patient 1
Baseline
6 weeks
B Patient 2
Baseline
6 weeks








Patient 1





Extended Data Table 1 | OTOF variant interpretation in patients
| Patient | DNA change | Amino acid change | ACMG criteria | ACMG Classification |
| Patient 1 | c.
|
p.Trp1241* | PVS1+PM2_Supporting+PM3+P |
|
| P4 | ||||
| c.2215-1G>C | – | PVS1+PM2_Supporting+PM3+P |
|
|
| P4 | ||||
| Patient 2 | c.1498C>T | p.Arg500* | PVS1+PM2_Supporting+PM3+P | P |
| P4 | ||||
| c.5989del | p.Ala1997Hisfs*68 | PM2_Supporting+PM3+PVS1_M oderate+PP4 | LP | |
| Patient 3 | c.2405_2565del | p.Leu802Glnfs*37 | PVS1+PM2_Supporting+PP4 |
|
| c.5566C>T | p.Arg1856Trp | LP | ||
| PM2_Supporting+PM3_Strong+P P3+PM5_Supporting+PP4 | ||||
| Patient 4 | c.5000C
|
p.Ala1667Asp | PM2_Supporting+PM3_Strong+P
|
|
| c.4030C
|
p.Arg1344* | PVS1+PM2_Supporting+PP1+PP |
|
|
| 4 | ||||
| Patient 5 | c.
|
p.Glu1733Lys | PM2_Supporting+PM3_Strong+P P1_Strong+PP3_Moderate+PP4 |
|
| c.2610_2615du pGCTCTT | p.Leu870_Leu871dup | PM2_Supporting+PM3+PM4+PP |
|
|
| 4 |
Extended Data Table 2 | Speech perception and sound source localization in patient 1
| Monosyllable (%) | Disyllable (%) | Sentence (%) | Ambient sound (%) | Tone (%) | Initial (%) | Final (%) | Bilateral RMSE (mean
|
Unilateral RMSE (mean
|
|
| Patient 1 | |||||||||
| Baseline | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
|
ND |
| 6 weeks | 0 | 0 | 0 | 31.3 | 25.0 | 25.0 | 25.0 |
|
ND |
| 13 weeks | 0 | 0 | 0 | 28.2 | 12.6 | 31.3 | 12.5 |
|
|
| 26 weeks | 2.0 | 1.4 | 0 | 31.3 | 31.3 | 20.8 | 20.8 |
|
|
Extended Data Table 3 | Immune responses and vector shedding
| Patient 1 | Patient 2 | Patient 3 | Patient 4 | Patient 5 | |
| Neutralizing | |||||
| antibodies | |||||
| Baseline | <1:5 | <1:5 | <1:5 | <1:5 | <1:5 |
| 6 weeks | 1:1215 | 1:1215 | 1:1215 | 1:1215 | 1:1215 |
| Vector DNA | |||||
| Baseline | Negative § | Negative | Negative | Negative | Negative |
| 7 days | Negative | Negative | Negative | Negative | Negative |
natureportfolio
Reporting Summary
Statistics
Only common tests should be described solely by name; describe more complex techniques in the Methods section.
A full description of the statistical parameters including central tendency (e.g. means) or other basic estimates (e.g. regression coefficient) AND variation (e.g. standard deviation) or associated estimates of uncertainty (e.g. confidence intervals)
Our web collection on statistics for biologists contains articles on many of the points above.
Software and code

Data
All manuscripts must include a data availability statement. This statement should provide the following information, where applicable:
- Accession codes, unique identifiers, or web links for publicly available datasets
- A description of any restrictions on data availability
- For clinical datasets or third party data, please ensure that the statement adheres to our policy
Research involving human participants, their data, or biological material
Patients could access the enrollment information through advertisements posted in the hospital, inquiries during the consultation, and multimedia platforms. Patients were screened and enrolled based on the genotypes, audiometric tests and related inclusion/exclusion criteria at baseline. Written informed consents were obtained from parents or legal guardians of the children before enrollment. Five DFNB9 subjects with biallelic OTOF gene mutations were enrolled at the study site. Full inclusion/exclusion criteria were provided in the manuscript and trial protocol. No self-selection bias and other biases.
Field-specific reporting
Life sciences
For a reference copy of the document with all sections, see nature.com/documents/nr-reporting-summary-flat.pdf
Life sciences study design
| Sample size | Because DFNB9 is a rare disease, the number of DFNB9 patients is limited. After binaural gene therapy, no dose-limiting toxicity and serious adverse event occurred. The patients, who were born entirely deaf, underwent bilateral hearing recovery, with the improvement of speech perception and sound source localization. The efficacy was robust. The sample size of the study was based on enrollment feasibility, and not based on statistical considerations. |
| Data exclusions | No data were excluded from analyses. |
| Replication | We replicated related experiments on a total of 5 patients. AAV1-hOTOF were injected into 5 patients. The primary and secondary endpoints were evaluated by biochemical analyses, audiometric testing, and related questionnaires and tests in 5 patients. Each sample analyzed was a unique sample. The experimental findings were replicated. Tests for speech perception and sound source localization were performed in one patient. |
| Randomization | The trial is non-randomized. Data analysis was performed between before and after gene therapy. |
| Blinding | This trial was a single-arm trial. Blinding is not applicable for this study. |
Behavioural & social sciences study design
| Study description | Briefly describe the study type including whether data are quantitative, qualitative, or mixed-methods (e.g. qualitative cross-sectional, quantitative experimental, mixed-methods case study). |
| Research sample | State the research sample (e.g. Harvard university undergraduates, villagers in rural India) and provide relevant demographic information (e.g. age, sex) and indicate whether the sample is representative. Provide a rationale for the study sample chosen. For studies involving existing datasets, please describe the dataset and source. |
| Sampling strategy | Describe the sampling procedure (e.g. random, snowball, stratified, convenience). Describe the statistical methods that were used to predetermine sample size OR if no sample-size calculation was performed, describe how sample sizes were chosen and provide a rationale for why these sample sizes are sufficient. For qualitative data, please indicate whether data saturation was considered, and what criteria were used to decide that no further sampling was needed. |
| Data collection | Provide details about the data collection procedure, including the instruments or devices used to record the data (e.g. pen and paper, computer, eye tracker, video or audio equipment) whether anyone was present besides the participant(s) and the researcher, and whether the researcher was blind to experimental condition and/or the study hypothesis during data collection. |
| Timing | Indicate the start and stop dates of data collection. If there is a gap between collection periods, state the dates for each sample cohort. |
| Data exclusions | If no data were excluded from the analyses, state so
|
| Non-participation | State how many participants dropped out/declined participation and the reason(s) given OR provide response rate OR state that no participants dropped out/declined participation. |
| Randomization | If participants were not allocated into experimental groups, state so OR describe how participants were allocated to groups, and if allocation was not random, describe how covariates were controlled. |
Ecological, evolutionary & environmental sciences study design
|
Briefly describe the study. For quantitative data include treatment factors and interactions, design structure (e.g. factorial, nested, hierarchical), nature and number of experimental units and replicates. | ||
| Describe the research sample (e.g. a group of tagged Passer domesticus, all Stenocereus thurberi within Organ Pipe Cactus National Monument), and provide a rationale for the sample choice. When relevant, describe the organism taxa, source, sex, age range and any manipulations. State what population the sample is meant to represent when applicable. For studies involving existing datasets, describe the data and its source. | |||
| Sampling strategy | Note the sampling procedure. Describe the statistical methods that were used to predetermine sample size OR if no sample-size calculation was performed, describe how sample sizes were chosen and provide a rationale for why these sample sizes are sufficient. | ||
| Data collection | Describe the data collection procedure, including who recorded the data and how. | ||
| Timing and spatial scale | Indicate the start and stop dates of data collection, noting the frequency and periodicity of sampling and providing a rationale for these choices. If there is a gap between collection periods, state the dates for each sample cohort. Specify the spatial scale from which the data are taken | ||
| Data exclusions | If no data were excluded from the analyses, state so OR if data were excluded, describe the exclusions and the rationale behind them, indicating whether exclusion criteria were pre-established. | ||
| Reproducibility | Describe the measures taken to verify the reproducibility of experimental findings. For each experiment, note whether any attempts to repeat the experiment failed OR state that all attempts to repeat the experiment were successful. | ||
| Randomization | Describe how samples/organisms/participants were allocated into groups. If allocation was not random, describe how covariates were controlled. If this is not relevant to your study, explain why. | ||
| Blinding | Describe the extent of blinding used during data acquisition and analysis. If blinding was not possible, describe why OR explain why blinding was not relevant to your study. | ||
| Field work, collection and transport | |||
| Field conditions | Describe the study conditions for field work, providing relevant parameters (e.g. temperature, rainfall). | ||
| Location | State the location of the sampling or experiment, providing relevant parameters (e.g. latitude and longitude, elevation, water depth). | ||
| Access & import/export | Describe the efforts you have made to access habitats and to collect and import/export your samples in a responsible manner and in compliance with local, national and international laws, noting any permits that were obtained (give the name of the issuing authority, the date of issue, and any identifying information). | ||
| Disturbance | Describe any disturbance caused by the study and how it was minimized. | ||
| Reporting for specific materials, systems and methods | |||
| Materials & experimental systems | Methods | ||
| n/a | Involved in the study | n/a | Involved in the study |
|
|
 |
 |
|
|
|
Eukaryotic cell lines |  |
|
 |
|
 |
|
 |
|
||
|
|
 |
||
 |
|
||
 |
|
||
Antibodies
| Antibodies used | Anti-human CD3 mAb (CD3-2) (MABTECH, Code: 3605-1S); Anti-human IFN-
|
| Validation | ELISpot Pro: Human IFN-
|
Eukaryotic cell lines
| Cell line source(s) | HEK293FT cells (NANJING COBIOER BIOSCIENCES CO., LTD.) |
| Authentication | Authentication for HEK293FT cell line was validated by STR profiling (NANJING COBIOER BIOSCIENCES CO., LTD.). |
| Mycoplasma contamination | Cells were confirmed negative for mycoplasma. |
| Commonly misidentified lines (See ICLAC register) | No commonly misidentified lines were used in this study. |
Palaeontology and Archaeology
| Specimen provenance | Provide provenance information for specimens and describe permits that were obtained for the work (including the name of the issuing authority, the date of issue, and any identifying information). Permits should encompass collection and, where applicable, export. |
| Specimen deposition | Indicate where the specimens have been deposited to permit free access by other researchers. |
| Dating methods | If new dates are provided, describe how they were obtained (e.g. collection, storage, sample pretreatment and measurement), where they were obtained (i.e. lab name), the calibration program and the protocol for quality assurance OR state that no new dates are provided. |
Ethics oversight
Identify the organization(s) that approved or provided guidance on the study protocol, OR state that no ethical approval or guidance was required and explain why not.
Animals and other research organisms
| Laboratory animals | For laboratory animals, report species, strain and age OR state that the study did not involve laboratory animals. |
| Wild animals | Provide details on animals observed in or captured in the field; report species and age where possible. Describe how animals were caught and transported and what happened to captive animals after the study (if killed, explain why and describe method; if released, say where and when) OR state that the study did not involve wild animals. |
| Reporting on sex | Indicate if findings apply to only one sex; describe whether sex was considered in study design, methods used for assigning sex. |
Reporting on sex
Field-collected samples
Ethics oversight
Clinical data
Policy information about clinical studies
Study protocol
Data collection
The full trial protocol was provided in the Supplementary information.
Dual use research of concern
Policy information about dual use research of concern
Hazards
Yes
Experiments of concern
Plants
| Seed stocks | No plant was used in this trial. | ||||
| Novel plant genotypes | No plant was used in this trial. | ||||
| Authentication | No plant was used in this trial. | ||||
| ChIP-seq | |||||
| Data deposition |
|||||
|
For “Initial submission” or “Revised version” documents, provide reviewer access links. For your “Final submission” document, provide a link to the deposited data. | ||||
| Provide a list of all files available in the database submission. | |||||
| Provide a link to an anonymized genome browser session for “Initial submission” and “Revised version” documents only, to enable peer review. Write “no longer applicable” for “Final submission” documents. | |||||
| Methodology | |||||
|
Describe the experimental replicates, specifying number, type and replicate agreement. | ||||
| Describe the sequencing depth for each experiment, providing the total number of reads, uniquely mapped reads, length of reads and whether they were paired- or single-end. | |||||
| Antibodies | Describe the antibodies used for the ChIP-seq experiments; as applicable, provide supplier name, catalog number, clone name, and lot number. | ||||
|
Specify the command line program and parameters used for read mapping and peak calling, including the ChIP, control and index files used. | ||||
| Describe the methods used to ensure data quality in full detail, including how many peaks are at FDR 5% and above 5-fold enrichment. | |||||
| Describe the software used to collect and analyze the ChIP-seq data. For custom code that has been deposited into a community repository, provide accession details. | |||||
|
|||||
| Methodology | |||||
| Sample preparation | Describe the sample preparation, detailing the biological source of the cells and any tissue processing steps used. | ||||
| Instrument | Identify the instrument used for data collection, specifying make and model number. | ||||
| Software | Describe the software used to collect and analyze the flow cytometry data. For custom code that has been deposited into a community repository, provide accession details. | ||||
Cell population abundance
Gating strategy
Magnetic resonance imaging
Experimental design
| Design type | Indicate task or resting state; event-related or block design. |
| Design specifications | Specify the number of blocks, trials or experimental units per session and/or subject, and specify the length of each trial or block (if trials are blocked) and interval between trials. |
| Behavioral performance measures | State number and/or type of variables recorded (e.g. correct button press, response time) and what statistics were used to establish that the subjects were performing the task as expected (e.g. mean, range, and/or standard deviation across subjects). |
Acquisition
Imaging type(s)
Sequence & imaging parameters
Area of acquisition
Specify: functional, structural, diffusion, perfusion.
Specify in Tesla
Specify the pulse sequence type (gradient echo, spin echo, etc.), imaging type (EPI, spiral, etc.), field of view, matrix size, slice thickness, orientation and TE/TR/flip angle.
Preprocessing
| Preprocessing software | Provide detail on software version and revision number and on specific parameters (model/functions, brain extraction, segmentation, smoothing kernel size, etc.). |
| Normalization | If data were normalized/standardized, describe the approach(es): specify linear or non-linear and define image types used for transformation OR indicate that data were not normalized and explain rationale for lack of normalization. |
| Normalization template | Describe the template used for normalization/transformation, specifying subject space or group standardized space (e.g. original Talairach, MNI305, ICBM152) OR indicate that the data were not normalized. |
| Noise and artifact removal | Describe your procedure(s) for artifact and structured noise removal, specifying motion parameters, tissue signals and physiological signals (heart rate, respiration). |
| Volume censoring | Define your software and/or method and criteria for volume censoring, and state the extent of such censoring. |
Statistical modeling & inference
| Model type and settings | Specify type (mass univariate, multivariate, RSA, predictive, etc.) and describe essential details of the model at the first and second levels (e.g. fixed, random or mixed effects; drift or auto-correlation). | ||
| Effect(s) tested | Define precise effect in terms of the task or stimulus conditions instead of psychological concepts and indicate whether ANOVA or factorial designs were used. | ||
| Specify type of analysis: |
|
||
|
Specify voxel-wise or cluster-wise and report all relevant parameters for cluster-wise methods. | ||
| Correction | Describe the type of correction and how it is obtained for multiple comparisons (e.g. FWE, FDR, permutation or Monte Carlo). |
Models & analysis
n/a Involved in the study
Functional and/or effective connectivity
Graph analysis
Multivariate modeling or predictive analysis
Report the measures of dependence used and the model details (e.g. Pearson correlation, partial correlation, mutual information).
Report the dependent variable and connectivity measure, specifying weighted graph or binarized graph, subject- or group-level, and the global and/or node summaries used (e.g. clustering coefficient, efficiency, etc.).
Specify independent variables, features extraction and dimension reduction, model, training and evaluation metrics.
ENT Institute and Otorhinolaryngology Department of Eye & ENT Hospital, Fudan University, Shanghai, China. NHC Key Laboratory of Hearing Medicine, Fudan University, Shanghai, China. Institutes of Biomedical Sciences, Fudan University, Shanghai, China. State Key Laboratory of Medical Neurobiology and MOE Frontiers Center for Brain Science, Fudan University, Shanghai, China. Department of Otorhinolaryngology, the Second Affiliated Hospital, Hengyang Medical School, University of South China, Hengyang, Hunan, China. Shanghai Rehabilitation Institute for the Exceptional Children, Shanghai, China. Shanghai Refreshgene Therapeutics Co. Ltd., Shanghai, China. Department of Otolaryngology—Head and Neck Surgery, Graduate Program in Speech and Hearing Bioscience and Technology and Program in Neuroscience, Harvard Medical School, Boston, MA, USA. Eaton-Peabody Laboratory, Massachusetts Eye and Ear, Boston, MA, USA. These authors contributed equally: Hui Wang, Yuxin Chen, Jun Lv, Xiaoting Cheng, Qi Cao. - Transcript ID: NM_001287489.2. ACMG, the American College of Medical Genetics and Genomics;
, pathogenic; , likely pathogenic.
