DOI: https://doi.org/10.1186/s13054-024-04799-1
PMID: https://pubmed.ncbi.nlm.nih.gov/38229072
تاريخ النشر: 2024-01-16
العلاقة بين مسار اليوريا وجرعة البروتين لدى البالغين المصابين بأمراض حرجة: تحليل استكشافي ثانوي لتجربة بروتين الجهد (RE-EFFORT)
الملخص
الخلفية: لم تؤدِ تقديم جرعات أعلى من البروتين للمرضى المصابين بأمراض حرجة والذين يتنفسون ميكانيكياً إلى تحسين نتائج المرضى وقد تكون قد تسببت في ضرر. يمكن أن توفر قياسات اليوريا الطولية معلومات إضافية حول تأثير العلاج لجرعات البروتين الأعلى. افترضنا أن القيم الأعلى لليوريا مع مرور الوقت قد تفسر التأثيرات الضارة المحتملة للعلاج بجرعات أعلى من البروتين. الطرق: أجرينا إعادة تحليل لتجربة عشوائية محكومة لجرعات أعلى من البروتين في الأمراض الحرجة (EFFORT Protein). استخدمنا نماذج بايزيان المشتركة لتقدير قوة العلاقة بين اليوريا والبقاء على قيد الحياة لمدة 30 يومًا وفهم تأثير العلاج لجرعات البروتين الأعلى. النتائج: من بين 1301 مريضًا تم تضمينهم في EFFORT Protein، تم تضمين 1277 في هذا التحليل. كانت هناك 344 حالة وفاة بعد 30 يومًا من العشوائية. بحلول اليوم السادس، كانت اليوريا المتوسطة
المقدمة
البروتين الذي لا يتم امتصاصه بواسطة الأنسجة يتم تحليله إلى أحماض أمينية ويتم استقلابها لاحقًا إلى أمونيا ومن ثم إلى يوريا. الخطوة المحددة هي كربامويل فوسفات سينثيتاز 1، والتي تعتمد على ATP وقد تكون محدودة من خلال تغيير استخدام الركيزة [13، 14]. بينما تعتبر الأمونيا سامة، فإن قياسها غير موصى به في الغالبية العظمى من الإعدادات السريرية [15]. تظهر مستويات الأمونيا في المصل مزيدًا من التباين من معالجة العينات ومعالجتها، مما يجعل التقييمات متعددة المراكز غير موثوقة [16]. تعمل اليوريا كتوقيع بيولوجي لوظيفة دورة اليوريا والتخلص من الأمونيا، ويمكن قياسها على نطاق واسع، على سبيل المثال، في تجربة شملت 85 مركزًا عشوّت 1301 مريضًا. هناك كل من الأساس البيولوجي والبيانات الملاحظة
لإنتاج اليوريا نتيجة لنشاط دورة اليوريا المتغيرة أو الزائدة في فشل متعدد الأعضاء [17].
الطرق
تصميم الدراسة
تجربة بروتين EFFORT
الموافقات
المرضى
الإجراءات والنتائج
- العمر؛ يرتبط العمر المتزايد بزيادة شدة المرض وزيادة محتملة في عدم القدرة على معالجة تحميل البروتين الزائد [19].
- شدة المرض (درجة SOFA عند الأساس)؛ قد تؤثر زيادة شدة المرض على القدرة على معالجة البروتين الزائد، مما يجعل المرضى الأكثر شدة يعانون من الآثار السلبية للأحماض الأمينية المعالجة بشكل غير صحيح [17].
- إصابة الكلى الحادة (عند التسجيل)؛ قد تؤثر وظيفة الكلى ودعم الكلى على التأثير الأيضي لجرعات البروتين العالية. وقد اقترحت بعض البيانات الملاحظة وجود ضرر من توصيل الأحماض الأمينية في المرضى الذين يعانون من AKI. [20-22]
- علاج استبدال الكلى (RRT؛ تم إدارته في يوم التسجيل). هناك زيادة في خطر الوفاة لدى المرضى الذين يتلقون RRT بينما تؤثر إزالة اليوريا خارج الجسم على مسار اليوريا الطولي [17].
التحليل الإحصائي
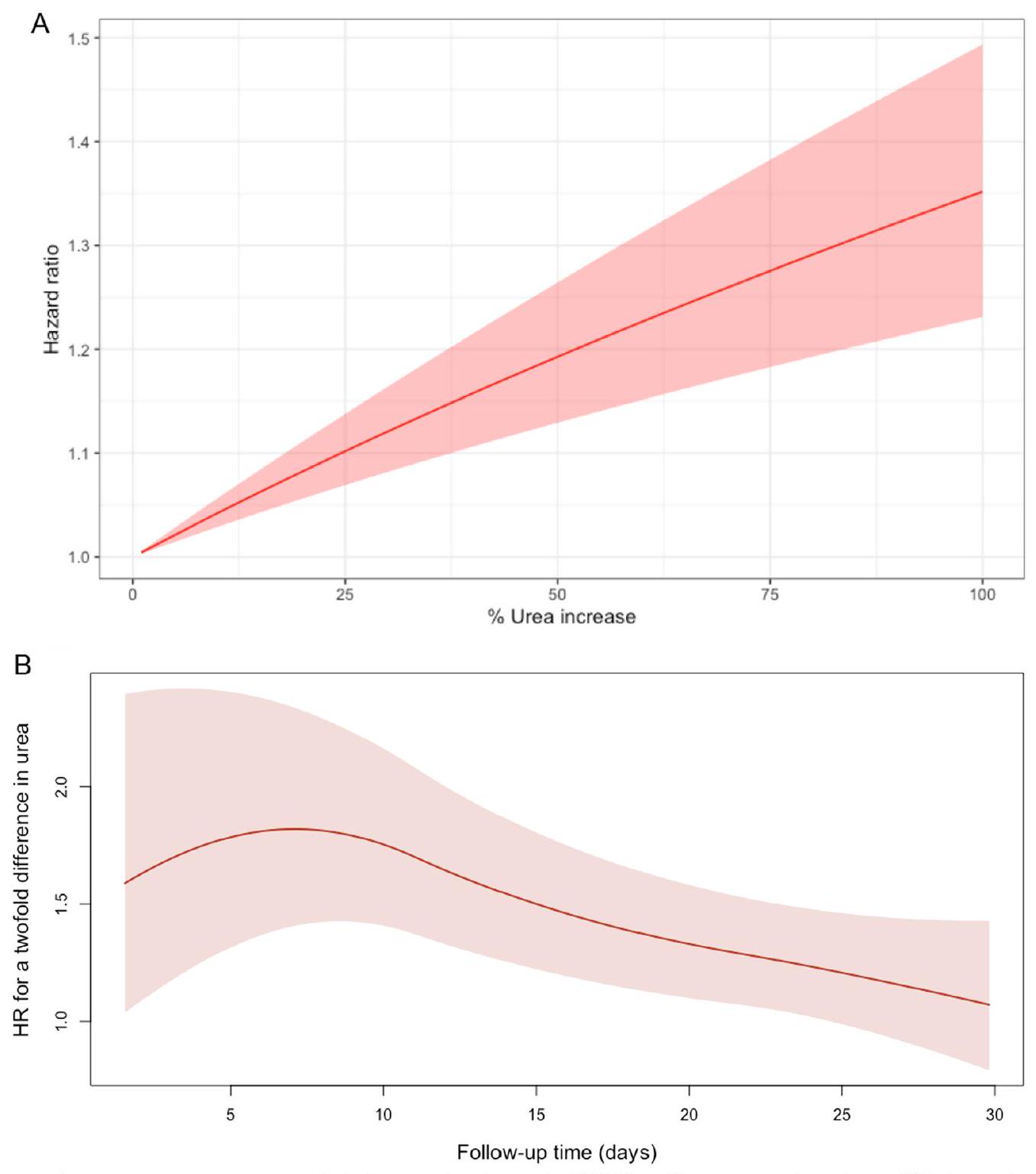
الخصائص، تم تصنيف المرضى حسب مسار اليوريا باستخدام التجميع الطولي.
تحليل النتيجة الرئيسية
يوريا متزايدة. لذلك، استكشفنا ما إذا كان خطر الوفاة في نقطة الوقت
تحليل الحساسية
ثانيًا، لاختبار الارتباط بين تغيير اليوريا وجرعة البروتين والوفيات بشكل أكبر، استخدمنا نموذجًا مشتركًا متعدد المتغيرات لتضمين درجة POD اليومية. اختبر هذا النموذج المشترك الارتباط بين درجة POD الطولية واليوريا مع معدل الوفيات خلال 30 يومًا. قمنا بإنشاء DAG لتوضيح هيكل النموذج المتعدد المتغيرات، الملف الإضافي 1: الشكل S3. في هذا التحليل المتعدد المتغيرات، توقعنا أن يبقى الارتباط بين اليوريا ومعدل الوفيات خلال 30 يومًا ولكن يكون أقل في الحجم مقارنة بالنموذج المشترك أحادي المتغير. وهذا من شأنه أن يشير إلى أن العمليات البيولوجية التي تربط اليوريا وPOD والنتيجة مترابطة، ولكن اليوريا ستستمر في تقديم معلومات إضافية حول خطر الوفاة [24].
البيانات المفقودة
النتائج
تقدير العلاقة بين اليوريميا وخطر الوفاة
|
|
منخفض
|
متوسط
|
عالي
|
جميع المرضى (
|
|
| العمر، سنوات | 1277 | ٣٥/٤٩/٦١ | 50/61/71 | ٥٤/٦٣/٧٠ | ٤٦/٥٩/٦٩ |
| أنثى | 1276 | 44% 175/398 | 40% 226/568 | ٣٥٪ ١٠٨/٣١٠ | 40% 509/1276 |
| تم توزيعهم عشوائيًا على بروتين عالي | 1277 | ٤٥٪ ١٧٨/٣٩٨ | ٤٧٪ ٢٦٩/٥٦٨ | 60% 186/311 | 50% 633/1277 |
| فئة القبول: | 1277 | 75% 297/398 | 86% 491/568 | 91% 284/311 | 84% 1072/1277 |
| طبي | |||||
| جراحة اختيارية | 5% 20/398 | 3% 19/568 | 1% 4/311 | 3% 43/1277 | |
| حالة طبية طارئة | 20% 81/398 | 10% 58/568 | 7% 23/311 | ١٣٪ ١٦٢/١٢٧٧ | |
| إيجابي COVID-19 عند القبول | 1277 | 2% 8/398 | 10% 55/568 | 6% 20/311 | 6% 83/1277 |
| مؤشر كتلة الجسم | 1277 | ٢١.٦/٢٤.٨/٢٩.٨ | ٢٣.٥/٢٦.٩/٣٤.٢ | ٢٢.١/٢٦.٤/٣٢.٣ | 22.5/26.0/32.2 |
| مؤشر تشارلسون للاعتلال المشترك | 1277 | 0/0/1 | 0/0/1 | 0/1/2 | 0/0/1 |
| درجة SOFA الأساسية | 1277 | 5/8/10 | 6/9/11 | 8/10/13 | 6/9/11 |
| درجة أباش II | 1209 | 13.2/18.0/22.0 | 15.0/21.0/26.0 | 20.0/25.0/29.0 | 15/21/26 |
| درجة mNUTRIC | 1209 | ٢/٤/٥ | 3/5/6 | ٤/٦/٧ | 3/5/6 |
| هشاشة | 1173 | 2/3/4 | 2/3/4 | 2/3/5 | 2/3/4 |
| درجة SARC-F | 1145 | 0/1/5 | 0/1/4 | 0/2/5 | 0/1/5 |
| علاج استبدال الكلى في يوم التوزيع العشوائي | 1277 | 3% 13/398 | 12% 70/568 | 43% 133/311 | 17% 216/1277 |
| إصابة حادة في الكلى عند وقت التوزيع العشوائي*: | 1277 | ||||
| نعم | 9% 35/398 | 22% 124/568 | ٤٧٪ ١٤٦/٣١١ | 24% 305/1277 | |
| المرحلة 1 | ٤٦٪ ١٦/٣٥ | 48% 60/124 | 27% 40/146 | ٣٨٪ ١١٦/٣٠٥ | |
| المرحلة 2 | ٣٧٪ ١٣/٣٥ | 25% 31/124 | 18% 27/146 | 23% 71/305 | |
| المرحلة 3 | 17% 6/35 | 27% 33/124 | 54% 79/146 | ٣٩٪ ١١٨/٣٠٥ | |
| مرض الكلى المزمن المعتدل أو الشديد
|
1277 | 2% 7/398 | 6% 35/568 | 23% 70/311 | 9% 112/1277 |
| مدة الإقامة في وحدة العناية المركزة | 1271 | 5.2/ 9.4/17.7 | 5.5/10.2/20.2 | 4.9/9.1/18.1 | 5.2/9.8/18.5 |
| مدة الإقامة في المستشفى | 1269 | ١١.٠/٢١.٠/٣٨.٧٣ | 9.7/19.0/35.9 | 7.3/17.1/38.8 | 9.5/19.1/38.0 |
| وفيات خلال 30 يومًا | 1277 | 0.17 67/398 | 0.27 153/568 | 0.40 124/311 | 0.27 344/1277 |
| وفيات خلال 60 يومًا | 1277 | 0.22 88/398 | 0.33 185/568 | 0.47 147/311 | 0.33 420/1277 |
تشير إصابة الكلى الحادة إلى المرضى الذين استوفوا معايير KDIGO: المرحلة 1 هي على الأقل
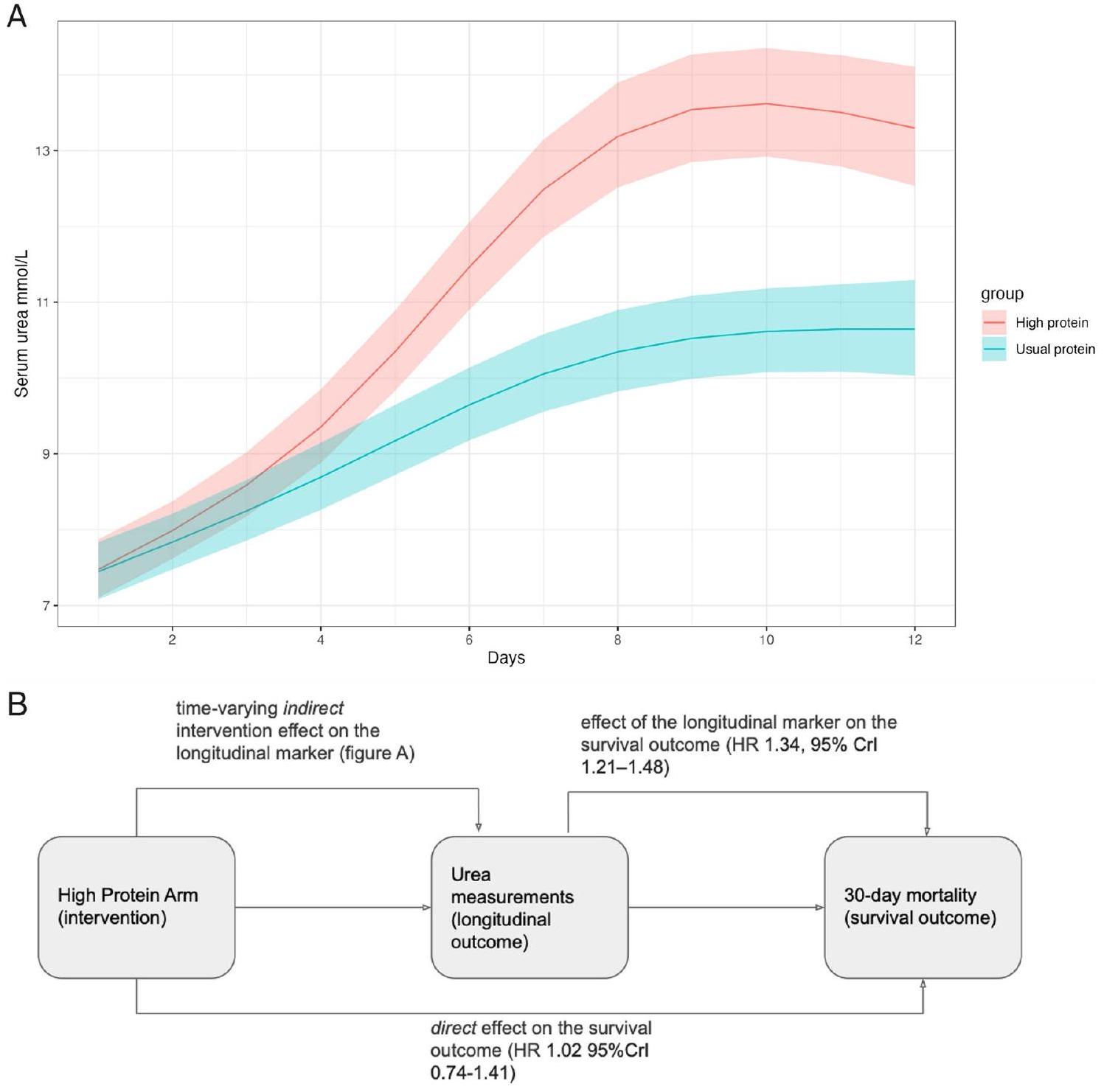
يظهر تأثير التدخل علاقة قوية بين البروتين العالي وزيادة اليوريا مع مرور الوقت. يتم دمج هذه العلاقة مع تقدير التأثير للعلامة الطولية على نتيجة البقاء لتلخيص التأثير غير المباشر للتدخل على نتيجة البقاء، من خلال اليوريا. بالنسبة لزيادة بنسبة 1% في اليوريا المتغيرة مع الوقت، هناك
امتدادات نموذج المفصل الأساسي
كانت الوفيات مستمرة طوال فترة المتابعة التي استمرت 30 يومًا (الشكل 2B). ثانيًا، كانت المسارات المتزايدة والقيم التراكمية الأعلى لليوريا مرتبطة بزيادة خطر الوفاة خلال 30 يومًا (الملف الإضافي 1: الجدول S2). حيث أن مضاعفة معدل ارتفاع اليوريا لدى المريض من اليوم السابق، تؤدي إلى زيادة مقدرة في خطر الوفاة (HR 3.42، 95% CrI 1.72-6.94). وبالمثل، قمنا بقياس تأثير تراكمي للتعرض لمستويات أعلى من اليوريا (المساحة تحت المنحنى)، الملف الإضافي 1: الجدول S2. كان هناك زيادة في خطر الوفاة (HR 1.42، 95% CrI 1.22-1.65) لمضاعفة المساحة تحت المنحنى لمسار اليوريا.
تحليلات الحساسية
| نموذج مشترك لتقدير معدل اليوريا المتغير مع الزمن (95% فترة موثوقية) | نموذج مشترك لمستويات اليوريا المتغيرة مع الزمن وتقدير معدل الخطر لخلل الأعضاء المستمر (فترة الثقة 95%) | |
| المتغيرات الأساسية | ||
| عمر | 1.29 (1.15-1.45) | 1.30 (1.15-1.49) |
| أريكة | 1.09 (0.97-1.23) | 1.07 (0.96-1.20) |
| العشوائية | 1.02 (0.74-1.41) | 1.03 (0.76-1.41) |
| RRT | 1.06 (0.73-1.57) | 1.10 (0.78-1.56) |
| أكي | 1.24 (0.89-1.69) | 1.25 (0.91-1.69) |
| المتغيرات المتغيرة مع الزمن | ||
| يوريا | 1.34 (1.21-1.48) | 1.30 (1.18-1.43) |
| بود | – | 1.32 (1.20-1.45) |
في نموذج مشترك تم تعديله للمتغيرات الأساسية المحددة مسبقًا في نموذج وفيات البروتين EFFORT الأصلي، ظل الارتفاع في اليوريا المتغيرة مع الزمن مرتبطًا بوفيات 30 يومًا (HR 1.31، 95% CrI 1.19-1.47، تم تعديله لـ؛ العمر، درجة APACHE II، درجة الضعف السريرية، الساركوبينيا، نوع القبول، والمنطقة الجغرافية، الملف الإضافي 1: الجدول S3). في تحليل لاحق، تم تقدير أن اليوريا المتغيرة مع الزمن كانت مرتبطة بوفيات 30 يومًا في نموذج مشترك يشمل CKD الأساسية في المتغيرات المعدلة (HR 1.34، 95% CrI 1.21-1.51، تم تعديله للعمر، درجة SOFA الأساسية، RRT في يوم التوزيع العشوائي، وجود AKI، مرض الكلى المزمن، وتوزيع جرعة البروتين عشوائيًا، الملف الإضافي 1: الجدول S3).
المناقشة
اليوراجينيس
يوحي بأن هذا قد تم أخذه في الاعتبار. في الأعمال السابقة، أظهرنا نحن وآخرون العلاقة بين الوفيات، والمراضة، والأمراض الحرجة المستمرة مع نسبة اليوريا إلى الكرياتينين [21]. زادت نسبة اليوريا إلى الكرياتينين في المرضى الذين تم توزيعهم عشوائيًا إلى بروتين أعلى مما يشير إلى زيادة في الكاتابوليزم. ومع ذلك، لم يتم تقييم فقدان توليد الكرياتينين المرتبط بهدر العضلات في هذا التحليل، حيث كان التركيز على العلاقة الأقرب بكثير بين جرعة البروتين واستقلاب اليوريا.
الآثار السريرية والاتجاهات المستقبلية
نقاط القوة والقيود
يشير إلى أنه تم معالجة التداخل الأساسي المتبقي والتداخل المتغير مع الوقت وأن الاعتماد المتبادل المشترك بين قياسات اليوريا الطولية ومعدل الوفيات خلال 30 يومًا يتم شرحه بواسطة تأثيرات عشوائية كامنة خاصة بالموضوع. إن استمرار العلاقة بين ارتفاع اليوريا والوفيات في النماذج المشتركة مع مجموعة متنوعة من هياكل الارتباط وفي النماذج التي تتضمن خلل الأعضاء المتغير مع الوقت، أو حالة الفشل الكلوي الحاد بشكل خاص، يضيف دعمًا لعلاقة سببية محتملة. في تحليلات الحساسية، تمكنا من اختبار العلاقة باستخدام مجموعة التعديل الأصلية لتجربة EFFORT Protein لتوفير التناسق مع العوامل المربكة ذات الصلة سريريًا التي تم اختيارها مسبقًا. أخيرًا، عندما أزلنا أي تأثير للفشل الكلوي الحاد الأساسي، وهي مجموعة فرعية مهمة بها إشارة للضرر في تجربة EFFORT Protein، ظلت زيادات اليوريا مرتبطة بالوفيات. تضيف هذه التحليلات دليلًا مهمًا لدعم اليوريا كبديل في المسار السببي لتأثير البروتينات على الوفيات.
مستوى المريض الفردي مع اختلاف المخاطر الأساسية لا يزال غير معروف.
الاستنتاجات
معلومات إضافية
مساهمات المؤلفين
التمويل
توفر البيانات والمواد
الإعلانات
موافقة الأخلاقيات والموافقة على المشاركة
المصالح المتنافسة
تفاصيل المؤلف
تم النشر على الإنترنت: 16 يناير 2024
References
- Compher C, Bingham AL, McCall M, et al. Guidelines for the provision of nutrition support therapy in the adult critically ill patient: The American Society for Parenteral and Enteral Nutrition. J Parenter Enter Nutr. 2022;46:12-41. https://doi.org/10.1002/jpen.2267.
- Patel JJ, Rice T, Compher C, Heyland DK. Do we have clinical equipoise (or uncertainty) about how much protein to provide to critically III patients? Nutr Clin Pract. 2020;35:499-505. https://doi.org/10.1002/ncp.10320.
- Heyland DK, Patel J, Compher C, et al. The effect of higher protein dosing in critically ill patients with high nutritional risk (EFFORT Protein): an international, multicentre, pragmatic, registry-based randomised trial. The Lancet. 2023;401:568-76. https://doi.org/10.1016/S0140-6736(22) 02469-2.
- Puthucheary ZA, Rawal J, McPhail M, et al. Acute skeletal muscle wasting in critical illness. JAMA. 2013;310:1591-600. https://doi.org/10.1001/jama. 2013.278481.
- van Oudenhoven FM, Swinkels SHN, Hartmann T, Rizopoulos D. Modeling the underlying biological processes in Alzheimer’s disease using a multivariate competing risk joint model. Stat Med. 2022;41:3421-33. https:// doi.org/10.1002/sim.9425.
- Reddy K, Sinha P, O’Kane CM, et al. Subphenotypes in critical care: translation into clinical practice. Lancet Respir Med. 2020;8:631-43. https://doi. org/10.1016/S2213-2600(20)30124-7.
- Harhay MO, Casey JD, Clement M, et al. Contemporary strategies to improve clinical trial design for critical care research: insights from the First Critical Care Clinical Trialists Workshop. Intensive Care Med. 2020;46:930-42. https://doi.org/10.1007/s00134-020-05934-6.
- van Eijk RPA, Roes KCB, van den Berg LH, Lu Y. Joint modeling of endpoints can be used to answer various research questions in randomized clinical trials. J Clin Epidemiol. 2022;147:32-9. https://doi.org/10.1016/j. jclinepi.2022.03.009.
- van Oudenhoven FM, Swinkels SHN, Ibrahim JG, Rizopoulos D. A marginal estimate for the overall treatment effect on a survival outcome within the joint modeling framework. Stat Med. 2020;39:4120-32. https://doi.org/10. 1002/sim. 8713.
- Heyland D, Muscedere J, Wischmeyer PE, et al. A randomized trial of glutamine and antioxidants in critically ill patients. N Engl J Med. 2013;368:1489-97. https://doi.org/10.1056/NEJMoa1212722.
- Heyland DK, Wibbenmeyer L, Pollack JA, et al. A randomized trial of enteral glutamine for treatment of burn injuries. N Engl J Med. 2022;387:1001-10. https://doi.org/10.1056/NEJMoa2203364.
- Chapple LS, Kouw IWK, Summers MJ, et al. Muscle protein synthesis after protein administration in critical illness. Am J Respir Crit Care Med. 2022;206:740-9. https://doi.org/10.1164/rccm.202112-2780OC.
- Taguchi A, Fahrmann JF, Hanash SM. A promising CPS1 inhibitor keeping ammonia from Fueling cancer. Cell Chem Biol. 2020;27:253-4. https://doi. org/10.1016/j.chembiol.2020.03.002.
- Puthucheary ZA, Astin R, Mcphail MJW, et al. Metabolic phenotype of skeletal muscle in early critical illness. Thorax. 2018;73:926-35. https://doi. org/10.1136/thoraxjnl-2017-211073.
- Vilstrup H, Amodio P, Bajaj J, et al. Hepatic encephalopathy in chronic liver disease: 2014 practice guideline by the american association for the study of liver diseases and the European association for the study of the
liver. Hepatol Baltim Md. 2014;60:715-35. https://doi.org/10.1002/hep. 27210. - Bajaj JS, Bloom PP, Chung RT, et al. Variability and lability of ammonia levels in healthy volunteers and patients with cirrhosis: implications for trial design and clinical practice. Am J Gastroenterol. 2020;115:783-5. https:// doi.org/10.14309/ajg. 0000000000000384.
- Haines RW, Fowler AJ, Wan YI, et al. Catabolism in critical illness: a reanalysis of the reducing deaths due to oxidative stress (REDOXS) trial*. Crit Care Med. 2022;50:1072-82. https://doi.org/10.1097/CCM. 0000000000 005499.
- Heyland DK, Patel J, Bear D, et al. The effect of higher protein dosing in critically III patients: a multicenter registry-based randomized trial: the EFFORT trial. J Parenter Enter Nutr. 2019;43:326-34. https://doi.org/10. 1002/jpen. 1449.
- Breen L, Phillips SM. Skeletal muscle protein metabolism in the elderly: interventions to counteract the “anabolic resistance” of ageing. Nutr Metab. 2011;8:68. https://doi.org/10.1186/1743-7075-8-68.
- Zhu R, Allingstrup MJ, Perner A, et al. The effect of IV amino acid supplementation on mortality in ICU patients may be dependent on kidney function: post hoc subgroup analyses of a multicenter randomized trial. Crit Care Med. 2018;46:1293-301. https://doi.org/10.1097/CCM. 00000 00000003221.
- Haines RW, Zolfaghari P, Wan Y, et al. Elevated urea-to-creatinine ratio provides a biochemical signature of muscle catabolism and persistent critical illness after major trauma. Intensive Care Med. 2019;45:1718-31. https://doi.org/10.1007/s00134-019-05760-5.
- Heyland DK, Elke G, Cook D, et al. Glutamine and antioxidants in the critically ill patient: a post hoc analysis of a large-scale randomized trial. JPEN J Parenter Enteral Nutr. 2015;39:401-9. https://doi.org/10.1177/01486 07114529994.
- Urner
, Jüni P, Hansen B, et al. Time-varying intensity of mechanical ventilation and mortality in patients with acute respiratory failure: a registry-based, prospective cohort study. Lancet Respir Med. 2020;8:90513. https://doi.org/10.1016/S2213-2600(20)30325-8. - Rizopoulos D, Ghosh P. A Bayesian semiparametric multivariate joint model for multiple longitudinal outcomes and a time-to-event. Stat Med. 2011;30:1366-80. https://doi.org/10.1002/sim. 4205.
- Ibrahim JG, Chu H, Chen LM. Basic concepts and methods for joint models of longitudinal and survival data. J Clin Oncol. 2010;28:2796-801. https://doi.org/10.1200/JCO.2009.25.0654.
- Harrell FE. Regression Modeling Strategies: With Applications to Linear Models, Logistic Regression, and Survival Analysis. New York, NY: Springer; 2001.
- Group K. KDIGO clinical practice guideline for acute kidney injury. Kidney Int Suppl. 2012;2:1.
- Joint Models for Longitudinal and Time-to-Event Data: With Applications in R. In: Routledge CRC Press. https://www.routledge.com/Joint-Mod-els-for-Longitudinal-and-Time-to-Event-Data-With-Applications/Rizop oulos/p/book/9781439872864. Accessed 31 Jul 2022
- Rizopoulos D (2022) JMbayes2: Extended Joint Models for Longitudinal and Time-to-Event Data
- Gunst J, Casaer MP, Preiser J-C, et al. Toward nutrition improving outcome of critically ill patients: How to interpret recent feeding RCTs? Crit Care. 2023;27:43. https://doi.org/10.1186/s13054-023-04317-9.
- Hermans G, Casaer MP, Clerckx B, et al. Effect of tolerating macronutrient deficit on the development of intensive-care unit acquired weakness: a subanalysis of the EPaNIC trial. Lancet Respir Med. 2013;1:621-9. https:// doi.org/10.1016/S2213-2600(13)70183-8.
- Mansournia MA, Etminan M, Danaei G, et al. Handling time varying confounding in observational research. BMJ. 2017;359: j4587. https://doi.org/ 10.1136/bmj.j4587.
- Vanhorebeek I, Latronico N, Van den Berghe G. ICU-acquired weakness. Intensive Care Med. 2020;46:637-53. https://doi.org/10.1007/ s00134-020-05944-4.
ملاحظة الناشر
المؤلف المشترك الكبير: دارين ك. هيلاند وزودين باثوتشاري.
*المراسلة:
رايان و. هاينز
r.haines@qmul.ac.ukقائمة كاملة بمعلومات المؤلف متاحة في نهاية المقال
DOI: https://doi.org/10.1186/s13054-024-04799-1
PMID: https://pubmed.ncbi.nlm.nih.gov/38229072
Publication Date: 2024-01-16
Association between urea trajectory and protein dose in critically ill adults: a secondary exploratory analysis of the effort protein trial (RE-EFFORT)
Abstract
Background Delivering higher doses of protein to mechanically ventilated critically ill patients did not improve patient outcomes and may have caused harm. Longitudinal urea measurements could provide additional information about the treatment effect of higher protein doses. We hypothesised that higher urea values over time could explain the potential harmful treatment effects of higher doses of protein. Methods We conducted a reanalysis of a randomised controlled trial of higher protein doses in critical illness (EFFORT Protein). We applied Bayesian joint models to estimate the strength of association of urea with 30-day survival and understand the treatment effect of higher protein doses. Results Of the 1301 patients included in EFFORT Protein, 1277 were included in this analysis. There were 344 deaths at 30 days post-randomisation. By day 6, median urea was
Introduction
Protein not taken up by tissues are degraded to amino acids and further metabolised to ammonia and thereafter into urea. The rate limiting step is carbamoyl phosphate synthetase 1 , which is ATP dependent and may therefore be limited by altered substrate utilisation [13, 14]. While ammonia is toxic, its measurement is not recommended in the majority of clinical settings [15]. Further serum ammonia levels show variability from sample handling and processing, making multicentre evaluations unreliable [16]. Urea acts as a biological signature of urea cycle function and ammonia disposal, and can be measured at scale, e.g. in an 85 centre trial randomising 1301 patients. There is both biological rationale and observational data
for ureagenesis as a result of altered or excess urea cycle activity in multi-organ failure [17].
Methods
Study design
The EFFORT protein trial
Approvals
Patients
Procedures and outcomes
- Age; increasing age is associated with increased illness severity and potential increase in inability to process excess protein load [19].
- Illness severity (SOFA score at baseline); increased severity of illness may affect the capability to process excess protein, with more severely ill patients then experiencing the negative effects of mal-processed amino acids [17].
- Acute kidney injury (at enrolment); kidney function and kidney support may affect the metabolic impact of higher protein doses. Some observational data have suggested harm from amino acid delivery in patients with AKI. [20-22]
- Renal replacement therapy (RRT; administered on the day of enrolment). There is an increased risk of mortality in patients receiving RRT while extracorporeal clearance of urea alters longitudinal urea trajectory [17].
Statistical analysis
characteristics, patients were stratified by urea trajectory using the longitudinal clustering.
Analysis of primary outcome
an increasing urea. Therefore, we explored whether the hazard of death at time point
Sensitivity analysis
Secondly, to further test the association of urea change with protein dose and mortality, we used a multivariate joint model to include a daily POD score. This joint model tested the association of longitudinal POD score and urea with 30-day mortality. We constructed a DAG to elucidate the structure of the multivariate model, Additional file 1: Fig S3. In this multivariate analysis, we expected association of urea with 30-day mortality to remain but be smaller in magnitude than in the univariate joint model. This would suggest that the biological processes linking urea, POD, and outcome are interrelated, but that urea will continue to provide additional information on risk of death [24].
Missing data
Results
Estimation of association between uraemia and risk of death
|
|
Low (
|
Medium (
|
High (
|
All patients (
|
|
| Age, years | 1277 | 35/49/61 | 50/61/71 | 54/63/70 | 46/59/69 |
| Female | 1276 | 44% 175/398 | 40% 226/568 | 35% 108/310 | 40% 509/1276 |
| Randomised to high protein | 1277 | 45% 178/398 | 47% 269/568 | 60% 186/311 | 50% 633/1277 |
| Admission category: | 1277 | 75% 297/398 | 86% 491/568 | 91% 284/311 | 84% 1072/1277 |
| Medical | |||||
| Surgical Elective | 5% 20/398 | 3% 19/568 | 1% 4/311 | 3% 43/1277 | |
| Surgical Emergency | 20% 81/398 | 10% 58/568 | 7% 23/311 | 13% 162/1277 | |
| COVID-19 positive on admission | 1277 | 2% 8/398 | 10% 55/568 | 6% 20/311 | 6% 83/1277 |
| BMI | 1277 | 21.6/24.8/29.8 | 23.5/26.9/34.2 | 22.1/26.4/32.3 | 22.5/26.0/32.2 |
| Charlson Comorbidity Index | 1277 | 0/0/1 | 0/0/1 | 0/1/2 | 0/0/1 |
| Baseline SOFA score | 1277 | 5/8/10 | 6/9/11 | 8/10/13 | 6/9/11 |
| APACHE II score | 1209 | 13.2/18.0/22.0 | 15.0/21.0/26.0 | 20.0/25.0/29.0 | 15/21/26 |
| mNUTRIC score | 1209 | 2/4/5 | 3/5/6 | 4/6/7 | 3/5/6 |
| Frailty | 1173 | 2/3/4 | 2/3/4 | 2/3/5 | 2/3/4 |
| SARC-F score | 1145 | 0/1/5 | 0/1/4 | 0/2/5 | 0/1/5 |
| Renal replacement therapy on randomisation day | 1277 | 3% 13/398 | 12% 70/568 | 43% 133/311 | 17% 216/1277 |
| Acute kidney injury at time of randomisation*: | 1277 | ||||
| Yes | 9% 35/398 | 22% 124/568 | 47% 146/311 | 24% 305/1277 | |
| Stage 1 | 46% 16/35 | 48% 60/124 | 27% 40/146 | 38% 116/305 | |
| Stage 2 | 37% 13/35 | 25% 31/124 | 18% 27/146 | 23% 71/305 | |
| Stage 3 | 17% 6/35 | 27% 33/124 | 54% 79/146 | 39% 118/305 | |
| Moderate or severe chronic renal disease
|
1277 | 2% 7/398 | 6% 35/568 | 23% 70/311 | 9% 112/1277 |
| ICU length of stay | 1271 | 5.2/ 9.4/17.7 | 5.5/10.2/20.2 | 4.9/9.1/18.1 | 5.2/9.8/18.5 |
| Hospital length of stay | 1269 | 11.0/21.0/38.73 | 9.7/19.0/35.9 | 7.3/17.1/38.8 | 9.5/19.1/38.0 |
| 30-day mortality | 1277 | 0.17 67/398 | 0.27 153/568 | 0.40 124/311 | 0.27 344/1277 |
| 60-day mortality | 1277 | 0.22 88/398 | 0.33 185/568 | 0.47 147/311 | 0.33 420/1277 |
*Acute kidney injury refers to patients who met the criteria of KDIGO: stage 1 is at least
intervention effect shows a strong relationship between high protein and increase in urea over time. This association is combined with the effect estimate of the longitudinal marker on the survival outcome to summarise the indirect effect of the intervention on the survival outcome, through urea. For a 1% increase in time-varying urea there is a
Extensions of the primary joint model
mortality was persistent across the entire duration of 30-day follow-up (Fig. 2B). Secondly, increasing trajectories and higher cumulative values of urea were associated with higher risk of 30-day mortality (Additional file 1: Table S2). Whereby a doubling of the rate of rise of a patient’s urea from the previous day, results in an estimated increase in the hazard of death (HR 3.42, 95% CrI 1.72-6.94). Similarly, we measured a cumulative effect of exposure to higher urea levels (area under the curve), Additional file 1: Table S2. There was an increased risk of death (HR 1.42, 95% CrI 1.22-1.65) for a doubling of the area under the curve of the urea trajectory.

Sensitivity analyses
| Joint model of time-varying urea HR estimate (95% Crl) | Joint model of timevarying urea and persistent organ dysfunction HR estimate (95% CrI) | |
| Baseline variables | ||
| Age | 1.29 (1.15-1.45) | 1.30 (1.15-1.49) |
| SOFA | 1.09 (0.97-1.23) | 1.07 (0.96-1.20) |
| Randomisation | 1.02 (0.74-1.41) | 1.03 (0.76-1.41) |
| RRT | 1.06 (0.73-1.57) | 1.10 (0.78-1.56) |
| AKI | 1.24 (0.89-1.69) | 1.25 (0.91-1.69) |
| Time-varying variables | ||
| Urea | 1.34 (1.21-1.48) | 1.30 (1.18-1.43) |
| POD | – | 1.32 (1.20-1.45) |
In a joint model adjusted for baseline covariates prespecified in the original EFFORT Protein mortality model, an increase in time-varying urea remained associated with 30 -day mortality (HR 1.31, 95% CrI 1.19-1.47, adjusted for; age, APACHE II score, clinical frailty score, sarcopenia, admission type, and geographic region, Additional file 1: Table S3). In a post hoc analysis, timevarying urea was estimated to be associated with 30-day mortality in a joint model including baseline CKD in the adjusted covariates (HR 1.34, 95% CrI 1.21-1.51, adjusted for age, baseline SOFA score, RRT on the day of randomisation, presence of AKI, chronic kidney disease, and protein dose randomisation, Additional file 1: Table S3).
Discussion
Ureagenesis

dysfunction implies that this may have been accounted for. In previous work, ourselves and others have demonstrated the relationship between mortality, morbidity, and persistent critical illness with the urea-to-creatinine ratio [21]. Urea-to-creatinine ratio increased in patients randomised to higher protein suggesting an increase in catabolism. However, loss of creatinine generation related to muscle wasting was not assessed in this reanalysis, as the focus was on the much closer relationship between protein dose and urea metabolism.
Clinical implications and future directions
Strengths and limitations
assumption suggests residual baseline and time-varying confounding has been addressed and the shared interdependencies between the longitudinal urea measurements and 30-day mortality are explained by latent, subject-specific random effects [23]. The persistence of the association between urea rise and mortality in joint models with a variety of association structures and in models incorporating time-varying organ dysfunction, or specifically AKI status, adds support to a putative causal relationship. In sensitivity analyses, we were able to test the association using the original EFFORT Protein adjustment set to provide consistency with preselected, clinically relevant confounders. Finally, when we removed any effect of baseline AKI, an important subgroup with a signal for harm in the EFFORT Protein, urea increases remained associated with mortality. These analyses add important evidence to support urea as a surrogate on the causal pathway in proteins’ effect on mortality [7].
an individual patient level with differing baseline risk remains unknown.
Conclusions
Supplementary Information
Author contributions
Funding
Availability of data and materials
Declarations
Ethics approval and consent to participate
Competing interest
Author details
Published online: 16 January 2024
References
- Compher C, Bingham AL, McCall M, et al. Guidelines for the provision of nutrition support therapy in the adult critically ill patient: The American Society for Parenteral and Enteral Nutrition. J Parenter Enter Nutr. 2022;46:12-41. https://doi.org/10.1002/jpen.2267.
- Patel JJ, Rice T, Compher C, Heyland DK. Do we have clinical equipoise (or uncertainty) about how much protein to provide to critically III patients? Nutr Clin Pract. 2020;35:499-505. https://doi.org/10.1002/ncp.10320.
- Heyland DK, Patel J, Compher C, et al. The effect of higher protein dosing in critically ill patients with high nutritional risk (EFFORT Protein): an international, multicentre, pragmatic, registry-based randomised trial. The Lancet. 2023;401:568-76. https://doi.org/10.1016/S0140-6736(22) 02469-2.
- Puthucheary ZA, Rawal J, McPhail M, et al. Acute skeletal muscle wasting in critical illness. JAMA. 2013;310:1591-600. https://doi.org/10.1001/jama. 2013.278481.
- van Oudenhoven FM, Swinkels SHN, Hartmann T, Rizopoulos D. Modeling the underlying biological processes in Alzheimer’s disease using a multivariate competing risk joint model. Stat Med. 2022;41:3421-33. https:// doi.org/10.1002/sim.9425.
- Reddy K, Sinha P, O’Kane CM, et al. Subphenotypes in critical care: translation into clinical practice. Lancet Respir Med. 2020;8:631-43. https://doi. org/10.1016/S2213-2600(20)30124-7.
- Harhay MO, Casey JD, Clement M, et al. Contemporary strategies to improve clinical trial design for critical care research: insights from the First Critical Care Clinical Trialists Workshop. Intensive Care Med. 2020;46:930-42. https://doi.org/10.1007/s00134-020-05934-6.
- van Eijk RPA, Roes KCB, van den Berg LH, Lu Y. Joint modeling of endpoints can be used to answer various research questions in randomized clinical trials. J Clin Epidemiol. 2022;147:32-9. https://doi.org/10.1016/j. jclinepi.2022.03.009.
- van Oudenhoven FM, Swinkels SHN, Ibrahim JG, Rizopoulos D. A marginal estimate for the overall treatment effect on a survival outcome within the joint modeling framework. Stat Med. 2020;39:4120-32. https://doi.org/10. 1002/sim. 8713.
- Heyland D, Muscedere J, Wischmeyer PE, et al. A randomized trial of glutamine and antioxidants in critically ill patients. N Engl J Med. 2013;368:1489-97. https://doi.org/10.1056/NEJMoa1212722.
- Heyland DK, Wibbenmeyer L, Pollack JA, et al. A randomized trial of enteral glutamine for treatment of burn injuries. N Engl J Med. 2022;387:1001-10. https://doi.org/10.1056/NEJMoa2203364.
- Chapple LS, Kouw IWK, Summers MJ, et al. Muscle protein synthesis after protein administration in critical illness. Am J Respir Crit Care Med. 2022;206:740-9. https://doi.org/10.1164/rccm.202112-2780OC.
- Taguchi A, Fahrmann JF, Hanash SM. A promising CPS1 inhibitor keeping ammonia from Fueling cancer. Cell Chem Biol. 2020;27:253-4. https://doi. org/10.1016/j.chembiol.2020.03.002.
- Puthucheary ZA, Astin R, Mcphail MJW, et al. Metabolic phenotype of skeletal muscle in early critical illness. Thorax. 2018;73:926-35. https://doi. org/10.1136/thoraxjnl-2017-211073.
- Vilstrup H, Amodio P, Bajaj J, et al. Hepatic encephalopathy in chronic liver disease: 2014 practice guideline by the american association for the study of liver diseases and the European association for the study of the
liver. Hepatol Baltim Md. 2014;60:715-35. https://doi.org/10.1002/hep. 27210. - Bajaj JS, Bloom PP, Chung RT, et al. Variability and lability of ammonia levels in healthy volunteers and patients with cirrhosis: implications for trial design and clinical practice. Am J Gastroenterol. 2020;115:783-5. https:// doi.org/10.14309/ajg. 0000000000000384.
- Haines RW, Fowler AJ, Wan YI, et al. Catabolism in critical illness: a reanalysis of the reducing deaths due to oxidative stress (REDOXS) trial*. Crit Care Med. 2022;50:1072-82. https://doi.org/10.1097/CCM. 0000000000 005499.
- Heyland DK, Patel J, Bear D, et al. The effect of higher protein dosing in critically III patients: a multicenter registry-based randomized trial: the EFFORT trial. J Parenter Enter Nutr. 2019;43:326-34. https://doi.org/10. 1002/jpen. 1449.
- Breen L, Phillips SM. Skeletal muscle protein metabolism in the elderly: interventions to counteract the “anabolic resistance” of ageing. Nutr Metab. 2011;8:68. https://doi.org/10.1186/1743-7075-8-68.
- Zhu R, Allingstrup MJ, Perner A, et al. The effect of IV amino acid supplementation on mortality in ICU patients may be dependent on kidney function: post hoc subgroup analyses of a multicenter randomized trial. Crit Care Med. 2018;46:1293-301. https://doi.org/10.1097/CCM. 00000 00000003221.
- Haines RW, Zolfaghari P, Wan Y, et al. Elevated urea-to-creatinine ratio provides a biochemical signature of muscle catabolism and persistent critical illness after major trauma. Intensive Care Med. 2019;45:1718-31. https://doi.org/10.1007/s00134-019-05760-5.
- Heyland DK, Elke G, Cook D, et al. Glutamine and antioxidants in the critically ill patient: a post hoc analysis of a large-scale randomized trial. JPEN J Parenter Enteral Nutr. 2015;39:401-9. https://doi.org/10.1177/01486 07114529994.
- Urner
, Jüni P, Hansen B, et al. Time-varying intensity of mechanical ventilation and mortality in patients with acute respiratory failure: a registry-based, prospective cohort study. Lancet Respir Med. 2020;8:90513. https://doi.org/10.1016/S2213-2600(20)30325-8. - Rizopoulos D, Ghosh P. A Bayesian semiparametric multivariate joint model for multiple longitudinal outcomes and a time-to-event. Stat Med. 2011;30:1366-80. https://doi.org/10.1002/sim. 4205.
- Ibrahim JG, Chu H, Chen LM. Basic concepts and methods for joint models of longitudinal and survival data. J Clin Oncol. 2010;28:2796-801. https://doi.org/10.1200/JCO.2009.25.0654.
- Harrell FE. Regression Modeling Strategies: With Applications to Linear Models, Logistic Regression, and Survival Analysis. New York, NY: Springer; 2001.
- Group K. KDIGO clinical practice guideline for acute kidney injury. Kidney Int Suppl. 2012;2:1.
- Joint Models for Longitudinal and Time-to-Event Data: With Applications in R. In: Routledge CRC Press. https://www.routledge.com/Joint-Mod-els-for-Longitudinal-and-Time-to-Event-Data-With-Applications/Rizop oulos/p/book/9781439872864. Accessed 31 Jul 2022
- Rizopoulos D (2022) JMbayes2: Extended Joint Models for Longitudinal and Time-to-Event Data
- Gunst J, Casaer MP, Preiser J-C, et al. Toward nutrition improving outcome of critically ill patients: How to interpret recent feeding RCTs? Crit Care. 2023;27:43. https://doi.org/10.1186/s13054-023-04317-9.
- Hermans G, Casaer MP, Clerckx B, et al. Effect of tolerating macronutrient deficit on the development of intensive-care unit acquired weakness: a subanalysis of the EPaNIC trial. Lancet Respir Med. 2013;1:621-9. https:// doi.org/10.1016/S2213-2600(13)70183-8.
- Mansournia MA, Etminan M, Danaei G, et al. Handling time varying confounding in observational research. BMJ. 2017;359: j4587. https://doi.org/ 10.1136/bmj.j4587.
- Vanhorebeek I, Latronico N, Van den Berghe G. ICU-acquired weakness. Intensive Care Med. 2020;46:637-53. https://doi.org/10.1007/ s00134-020-05944-4.
Publisher’s Note
Joint Senior Author: Daren K. Heyland and Zudin Puthucheary.
*Correspondence:
Ryan W. Haines
r.haines@qmul.ac.ukFull list of author information is available at the end of the article
