DOI: https://doi.org/10.2147/rrtm.s397138
PMID: https://pubmed.ncbi.nlm.nih.gov/38371362
تاريخ النشر: 2024-02-01
تحديث حول مسببات الفاسيولياز: ماذا نعرف؟
الملخص
فاسيولا هيباتيكا هي طفيلي ديدان مسطحة منتشر في جميع أنحاء العالم. من المعروف أنها تسبب الأمراض في الثدييات، مما يؤدي إلى خسائر اقتصادية كبيرة في صناعة الماشية وعبء على صحة الإنسان. بعد الابتلاع، تهاجر الطفيليات عبر الكبد وتنضج في القنوات الصفراوية. سيساعد فهم أفضل لمسببات المناعة للطفيلي في تطوير علاجات ولقاحات فعالة. حاليًا، يأتي الكثير من معرفتنا من دراسات في المختبر وفي الكائنات الحية في نماذج حيوانية. يُعرف القليل نسبيًا عن تفاعلات المضيف والطفيلي في البشر. هنا، نقدم مراجعة سردية لما هو معروف حاليًا عن مسببات المرض واستجابات المناعة المضيفة لـ
المقدمة
الاستجابات المناعية والعمليات المسببة للمرض الموصوفة في مضيفين مختلفين مع التركيز على البشر. ستشير فاسيولا إلى ف. هيباتيكا ما لم يُذكر خلاف ذلك في النص.
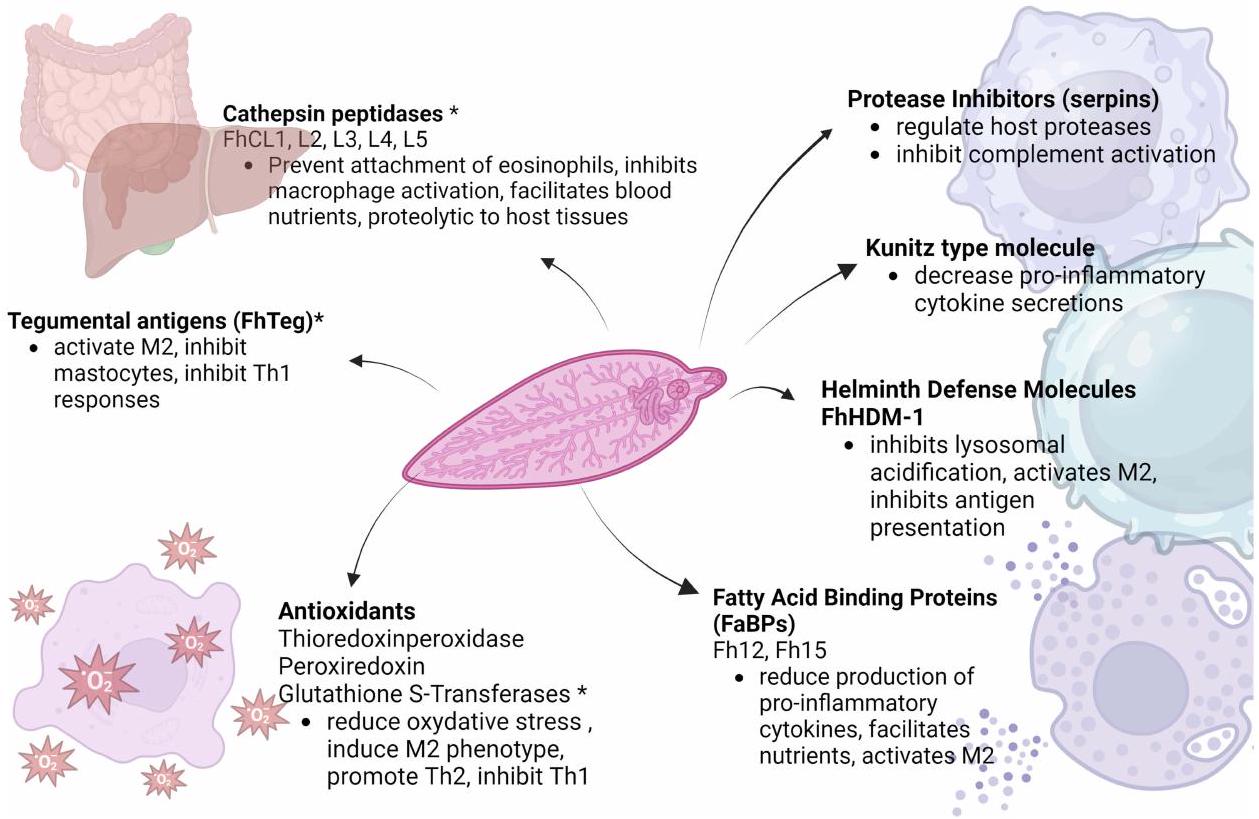
مسببات المناعة
المرحلة الحادة
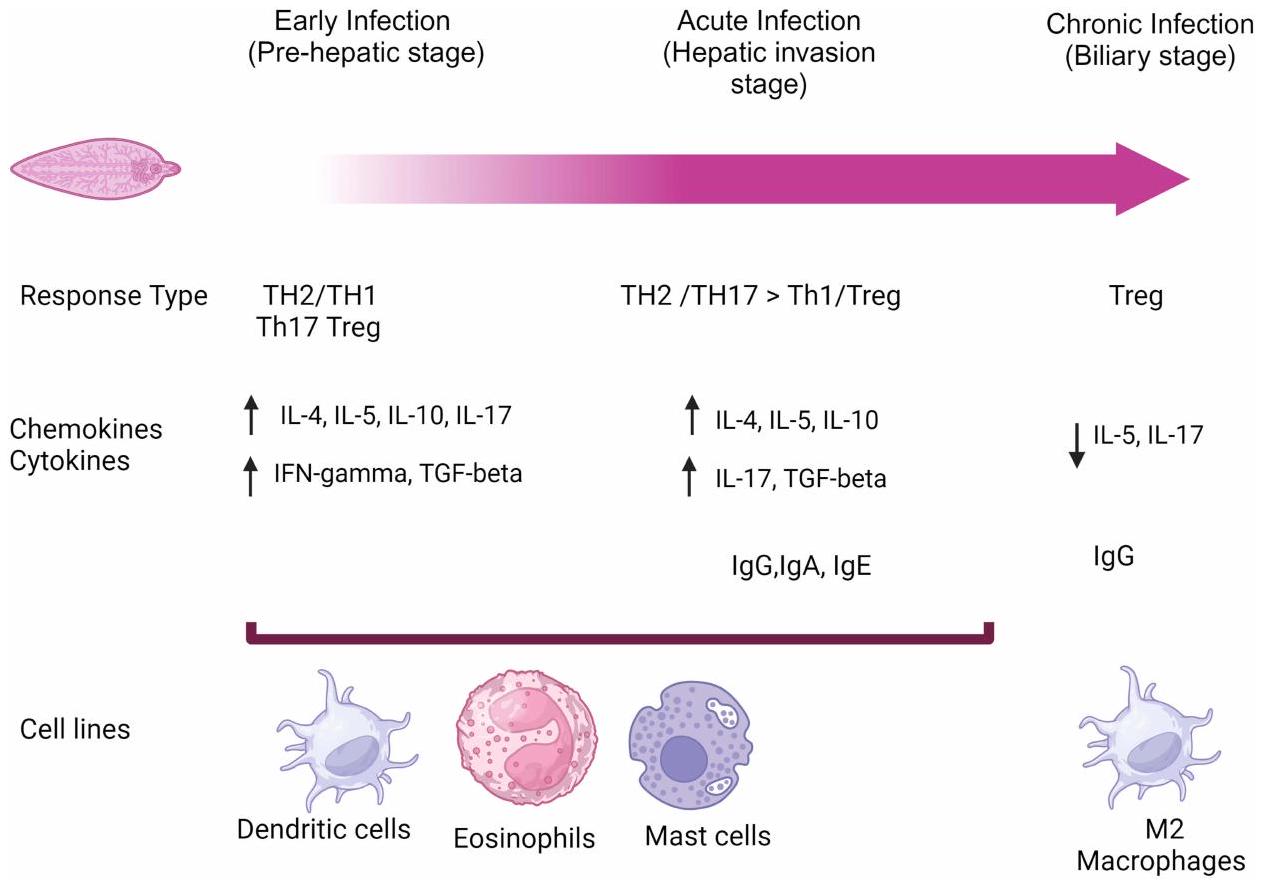
ملاحظات:
المرحلة المزمنة
علم الأمراض المرتبط بالفاسيولiasis
علم أمراض نسيج الكبد
تكون وراء التأثير الكبير على معايير الإنتاج الملحوظة مع الفاسيولiasis.
علم أمراض شجرة القنوات الصفراوية
تشير الحيوانات المصابة ونموذج الحيوانات إلى أن الفاسيولا قد تكون مرتبطة بتكوين الحصوات.
التظاهرات الجهازية
الاستنتاجات
الشكر والتقدير
الإفصاح
References
- Caravedo MA, Cabada MM. Human Fascioliasis: current Epidemiological Status and Strategies for Diagnosis, Treatment, and Control. Res Rep Trop Med. 2020;11:149-158.
- May K, Bohlsen E, Konig S, Strube C. Fasciola hepatica seroprevalence in Northern German dairy herds and associations with milk production parameters and milk ketone bodies. Vet Parasitol. 2020;277:109016.
- Mehmood K, Zhang H, Sabir AJ, et al. A review on epidemiology, global prevalence and economical losses of fasciolosis in ruminants. Microb Pathog. 2017;109:253-262.
- Donnelly S, Flynn RJ, Mulcahy G, O’Neill SM Chapter Immunological interaction between Fasciola and its host. In Fascioliasis II. 2022. Available from: http://hdl.handle.net/10453/166688. Accessed January 31, 2024.
- Lalor R, Cwiklinski K, Calvani NED, et al. Pathogenicity and virulence of the liver flukes Fasciola hepatica and Fasciola gigantica that cause the zoonosis Fasciolosis. Virulence. 2021;12(1):2839-2867.
- Chang Wong MR, Pinto Elera JO, Guzman Rojas P, Terashima Iwashita A, Samalvides cuba F. Caracterizacion clinica y epidemiologica de la infeccion por Fasciola hepatica entre los años 2003-2010 en el Hospital Nacional Cayetano Heredia, Lima, Peru. [Demographic and clinical aspects of Fasciola hepatica between 2013-2010 in National Hospital Cayetano Heredia, Lima, Peru] Spanish. Rev Gastroenterol Peru. 2016;36 (1):23-28.
- Machicado C, Machicado JD, Maco V, Terashima A, Marcos LA. Association of Fasciola hepatica Infection with Liver Fibrosis, Cirrhosis, and Cancer: a Systematic Review. PLoS Negl Trop Dis. 2016;10(9):e0004962.
- Cabada MM, Goodrich MR, Graham B, et al. Prevalence of intestinal helminths, anemia, and malnutrition in Paucartambo, Peru. Rev Panam Salud Publica. 2015;37(2):69-75.
- Vázquez AA, Alda P, Lounnas M, et al. Lymnaeid snails hosts of Fasciola hepatica and Fasciola gigantica (Trematoda: digenea): a worldwide review. CABI Reviews. 2018;1-15.
- Mas-Coma S, Bargues MD, Valero MA. Human fascioliasis infection sources, their diversity, incidence factors, analytical methods and prevention measures. Parasitology. 2018;145(13):1665-1699.
- Klion AD, Nutman TB. The role of eosinophils in host defense against helminth parasites. J Allergy Clin Immunol. 2004;113(1):30-37.
- Cwiklinski K, Jewhurst H, McVeigh P, et al. Infection by the Helminth Parasite Fasciola hepatica Requires Rapid Regulation of Metabolic, Virulence, and Invasive Factors to Adjust to Its Mammalian Host. Mol Cell Proteomics. 2018;17(4):792-809.
- Andreyanov ON, Postevoy AN, Sidor EA. The effect of ambient temperature on biological properties and energy metabolism of Fasciola hepatica metacercariae. Vet Parasitol. 2021;299:109576.
- Dow C, Ross JG, Todd JR. The histopathology of Fasciola hepatica infections in sheep. Parasitology. 1968;58(1):129-135.
- Van Milligen FJ, Cornelissen JB, Hendriks IM, Gaasenbeek CP, Bokhout BA. Protection of Fasciola hepatica in the gut mucosa of immune rats is associated with infiltrates of eosinophils, IgG1 and IgG2a antibodies around the parasites. Parasite Immunol. 1998;20(6):285-292.
- Zafra R, Perez-Ecija RA, Buffoni L, et al. Early hepatic and peritoneal changes and immune response in goats vaccinated with a recombinant glutathione transferase sigma class and challenged with Fasciola hepatica. Res Vet Sci. 2013;94(3):602-609.
- van Milligen FJ, Cornelissen JB, Gaasenbeek CP, Bokhout BA. A novel ex vivo rat infection model to study protective immunity against Fasciola hepatica at the gut level. J Immunol Methods. 1998;213(2):183-190.
- Wicki P, Schwalbach B, Charbon JL, et al. Réactions cellulaires intestinales du bovin après infection par Fasciola hepatica [Intestinal cellular reaction of cattle after infection by Fasciola hepatica]. Schweiz Arch Tierheilkd. 1991;133(9):429-437.
- Ruiz-Campillo MT, Molina Hernandez V, Escamilla A, et al. Immune signatures of pathogenesis in the peritoneal compartment during early infection of sheep with Fasciola hepatica. Sci Rep. 2017;7:2782.
- Robinson MW, Hutchinson AT, Dalton JP, Donnelly S. Peroxiredoxin: a central player in immune modulation. Parasite Immunol. 2010;32 (5):305-313.
- Di Maggio LS, Tirloni L, Pinto AF, et al. Across intra-mammalian stages of the liver fluke Fasciola hepatica: a proteomic study. Sci Rep. 2016;6:32796.
- Figueroa-Santiago O, Espino AM. Fasciola hepatica fatty acid binding protein induces the alternative activation of human macrophages. Infect Immun. 2014;82(12):5005-5012.
- Ryan S, Shiels J, Taggart CC, Dalton JP, Weldon S. Fasciola hepatica-Derived Molecules as Regulators of the Host Immune Response. Front Immunol. 2020;11:2182.
- Robinson MW, Alvarado R, To J, et al. A helminth cathelicidin-like protein suppresses antigen processing and presentation in macrophages via inhibition of lysosomal vATPase. FASEB J. 2012;26(11):4614-4627.
- Martinez-Sernandez V, Mezo M, Gonzalez-Warleta M, et al. The MF6p/FhHDM-1 major antigen secreted by the trematode parasite Fasciola hepatica is a heme-binding protein. J Biol Chem. 2014;289(3):1441-1456.
- O’Neill S, Donnelly S. Mechanisms of Immune Modulation by Fasciola hepatica: the Impact of Innate Immune Cells on the Developing Adaptive Immune Response. In: Jirillo E, Magrone T, Miragliotta G, editors. In Immune Response to Parasitic Infections: Immunity to Helminths and Novel Therapeutic. Approaches. Bentham Books; 2014.
- Flynn RJ, Mulcahy G, Elsheikha HM. Coordinating innate and adaptive immunity in Fasciola hepatica infection: implications for control. Vet Parasitol. 2010;169(3-4):235-240.
- Ravida A, Cwiklinski K, Aldridge AM, et al. Fasciola hepatica Surface Tegument: glycoproteins at the Interface of Parasite and Host. Mol Cell Proteomics. 2016;15(10):3139-3153.
- Adams PN, Aldridge A, Vukman KV, Donnelly S, O’Neill SM. Fasciola hepatica tegumental antigens indirectly induce an M2 macrophage-like phenotype in vivo. Parasite Immunol. 2014;36(10):531-539.
- Vukman KV, Adams PN, Metz M, Maurer M, O’Neill SM. Fasciola hepatica tegumental coat impairs mast cells’ ability to drive Th1 immune responses. J Immunol. 2013;190(6):2873-2879.
- Cameron TC, Cooke I, Faou P, et al. A novel ex vivo immunoproteomic approach characterizing Fasciola hepatica tegumental antigens identified using immune antibody from resistant sheep. Int J Parasitol. 2017;47(9):555-567.
- Morales A, Espino AM. Evaluation and characterization of Fasciola hepatica tegument protein extract for serodiagnosis of human fascioliasis. Clin Vaccine Immunol. 2012;19(11):1870-1878.
- Trelis M, Sanchez-Lopez CM, Sanchez-Palencia LF, Ramirez-Toledo V, Marcilla A, Bernal D. Proteomic Analysis of Extracellular Vesicles from Fasciola hepatica Hatching Eggs and Juveniles in Culture. Front Cell Infect Microbiol. 2022;12:903602.
- Walsh KP, Brady MT, Finlay CM, Boon L, Mills KH. Infection with a helminth parasite attenuates autoimmunity through TGF-beta-mediated suppression of Th17 and Th1 responses. J Immunol. 2009;183(3):1577-1586.
- Flynn RJ, Mulcahy G. The roles of IL-10 and TGF-beta in controlling IL-4 and IFN-gamma production during experimental Fasciola hepatica infection. Int
Parasitol. 2008;38(14):1673-1680. - Donnelly S, O’Neill SM, Sekiya M, Mulcahy G, Dalton JP. Thioredoxin peroxidase secreted by Fasciola hepatica induces the alternative activation of macrophages. Infect Immun. 2005;73(1):166-173.
- Donnelly S, Stack CM, O’Neill SM, Sayed AA, Williams DL, Dalton JP. Helminth 2-Cys peroxiredoxin drives Th2 responses through a mechanism involving alternatively activated macrophages. FASEB J. 2008;22(11):4022-4032.
- Naranjo-Lucena A, Correia CN, Molina-Hernandez V, et al. Transcriptomic Analysis of Ovine Hepatic Lymph Node Following Fasciola hepatica Infection – Inhibition of NK Cell and IgE-Mediated Signaling. Front Immunol. 2021;12:687579.
- Rodriguez E, Noya V, Cervi L, et al. Glycans from Fasciola hepatica Modulate the Host Immune Response and TLR-Induced Maturation of Dendritic Cells. PLoS Negl Trop Dis. 2015;9(12):e0004234.
- Dowling DJ, Hamilton CM, Donnelly S, et al. Major secretory antigens of the helminth Fasciola hepatica activate a suppressive dendritic cell phenotype that attenuates Th17 cells but fails to activate Th2 immune responses. Infect Immun. 2010;78(2):793-801.
- De Marco Verissimo C, Jewhurst HL, Tikhonova IG, et al. Fasciola hepatica serine protease inhibitor family (serpins): purposely crafted for regulating host proteases. PLoS Negl Trop Dis. 2020;14(8):e0008510.
- Donnelly S, Stack CM, O’Neill SM, Sayed AA, Williams DL, Dalton JP. Helminth 2-Cys peroxiredoxin drives responses through a mechanism involving alternatively activated macrophages. FASEB J. 2008;22(11):4022.
- Aron-Said C, Montes M, White AC, Cabada MM. Plasma cytokines during acute human fascioliasis. Parasitol Res. 2021;120(8):2965-2968.
- Frigerio S, da Costa V, Costa M, et al. Eosinophils Control Liver Damage by Modulating Immune Responses Against Fasciola hepatica. Front Immunol. 2020;11:579801.
- Serradell MC, Guasconi L, Cervi L, Chiapello LS, Masih DT. Excretory-secretory products from Fasciola hepatica induce eosinophil apoptosis by a caspase-dependent mechanism. Vet Immunol Immunopathol. 2007;117(3-4):197-208.
- Carmona C, Dowd AJ, Smith AM, Dalton JP. Cathepsin L proteinase secreted by Fasciola hepatica in vitro prevents antibody-mediated eosinophil attachment to newly excysted juveniles. Mol Biochem Parasitol. 1993;62(1):9-17.
- Bramhall M, Zaph C. Mastering gut permeability: new roles for old friends. Eur J Immunol. 2017;47(2):236-239. doi:10.1002/eji.201646842
- Robinson MW, Dalton JP, O’Neill SM, Donnelly SM. Chapter 27: mechanisms of Immune Modulation by Fasciola hepatica: importance for Vaccine Development and for Novel Immunotherapeutics. In: Cr C, editor. Parasitic Helminths: Targets, Screens, Drugs and Vaccines. Wiley Online Library; 2012.
- Cruz AA, Lima F, Sarinho E, et al. Safety of anti-immunoglobulin E therapy with omalizumab in allergic patients at risk of geohelminth infection. Clin Exp Allergy. 2007;37(2):197-207.
- Silva SML, Vindimian M, Wattre P, Capron A. Etude des anticorps IgE dans la distomatose humaine a Fasciola hepatica. [IgE antibodies in human Fasciola hepatica distomiasis] French. Pathol Biol. 1985;33(7):746-750.
- Kita H, Kaneko M, Bartemes KR, et al. Does IgE bind to and activate eosinophils from patients with allergy? J Immunol. 1999;162 (11):6901-6911.
- Hamilton CM, Dowling DJ, Loscher CE, Morphew RM, Brophy PM, O’Neill SM. The Fasciola hepatica tegumental antigen suppresses dendritic cell maturation and function. Infect Immun. 2009;77(6):2488-2498.
- Morrison CA, Colin T, Sexton JL, et al. Protection of cattle against Fasciola hepatica infection by vaccination with glutathione S-transferase. Vaccine. 1996;14(17-18):1603-1612.
- Golden O, Flynn RJ, Read C, et al. Protection of cattle against a natural infection of Fasciola hepatica by vaccination with recombinant cathepsin L1 (rFhCL1). Vaccine. 2010;28(34):5551-5557.
- Zafra R, Buffoni L, Perez-Caballero R, et al. Efficacy of a multivalent vaccine against Fasciola hepatica infection in sheep. Vet Res. 2021;52 (1):13.
- Maggio L, Tirloni L, Uhl M, et al. Serpins in Fasciola hepatica: insights into host-parasite interactions. Int J Parasitol. 2020;50(12):931-943.
- Smith AM, Dowd AJ, Heffernan M, Robertson CD, Dalton JP. Fasciola hepatica: a secreted cathepsin L-like proteinase cleaves host immunoglobulin. Int J Parasitol. 1993;23(8):977-983.
- De Marco Verissimo C, Jewhurst HL, Dobo J, Gal P, Dalton JP, Cwiklinski K. Fasciola hepatica is refractory to complement killing by preventing attachment of mannose binding lectin (MBL) and inhibiting MBL-associated serine proteases (MASPs) with serpins. PLoS Pathog. 2022;18(1):e1010226.
- Guasconi L, Serradell MC, Masih DT, Chiapello LS. Immunomodulatory Effect of Fasciola hepatica Excretory-Secretory Products on Macrophages. In: Fasciola Hepatica: Methods and Protocols. Springer; 2020.
- White MPJ, McManus CM, Maizels RM. Regulatory T-cells in helminth infection: induction, function and therapeutic potential. Immunology. 2020;160(3):248-260.
- Lund ME, O’Brien BA, Hutchinson AT, et al. Secreted proteins from the helminth Fasciola hepatica inhibit the initiation of autoreactive T cell responses and prevent diabetes in the NOD mouse. PLoS One. 2014;9(1):e86289.
- Costa M, da Costa V, Lores P, et al. Macrophage Gal/GalNAc lectin 2 (MGL2)(+) peritoneal antigen presenting cells during Fasciola hepatica infection are essential for regulatory T cell induction. Sci Rep. 2022;12(1):17661.
- Costa M, da Costa V, Frigerio S, et al. Heme-Oxygenase-1 Attenuates Oxidative Functions of Antigen Presenting Cells and Promotes Regulatory T Cell Differentiation during Fasciola hepatica Infection. Antioxidants. 2021;10(12):1322.
- Gironènes N, Valero AM, García-Bodelón MA, et al. Immune Suppression in Advanced Chronic Fascioliasis: an Experimental Study in a Rat Model. J Infectious Dis. 2007;195(10):1504-1512.
- Richter J, Freise S, Mull R, Millan JC. Fascioliasis: sonographic abnormalities of the biliary tract and evolution after treatment with triclabendazole. Trop Med Int Health. 1999;4(11):774-781.
- Oyarzun-Ruiz P, Alvelo C, Vera F, Moroni M. Histopathological findings of Fasciola hepatica infection in non-native European hare (Lepus europaeus) in Southern Chile. Rev Bras Parasitol Vet. 2019;28(1):145-150.
- Matsuda K, Kogame S, Niki H, Saito M, Ishiguro Y, Sano Y. Gross and histological lesions in the livers of sika deer with particular emphasis on fascioliasis. J Vet Med Sci. 2020;82(2):125-134.
- Capucchio MT, Catalano D, Di Marco V, et al. Natural trematode infestation in feral Nebrodi Black pigs: pathological investigations. Vet Parasitol. 2009;159(1):37-42.
- Mpisana Z, Jaja IF, Byaruhanga C, Marufu MC. Body condition scores, fluke intensity, liver pathology, and carcass quality of different dairy cattle genotypes infected with Fasciola species at high throughput abattoirs in South Africa. Parasitol Res. 2022;121(6):1671-1682.
- Winaya IBO, Oka IBM, Adnyana IBW, Sudipa PH. Fibrosis and Collagen-I Accumulation in Bali Cattle Liver Tissue Infected with Fasciola gigantica. Inter J Vet Sc. 2023;12(2):224-229.
- Phiri AM, Phiri IK, Sikasunge CS, Chembensofu M, Monrad J. Comparative fluke burden and pathology in condemned and non-condemned cattle livers from selected abattoirs in Zambia. Onderstepoort J Vet Res. 2006;73(4):275-281.
- Zhang Y, Mei X, Liang Y, et al. Newly excysted juveniles (NEJs) of Fasciola gigantica induce mice liver fibrosis and M2 macrophage-like phenotype in vivo. Microb Pathog. 2020;139:103909.
- Kolodziejczyk L, Laszczynska M, Masiuk M, Grabowska M, Skrzydlewska E. Immunoexpression of intermediate filaments and morphological changes in the liver and bile duct of rats infected with Fasciola hepatica. Biotech Histochem. 2015;90(7):477-485.
- Marcos LA, Terashima A, Yi P, et al. Mechanisms of liver fibrosis associated with experimental Fasciola hepatica infection: roles of Fas2 proteinase and hepatic stellate cell activation. J Parasitol. 2011;97(1):82-87.
- Alvarez Rojas CA, Ansell BR, Hall RS, et al. Transcriptional analysis identifies key genes involved in metabolism, fibrosis/tissue repair and the immune response against Fasciola hepatica in sheep liver. Parasit Vectors. 2015;8:124.
- Almendras-Jaramillo M, Rivera-Medina J, Seijas-Mogrovejo J, Almendras-Jaramillo K. Fascioliasis Hepatica En niños: manifestaciones clinicas poco frecuentes. [Hepatic fascioliasis in children: uncommon clinical manifestations] Spanish. Arq Gastroenterol. 1997;34(4):241-247.
- Marcos LA, Maco V, Castillo M, Terashima A, Zerpa R, Gotuzzo E. Reporte de casos de Fasciolosis humana en el Instituto Especializado de Salud del Nino, Lima, Peru (1988-2003). [Report of cases of human fascioliasis in the Specialized Children’s Health Institute, Lima, Peru (1988′-2003)] Spanish. Rev Gastroenterol Peru. 2005;25(2):198-205.
- Sanchez-Sosa S, Rojas-Ortega S, Reed-San Roman G, Torres-Santana MA. Fasciolosis hepatobiliar masiva. [Massive hepatobiliary fascioliasis] Spanish. Rev Gastroenterol Mex. 2000;65(4):179-183.
- Bestas R, Yalcin K, Cicek M. Cholestasis caused by Fasciola gigantica. Turkiye Parazitol Derg. 2014;38(3):201-204.
- Hosamirudsari H JRY. Fasciola hepatica an Unusual Cause of Chronic Cholecystitis. Int J Infect. 2015;2(2):e23108.
- Guzman Calderon E, Vera Calderon A, Diaz Rios R, Arcana Lopez R, Alva Alva E. Fasciola hepatica in the common bile duct: spyglass visualization and endoscopic extraction. Rev Esp Enferm Dig. 2018;110(10):671-673.
- Gulsen MT, Savas MC, Koruk M, Kadayifci A, Demirci F. Fascioliasis: a report of five cases presenting with common bile duct obstruction. Neth J Med. 2006;64(1):17-19.
- Dolay K, Hasbahceci M, Hatipoglu E, Umit Malya F, Akcakaya A. Endoscopic diagnosis and treatment of biliary obstruction due to acute cholangitis and acute pancreatitis secondary to Fasciola hepatica infection. Ulus Travma Acil Cerrahi Derg. 2018;24(1):71-73.
- Ha JS, Choi HJ, Moon JH, et al. Endoscopic Extraction of Biliary Fascioliasis Diagnosed Using Intraductal Ultrasonography in a Patient with Acute Cholangitis. Clin Endosc. 2015;48(6):579-582.
- Veerappan A, Siegel JH, Podany J, Prudente R, Gelb A. Fasciola hepatica pancreatitis: endoscopic extraction of live parasites. Gastrointest Endosc. 1991;37(4):473-475.
- Dzib Calan EA, Larracilla Salazar I, Morales Perez JI. A giant liver abscess due to Fasciola hepatica infection. Rev Esp Enferm Dig. 2019 ; 111 (10):815-816.
- Losada H, Hirsch M, Guzman P, Fonseca F, Hofmann E, Alanis M. Fascioliasis simulating an intrahepatic cholangiocarcinoma-Case report with imaging and pathology correlation. Hepatobiliary Surg Nutr. 2015;4(1).
- Wang H, Itoh S, Matsumoto Y, et al. Surgically resected hepatic mass caused by fascioliasis. Clin J Gastroenterol. 2021;14(2):662-667.
- Yen TJ, Hsiao CH, Hu RH, Liu KL, Chen CH. Education and imaging: hepatobiliary and pancreatic: chronic hepatic abscess associated with fascioliasis. J Gastroenterol Hepatol. 2011;26(3):611.
- Sripa B, Kanla P, Sinawat P, Haswell-Elkins MR. Opisthorchiasis-associated biliary stones: light and scanning electron microscopic study. World J Gastroenterol. 2004;10(22):3318-3321.
- Pfeifer CM, Bourm KS, Brandt MR, Ali K. Liver fluke-induced choledocholithiasis with biliary ductal obstruction. Radiol Case Rep. 2019;14 (12):1483-1486.
- Lefryekh R, Bensaad A, Bensardi F, et al. Hepatic fascioliasis presenting with bile duct obstruction: a case report. Pan Afr Med J. 2017;28:44.
- Brahmbhatt NN, Kumar B, Thakre BJ, Bilwal AK. Haemato-biochemical characterization of fasciolosis in Gir cattle and Jaffrabadi buffaloes. J Parasit Dis. 2021;45(3):683-688.
- Javaregowda AK, Rani KB. Chronic bovine fasciolosis associated cholangiolithiasis: a case report. J Parasit Dis. 2017;41(1):90-92.
- Valero MA, Santana M, Morales M, Hernandez JL, Mas-Coma S. Risk of gallstone disease in advanced chronic phase of fascioliasis: an experimental study in a rat model. J Infect Dis. 2003;188(5):787-793.
- Valero MA, Varea MT, Marin R. Fasciola hepatica: lithogenic capacity in experimentally infested rats and chemical determination of the main stone components. Parasitol Res. 2000;86(7):558-562.
- Cetta F. The role of bacteria in pigment gallstone disease. Ann Surg. 1991;213(4):315-326.
- Binda C, Gibiino G, Coluccio C, et al. Biliary Diseases from the Microbiome Perspective: how Microorganisms Could Change the Approach to Benign and Malignant Diseases. Microorganisms. 2022;10(2):312.
- Stewart L, Grifiss JM, Jarvis GA, Way LW. Biliary bacterial factors determine the path of gallstone formation. Am J Surg. 2006;192 (5):598-603.
- Dan WY, Yang YS, Peng LH, Sun G, Wang ZK. Gastrointestinal microbiome and cholelithiasis: current status and perspectives. World J Gastroenterol. 2023;29(10):1589-1601.
- Ramirez AL, Herrera G, Munoz M, et al. Describing the intestinal microbiota of Holstein Fasciola-positive and -negative cattle from a hyperendemic area of fascioliasis in central Colombia. PLoS Negl Trop Dis. 2021;15(8):45.
- Humans IWGotEoCRt. Biological agents. IARC Monogr Eval Carcinog Risks Hum. 2012;100(Pt B).
- Liau MYQ, Toh EQ, Shelat VG. Opisthorchis viverrini-Current Understanding of the Neglected Hepatobiliary Parasite. Pathogens. 2023;12 (6):56.
- Salazar M, Ituarte C, Abriata MG, Santoro F, Arroyo G. Gallbladder cancer in South America: epidemiology and prevention. Chin Clin Oncol. 2019;8(4):32.
- Machicado C, Marcos LA, Zimic M. Hypothetical granulin-like molecule from Fasciola hepatica identified by bioinformatics analysis. Springerplus. 2016;5(1):773.
- Vale N, Gouveia MJ, Gartner F, Brindley PJ. Oxysterols of helminth parasites and pathogenesis of foodborne hepatic trematodiasis caused by Opisthorchis and Fasciola species. Parasitol Res. 2020;119(5):1443-1453.
- Bottari NB, Mendes RE, Baldissera MD, et al. Relation between iron metabolism and antioxidants enzymes and delta-ALA-D activity in rats experimentally infected by Fasciola hepatica. Exp Parasitol. 2016;165:58-63.
- Swain B, Otta S, Sahu MK, Uthansingh K. Fasciola hepatica association with gallbladder malignancy: a rare case report. Trop Parasitol. 2021;11(1):42-45.
- Lopez M, White AC Jr, Cabada MM. Burden of Fasciola hepatica Infection among children from Paucartambo in Cusco, Peru. Am J Trop Med Hyg. 2012;86(3):481-485.
- Stuen S, Ersdal C. Fasciolosis-An Increasing Challenge in the Sheep Industry. Animals. 2022;12(12).
- Wong RK, Peura DA, Mutter ML, Heit HA, Birns MT, Johnson LF. Hemobilia and liver flukes in a patient from Thailand. Gastroenterology. 1985;88(6):1958-1963.
- Bahcecioglu IH, Ataseven H, Aygen E, Coskun S, Kuzu N, Ilhan F. Fasciola hepatica case with hemobilia. Acta Medica. 2007;50(2):155-156.
- Acuna-Soto R, Braun-Roth G. Bleeding ulcer in the common bile duct due to Fasciola hepatica. Am J Gastroenterol. 1987;82(6):560-562.
- Leon M, Alave J, Alvarado R, Gotuzzo E, Terashima A, Seas C. A 52 -year-old woman with a subcapsular liver hematoma. Clin Infect Dis. 2011;52(9):1137, 1195-6.
- Loja Oropeza D, Alvizuri Escobedo J, Vilca Vasquez M, Aviles Gonzaga R, Sanchez Mercado M. Hematoma hepatico subcapsular por Fasciola. [Hepatic subcapsular hematoma caused by fascioliasis] Spanish. Rev Gastroenterol Peru. 2003;23(2):142-148.
- Montembault S, Serfaty L, Poirot JL, Wendum D, Penna C, Poupon R. Ascite hemorragique revelant une infection massive a Fasciola hepatica. [Hemorrhagic ascites disclosing massive Fasciola hepatica infection] French. Gastroenterol Clin Biol. 1997;21(10):785-788.
- Sukhdeo MV, Sangster NC, Mettrick DF. Permanent feeding sites of adult Fasciola hepatica in rabbits? Int J Parasitol. 1988;18(4):509-512.
- Valero MA, Girones N, Garcia-Bodelon MA, et al. Anaemia in advanced chronic fasciolosis. Acta Trop. 2008;108(1):35-43.
- Lotfollahzadeh S, Mohri M, Bahadori Sh R, Dezfouly MR, Tajik P. The relationship between normocytic, hypochromic anaemia and iron concentration together with hepatic enzyme activities in cattle infected with Fasciola hepatica. J Helminthol. 2008;82(1):85-88.
- Shrimali RG, Patel MD, Patel RM. Comparative efficacy of anthelmintics and their effects on hemato-biochemical changes in fasciolosis of goats of South Gujarat. Vet World. 2016;9(5):524-529.
- El-Shazly AM, El-Nahas HA, Abdel-Mageed AA, et al. Human fascioliasis and anaemia in Dakahlia Governorate, Egypt. J Egypt Soc Parasitol. 2005;35(2):421-432.
- Valero MA, Perez-Crespo I, Chillon-Marinas C, et al. Fasciola hepatica reinfection potentiates a mixed Th1/Th2/Th17/Treg response and correlates with the clinical phenotypes of anemia. PLoS One. 2017;12(3).
- Rashid M, Zahra N, Chudhary A, et al. Cost-benefit ratio of anthelmintic treatment and its comparative efficacy in commercial dairy farms. Front Vet Sci. 2022;9:1047497.
- Karahocagil MK, Akdeniz H, Sunnetcioglu M, et al. A familial outbreak of fascioliasis in Eastern Anatolia: a report with review of literature. Acta Trop. 2011;118(3):177-183.
البحوث والتقارير في الطب الاستوائي
انشر عملك في هذه المجلة
DOI: https://doi.org/10.2147/rrtm.s397138
PMID: https://pubmed.ncbi.nlm.nih.gov/38371362
Publication Date: 2024-02-01
An Update on the Pathogenesis of Fascioliasis: What Do We Know?
Abstract
Fasciola hepatica is a trematode parasite distributed worldwide. It is known to cause disease in mammals, producing significant economic loses to livestock industry and burden to human health. After ingestion, the parasites migrate through the liver and mature in the bile ducts. A better understanding of the parasite’s immunopathogenesis would help to develop efficacious therapeutics and vaccines. Currently, much of our knowledge comes from in vitro and in vivo studies in animal models. Relatively little is known about the host-parasite interactions in humans. Here, we provide a narrative review of what is currently know about the pathogenesis and host immune responses to
Introduction
immune responses and pathogenic processes describe in different hosts with emphasis on human. Fasciola will refer to F. hepatica unless indicated otherwise in the text.
Immunopathogenesis
Acute Phase


Notes:
Chronic Phase
Pathology Associated with Fascioliasis
Liver Parenchyma Pathology
be behind the high impact on production parameters observed with fascioliasis.
Biliary Tree Pathology
infected animals and animal model suggest that Fasciola may be associated with stone formation.
Systemic Manifestations
Conclusions
Acknowledgments
Disclosure
References
- Caravedo MA, Cabada MM. Human Fascioliasis: current Epidemiological Status and Strategies for Diagnosis, Treatment, and Control. Res Rep Trop Med. 2020;11:149-158.
- May K, Bohlsen E, Konig S, Strube C. Fasciola hepatica seroprevalence in Northern German dairy herds and associations with milk production parameters and milk ketone bodies. Vet Parasitol. 2020;277:109016.
- Mehmood K, Zhang H, Sabir AJ, et al. A review on epidemiology, global prevalence and economical losses of fasciolosis in ruminants. Microb Pathog. 2017;109:253-262.
- Donnelly S, Flynn RJ, Mulcahy G, O’Neill SM Chapter Immunological interaction between Fasciola and its host. In Fascioliasis II. 2022. Available from: http://hdl.handle.net/10453/166688. Accessed January 31, 2024.
- Lalor R, Cwiklinski K, Calvani NED, et al. Pathogenicity and virulence of the liver flukes Fasciola hepatica and Fasciola gigantica that cause the zoonosis Fasciolosis. Virulence. 2021;12(1):2839-2867.
- Chang Wong MR, Pinto Elera JO, Guzman Rojas P, Terashima Iwashita A, Samalvides cuba F. Caracterizacion clinica y epidemiologica de la infeccion por Fasciola hepatica entre los años 2003-2010 en el Hospital Nacional Cayetano Heredia, Lima, Peru. [Demographic and clinical aspects of Fasciola hepatica between 2013-2010 in National Hospital Cayetano Heredia, Lima, Peru] Spanish. Rev Gastroenterol Peru. 2016;36 (1):23-28.
- Machicado C, Machicado JD, Maco V, Terashima A, Marcos LA. Association of Fasciola hepatica Infection with Liver Fibrosis, Cirrhosis, and Cancer: a Systematic Review. PLoS Negl Trop Dis. 2016;10(9):e0004962.
- Cabada MM, Goodrich MR, Graham B, et al. Prevalence of intestinal helminths, anemia, and malnutrition in Paucartambo, Peru. Rev Panam Salud Publica. 2015;37(2):69-75.
- Vázquez AA, Alda P, Lounnas M, et al. Lymnaeid snails hosts of Fasciola hepatica and Fasciola gigantica (Trematoda: digenea): a worldwide review. CABI Reviews. 2018;1-15.
- Mas-Coma S, Bargues MD, Valero MA. Human fascioliasis infection sources, their diversity, incidence factors, analytical methods and prevention measures. Parasitology. 2018;145(13):1665-1699.
- Klion AD, Nutman TB. The role of eosinophils in host defense against helminth parasites. J Allergy Clin Immunol. 2004;113(1):30-37.
- Cwiklinski K, Jewhurst H, McVeigh P, et al. Infection by the Helminth Parasite Fasciola hepatica Requires Rapid Regulation of Metabolic, Virulence, and Invasive Factors to Adjust to Its Mammalian Host. Mol Cell Proteomics. 2018;17(4):792-809.
- Andreyanov ON, Postevoy AN, Sidor EA. The effect of ambient temperature on biological properties and energy metabolism of Fasciola hepatica metacercariae. Vet Parasitol. 2021;299:109576.
- Dow C, Ross JG, Todd JR. The histopathology of Fasciola hepatica infections in sheep. Parasitology. 1968;58(1):129-135.
- Van Milligen FJ, Cornelissen JB, Hendriks IM, Gaasenbeek CP, Bokhout BA. Protection of Fasciola hepatica in the gut mucosa of immune rats is associated with infiltrates of eosinophils, IgG1 and IgG2a antibodies around the parasites. Parasite Immunol. 1998;20(6):285-292.
- Zafra R, Perez-Ecija RA, Buffoni L, et al. Early hepatic and peritoneal changes and immune response in goats vaccinated with a recombinant glutathione transferase sigma class and challenged with Fasciola hepatica. Res Vet Sci. 2013;94(3):602-609.
- van Milligen FJ, Cornelissen JB, Gaasenbeek CP, Bokhout BA. A novel ex vivo rat infection model to study protective immunity against Fasciola hepatica at the gut level. J Immunol Methods. 1998;213(2):183-190.
- Wicki P, Schwalbach B, Charbon JL, et al. Réactions cellulaires intestinales du bovin après infection par Fasciola hepatica [Intestinal cellular reaction of cattle after infection by Fasciola hepatica]. Schweiz Arch Tierheilkd. 1991;133(9):429-437.
- Ruiz-Campillo MT, Molina Hernandez V, Escamilla A, et al. Immune signatures of pathogenesis in the peritoneal compartment during early infection of sheep with Fasciola hepatica. Sci Rep. 2017;7:2782.
- Robinson MW, Hutchinson AT, Dalton JP, Donnelly S. Peroxiredoxin: a central player in immune modulation. Parasite Immunol. 2010;32 (5):305-313.
- Di Maggio LS, Tirloni L, Pinto AF, et al. Across intra-mammalian stages of the liver fluke Fasciola hepatica: a proteomic study. Sci Rep. 2016;6:32796.
- Figueroa-Santiago O, Espino AM. Fasciola hepatica fatty acid binding protein induces the alternative activation of human macrophages. Infect Immun. 2014;82(12):5005-5012.
- Ryan S, Shiels J, Taggart CC, Dalton JP, Weldon S. Fasciola hepatica-Derived Molecules as Regulators of the Host Immune Response. Front Immunol. 2020;11:2182.
- Robinson MW, Alvarado R, To J, et al. A helminth cathelicidin-like protein suppresses antigen processing and presentation in macrophages via inhibition of lysosomal vATPase. FASEB J. 2012;26(11):4614-4627.
- Martinez-Sernandez V, Mezo M, Gonzalez-Warleta M, et al. The MF6p/FhHDM-1 major antigen secreted by the trematode parasite Fasciola hepatica is a heme-binding protein. J Biol Chem. 2014;289(3):1441-1456.
- O’Neill S, Donnelly S. Mechanisms of Immune Modulation by Fasciola hepatica: the Impact of Innate Immune Cells on the Developing Adaptive Immune Response. In: Jirillo E, Magrone T, Miragliotta G, editors. In Immune Response to Parasitic Infections: Immunity to Helminths and Novel Therapeutic. Approaches. Bentham Books; 2014.
- Flynn RJ, Mulcahy G, Elsheikha HM. Coordinating innate and adaptive immunity in Fasciola hepatica infection: implications for control. Vet Parasitol. 2010;169(3-4):235-240.
- Ravida A, Cwiklinski K, Aldridge AM, et al. Fasciola hepatica Surface Tegument: glycoproteins at the Interface of Parasite and Host. Mol Cell Proteomics. 2016;15(10):3139-3153.
- Adams PN, Aldridge A, Vukman KV, Donnelly S, O’Neill SM. Fasciola hepatica tegumental antigens indirectly induce an M2 macrophage-like phenotype in vivo. Parasite Immunol. 2014;36(10):531-539.
- Vukman KV, Adams PN, Metz M, Maurer M, O’Neill SM. Fasciola hepatica tegumental coat impairs mast cells’ ability to drive Th1 immune responses. J Immunol. 2013;190(6):2873-2879.
- Cameron TC, Cooke I, Faou P, et al. A novel ex vivo immunoproteomic approach characterizing Fasciola hepatica tegumental antigens identified using immune antibody from resistant sheep. Int J Parasitol. 2017;47(9):555-567.
- Morales A, Espino AM. Evaluation and characterization of Fasciola hepatica tegument protein extract for serodiagnosis of human fascioliasis. Clin Vaccine Immunol. 2012;19(11):1870-1878.
- Trelis M, Sanchez-Lopez CM, Sanchez-Palencia LF, Ramirez-Toledo V, Marcilla A, Bernal D. Proteomic Analysis of Extracellular Vesicles from Fasciola hepatica Hatching Eggs and Juveniles in Culture. Front Cell Infect Microbiol. 2022;12:903602.
- Walsh KP, Brady MT, Finlay CM, Boon L, Mills KH. Infection with a helminth parasite attenuates autoimmunity through TGF-beta-mediated suppression of Th17 and Th1 responses. J Immunol. 2009;183(3):1577-1586.
- Flynn RJ, Mulcahy G. The roles of IL-10 and TGF-beta in controlling IL-4 and IFN-gamma production during experimental Fasciola hepatica infection. Int
Parasitol. 2008;38(14):1673-1680. - Donnelly S, O’Neill SM, Sekiya M, Mulcahy G, Dalton JP. Thioredoxin peroxidase secreted by Fasciola hepatica induces the alternative activation of macrophages. Infect Immun. 2005;73(1):166-173.
- Donnelly S, Stack CM, O’Neill SM, Sayed AA, Williams DL, Dalton JP. Helminth 2-Cys peroxiredoxin drives Th2 responses through a mechanism involving alternatively activated macrophages. FASEB J. 2008;22(11):4022-4032.
- Naranjo-Lucena A, Correia CN, Molina-Hernandez V, et al. Transcriptomic Analysis of Ovine Hepatic Lymph Node Following Fasciola hepatica Infection – Inhibition of NK Cell and IgE-Mediated Signaling. Front Immunol. 2021;12:687579.
- Rodriguez E, Noya V, Cervi L, et al. Glycans from Fasciola hepatica Modulate the Host Immune Response and TLR-Induced Maturation of Dendritic Cells. PLoS Negl Trop Dis. 2015;9(12):e0004234.
- Dowling DJ, Hamilton CM, Donnelly S, et al. Major secretory antigens of the helminth Fasciola hepatica activate a suppressive dendritic cell phenotype that attenuates Th17 cells but fails to activate Th2 immune responses. Infect Immun. 2010;78(2):793-801.
- De Marco Verissimo C, Jewhurst HL, Tikhonova IG, et al. Fasciola hepatica serine protease inhibitor family (serpins): purposely crafted for regulating host proteases. PLoS Negl Trop Dis. 2020;14(8):e0008510.
- Donnelly S, Stack CM, O’Neill SM, Sayed AA, Williams DL, Dalton JP. Helminth 2-Cys peroxiredoxin drives responses through a mechanism involving alternatively activated macrophages. FASEB J. 2008;22(11):4022.
- Aron-Said C, Montes M, White AC, Cabada MM. Plasma cytokines during acute human fascioliasis. Parasitol Res. 2021;120(8):2965-2968.
- Frigerio S, da Costa V, Costa M, et al. Eosinophils Control Liver Damage by Modulating Immune Responses Against Fasciola hepatica. Front Immunol. 2020;11:579801.
- Serradell MC, Guasconi L, Cervi L, Chiapello LS, Masih DT. Excretory-secretory products from Fasciola hepatica induce eosinophil apoptosis by a caspase-dependent mechanism. Vet Immunol Immunopathol. 2007;117(3-4):197-208.
- Carmona C, Dowd AJ, Smith AM, Dalton JP. Cathepsin L proteinase secreted by Fasciola hepatica in vitro prevents antibody-mediated eosinophil attachment to newly excysted juveniles. Mol Biochem Parasitol. 1993;62(1):9-17.
- Bramhall M, Zaph C. Mastering gut permeability: new roles for old friends. Eur J Immunol. 2017;47(2):236-239. doi:10.1002/eji.201646842
- Robinson MW, Dalton JP, O’Neill SM, Donnelly SM. Chapter 27: mechanisms of Immune Modulation by Fasciola hepatica: importance for Vaccine Development and for Novel Immunotherapeutics. In: Cr C, editor. Parasitic Helminths: Targets, Screens, Drugs and Vaccines. Wiley Online Library; 2012.
- Cruz AA, Lima F, Sarinho E, et al. Safety of anti-immunoglobulin E therapy with omalizumab in allergic patients at risk of geohelminth infection. Clin Exp Allergy. 2007;37(2):197-207.
- Silva SML, Vindimian M, Wattre P, Capron A. Etude des anticorps IgE dans la distomatose humaine a Fasciola hepatica. [IgE antibodies in human Fasciola hepatica distomiasis] French. Pathol Biol. 1985;33(7):746-750.
- Kita H, Kaneko M, Bartemes KR, et al. Does IgE bind to and activate eosinophils from patients with allergy? J Immunol. 1999;162 (11):6901-6911.
- Hamilton CM, Dowling DJ, Loscher CE, Morphew RM, Brophy PM, O’Neill SM. The Fasciola hepatica tegumental antigen suppresses dendritic cell maturation and function. Infect Immun. 2009;77(6):2488-2498.
- Morrison CA, Colin T, Sexton JL, et al. Protection of cattle against Fasciola hepatica infection by vaccination with glutathione S-transferase. Vaccine. 1996;14(17-18):1603-1612.
- Golden O, Flynn RJ, Read C, et al. Protection of cattle against a natural infection of Fasciola hepatica by vaccination with recombinant cathepsin L1 (rFhCL1). Vaccine. 2010;28(34):5551-5557.
- Zafra R, Buffoni L, Perez-Caballero R, et al. Efficacy of a multivalent vaccine against Fasciola hepatica infection in sheep. Vet Res. 2021;52 (1):13.
- Maggio L, Tirloni L, Uhl M, et al. Serpins in Fasciola hepatica: insights into host-parasite interactions. Int J Parasitol. 2020;50(12):931-943.
- Smith AM, Dowd AJ, Heffernan M, Robertson CD, Dalton JP. Fasciola hepatica: a secreted cathepsin L-like proteinase cleaves host immunoglobulin. Int J Parasitol. 1993;23(8):977-983.
- De Marco Verissimo C, Jewhurst HL, Dobo J, Gal P, Dalton JP, Cwiklinski K. Fasciola hepatica is refractory to complement killing by preventing attachment of mannose binding lectin (MBL) and inhibiting MBL-associated serine proteases (MASPs) with serpins. PLoS Pathog. 2022;18(1):e1010226.
- Guasconi L, Serradell MC, Masih DT, Chiapello LS. Immunomodulatory Effect of Fasciola hepatica Excretory-Secretory Products on Macrophages. In: Fasciola Hepatica: Methods and Protocols. Springer; 2020.
- White MPJ, McManus CM, Maizels RM. Regulatory T-cells in helminth infection: induction, function and therapeutic potential. Immunology. 2020;160(3):248-260.
- Lund ME, O’Brien BA, Hutchinson AT, et al. Secreted proteins from the helminth Fasciola hepatica inhibit the initiation of autoreactive T cell responses and prevent diabetes in the NOD mouse. PLoS One. 2014;9(1):e86289.
- Costa M, da Costa V, Lores P, et al. Macrophage Gal/GalNAc lectin 2 (MGL2)(+) peritoneal antigen presenting cells during Fasciola hepatica infection are essential for regulatory T cell induction. Sci Rep. 2022;12(1):17661.
- Costa M, da Costa V, Frigerio S, et al. Heme-Oxygenase-1 Attenuates Oxidative Functions of Antigen Presenting Cells and Promotes Regulatory T Cell Differentiation during Fasciola hepatica Infection. Antioxidants. 2021;10(12):1322.
- Gironènes N, Valero AM, García-Bodelón MA, et al. Immune Suppression in Advanced Chronic Fascioliasis: an Experimental Study in a Rat Model. J Infectious Dis. 2007;195(10):1504-1512.
- Richter J, Freise S, Mull R, Millan JC. Fascioliasis: sonographic abnormalities of the biliary tract and evolution after treatment with triclabendazole. Trop Med Int Health. 1999;4(11):774-781.
- Oyarzun-Ruiz P, Alvelo C, Vera F, Moroni M. Histopathological findings of Fasciola hepatica infection in non-native European hare (Lepus europaeus) in Southern Chile. Rev Bras Parasitol Vet. 2019;28(1):145-150.
- Matsuda K, Kogame S, Niki H, Saito M, Ishiguro Y, Sano Y. Gross and histological lesions in the livers of sika deer with particular emphasis on fascioliasis. J Vet Med Sci. 2020;82(2):125-134.
- Capucchio MT, Catalano D, Di Marco V, et al. Natural trematode infestation in feral Nebrodi Black pigs: pathological investigations. Vet Parasitol. 2009;159(1):37-42.
- Mpisana Z, Jaja IF, Byaruhanga C, Marufu MC. Body condition scores, fluke intensity, liver pathology, and carcass quality of different dairy cattle genotypes infected with Fasciola species at high throughput abattoirs in South Africa. Parasitol Res. 2022;121(6):1671-1682.
- Winaya IBO, Oka IBM, Adnyana IBW, Sudipa PH. Fibrosis and Collagen-I Accumulation in Bali Cattle Liver Tissue Infected with Fasciola gigantica. Inter J Vet Sc. 2023;12(2):224-229.
- Phiri AM, Phiri IK, Sikasunge CS, Chembensofu M, Monrad J. Comparative fluke burden and pathology in condemned and non-condemned cattle livers from selected abattoirs in Zambia. Onderstepoort J Vet Res. 2006;73(4):275-281.
- Zhang Y, Mei X, Liang Y, et al. Newly excysted juveniles (NEJs) of Fasciola gigantica induce mice liver fibrosis and M2 macrophage-like phenotype in vivo. Microb Pathog. 2020;139:103909.
- Kolodziejczyk L, Laszczynska M, Masiuk M, Grabowska M, Skrzydlewska E. Immunoexpression of intermediate filaments and morphological changes in the liver and bile duct of rats infected with Fasciola hepatica. Biotech Histochem. 2015;90(7):477-485.
- Marcos LA, Terashima A, Yi P, et al. Mechanisms of liver fibrosis associated with experimental Fasciola hepatica infection: roles of Fas2 proteinase and hepatic stellate cell activation. J Parasitol. 2011;97(1):82-87.
- Alvarez Rojas CA, Ansell BR, Hall RS, et al. Transcriptional analysis identifies key genes involved in metabolism, fibrosis/tissue repair and the immune response against Fasciola hepatica in sheep liver. Parasit Vectors. 2015;8:124.
- Almendras-Jaramillo M, Rivera-Medina J, Seijas-Mogrovejo J, Almendras-Jaramillo K. Fascioliasis Hepatica En niños: manifestaciones clinicas poco frecuentes. [Hepatic fascioliasis in children: uncommon clinical manifestations] Spanish. Arq Gastroenterol. 1997;34(4):241-247.
- Marcos LA, Maco V, Castillo M, Terashima A, Zerpa R, Gotuzzo E. Reporte de casos de Fasciolosis humana en el Instituto Especializado de Salud del Nino, Lima, Peru (1988-2003). [Report of cases of human fascioliasis in the Specialized Children’s Health Institute, Lima, Peru (1988′-2003)] Spanish. Rev Gastroenterol Peru. 2005;25(2):198-205.
- Sanchez-Sosa S, Rojas-Ortega S, Reed-San Roman G, Torres-Santana MA. Fasciolosis hepatobiliar masiva. [Massive hepatobiliary fascioliasis] Spanish. Rev Gastroenterol Mex. 2000;65(4):179-183.
- Bestas R, Yalcin K, Cicek M. Cholestasis caused by Fasciola gigantica. Turkiye Parazitol Derg. 2014;38(3):201-204.
- Hosamirudsari H JRY. Fasciola hepatica an Unusual Cause of Chronic Cholecystitis. Int J Infect. 2015;2(2):e23108.
- Guzman Calderon E, Vera Calderon A, Diaz Rios R, Arcana Lopez R, Alva Alva E. Fasciola hepatica in the common bile duct: spyglass visualization and endoscopic extraction. Rev Esp Enferm Dig. 2018;110(10):671-673.
- Gulsen MT, Savas MC, Koruk M, Kadayifci A, Demirci F. Fascioliasis: a report of five cases presenting with common bile duct obstruction. Neth J Med. 2006;64(1):17-19.
- Dolay K, Hasbahceci M, Hatipoglu E, Umit Malya F, Akcakaya A. Endoscopic diagnosis and treatment of biliary obstruction due to acute cholangitis and acute pancreatitis secondary to Fasciola hepatica infection. Ulus Travma Acil Cerrahi Derg. 2018;24(1):71-73.
- Ha JS, Choi HJ, Moon JH, et al. Endoscopic Extraction of Biliary Fascioliasis Diagnosed Using Intraductal Ultrasonography in a Patient with Acute Cholangitis. Clin Endosc. 2015;48(6):579-582.
- Veerappan A, Siegel JH, Podany J, Prudente R, Gelb A. Fasciola hepatica pancreatitis: endoscopic extraction of live parasites. Gastrointest Endosc. 1991;37(4):473-475.
- Dzib Calan EA, Larracilla Salazar I, Morales Perez JI. A giant liver abscess due to Fasciola hepatica infection. Rev Esp Enferm Dig. 2019 ; 111 (10):815-816.
- Losada H, Hirsch M, Guzman P, Fonseca F, Hofmann E, Alanis M. Fascioliasis simulating an intrahepatic cholangiocarcinoma-Case report with imaging and pathology correlation. Hepatobiliary Surg Nutr. 2015;4(1).
- Wang H, Itoh S, Matsumoto Y, et al. Surgically resected hepatic mass caused by fascioliasis. Clin J Gastroenterol. 2021;14(2):662-667.
- Yen TJ, Hsiao CH, Hu RH, Liu KL, Chen CH. Education and imaging: hepatobiliary and pancreatic: chronic hepatic abscess associated with fascioliasis. J Gastroenterol Hepatol. 2011;26(3):611.
- Sripa B, Kanla P, Sinawat P, Haswell-Elkins MR. Opisthorchiasis-associated biliary stones: light and scanning electron microscopic study. World J Gastroenterol. 2004;10(22):3318-3321.
- Pfeifer CM, Bourm KS, Brandt MR, Ali K. Liver fluke-induced choledocholithiasis with biliary ductal obstruction. Radiol Case Rep. 2019;14 (12):1483-1486.
- Lefryekh R, Bensaad A, Bensardi F, et al. Hepatic fascioliasis presenting with bile duct obstruction: a case report. Pan Afr Med J. 2017;28:44.
- Brahmbhatt NN, Kumar B, Thakre BJ, Bilwal AK. Haemato-biochemical characterization of fasciolosis in Gir cattle and Jaffrabadi buffaloes. J Parasit Dis. 2021;45(3):683-688.
- Javaregowda AK, Rani KB. Chronic bovine fasciolosis associated cholangiolithiasis: a case report. J Parasit Dis. 2017;41(1):90-92.
- Valero MA, Santana M, Morales M, Hernandez JL, Mas-Coma S. Risk of gallstone disease in advanced chronic phase of fascioliasis: an experimental study in a rat model. J Infect Dis. 2003;188(5):787-793.
- Valero MA, Varea MT, Marin R. Fasciola hepatica: lithogenic capacity in experimentally infested rats and chemical determination of the main stone components. Parasitol Res. 2000;86(7):558-562.
- Cetta F. The role of bacteria in pigment gallstone disease. Ann Surg. 1991;213(4):315-326.
- Binda C, Gibiino G, Coluccio C, et al. Biliary Diseases from the Microbiome Perspective: how Microorganisms Could Change the Approach to Benign and Malignant Diseases. Microorganisms. 2022;10(2):312.
- Stewart L, Grifiss JM, Jarvis GA, Way LW. Biliary bacterial factors determine the path of gallstone formation. Am J Surg. 2006;192 (5):598-603.
- Dan WY, Yang YS, Peng LH, Sun G, Wang ZK. Gastrointestinal microbiome and cholelithiasis: current status and perspectives. World J Gastroenterol. 2023;29(10):1589-1601.
- Ramirez AL, Herrera G, Munoz M, et al. Describing the intestinal microbiota of Holstein Fasciola-positive and -negative cattle from a hyperendemic area of fascioliasis in central Colombia. PLoS Negl Trop Dis. 2021;15(8):45.
- Humans IWGotEoCRt. Biological agents. IARC Monogr Eval Carcinog Risks Hum. 2012;100(Pt B).
- Liau MYQ, Toh EQ, Shelat VG. Opisthorchis viverrini-Current Understanding of the Neglected Hepatobiliary Parasite. Pathogens. 2023;12 (6):56.
- Salazar M, Ituarte C, Abriata MG, Santoro F, Arroyo G. Gallbladder cancer in South America: epidemiology and prevention. Chin Clin Oncol. 2019;8(4):32.
- Machicado C, Marcos LA, Zimic M. Hypothetical granulin-like molecule from Fasciola hepatica identified by bioinformatics analysis. Springerplus. 2016;5(1):773.
- Vale N, Gouveia MJ, Gartner F, Brindley PJ. Oxysterols of helminth parasites and pathogenesis of foodborne hepatic trematodiasis caused by Opisthorchis and Fasciola species. Parasitol Res. 2020;119(5):1443-1453.
- Bottari NB, Mendes RE, Baldissera MD, et al. Relation between iron metabolism and antioxidants enzymes and delta-ALA-D activity in rats experimentally infected by Fasciola hepatica. Exp Parasitol. 2016;165:58-63.
- Swain B, Otta S, Sahu MK, Uthansingh K. Fasciola hepatica association with gallbladder malignancy: a rare case report. Trop Parasitol. 2021;11(1):42-45.
- Lopez M, White AC Jr, Cabada MM. Burden of Fasciola hepatica Infection among children from Paucartambo in Cusco, Peru. Am J Trop Med Hyg. 2012;86(3):481-485.
- Stuen S, Ersdal C. Fasciolosis-An Increasing Challenge in the Sheep Industry. Animals. 2022;12(12).
- Wong RK, Peura DA, Mutter ML, Heit HA, Birns MT, Johnson LF. Hemobilia and liver flukes in a patient from Thailand. Gastroenterology. 1985;88(6):1958-1963.
- Bahcecioglu IH, Ataseven H, Aygen E, Coskun S, Kuzu N, Ilhan F. Fasciola hepatica case with hemobilia. Acta Medica. 2007;50(2):155-156.
- Acuna-Soto R, Braun-Roth G. Bleeding ulcer in the common bile duct due to Fasciola hepatica. Am J Gastroenterol. 1987;82(6):560-562.
- Leon M, Alave J, Alvarado R, Gotuzzo E, Terashima A, Seas C. A 52 -year-old woman with a subcapsular liver hematoma. Clin Infect Dis. 2011;52(9):1137, 1195-6.
- Loja Oropeza D, Alvizuri Escobedo J, Vilca Vasquez M, Aviles Gonzaga R, Sanchez Mercado M. Hematoma hepatico subcapsular por Fasciola. [Hepatic subcapsular hematoma caused by fascioliasis] Spanish. Rev Gastroenterol Peru. 2003;23(2):142-148.
- Montembault S, Serfaty L, Poirot JL, Wendum D, Penna C, Poupon R. Ascite hemorragique revelant une infection massive a Fasciola hepatica. [Hemorrhagic ascites disclosing massive Fasciola hepatica infection] French. Gastroenterol Clin Biol. 1997;21(10):785-788.
- Sukhdeo MV, Sangster NC, Mettrick DF. Permanent feeding sites of adult Fasciola hepatica in rabbits? Int J Parasitol. 1988;18(4):509-512.
- Valero MA, Girones N, Garcia-Bodelon MA, et al. Anaemia in advanced chronic fasciolosis. Acta Trop. 2008;108(1):35-43.
- Lotfollahzadeh S, Mohri M, Bahadori Sh R, Dezfouly MR, Tajik P. The relationship between normocytic, hypochromic anaemia and iron concentration together with hepatic enzyme activities in cattle infected with Fasciola hepatica. J Helminthol. 2008;82(1):85-88.
- Shrimali RG, Patel MD, Patel RM. Comparative efficacy of anthelmintics and their effects on hemato-biochemical changes in fasciolosis of goats of South Gujarat. Vet World. 2016;9(5):524-529.
- El-Shazly AM, El-Nahas HA, Abdel-Mageed AA, et al. Human fascioliasis and anaemia in Dakahlia Governorate, Egypt. J Egypt Soc Parasitol. 2005;35(2):421-432.
- Valero MA, Perez-Crespo I, Chillon-Marinas C, et al. Fasciola hepatica reinfection potentiates a mixed Th1/Th2/Th17/Treg response and correlates with the clinical phenotypes of anemia. PLoS One. 2017;12(3).
- Rashid M, Zahra N, Chudhary A, et al. Cost-benefit ratio of anthelmintic treatment and its comparative efficacy in commercial dairy farms. Front Vet Sci. 2022;9:1047497.
- Karahocagil MK, Akdeniz H, Sunnetcioglu M, et al. A familial outbreak of fascioliasis in Eastern Anatolia: a report with review of literature. Acta Trop. 2011;118(3):177-183.
