DOI: https://doi.org/10.1186/s12951-024-03054-7
PMID: https://pubmed.ncbi.nlm.nih.gov/39815246
تاريخ النشر: 2025-01-15
تحسين النشاط المضاد للأكسدة المعتمد على تأثير الحجم لجزيئات السيلينيوم النانوية التي تنظم مسارات Anti-PI3K-mTOR و Ras-MEK لعلاج إصابة الحبل الشوكي لتجنب قمع المناعة الناتج عن صدمة الهرمونات
الملخص
إصابة الحبل الشوكي (SCI) هي حالة حرجة تؤثر على الجهاز العصبي المركزي وغالبًا ما تكون لها عواقب دائمة ومعوقة، بما في ذلك الإصابات الثانوية. تعتبر الأضرار التأكسدية والالتهاب عوامل حاسمة في العمليات المرضية الثانوية. لقد أظهرت جزيئات السيلينيوم النانوية خصائص مضادة للأكسدة ومضادة للالتهابات بشكل كبير عبر مسار غير مثبط للمناعة؛ ومع ذلك، كانت تطبيقاتها السريرية محدودة بسبب عدم استقرارها ووظيفتها غير الكافية لعبور حاجز الدم-الحبل الشوكي (BSCB). اقترحت هذه الدراسة طريقة تخليق لجزيئات السيلينيوم النانوية ذات القطر الصغير للغاية (LNT-UsSeNPs) مع قدرات كبيرة في التخلص من أنواع الأكسجين التفاعلية (ROS) مقارنة بجزيئات السيلينيوم النانوية التقليدية (LNT-SeNPs). هذه المركبات حمت خلايا PC-12 بشكل فعال من السمية الناتجة عن الإجهاد التأكسدي، وقللت من خلل الميتوكوندريا، وخفضت من موت الخلايا. أظهرت الدراسات الحية أن LNT-UsSeNPs اخترقت BSCB بكفاءة وكبحت بشكل فعال موت خلايا الحبل الشوكي. في النهاية، نظمت LNT-UsSeNPs مباشرة مسارات الإشارة PI3K-AKT-mTOR و Ras-Raf-MEK-ERK عن طريق تنظيم السيلينوبروتينات لتحقيق علاج مضاد للالتهابات غير مثبط للمناعة. نظرًا لصغر حجمها للغاية، أظهرت LNT-UsSeNPs اختراقًا قويًا للحاجز الشوكي وتأثيرات مضادة للأكسدة ومضادة للالتهابات قوية دون المساس بوظيفة المناعة. تشير هذه النتائج إلى أن LNT-UsSeNPs هي مرشحة واعدة لمزيد من التطوير في النانوميدicine لعلاج فعال لإصابة الحبل الشوكي.
*المراسلة:
تيانفينغ تشين
tchentf@jnu.edu.cn
يي تشين
qinyi0225@163.com
القائمة الكاملة لمعلومات المؤلف متاحة في نهاية المقالة
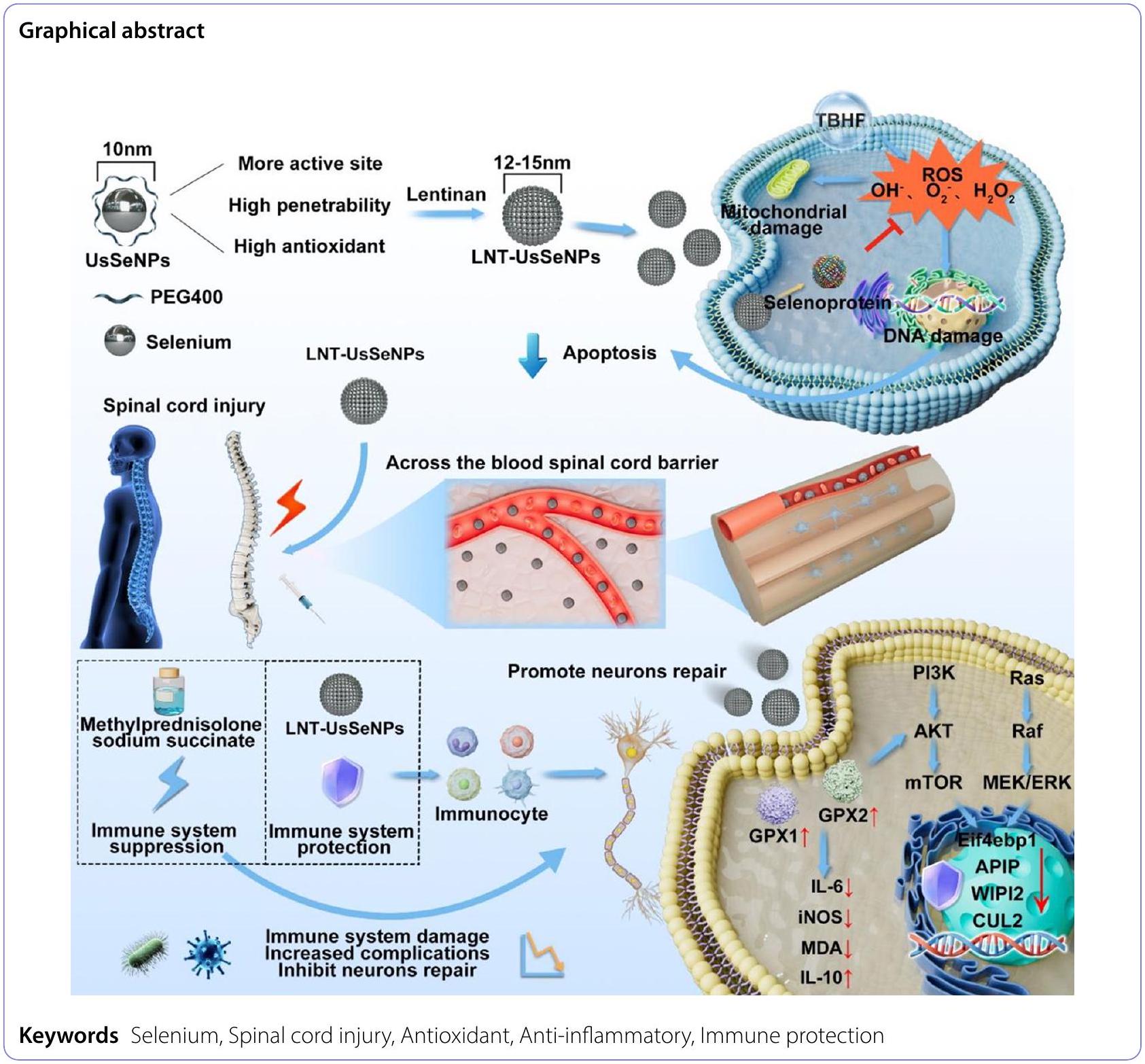
المقدمة
قطع ناتج عن ضغط ميكانيكي فوري أو مستمر أو سحب على الحبل الشوكي [4-8]. الإصابة الثانوية هي استجابة الجسم والخلايا للإصابة الأولية وتنطوي على تغييرات معقدة في الجهاز المناعي، والجهاز العصبي، والدورة الدموية. تشمل هذه التغييرات نقص تروية الحبل الشوكي، موت الخلايا العصبية، الإجهاد التأكسدي، الاستجابات الالتهابية، موت الخلايا العصبية، إزالة الميالين المحوري، وتكوين ندبات دهنية. الإصابة الثانوية هي عامل رئيسي يؤدي إلى خلل في الحبل الشوكي ويعيق الشفاء، حيث تلعب الالتهابات والإجهاد التأكسدي أدوارًا حاسمة في هذه العملية. أظهرت العديد من الدراسات أن الإجهاد التأكسدي حاسم لظهور وتقدم SCI. ينتج الإجهاد التأكسدي في موقع الإصابة عن عدم التوازن بين إنتاج وحياد ROS، والذي يشمل
جزيئات الأكسجين التفاعلية مثل
حاليًا، تستخدم الأساليب السريرية بشكل أساسي الجلوكوكورتيكويدات، مثل ميثيل بريدنيزولون (MP)، لتثبيط إنتاج عوامل الالتهاب بعد SCI، ومنع موت الخلايا العصبية الثانوية، وتثبيط أكسدة الدهون لتقليل إنتاج ROS وتخفيف الوذمة [17، 18]. ومع ذلك، يمكن أن تسبب العلاجات الهرمونية عالية الجرعة اضطرابات في الجهاز المناعي وزيادة خطر العدوى ومضاعفات أخرى، مما يؤثر على شفاء المرضى. مع التقدم التكنولوجي الأخير، تم دراسة المواد النانوية بشكل مكثف في تطبيقات علاج الأمراض وقد أظهرت باستمرار فعالية كبيرة. خاصة في النانوميدicine، غالبًا ما تظهر الجزيئات النانوية تأثيرات تحفيزية عالية نظرًا لأحجام جزيئاتها الفريدة ومواقعها النشطة الغنية على السطح. لذلك، أصبح تطوير النانوميدicine ذات الحجم الصغير والنشاط التحفيزي العالي هدفًا للعلماء. السيلينيوم (Se)، عنصر تتبع غير معدني أساسي في البشر والحيوانات، يلعب دورًا حيويًا في الحفاظ على الصحة. لديه سلامة حيوية عالية وتوافق. كعنصر رئيسي في نظام مضادات الأكسدة في الجسم، يشارك Se في تخليق البروتينات المحتوية على Se، من بينها إنزيم الجلوتاثيون بيروكسيداز (GPX) وإنزيم ثيوريدوكسين ريدوكتاز (
وتحرير عوامل الالتهاب بعد SCI، مما يقلل بشكل كبير من مستويات التعبير عن مجموعة متنوعة من علامات الإجهاد التأكسدي، مثل سوبر أكسيد ديسموتاز (SOD) ومالونديالديهايد (MDA). كما يقلل Se من موت الخلايا العصبية من خلال مسارات تشمل Bax وBcl-2 وcaspase-3 [22]. بالإضافة إلى ذلك، يمكن أن يؤدي مكمل Se إلى استقطاب البلعميات إلى النوع M2 مما يؤدي إلى تقليل التعبير عن إنترلوكين 6 (IL-6) وإنزيم أكسيد النيتريك المحفز (iNOS) وعامل نخر الورم
بعض الأدبيات أفادت بتعديل الببتيدات عبر الغشاء، وتحسين الذوبان في الدهون، والتحكم في حجم الجسيمات، مما يعزز اختراق الحاجز للأدوية النانوية. وبالتالي، تم إعداد جزيئات السيلينيوم فائقة الصغر لاختراق BSCB بشكل أفضل، والتجمع بفعالية في موقع الإصابة، وتحسين فعالية علاج إصابة الحبل الشوكي بشكل كبير. على الرغم من أن الحجم الفائق الصغر يسمح لجزيئات السيلينيوم النانوية باختراق BSCB بشكل أفضل، إلا أنه يقدم مشاكل جديدة، مثل عمر نصف قصير واستقرار ضعيف. تظهر بوليسكريات اللنتينان (LNT) توافقًا حيويًا ممتازًا وتمتلك بنية جزيئية غنية بالهيدروكسيل ومجموعات وظيفية أخرى. تتفاعل هذه المجموعات مع أسطح الأدوية النانوية لتشكيل روابط كيميائية مستقرة أو طبقات امتصاص فيزيائية. تمنع هذه التفاعلات تجمع الأدوية النانوية في المحاليل المائية أو البيئات الفسيولوجية، مما يعزز قابلية تشتتها واستقرارها. هنا، قمنا بإعداد نظام نانوي قائم على السيلينيوم فائق الصغر مع تعديل LNT (LNT-UsSeNPs) لتحقيق اختراق عالي لـ BSCB وثبات حيوي مناسب.
النتائج والمناقشة
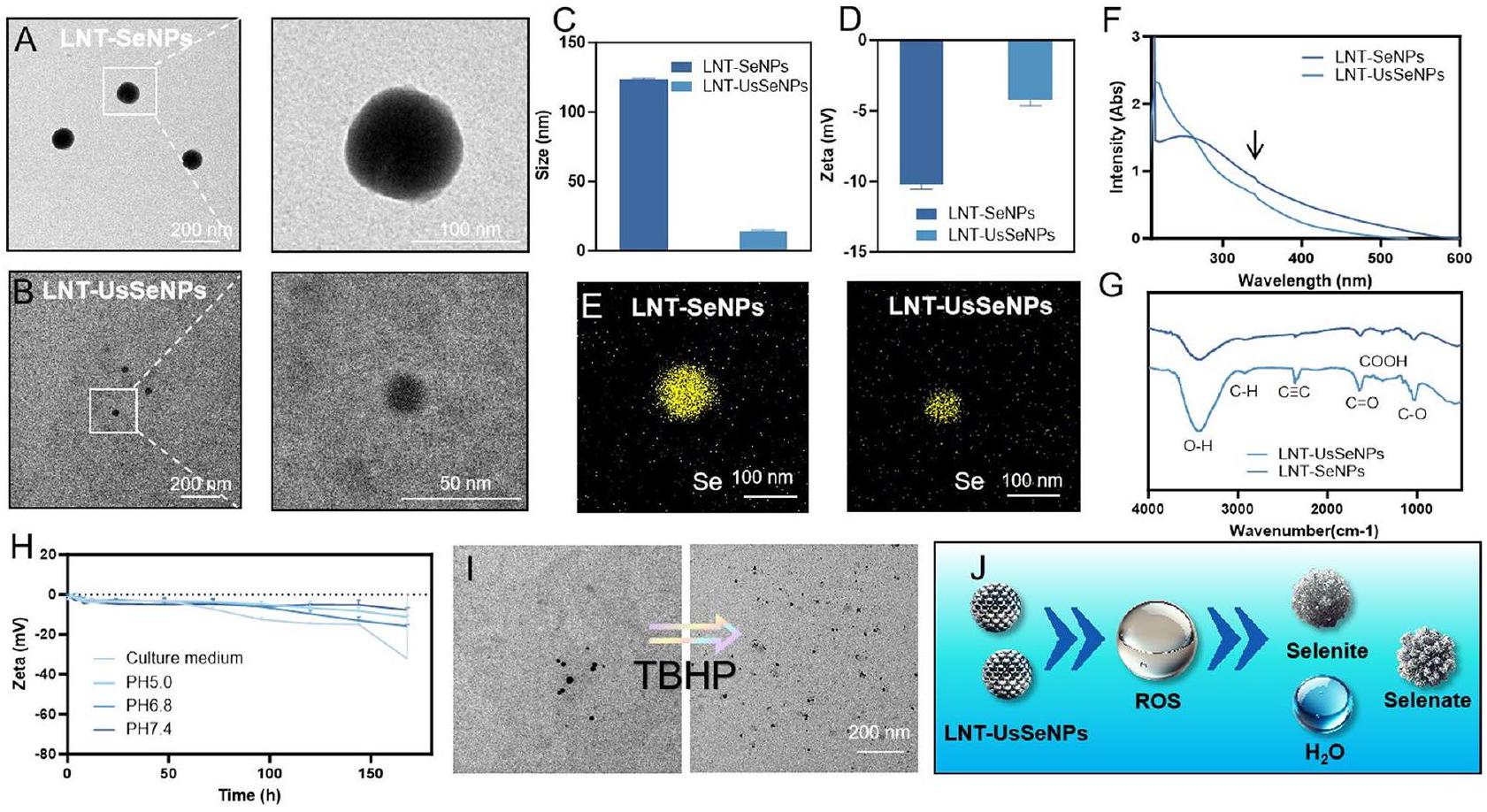
تصميم وتخليق LNT-UsSeNPs
تقييم قدرة إزالة ROS لـ LNT-UsSeNPs
تمت دراسة تأثيرات إزالة الجذور الحرة ( ⋅ OH) لـ LNT-SeNPs وLNT-UsSeNPs بشكل أكبر باستخدام مطياف الرنين المغناطيسي الإلكتروني (EPR) (الشكل 2B). تم توليد ⋅ OH بواسطة نظام
تأثيرات استنزاف الجذور الحرة وتأثيرات الحماية لـ LNTUsSeNPs على إصابة الإجهاد التأكسدي في خلايا PC-12
قمنا أيضًا بتحليل محتوى السيلينيوم في خلايا PC-12 في نقاط زمنية مختلفة بعد الإدارة باستخدام مطيافية الكتلة مع البلازما المقترنة بالحث (ICP-MS). كما هو موضح في الشكل 2E، وصلت تركيزات السيلينيوم داخل الخلايا لمجموعتي LNT-SeNPs و LNT-UsSeNPs إلى مستوى أعلى بعد الحضانة لمدة ساعتين، مما يشير إلى أن LNT-SeNPs و LNT-UsSeNPs كان لهما قدرة أفضل على حماية خلايا PC-12 بعد الإدارة المسبقة لمدة ساعتين. وبالتالي، أظهر اختبار CCK-8 أن التعرض لـ
تم تقييم توقف دورة الخلية والموت الخلوي لاستكشاف الآليات الوقائية المحتملة لـ LNTSeNPs و LNT-UsSeNPs على خلايا PC-12، وهي الآليات الأساسية التي من خلالها يؤثر الإجهاد التأكسدي على نمو الخلايا ويؤدي إلى موت الخلايا [33]. جهد غشاء الميتوكوندريا (
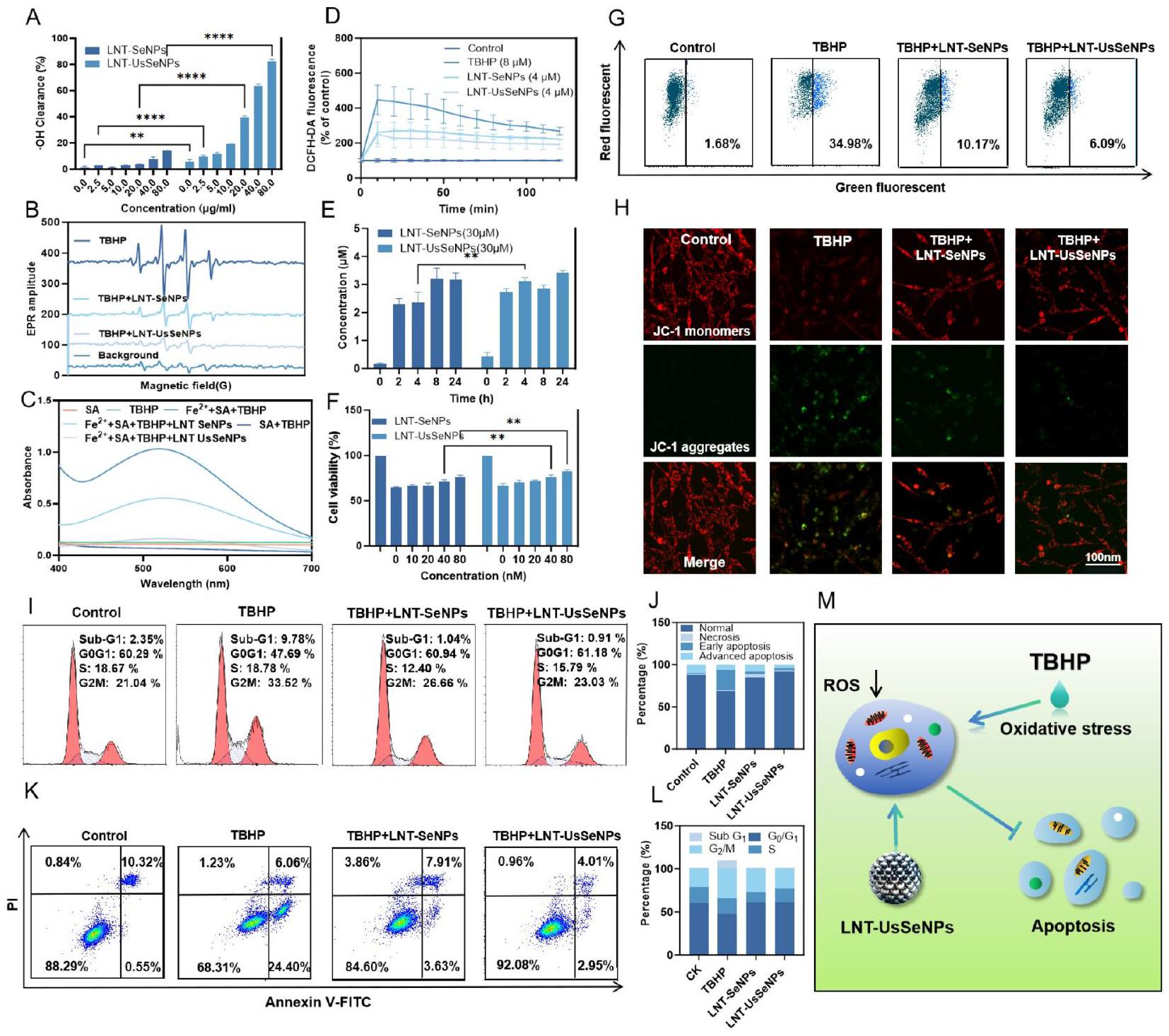
أكدت صور الفلورية هذه النتائج، حيث أظهرت أن LNT-UsSeNPs عكست تأثير TBHP المسبب
انخفاض في نسبة الفلورية الحمراء إلى الخضراء (الشكل 2H). وبالتالي، فإن LNT-UsSeNPs خفضت بشكل فعال تلف الخلايا الناتج عن TBHP. بالإضافة إلى ذلك، أظهرت تحليل دورة الخلية (الشكل 2I وJ) أن معالجة TBHP زادت بشكل كبير من احتجاز الخلايا في مرحلة S في خلايا PC-12. وقد زادت مرحلة Sub-G1 من 2.35 إلى
تخفيف فعّال لزيادة مرحلة Sub-G1 الناتجة عن TBHP (من 9.78 إلى
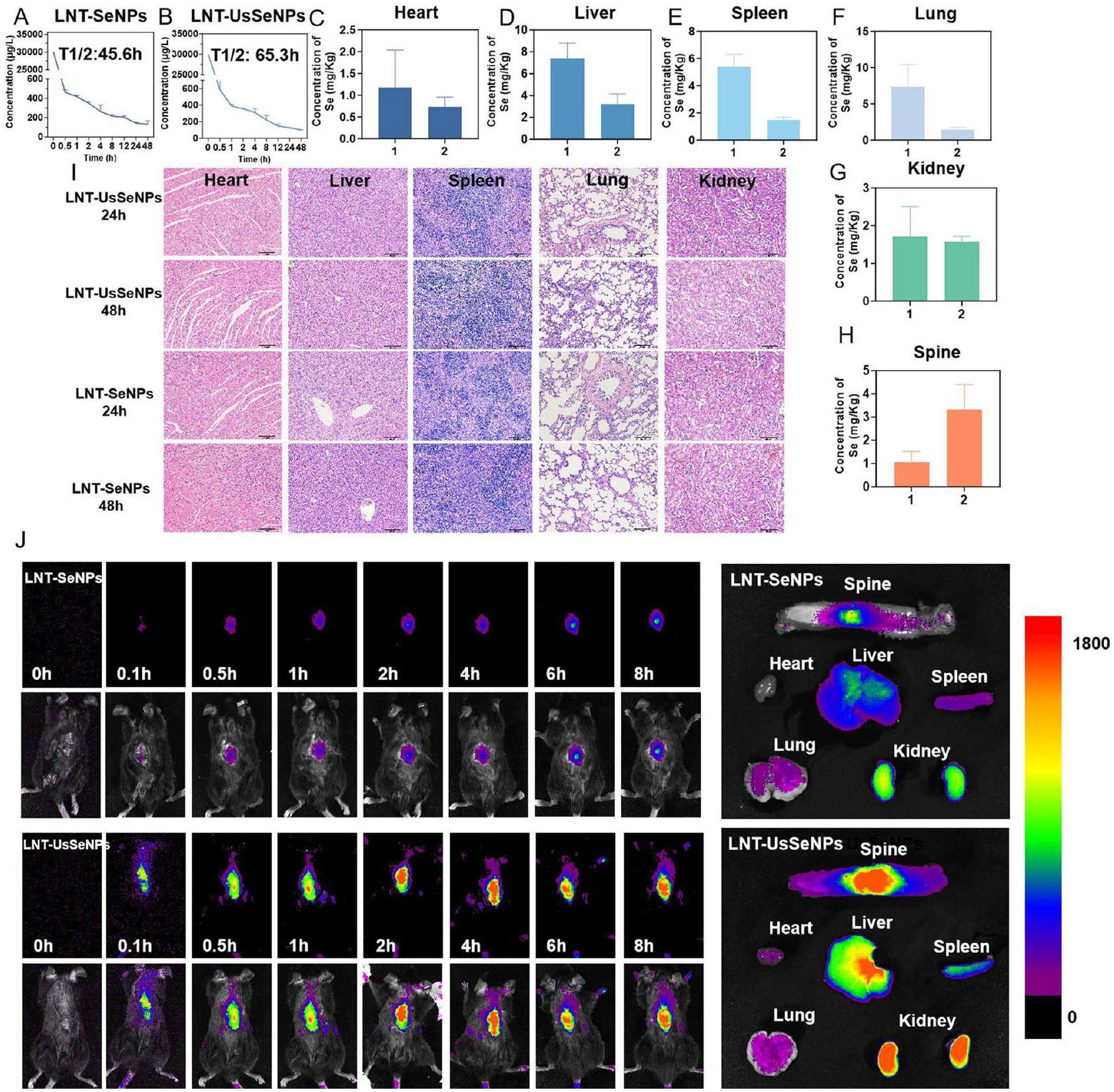
التقييم الأيضي وسلامة الاستخدام لـ LNT-SeNPs و LNTUsSeNPs
لتقييم السمية الحية للجزيئات النانوية، أجرينا فحوصات نسيجية باستخدام صبغة الهيماتوكسيلين والإيوزين (H&E) لشرائح من الأعضاء الرئيسية بعد الحقن. أظهرت النتائج في الشكل 3I عدم وجود ضرر نسيجي كبير للأعضاء الرئيسية، مما يؤكد السلامة الحيوية الكافية لـ LNT-SeNPs و LNT-UsSeNPs ضمن نطاق الجرعة المعطاة.
علاوة على ذلك، استكشفنا كفاءة التوزيع ومعالجة LNT-UsSeNPs في الجسم الحي. بعد حقن الجزيئات النانوية السيلينيوم المعلّمة بالفلوريسنت،
كانت شدة الفلورسنت في موقع SCI في مجموعة LNTUsSeNPs أعلى بشكل ملحوظ في نقاط زمنية مختلفة مقارنة بمجموعة LNT-SeNPs، كما لوحظ في صور الفلورسنت للأحشاء الفأرية. علاوة على ذلك، أظهرت صور مجموعة LNT-UsSeNPs شدة فلورسنت أعلى بشكل ملحوظ في موقع SCI مقارنة بمجموعة LNT-SeNPs، مع ملاحظات لشدة نسبية عالية أيضًا في الكبد والطحال والكلى (الشكل 3J). تشير هذه النتائج إلى أن LNT-UsSeNPs يمكن أن تعبر بشكل أكثر فعالية عن BSCB من خلال الدورة الدموية للوصول إلى موقع SCI في الفئران، مما يحقق تركيز دوائي محلي فعال علاجياً قد يسهل العلاج اللاحق لـ SCI.
تحسين الوظيفة الحركية وبقاء الخلايا العصبية في الفئران المصابة بـ SCI عند العلاج بـ LNT-SeNPs و LNTUsSeNPs
أدى التحقيق الإضافي في حركة الأطراف الخلفية للفأر أثناء المشي إلى تقسيم الحركات إلى سلسلة من المراحل – الوقوف، الدفع، الرفع، التأرجح، والوقوف – لإكمال دورة واحدة، كما هو موضح في الشكل 4D. أظهرت مجموعة SCI شلل الأطراف الخلفية وسحبًا مستمرًا. في المقابل، أظهرت الفئران المعالجة بـ LNT-UsSeNPs تحسينات ملحوظة، مثل استعادة وضعية الوقوف (قدرة الوقوف)، وزيادة دعم الوزن، كما يتضح من زيادة ارتفاع قمة الحوض، ونطاق موسع من حركة المفاصل، مما يسهل حركات الدفع والتأرجح الفعالة.
آثار LNT-SeNPs و LNT-UsSeNPs على علم الأمراض النسيجية للحبل الشوكي وبقاء الخلايا العصبية
(الشكل 4F). (عدد الخلايا العصبية: وهمية: 9؛ SCI: 4؛ LNT-SeNPs: 7؛ LNT-UsSeNPs: 8) قيّمت صبغة المناعية المزدوجة تعبير بروتين نوى الخلايا العصبية (Neun)، الذي يعد مهمًا لتوليد المشابك وتوازن الدوائر العصبية، و
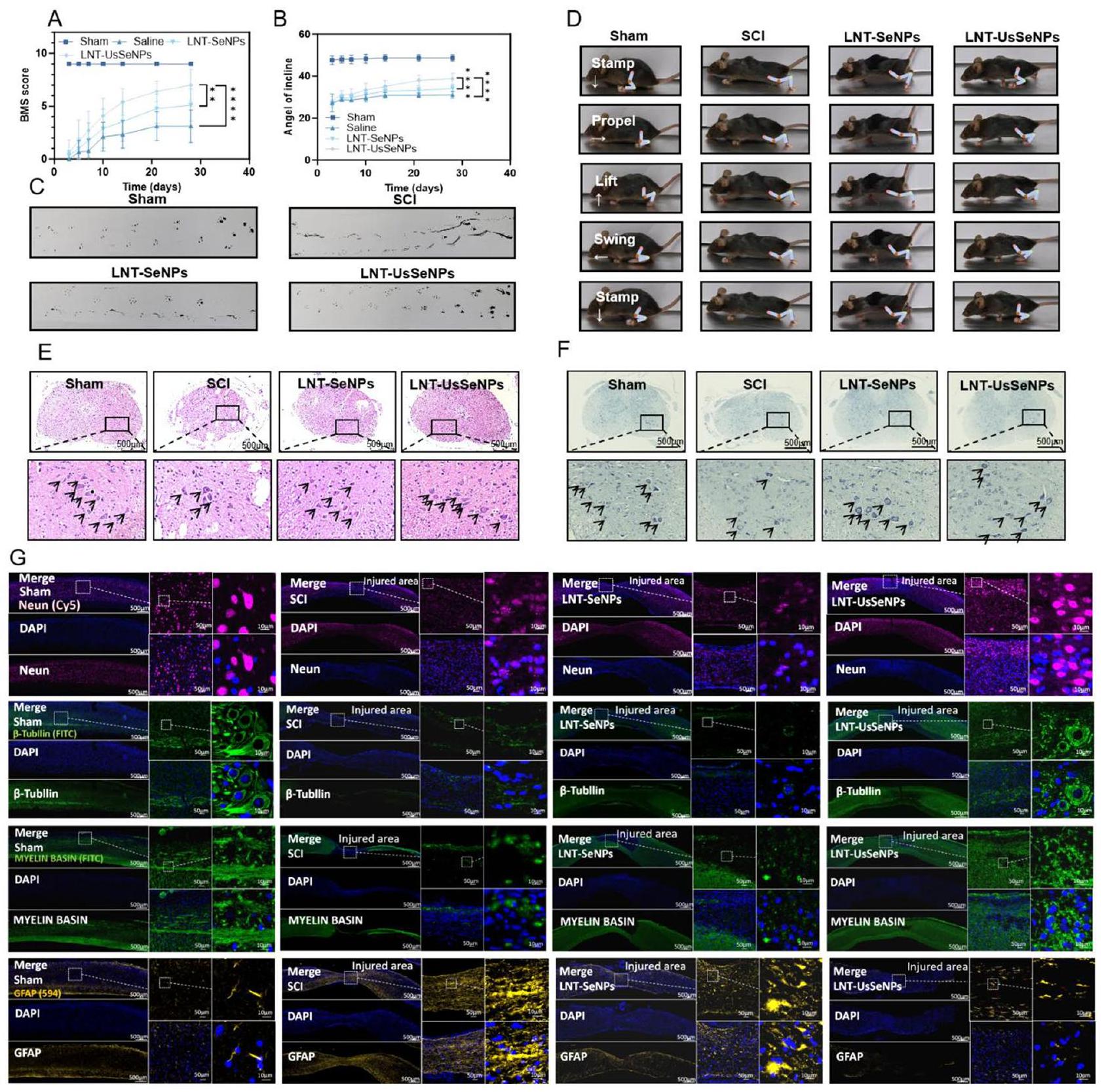
(GFAP) لتحليل استجابات الخلايا الدبقية بعد الإصابة [38]. عادةً ما يؤدي SCI إلى تحفيز الخلايا الدبقية لإنتاج GFAP، مما يؤدي إلى تكوين ندبة دبقية تعيق تجديد الخلايا العصبية. أظهرت صبغة GFAP أن تعبير GFAP كان أقل بكثير في مجموعة LNT-UsSeNPs، مما يشير إلى انخفاض الإجهاد التأكسدي، الالتهاب، وتكوين ندبات دبقية أقل. مجتمعة، تؤكد هذه النتائج
أن LNT-UsSeNPs توفر تأثيرات واقية عصبية، وتثبط إزالة المايلين المحوري، وتقلل من تكوين الندبات الدبقية في الجسم الحي، مما يوفر فوائد علاجية كبيرة لعلاج SCI.
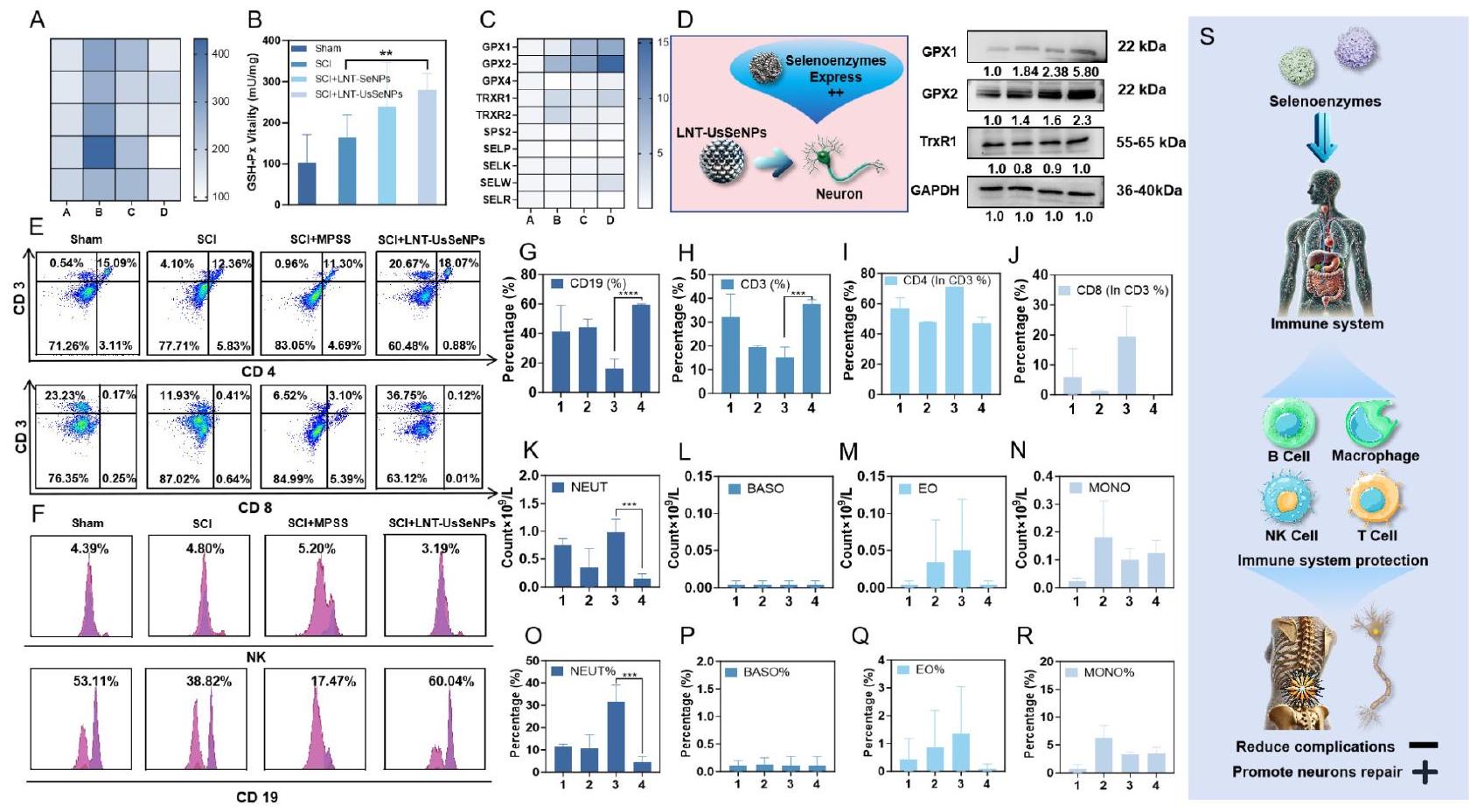
تنظم LNT-UsSeNPs السيلينوزيمات لتخفيف
MDA، وهو منتج ثانوي لعملية أكسدة الدهون، يعمل كعلامة حيوية للإجهاد التأكسدي ويكون شائعًا في الحبل الشوكي الغني بالدهون، حيث من المحتمل أن تحدث أكسدة الدهون بعد الإصابة [39]. لذلك، قمنا بتقييم محتوى MDA في الحبل الشوكي، ووجدنا أنه انخفض بشكل ملحوظ في مجموعة LNT-UsSeNPs مقارنة بمجموعة SCI (الشكل 5A). تظهر هذه النتائج أن LNT-UsSeNPs تظهر قدرة مضادة للأكسدة تفوق LNT-SeNPs، بما يتماشى مع الدراسات السابقة المضادة للأكسدة في المختبر.
يحتوي جسم الإنسان على ما لا يقل عن 25 بروتينًا يحتوي على السيلينيوم، يعمل العديد منها كإنزيمات مضادة للأكسدة تساهم في تخفيف الأضرار الناتجة عن الإجهاد التأكسدي [40، 41]. لذلك، قمنا بتقييم تعبير mRNA للبروتين السيلينوزيم المضاد للأكسدة مثل الجلوتاثيون
البيروكسي داز (GSH-Px)، TrxR، السيلينوبروتين K (SelK)، والسيلينوبروتين T (SelT). كما هو موضح في الشكل 5B، فإن العلاج بكل من LNT-SeNPs وLNT-UsSeNPs زاد بشكل كبير من نشاط GSH-Px، حيث أظهرت LNT-UsSeNPs نشاطًا أعلى بشكل ملحوظ من LNT-SeNPs. علاوة على ذلك، قمنا بالتحقيق في تأثير LNT-UsSeNPs على التعبير عن السيلينوبروتينات المضادة للأكسدة باستخدام تحليل qPCR وتحليل Western blot. أظهرت نتائج qPCR (الشكل 5C) أن العلاج بـ LNT-UsSeNPs زاد بشكل كبير من التعبير عن mRNA لـ GPX1 وGPX2 وSelW وTrxR1 مقارنة بمجموعة SCI. وأكد تحليل Western blot اللاحق أن LNT-UsSeNPs زادت من التعبير عن GPX1 وGPX2 وTrxR1 في أنسجة الحبل الشوكي. تشير هذه النتائج إلى أن LNT-UsSeNPs تخفف من الإجهاد التأكسدي الناتج عن إصابة الحبل الشوكي عن طريق تنظيم السيلينوبروتينات المضادة للأكسدة، مما يؤدي إلى تأثيرات وقائية عصبية في الفئران المصابة بإصابة الحبل الشوكي. كما أكدت نتائج Western blot نتائج qPCR (الشكل 5D).
العلاج السريري الشائع لإصابة الحبل الشوكي يتضمن العلاج بجرعات عالية من الكورتيكوستيرويدات، وبشكل خاص مع ميثيل بريدنيزولون صوديوم سكسينات (MPSS)، الذي يثبط وظيفة المناعة على الرغم من فوائده المضادة للالتهابات ومضادات الأكسدة. يمكن أن يؤدي هذا التثبيط إلى
تؤثر LNT-UsSeNPs بشكل مضاد للأكسدة ومضاد للالتهابات لتثبيط موت الخلايا العصبية عبر مسارات PI3K-AKT-mTOR-elF4EBP1 و Ras-Raf-MEK-WIPI2
تحليل إثراء البيانات البروتينية TMT حدد البروتينات المعبر عنها بشكل مختلف بين مجموعتي LNTUsSeNPs و SCI التي كانت لها أهمية بيولوجية كبيرة (الشكل 6A). أشار تحليل الموقع الفرعي الخلوي إلى أن الغالبية العظمى من هذه البروتينات المعبر عنها بشكل مختلف كانت موجودة بشكل أساسي في السيتوبلازم، والمصفوفة خارج الخلوية، والنواة، مما يشير إلى أنها تلعب أدوارًا حاسمة في مختلف أقسام الخلية (الشكل 6B). حدد تحليل مخطط البركان عددًا من البروتينات ذات التعبير المختلف بشكل كبير (الشكل 6C)، مما يسلط الضوء على الآليات الجزيئية المحتملة التي تكمن وراء تأثيرات LNT-UsSeNPs. باستخدام تحليل إثراء مسار موسوعة كيوتو للجينات والجينومات (KEGG)، قمنا بتعليق وظائف البروتينات التي أظهرت تعبيرًا متغيرًا وأجرينا تحليلًا مقارنًا للتمييز بين تلك التي تم تنظيمها لأعلى وتلك التي تم تنظيمها لأسفل (الشكل 6D و F). أظهرت النتائج أن LNT-UsSeNPs زادت بشكل كبير من تنظيم البروتينات الرئيسية في مسارات الإشارات PI3K-AKT-mTOR و Ras-Raf-MEK-ERK، مما يعزز نمو الخلايا، وتكاثرها، وتمايزها. بعد إصابة الحبل الشوكي، تساهم الإجهاد التأكسدي والالتهاب بشكل كبير في الضرر الثانوي، وإصابة الخلايا العصبية، وفقدان الوظيفة. تعتبر مسارات PI3K-AKT-mTOR و Ras-Raf-MEK-ERK حاسمة في التخفيف من الإجهاد التأكسدي والالتهاب. يعزز مسار PI3K-AKT-mTOR إصلاح الأعصاب من خلال تنظيم بقاء الخلايا وكبح الإجهاد التأكسدي والالتهاب. تنشيط AKT يقلل من الجذور الحرة من خلال زيادة تنظيم الإنزيمات المضادة للأكسدة مثل SOD، بينما يكبح أيضًا إطلاق العوامل الالتهابية مثل TNF-
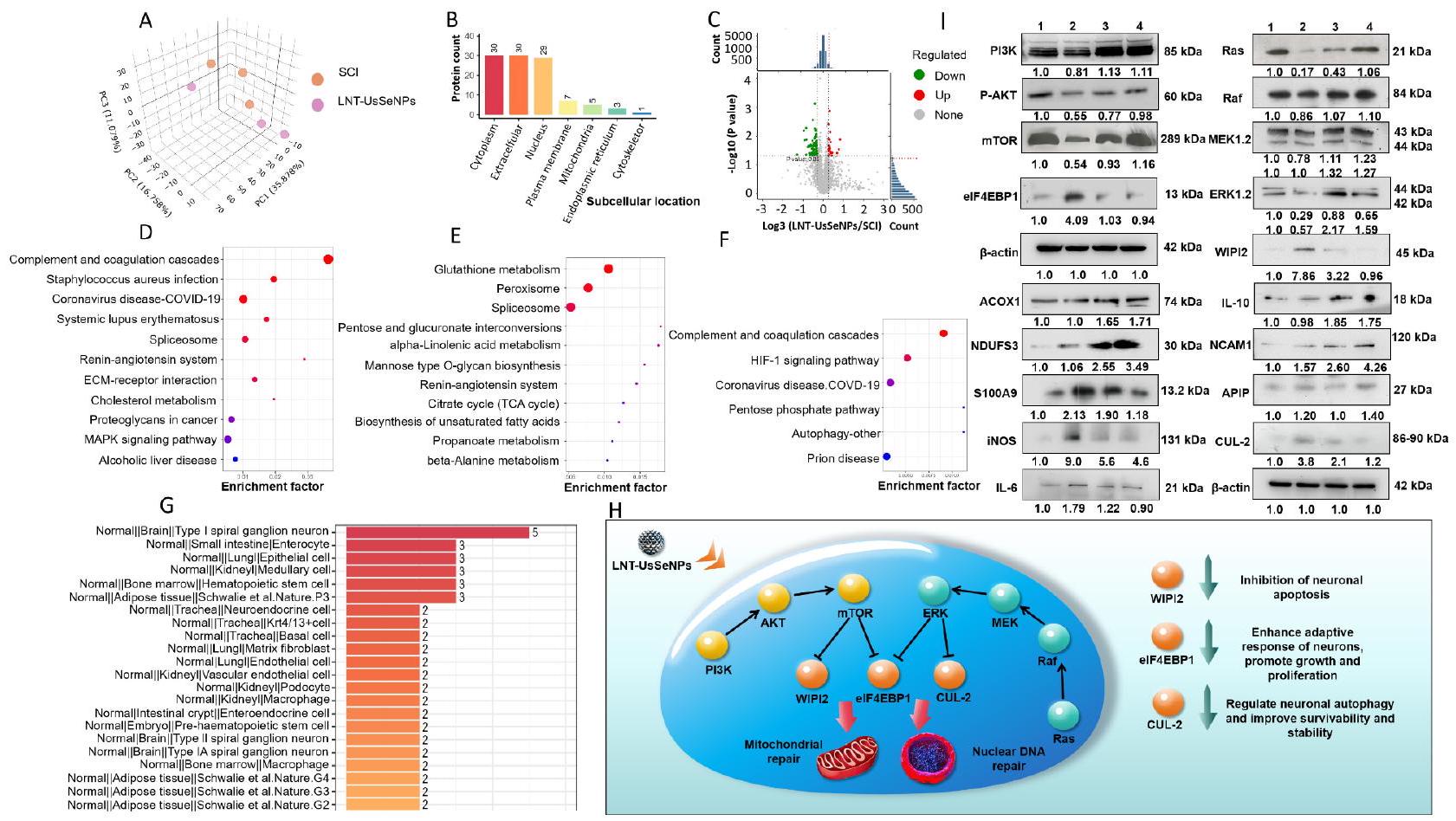
تم إجراء تحليل Western blot بعد ذلك للتحقق من بيانات البروتيوم (الشكل 6H). كشفت النتائج أن LNT-UsSeNPs زادت من تعبير البروتينات داخل مسار الإشارة PI3K-AKT-mTOR وفي الوقت نفسه قيدت تعبير مثبط بدء الترجمة، بروتين 4E المرتبط بعامل بدء الترجمة حقيقي النواة 1 (eIF4EBP1). عزز هذا العمل المزدوج ترجمة mRNA وتخليق البروتين في الخلايا العصبية. تشير بياناتنا إلى أن زيادة التعبير عن eIF4EBP1/2 تنشط عامل بدء الترجمة حقيقي النواة 4E (eIF4E)، مما يبدأ ترجمة mRNA المعتمدة على الكاب. هذه العملية ضرورية لتطور الخلايا العصبية ونمو الاتصالات المشبكية [45]. بالإضافة إلى ذلك، خفضت LNT-UsSeNPs تعبير البروتين المرتبط بالموت الخلوي WIPI2، مما يعزز بقاء الخلايا العصبية ويقلل من الموت الخلوي. في الوقت نفسه، زادت من تنظيم
مسار Ras-Raf-MEK-ERK يمنع تعبير Cullin 2، وهو مكون من مجمع اليوبكويتين، مما يقيد موت الخلايا العصبية.
علاوة على ذلك، أظهرت LNT-UsSeNPs أنها تقلل من مستويات تعبير البروتينات المؤيدة للالتهابات، مثل S100A9 و iNOS و IL-6، وتعزز في الوقت نفسه تعبير البروتين المضاد للالتهابات IL-10. فيما يتعلق بالخصائص المضادة للأكسدة، عززت LNT-UsSeNPs تعبير بروتين عامل تنشيط البروتياز المرتبط بالموت الخلوي-1 (APIP)، مما يقلل من موت الخلايا العصبية الناتج عن الإجهاد التأكسدي. علاوة على ذلك، زادت LNT-UsSeNPs من مستويات بروتين نازع هيدروجين NADH الحديدي-الكبريتي 3 (NDUFS3)، مما يحافظ على الأيض الهوائي الطبيعي في الخلايا العصبية وزادت من تعبير أكسيداز أسيل CoA 1 (ACOX1)، مما يثبت الأيض الدهني داخل الخلايا. كما زادت معالجة LNT-UsSeNPs من تعبير جزيء التصاق الخلايا العصبية 1 (NCAM1)، مما يسهل التجديد العصبي ونقل الإشارات عبر الغشاء، وهو ما يفيد في إصلاح وظيفة الأعصاب بعد إصابة الحبل الشوكي.
بشكل جماعي، تظهر هذه النتائج بشكل قوي أن LNT-UsSeNPs تخفف من موت الخلايا العصبية من خلال زيادة تنظيم مسارات PI3K-AKT-mTOR و Ras-Raf-MEK-ERK وتعديل تعبير البروتينات ذات الصلة
المضادة للأكسدة والمضادة للالتهابات. تقلل هذه التأثيرات من الإجهاد التأكسدي المحلي والالتهاب بينما تعزز تعبير البروتينات المشاركة في الإصلاح العصبي وتعزز التعافي الوظيفي. بشكل عام، أظهرت LNT-UsSeNPs تأثيرات مضادة للالتهابات ومضادة للأكسدة دون تثبيط الجهاز المناعي، كما يتضح من التجارب المتعلقة بالمناعة وتجارب البروتينات المرتبطة بالأنسجة. هذه ميزة كبيرة مقارنة بالعلاج بالجلوكوكورتيكويد، حيث تتجنب الآثار الجانبية المعدية المرتبطة.
الاستنتاجات
المواد والأساليب
تحضير LNT-UsSeNPs
تحضير LNT-SeNPs
توصيف LNT-SeNPs و LNT-UsSeNPs
إمكانات هذه الجسيمات النانوية للتطبيقات الطبية الحيوية، لا سيما من حيث استقرارها وسلامتها في بيئات بيولوجية متنوعة.
تقييم نشاط إزالة الجذور الحرة
تقييم ⋅ OH و
زراعة خلايا PC-12 وتقييم حيوية الخلايا
تحليل تدفق الخلايا لدورة الخلية، الموت المبرمج، و
التي تم حضنها بعد ذلك عند
كشف مستويات ROS داخل الخلايا الكلية
دراسات الأيض السريرية والسمية
إنشاء نموذج حيواني SCI
تم إجراء تقييمات سلوكية باستخدام مقياس باسو للفأر (BMS) واختبارات المنحدر بانتظام. في اليوم الثامن والعشرين، تم إجراء تحليل للمشي، تلاه euthanasia للفئران واستخراج الحبل الشوكي.
التقييمات السلوكية
صبغة نسيجية
تحليل استقلاب LNT-SeNPs و LNT-UsSeNPs في الفئران
تحليل القدرة المضادة للأكسدة في الجسم الحي
تحليل qPCR للتعبير عن السيلينوبروتين
تحليل البروتينات
توسيم TMT
فصل الكروماتوغرافيا السائلة عالية الضغط بالطور العكسي (HPLC)
الكشف الكمي بواسطة nano-LC-MS/MS
وضع (نطاق MS:
التحليل الإحصائي
تحليل البقعة الغربية
تحليل مناعي في الجسم الحي في الفئران بعد علاج LNT-UsSeNPs
معلومات إضافية
المادة الإضافية 1
الشكر والتقدير
مساهمات المؤلفين
التمويل
توفر البيانات
الإعلانات
الموافقة الأخلاقية والموافقة على المشاركة
الموافقة على النشر
المصالح المتنافسة
تفاصيل المؤلف
تم النشر عبر الإنترنت: 16 يناير 2025
References
- Kumar R, Lim J, Mekary RA, Rattani A, Dewan MC, Sharif SY, Osorio-Fonseca E, Park KB. Traumatic spinal Injury: Global Epidemiology and Worldwide volume. World Neurosurg. 2018;113:e345-63.
- Hu X, Xu W, Ren Y, Wang Z, He X, Huang R, Ma B, Zhao J, Zhu R, Cheng L. Spinal cord injury: molecular mechanisms and therapeutic interventions. Signal Transduct Target Ther. 2023;8:245.
- Kong G, Xiong W, Li C, Xiao C, Wang S, Li W, Chen X, Wang J, Chen S, Zhang Y, et al. Treg cells-derived exosomes promote blood-spinal cord barrier repair
and motor function recovery after spinal cord injury by delivering miR-2861. J Nanobiotechnol. 2023;21:364. - Nie X, Liu Y, Yuan T, Yu T, Yun Z, Xue W, Yu T, An J, Dai A, Wu K, Liu Q. Plateletrich plasma-derived exosomes promote blood-spinal cord barrier repair and attenuate neuroinflammation after spinal cord injury. J Nanobiotechnol. 2024;22:456.
- Karsy M, Hawryluk G. Modern Medical Management of spinal cord Injury. Curr Neurol Neurosci Rep. 2019;19:65.
- Gao P, Yi J, Chen W, Gu J, Miao S, Wang X, Huang Y, Jiang T, Li Q, Zhou W, et al. Pericyte-derived exosomal miR-210 improves mitochondrial function and inhibits lipid peroxidation in vascular endothelial cells after traumatic spinal cord injury by activating JAK1/STAT3 signaling pathway. J Nanobiotechnol. 2023;21:452.
- Cavone L, McCann T, Drake LK, Aguzzi EA, Oprisoreanu AM, Pedersen E, Sandi S, Selvarajah J, Tsarouchas TM, Wehner D, et al. A unique macrophage subpopulation signals directly to progenitor cells to promote regenerative neurogenesis in the zebrafish spinal cord. Dev Cell. 2021;56:1617-e16301616.
- Sandler AN, Tator CH. Effect of acute spinal cord compression injury on regional spinal cord blood flow in primates. J Neurosurg. 1976;45:660-76.
- Liu Z, Yao X, Jiang W, Li W, Zhu S, Liao C, Zou L, Ding R, Chen J. Advanced oxidation protein products induce microglia-mediated neuroinflammation via MAPKs-NF-kappaB signaling pathway and pyroptosis after secondary spinal cord injury. J Neuroinflammation. 2020;17:90.
- Li H, Sun D, Zhao Z, Fang J, Li M, Lv C, Zhou W, Li N, Guo Y, Cao Z, et al. Neutrophil membrane-derived nanoparticles protect traumatic brain injury via inhibiting calcium overload and scavenging ROS. J Nanobiotechnol. 2024;22:477.
- McGarry T, Biniecka M, Veale DJ, Fearon U. Hypoxia, oxidative stress and inflammation. Free Radic Biol Med. 2018;125:15-24.
- Zrzavy T, Schwaiger C, Wimmer I, Berger T, Bauer J, Butovsky O, Schwab JM, Lassmann H, Hoftberger R. Acute and non-resolving inflammation associate with oxidative injury after human spinal cord injury. Brain. 2021;144:144-61.
- Hou Y, Luan J, Huang T, Deng T, Li X, Xiao Z, Zhan J, Luo D, Hou Y, Xu L, Lin D. Tauroursodeoxycholic acid alleviates secondary injury in spinal cord injury mice by reducing oxidative stress, apoptosis, and inflammatory response. J Neuroinflammation. 2021;18:216.
- Liu C, Hu F, Jiao G, Guo Y, Zhou P, Zhang Y, Zhang Z, Yi J, You Y, Li Z, et al. Dental pulp stem cell-derived exosomes suppress M1 macrophage polarization through the ROS-MAPK-NFkappaB P65 signaling pathway after spinal cord injury. J Nanobiotechnol. 2022;20:65.
- Yang Y, Fan S, Chen Q, Lu Y, Zhu Y, Chen X, Xia L, Huang Q, Zheng J, Liu X. Acute exposure to gold nanoparticles aggravates lipopolysaccharideinduced liver injury by amplifying apoptosis via ROS-mediated macrophagehepatocyte crosstalk. J Nanobiotechnol. 2022;20:37.
- Zhao P, Hu HZ, Chen XT, Jiang QY, Yu XZ, Cen XL, Lin SQ, Mai SQ, Pang WL, Chen JX, Zhang Q. Mild hyperthermia enhanced synergistic uric acid degradation and multiple ROS elimination for an effective acute gout therapy. J Nanobiotechnol. 2024;22:275.
- Costa DD, Beghi E, Carignano P, Pagliacci C, Faccioli F, Pupillo E, Messina P, Gorio A, Redaelli T. Tolerability and efficacy of erythropoietin (EPO) treatment in traumatic spinal cord injury: a preliminary randomized comparative trial vs. methylprednisolone (MP). Neurol Sci. 2015;36:1567-74.
- Liu Z, Yang Y, He L, Pang M, Luo C, Liu B, Rong L. High-dose methylprednisolone for acute traumatic spinal cord injury: a meta-analysis. Neurology. 2019;93:e841-50.
- Xu Y, Lai H, Pan S, Pan L, Liu T, Yang Z, Chen T, Zhu X. Selenium promotes immunogenic radiotherapy against cervical cancer metastasis through evoking P53 activation. Biomaterials. 2024;305:122452.
- Li Y, Liu T, Zheng R, Lai J, Su J, Li J, Zhu B, Chen T. Translational selenium nanoparticles boost GPx1 activation to reverse HAdV-14 virus-induced oxidative damage. Bioact Mater. 2024;38:276-91.
- Zou B, Xiong Z, Yu Y, Shi S, Li X, Chen T. Rapid Selenoprotein activation by Selenium nanoparticles to suppresses osteoclastogenesis and pathological bone loss. Adv Mater. 2024;36:e2401620.
- Liu C, Wang W, Lai H, Chen Y, Li L, Li H, Zhan M, Chen T, Cao W, Li X. Biosynthesis of fungus-based oral selenium microcarriers for radioprotection and immuno-homeostasis shaping against radiation-induced heart disease. Bioact Mater. 2024;37:393-406.
- Liu X, Mao Y, Huang S, Li W, Zhang W, An J, Jin Y, Guan J, Wu L, Zhou P. Selenium nanoparticles derived from Proteus mirabilis YC801 alleviate oxidative stress and inflammatory response to promote nerve repair in rats with spinal cord injury. Regen Biomater. 2022;9:rbac042.
- Rao S, Lin Y, Lin R, Liu J, Wang H, Hu W, Chen B, Chen T. Traditional Chinese medicine active ingredients-based selenium nanoparticles regulate antioxidant selenoproteins for spinal cord injury treatment. J Nanobiotechnol. 2022;20:278.
- Hao M, Zhang D, Wang W, Wei Z, Duan J, He J, Kong X, Sang Y, Feng S, Liu H. HAp Thermosensitive Nanohydrogel cavities Act as Brood pouches to Incubate and Control-Release NSCs for Rapid spinal cord Injury Therapy. Adv Funct Mater. 2022, 32.
- Xiong Z, Lin H, Li H, Zou B, Xie B, Yu Y, He L, Chen T. Chiral selenium Nanotherapeutics regulates selenoproteins to Attenuate Glucocorticoid-Induced osteoporosis. Adv Funct Mater. 2023, 33.
- Xie B, Zeng D, Yang M, Tang Z, He L, Chen T. Translational selenium nanoparticles to Attenuate allergic dermatitis through Nrf2-Keap1-Driven activation of Selenoproteins. ACS Nano. 2023;17:14053-68.
- Hu Y, Liu T, Li J, Mai F, Li J, Chen Y, Jing Y, Dong X, Lin L, He J, et al. Selenium nanoparticles as new strategy to potentiate gammadelta T cell anti-tumor cytotoxicity through upregulation of tubulin-alpha acetylation. Biomaterials. 2019;222:119397.
- Lai H, Xu L, Liu C, Shi S, Jiang Y, Yu Y, Deng B, Chen T. Universal selenium nanoadjuvant with immunopotentiating and redox-shaping activities inducing high-quality immunity for SARS-CoV-2 vaccine. Signal Transduct Target Ther. 2023;8:88.
- Ouyang J, Deng B, Zou B, Li Y, Bu Q, Tian Y, Chen M, Chen W, Kong N, Chen T, Tao W. Oral hydrogel microbeads-mediated in situ synthesis of selenoproteins for regulating intestinal immunity and microbiota. J Am Chem Soc. 2023;145:12193-205.
- Oprea D, Sanz CG, Barsan MM, Enache TA. PC-12 cell line as a neuronal cell model for Biosensing Applications. Biosens (Basel) 2022, 12.
- Liu X, Chen Z, Bai J, Li X, Chen X, Li Z, Pan H, Li S, Gao Q, Zhao N, et al. Multifunctional Hydrogel Eye drops for synergistic treatment of ocular inflammatory disease. ACS Nano. 2023;17:25377-90.
- Liu M, Wu X, Cui Y, Liu P, Xiao B, Zhang X, Zhang J, Sun Z, Song M, Shao B, Li Y. Mitophagy and apoptosis mediated by ROS participate in
-induced MC3T3-E1 cell dysfunction. Food Chem Toxicol. 2021;155:112388. - Fujita K, Ito H, Nakano S, Kinoshita Y, Wate R, Kusaka H. Immunohistochemical identification of messenger RNA-related proteins in basophilic inclusions of adult-onset atypical motor neuron disease. Acta Neuropathol. 2008;116:439-45.
- Ungari M, Manotti L, Tanzi G, Varotti E, Ferrero G, Gusolfino MD, Trombatore M, Cavazzuti L, Tolomini M. NeuN, a DNA-binding neuron-specific protein
expressed by Merkel cell carcinoma: analysis of 15 cases. Pathologica. 2021;113:421-6. - Sanyal C, Pietsch N, Ramirez Rios S, Peris L, Carrier L, Moutin MJ. The dety-rosination/re-tyrosination cycle of tubulin and its role and dysfunction in neurons and cardiomyocytes. Semin Cell Dev Biol. 2023;137:46-62.
- Valdivia AO, Farr V, Bhattacharya SK. A novel myelin basic protein transcript variant in the murine central nervous system. Mol Biol Rep. 2019;46:2547-53.
- Mandwie M, Piper JA, Gorrie CA, Keay KA, Musumeci G, AI-Badri G, Castorina A. Rapid GFAP and Iba1 expression changes in the female rat brain following spinal cord injury. Neural Regen Res. 2022;17:378-85.
- Haro Giron S, Monserrat Sanz J, Ortega MA, Garcia-Montero C, Fraile-Martinez O, Gomez-Lahoz AM, Boaru DL, de Leon-Oliva D, Guijarro LG, Atienza-Perez M et al. Prognostic value of Malondialdehyde (MDA) in the temporal progression of chronic spinal cord Injury. J Pers Med. 2023, 13.
- Li F, Shi Z, Cheng M, Zhou Z, Chu M, Sun L, Zhou JC. Biology and roles in diseases of Selenoprotein I characterized by ethanolamine phosphotransferase activity and antioxidant potential. J Nutr. 2023;153:3164-72.
- Hariharan
, Dharmaraj S. Selenium and selenoproteins: it’s role in regulation of inflammation. Inflammopharmacol. 2020;28:667-95. - Liu C, Xi L, Liu Y, Mak JCW, Mao S, Wang Z, Zheng Y. An inhalable hybrid Biomimetic Nanoplatform for Sequential Drug Release and Remodeling Lung Immune Homeostasis in Acute Lung Injury Treatment. ACS Nano. 2023;17:11626-44.
- Murugaiah V, Yasmin H, Pandit H, Ganguly K, Subedi R, Al-Mozaini M, Madan T, Kishore U. Innate Immune Response against HIV-1. Adv Exp Med Biol. 2021;1313:23-58.
- Zahorec R. Neutrophil-to-lymphocyte ratio, past, present and future perspectives. Bratisl Lek Listy. 2021;122:474-88.
- Jin H, Xu W, Rahman R, Na D, Fieldsend A, Song W, Liu S, Li C, Rosbash M. TRIBE editing reveals specific mRNA targets of elF4E-BP in Drosophila and in mammals. Sci Adv. 2020;6:eabb8771.
ملاحظة الناشر
DOI: https://doi.org/10.1186/s12951-024-03054-7
PMID: https://pubmed.ncbi.nlm.nih.gov/39815246
Publication Date: 2025-01-15
Size effect-based improved antioxidant activity of selenium nanoparticles regulating Anti-PI3K-mTOR and Ras-MEK pathways for treating spinal cord injury to avoid hormone shock-induced immunosuppression
Abstract
Spinal cord injury (SCI) is a critical condition affecting the central nervous system that often has permanent and debilitating consequences, including secondary injuries. Oxidative damage and inflammation are critical factors in secondary pathological processes. Selenium nanoparticles have demonstrated significant antioxidative and anti-inflammatory properties via a non-immunosuppressive pathway; however, their clinical application has been limited by their inadequate stability and functionality to cross the blood-spinal cord barrier (BSCB). This study proposed a synthesis method for ultra-small-diameter lentinan Se nanoparticles (LNT-UsSeNPs) with significantly superior reactive oxygen species (ROS) scavenging capabilities compared to conventional lentinan Se nanoparticles (LNT-SeNPs). These compounds effectively protected PC-12 cells from oxidative stress-induced cytotoxicity, alleviated mitochondrial dysfunction, reduced apoptosis. In vivo studies indicated that LNT-UsSeNPs efficiently penetrated the BSCB and effectively inhibited the apoptosis of spinal neurons. Ultimately, LNT-UsSeNPs directly regulated the PI3K-AKT-mTOR and Ras-Raf-MEK-ERK signaling pathways by regulating selenoproteins to achieve non-immunosuppressive anti-inflammatory therapy. Owing to their ultra-small size, LNT-UsSeNPs exhibited strong spinal barrier penetration and potent antioxidative and anti-inflammatory effects without compromising immune function. These findings suggest that LNT-UsSeNPs are promising candidates for further development in nanomedicine for the effective treatment of SCI.
*Correspondence:
Tianfeng Chen
tchentf@jnu.edu.cn
Yi Qin
qinyi0225@163.com
Full list of author information is available at the end of the article

Introduction
transection caused by immediate or sustained mechanical compression or traction on the spinal cord [4-8]. Secondary injury is the response of the body and cells to primary injury and involves complex changes in the immune system, nervous system, and blood circulation. These changes include spinal cord ischemia, neuronal death, oxidative stress, inflammatory responses, neuronal apoptosis, axonal demyelination, and glial scar formation. Secondary injury is a key factor leading to spinal cord dysfunction and impedes recovery, with inflammation and oxidative stress playing critical roles in the process. Many studies have showed that oxidative stress is crucial for the onset and progression of SCI. Oxidative stress at the injury site results from a disparity between the production and neutralization of ROS, which encompasses
reactive oxygen molecules like
Currently, clinical approaches primarily use glucocorticoids, such as methylprednisolone (MP), to inhibit the production of inflammatory factors after SCI, prevent secondary neuronal death, and inhibit lipid peroxidation to reduce ROS generation and alleviate edema [17, 18]. However, high-dose hormone therapy can cause immune system disorders and increase the risk of infection and other complications, thereby affecting patient recovery. With recent technological advancements, nanomaterials have been extensively studied in disease treatment applications and have consistently demonstrated significant efficacy. Particularly in nanomedicine, nanoparticles often exhibit high catalytic effects owing to their unique particle sizes and rich surface-active sites. Hence, developing nanomedicines with small size and high catalytic activity has become a goal for scientists. Selenium (Se), an essential non-metallic trace element in humans and animals, plays a vital role in maintaining health. It has high biological safety and compatibility. As a key component of the body’s antioxidant system, Se is involved in the synthesis of Se-containing proteins, among which glutathione peroxidase (GPX) and thioredoxin reductase (
and inflammatory factor release after SCI, significantly down-regulating the expression levels of variety oxidative stress markers, such as superoxide dismutase (SOD) and malondialdehyde (MDA). Se also reduces neuronal apoptosis through pathways involving Bax, Bcl-2, and caspase-3 [22]. Additionally, Se supplementation can cause macrophage polarizing to M2 type results in the attenuated expression of interleukin 6 (IL-6), inducible nitric oxide synthase (iNOS) and tumor necrosis factor
Some literatures reported the modification of transmembrane peptides, the improvement of fat solubility and the controlled particles size both advance the barrier penetration of nanodrugs. Thus, ultra-small Se particles have been prepared to better penetrate the BSCB, accumulate effectively at the injury site, and significantly improve SCI treatment efficacy. Although the ultra-small size allows Se nanoparticles to have better BSCB penetration, it introduces new problems, such as a short half-life and poor stability. Lentinan polysaccharides (LNT) exhibit excellent biocompatibility and possess a molecular structure rich in hydroxyl and other functional groups. These groups interact with the surfaces of nanomedicines to form stable chemical bonds or physical adsorption layers. This interaction prevents the aggregation of nanomedicines in aqueous solutions or physiological environments, enhancing their dispersibility and stability. Herein, we prepared an ultra-small Se-based nanosystem with LNT modification (LNT-UsSeNPs) to achieve high BSCB penetration and suitable biostability.
Results and discussion
Design and synthesis of LNT-UsSeNPs

Assessment of the ROS scavenging capacity of LNTUsSeNPs
The hydroxyl radical ( ⋅ OH)-scavenging effects of LNTSeNPs and LNT-UsSeNPs were further investigated using electron paramagnetic resonance (EPR) spectroscopy (Fig. 2B). The
ROS scavenging effects and protective effects of LNTUsSeNPs on oxidative stress injury in PC-12 cells
We also analyzed the Se content in PC-12 cells at different time points post-administration using inductively coupled plasma mass spectrometry (ICP-MS). As illustrated in Fig. 2E, the intracellular Se concentration of LNT-SeNPs and LNT-UsSeNPs groups reached a higher level after incubation for 2 h , indicating that LNT-SeNPs and LNT-UsSeNPs had better potential to protect PC-12 cells after pre-administration for 2 h . Thus, the CCK-8 assay demonstrated that exposure to
Cell cycle arrest and apoptosis were also assessed to explore the possible protective mechanisms of LNTSeNPs and LNT-UsSeNPs on PC-12 cells, which are the primary mechanisms by which oxidative stress impairs cell growth and induces cell death [33]. Mitochondrial membrane potential (

Fluorescence images confirmed these findings, showing that LNT-UsSeNPs reversed the TBHP-induced
reduction in the red-to-green fluorescence ratio (Fig. 2H). Thus, LNT-UsSeNPs effectively downregulated TBHP-induced cell damage. Additionally, cell cycle analysis (Fig. 2I and J) indicated that TBHP treatment significantly increased S-phase cell cycle arrest in PC-12 cells. The Sub-G1 phase of cells was increased from 2.35 to
effectively mitigated the TBHP-induced increasing of Sub-G1 phase (from 9.78 to
Metabolic and biosafety evaluation of LNT-SeNPs and LNTUsSeNPs
To assess the in vivo toxicity of the nanoparticles, we conducted histological examinations using hematoxylin and eosin (H&E) staining of sections of major organs post-injection. The results in Fig. 3I indicated no significant tissue damage to the main organs, confirming the adequate biosafety of LNT-SeNPs and LNT-UsSeNPs within the administered dose range.
Furthermore, we explored the distribution efficiency and processing of LNT-UsSeNPs in vivo. After the injection of fluorescently labeled Se nanoparticles,
the fluorescence intensity at the SCI site in the LNTUsSeNPs group was significantly higher at various time points than in the LNT-SeNPs group, as observed in the fluorescence images of the mouse viscera. Furthermore, the images of LNT-UsSeNP group exhibited significantly higher fluorescence intensity at the SCI site than those of LNT-SeNPs group, with relatively high intensities also observed in the liver, spleen, and kidneys (Fig. 3J). These results indicate that LNT-UsSeNPs can more effectively cross the BSCB through blood circulation to reach the SCI site in mice, achieving a therapeutically effective local drug concentration that may facilitate subsequent treatment of SCI.
Enhancement of motor function and neuronal survival in mice with SCl upon treatment with LNT-SeNPs and LNTUsSeNPs
Further investigation of the motion of the mouse hind limbs during walking broke down the movements into a sequence of phases-stance, push-off, lift, swing, and stance-completing one cycle, as depicted in Fig. 4D. The SCI group consistently demonstrated hind limb paralysis and dragging. In contrast, mice treated with LNT-UsSeNPs showed notable improvements, such as restored standing posture (stance ability), enhanced weight support, indicated by an increase in iliac crest height, and an expanded range of joint motion, facilitating effective push and swing movements.
Effects of LNT-SeNPs and LNT-UsSeNPs on spinal cord tissue pathology and neuronal survival

(Fig. 4F). (Neuron count: Sham: 9; SCI: 4; LNT-SeNPs: 7; LNT-UsSeNPs: 8) Dual immunofluorescence staining assessed the expression of neuronal nuclei protein (Neun), which is important for synaptic generation and neural circuit balance, and

(GFAP) expression to analyze astrocytic responses postinjury [38]. SCI typically induces astrocytes to produce GFAP, leading to glial scar formation that impedes neuronal regeneration. GFAP staining revealed that GFAP expression was substantially lower in the LNT-UsSeNPs group, suggesting reduced oxidative stress, inflammation, and less glial scar formation. Collectively, these results
confirm that LNT-UsSeNPs provide neuroprotective effects, inhibit axonal demyelination, and reduce glial scar formation in vivo, thereby offering significant therapeutic benefits for SCI treatment.
LNT-UsSeNPs regulate selenoenzymes to mitigate
MDA, a byproduct of lipid peroxidation, serves as a biomarker for oxidative stress and is prevalent in the lipid-rich spinal cord, where lipid peroxidation is likely to occur post-injury [39]. Thus, we evaluated the MDA content in the spinal cord, finding it notably decreased in the LNT-UsSeNPs group compared to the SCI group (Fig. 5A). These results demonstrate that LNT-UsSeNPs exhibit superior antioxidant capacity compared to LNTSeNPs, consistent with previous in vitro antioxidant studies.
The human body contains at least 25 Se -containing proteins, several of which function as antioxidant enzymes that contribute to mitigating oxidative stress-induced damage [40, 41]. Thus, we assessed the mRNA expression of the antioxidative selenoprotein as as glutathione
peroxidase (GSH-Px), TrxR, selenoprotein K (SelK), and selenoprotein T (SelT). As illustrated in Fig. 5B, treatment with both LNT-SeNPs and LNT-UsSeNPs significantly enhanced GSH-Px activity, with LNT-UsSeNPs showing notably higher activity than LNT-SeNPs. Furthermore, we investigated the effect of LNT-UsSeNPs on the expression of antioxidant selenoproteins using qPCR and western blot analyses. The qPCR results (Fig. 5C) showed that treatment with LNT-UsSeNPs significantly increased the mRNA expression of GPX1, GPX2, SelW, and TrxR1 compared to the SCI group. Subsequent western blot analysis validated that LNT-UsSeNPs upregulated the expression of GPX1, GPX2, and TrxR1 in spinal cord tissues. These findings suggest that LNT-UsSeNPs mitigate oxidative stress-induced SCI by regulating antioxidant selenoproteins, thereby exerting neuroprotective effects in mice with SCI. The western blot results further verified the qPCR results (Fig. 5D).
The common clinical treatment for SCI involves highdose corticosteroid therapy, specifically with methylprednisolone sodium succinate (MPSS), which suppresses immune function despite its anti-inflammatory and antioxidative benefits. This suppression can lead to

LNT-UsSeNPs exert antioxidant and anti-inflammatory effects to inhibit neuronal apoptosis via the PI3K-AKT-mTOR-elF4EBP1 and Ras-Raf-MEK-WIPI2 pathways
enrichment analysis of the TMT proteomic data identified differentially expressed proteins between the LNTUsSeNPs and SCI groups that had significant biological relevance (Fig. 6A). Subcellular localization analysis indicated that the majority of these differentially expressed proteins were primarily found in the cytoplasm, extracellular matrix and nucleus, suggesting that they play critical roles in different cellular compartments (Fig. 6B). Volcano plot analysis identified a number of proteins with significant differential expression (Fig. 6C), shedding light on the potential molecular mechanisms underlying the effects of LNT-UsSeNPs. Utilizing the Kyoto Encyclopedia of Genes and Genomes (KEGG) pathway enrichment analysis, we annotated the functions of the proteins that exhibited variable expression and conducted a comparative analysis to distinguish between those that were upregulated and those that were downregulated (Fig. 6D and F). The results demonstrated that LNT-UsSeNPs significantly upregulated key proteins in the PI3K-AKT-mTOR and Ras-Raf-MEK-ERK signaling pathways, promoting cell growth, proliferation, and differentiation. After SCI, oxidative stress and inflammation contribute significantly to secondary damage, neuronal injury, and functional loss. The PI3K-AKT-mTOR and Ras-Raf-MEK-ERK pathways are crucial in mitigating oxidative stress and inflammation. The PI3K-AKT-mTOR pathway promotes neural repair by regulating cell survival and inhibiting oxidative stress and inflammation. AKT activation reduces free radicals by upregulating antioxidant enzymes like SOD, while also suppressing the release of inflammatory factors such as TNF-

Western blotting was then performed to validate the proteomic data (Fig. 6H). The results revealed that LNTUsSeNPs increased the expression of proteins within the PI3K-AKT-mTOR signaling pathway and simultaneously suppressed the expression of the translation initiation repressor, eukaryotic translation initiation factor 4E binding protein 1 (eIF4EBP1). This dual action enhanced mRNA translation and protein synthesis in neurons. Our data suggest that the upregulation of eIF4EBP1/2 activates eukaryotic Initiation Factor 4E (eIF4E), initiating cap-dependent mRNA translation. This process is essential for neuronal development and the growth of synaptic connections [45]. Additionally, LNT-UsSeNPs downregulated the expression of the apoptosis-related protein WD repeat domain phosphoinositide-interacting protein 2 (WIPI2), enhancing neuronal cell survival and reducing apoptosis. Simultaneously, the upregulation of
the Ras-Raf-MEK-ERK pathway inhibits the expression of Cullin 2, a component of the ubiquitin complex, suppressing neuronal apoptosis.
Furthermore, LNT-UsSeNPs have been showed to reduce the expression levels of pro-inflammatory proteins, such as S100A9, iNOS, and IL-6, and concurrently enhance the expression of the anti-inflammatory protein IL-10. Regarding antioxidant properties, LNT-UsSeNPs promoted the expression of apoptosis protease activating factor-1 interacting protein (APIP), mitigating oxidative stress-induced neuronal apoptosis. Furthermore, LNTUsSeNPs enhanced the levels of NADH dehydrogenase iron-sulfur protein 3 (NDUFS3), maintaining normal aerobic metabolism in neurons and upregulated acylCoA oxidase 1 (ACOX1) expression, stabilizing intracellular lipid metabolism. LNT-UsSeNPs treatment also increased the expression of neural cell adhesion molecule 1 (NCAM1), facilitating neural regeneration and transmembrane signal transmission, which are beneficial for neural function repair post-SCI.
Collectively, these results robustly demonstrate that LNT-UsSeNPs mitigate neuronal apoptosis by upregulating the PI3K-AKT-mTOR and Ras-Raf-MEK-ERK pathways and modulating the expression of related
antioxidant and anti-inflammatory proteins. These effects reduce local oxidative stress and inflammation while enhancing the expression of proteins involved in neural repair and promoting functional recovery. In general, LNT-UsSeNPs exerted anti-inflammatory and antioxidant effects without inhibiting the immune system, as demonstrated by immune-related and tissue proteinrelated experiments. This has a significant advantage over glucocorticoid therapy, as it avoids related infectious side effects.
Conclusions
Materials and methods
Preparation of LNT-UsSeNPs
Preparation of LNT-SeNPs
Characterization of LNT-SeNPs and LNT-UsSeNPs
potential of these nanoparticles for biomedical applications, particularly in terms of their stability and integrity in diverse biological environments.
Evaluation of the ROS scavenging activity
Evaluation of ⋅ OH and
PC-12 cell culture and assessment of cell viability
Flow cytometry analysis of the cell cycle, apoptosis, and
which were then incubated at
Detection of total intracellular ROS levels
In vivo metabolism and toxicity studies
SCI Animal model establishment
modeling. Behavioral assessments Basso Mouse Scale (BMS) and inclined plane tests were conducted regularly. On day 28, gait analysis was performed, followed by euthanasia of the mice and extraction of the spinal cord.
Behavioral assessments
Histological staining
Analysis of LNT-SeNPs and LNT-UsSeNPs metabolism in mice
In vivo antioxidant capacity analysis
qPCR analysis of selenoprotein expression
Proteomic analysis
TMT labeling
Reversed-phase high-pressure liquid chromatography (HPLC) fractionation
Quantitative detection by nano-LC-MS/MS
mode (MS range:
Statistical analysis
Western blot analysis
In vivo immunological analysis in mice after LNT-UsSeNPs treatment
Supplementary Information
Supplementary Material 1
Acknowledgements
Author contributions
Funding
Data availability
Declarations
Ethical approval and consent to participate
Consent for publication
Competing interests
Author details
Published online: 16 January 2025
References
- Kumar R, Lim J, Mekary RA, Rattani A, Dewan MC, Sharif SY, Osorio-Fonseca E, Park KB. Traumatic spinal Injury: Global Epidemiology and Worldwide volume. World Neurosurg. 2018;113:e345-63.
- Hu X, Xu W, Ren Y, Wang Z, He X, Huang R, Ma B, Zhao J, Zhu R, Cheng L. Spinal cord injury: molecular mechanisms and therapeutic interventions. Signal Transduct Target Ther. 2023;8:245.
- Kong G, Xiong W, Li C, Xiao C, Wang S, Li W, Chen X, Wang J, Chen S, Zhang Y, et al. Treg cells-derived exosomes promote blood-spinal cord barrier repair
and motor function recovery after spinal cord injury by delivering miR-2861. J Nanobiotechnol. 2023;21:364. - Nie X, Liu Y, Yuan T, Yu T, Yun Z, Xue W, Yu T, An J, Dai A, Wu K, Liu Q. Plateletrich plasma-derived exosomes promote blood-spinal cord barrier repair and attenuate neuroinflammation after spinal cord injury. J Nanobiotechnol. 2024;22:456.
- Karsy M, Hawryluk G. Modern Medical Management of spinal cord Injury. Curr Neurol Neurosci Rep. 2019;19:65.
- Gao P, Yi J, Chen W, Gu J, Miao S, Wang X, Huang Y, Jiang T, Li Q, Zhou W, et al. Pericyte-derived exosomal miR-210 improves mitochondrial function and inhibits lipid peroxidation in vascular endothelial cells after traumatic spinal cord injury by activating JAK1/STAT3 signaling pathway. J Nanobiotechnol. 2023;21:452.
- Cavone L, McCann T, Drake LK, Aguzzi EA, Oprisoreanu AM, Pedersen E, Sandi S, Selvarajah J, Tsarouchas TM, Wehner D, et al. A unique macrophage subpopulation signals directly to progenitor cells to promote regenerative neurogenesis in the zebrafish spinal cord. Dev Cell. 2021;56:1617-e16301616.
- Sandler AN, Tator CH. Effect of acute spinal cord compression injury on regional spinal cord blood flow in primates. J Neurosurg. 1976;45:660-76.
- Liu Z, Yao X, Jiang W, Li W, Zhu S, Liao C, Zou L, Ding R, Chen J. Advanced oxidation protein products induce microglia-mediated neuroinflammation via MAPKs-NF-kappaB signaling pathway and pyroptosis after secondary spinal cord injury. J Neuroinflammation. 2020;17:90.
- Li H, Sun D, Zhao Z, Fang J, Li M, Lv C, Zhou W, Li N, Guo Y, Cao Z, et al. Neutrophil membrane-derived nanoparticles protect traumatic brain injury via inhibiting calcium overload and scavenging ROS. J Nanobiotechnol. 2024;22:477.
- McGarry T, Biniecka M, Veale DJ, Fearon U. Hypoxia, oxidative stress and inflammation. Free Radic Biol Med. 2018;125:15-24.
- Zrzavy T, Schwaiger C, Wimmer I, Berger T, Bauer J, Butovsky O, Schwab JM, Lassmann H, Hoftberger R. Acute and non-resolving inflammation associate with oxidative injury after human spinal cord injury. Brain. 2021;144:144-61.
- Hou Y, Luan J, Huang T, Deng T, Li X, Xiao Z, Zhan J, Luo D, Hou Y, Xu L, Lin D. Tauroursodeoxycholic acid alleviates secondary injury in spinal cord injury mice by reducing oxidative stress, apoptosis, and inflammatory response. J Neuroinflammation. 2021;18:216.
- Liu C, Hu F, Jiao G, Guo Y, Zhou P, Zhang Y, Zhang Z, Yi J, You Y, Li Z, et al. Dental pulp stem cell-derived exosomes suppress M1 macrophage polarization through the ROS-MAPK-NFkappaB P65 signaling pathway after spinal cord injury. J Nanobiotechnol. 2022;20:65.
- Yang Y, Fan S, Chen Q, Lu Y, Zhu Y, Chen X, Xia L, Huang Q, Zheng J, Liu X. Acute exposure to gold nanoparticles aggravates lipopolysaccharideinduced liver injury by amplifying apoptosis via ROS-mediated macrophagehepatocyte crosstalk. J Nanobiotechnol. 2022;20:37.
- Zhao P, Hu HZ, Chen XT, Jiang QY, Yu XZ, Cen XL, Lin SQ, Mai SQ, Pang WL, Chen JX, Zhang Q. Mild hyperthermia enhanced synergistic uric acid degradation and multiple ROS elimination for an effective acute gout therapy. J Nanobiotechnol. 2024;22:275.
- Costa DD, Beghi E, Carignano P, Pagliacci C, Faccioli F, Pupillo E, Messina P, Gorio A, Redaelli T. Tolerability and efficacy of erythropoietin (EPO) treatment in traumatic spinal cord injury: a preliminary randomized comparative trial vs. methylprednisolone (MP). Neurol Sci. 2015;36:1567-74.
- Liu Z, Yang Y, He L, Pang M, Luo C, Liu B, Rong L. High-dose methylprednisolone for acute traumatic spinal cord injury: a meta-analysis. Neurology. 2019;93:e841-50.
- Xu Y, Lai H, Pan S, Pan L, Liu T, Yang Z, Chen T, Zhu X. Selenium promotes immunogenic radiotherapy against cervical cancer metastasis through evoking P53 activation. Biomaterials. 2024;305:122452.
- Li Y, Liu T, Zheng R, Lai J, Su J, Li J, Zhu B, Chen T. Translational selenium nanoparticles boost GPx1 activation to reverse HAdV-14 virus-induced oxidative damage. Bioact Mater. 2024;38:276-91.
- Zou B, Xiong Z, Yu Y, Shi S, Li X, Chen T. Rapid Selenoprotein activation by Selenium nanoparticles to suppresses osteoclastogenesis and pathological bone loss. Adv Mater. 2024;36:e2401620.
- Liu C, Wang W, Lai H, Chen Y, Li L, Li H, Zhan M, Chen T, Cao W, Li X. Biosynthesis of fungus-based oral selenium microcarriers for radioprotection and immuno-homeostasis shaping against radiation-induced heart disease. Bioact Mater. 2024;37:393-406.
- Liu X, Mao Y, Huang S, Li W, Zhang W, An J, Jin Y, Guan J, Wu L, Zhou P. Selenium nanoparticles derived from Proteus mirabilis YC801 alleviate oxidative stress and inflammatory response to promote nerve repair in rats with spinal cord injury. Regen Biomater. 2022;9:rbac042.
- Rao S, Lin Y, Lin R, Liu J, Wang H, Hu W, Chen B, Chen T. Traditional Chinese medicine active ingredients-based selenium nanoparticles regulate antioxidant selenoproteins for spinal cord injury treatment. J Nanobiotechnol. 2022;20:278.
- Hao M, Zhang D, Wang W, Wei Z, Duan J, He J, Kong X, Sang Y, Feng S, Liu H. HAp Thermosensitive Nanohydrogel cavities Act as Brood pouches to Incubate and Control-Release NSCs for Rapid spinal cord Injury Therapy. Adv Funct Mater. 2022, 32.
- Xiong Z, Lin H, Li H, Zou B, Xie B, Yu Y, He L, Chen T. Chiral selenium Nanotherapeutics regulates selenoproteins to Attenuate Glucocorticoid-Induced osteoporosis. Adv Funct Mater. 2023, 33.
- Xie B, Zeng D, Yang M, Tang Z, He L, Chen T. Translational selenium nanoparticles to Attenuate allergic dermatitis through Nrf2-Keap1-Driven activation of Selenoproteins. ACS Nano. 2023;17:14053-68.
- Hu Y, Liu T, Li J, Mai F, Li J, Chen Y, Jing Y, Dong X, Lin L, He J, et al. Selenium nanoparticles as new strategy to potentiate gammadelta T cell anti-tumor cytotoxicity through upregulation of tubulin-alpha acetylation. Biomaterials. 2019;222:119397.
- Lai H, Xu L, Liu C, Shi S, Jiang Y, Yu Y, Deng B, Chen T. Universal selenium nanoadjuvant with immunopotentiating and redox-shaping activities inducing high-quality immunity for SARS-CoV-2 vaccine. Signal Transduct Target Ther. 2023;8:88.
- Ouyang J, Deng B, Zou B, Li Y, Bu Q, Tian Y, Chen M, Chen W, Kong N, Chen T, Tao W. Oral hydrogel microbeads-mediated in situ synthesis of selenoproteins for regulating intestinal immunity and microbiota. J Am Chem Soc. 2023;145:12193-205.
- Oprea D, Sanz CG, Barsan MM, Enache TA. PC-12 cell line as a neuronal cell model for Biosensing Applications. Biosens (Basel) 2022, 12.
- Liu X, Chen Z, Bai J, Li X, Chen X, Li Z, Pan H, Li S, Gao Q, Zhao N, et al. Multifunctional Hydrogel Eye drops for synergistic treatment of ocular inflammatory disease. ACS Nano. 2023;17:25377-90.
- Liu M, Wu X, Cui Y, Liu P, Xiao B, Zhang X, Zhang J, Sun Z, Song M, Shao B, Li Y. Mitophagy and apoptosis mediated by ROS participate in
-induced MC3T3-E1 cell dysfunction. Food Chem Toxicol. 2021;155:112388. - Fujita K, Ito H, Nakano S, Kinoshita Y, Wate R, Kusaka H. Immunohistochemical identification of messenger RNA-related proteins in basophilic inclusions of adult-onset atypical motor neuron disease. Acta Neuropathol. 2008;116:439-45.
- Ungari M, Manotti L, Tanzi G, Varotti E, Ferrero G, Gusolfino MD, Trombatore M, Cavazzuti L, Tolomini M. NeuN, a DNA-binding neuron-specific protein
expressed by Merkel cell carcinoma: analysis of 15 cases. Pathologica. 2021;113:421-6. - Sanyal C, Pietsch N, Ramirez Rios S, Peris L, Carrier L, Moutin MJ. The dety-rosination/re-tyrosination cycle of tubulin and its role and dysfunction in neurons and cardiomyocytes. Semin Cell Dev Biol. 2023;137:46-62.
- Valdivia AO, Farr V, Bhattacharya SK. A novel myelin basic protein transcript variant in the murine central nervous system. Mol Biol Rep. 2019;46:2547-53.
- Mandwie M, Piper JA, Gorrie CA, Keay KA, Musumeci G, AI-Badri G, Castorina A. Rapid GFAP and Iba1 expression changes in the female rat brain following spinal cord injury. Neural Regen Res. 2022;17:378-85.
- Haro Giron S, Monserrat Sanz J, Ortega MA, Garcia-Montero C, Fraile-Martinez O, Gomez-Lahoz AM, Boaru DL, de Leon-Oliva D, Guijarro LG, Atienza-Perez M et al. Prognostic value of Malondialdehyde (MDA) in the temporal progression of chronic spinal cord Injury. J Pers Med. 2023, 13.
- Li F, Shi Z, Cheng M, Zhou Z, Chu M, Sun L, Zhou JC. Biology and roles in diseases of Selenoprotein I characterized by ethanolamine phosphotransferase activity and antioxidant potential. J Nutr. 2023;153:3164-72.
- Hariharan
, Dharmaraj S. Selenium and selenoproteins: it’s role in regulation of inflammation. Inflammopharmacol. 2020;28:667-95. - Liu C, Xi L, Liu Y, Mak JCW, Mao S, Wang Z, Zheng Y. An inhalable hybrid Biomimetic Nanoplatform for Sequential Drug Release and Remodeling Lung Immune Homeostasis in Acute Lung Injury Treatment. ACS Nano. 2023;17:11626-44.
- Murugaiah V, Yasmin H, Pandit H, Ganguly K, Subedi R, Al-Mozaini M, Madan T, Kishore U. Innate Immune Response against HIV-1. Adv Exp Med Biol. 2021;1313:23-58.
- Zahorec R. Neutrophil-to-lymphocyte ratio, past, present and future perspectives. Bratisl Lek Listy. 2021;122:474-88.
- Jin H, Xu W, Rahman R, Na D, Fieldsend A, Song W, Liu S, Li C, Rosbash M. TRIBE editing reveals specific mRNA targets of elF4E-BP in Drosophila and in mammals. Sci Adv. 2020;6:eabb8771.
