DOI: https://doi.org/10.1186/s40168-024-01756-6
PMID: https://pubmed.ncbi.nlm.nih.gov/38378622
تاريخ النشر: 2024-02-20
تسبب اختلال ميكروبات الأمعاء في تطوير سلوك يشبه الاكتئاب من خلال تقليم المشابك غير الطبيعي في الخلايا الدبقية بواسطة المكمل C3
الملخص
خلفية إعادة تشكيل التوازن الميكروبي في بيئة الأمعاء قد تساهم في منع حدوث وتطور الاكتئاب. لقد أظهرت الأدلة التجريبية المتزايدة أن إشارات المكمل C3 مرتبطة بمرض الاكتئاب، وأن اضطراب ميكروبات الأمعاء قد يكون سببًا أساسيًا لتنشيط نظام المكمل. ومع ذلك، لا يزال الآلية التي يشارك بها المكمل C3 في التواصل بين الأمعاء والدماغ في مرض الاكتئاب غير معروفة. النتائج في هذه الدراسة الحالية، وجدنا أن الفئران التي تعرضت للإجهاد الخفيف غير المتوقع المزمن (CUMS) أظهرت سلوكًا واضحًا يشبه الاكتئاب بالإضافة إلى ضعف إدراكي، والذي كان مرتبطًا باختلال ميكروبات الأمعاء بشكل ملحوظ، خاصةً زيادة بكتيريا البروتيوبكتيريا وارتفاع مستويات الليبوساكاريد المشتق من الميكروبات (LPS). بالإضافة إلى ذلك، تم ملاحظة تنشيط المكمل C3 المحيطي والمركزي وتقليم المشابك غير الطبيعي في الخلايا الدبقية بواسطة C3/CR3. زراعة ميكروبات الأمعاء من فئران نموذج الاكتئاب المستحثة بـ CUMS في فئران خالية من مسببات الأمراض وفئران خالية من الجراثيم أدت إلى سلوك يشبه الاكتئاب وضعف إدراكي متزامن في الفئران المستقبلة، مصحوبة بزيادة تنشيط مسار المكمل C3/CR3 في القشرة الجبهية abnormalities في تقليم المشابك الذي تسببه الخلايا الدبقية. على العكس من ذلك، أدت مضادات الاكتئاب وزراعة ميكروبات البراز من المتبرعين المعالجين بمضادات الاكتئاب إلى تحسين سلوكيات تشبه الاكتئاب واستعادة اضطرابات ميكروبات الأمعاء في الفئران المكتئبة. في الوقت نفسه، تم ملاحظة تثبيط مسار المكمل C3/CR3، وتحسين تقليم المشابك غير الطبيعي، وزيادة تعبير بروتين السيناكسين وبروتين كثافة ما بعد المشبك 95. بشكل جماعي، كشفت نتائجنا أن اختلال ميكروبات الأمعاء يؤدي إلى تطوير سلوكيات تشبه الاكتئاب من خلال تقليم المشابك غير الطبيعي في الخلايا الدبقية بواسطة المكمل C3، وأن تثبيط تقليم المشابك غير الطبيعي هو المفتاح لاستهداف الميكروبات لعلاج الاكتئاب.
الكلمات الرئيسية المكمل C3، الاكتئاب، زراعة ميكروبات البراز، ميكروبات الأمعاء، الخلايا الدبقية، تقليم المشابك
خلفية
تقليم المشابك هو حلقة مهمة في تشكيل الدوائر العصبية الصحيحة وهو أمر حاسم لتطوير الدماغ وصيانة التوازن العصبي في الاكتئاب [8، 9]. كشفت الأبحاث الحديثة أن المكملات تشارك في تقليم المشابك التطوري وفقدان المشابك المرضي، والذي يساهم في العديد من أمراض الدماغ بما في ذلك الفصام والاكتئاب والتوحد واضطرابات القلق [10،11]. في الدماغ، يشارك نظام المكمل في تنظيم تقليم المشابك في الخلايا الدبقية [12]. المكمل C 3 هو الرابط المركزي في مسار تنشيط المكمل [13]. من خلال وسم المكمل عند المشبك، يرتبط المكمل C 3 بمستقبلات المكمل، وخاصة مستقبل المكمل 3 (CR3)، على الخلايا الدبقية الكيميائية، مما يحفز الخلايا الدبقية على ابتلاع المكونات الخلوية المسمّاة [14]. تم ملاحظة أنظمة المكمل المنشطة محيطياً ومركزياً في المرضى الذين يعانون من الاكتئاب ونماذج حيوانية للاكتئاب [15]. تشير هذه النتائج إلى أن إشارات المكمل C3/CR3 مرتبطة بمرض الاكتئاب. ومع ذلك، لم يتم تحديد مصدر المكمل C 3 [15]. تعد ميكروبات الأمعاء من modulates المناعة المحيطية والمناعة العصبية للمضيف، ومشتقاتها الميكروبية هي
منشطة مهمة للمكمل C3 [16]. ومع ذلك، لا يزال غير معروف ما إذا كانت ميكروبات الأمعاء هي مصدر المكمل الذي يشارك في تقليم المشابك المركزي خلال مرض الاكتئاب وما إذا كان المكمل هو حلقة مهمة في التواصل بين الأمعاء والدماغ.
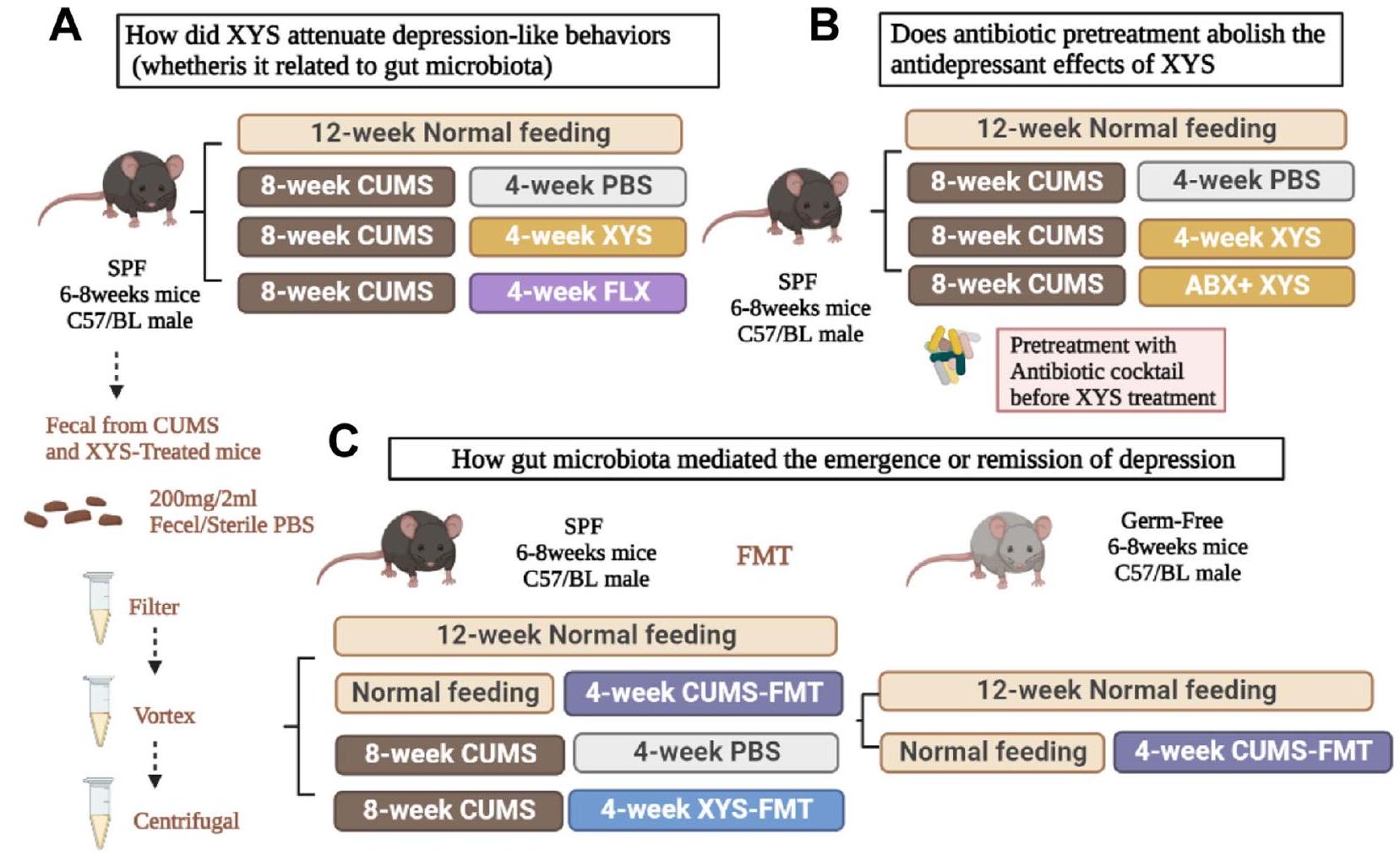
تم تقييم الإدارة في نموذج فئران من الاكتئاب الناتج عن الإجهاد الخفيف غير المتوقع المزمن (CUMS). تم استخدام التدخل بالمضادات الحيوية لاستكشاف تأثير إزالة الميكروبات على فعالية مضادات الاكتئاب. بعد ذلك، تدخلنا في الفلورا الميكروبية المعوية لفئران خالية من مسببات الأمراض المحددة (SPF) العادية والمكتئبة باستخدام CUMS-FMT وXYS-FMT، على التوالي، لاستكشاف التأثير العلاجي والآلية التنظيمية للفلورا الميكروبية المعوية على السلوك الاكتئابي. أخيرًا، قمنا بإجراء زراعة ميكروبية في فئران خالية من الجراثيم (GF) للتحقق بشكل أكبر من التفاعل بين ميكروبات الأمعاء وتقليم المشابك، مما يوضح أكثر أن ميكروبات الأمعاء أساسية في تخفيف الاكتئاب.
طرق
الحيوانات وإجراءات CUMS
العلاجات وجمع العينات
اختبارات سلوكية
اختبار تفضيل السكروز (SPT)
اختبار الحقل المفتوح (OFT)
تم إجراء اختبار السلوك في ظروف إضاءة محددة تبلغ 60 لوكس [27]. تم تنفيذ اختبار السلوك باستخدام برنامج تحليل السلوك المعترف به دوليًا (نظام تحليل برنامج إيثو فيجن، تكنولوجيا نولدوس، ليسبرغ، فيرجينيا، الولايات المتحدة الأمريكية) وشمل تحليل المسافة الإجمالية للحركة لكل مجموعة من الفئران.
اختبار تعليق الذيل (TST)
اختبار المتاهة المرفوعة (EPM)
اختبار التعرف على الأجسام الجديدة (NORT)
تم وضعها بين الجسم الجديد والقديم وسمح لها بالاستكشاف بحرية لمدة 10 دقائق. بعد كل جلسة تجريبية، تم تنظيف الأقفاص على الفور باستخدام محلول كحول بنسبة 75%. تم تحليل بيانات NORT باستخدام برنامج تحليل السلوك (نظام تحليل برنامج EthoVision، Noldus Information Technology، Leesburg، VA، الولايات المتحدة الأمريكية). تم تسجيل الوقت الذي قضته الفأرة في استكشاف كل جسم (الوقت الذي قضته في استكشاف الجسم المألوف، N1؛ الوقت الذي قضته في استكشاف الجسم الجديد، N2). تم حساب نسبة التمييز (DR، %) على النحو التالي:
مهمة متاهة Y
الاختبارات الحيوية
صبغة الهيماتوكسيلين والإيوزين (HE)
المورفولوجيا فوق الدقيقة للقولون
اختبار الامتصاص المناعي المرتبط بالإنزيم (ELISA)
تم تحديدها باستخدام مجموعة كشف ELISA (كوسابيو، ووهان، الصين). IL-6، IL-10، IL-1
تلطيخ المناعة الفلورية (IF)
التحليل الغربي (WB)
استخراج الحمض النووي البكتيري، تسلسل 16S rRNA، والتحليلات
تحليلات الميتابولوم
تم إجراء تحليل التمييز باستخدام المربعات (PLS-DA) باستخدام SIMCA
تحليل ارتباط البيانات
التحليل الإحصائي
النتائج
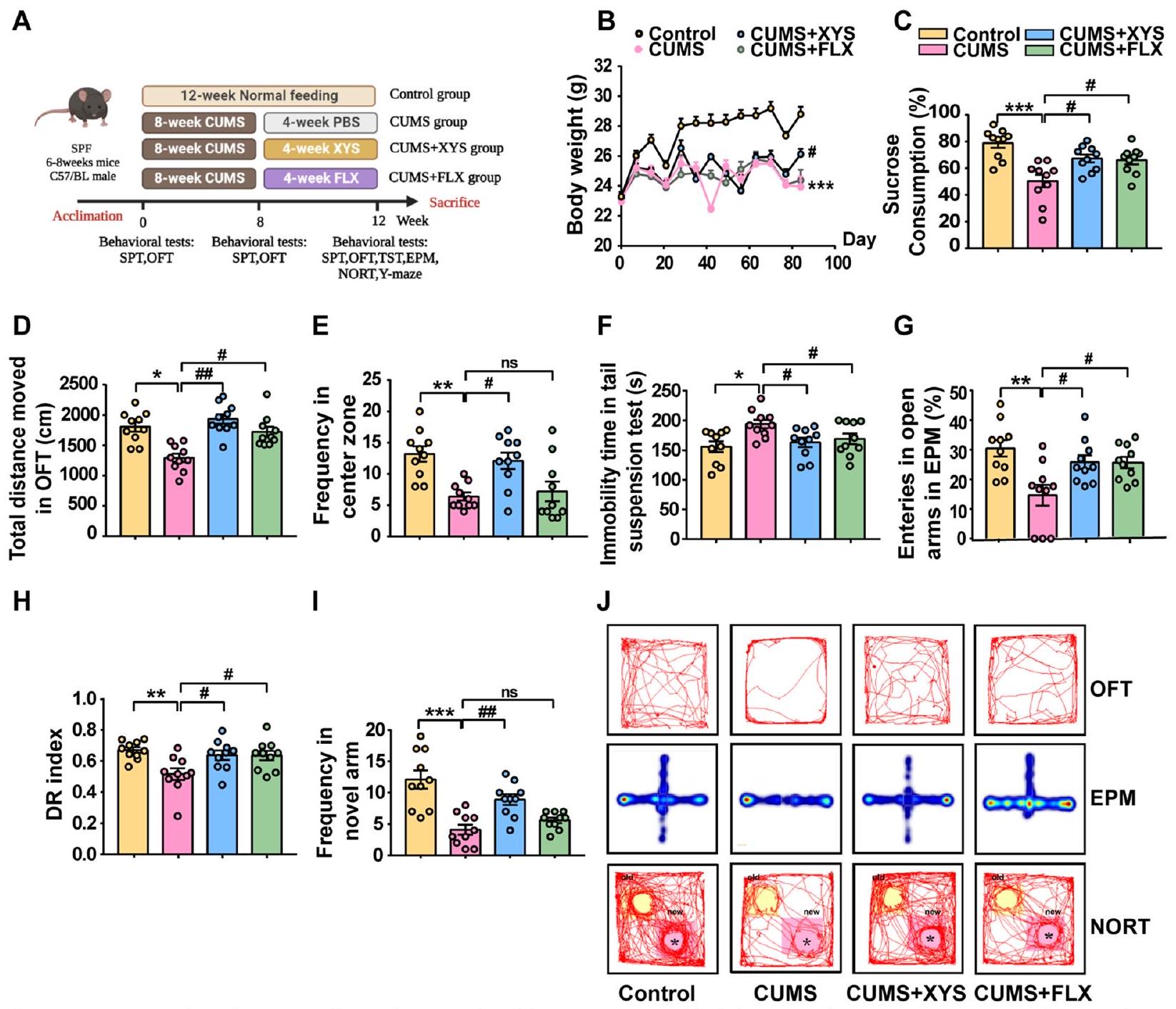
تم تقييم النشاط المحتمل لمضادات الاكتئاب لـ XYS على سلوكيات الاكتئاب الناتجة عن CUMS من خلال تحفيز سلوكيات شبيهة بالاكتئاب في الفئران عن طريق إعطاء CUMS لمدة 8 أسابيع، تليها 4 أسابيع من الإدارة اليومية عن طريق الفم لـ XYS (الشكل 2A). لم تُلاحظ أي اختلافات في وزن الجسم، أو تفضيل السكروز، أو الوظيفة الحركية بين المجموعات قبل التجربة (الشكل S1a-c). سلوكيات شبيهة بالاكتئاب ملحوظة.
تمت ملاحظتها في الفئران التي تلقت تدخل CUMS لمدة 8 أسابيع (الشكل S1d-g). بعد النجاح في إنشاء نموذج الفأر CUMS، تم فحص تأثير تدخل XYS على سلوك الفئران. خفف تدخل XYS بشكل كبير من سلوكيات الاكتئاب الناتجة عن CUMS مقارنة بمجموعة CUMS، كما يتضح من انخفاض ملحوظ في فقدان الوزن، وزيادة التفضيل في اختبار SPT، وزيادة المسافة الإجمالية وتكرار الدخول في اختبار OFT، وانخفاض وقت السكون في اختبار TST (الشكل 2B-F). كما حسّن علاج XYS بشكل كبير من سلوكيات القلق والضعف الإدراكي في الفئران التي تعاني من سلوكيات الاكتئاب الناتجة عن CUMS. أظهرت الفئران التي تلقت تدخل XYS زيادة في تكرار الدخول إلى الذراع المفتوحة في اختبار EPM (الشكل 2G) وزيادة في استكشاف المناطق الجديدة في اختبارات NORT (الشكل 2H) واختبار المتاهة Y (الشكل 2I). تظهر مسارات حركة الفئران في اختبارات OFT وEPM وNORT في الشكل 2J. تشير النتائج أعلاه إلى أن XYS له تأثيرات مضادة للاكتئاب كبيرة ويمكن دراستها بشكل أكبر كعلاج محتمل للاكتئاب.
السلوكيات الشبيهة بالاكتئاب مصحوبة بخلل في ميكروبيوم الأمعاء
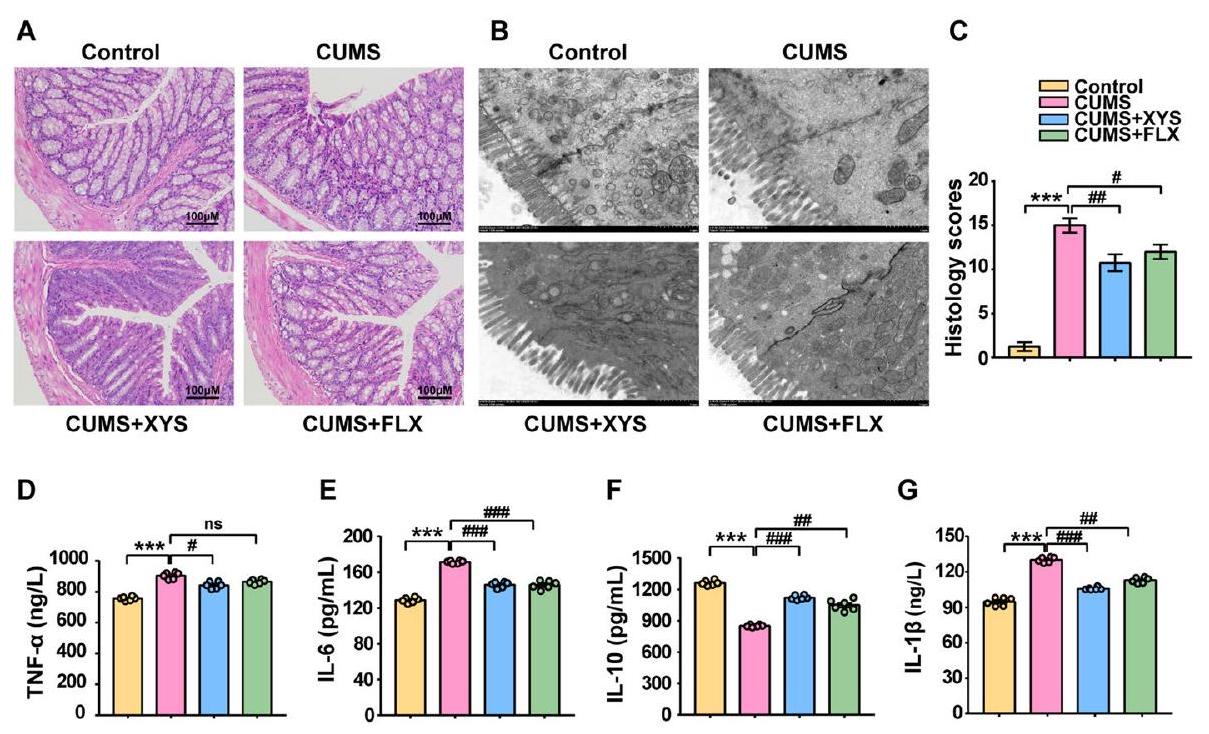
تم تحسين التهاب الأمعاء، وزاد حجم وعدد الزغابات المعوية القولونية، وتم عكس المحاذاة غير الطبيعية (الشكل 3A-C). بالإضافة إلى ذلك، قلل XYS من مستويات IL-
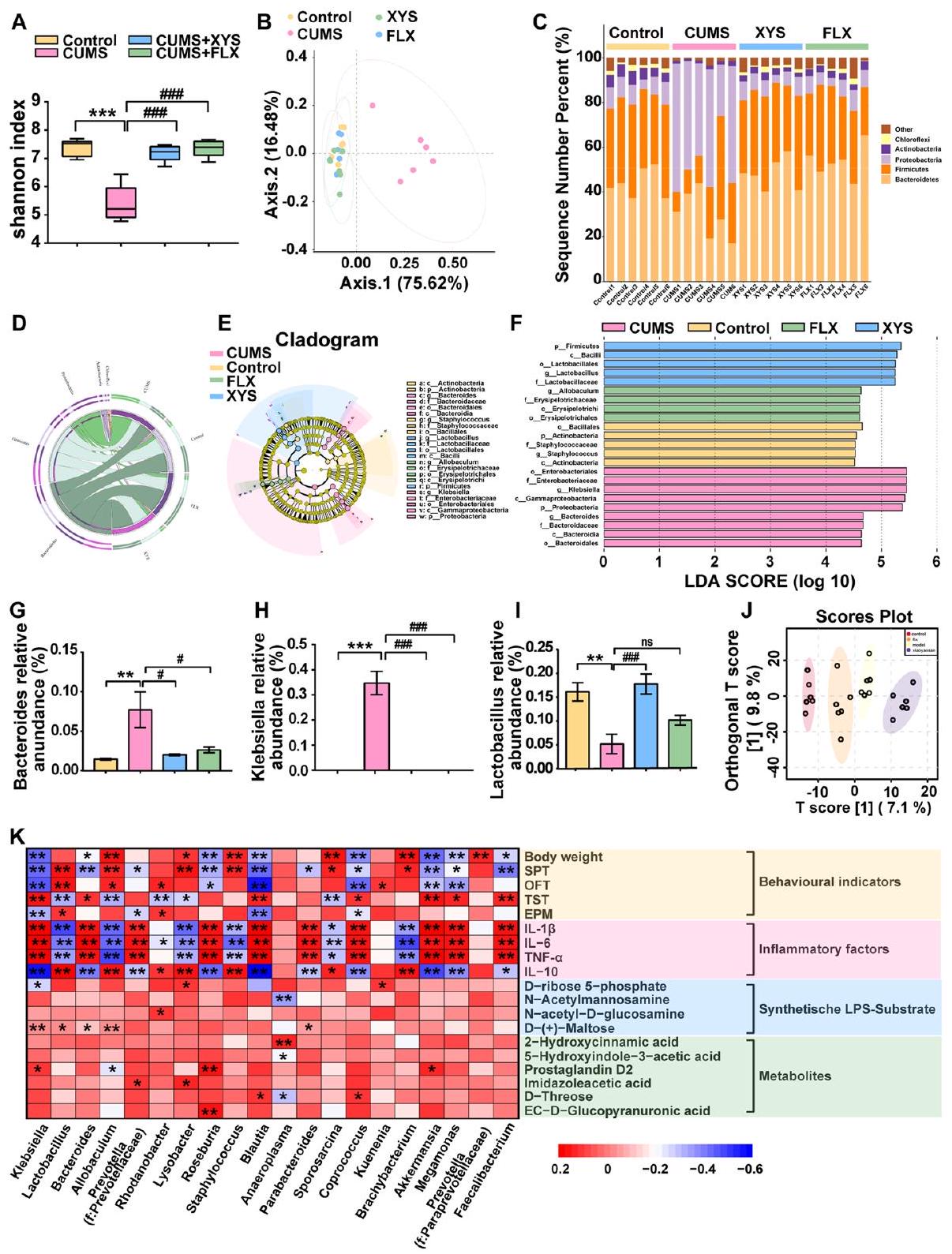
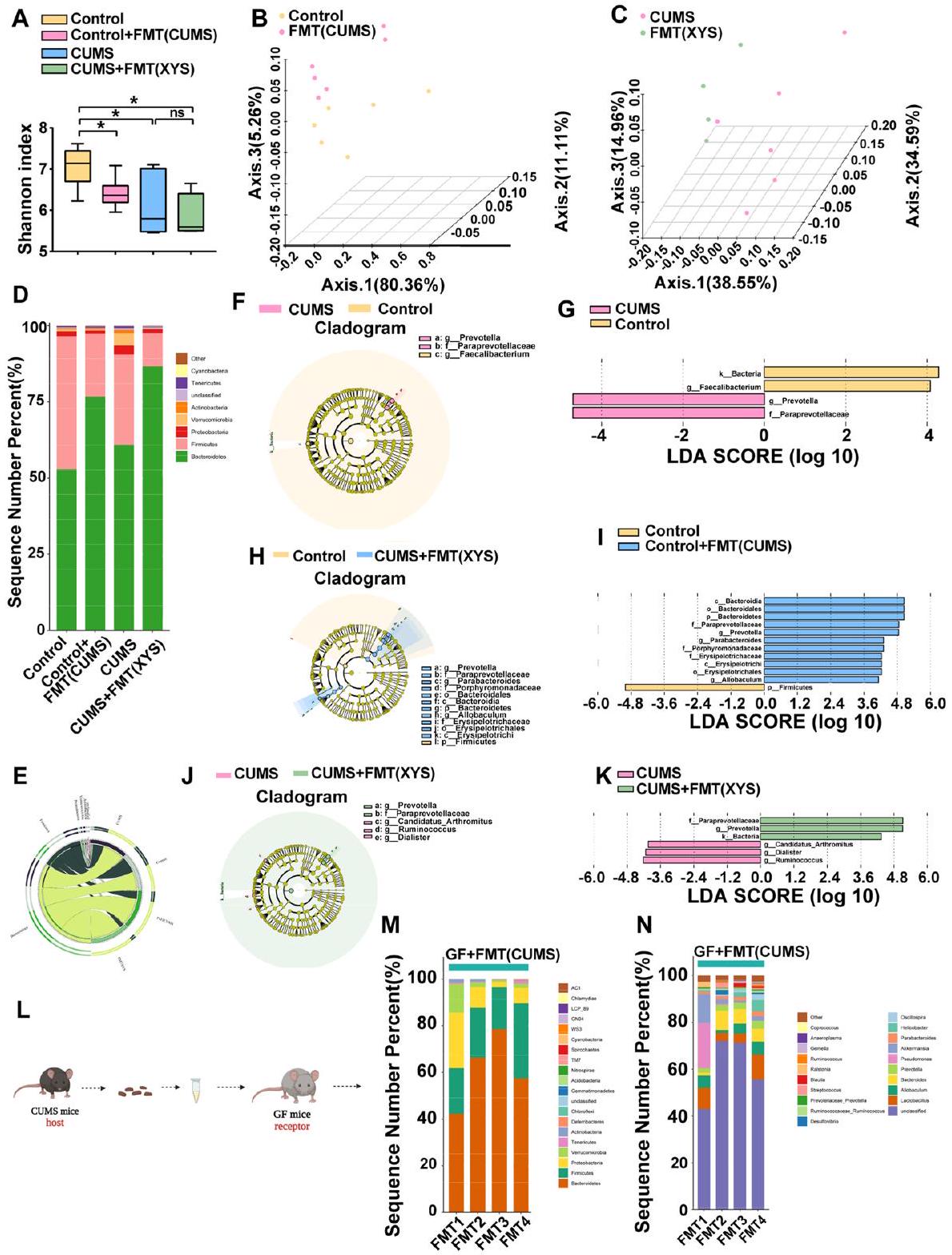
تم تحديد ما مجموعه 37 شعبة في هذه الدراسة. كانت Firmicutes وBacteroidetes وProteobacteria هي الشعب السائدة في الميكروبيوم البرازي للفئران. كانت Proteobacteria هي الشعبة السائدة في الميكروبيوم البرازي للفئران التي تظهر سلوكيات مشابهة للاكتئاب. قلل تدخل XYS بشكل كبير من وفرة Proteobacteria مقارنة بفئران CUMS التي لم تتلقَ علاجًا (الشكل 4C، D؛ الشكل S2d). أظهر مخطط شجري تم إنشاؤه بواسطة تحليل LEfSe لبيانات الميكروبيوم (الشكل 4E، F) تسعة وخمسة عائلات ذات وفرة مختلفة على مستوى العائلة في مجموعتي CUMS وXYS، على التوالي.
زادت الوفرة النسبية لبكتيريا اللاكتوباسيلوس في فئران CUMS (
المواد الناتجة عن LPS (الشكل S2k). مادتان ناتجتان عن LPS (D-( + )-مانوز و
تم تقييم المحتوى في المصل. كانت تركيزات LPS في مصل الفئران التي تظهر سلوكيات مشابهة للاكتئاب مرتفعة بشكل ملحوظ مقارنة بالفئران الضابطة (الشكل 5A). ومع ذلك، فإن إدارة XYS خففت من مستويات LPS، وهو ما يتماشى مع نتائج التسلسل التي لوحظت في تحليلات الميتابولوميات.
تشير هذه النتائج مجتمعة إلى أن تطور سلوك يشبه الاكتئاب يترافق مع اختلال في توازن الأمعاء (بما في ذلك الاستجابة الالتهابية القولونية، وتدمير وظيفة الحاجز القولوني، وتقليل تنوع الميكروبات المعوية، وتراكم المستقلبات الميكروبية – LPS). ومع ذلك، فإن مضادات الاكتئاب تثبط الاستجابة الالتهابية القولونية الناتجة عن الإجهاد المزمن، وتحسن وظيفة الحاجز، وتنظم تركيبة وعمليات الأيض للميكروبات المعوية (خاصة تثبيط وفرة البكتيريا سالبة الجرام ومستويات LPS).
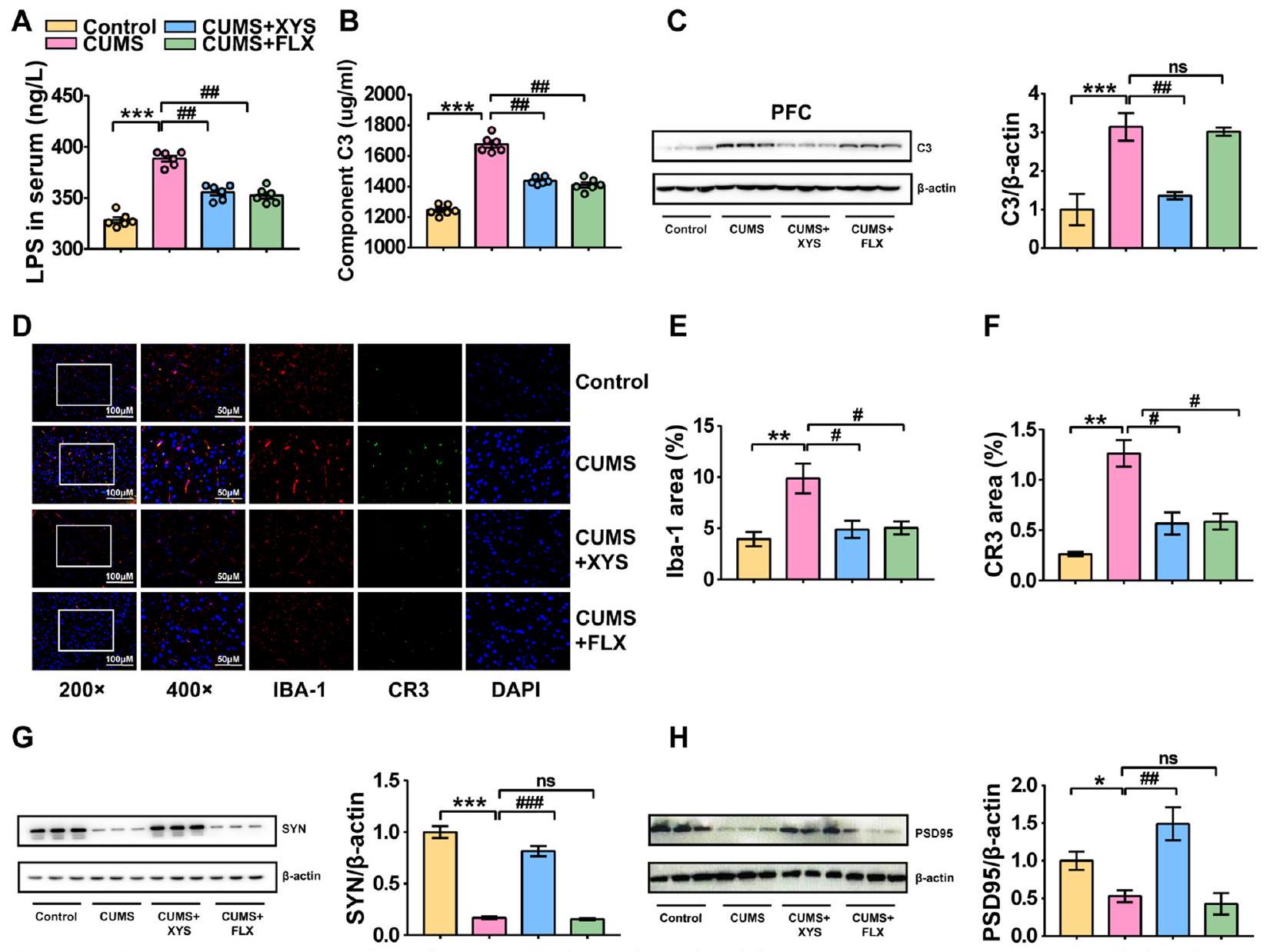
تشير هذه النتائج مجتمعة إلى أن تنشيط المكمل C3/CR3 والتقليم الشاذ للمشابك الذي تسببه الخلايا الدبقية الصغيرة هي مظاهر مرضية مهمة للاكتئاب. في الوقت نفسه، تقوم مضادات الاكتئاب بتثبيط تنشيط المكمل C3/CR3 الذي تسببه الضغوط المزمنة، وكذلك التقليم الشاذ للمشابك الذي تشارك فيه الخلايا الدبقية الصغيرة، مما يساعد على الحفاظ على النمو الطبيعي للخلايا العصبية المشبكية.
زراعة ميكروبات الأمعاء غير المنظمة تحفز تطور سلوكيات مشابهة للاكتئاب
أظهرت الفئران سلوكيات ملحوظة تشبه الاكتئاب والقلق بعد زراعة البراز، والتي كانت مصحوبة بضعف في الذاكرة المعرفية. الفئران SPF التي تلقت ميكروبيوتا البراز من الفئران التي تم تحفيزها بواسطة CUMS أظهرت فقدان الوزن، وانخفاض تفضيل السكروز، وانخفاض المسافة الإجمالية في اختبار فتح المجال، وانخفاض الرغبة في التجديد في اختبار تفضيل الأشياء الجديدة ومتاهة Y مقارنة بالفئران الضابطة؛ وهذا مشابه للفئران بعد تحفيز CUMS لمدة 8 أسابيع. تم ملاحظة نتائج مماثلة في الفئران GF. الفئران GF التي تلقت ميكروبيوتا البراز من فئران CUMS أظهرت انخفاضًا كبيرًا في المسافة الإجمالية للحركة في اختبار فتح المجال، وزيادة في وقت السكون في اختبار السكون، وضعف إدراكي في اختبار تفضيل الأشياء الجديدة ومتاهة Y. تشير هذه النتائج إلى أنه في ظل ظروف مستقلة عن الضغط، يمكن أن يؤدي تلقي زراعة براز من مضيف CUMS بسلوك يشبه الاكتئاب وضعف إدراكي إلى حدوث شذوذات سلوكية، بما في ذلك سلوكيات تشبه الاكتئاب.
اختلال ميكروبيوم الأمعاء أدى إلى التهاب القولون وتدمير الحاجز
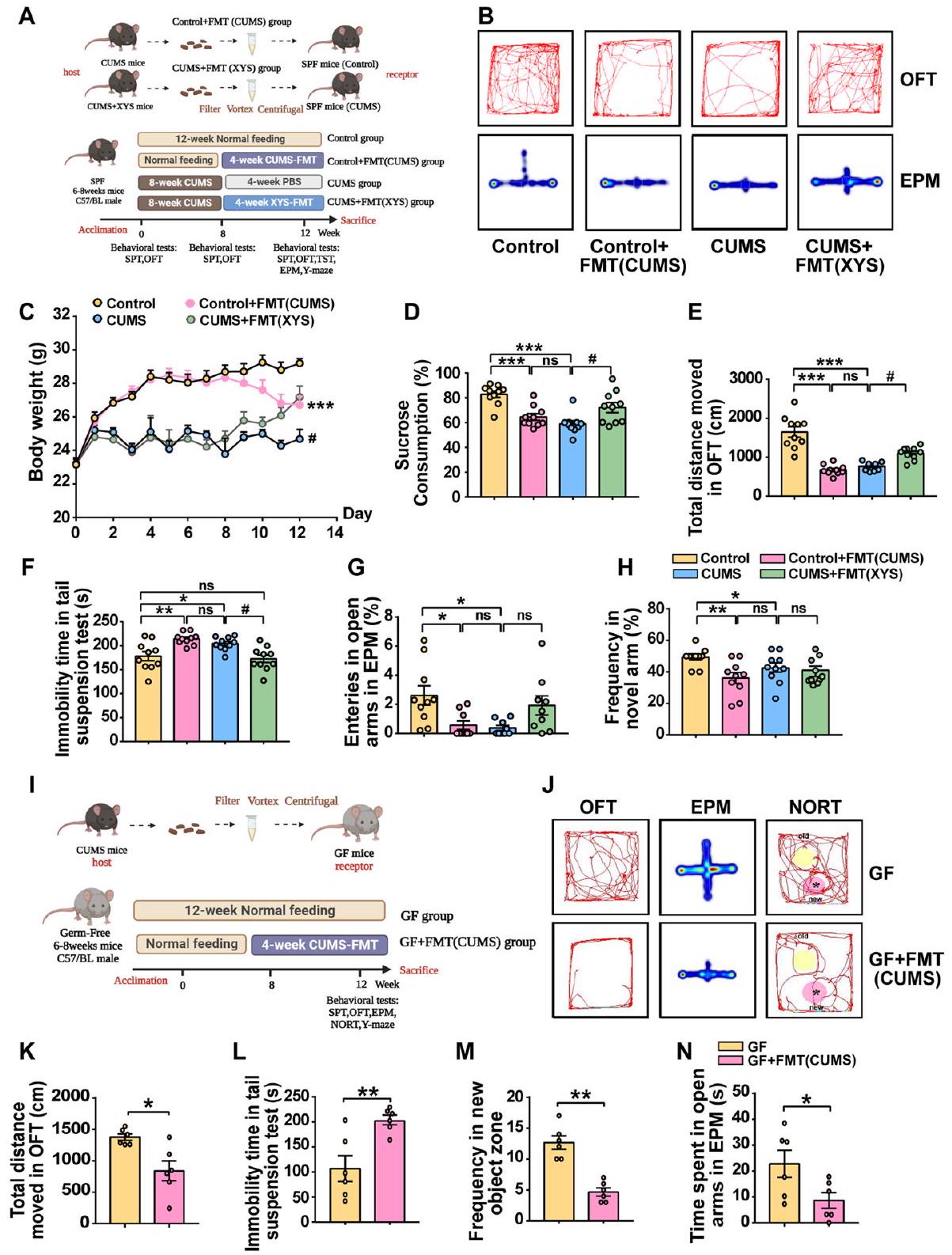
تم التحقق من تأثير الميكروبيوتا المعتمدة على مضادات الاكتئاب على الاكتئاب من خلال زراعة ميكروبيوتا البراز المأخوذة من الفئران التي تم إعطاؤها XYS في نموذج الاكتئاب الناتج عن الإجهاد المزمن.
الفئران. في فئران SPF، تم عكس الالتهاب القولوني الناتج عن CUMS بواسطة XYS-FMT (الشكل 7A). أظهرت المجهرية الإلكترونية الناقلة أن الزغابات المعوية كانت أقل حجمًا وعددًا وظهرت بمظهر غير طبيعي في مجموعة CUMS. زاد حجم وعدد الزغابات المعوية وتم عكس الترتيب غير الطبيعي بواسطة XYS-FMT (الشكل 7B). زاد XYS-FMT من
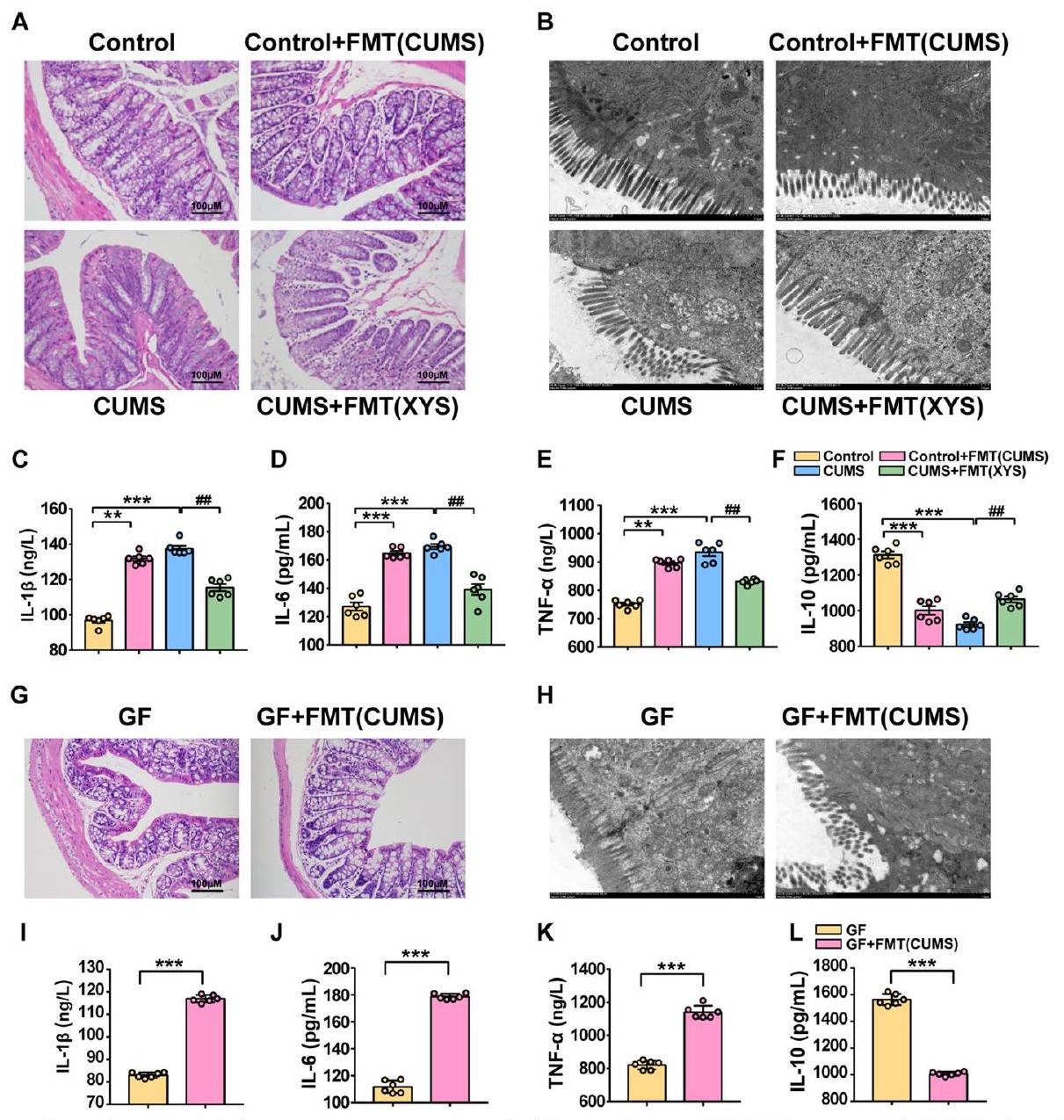
تشير هذه النتائج إلى أن CUMS-FMT تساهم في الاستجابة الالتهابية القولونية وتلف حاجز الأمعاء. بالإضافة إلى ذلك، فإن XYS-FMT خفف من الاستجابة الالتهابية القولونية الناتجة عن CUMS وحسن وظيفة الحاجز. وهذا يشير إلى أن ميكروبات الأمعاء غير المنظمة تتوسط الالتهاب القولوني وتفكك الحاجز، بينما كان لعلاج FMT مع مضادات الاكتئاب تأثير مثبط على الالتهاب القولوني وتفكك الحاجز.
توسط CUMS-FMT اضطراب ميكروبات الأمعاء واستعاد XYS-FMT التوازن المعوي
من خلال مؤشر شانون، تأثر بـ FMT (الشكل 8A؛ الشكل S5a-c:
في وفرة Lactobacillus وزيادة كبيرة في وفرة Prevotella (Prevotellaceae) مقارنةً بتلك الخاصة بمجموعة التحكم (الشكل S5d).
بعد ذلك، تم تقييم تأثير FMT على ميكروبات الأمعاء لدى المضيف. أشارت النتائج السابقة إلى أن الفئران SPF التي تتلقى CUMS-FMT تظهر سلوكيات شبيهة بالاكتئاب بشكل ملحوظ. وبالمثل، أظهرت الفئران SPF التي تتلقى CUMS-FMT أيضًا هيكلًا وتركيبًا ميكروبيًا معويًا متغيرًا. على مستوى الشعبة، كانت
وفرة Bacteroidetes قد زادت بشكل كبير في الفئران التي تتلقى CUMS-FMT مقارنةً بتلك الخاصة بمجموعة التحكم، بينما لم يكن هناك فرق كبير في وفرة Proteobacteria (الشكل 8D، E). ومع ذلك، على مستوى النوع، تم تحفيز تأثير كبير بواسطة FMT. تم إنشاء مخطط شجري بواسطة تحليل LEfSe لبيانات الميكروبيوم (الشكل 8H، I) وأظهر 11 مجموعة من الأنواع بوفرة مختلفة على مستوى النوع في مجموعة CUMS-FMT ومجموعة واحدة من الأنواع بوفرة مختلفة على مستوى النوع في مجموعة التحكم (
بالإضافة إلى ذلك، لوحظت تغييرات في ميكروبات الفئران GF التي تلقت CUMS-FMT. لا تحتوي الفئران GF على أي ميكروبات معروفة في أمعائها؛ لذلك، كانت التغييرات في ميكروباتها أكثر وضوحًا من تلك الخاصة بالفئران SPF. على مستوى الشعبة، كانت Proteobacteria واحدة من الشُعب السائدة في الفئران بعد CUMS-FMT، مشابهةً لميكروبات الفئران التي تعرضت لـ CUMS. بشكل متسق، على مستوى النوع، كانت وفرة Bacteroides تتوافق مع ميكروبات الفئران المعرضة للضغط (الشكل 8L).
تسبب اختلال ميكروبات الأمعاء في تنشيط المكمل C3 وتقليم المشابك الشاذ بواسطة الخلايا الدبقية
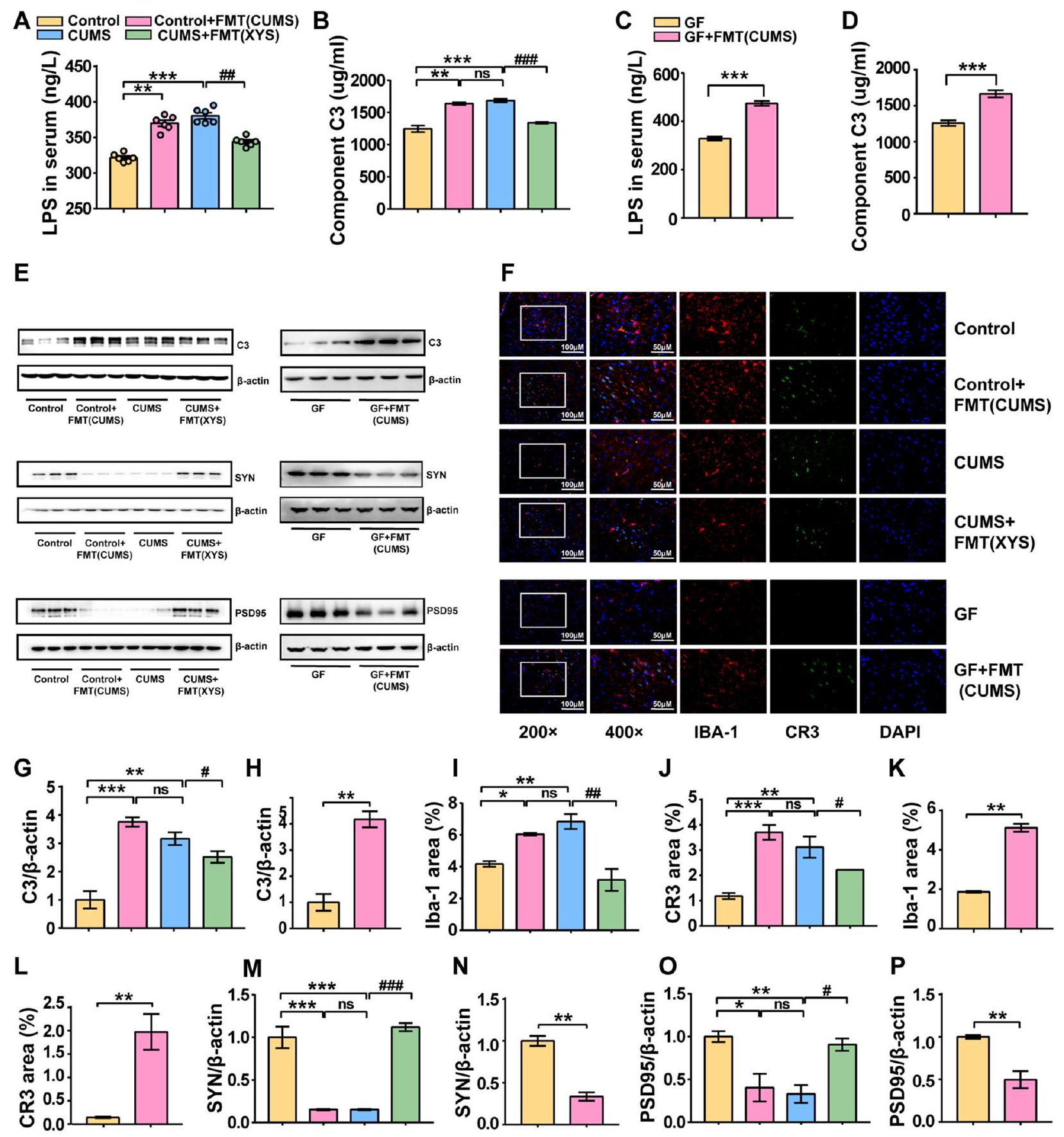
ومع ذلك، ليس من الواضح ما إذا كان تنشيط المكمل C3/CR3 في PFC وتقليم المشابك الشاذ بواسطة الخلايا الدبقية مرتبطًا مباشرةً بتغييرات في ميكروبات الأمعاء. لاستكشاف ما إذا كان استعمار الميكروبات البرازية بدون تحفيز ضغط يمكن أن يؤدي إلى تغييرات في المكمل C3 وتقليم المشابك الشاذ بواسطة الخلايا الدبقية، تم إجراء FMT من الفئران المستحثة بـ CUMS إلى الفئران SPF وGF. كانت مستويات LPS وC3 في مصل الفئران قد زادت بشكل كبير بعد تلقي ميكروبات البراز من الفئران المستحثة بـ CUMS مقارنةً بتلك الخاصة بالفئران SPF الضابطة (الشكل 9A، B). تم الإبلاغ عن نتائج متسقة أيضًا للفئران GF (الشكل 9C، D). علاوة على ذلك، متسقة مع تحفيز CUMS، لوحظت زيادة كبيرة في تعبير البروتين للمكمل C3 في أنسجة PFC لكل من الفئران SPF وGF بعد تلقي ميكروبات البراز من الفئران المستحثة بـ CUMS (الشكل 9E). بالإضافة إلى ذلك، أظهرت نتائج المناعية الفلورية المستندة إلى CR3 وIBA-1 أن CUMS-FMT حفزت تنشيط الخلايا الدبقية في PFC وزادت من تعبير CR3، مما يشير إلى أن CUMS-FMT يمكن أن تحفز مباشرةً تنشيط مسار C3/CR3 (الشكل 9F-L). كانت التغييرات التي أحدثها LPS في مستويات تعبير CD68 وIBA-1 متسقة أيضًا مع ضغط CUMS (الشكل S3d-i). لوحظت مستويات تعبير منخفضة لـ SYN وPSD95، مما يشير أيضًا إلى تلف عصبي ناتج عن تقليم مشابك غير طبيعي (الشكل 9M-P؛ الملف الإضافي 3).
المناقشة
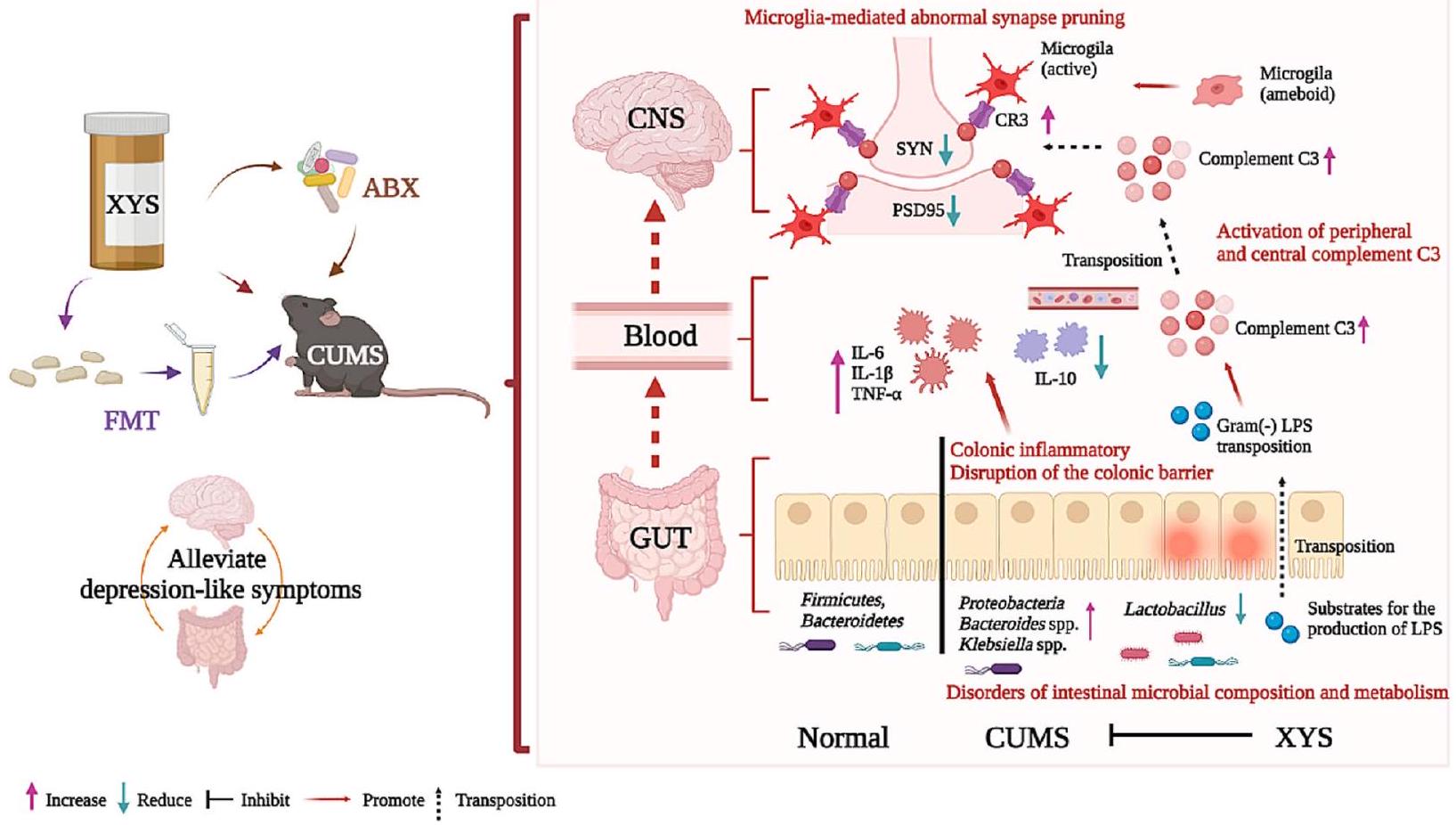
لدواء مضاد للاكتئاب (XYS) حسّن سلوكيات شبيهة بالاكتئاب، وسلوكيات شبيهة بالقلق، والضعف الإدراكي في الفئران وكذلك منع اختلال المكمل الناتج عن اختلال ميكروبيوم الأمعاء والاضطرابات في تقليم المشابك المتعلق بالمكمل. علاوة على ذلك، أكدت زراعة البراز CUMS-FMT في الفئران SPF و GF وجود ارتباط مباشر بين ميكروبيوم الأمعاء ونظام المكمل وتقليم المشابك الدبقية الصغيرة. حسّن XYSFMT بشكل كبير سلوكيات شبيهة بالاكتئاب في الفئران، مما يشير إلى أن الآليات الأساسية لفعالية مضادات الاكتئاب XYS تعتمد بشكل رئيسي على تنظيم التفاعل بين الأمعاء والدماغ. بالإضافة إلى ذلك، فإن استخدام المضادات الحيوية واسعة الطيف يلغي تحسين السلوك الناتج عن مضادات الاكتئاب، مما يبرز الدور الأساسي لميكروبيوم الأمعاء في التوسط في سلوكيات شبيهة بالاكتئاب.
أسابيع) مع مضادات حيوية مختلطة يمكن أن يؤدي إلى سلوكيات شبيهة بالاكتئاب في الفئران [33، 34]. بالإضافة إلى ذلك، اقترحت نتائجنا أن علاج المضادات الحيوية عن طريق الفم لمدة أسبوع واحد لا يؤثر على سلوك SPF (تم عرض نتائج الدراسة في الملف الإضافي 4). لذلك، لتجنب تأثير تدخل المضادات الحيوية على الحالة الاكتئابية للفئران، تم إعطاء تدخل مضاد حيوي قصير الأمد (7 أيام) لإزالة وتلاعب الميكروبات المعوية للفئران دون تفاقم سلوكيات شبيهة بالاكتئاب للفئران. تم القضاء على تأثير مضاد الاكتئاب لـ XYS بعد إعطاء ABX لإزالة ميكروبيوم الأمعاء، مما يشير إلى أن وجود الميكروبات المعوية ضروري لـ XYS لتحقيق تأثيره المضاد للاكتئاب. من ناحية، يؤدي اختفاء الميكروبيوم إلى تثبيط امتصاص واستقلاب المواد الفعالة المضادة للاكتئاب في XYS وعدم فعالية الأنشطة المضادة للاكتئاب اللاحقة؛ من ناحية أخرى، بسبب التغيرات في البيئة الميكروبية المعوية، لا يمكن تحقيق التأثيرات الشبيهة بالبريبايوتيك لـ XYS المرتبطة بمضادات الاكتئاب. لذلك، تم استخدام طريقة FMT لاستكشاف تحسين سلوكيات شبيهة بالاكتئاب في الفئران المعالجة ببكتيريا براز مضادة للاكتئاب (ميكروبيوم الأمعاء، مع أو بدون مواد أيضية). تشير نتائجنا إلى أن زراعة براز من المضيف المعالج بمضادات الاكتئاب في الفئران المكتئبة حسنت سلوكيات شبيهة بالاكتئاب في الفئران المعرضة لـ CUMS. وهذا يشير إلى أن XYS يمكن أن يحسن أعراض الاكتئاب مباشرة من خلال استعمار الفلورا المعوية. تؤكد هذه النتائج أن العمل الديناميكي الدوائي لـ XYS كمضاد للاكتئاب محتمل يعتمد بشكل رئيسي على خصائصه الشبيهة بالبريبايوتيك.
[40]. بشكل متسق، في الدراسة الحالية، كانت وفرة البكتيريا البروتيوبكتيرية مرتفعة بشكل ملحوظ في نموذج الاكتئاب الناتج عن CUMS. أظهرت تحليل LDA أن مكملات XYS قللت من وفرة البروتيوبكتيريا على مستوى الفيلوم، وكذلك من الأنواع الأدنى، مثل Enterobacteriales وEnterobacteriaceae وKlebsiella على مستويات الطلب والعائلة والجنس، على التوالي، في الفئران المعرضة لـ CUMS. أظهرت الدراسات السابقة أن إعطاء Klebsiella oxytoca وEscherichia coli وCronobacter sakazakii، التي تنتمي إلى Enterobacteriaceae، بشكل منفصل أو مجتمعة، تسبب سلوكيات شبيهة بالاكتئاب في كل من الفئران GF وSPF، مما يشير إلى أن البروتيوبكتيريا مرتبطة ارتباطًا وثيقًا بالاكتئاب [41]. تم ربط الميكروبيوم الذي ينتمي إلى الفيلوم Bacteroidetes بالإدراك والأمراض التنكسية العصبية. أظهرت الدراسات السريرية أن الرضع الذين لديهم مستويات عالية من Bacteroides في الأمعاء يظهرون أداءً إدراكيًا أعلى في سن 1 و2 [42]. في الدراسة الحالية، وجدنا أن XYS زاد من وفرة Bacteroidetes على مستوى الفيلوم، مما يشير إلى أنه قد يكون مسؤولًا عن تحسين العجز الإدراكي. علاوة على ذلك، على مستوى الجنس، قلل XYS من وفرة Bacteroides وزاد من وفرة Lactobacillus. يُعتقد أن Bacteroides مرتبطة باضطراب الاكتئاب الرئيسي (MDD) [43]. كانت مستويات عالية من Bacteroides spp. موجودة في عينات البراز من 156 مريضًا يعانون من MDD، مقارنة بالأفراد الأصحاء [44]. يُعتبر Lactobacillus بروبيوتيك له تأثير مثبط على الاكتئاب [45]. وقد تم الإبلاغ عن أن إنتاج بيروكسيد الهيدروجين بواسطة Lactobacillus قد يمنع سلوكيات الاكتئاب الناتجة عن CUMS عن طريق تثبيط إنزيم الإندولامين-2،3-ديوكسيجيناز المعوي مباشرة [46]. وجدنا أن إعطاء XYS قلل بشكل ملحوظ من تعبير Bacteroides وزاد من تعبير Lactobacillus. بشكل عام، تدعم هذه النتائج أن مكملات XYS تحسن من تركيب الميكروبيوم المعوي، وخاصةً من خلال قمع البروتيوبكتيريا وتعزيز Bacteroidetes، مما قد يساهم في الوقاية من سلوكيات شبيهة بالاكتئاب والعجز الإدراكي المصاحب في الفئران التي تعاني من الاكتئاب الناتج عن الإجهاد المزمن. بالإضافة إلى ذلك، فإن تنوع الميكروبيوم البرازي أقل في المرضى الذين يعانون من الاكتئاب مقارنةً بالضوابط الأصحاء. تم تقليل تنوع الميكروبيوم المعوي في فئران CUMS، ومنعت مكملات XYS هذه التغيرات في الميكروبيوم المعوي. لذلك، يُفترض أن تنظيم مضادات الاكتئاب على تركيب وتنوع الميكروبيوم المعوي قد يكون حاسمًا لتحسين الاكتئاب.
للمضيفين الأصحاء. بالنسبة لـ FMT في الفئران SPF، تم إزعاج ميكروبيوم الفئران الضابطة، بدلاً من استبداله بالميكروبيوم من فئران CUMS. على مستوى الفيلوم، وبما يتعارض مع التغيرات الناتجة عن الإجهاد في الميكروبيوم المعوي، لم يُلاحظ أي زيادة ملحوظة في وفرة البروتيوبكتيريا بعد CUMS-FMT. ومع ذلك، على مستوى الجنس، لوحظ انخفاض في وفرة Lactobacillus وزيادة في وفرة Bacteroides، وهو ما يتماشى مع التغيرات في الفئران المعرضة لـ CUMS. قد يكون سبب هذه الظاهرة هو أنه خلال عملية FMT، يكون للميكروبيوم المعوي الأصلي للمضيف مقاومة معينة للميكروبيوم CUMS؛ لذلك، فإن التغيرات على مستوى الفيلوم ليست متسقة تمامًا مع التغيرات في ميكروبيوم فئران CUMS. لذلك، قمنا بإجراء CUMS-FMT في الفئران GF. بما يتماشى مع توقعاتنا، تم تكرار توقيع الميكروبات المعوية (بما في ذلك زيادة وفرة البروتيوبكتيريا على مستوى الفيلوم وBacteroides على مستوى الجنس) لفئران CUMS في الفئران GF بسبب غياب الميكروبات الساكنة في الأمعاء. أظهرت كل من الفئران SPF وGF سلوكيات شبيهة بالاكتئاب بعد علاج CUMS-FMT. وهذا يؤكد أكثر أن الاضطرابات في الميكروبيوم، حتى على مستوى الجنس، كافية للتأثير على عدم توازن الميكروبيوم المعوي بشكل عام وتحفيز ظهور سلوكيات شبيهة بالاكتئاب. في هذه الدراسة، تم إجراء FMT حصريًا من فئران CUMS إلى فئران GF؛ لم يتم إجراء FMT من فئران SPF الضابطة إلى فئران GF. تشير المراجع الحديثة عالية الجودة باستمرار إلى أن FMT من الحيوانات غير المجهدة لا تحفز سلوكيات الاكتئاب في الفئران GF [47-49]. أشارت الدراسات السابقة إلى أن الفئران GF لم تظهر سلوكيات شبيهة بالاكتئاب حتى بعد تلقي بكتيريا برازية من فئران ضابطة أو أفراد أصحاء. وهذا يشير إلى أن البكتيريا البرازية المزروعة من الفئران أو الأفراد غير المجهدين لم تؤثر على سلوك الفئران GF [47.48]. بعد ذلك، تم ملاحظة تأثير XYSFMT على الميكروبات المعوية في فئران CUMS. على مستوى الفيلوم، قلل XYS-FMT من وفرة البروتيوبكتيريا وزاد من وفرة Bacteroidetes، وهو ما يتماشى مع تنظيم الميكروبيوم المعوي بواسطة إعطاء XYS. على مستوى الجنس، لوحظ زيادة في وفرة Lactobacillus. والأهم من ذلك، تم ملاحظة تغييرات في Prevotellaceae على مستوى العائلة وPrevotella على مستوى الجنس. يمكن لأعضاء Prevotellaceae، المعروفين كمتعايشين معويين، إنتاج SCFAs من خلال تخمير الألياف الغذائية والمخاط المعوي [50]. أظهرت الدراسات أن تقليل Prevotellaceae يؤدي إلى زيادة التعرض لنظام الإندوتوكسين البكتيري وزيادة نفاذية الأمعاء، مما يحفز الالتهاب [51]. في هذه الدراسة، أظهر تحليل LDA أن XYS-FMT زاد من وفرة Prevotellaceae على مستوى العائلة و
يتجلى التداخل بين ميكروبات الأمعاء وسلوك المضيف أيضًا في تعطيل وظيفة حاجز الأمعاء وتنظيم المستقلبات الميكروبية. يتم الحفاظ على التوازن المعوي من خلال التداخل بين الميكروبيوتا وحاجز الأمعاء والجهاز المناعي. غالبًا ما يؤدي عدم التوازن في الميكروبيوم إلى تدمير حاجز الأمعاء والجهاز المناعي. في ظل الظروف الفسيولوجية الطبيعية، تدعم خلايا الظهارة المعوية والميكروبيومات والخلايا المناعية حالة مستقرة في النظام المعوي. تتلقى خلايا الظهارة المعوية إشارات من الميكروبيوم، مثل المستقلبات الميكروبية أو الميكروبات، للحفاظ على الحاجز المخاطي. كما ينظم الميكروبيوم مناعة المضيف من خلال مستقلباته والسموم الداخلية. علاوة على ذلك، يمكن أن تؤثر الخلايا المناعية بشكل مباشر أو غير مباشر على الميكروبيوم من خلال إفراز السيتوكينات أو الكيموكينات. ومع ذلك، يؤدي عدم التوازن في الميكروبيوم إلى تدمير حاجز الأمعاء وزيادة نشاط المناعة المعوية. أظهرت الدراسات أن تغييرًا في هيكل الميكروبيوم يؤدي إلى زيادة في بروتينات الوصلات الضيقة المعوية ونفاذية الأمعاء. هذه الأحداث تحفز الالتهاب في القولون وتنتج سيتوكينات مؤيدة للالتهاب مثل IL-6 وIL-1.
أن CUMS أو CUMS-FMT يمكن أن تؤدي إلى تعطيل وظيفة حاجز القولون، وإنتاج التهاب القولون، وارتفاع مستوى السيتوكينات البروالتهابية في المصل IL-6 وIL-1
الدم، الذي يتماشى مع الزيادة في وفرة البكتيريا المنتجة لـ LPS في ميكروبيوم الأمعاء. كما أكدت تحليل الارتباط أن الميكروبات المعوية كانت مرتبطة بشكل كبير بإنتاج LPS.
التعرض المفرط لـ LPS يحفز التعبير عن نظام المكملات وتنشيط الخلايا الدبقية الصغيرة. المكملات، وهو بروتين في المصل، له نشاط إنزيمي ويقوم بوساطة الاستجابات المناعية والالتهابية. يعتبر المكمل C3 بروتينًا رئيسيًا في نظام المكملات. تم ملاحظة مستويات مرتفعة من C3 في أدمغة المرضى الذين يعانون من الاكتئاب ونماذج الاكتئاب الحيوانية، ويعتقد أنها مرتبطة إيجابيًا بشدة الأعراض الاكتئابية. وقد وجد الباحثون أن الإجهاد المزمن يمكن أن يؤدي إلى زيادة التعبير عن C3 في القشرة الجبهية الأمامية للفئران، وأن الفئران التي تفتقر إلى C3 لا تطور سلوكيات مشابهة للاكتئاب، مما يشير إلى أن مستوى مرتفع من C3 هو شرط مهم لظهور الاكتئاب. للأسف، لا يزال مصدر المكمل C3 (سواء من الجهاز العصبي المركزي مباشرة أو عبر الهجرة الالتهابية من المحيط إلى الدماغ) غير واضح. يُعتقد أن LPS هو منشط رئيسي للمكمل C3، حيث يقوم بوساطة مستويات المكمل C3 في المصل المحيطي.
[66]. بعد ملاحظة ارتفاع LPS المنظم بواسطة ميكروبات الأمعاء، تم فحص تعبير C3 في مصل الدم والقشرة الجبهية الأمامية للفئران. يتماشى ذلك مع التغيرات الناتجة عن الإجهاد في المكملات، حيث يشير التعبير العالي عن C3 في القشرة المحيطية والجبهية الأمامية بعد زراعة البراز إلى أن الاضطرابات الميكروبية المعوية قد تكون محفزًا وعاملاً مفاقمًا لتنشيط C3. بالإضافة إلى ذلك، تم ملاحظة تنشيط الميكروغليا الذي تم تحفيزه بشكل خاص بواسطة LPS في الجهاز العصبي المركزي. كخلايا فعالة مناعية فطرية في الجهاز العصبي المركزي، تلعب الميكروغليا دورًا مهمًا في الحفاظ على تطور الخلايا العصبية ووظيفة الأعصاب الطبيعية [67]. من بينها، يعتبر تقليم المشابك الطريقة الرئيسية للميكروغليا للتخلص من المشابك وهو آلية مهمة لتقليم الخلايا العصبية بشكل انتقائي للحفاظ على الأنظمة العصبية الطبيعية [68]. التفاعل مع نظام المكملات، الذي يتوسط تقليم المشابك بواسطة الميكروغليا، أمر حاسم لتنظيم شكل المشابك بواسطة الميكروغليا [69]. أظهرت الأبحاث الحديثة أن الإفراط في التعبير عن المكمل C3 يؤثر على البلعمة وتقليص المشابك للميكروغليا، مما يؤدي إلى الاكتئاب وسلوك إدراكي غير طبيعي [70]. CR3 هو مستقبل المكمل C3 الذي يتم التعبير عنه بواسطة الميكروغليا، وترابطه مع
تشير نتائجنا بشكل جماعي إلى أن اختلال التوازن الميكروبي في الأمعاء يسبب سلوكيات مشابهة للاكتئاب من خلال تقليم المشابك غير الطبيعي في الخلايا الدبقية الصغيرة، والذي يتم بوساطة المكمل C3. علاوة على ذلك، تلعب التغيرات التي تحدثها مضادات الاكتئاب في الميكروبيوم، وخاصة تثبيط البكتيريا البروتيوبكتيرية، دورًا رئيسيًا في تخفيف الاكتئاب. من خلال تنظيم المكمل C3 والخلايا الدبقية الصغيرة المعنية في مسار التواصل بين الأمعاء والدماغ في مسببات الاكتئاب، يصبح تثبيط التقليم المشبكي غير الطبيعي هو المفتاح لاستهداف الميكروبات لعلاج الاكتئاب. تم تلخيص هذه النتائج في الشكل 10.
الخاتمة
الاختصارات
| ABX | المضادات الحيوية |
| C3 | المكون 3 |
| كومز | ضغط خفيف مزمن غير متوقع |
| CR3 | مستقبلات المكمل 3 |
| الجهاز العصبي المركزي | الجهاز العصبي المركزي |
| إي بي إم | اختبار المتاهة المرتفعة زائد |
| إليزا | اختبار الامتصاص المناعي المرتبط بالإنزيم |
| FMT | زراعة ميكروبات البراز |
| فلكس | فلوكستين |
| صديقة | خالي من الجراثيم |
| هو | الهيماتوكسيلين والإيوزين |
| إذا | المناعية الفلورية |
| إل | إنترلوكين |
| كيج | موسوعة كيوتو للجينات والجينومات |
| ليفس | حجم تأثير تحليل التمييز الخطي |
| LPS | ليبوبوليسكاريد |
| نورت | اختبار التعرف على الأجسام الجديدة |
| OFT | اختبار الحقل المفتوح |
| تحليل التمييز القائم على النماذج الجزئية | تحليل التمييز باستخدام المربعات الصغرى المتعامدة الجزئية |
| PBS | محلول ملحي معزز بالفوسفات |
| تحليل المكونات الرئيسية باستخدام الانحدار الجزئي | تحليل التمييز باستخدام المربعات الصغرى الجزئية |
| تحليل المكونات الرئيسية | تحليل المكونات الرئيسية |
| PFC | القشرة الجبهية الأمامية |
| PSD95 | كثافة ما بعد المشبك 95 |
| SPF | خالي من مسببات الأمراض المحددة |
| SPT | اختبار تفضيل السكروز |
| سين | سيناپسين |
| TST | اختبار تعليق الذيل |
| TNF | عامل نخر الورم |
| UHPLC-QTOF-MS | الكروماتوغرافيا السائلة عالية الأداء – مطياف الكتلة رباعي القطب بتقنية وقت الطيران |
| منظمة الصحة العالمية | منظمة الصحة العالمية |
| WB | التحليل الغربي |
| XYS | شياوياوسان |
معلومات إضافية
ملف إضافي 2.
ملف إضافي 4.
يعني
الملف الإضافي 9: الشكل التوضيحي 5. اضطراب ميكروبيوم الأمعاء في الفئران الناتج عن CUMS-FMT؛ تنظيم XYS-FMT لتكوين ميكروبيوم الأمعاء. تنوع ألفا موضح بواسطة A: مؤشر سيمبسون. B: المؤشر المرصود. C: مؤشر تشاو1. D: تغيير ميكروبيوم الأمعاء على مستوى الجنس (التحكم مقابل CUMS). E: تغيير ميكروبيوم الأمعاء على مستوى الجنس (التحكم مقابل التحكم+FMT(CUMS)). F: تغيير ميكروبيوم الأمعاء على مستوى الجنس (CUMS مقابل CUMS+FMT(XYS)).
شكر وتقدير
مساهمات المؤلفين
تمويل
توفر البيانات والمواد
الإعلانات
موافقة الأخلاقيات والموافقة على المشاركة
الموافقة على النشر
المصالح المتنافسة
تفاصيل المؤلف
تم النشر على الإنترنت: 20 فبراير 2024
References
- Wolf J, Padberg F, Nenov-Matt T, Amann BL, Barton BB, Tang J, et al. Suicidal behaviors are associated with loneliness and decrease during inpatient CBASP treatment for persistent depressive disorder. J Psychiatr Res. 2022;154:139-44.
- Sender R, Fuchs S, Milo R. Are we really vastly outnumbered? Revisiting the ratio of bacterial to host cells in humans. Cell. 2016;164:337-40.
- Dinan TG, Cryan JF. Gut instincts: microbiota as a key regulator of brain development, ageing and neurodegeneration. J Physiol. 2017;595:489-503.
- Wu X, Xia Y, He F, Zhu C. Intestinal mycobiota in health and diseases: from a disrupted equilibrium to clinical opportunities. Microbiome. 2021;9:1-18.
- Tian T, Mao Q, Xie J, Wang Y, Shao WH, Zhong Q, et al. Multi-omics data reveals the disturbance of glycerophospholipid metabolism caused by disordered gut microbiota in depressed mice. J Adv Res. 2022;39:135-45.
- Simkin DR. Microbiome and mental health, specifically as it relates to adolescents. Curr Psychiatry Rep. 2019;21:1-12.
- Lahtinen P, Jalanka J, Hartikainen A, Mattila E, Hillilä M, Punkkinen J, et al. Randomised clinical trial: faecal microbiota transplantation versus autologous placebo administered via colonoscopy in irritable bowel syndrome. Aliment Pharmacol Ther. 2020;51:1321-31.
- Zhang YQ, Lin WP, Huang LP, Zhao B, Zhang CC, Yin DM. Dopamine D2 receptor regulates cortical synaptic pruning in rodents. Nat Commun. 2021;12:1-17.
- Duman RS, Aghajanian GK. Synaptic dysfunction in depression: potential therapeutic targets. Science. 2012;338:68-72.
- Hong S, Beja-Glasser VF, Nfonoyim BM, Frouin A, Li S, Ramakrishnan S, et al. Complement and microglia mediate early synapse loss in Alzheimer mouse models. Science. 2016;352:712-6.
- Zhang MM, Guo MX, Zhang QP, Chen XQ, Li NZ, Liu Q, et al. IL-1R/C3aR signaling regulates synaptic pruning in the prefrontal cortex of depression. Cell Biosci. 2022;12:1-18.
- Boulanger LM. Immune proteins in brain development and synaptic plasticity. Neuron. 2009;64:93-109.
- Geisbrecht BV, Lambris JD, Gros P. Complement component C3: a structural perspective and potential therapeutic implications. Semin Immunol. 2022;59: 101627.
- Cornell J, Salinas S, Huang HY, Zhou M. Microglia regulation of synaptic plasticity and learning and memory. Neural Regen Res. 2022;17:705.
- Crider A, Feng T, Pandya CD, Davis T, Nair A, Ahmed AO, et al. Complement component 3a receptor deficiency attenuates chronic stressinduced monocyte infiltration and depressive-like behavior. Brain Behav Immun. 2018;70:246-56.
- Berkowitz S, Chapman J, Dori A, Gofrit SG, et al. Complement and coagulation system crosstalk in synaptic and neural conduction in the central and peripheral nervous systems. Biomedicines. 2021;9:1950.
- Bi C, Guo S, Hu S, Chen J, Ye M, Liu Z. The microbiota-gut-brain axis and its modulation in the therapy of depression: comparison of efficacy of conventional drugs and traditional Chinese medicine approaches. Pharmacol Res. 2022;183: 106372.
- Hao W, Gan H, Wang L, Huang J, Chen J. Polyphenols in edible herbal medicine: targeting gut-brain interactions in depression-associated neuroinflammation. Crit Rev Food Sci Nutr. 2023;63(33):12207-23.
- Hao W, Wu J, Yuan N, Gong L, Huang J, Ma Q, et al. Xiaoyaosan improves antibiotic-induced depressive-like and anxiety-like behavior in mice through modulating the gut microbiota and regulating the NLRP3 inflammasome in the colon. Front Pharmacol. 2021;12: 619103.
- Chen J, Lei C, Li X, Wu Q, Liu C, Ma Q, et al. Research progress on classical traditional Chinese medicine formula xiaoyaosan in the treatment of depression. Front Pharmacol. 2022;13: 925514.
- Chan K, Lee H. The progress of Chinese medicine in the United Kingdom[M]//The Way Forward for Chinese Medicine. Routledge; 2001. p. 317-344.
- Wang Q, Gao S, Zhang W, Zhao Y, He Y, Sun W, et al. Traditional use and safety evaluation of combination Traditional Chinese Medicine in European registration: with XiaoYao Tablets as an example. Pharmazie. 2022;77:125-30.
- Commission GBM, GM. Council, British pharmacopoeia. General Medical Council. 1864.
- Zhu HZ, Liang YD, Ma QY, Hao WZ, Li XJ, Wu MS, et al. Xiaoyaosan improves depressive-like behavior in rats with chronic immobilization stress through modulation of the gut microbiota. Biomed Pharmacother. 2019;112: 108621.
- Hao WZ, Ma QY, Tao G, Huang JQ, Chen JX. Oral coniferyl ferulate attenuated depression symptoms in mice via reshaping gut microbiota and microbial metabolism. Food Funct. 2021;12:12550-64.
- O’Leary OF, Felice D, Galimberti S, Savignac HM, Bravo JA, Crowley T, El Yacoubi M, Vaugeois JM, Gassmann M, Bettler B, Dinan TG, Cryan JF. GABAB(1) receptor subunit isoforms differentially regulate stress resilience. Proc Natl Acad Sci U S A. 2014;111(42):15232-7.
- van de Wouw M, Walsh AM, Crispie F, van Leuven L, Lyte JM, et al. Distinct actions of the fermented beverage kefir on host behaviour, immunity and microbiome gut-brain modules in the mouse. Microbiome. 2020;8(1):67.
- Wu Z, Huang S, Li T, Li N, Han D, et al. Gut microbiota from green tea polyphenol-dosed mice improves intestinal epithelial homeostasis and ameliorates experimental colitis. Microbiome. 2021;9(1):184.
- Shi H, Yu Y, Lin D, Zheng P, Zhang P, et al.
-glucan attenuates cognitive impairment via the gut-brain axis in diet-induced obese mice. Microbiome. 2020;8(1):143. - Gershon MD, Margolis KG. The gut, its microbiome, and the brain: connections and communications. J Clin Invest. 2021;131: 143768.
- Palepu MSK, Dandekar MP. Remodeling of microbiota gut-brain axis using psychobiotics in depression. Eur J Pharmacol. 2022;931: 175171.
- Schaub AC, Schneider E, Vazquez-Castellanos JF, Schweinfurth N, Kettelhack C, Doll JPK, et al. Clinical, gut microbial and neural effects of a probiotic add-on therapy in depressed patients: a randomized controlled trial. Transl Psychiatry. 2022;12:1-10.
- Guida F, Turco F, lannotta M, De Gregorio D, Palumbo I, Sarnelli G, et al. Antibiotic-induced microbiota perturbation causes gut endocannabinoidome changes, hippocampal neuroglial reorganization and depression in mice. Brain Behav Immun. 2018;67:230-45.
- Ilgin S, Can OD, Atli O, Ucel UI, Sener E, Guven I. Ciprofloxacin-induced neurotoxicity: evaluation of possible underlying mechanisms. Toxicol Mech Methods. 2015;25:374-81.
- Łoniewski I, Misera A, Skonieczna-Żydecka K, Kaczmarczyk M, Kaźmierczak-Siedlecka K, Misiak B, et al. Major depressive disorder and gut microbiota-association not causation. A scoping review. Prog Neuropsychopharmacol Biol Psychiatry. 2021;106:110111.
- Kosuge A, Kunisawa K, Arai S, Sugawara Y, Shinohara K, lida T, et al. Heat-sterilized Bifidobacterium breve prevents depression-like behavior and interleukin-
expression in mice exposed to chronic social defeat stress. Brain Behav Immun. 2021;96:200-11. - Shin NR, Whon TW, Bae JW. Proteobacteria: microbial signature of dysbiosis in gut microbiota. Trends Biotechnol. 2015;33:496-503.
- Morgan XC, Tickle TL, Sokol H, Gevers D, Devaney KL, Ward DV, et al. Dysfunction of the intestinal microbiome in inflammatory bowel disease and treatment. Genome Biol. 2012;13:1-18.
- Simpson CA, Mu A, Haslam N, Schwartz OS, Simmons JG. Feeling down? A systematic review of the gut microbiota in anxiety/depression and irritable bowel syndrome. J Affect Disord. 2020;266:429-46.
- Zhang Y, Liang H, Wang Y, Cheng R, Pu F, Yang Y, et al. Heat-inactivated Lacticaseibacillus paracasei N1115 alleviates the damage due to brain function caused by long-term antibiotic cocktail exposure in mice. BMC Neurosci. 2022;23:1-14.
- Jang HM, Kim JK, Joo MK, Shin YJ, Lee KE, Lee CK, et al. Enterococcus faecium and Pediococcus acidilactici deteriorate Enterobacteriaceaeinduced depression and colitis in mice. Sci Rep. 2022;12:1-13.
- Tamana SK, Tun HM, Konya T, Chari RS, Field CJ, Guttman DS, et al. Bacteroides-dominant gut microbiome of late infancy is associated with enhanced neurodevelopment. Gut Microbes. 2021;13:1930875.
- Zhang Y, Fan Q, Hou Y, Zhang X, Yin Z, Cai X, et al. Bacteroides species differentially modulate depression-like behavior via gut-brain metabolic signaling. Brain Behav Immun. 2022;102:11-22.
- Yang J, Zheng P, Li Y, Wu J, Tan X, Zhou J, et al. Landscapes of bacterial and metabolic signatures and their interaction in major depressive disorders. Sci Adv. 2020;6:8555.
- Romijn AR, Rucklidge JJ, Kuijer RG, Frampton C. A double-blind, randomized, placebo-controlled trial of Lactobacillus helveticus and Bifidobacterium longum for the symptoms of depression. Aust N Z J Psychiatry. 2017;51:810-21.
- Zheng P, Zeng B, Zhou C, Liu M, Fang Z, Xu X, et al. Gut microbiome remodeling induces depressive-like behaviors through a pathway mediated by the host’s metabolism. Mol Psychiatry. 2016;21:786-96.
- De Palma G, Blennerhassett P, Lu J, Deng Y, Park AJ, et al. Microbiota and host determinants of behavioural phenotype in maternally separated mice. Nat Commun. 2015;6:7735.
- Zheng P, Zeng B, Zhou C, Liu M, Fang Z, et al. Gut microbiome remodeling induces depressive-like behaviors through a pathway mediated by the host’s metabolism. Mol Psychiatry. 2016;21(6):786-96.
- Luo YY, Zeng BH, Zeng L, Du XY, Li B, et al. Gut microbiota regulates mouse behaviors through glucocorticoid receptor pathway genes in the hippocampus. Transl Psychiatry. 2018;8(1):187.
- Sorboni SG, Moghaddam HS, Jafarzadeh-Esfehani R, Soleimanpour S. A comprehensive review on the role of the gut microbiome in human neurological disorders. Clin Microbiol Rev. 2022;35:33820.
- Rosario D, Bidkhori G, Lee S, Bedarf J, Hildebrand F, Le Chatelier E, et al. Systematic analysis of gut microbiome reveals the role of bacterial folate and homocysteine metabolism in Parkinson’s disease. Cell Rep. 2021;34: 108807.
- Teng T, Clarke G, Maes M, Jiang Y, Wang J, Li X, et al. Biogeography of the large intestinal mucosal and luminal microbiome in cynomolgus macaques with depressive-like behavior. Mol Psychiatry. 2022;27:1059-67.
- Krautkramer KA, Fan J, Bäckhed F. Gut microbial metabolites as multikingdom intermediates. Nat Rev Microbiol. 2021;19:77-94.
- Kayama H, Okumura R, Takeda K. Interaction between the microbiota, epithelia, and immune cells in the intestine. Annu Rev Immunol. 2020;38:23-48.
- Nadjsombati MS, McGinty JW, Lyons-Cohen MR, Jaffe JB, DiPeso L, Schneider C, et al. Detection of succinate by intestinal tuft cells triggers a type 2 innate immune circuit. Immunity. 2018;49:33-41.
- Levy M, Kolodziejczyk AA, Thaiss CA, Elinav E. Dysbiosis and the immune system. Nat Rev Immunol. 2017;17:219-32.
- Hao WZ, Li XJ, Zhang PW, Chen JX. A review of antibiotics, depression, and the gut microbiome. Psychiatry Res. 2020;284: 112691.
- Berkins S, Schiöth HB, Rukh G. Depression and vegetarians: association between dietary vitamin B6, B12 and folate intake and global and subcortical brain volumes. Nutrients. 2021;13:1790.
- Mesripour A, Alhimma F, Hajhashemi V. The effect of vitamin B6 on dexamethasone-induced depression in mice model of despair. Nutr Neurosci. 2019;22:744-9.
- Yu Y, Wang H, Rao X, Liu L, Zheng P, Li W, et al. Proteomic profiling of lysine acetylation indicates mitochondrial dysfunction in the hippocampus of gut microbiota-absent mice. Front Mol Neurosci. 2021;14: 594332.
- Raetz CR, Whitfield C. Lipopolysaccharide endotoxins. Annu Rev Biochem. 2002;71:635-700.
- Stevens BR, Goel R, Seungbum K, Richards EM, Holbert RC, Pepine CJ, et al. Increased human intestinal barrier permeability plasma biomarkers zonulin and FABP2 correlated with plasma LPS and altered gut microbiome in anxiety or depression. Gut. 2018;67:1555-7.
- Bodea LG, Wang Y, Linnartz-Gerlach B, Kopatz J, Sinkkonen L, Musgrove R, et al. Neurodegeneration by activation of the microglial complementphagosome pathway. J Neurosci. 2014;34:8546-56.
- Götze O , Müller-Eberhard HJ. The C3-activator system: an alternate pathway of complement activation. J Exp Med. 1971;134:90-108.
- Tao H, Chen X, Zhou H, Fu J, Yu Q, Liu Y. Changes of serum melatonin, Interleukin-6, Homocysteine, and Complement C3 and C4 levels in patients with depression. Front Psychol. 2020;11:1271.
- Morrison DC, Kline LF. Activation of the classical and properdin pathways of complement by bacterial lipopolysaccharides (LPS). J Immunol. 1977;118:362-8.
- Hong S, Dissing-Olesen L, Stevens B. New insights on the role of microglia in synaptic pruning in health and disease. Curr Opin Neurobiol. 2016;36:128-34.
- Paolicelli RC, Bolasco G, Pagani F, Maggi L, Scianni M, Panzanelli P, et al. Synaptic pruning by microglia is necessary for normal brain development. Science. 2011;333:1456-8.
- Stephan AH, Barres BA, Stevens B. The complement system: an unexpected role in synaptic pruning during development and disease. Annu Rev Neurosci. 2012;35:369-89.
- Germann M, Brederoo SG, Sommer IEC. Abnormal synaptic pruning during adolescence underlying the development of psychotic disorders. Curr Opin Psychiatry. 2021;34:222.
- Presumey J, Bialas AR, Carroll MC. Complement system in neural synapse elimination in development and disease. Adv Immunol. 2017;135:53-79.
- Vatandoust SM, Meftahi GH. The effect of sericin on the cognitive impairment, depression, and anxiety caused by learned helplessness in male mice. J Mol Neurosci. 2022;72:963-74.
ملاحظة الناشر
وينتشي هاو وكينغيو ما هما المؤلفان الرئيسيان المشاركان.
*المراسلة:
شياوجوان لي
lixiaojuan@jnu.edu.cn
جونكينغ هوانغ
jqhuang@jnu.edu.cn
جياسو تشين
chenjiaxu@hotmail.com
القائمة الكاملة لمعلومات المؤلف متاحة في نهاية المقال
DOI: https://doi.org/10.1186/s40168-024-01756-6
PMID: https://pubmed.ncbi.nlm.nih.gov/38378622
Publication Date: 2024-02-20
Gut dysbiosis induces the development of depression-like behavior through abnormal synapse pruning in microglia-mediated by complement C3
Abstract
Background Remodeling eubiosis of the gut microenvironment may contribute to preventing the occurrence and development of depression. Mounting experimental evidence has shown that complement C3 signaling is associated with the pathogenesis of depression, and disruption of the gut microbiota may be an underlying cause of complement system activation. However, the mechanism by which complement C3 participates in gut-brain crosstalk in the pathogenesis of depression remains unknown. Results In the present study, we found that chronic unpredictable mild stress (CUMS)-induced mice exhibited obvious depression-like behavior as well as cognitive impairment, which was associated with significant gut dysbiosis, especially enrichment of Proteobacteria and elevation of microbiota-derived lipopolysaccharides (LPS). In addition, peripheral and central complement C3 activation and central C3/CR3-mediated aberrant synaptic pruning in microglia have also been observed. Transplantation of gut microbiota from CUMS-induced depression model mice into specific pathogen-free and germ-free mice induced depression-like behavior and concomitant cognitive impairment in the recipient mice, accompanied by increased activation of the complement C3/CR3 pathway in the prefrontal cortex and abnormalities in microglia-mediated synaptic pruning. Conversely, antidepressants and fecal microbiota transplantation from antidepressant-treated donors improved depression-like behaviors and restored gut microbiome disturbances in depressed mice. Concurrently, inhibition of the complement C3/CR3 pathway, amelioration of abnormal microglia-mediated synaptic pruning, and increased expression of the synapsin and postsynaptic density protein 95 were observed. Collectively, our results revealed that gut dysbiosis induces the development of depression-like behaviors through abnormal synapse pruning in microglia-mediated by complement C3, and the inhibition of abnormal synaptic pruning is the key to targeting microbes to treat depression.
Keywords Complement C3, Depression, Fecal microbiota transplantation, Gut microbiota, Microglia, Synaptic pruning
Background
Synaptic pruning is an important link in the formation of correct neural circuits and is crucial for brain development and maintenance of neural homeostasis in depression [8, 9]. Recent research has revealed that complement is involved in developmental synaptic pruning and pathological synapse loss, the latter of which contributes to various brain diseases including schizophrenia, depression, autism, and anxiety disorders [10,11]. In the brain, the complement system participates in the regulation of synaptic pruning in microglia [12]. Complement C 3 is the central link in the complement activation pathway [13]. Through complement labeling at the synapse, complement C 3 binds to complement receptors, mainly complement receptor 3 (CR3), on chemotactic microglia, inducing microglia to engulf the labeled cellular components [14]. Both peripherally and centrally activated complement systems have been observed in patients with depression and animal models of depression [15]. These results indicate that complement C3/CR3 signaling is associated with the pathogenesis of depression. However, the source of complement C 3 has not been determined [15]. The gut microbiota modulates host peripheral and neuroimmunity, and its microbial metabolites are
important activators of complement C3 [16]. However, whether the gut microbiota is the source of the complement that mediates central synaptic pruning during the pathogenesis of depression and whether the complement is an important link in gut-brain crosstalk is still unknown.
administration in a murine model of chronic unpredicted mild stress (CUMS)-induced depression were evaluated. Antibiotic intervention was used to explore the effect of microbiota clearance on antidepressant efficacy. Next, we interfered with the intestinal microbial flora of normal and depressed specific pathogen-free (SPF) mice using CUMS-FMT and XYS-FMT, respectively, to explore the therapeutic effect and regulatory mechanism of intestinal microbial flora on depressive behavior. Finally, we performed FMT in germ-free (GF) mice to further verify the crosstalk between gut microbes and synaptic pruning, further demonstrating that the gut microbiota is integral to depression remission.
Methods
Animals and CUMS procedure
Treatments and sample collection

Behavioral tests
Sucrose preference test (SPT)
Open field test (OFT)
specifically at 60 lx [27]. The OFT was performed using the internationally recognized Behavior Analysis software (EthoVision software analysis system, Noldus Information Technology, Leesburg, VA, USA) and included the analysis of the total movement distance of each group of mice.
Tail suspension test (TST)
Elevated plus-maze test (EPM)
Novel object recognition test (NORT)
placed between the new and old object and allowed to explore freely for 10 min . Subsequent to each experimental session, the enclosures were promptly cleaned using a 75% alcohol solution. NORT data were analyzed using Behavior Analysis software (EthoVision software analysis system, Noldus Information Technology, Leesburg, VA, USA). The time the mouse spent exploring each object (time spent exploring the familiar object, N1; time spent exploring the novel object, N2) was recorded. The discrimination ratio (DR, %) was calculated as follows:
Y-maze task
Bioassays
Hematoxylin and eosin (HE) staining
Colon ultrastructural morphology
Enzyme-linked immunosorbent assay (ELISA)
were determined using an ELISA detection kit (Cusabio, Wuhan, China). The IL-6, IL-10, IL-1
Immunofluorescence (IF) staining
Western blotting (WB)
Bacterial DNA extraction, 16 S rRNA sequencing, and analyses
Metabolomic analyses
squares-discriminant analysis (PLS-DA) was performed using SIMCA
Data correlation analysis
Statistical analysis
Results
The potential antidepressant activity of XYS on CUMSinduced depression-like behaviors was evaluated by inducing depression-like behaviors in mice by administering 8 weeks of CUMS, followed by 4 weeks of daily oral administration of XYS (Fig. 2A). No differences were observed in body weight, sucrose preference, or motor function among the groups before the experiment (Fig. S1a-c). Significant depression-like behaviors
were observed in the mice that received the 8 -week CUMS intervention (Fig. S1d-g). Following the successful establishment of the CUMS mouse model, the effects of XYS intervention on mouse behavior were examined. XYS intervention significantly alleviated CUMS-induced depression-like behaviors compared with the CUMS group, as evidenced by markedly reduced weight loss, increased preference in the SPT, increased total distance and entry frequency in the OFT and decreased immobility time in the TST (Fig. 2B-F). XYS treatment also significantly improved anxiety-like behaviors and cognitive impairment in mice with CUMS-induced depressionlike behaviors. Mice receiving XYS intervention showed an increased frequency of open arm entry in the EPM (Fig. 2G) and increased exploration of novel areas in the NORT (Fig. 2H) and Y-maze tests (Fig. 2I). The movement trajectories of the mice in the OFT, EPM, and NORT are shown in Fig. 2J. The above results indicate that XYS has significant antidepressant effects and could be further studied as a potential antidepressant.
Depression-like behaviors are accompanied by gut dysbiosis

administration, intestinal inflammation was ameliorated, the size and number of colonic microvilli increased, and abnormal alignment was reversed (Fig. 3A-C). In addition, XYS reduced the levels of IL-

A total of 37 phyla were identified in this study. Firmicutes, Bacteroidetes, and Proteobacteria were the dominant phyla in the fecal microbiota of the mice. Proteobacteria was the dominant phylum in the fecal microbiota of mice with depression-like behaviors. XYS intervention significantly reduced the abundance of Proteobacteria compared with the CUMS mice without treatment (Fig. 4C, D; Fig. S2d). A cladogram generated by LEfSe analysis of the microbiome data (Fig. 4E, F) showed nine and five differentially abundant clades at the family level in the CUMS and XYS groups, respectively (
increased the relative abundance of Lactobacillus in the CUMS mice (

of LPS-generated substrates (Fig. S2k). Two LPS-generated substrates (D-( + )-mannose and
content in the serum was evaluated. The concentration of LPS in the serum of mice with depression-like behaviors was significantly increased compared with control mice (Fig. 5A). However, XYS administration attenuated LPS levels, which is consistent with the sequencing results observed in the metabolomics analyses.
Collectively, these results indicate that the development of depression-like behavior is accompanied by dysbiosis in gut homeostasis (including colonic inflammatory response, destruction of colonic barrier function, reduction in intestinal microbial diversity, and accumulation of microbial metabolite-LPS). However, antidepressants suppress the CUMS-induced colonic inflammatory response, improve barrier function and regulate the composition and metabolism of gut microbiota (especially the inhibition of gram-negative bacteria abundance and levels of LPS).

Collectively, these results indicate that complement C3/CR3 activation and microglia-mediated aberrant synaptic pruning are important pathological manifestations of depression. Meanwhile, antidepressants suppress the CUMS-induced activation of complement C3/CR3 and complement-involved microglia-mediated abnormal synaptic pruning, thereby maintaining the normal growth of synaptic neurons.
Transplantation of dysregulated gut microbiota induces the development of depression-like behaviors
mice exhibited significant depression-like and anxietylike behaviors after FMT, which were accompanied by impairments in cognitive memory. SPF mice receiving the fecal microbiota of CUMS-induced mice exhibited weight loss, decreased sucrose preference, decreased total distance in the OFT, and decreased desire for novelty in the NORT and Y-maze compared with the control mice; this is similar to mice after 8-week CUMS stimulation (Fig. 6B-H). Similar results were observed in GF mice. GF mice receiving the fecal microbiota of CUMS mice showed a significant reduction in total movement distance in the OFT, increased immobility time in the TST (Fig. 6I-K), and cognitive impairment in the NORT and Y-maze (Fig. 6L-N). These results suggest that under stress-independent conditions, receiving a FMT from a CUMS host with depressive-like behavior and cognitive impairment can lead to behavioral abnormalities, including depression-like behaviors.
Dysregulated gut microbiota mediated colonic inflammation and barrier disruption

The impact of antidepressant-mediated microbiota on depression was validated by transplanting fecal microbiota derived from mice administered XYS into CUMS-induced
mice. In SPF mice, the CUMS-induced colonic inflammation was reversed by XYS-FMT (Fig. 7A). Transmission electron microscopy showed that the microvilli were reduced in size and number and exhibited an abnormal appearance in the CUMS group. The size and number of microvilli increased and the abnormal arrangement was reversed by XYS-FMT (Fig. 7B). XYS-FMT increased the

These results indicate that CUMS-FMT contributes to colonic inflammatory response and intestinal barrier damage. In addition, XYS-FMT suppressed the CUMS-induced colonic inflammatory response and improved the barrier function. This suggests that dysregulated gut microbiota mediates colonic inflammation and barrier disruption, while FMT treatment with antidepressants has an inhibitory effect on colonic inflammation and barrier disruption.
CUMS-FMT mediated the disturbance of gut microbiota and XYS-FMT restored the intestinal balance
by the Shannon index, was impacted by FMT (Fig. 8A; Fig. S5a-c:

in the abundance of Lactobacillus and the significant increase in the abundance of Prevotella (Prevotellaceae) compared with that of the control group (Fig. S5d).
Next, the effects of FMT on the host gut microbiota were assessed. Previous results have indicated that SPF mice receiving CUMS-FMT exhibit pronounced depres-sion-like behaviors. Correspondingly, SPF mice receiving CUMS-FMT also exhibited an altered gut microbial structure and composition. At the phylum level, the
abundance of Bacteroidetes was significantly increased in mice receiving CUMS-FMT compared with that of the control group, while there was no significant difference in the abundance of Proteobacteria (Fig. 8D, E). However, at the genus level, a significant effect was induced by FMT. A cladogram was generated by LEfSe analysis of microbiome data (Fig. 8H, I) and showed 11 differentially abundant clades at the genus level in the CUMS-FMT group and one differentially abundant clade at the genus level in the control group (
Additionally, changes in the microbiota of GF mice that received CUMS-FMT were observed. GF mice do not harbor any known microbes in their intestines; therefore, the changes in their microbiota were more pronounced than those of SPF mice. At the phylum level, Proteobacteria was one of the dominant phyla in mice following CUMS-FMT, similar to the microbiota of mice subjected to CUMS. Consistently, at the genus level, the abundance of Bacteroides corresponded to the microbiota of mice exposed to stress (Fig. 8L).
Dysregulated gut microbiota-induced complement C3 activation and microglia-mediated aberrant synaptic pruning
pruning. However, it is unclear whether the activation of complement C3/CR3 in the PFC and microglia-mediated aberrant synaptic pruning are directly associated with changes in gut microbiota. To explore whether fecal microbial colonization without stressful stimulation could induce alterations in complement C3 and aberrant microglia-mediated synaptic pruning, FMT was performed from CUMS-induced mice into SPF and GF mice. The LPS and C3 levels in mice sera were significantly increased after receiving the fecal microbiota of CUMSinduced mice compared with that of control SPF mice (Fig. 9A, B). Consistent results were also reported for GF mice (Fig. 9C, D). Furthermore, consistent with CUMS induction, significantly increased protein expression of complement C3 was observed in the PFC tissues of both SPF and GF mice after receiving the fecal microbiota of CUMS-induced mice (Fig. 9E). In addition, immunofluorescence results based on CR3 and IBA-1 demonstrated that CUMS-FMT induced the activation of microglia in the PFC and increased CR3 expression, suggesting that CUMS-FMT could directly induce the activation of the C3/CR3 pathway (Fig. 9F-L). LPS-induced changes in CD68 and IBA-1 expression levels were also consistent with CUMS-induced stress (Fig. S3d-i). Decreased expression levels of SYN and PSD95 were observed, which also indicated neuronal damage caused by abnormal synaptic pruning (Fig. 9M-P; Additional file 3).
Discussion

The microbiota-gut-brain axis is considered a key regulator of neural function and plays a key role in the pathogenesis of depression [30, 31]. Manipulation of gut microbes is considered a potential treatment for depression [32]. As a botanical formulation widely used in Asia and Europe, XYS contains a variety of active substances and is considered to have prebiotic-like properties [20]. In the current study, XYS, a potential antidepressant drug, was used to explore the role of gut microbiota in the treatment of depression and the specific mechanisms underlying the interaction between gut microbes and the CNS. Behavioral tests including SPT, OFT, TST, EPM, NORT, and Y-maze tests were used to explore the improvement effect of XYS on depression and its accompanying symptoms, such as anxiety-like behavior and cognitive impairment, to confirm its potential as an antidepressant. In addition, using 16 S RNA sequencing and UHPLC-QTOF-MS/MS metabolic analysis, the improvement in depressive-like behaviors was shown to be accompanied by the regulation of gut microbes and microbial metabolites. Next, to verify whether the prebi-otic-like properties of antidepressants play a key role in the improvement of depressive-like behaviors, ABX and FMT interventions were used to explore the antidepressant effect of XYS in different gut microbial environments. A variety of antibiotics were mixed into the daily drinking water of the mice and mice were allowed to drink freely for 7 days. The abovementioned antibiotic intervention method was chosen because previous studies have shown that intraperitoneal injection of antibiotics or long-term intervention (
intervention was administered to eliminate and manipulate the gut microbes of mice without aggravating the depressive-like behavior of mice. The antidepressant effect of XYS was eliminated after administering ABX for gut microbiota clearance, suggesting that the presence of gut microbes is necessary for XYS to exert its antidepressant effect. On the one hand, the disappearance of the microbiome results in the absorption and metabolism of the antidepressant active substances in XYS being inhibited and the subsequent antidepressant activities being ineffective; on the other hand, due to the changes in the intestinal microenvironment, the prebiotic-like effects of XYS associated with anti-depression cannot be exerted. Therefore, the FMT method was used to explore the improvement of depression-like behavior in mice treated with XYS-treated host fecal bacteria (gut microbiota, with or without metabolites). Our results indicate that transplanting feces from the antidepressant-treated host into depressed mice ameliorated depression-like behaviors in mice subjected to CUMS. This suggests that XYS can directly ameliorate depression symptoms through the colonization of the intestinal flora. These results confirm that the pharmacodynamic action of XYS as a potential antidepressant is mainly based on its prebioticlike properties.
[40]. Consistently, in the present study, the abundance of Proteobacteria was significantly elevated in the CUMSinduced depression model. The LDA analysis showed that XYS supplementation decreased not only the Proteobacteria at the phylum level, but also its lower taxa, such as Enterobacteriales, Enterobacteriaceae, and Klebsiella at the order, family, genus levels, respectively, in the CUMS-induced mice. Previous studies have shown that oral gavages of Klebsiella oxytoca, Escherichia coli, and Cronobacter sakazakii belonging to Enterobacteriaceae, in isolation or combination, cause depression-like behaviors in both GF and SPF mice, suggesting that Proteobacteria are closely associated with depression [41]. The microbiota belonging to the phylum Bacteroidetes has been associated with cognition and neurodegenerative diseases. Clinical studies have shown that infants with high levels of Bacteroides in the gut exhibit higher cognitive performance at 1 and 2 years of age [42]. In the present study, we found that XYS increased the abundance of Bacteroidetes at the phylum level, suggesting that it may be responsible for improving cognitive impairment. Furthermore, at the genus level, XYS decreased the abundance of Bacteroides and increased the abundance of Lactobacillus. Bacteroides are thought to be associated with major depressive disorder (MDD) [43]. High levels of Bacteroides spp. were present in fecal samples from 156 patients with MDD, compared with healthy individuals [44]. Lactobacillus is regarded as a probiotic with an inhibitory effect on depression [45]. It has been reported that the production of hydrogen peroxide by Lactobacillus may prevent CUMS-induced depressive behaviors by directly inhibiting intestinal indoleamine-2,3-dioxygenase [46]. We found that XYS administration significantly reduced the expression of Bacteroides and increased the expression of Lactobacillus. Overall, these findings support that XYS supplementation improves gut microbiota composition, particularly for the suppression of Proteobacteria and promotion of Bacteroidetes, which may contribute to the prevention of depression-like behaviors and concomitant cognitive impairment in mice with chronic stress-induced depression. In addition, the diversity of fecal microbiota is lower in patients with depression than in healthy controls. The gut microbiota diversity was reduced in CUMS mice, and XYS supplementation prevented these alterations in the gut microbiota. Therefore, it is speculated that the regulation of antidepressants on the composition and diversity of the gut microbiota may be crucial for improving depression.
of healthy hosts was observed. For FMT in SPF mice, the microbiota of control mice was disturbed, rather than replaced by the microbiota from CUMS mice. At the phylum level, inconsistent with the stress-induced changes in the gut microbiota, no significant increase was observed in the abundance of Proteobacteria after CUMS-FMT. However, at the genus level, a decrease in Lactobacillus abundance and an increased abundance of Bacteroides was observed, which is consistent with changes in CUMS-induced mice. The reason for this phenomenon may be that during the FMT process, the host’s original gut microbiota has a certain resistance to the CUMS microbiota; therefore, the changes at the phylum level are not completely consistent with the changes in the microbiota of CUMS mice. Therefore, we performed CUMS-FMT in GF mice. Consistent with our expectations, the gut microbial signature (including the increased abundance of Proteobacteria at the phylum level and Bacteroides at the genus level) of CUMS mice was replicated in GF mice owing to the absence of resident microbiota in the gut. Both SPF and GF mice exhibited obvious depression-like behavior after CUMS-FMT treatment. This further confirms that perturbations in the microbiota, even at the genus level, are sufficient to affect the overall gut microbiome imbalances and induce the emergence of depressive-like behaviors. In this study, FMT was exclusively performed from CUMS mice to GF mice; FMT from control SPF mice to GF mice was not conducted. Recent high-quality references consistently demonstrate that FMT from unstressed animals does not induce depressive behavior in GF mice [47-49]. Earlier studies have indicated that GF mice did not display depression-like behaviors even after receiving fecal bacteria from control mice or healthy individuals. This suggests that fecal bacteria transplanted from unstressed mice or individuals did not influence the behavior of GF mice [47.48]. Next, the modulating effect of XYSFMT on gut microbes was observed in CUMS mice. At the phylum level, XYS-FMT reduced the abundance of Proteobacteria and increased the abundance of Bacteroidetes, which is consistent with the regulation of gut microbiota by XYS administration. At the genus level, an increase in the abundance of Lactobacillus was observed. More importantly, changes in Prevotellaceae at the family level and Prevotella at the genus level were observed. Members of Prevotellaceae, known as gut symbionts, can produce SCFAs through dietary fiber fermentation and intestinal mucins [50]. Studies have shown that the reduction of Prevotellaceae results in increased exposure to the bacterial endotoxin system and increased intestinal permeability, inducing inflammation [51]. In this study, the LDA analysis showed that XYS-FMT increased the abundance of Prevotellaceae at the family level and
Crosstalk between gut microbes and host behavior is also reflected in the disruption of gut barrier function and regulation of microbial metabolites [53]. Intestinal homeostasis is maintained by crosstalk between the microbiota, intestinal barrier, and immune system [54]. An imbalance in the microbiome often leads to the destruction of the intestinal barrier and immune system. Under normal physiological conditions, intestinal epithelial cells, microbiomes, and immune cells support a steady state in the intestinal system. Intestinal epithelial cells receive signals from the microbiome, such as microbial metabolites or microbes, to preserve the mucosal barrier [55]. The microbiome also regulates host immunity through its metabolites and endotoxins. Furthermore, immune cells can directly or indirectly affect the microbiome by releasing cytokines or chemokines [56]. However, an imbalance in the microbiome leads to the destruction of the intestinal barrier and the overactivation of intestinal immunity. Studies have shown that a shift in microbiome structure leads to an increase in intestinal tight junction proteins and intestinal permeability. These events induce inflammation in the colon and produce proinflammatory cytokines such as IL-6, IL-1
that CUMS or CUMS-FMT could lead to the disruption of colonic barrier function, production of colonic inflammation, and elevation of serum proinflammatory cytokines IL-6, IL-1
blood, which is consistent with the increased abundance of LPS-producing bacteria in the gut microbiota. Correlation analysis also confirmed that the gut microbes were highly correlated with LPS production.
Overexposure to LPS induces expression of the complement system and activation of microglia [63]. Complement, a serum protein, has enzymatic activity and mediates immune and inflammatory responses. Complement C3 is a key protein in the complement system [64]. Elevated levels of C3 have been observed in the brains of patients with depression and animal depression models and are thought to be positively correlated with the severity of depressive symptoms [65]. Researchers have found that chronic stress can lead to increased expression of C 3 in the PFC of mice, and C3-KO mice do not develop depression-like behaviors, suggesting that a high level of C3 is an important condition for the onset of depression [15]. Unfortunately, the source of complement C3 (either directly from the CNS or via inflammatory migration from the periphery to the brain) remains unclear. LPS is thought to be a key activator of complement C3, mediating the levels of complement C3 in peripheral sera
[66]. After observing gut microbiota-regulated LPS elevation, C3 expression in the sera and PFC of mice were examined. Consistent with stress-induced complement changes, high expression of C3 in the peripheral and prefrontal cortices after fecal transplantation suggests that gut microbial disturbances may be a trigger and aggravating factor for C3 activation. In addition, the activation of microglia specifically induced by LPS in the CNS was observed. As innate immune effector cells in the CNS, microglia play an important role in maintaining neuronal development and normal neural function [67]. Among them, synapse pruning is the main method for microglia to eliminate synapses and is an important mechanism for the selective pruning of neurons to maintain normal neuronal systems [68]. Crosstalk with the complement system, which mediates microglial synapse pruning, is critical for the regulation of synaptic morphology by microglia [69]. Recent research has shown that overexpression of complement C3 affects phagocytosis and synaptic pruning of microglia, leading to depression and abnormal cognitive behavior [70]. CR3 is a complement C3 receptor expressed by microglia, and its binding to

Collectively, our results suggest that gut dysbiosis induces depression-like behaviors through abnormal synapse pruning in microglia, mediated by complement C3. Furthermore, antidepressant-mediated alterations in the microbiome, especially inhibition of Proteobacteria, play a key role in the alleviation of depression. By regulating complement C3 and microglia involved in the gut-brain crosstalk pathway in the pathogenesis of depression, the inhibition of abnormal synaptic pruning becomes the key to targeting microbes to treat depression. These results are summarized in Fig. 10.
Conclusion
Abbreviations
| ABX | Antibiotics |
| C3 | Component 3 |
| CUMS | Chronic unpredictable mild stress |
| CR3 | Complement receptors 3 |
| CNS | Central nervous system |
| EPM | Elevated plus-maze test |
| ELISA | Enzyme-linked immunosorbent assay |
| FMT | Fecal microbiota transplantation |
| FLX | Fluoxetine |
| GF | Germ-free |
| HE | Hematoxylin and eosin |
| IF | Immunofluorescence |
| IL | Interleukin |
| KEGG | Kyoto Encyclopedia of Genes and Genomes |
| LEfSe | Linear discriminant analysis effect size |
| LPS | Lipopolysaccharide |
| NORT | Novel object recognition test |
| OFT | Open field test |
| OPLS-DA | Orthogonal partial least squares-discriminant analysis |
| PBS | Phosphate-buffered saline |
| PLS-DA | Partial least squares-discriminant analysis |
| PCoA | Principal coordinate analysis |
| PFC | Prefrontal cortex |
| PSD95 | Postsynaptic density 95 |
| SPF | Specific pathogen-free |
| SPT | Sucrose preference test |
| SYN | Synapsin |
| TST | Tail suspension test |
| TNF | Tumor necrosis factor |
| UhPLC-QTOF-MS | Ultra-high performance liquid chromatography-quadrupole time-of-flight mass spectrometry |
| WHO | World Health Organization |
| WB | Western blotting |
| XYS | Xiaoyaosan |
Supplementary Information
Additional file 2.
Additional file 4.
mean
Additional file 9: Supplement Fig. 5. CUMS-FMT mediated disturbance of the gut microbiota in mice; XYS-FMT regulated the composition of gut microbiota. Alpha diversity shown by A: simpson index. B: observed index. C: chao1 index. D: Gut microbiota change at genus level (Control versus CUMS). E: Gut microbiota change at genus level (Control versus Control+FMT(CUMS)). F: Gut microbiota change at genus level (CUMS versus CUMS+FMT(XYS)).
Acknowledgements
Authors’ contributions
Funding
Availability of data and materials
Declarations
Ethics approval and consent to participate
Consent for publication
Competing interests
Author details
Published online: 20 February 2024
References
- Wolf J, Padberg F, Nenov-Matt T, Amann BL, Barton BB, Tang J, et al. Suicidal behaviors are associated with loneliness and decrease during inpatient CBASP treatment for persistent depressive disorder. J Psychiatr Res. 2022;154:139-44.
- Sender R, Fuchs S, Milo R. Are we really vastly outnumbered? Revisiting the ratio of bacterial to host cells in humans. Cell. 2016;164:337-40.
- Dinan TG, Cryan JF. Gut instincts: microbiota as a key regulator of brain development, ageing and neurodegeneration. J Physiol. 2017;595:489-503.
- Wu X, Xia Y, He F, Zhu C. Intestinal mycobiota in health and diseases: from a disrupted equilibrium to clinical opportunities. Microbiome. 2021;9:1-18.
- Tian T, Mao Q, Xie J, Wang Y, Shao WH, Zhong Q, et al. Multi-omics data reveals the disturbance of glycerophospholipid metabolism caused by disordered gut microbiota in depressed mice. J Adv Res. 2022;39:135-45.
- Simkin DR. Microbiome and mental health, specifically as it relates to adolescents. Curr Psychiatry Rep. 2019;21:1-12.
- Lahtinen P, Jalanka J, Hartikainen A, Mattila E, Hillilä M, Punkkinen J, et al. Randomised clinical trial: faecal microbiota transplantation versus autologous placebo administered via colonoscopy in irritable bowel syndrome. Aliment Pharmacol Ther. 2020;51:1321-31.
- Zhang YQ, Lin WP, Huang LP, Zhao B, Zhang CC, Yin DM. Dopamine D2 receptor regulates cortical synaptic pruning in rodents. Nat Commun. 2021;12:1-17.
- Duman RS, Aghajanian GK. Synaptic dysfunction in depression: potential therapeutic targets. Science. 2012;338:68-72.
- Hong S, Beja-Glasser VF, Nfonoyim BM, Frouin A, Li S, Ramakrishnan S, et al. Complement and microglia mediate early synapse loss in Alzheimer mouse models. Science. 2016;352:712-6.
- Zhang MM, Guo MX, Zhang QP, Chen XQ, Li NZ, Liu Q, et al. IL-1R/C3aR signaling regulates synaptic pruning in the prefrontal cortex of depression. Cell Biosci. 2022;12:1-18.
- Boulanger LM. Immune proteins in brain development and synaptic plasticity. Neuron. 2009;64:93-109.
- Geisbrecht BV, Lambris JD, Gros P. Complement component C3: a structural perspective and potential therapeutic implications. Semin Immunol. 2022;59: 101627.
- Cornell J, Salinas S, Huang HY, Zhou M. Microglia regulation of synaptic plasticity and learning and memory. Neural Regen Res. 2022;17:705.
- Crider A, Feng T, Pandya CD, Davis T, Nair A, Ahmed AO, et al. Complement component 3a receptor deficiency attenuates chronic stressinduced monocyte infiltration and depressive-like behavior. Brain Behav Immun. 2018;70:246-56.
- Berkowitz S, Chapman J, Dori A, Gofrit SG, et al. Complement and coagulation system crosstalk in synaptic and neural conduction in the central and peripheral nervous systems. Biomedicines. 2021;9:1950.
- Bi C, Guo S, Hu S, Chen J, Ye M, Liu Z. The microbiota-gut-brain axis and its modulation in the therapy of depression: comparison of efficacy of conventional drugs and traditional Chinese medicine approaches. Pharmacol Res. 2022;183: 106372.
- Hao W, Gan H, Wang L, Huang J, Chen J. Polyphenols in edible herbal medicine: targeting gut-brain interactions in depression-associated neuroinflammation. Crit Rev Food Sci Nutr. 2023;63(33):12207-23.
- Hao W, Wu J, Yuan N, Gong L, Huang J, Ma Q, et al. Xiaoyaosan improves antibiotic-induced depressive-like and anxiety-like behavior in mice through modulating the gut microbiota and regulating the NLRP3 inflammasome in the colon. Front Pharmacol. 2021;12: 619103.
- Chen J, Lei C, Li X, Wu Q, Liu C, Ma Q, et al. Research progress on classical traditional Chinese medicine formula xiaoyaosan in the treatment of depression. Front Pharmacol. 2022;13: 925514.
- Chan K, Lee H. The progress of Chinese medicine in the United Kingdom[M]//The Way Forward for Chinese Medicine. Routledge; 2001. p. 317-344.
- Wang Q, Gao S, Zhang W, Zhao Y, He Y, Sun W, et al. Traditional use and safety evaluation of combination Traditional Chinese Medicine in European registration: with XiaoYao Tablets as an example. Pharmazie. 2022;77:125-30.
- Commission GBM, GM. Council, British pharmacopoeia. General Medical Council. 1864.
- Zhu HZ, Liang YD, Ma QY, Hao WZ, Li XJ, Wu MS, et al. Xiaoyaosan improves depressive-like behavior in rats with chronic immobilization stress through modulation of the gut microbiota. Biomed Pharmacother. 2019;112: 108621.
- Hao WZ, Ma QY, Tao G, Huang JQ, Chen JX. Oral coniferyl ferulate attenuated depression symptoms in mice via reshaping gut microbiota and microbial metabolism. Food Funct. 2021;12:12550-64.
- O’Leary OF, Felice D, Galimberti S, Savignac HM, Bravo JA, Crowley T, El Yacoubi M, Vaugeois JM, Gassmann M, Bettler B, Dinan TG, Cryan JF. GABAB(1) receptor subunit isoforms differentially regulate stress resilience. Proc Natl Acad Sci U S A. 2014;111(42):15232-7.
- van de Wouw M, Walsh AM, Crispie F, van Leuven L, Lyte JM, et al. Distinct actions of the fermented beverage kefir on host behaviour, immunity and microbiome gut-brain modules in the mouse. Microbiome. 2020;8(1):67.
- Wu Z, Huang S, Li T, Li N, Han D, et al. Gut microbiota from green tea polyphenol-dosed mice improves intestinal epithelial homeostasis and ameliorates experimental colitis. Microbiome. 2021;9(1):184.
- Shi H, Yu Y, Lin D, Zheng P, Zhang P, et al.
-glucan attenuates cognitive impairment via the gut-brain axis in diet-induced obese mice. Microbiome. 2020;8(1):143. - Gershon MD, Margolis KG. The gut, its microbiome, and the brain: connections and communications. J Clin Invest. 2021;131: 143768.
- Palepu MSK, Dandekar MP. Remodeling of microbiota gut-brain axis using psychobiotics in depression. Eur J Pharmacol. 2022;931: 175171.
- Schaub AC, Schneider E, Vazquez-Castellanos JF, Schweinfurth N, Kettelhack C, Doll JPK, et al. Clinical, gut microbial and neural effects of a probiotic add-on therapy in depressed patients: a randomized controlled trial. Transl Psychiatry. 2022;12:1-10.
- Guida F, Turco F, lannotta M, De Gregorio D, Palumbo I, Sarnelli G, et al. Antibiotic-induced microbiota perturbation causes gut endocannabinoidome changes, hippocampal neuroglial reorganization and depression in mice. Brain Behav Immun. 2018;67:230-45.
- Ilgin S, Can OD, Atli O, Ucel UI, Sener E, Guven I. Ciprofloxacin-induced neurotoxicity: evaluation of possible underlying mechanisms. Toxicol Mech Methods. 2015;25:374-81.
- Łoniewski I, Misera A, Skonieczna-Żydecka K, Kaczmarczyk M, Kaźmierczak-Siedlecka K, Misiak B, et al. Major depressive disorder and gut microbiota-association not causation. A scoping review. Prog Neuropsychopharmacol Biol Psychiatry. 2021;106:110111.
- Kosuge A, Kunisawa K, Arai S, Sugawara Y, Shinohara K, lida T, et al. Heat-sterilized Bifidobacterium breve prevents depression-like behavior and interleukin-
expression in mice exposed to chronic social defeat stress. Brain Behav Immun. 2021;96:200-11. - Shin NR, Whon TW, Bae JW. Proteobacteria: microbial signature of dysbiosis in gut microbiota. Trends Biotechnol. 2015;33:496-503.
- Morgan XC, Tickle TL, Sokol H, Gevers D, Devaney KL, Ward DV, et al. Dysfunction of the intestinal microbiome in inflammatory bowel disease and treatment. Genome Biol. 2012;13:1-18.
- Simpson CA, Mu A, Haslam N, Schwartz OS, Simmons JG. Feeling down? A systematic review of the gut microbiota in anxiety/depression and irritable bowel syndrome. J Affect Disord. 2020;266:429-46.
- Zhang Y, Liang H, Wang Y, Cheng R, Pu F, Yang Y, et al. Heat-inactivated Lacticaseibacillus paracasei N1115 alleviates the damage due to brain function caused by long-term antibiotic cocktail exposure in mice. BMC Neurosci. 2022;23:1-14.
- Jang HM, Kim JK, Joo MK, Shin YJ, Lee KE, Lee CK, et al. Enterococcus faecium and Pediococcus acidilactici deteriorate Enterobacteriaceaeinduced depression and colitis in mice. Sci Rep. 2022;12:1-13.
- Tamana SK, Tun HM, Konya T, Chari RS, Field CJ, Guttman DS, et al. Bacteroides-dominant gut microbiome of late infancy is associated with enhanced neurodevelopment. Gut Microbes. 2021;13:1930875.
- Zhang Y, Fan Q, Hou Y, Zhang X, Yin Z, Cai X, et al. Bacteroides species differentially modulate depression-like behavior via gut-brain metabolic signaling. Brain Behav Immun. 2022;102:11-22.
- Yang J, Zheng P, Li Y, Wu J, Tan X, Zhou J, et al. Landscapes of bacterial and metabolic signatures and their interaction in major depressive disorders. Sci Adv. 2020;6:8555.
- Romijn AR, Rucklidge JJ, Kuijer RG, Frampton C. A double-blind, randomized, placebo-controlled trial of Lactobacillus helveticus and Bifidobacterium longum for the symptoms of depression. Aust N Z J Psychiatry. 2017;51:810-21.
- Zheng P, Zeng B, Zhou C, Liu M, Fang Z, Xu X, et al. Gut microbiome remodeling induces depressive-like behaviors through a pathway mediated by the host’s metabolism. Mol Psychiatry. 2016;21:786-96.
- De Palma G, Blennerhassett P, Lu J, Deng Y, Park AJ, et al. Microbiota and host determinants of behavioural phenotype in maternally separated mice. Nat Commun. 2015;6:7735.
- Zheng P, Zeng B, Zhou C, Liu M, Fang Z, et al. Gut microbiome remodeling induces depressive-like behaviors through a pathway mediated by the host’s metabolism. Mol Psychiatry. 2016;21(6):786-96.
- Luo YY, Zeng BH, Zeng L, Du XY, Li B, et al. Gut microbiota regulates mouse behaviors through glucocorticoid receptor pathway genes in the hippocampus. Transl Psychiatry. 2018;8(1):187.
- Sorboni SG, Moghaddam HS, Jafarzadeh-Esfehani R, Soleimanpour S. A comprehensive review on the role of the gut microbiome in human neurological disorders. Clin Microbiol Rev. 2022;35:33820.
- Rosario D, Bidkhori G, Lee S, Bedarf J, Hildebrand F, Le Chatelier E, et al. Systematic analysis of gut microbiome reveals the role of bacterial folate and homocysteine metabolism in Parkinson’s disease. Cell Rep. 2021;34: 108807.
- Teng T, Clarke G, Maes M, Jiang Y, Wang J, Li X, et al. Biogeography of the large intestinal mucosal and luminal microbiome in cynomolgus macaques with depressive-like behavior. Mol Psychiatry. 2022;27:1059-67.
- Krautkramer KA, Fan J, Bäckhed F. Gut microbial metabolites as multikingdom intermediates. Nat Rev Microbiol. 2021;19:77-94.
- Kayama H, Okumura R, Takeda K. Interaction between the microbiota, epithelia, and immune cells in the intestine. Annu Rev Immunol. 2020;38:23-48.
- Nadjsombati MS, McGinty JW, Lyons-Cohen MR, Jaffe JB, DiPeso L, Schneider C, et al. Detection of succinate by intestinal tuft cells triggers a type 2 innate immune circuit. Immunity. 2018;49:33-41.
- Levy M, Kolodziejczyk AA, Thaiss CA, Elinav E. Dysbiosis and the immune system. Nat Rev Immunol. 2017;17:219-32.
- Hao WZ, Li XJ, Zhang PW, Chen JX. A review of antibiotics, depression, and the gut microbiome. Psychiatry Res. 2020;284: 112691.
- Berkins S, Schiöth HB, Rukh G. Depression and vegetarians: association between dietary vitamin B6, B12 and folate intake and global and subcortical brain volumes. Nutrients. 2021;13:1790.
- Mesripour A, Alhimma F, Hajhashemi V. The effect of vitamin B6 on dexamethasone-induced depression in mice model of despair. Nutr Neurosci. 2019;22:744-9.
- Yu Y, Wang H, Rao X, Liu L, Zheng P, Li W, et al. Proteomic profiling of lysine acetylation indicates mitochondrial dysfunction in the hippocampus of gut microbiota-absent mice. Front Mol Neurosci. 2021;14: 594332.
- Raetz CR, Whitfield C. Lipopolysaccharide endotoxins. Annu Rev Biochem. 2002;71:635-700.
- Stevens BR, Goel R, Seungbum K, Richards EM, Holbert RC, Pepine CJ, et al. Increased human intestinal barrier permeability plasma biomarkers zonulin and FABP2 correlated with plasma LPS and altered gut microbiome in anxiety or depression. Gut. 2018;67:1555-7.
- Bodea LG, Wang Y, Linnartz-Gerlach B, Kopatz J, Sinkkonen L, Musgrove R, et al. Neurodegeneration by activation of the microglial complementphagosome pathway. J Neurosci. 2014;34:8546-56.
- Götze O , Müller-Eberhard HJ. The C3-activator system: an alternate pathway of complement activation. J Exp Med. 1971;134:90-108.
- Tao H, Chen X, Zhou H, Fu J, Yu Q, Liu Y. Changes of serum melatonin, Interleukin-6, Homocysteine, and Complement C3 and C4 levels in patients with depression. Front Psychol. 2020;11:1271.
- Morrison DC, Kline LF. Activation of the classical and properdin pathways of complement by bacterial lipopolysaccharides (LPS). J Immunol. 1977;118:362-8.
- Hong S, Dissing-Olesen L, Stevens B. New insights on the role of microglia in synaptic pruning in health and disease. Curr Opin Neurobiol. 2016;36:128-34.
- Paolicelli RC, Bolasco G, Pagani F, Maggi L, Scianni M, Panzanelli P, et al. Synaptic pruning by microglia is necessary for normal brain development. Science. 2011;333:1456-8.
- Stephan AH, Barres BA, Stevens B. The complement system: an unexpected role in synaptic pruning during development and disease. Annu Rev Neurosci. 2012;35:369-89.
- Germann M, Brederoo SG, Sommer IEC. Abnormal synaptic pruning during adolescence underlying the development of psychotic disorders. Curr Opin Psychiatry. 2021;34:222.
- Presumey J, Bialas AR, Carroll MC. Complement system in neural synapse elimination in development and disease. Adv Immunol. 2017;135:53-79.
- Vatandoust SM, Meftahi GH. The effect of sericin on the cognitive impairment, depression, and anxiety caused by learned helplessness in male mice. J Mol Neurosci. 2022;72:963-74.
Publisher’s Note
Wenzhi Hao and Qingyu Ma are co-first authors.
*Correspondence:
Xiaojuan Li
lixiaojuan@jnu.edu.cn
Junqing Huang
jqhuang@jnu.edu.cn
Jiaxu Chen
chenjiaxu@hotmail.com
Full list of author information is available at the end of the article
