DOI: https://doi.org/10.1111/prd.12556
PMID: https://pubmed.ncbi.nlm.nih.gov/38546140
تاريخ النشر: 2024-03-28
دقة التصوير المقطعي المحوسب باستخدام شعاع المخروط في تصوير مكونات النمط الظاهري اللثوي
المراسلة
الملخص
تعتبر مكونات وأبعاد النمط الظاهري اللثوي والنمط الظاهري المحيط بالزرع ذات أهمية عالية في أبحاث الأسنان المعاصرة ويجب أخذها بعين الاعتبار في عملية اتخاذ القرار في إدارة مجموعة متنوعة من السيناريوهات السريرية لتحسين نتائج العلاج. لقد ظهرت وتطورت طرق تقييم مختلفة لتحديد وتصنيف الأبعاد الظاهرية في العقود الأخيرة. ومع ذلك، فإن استخدام التصوير المقطعي المحوسب باستخدام شعاع المخروط (CBCT) لا يزال هو النهج الأكثر استخدامًا على مستوى العالم. ومع ذلك، قد تمثل دقة التصوير الكافي وقياس أبعاد مكونات الأنسجة الصلبة واللينة حول الأسنان تحديًا كبيرًا في سيناريوهات سريرية مختلفة بسبب عوامل مثل عمر المريض والحركة أثناء المسح، ووجود عيوب معدنية تسبب خطوط وتشوهات في القيم الرمادية، وتداخل الهياكل اللينة، وأداء الجهاز، ومعالجة الملفات، وحجم الفوكسل الصغير من بين أمور أخرى. تشكل هذه العوامل تحديًا خاصًا عندما تكون الهياكل الصغيرة قيد التحقيق، على سبيل المثال، طبقة العظام أو الأنسجة اللينة البوكية/اللسانية للقواطع السفلية/العليا. لذلك، تتناول هذه المراجعة المعلومات التقنية الأساسية لاستخدام مسحات CBCT، وتقترح بعض التوصيات حول استخدام هذه الطريقة للتقييم لاستخدامها بشكل مثالي على الرغم من قيود النظام الموروثة.
الكلمات الرئيسية
1 | المقدمة
من قمة العظام السنخية، في البداية في تعريف النمط الظاهري اللثوي المقدم في ورشة العمل العالمية 2017، أوصت الدراسات الحديثة بأخذ هذا المكون في الاعتبار كجزء لا يتجزأ من النمط الظاهري اللثوي بسبب ارتباطه بميزات ظاهرية أخرى وأهميته في الممارسة السريرية.
الأسنان، مثل استخدام الفحص البصري فقط للميزات الخارجية للحافة السنخية والأنسجة اللينة،
2 | خلفية التصوير المقطعي المحوسب باستخدام شعاع المخروط
2.1 | خلفية حول إعادة بناء صورة CBCT
في ذلك الموقع المحدد) وثلاثة إحداثيات (
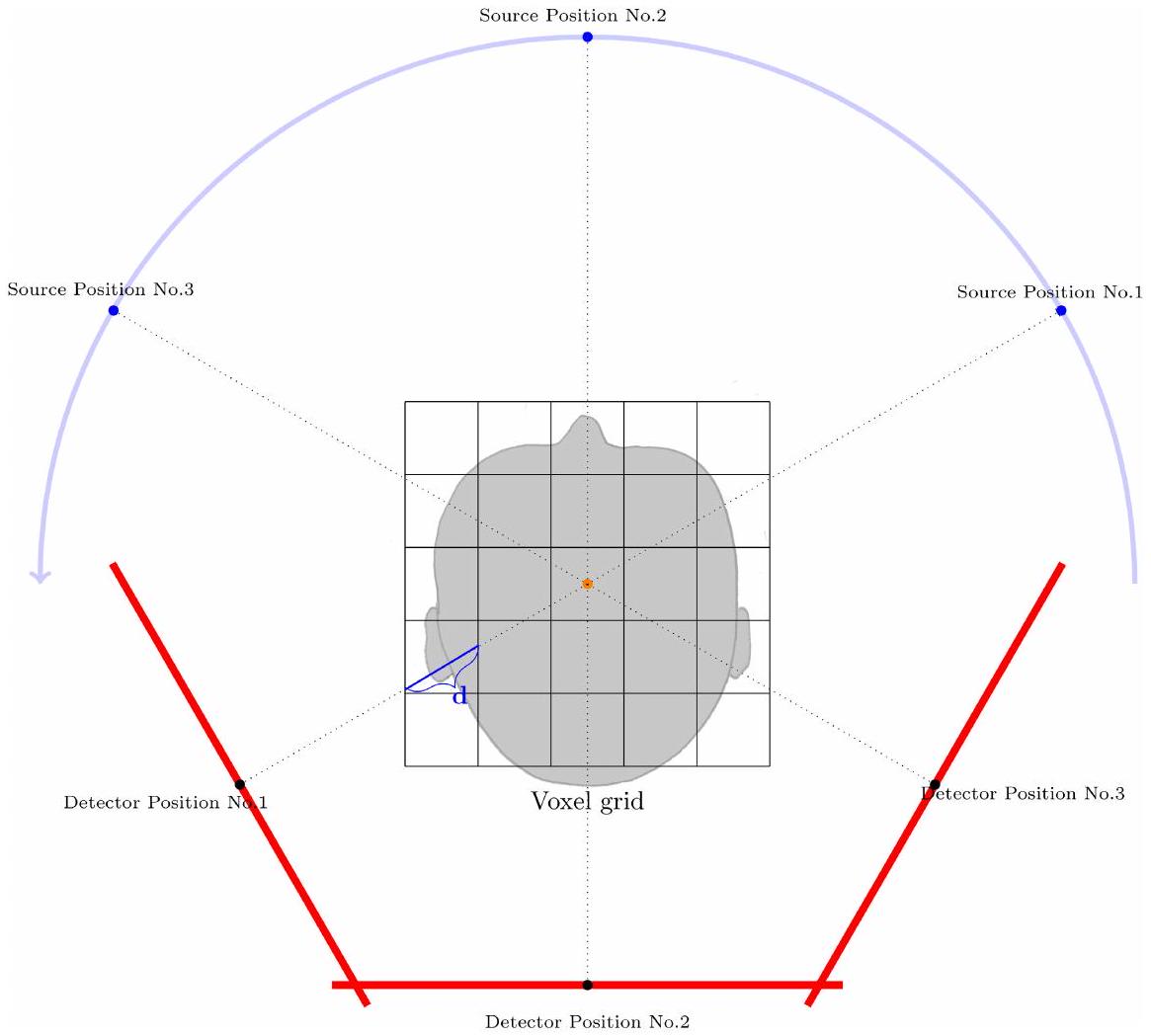
بعد ترتيب جميع مواقع المصدر والكاشف تقريبًا حول شبكة الفوكسل الافتراضية وفقًا للمواقع الحقيقية التي كانت فعالة لكل واحدة من مئات صور الأشعة السينية (الشكل 1)، يتم بناء خط من كل بكسل كاشف يهدف إلى الموقع ثلاثي الأبعاد لمصدر الأشعة السينية. لكل فوكسل وإسقاط k (أي، موقع المصدر إلى الكاشف رقم k) يتم حساب مسافة
تُعطى التقديرات لهذه المدخلات بعد ذلك، على سبيل المثال، متوسطًا لكل فوكسل، ويتم الحصول على تقدير جيد لكثافة المريض الموجود في كل فوكسل وتمثيله كقيمة رمادية.
2.2 | العوامل المؤثرة على جودة الصورة والدقة المكانية
2.2.1 | العوامل الفنية
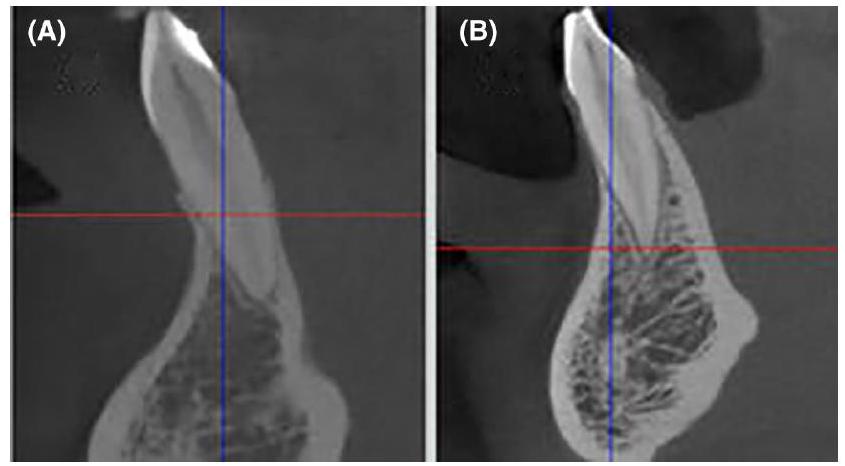
طريقة. بينما تقوم الطريقة الأولى بتقييم بصري لعدد الخطوط القابلة للإدراك لكل مليمتر في صورة وهمية (الشكل 2)، فإن الأخيرة هي مقياس يمكن تقييمه تلقائيًا وموضوعيًا من صور وهمية محددة. بعبارة أخرى، تقيس MTF الدقة المكانية بالنسبة إلى (التباين) المعياري. بينما تنتج مخرجاتها في “دورات لكل مليمتر”، يمكن ترجمتها بأمان إلى “أزواج الخطوط لكل مليمتر” أيضًا. عادةً ما ترتبط الدقة المكانية المحدودة بالقيمة التي تنخفض عندها MTF إلى

“يجب تجاهل الخطأ في”

في هذه الجملة!
ستكون التقييمات المعتمدة على CBCT للهياكل الصغيرة في نطاق أقل من مليمتر محاطة بهامش كبير من الخطأ. يدعم ذلك الملاحظات التي قام بها دوميك وزملاؤه الذين وجدوا دقة اكتشاف تبلغ فقط
صعوبة أخرى في تقييم الهياكل المجاورة حيث أنها تسبب أيضًا عيوب تصلب الشعاع (بالإضافة إلى عيوب أخرى) في جوارها.
| MTF 10% | أصغر حجم تفصيل مرئي الناتج |
|
|
0.50 مم |
|
|
0.33 مم |
|
|
0.25 مم |
|
|
0.20 مم |
ستتأثر قياسات المسافات الصغيرة بشكل أكبر من تلك الخاصة بالمسافات الكبيرة. إذا كانت المسافة قيد التحقيق في نطاق حجم عدد قليل من الفوكسلات فقط، فإن الخطأ سيساهم بشكل كبير في الحجم المقاس.
2.2.2 | العوامل التشريحية
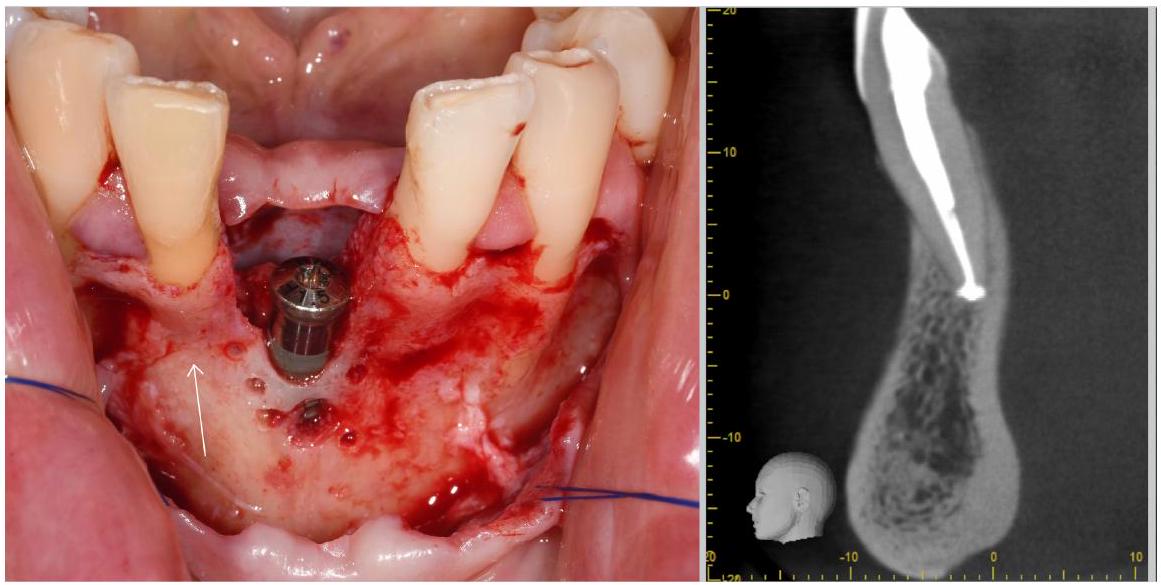
3 | التوصيات السريرية والتقنية

صغير لعملية المسح. في هذا السياق، ومع ذلك، يجب ملاحظة أن أحجام الفوكسل الصغيرة عادةً ما تزيد من وقت المسح مما يمنح المريض مزيدًا من الوقت للتحرك. حيث أن الحركة تعاكس دقة الفضاء، من الضروري إيجاد “أفضل توازن ممكن” بين حجم الفوكسل وحركة المريض المحتملة. إذا كان ذلك ممكنًا، يجب تطبيق تثبيت رأس الأجهزة، على الرغم من أن هذا معروف أيضًا أن له حدوده وربما لا يمكنه القضاء على الحركات الصغيرة.
- يجب تثبيت المريض باستخدام دعامة الذقن والرأس (إذا كانت موجودة).
- يجب اختيار حجم فوكسل مناسب (حوالي
). - يجب وضع المريض بحيث لا تتداخل العوائق من الهياكل المجاورة (مثل المعدن) مع الهيكل قيد الدراسة (انظر المرجع [42]).
- أثناء المسح، يجب فصل الأنسجة الرخوة الوجهية (الشفاه) عن قمة الحويصلات، على سبيل المثال، بواسطة لفة قطنية موضوعة في الفم لزيادة التباين المحلي.
- ويجب تعديل التباين وقيم الرمادي بشكل مناسب في العارض قبل القياس.
4 | المناقشة
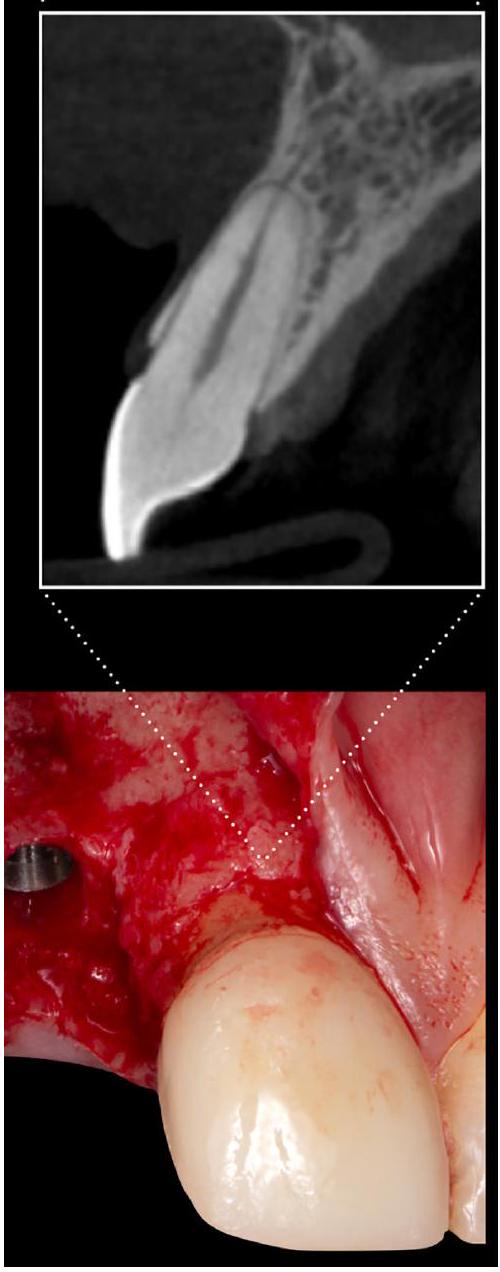
أو أبعاد الأنسجة فوق القمة، يمكن أن يوفر الجمع بين CBCT ومسح السطح البصري نتائج أكثر دقة.
5 | الاستنتاج
الشكر والتقدير
بيان تضارب المصالح
ORCID
REFERENCES
- Avila-Ortiz G, Gonzalez-Martin O, Couso-Queiruga E, Wang HL. The peri-implant phenotype. J Periodontol. 2020;91:283-288.
- Kao RT, Curtis DA, Kim DM, et al. American Academy of periodontology best evidence consensus statement on modifying periodontal phenotype in preparation for orthodontic and restorative treatment. J Periodontol. 2020;91:289-298.
- Jepsen S, Caton JG, Albandar JM, et al. Periodontal manifestations of systemic diseases and developmental and acquired conditions: consensus report of workgroup 3 of the 2017 world workshop on the classification of periodontal and Peri-implant diseases and conditions. J Clin Periodontol. 2018;45:S219-S229.
- Couso-Queiruga E, Barboza EP, Avila-Ortiz G, Gonzalez-Martin O, Chambrone L, Rodrigues DM. Relationship between supracrestal soft tissue dimensions and other periodontal phenotypic features: a cross-sectional study. J Periodontol. 2023;94:944-955.
- Couso-Queiruga E, Graham ZA, Peter T, Gonzalez-Martin O, Galindo-Moreno P, Avila-Ortiz G. Effect of periodontal phenotype characteristics on post-extraction dimensional changes of the alveolar ridge: a prospective case series. J Clin Periodontol. 2023;50:694-706.
- Wennström JL. Mucogingival considerations in orthodontic treatment. Semin Orthod. 1996;2:246-254.
- Gebistorf M, Mijuskovic M, Pandis N, Fudalej PS, Katsaros C. Gingival recession in orthodontic patients 10 to 15 years posttreatment: a retrospective cohort study. Am J Orthod Dentofacial Orthop. 2018;153:645-655.
- Katsaros C, Livas C, Renkema AM. Unexpected complications of bonded mandibular lingual retainers. Am J Orthod Dentofacial Orthop. 2007;132:838-841.
- Joss-Vassalli I, Grebenstein C, Topouzelis N, Sculean A, Katsaros C. Orthodontic therapy and gingival recession: a systematic review. Orthod Craniofac Res. 2010;13:127-141.
- Cortellini P, Bissada NF. Mucogingival conditions in the natural dentition: narrative review, case definitions, and diagnostic considerations. J Periodontol. 2018;89(Suppl 1):S204-s213.
- Agudio G, Chambrone L, Selvaggi F, Pini-Prato GP. Effect of gingival augmentation procedure (free gingival graft) on reducing the risk of non-carious cervical lesions: a 25 – to 30 -year follow-up study. J Periodontol. 2019;90:1235-1243.
- Barootchi S, Tavelli L, Di Gianfilippo R, et al. Soft tissue phenotype modification predicts gingival margin long-term (10-year) stability: longitudinal analysis of six randomized clinical trials. J Clin Periodontol. 2022;49:672-683.
- Carbone AC, Joly JC, Botelho J, et al. Long-term stability of gingival margin and periodontal soft-tissue phenotype achieved after mucogingival therapy: a systematic review. J Clin Periodontol. 2023;51:177-195.
- Lang NP, Kiel RA, Anderhalden K. Clinical and microbiological effects of subgingival restorations with overhanging or clinically perfect margins. J Clin Periodontol. 1983;10:563-578.
- Kells BE, Linden GJ. Overhanging amalgam restorations in young adults attending a periodontal department. J Dent. 1992;20:85-89.
- Sanavi F, Weisgold AS, Rose LF. Biologic width and its relation to periodontal biotypes. J Esthet Dent. 1998;10:157-163.
- Olsson M, Lindhe J. Periodontal characteristics in individuals with varying form of the upper central incisors. J Clin Periodontol. 1991;18:78-82.
- Stellini E, Comuzzi L, Mazzocco F, Parente N, Gobbato L. Relationships between different tooth shapes and patient’s periodontal phenotype. J Periodontal Res. 2013;48:657-662.
- Chappuis V, Engel O, Reyes M, Shahim K, Nolte LP, Buser D. Ridge alterations post-extraction in the esthetic zone: a 3D analysis with CBCT. J Dent Res. 2013;92:195s-201s.
- Chappuis V, Engel O, Shahim K, Reyes M, Katsaros C, Buser D. Soft tissue alterations in esthetic Postextraction sites: a 3-dimensional analysis. J Dent Res. 2015;94:187s-193s.
- Clementini M, Agostinelli A, Castelluzzo W, Cugnata F, Vignoletti F, De Sanctis M. The effect of immediate implant placement on alveolar ridge preservation compared to spontaneous healing after tooth extraction: radiographic results of a randomized controlled clinical trial. J Clin Periodontol. 2019;46:776-786.
- Avila-Ortiz G, Gubler M, Romero-Bustillos M, Nicholas CL, Zimmerman MB, Barwacz CA. Efficacy of alveolar ridge preservation: a randomized controlled trial. J Dent Res. 2020;99:402-409.
- Couso-Queiruga E, Stuhr S, Tattan M, Chambrone L, Avila-Ortiz G. Post-extraction dimensional changes: a systematic review and meta-analysis. J Clin Periodontol. 2021;48:126-144.
- Couso-Queiruga E, Garaicoa-Pazmino C, Fonseca M, Chappuis V, Gonzalez-Martin O, Avila-Ortiz G. Interproximal soft tissue height changes after unassisted socket healing versus alveolar ridge preservation therapy. Int J Periodontics Restorative Dent. 2023. doi:10. 11607/prd. 6809
- Couso-Queiruga E, Weber HA, Garaicoa-Pazmino C, et al. Influence of healing time on the outcomes of alveolar ridge preservation using a collagenated bovine bone xenograft: a randomized clinical trial. J Clin Periodontol. 2023;50:132-146.
- Pauwels R, Jacobs R, Singer SR, Mupparapu M. CBCT-based bone quality assessment: are Hounsfield units applicable? Dentomaxillofac Radiol. 2015;44:20140238.
- Couso-Queiruga E, Mansouri CJ, Alade AA, Allareddy TV, GalindoMoreno P, Avila-Ortiz G. Alveolar ridge preservation reduces the need for ancillary bone augmentation in the context of implant therapy. J Periodontol. 2022;93:847-856.
- Eghbali A, De Rouck T, De Bruyn H, Cosyn J. The gingival biotype assessed by experienced and inexperienced clinicians. J Clin Periodontol. 2009;36:958-963.
- De Rouck T, Eghbali R, Collys K, De Bruyn H, Cosyn J. The gingival biotype revisited: transparency of the periodontal probe through the gingival margin as a method to discriminate thin from thick gingiva. J Clin Periodontol. 2009;36:428-433.
- Kloukos D, Kalimeri E, Koukos G, Stähli A, Sculean A, Katsaros C. Gingival thickness threshold and probe visibility through soft tissue: a cross-sectional study. Clin Oral Investig. 2022;26:5155-5161.
- Bertl K, Al-Hotheiry M, Sun D, et al. Are colored periodontal probes reliable to classify the gingival phenotype in terms of gingival thickness? J Periodontol. 2022;93:412-422.
- Kloukos D, Koukos G, Doulis I, Sculean A, Stavropoulos A, Katsaros C. Gingival thickness assessment at the mandibular incisors with four methods: a cross-sectional study. J Periodontol. 2018;89:1300-1309.
- Tattan M, Sinjab K, Lee E, et al. Ultrasonography for chairside evaluation of periodontal structures: a pilot study. J Periodontol. 2020;91:890-899.
- Couso-Queiruga E, Raabe C, Belser UC, et al. Non-invasive assessment of peri-implant mucosal thickness: a cross-sectional study. J Periodontol. 2023;94:1315-1323.
- Kloukos D, Koukos G, Gkantidis N, Sculean A, Katsaros C, Stavropoulos A. Transgingival probing: a clinical gold standard for assessing gingival thickness. Quintessence Int. 2021;52:394-401.
- Alves PHM, Alves T, Pegoraro TA, Costa YM, Bonfante EA, de Almeida A. Measurement properties of gingival biotype evaluation methods. Clin Implant Dent Relat Res. 2018;20:280-284.
- Couso-Queiruga E, Tattan M, Ahmad U, Barwacz C, GonzalezMartin O, Avila-Ortiz G. Assessment of gingival thickness using digital file superimposition versus direct clinical measurements. Clin Oral Investig. 2021;25:2353-2361.
- Gkogkos A, Kloukos D, Koukos G, Liapis G, Sculean A, Katsaros C. Clinical and radiographic gingival thickness assessment at mandibular incisors: an ex vivo study. Oral Health Prev Dent. 2020;18:607-617.
- Saleh MHA, Couso-Queiruga E, Ravidà A, et al. Impact of the periodontal phenotype in premolar and molar sites on bone loss following full-thickness mucoperiosteal flap: a 1-year prospective clinical trial. J Periodontol. 2022;93:966-976.
- Nyquist H. Certain topics in telegraph transmission theory. Trans Am Inst Electr Eng. 1928;47:617-644.
- Shannon CE. Communication in the presence of noise. Proc IRE. 1949;37:10-21.
- Schulze R, Heil U, Gross D, et al. Artefacts in CBCT: a review. Dentomaxillofac Radiol. 2011;40:265-273.
- Birklein L, Niebler S, Schömer E, Brylka R, Schwanecke U, Schulze R. Motion correction for separate mandibular and cranial movements in cone beam CT reconstructions. Med Phys. 2023;50:3511-3525.
- Sun T, Kim JH, Fulton R, Nuyts J. An iterative projection-based motion estimation and compensation scheme for head x-ray CT. Med Phys. 2016;43:5705-5716.
- Spin-Neto R, Hauge Matzen L, Hermann L, Fuglsig J, Wenzel A. Head motion and perception of discomfort by young children during simulated CBCT examinations. Dentomaxillofac Radiol. 2021;50:20200445.
- Ozaki Y, Watanabe H, Nomura Y, Honda E, Sumi Y, Kurabayashi T. Location dependency of the spatial resolution of cone beam computed tomography for dental use. Oral Surg Oral Med Oral Pathol Oral Radiol. 2013;116:648-655.
- Feldkamp LA, Davis LC, Kress JW. Practical cone-beam algorithm. J Opt Soc Am A. 1984;1:612-619.
- IEC-standard. Evaluation and routine testing in medical imaging departments – Part 3-7: Acceptance and constancy tests – Imaging performance of X-ray equipment for dental cone beam computed tomography. 2022 61223-61223-61227.
- DIN 6868-15. Image Quality Assurance in X- Ray Departments – Part 15: RöV Constancy Testing of X-Ray Installations for Dental Radiographic Equipment for Digital Cone-Beam Computed Tomography. Deutsches Institut für Normung; 2015 6868-15.
- de Las Heras Gala H, Torresin A, Dasu A, et al. Quality control in cone-beam computed tomography (CBCT) EFOMP-ESTRO-IAEA protocol (summary report). Phys Med. 2017;39:67-72.
- Yang K, Kwan AL, Boone JM. Computer modeling of the spatial resolution properties of a dedicated breast CT system. Med Phys. 2007;34:2059-2069.
- Brüllmann D, Schulze RK. Spatial resolution in CBCT machines for dental/maxillofacial applications-what do we know today? Dentomaxillofac Radiol. 2015;44:20140204.
- European Commission. Directorate-General for Energy, Criteria for Acceptability of Medical Radiological Equipment Used in Diagnostic Radiology, Nuclear Medicine and Radiotherapy. Publications Office; 2012. doi:10.2768/22561
- Pauwels R, Nackaerts O, Bellaiche N, et al. Variability of dental cone beam CT grey values for density estimations. Br J Radiol. 2013;86:20120135.
- Domic D, Bertl K, Ahmad S, Schropp L, Hellén-Halme K, Stavropoulos A. Accuracy of cone-beam computed tomography is limited at implant sites with a thin buccal bone: a laboratory study. J Periodontol. 2021;92:592-601.
- Rußig LL, Schulze RK. Effects of minute misregistrations of prefabricated markers for image-guided dental implant surgery: an analytical evaluation. Clin Oral Implants Res. 2013;24:1339-1346.
- Ferry K, AlQallaf H, Blanchard S, Dutra V, Lin WS, Hamada Y. Evaluation of the accuracy of soft tissue thickness measurements with three different methodologies: an in vitro study. J Periodontol. 2022;93:1468-1475.
- Todorovic VS, Postma TC, Hoffman J, van Zyl AW. Buccal and palatal alveolar bone dimensions in the anterior maxilla: a micro-CT study. Clin Implant Dent Relat Res. 2023;25:261-270.
- Patcas R, Müller L, Ullrich O, Peltomäki T. Accuracy of conebeam computed tomography at different resolutions assessed on the bony covering of the mandibular anterior teeth. Am J Orthod Dentofacial Orthop. 2012;141:41-50.
- Januário AL, Barriviera M, Duarte WR. Soft tissue cone-beam computed tomography: a novel method for the measurement of gingival
tissue and the dimensions of the dentogingival unit. J Esthet Restor Dent. 2008;20:366-373. discussion 374. - Kloukos D, Kakali L, Koukos G, Sculean A, Stavropoulos A, Katsaros C. Gingival thickness assessment at mandibular incisors of orthodontic patients with ultrasound and cone-beam CT. A crosssectional study. Oral Health Prev Dent. 2021;19:263-270.
- Dritsas K, Halazonetis D, Ghamri M, Sculean A, Katsaros C, Gkantidis N. Accurate gingival recession quantification using 3D digital dental models. Clin Oral Investig. 2023;27:1697-1705.
- Khorshed A, Vilarrasa J, Monje A, Nart J, Blasi G. Digital evaluation of facial peri-implant mucosal thickness and its impact on dental implant aesthetics. Clin Oral Investig. 2023;27:581-590.
- Nascimento M, Boscolo SMA, Haiter-Neto F, et al. Influence of basis images and skull position on evaluation of cortical bone thickness in cone beam computed tomography. Oral Surg Oral Med Oral Pathol Oral Radiol. 2017;123(6):707-713. doi:10.1016/j.oooo.2017.01.015
- de Kinkelder R, Kalkman J, Faber DJ, et al. Heartbeat-induced axial motion artifacts in optical coherence tomography measurements of the retina. Invest Ophthalmol Vis Sci. 2011;52:3908-3913.
- Fan S, Sáenz-Ravello G, Al-Nawas B, Schiegnitz E, Diaz L, Sagheb K. The feasibility of ultrasonography for the measurement of
periodontal and peri-implant phenotype: a systematic review and meta-analysis. Clin Implant Dent Relat Res. 2023;25:892-909. - Wang J, Cha S, Zhao Q, Bai D. Methods to assess tooth gingival thickness and diagnose gingival phenotypes: a systematic review. J Esthet Restor Dent. 2022;34:620-632.
- Ludlow JB, Timothy R, Walker C, et al. Effective dose of dental CBCT-a meta analysis of published data and additional data for nine CBCT units. Dentomaxillofac Radiol. 2015;44:20140197.
- ICRP. The 2007 recommendations of the international commission on radiological protection. ICRP publication 103. Ann ICRP. 2007;37:2-4.
- This is an open access article under the terms of the Creative Commons Attribution License, which permits use, distribution and reproduction in any medium, provided the original work is properly cited.
© 2024 The Authors. Periodontology 2000 published by John Wiley & Sons Ltd.
DOI: https://doi.org/10.1111/prd.12556
PMID: https://pubmed.ncbi.nlm.nih.gov/38546140
Publication Date: 2024-03-28
Accuracy of cone-beam computed tomography in imaging the components of the periodontal phenotype
Correspondence
Abstract
The components and dimensions of the periodontal and peri-implant phenotype have a high relevance in contemporary dental research and should be taken into consideration in the decision-making process in the management of a variety of clinical scenarios to optimize the outcomes of therapy. Various assessment methods for quantifying and classifying the phenotypical dimensions have emerged and developed in recent decades. Nevertheless, the use of cone-beam computed tomography (CBCT) scans remains the most commonly used approach worldwide. However, the accuracy to adequately imaging and measuring the dimensions of the hard and soft tissue components around teeth may represent a significant challenge in different clinical scenarios due to factors such as the age of the patient and motion during the scan, presence of metallic artifacts causing streaks and gray-value distortion, overlapping of soft tissue structures, machine performance, file processing, and small voxel size among others. These factors pose a particular challenge when tiny structures are under investigation, for example, the buccal/lingual bony or soft tissue layer of lower/upper incisors. Therefore, this review addresses the underlying technical information of the use of CBCT scans, and suggests some recommendations on the utilization of this method of assessment to optimally use it despite its’ system-inherent limitations.
KEYWORDS
1 | INTRODUCTION
of the alveolar bone crest, was not initially included in the definition of periodontal phenotype provided in the 2017 World Workshop, recent studies recommended considering this component as an integral component of the periodontal phenotype due to its correlation with other phenotypic features and relevance in clinical practice.
teeth, such as the use of merely visual inspection of the external features of the alveolar ridge and soft tissues,
2 | BACKGROUND OF CONE-BEAM COMPUTED TOMOGRAPHY SCAN
2.1 | Background on image CBCT image reconstruction
at that particular location) and three coordinates (
After virtually arranging all source and detector positions around the virtual voxel grid according to the true locations which were effective for every single one of the hundreds of X-ray projection images (Figure 1), from every image detector-pixel a line is constructed aiming at the 3D position of the X-ray source. For each voxel and projection k (i.e., source-to-detector position No. k) a distance
projections and these entries are subsequently, for example, averaged per voxel, a good estimation of the density of the patient located in each voxel is obtained and represented as gray value.
2.2 | Factors affecting image quality and spatial resolution
2.2.1 | Technical factors

method. While the first method visually assesses the number of perceptible lines per millimeter in a phantom image (Figure 2), the latter is a metric that can be automatically and objectively assessed from specific phantoms. Roughly translated, the MTF measures spatial resolution in relation to (normalized) contrast. While it produces an output in “cycles per millimeter,” this can be safely translated into “line pairs per millimeter” as well. The limiting spatial resolution is normally associated with the value where the MTF falls to

“the error in” needs to be discarded

in this sentence!
in CBCT-based assessment of tiny structures in the submillimeter range will be beset with a significant margin of error. This is supported by the observations of Domic and colleagues who found a detection accuracy of only
another difficulty in the assessment of adjacent structures as it also induces beam-hardening (plus other) artifacts in its vicinity.
| MTF 10% | Resulting smallest visible detail size |
|
|
0.50 mm |
|
|
0.33 mm |
|
|
0.25 mm |
|
|
0.20 mm |
measurements of small distances will be far more affected than those of large distances. If the distance under investigation is in the range of the size of a few voxels only, the error will largely contribute to the measured size.
2.2.2 | Anatomical factors

3 | CLINICAL AND TECHNICAL RECOMMENDATIONS


small voxel size for the scan. In this context, however, it should be noted that small voxel sizes commonly increase scan time giving the patient more time to move. As motion counteracts spatial resolution, it is essential to find the “best possible” balance between voxel size and potential patient motion. If possible, hardware head immobilization should be applied, albeit this is also known to have its limits and probably cannot eliminate small movements.
- The patient should be immobilized by using the chin- and headrest (if existing).
- An appropriate voxel size should be selected (ca.
). - The patient should be positioned such that artifacts from neighboring structures (e.g., metal) do not overlap the structure under study (see Ref. [42]).
- During the scan, facial soft tissue (lip) should be separated from the alveolar crest, for example, by a cotton roll placed in the vestibulum to increase local contrast.
- And, contrast and gray values should be appropriately adapted in the viewer before the measurement.
4 | DISCUSSION

or the supracrestal tissue dimensions, the combination of a CBCT with an optical surface scan can provide more accurate results.
5 | CONCLUSION
ACKNOWLEDGMENTS
CONFLICT OF INTEREST STATEMENT
ORCID
REFERENCES
- Avila-Ortiz G, Gonzalez-Martin O, Couso-Queiruga E, Wang HL. The peri-implant phenotype. J Periodontol. 2020;91:283-288.
- Kao RT, Curtis DA, Kim DM, et al. American Academy of periodontology best evidence consensus statement on modifying periodontal phenotype in preparation for orthodontic and restorative treatment. J Periodontol. 2020;91:289-298.
- Jepsen S, Caton JG, Albandar JM, et al. Periodontal manifestations of systemic diseases and developmental and acquired conditions: consensus report of workgroup 3 of the 2017 world workshop on the classification of periodontal and Peri-implant diseases and conditions. J Clin Periodontol. 2018;45:S219-S229.
- Couso-Queiruga E, Barboza EP, Avila-Ortiz G, Gonzalez-Martin O, Chambrone L, Rodrigues DM. Relationship between supracrestal soft tissue dimensions and other periodontal phenotypic features: a cross-sectional study. J Periodontol. 2023;94:944-955.
- Couso-Queiruga E, Graham ZA, Peter T, Gonzalez-Martin O, Galindo-Moreno P, Avila-Ortiz G. Effect of periodontal phenotype characteristics on post-extraction dimensional changes of the alveolar ridge: a prospective case series. J Clin Periodontol. 2023;50:694-706.
- Wennström JL. Mucogingival considerations in orthodontic treatment. Semin Orthod. 1996;2:246-254.
- Gebistorf M, Mijuskovic M, Pandis N, Fudalej PS, Katsaros C. Gingival recession in orthodontic patients 10 to 15 years posttreatment: a retrospective cohort study. Am J Orthod Dentofacial Orthop. 2018;153:645-655.
- Katsaros C, Livas C, Renkema AM. Unexpected complications of bonded mandibular lingual retainers. Am J Orthod Dentofacial Orthop. 2007;132:838-841.
- Joss-Vassalli I, Grebenstein C, Topouzelis N, Sculean A, Katsaros C. Orthodontic therapy and gingival recession: a systematic review. Orthod Craniofac Res. 2010;13:127-141.
- Cortellini P, Bissada NF. Mucogingival conditions in the natural dentition: narrative review, case definitions, and diagnostic considerations. J Periodontol. 2018;89(Suppl 1):S204-s213.
- Agudio G, Chambrone L, Selvaggi F, Pini-Prato GP. Effect of gingival augmentation procedure (free gingival graft) on reducing the risk of non-carious cervical lesions: a 25 – to 30 -year follow-up study. J Periodontol. 2019;90:1235-1243.
- Barootchi S, Tavelli L, Di Gianfilippo R, et al. Soft tissue phenotype modification predicts gingival margin long-term (10-year) stability: longitudinal analysis of six randomized clinical trials. J Clin Periodontol. 2022;49:672-683.
- Carbone AC, Joly JC, Botelho J, et al. Long-term stability of gingival margin and periodontal soft-tissue phenotype achieved after mucogingival therapy: a systematic review. J Clin Periodontol. 2023;51:177-195.
- Lang NP, Kiel RA, Anderhalden K. Clinical and microbiological effects of subgingival restorations with overhanging or clinically perfect margins. J Clin Periodontol. 1983;10:563-578.
- Kells BE, Linden GJ. Overhanging amalgam restorations in young adults attending a periodontal department. J Dent. 1992;20:85-89.
- Sanavi F, Weisgold AS, Rose LF. Biologic width and its relation to periodontal biotypes. J Esthet Dent. 1998;10:157-163.
- Olsson M, Lindhe J. Periodontal characteristics in individuals with varying form of the upper central incisors. J Clin Periodontol. 1991;18:78-82.
- Stellini E, Comuzzi L, Mazzocco F, Parente N, Gobbato L. Relationships between different tooth shapes and patient’s periodontal phenotype. J Periodontal Res. 2013;48:657-662.
- Chappuis V, Engel O, Reyes M, Shahim K, Nolte LP, Buser D. Ridge alterations post-extraction in the esthetic zone: a 3D analysis with CBCT. J Dent Res. 2013;92:195s-201s.
- Chappuis V, Engel O, Shahim K, Reyes M, Katsaros C, Buser D. Soft tissue alterations in esthetic Postextraction sites: a 3-dimensional analysis. J Dent Res. 2015;94:187s-193s.
- Clementini M, Agostinelli A, Castelluzzo W, Cugnata F, Vignoletti F, De Sanctis M. The effect of immediate implant placement on alveolar ridge preservation compared to spontaneous healing after tooth extraction: radiographic results of a randomized controlled clinical trial. J Clin Periodontol. 2019;46:776-786.
- Avila-Ortiz G, Gubler M, Romero-Bustillos M, Nicholas CL, Zimmerman MB, Barwacz CA. Efficacy of alveolar ridge preservation: a randomized controlled trial. J Dent Res. 2020;99:402-409.
- Couso-Queiruga E, Stuhr S, Tattan M, Chambrone L, Avila-Ortiz G. Post-extraction dimensional changes: a systematic review and meta-analysis. J Clin Periodontol. 2021;48:126-144.
- Couso-Queiruga E, Garaicoa-Pazmino C, Fonseca M, Chappuis V, Gonzalez-Martin O, Avila-Ortiz G. Interproximal soft tissue height changes after unassisted socket healing versus alveolar ridge preservation therapy. Int J Periodontics Restorative Dent. 2023. doi:10. 11607/prd. 6809
- Couso-Queiruga E, Weber HA, Garaicoa-Pazmino C, et al. Influence of healing time on the outcomes of alveolar ridge preservation using a collagenated bovine bone xenograft: a randomized clinical trial. J Clin Periodontol. 2023;50:132-146.
- Pauwels R, Jacobs R, Singer SR, Mupparapu M. CBCT-based bone quality assessment: are Hounsfield units applicable? Dentomaxillofac Radiol. 2015;44:20140238.
- Couso-Queiruga E, Mansouri CJ, Alade AA, Allareddy TV, GalindoMoreno P, Avila-Ortiz G. Alveolar ridge preservation reduces the need for ancillary bone augmentation in the context of implant therapy. J Periodontol. 2022;93:847-856.
- Eghbali A, De Rouck T, De Bruyn H, Cosyn J. The gingival biotype assessed by experienced and inexperienced clinicians. J Clin Periodontol. 2009;36:958-963.
- De Rouck T, Eghbali R, Collys K, De Bruyn H, Cosyn J. The gingival biotype revisited: transparency of the periodontal probe through the gingival margin as a method to discriminate thin from thick gingiva. J Clin Periodontol. 2009;36:428-433.
- Kloukos D, Kalimeri E, Koukos G, Stähli A, Sculean A, Katsaros C. Gingival thickness threshold and probe visibility through soft tissue: a cross-sectional study. Clin Oral Investig. 2022;26:5155-5161.
- Bertl K, Al-Hotheiry M, Sun D, et al. Are colored periodontal probes reliable to classify the gingival phenotype in terms of gingival thickness? J Periodontol. 2022;93:412-422.
- Kloukos D, Koukos G, Doulis I, Sculean A, Stavropoulos A, Katsaros C. Gingival thickness assessment at the mandibular incisors with four methods: a cross-sectional study. J Periodontol. 2018;89:1300-1309.
- Tattan M, Sinjab K, Lee E, et al. Ultrasonography for chairside evaluation of periodontal structures: a pilot study. J Periodontol. 2020;91:890-899.
- Couso-Queiruga E, Raabe C, Belser UC, et al. Non-invasive assessment of peri-implant mucosal thickness: a cross-sectional study. J Periodontol. 2023;94:1315-1323.
- Kloukos D, Koukos G, Gkantidis N, Sculean A, Katsaros C, Stavropoulos A. Transgingival probing: a clinical gold standard for assessing gingival thickness. Quintessence Int. 2021;52:394-401.
- Alves PHM, Alves T, Pegoraro TA, Costa YM, Bonfante EA, de Almeida A. Measurement properties of gingival biotype evaluation methods. Clin Implant Dent Relat Res. 2018;20:280-284.
- Couso-Queiruga E, Tattan M, Ahmad U, Barwacz C, GonzalezMartin O, Avila-Ortiz G. Assessment of gingival thickness using digital file superimposition versus direct clinical measurements. Clin Oral Investig. 2021;25:2353-2361.
- Gkogkos A, Kloukos D, Koukos G, Liapis G, Sculean A, Katsaros C. Clinical and radiographic gingival thickness assessment at mandibular incisors: an ex vivo study. Oral Health Prev Dent. 2020;18:607-617.
- Saleh MHA, Couso-Queiruga E, Ravidà A, et al. Impact of the periodontal phenotype in premolar and molar sites on bone loss following full-thickness mucoperiosteal flap: a 1-year prospective clinical trial. J Periodontol. 2022;93:966-976.
- Nyquist H. Certain topics in telegraph transmission theory. Trans Am Inst Electr Eng. 1928;47:617-644.
- Shannon CE. Communication in the presence of noise. Proc IRE. 1949;37:10-21.
- Schulze R, Heil U, Gross D, et al. Artefacts in CBCT: a review. Dentomaxillofac Radiol. 2011;40:265-273.
- Birklein L, Niebler S, Schömer E, Brylka R, Schwanecke U, Schulze R. Motion correction for separate mandibular and cranial movements in cone beam CT reconstructions. Med Phys. 2023;50:3511-3525.
- Sun T, Kim JH, Fulton R, Nuyts J. An iterative projection-based motion estimation and compensation scheme for head x-ray CT. Med Phys. 2016;43:5705-5716.
- Spin-Neto R, Hauge Matzen L, Hermann L, Fuglsig J, Wenzel A. Head motion and perception of discomfort by young children during simulated CBCT examinations. Dentomaxillofac Radiol. 2021;50:20200445.
- Ozaki Y, Watanabe H, Nomura Y, Honda E, Sumi Y, Kurabayashi T. Location dependency of the spatial resolution of cone beam computed tomography for dental use. Oral Surg Oral Med Oral Pathol Oral Radiol. 2013;116:648-655.
- Feldkamp LA, Davis LC, Kress JW. Practical cone-beam algorithm. J Opt Soc Am A. 1984;1:612-619.
- IEC-standard. Evaluation and routine testing in medical imaging departments – Part 3-7: Acceptance and constancy tests – Imaging performance of X-ray equipment for dental cone beam computed tomography. 2022 61223-61223-61227.
- DIN 6868-15. Image Quality Assurance in X- Ray Departments – Part 15: RöV Constancy Testing of X-Ray Installations for Dental Radiographic Equipment for Digital Cone-Beam Computed Tomography. Deutsches Institut für Normung; 2015 6868-15.
- de Las Heras Gala H, Torresin A, Dasu A, et al. Quality control in cone-beam computed tomography (CBCT) EFOMP-ESTRO-IAEA protocol (summary report). Phys Med. 2017;39:67-72.
- Yang K, Kwan AL, Boone JM. Computer modeling of the spatial resolution properties of a dedicated breast CT system. Med Phys. 2007;34:2059-2069.
- Brüllmann D, Schulze RK. Spatial resolution in CBCT machines for dental/maxillofacial applications-what do we know today? Dentomaxillofac Radiol. 2015;44:20140204.
- European Commission. Directorate-General for Energy, Criteria for Acceptability of Medical Radiological Equipment Used in Diagnostic Radiology, Nuclear Medicine and Radiotherapy. Publications Office; 2012. doi:10.2768/22561
- Pauwels R, Nackaerts O, Bellaiche N, et al. Variability of dental cone beam CT grey values for density estimations. Br J Radiol. 2013;86:20120135.
- Domic D, Bertl K, Ahmad S, Schropp L, Hellén-Halme K, Stavropoulos A. Accuracy of cone-beam computed tomography is limited at implant sites with a thin buccal bone: a laboratory study. J Periodontol. 2021;92:592-601.
- Rußig LL, Schulze RK. Effects of minute misregistrations of prefabricated markers for image-guided dental implant surgery: an analytical evaluation. Clin Oral Implants Res. 2013;24:1339-1346.
- Ferry K, AlQallaf H, Blanchard S, Dutra V, Lin WS, Hamada Y. Evaluation of the accuracy of soft tissue thickness measurements with three different methodologies: an in vitro study. J Periodontol. 2022;93:1468-1475.
- Todorovic VS, Postma TC, Hoffman J, van Zyl AW. Buccal and palatal alveolar bone dimensions in the anterior maxilla: a micro-CT study. Clin Implant Dent Relat Res. 2023;25:261-270.
- Patcas R, Müller L, Ullrich O, Peltomäki T. Accuracy of conebeam computed tomography at different resolutions assessed on the bony covering of the mandibular anterior teeth. Am J Orthod Dentofacial Orthop. 2012;141:41-50.
- Januário AL, Barriviera M, Duarte WR. Soft tissue cone-beam computed tomography: a novel method for the measurement of gingival
tissue and the dimensions of the dentogingival unit. J Esthet Restor Dent. 2008;20:366-373. discussion 374. - Kloukos D, Kakali L, Koukos G, Sculean A, Stavropoulos A, Katsaros C. Gingival thickness assessment at mandibular incisors of orthodontic patients with ultrasound and cone-beam CT. A crosssectional study. Oral Health Prev Dent. 2021;19:263-270.
- Dritsas K, Halazonetis D, Ghamri M, Sculean A, Katsaros C, Gkantidis N. Accurate gingival recession quantification using 3D digital dental models. Clin Oral Investig. 2023;27:1697-1705.
- Khorshed A, Vilarrasa J, Monje A, Nart J, Blasi G. Digital evaluation of facial peri-implant mucosal thickness and its impact on dental implant aesthetics. Clin Oral Investig. 2023;27:581-590.
- Nascimento M, Boscolo SMA, Haiter-Neto F, et al. Influence of basis images and skull position on evaluation of cortical bone thickness in cone beam computed tomography. Oral Surg Oral Med Oral Pathol Oral Radiol. 2017;123(6):707-713. doi:10.1016/j.oooo.2017.01.015
- de Kinkelder R, Kalkman J, Faber DJ, et al. Heartbeat-induced axial motion artifacts in optical coherence tomography measurements of the retina. Invest Ophthalmol Vis Sci. 2011;52:3908-3913.
- Fan S, Sáenz-Ravello G, Al-Nawas B, Schiegnitz E, Diaz L, Sagheb K. The feasibility of ultrasonography for the measurement of
periodontal and peri-implant phenotype: a systematic review and meta-analysis. Clin Implant Dent Relat Res. 2023;25:892-909. - Wang J, Cha S, Zhao Q, Bai D. Methods to assess tooth gingival thickness and diagnose gingival phenotypes: a systematic review. J Esthet Restor Dent. 2022;34:620-632.
- Ludlow JB, Timothy R, Walker C, et al. Effective dose of dental CBCT-a meta analysis of published data and additional data for nine CBCT units. Dentomaxillofac Radiol. 2015;44:20140197.
- ICRP. The 2007 recommendations of the international commission on radiological protection. ICRP publication 103. Ann ICRP. 2007;37:2-4.
- This is an open access article under the terms of the Creative Commons Attribution License, which permits use, distribution and reproduction in any medium, provided the original work is properly cited.
© 2024 The Authors. Periodontology 2000 published by John Wiley & Sons Ltd.
