DOI: https://doi.org/10.1038/s41467-024-44995-9
PMID: https://pubmed.ncbi.nlm.nih.gov/38245517
تاريخ النشر: 2024-01-20
روبوت ناعم متعدد الطبقات مغناطيسي للالتصاق المستهدف عند الطلب
تم القبول: 4 يناير 2024
نُشر على الإنترنت: 20 يناير 2024
(ط) تحقق من التحديثات
الملخص
أظهرت الروبوتات اللينة المغناطيسية إمكانيات كبيرة للتطبيقات الطبية الحيوية بفضل قدرتها العالية على إعادة تشكيل الشكل، ومرونة الحركة، وتعدد الوظائف في البيئات الفسيولوجية. يمكن أن تعزز الروبوتات اللينة المغناطيسية ذات الهياكل متعددة الطبقات سعة التحميل وتعقيد الوظائف للتوصيل المستهدف. ومع ذلك، لم يتم التحقيق بشكل كامل في التفاعلات بين الكيانات اللينة، وبالتالي فإن تجميع الروبوتات اللينة المغناطيسية مع أوضاع حركة حسب الطلب من طبقات متعددة تشبه الأفلام لا يزال يمثل تحديًا. هنا، نقوم بنمذجة وتخصيص التفاعل المغناطيسي بين طبقات الأفلام اللينة ذات الهياكل المختلفة في المستوى، ثم نحقق روبوتات لينة متعددة الطبقات قادرة على أداء حركات مرنة والتصاق مستهدف. تتكون كل طبقة من الروبوت من ركيزة مغناطيسية لينة وفيلم لاصق. يتم توصيف الخصائص الميكانيكية وأداء الالتصاق للأفلام اللاصقة بشكل منهجي. الروبوت قادر على أداء وضعين للحركة، وهما الحركة الانتقالية وحركة التدوير، وكذلك الفصل حسب الطلب مع التصاق طبقة واحدة بالأنسجة. يتم تقديم نتائج المحاكاة، التي تتوافق نوعيًا بشكل جيد مع النتائج التجريبية. تم التحقق من جدوى استخدام الروبوت لأداء التصاق متعدد الأهداف في المعدة في كل من التجارب خارج الجسم وفي الجسم.
وتغطية سطح الروبوتات، مثل المسامير الدقيقة
روابط الهيدروجين. يتم تحديد أداء الالتصاق للفيلم اللاصق على الأنسجة المعدية الخنزيرية خارج الجسم. يتم استكشاف وضعين للحركة للروبوت على الأنسجة المعدية ونظهر الفصل عند الطلب بين الروبوت والطبقة الجانبية الملتصقة من خلال تطبيق عزم مغناطيسي كافٍ. يتم التحقق من جدوى استخدام روبوتات لينة متعددة الطبقات مغناطيسية للالتصاق المستهدف عند الطلب في بيئة غير منظمة في كل من الأنسجة المعدية خارج الجسم والمعدة المملوءة بالسوائل. كما تم إجراء تجارب داخل الجسم للالتصاق متعدد الأهداف للتحقق من الاستراتيجية المقترحة. يقدم هذا العمل تصميمًا فعالًا لروبوتات لينة متعددة الطبقات مغناطيسية، مما يمهد الطريق لفرص سريرية واعدة، خاصة للعمليات في الجهاز الهضمي.
النتائج
تصميم روبوت ناعم متعدد الطبقات مغناطيسي
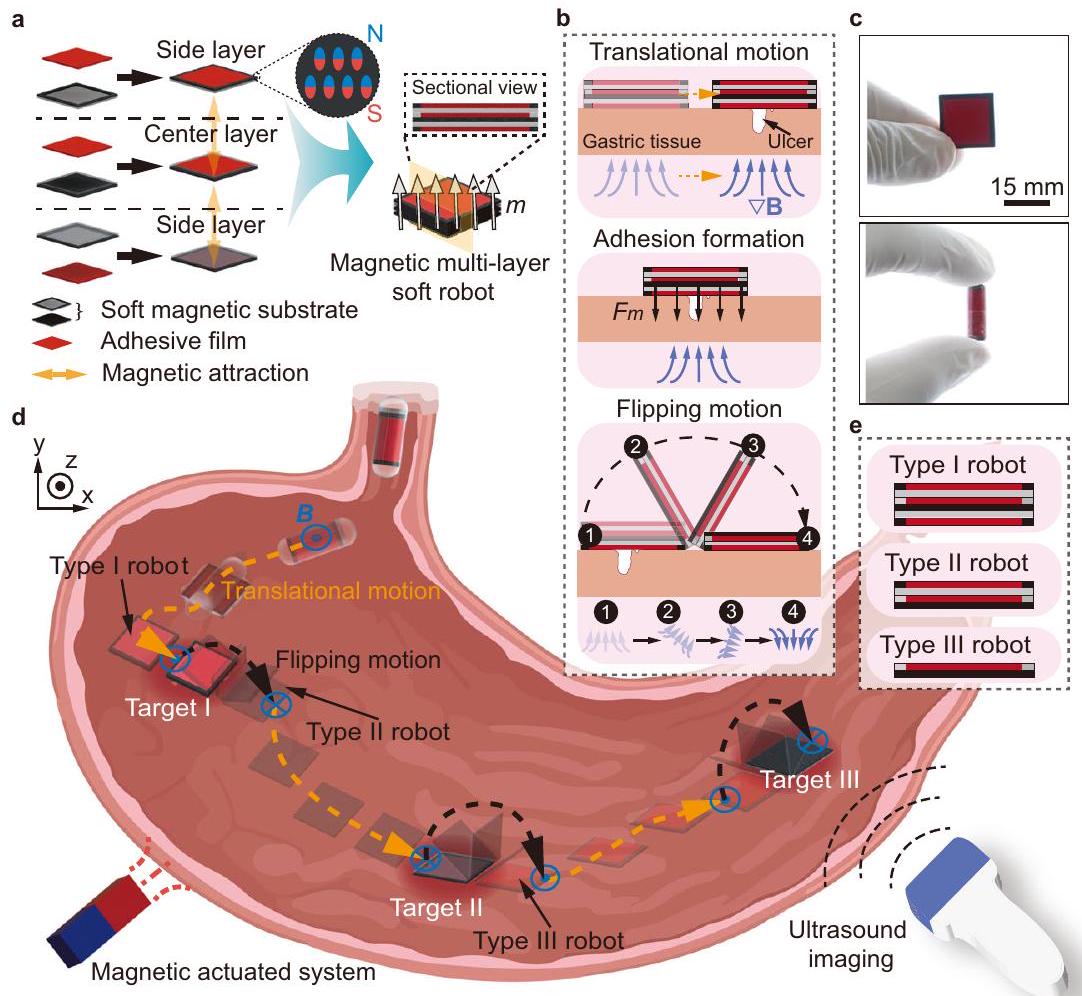
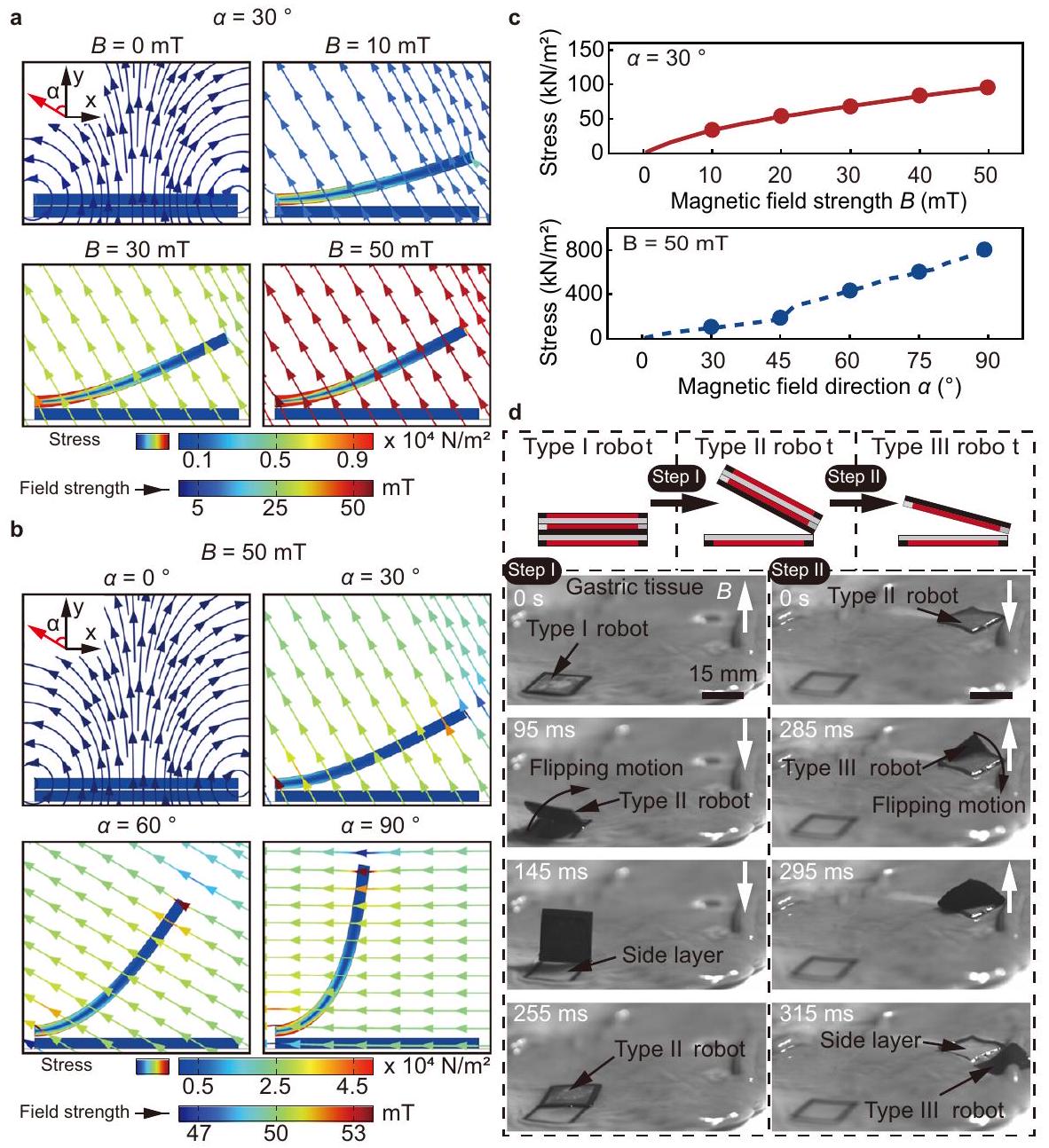
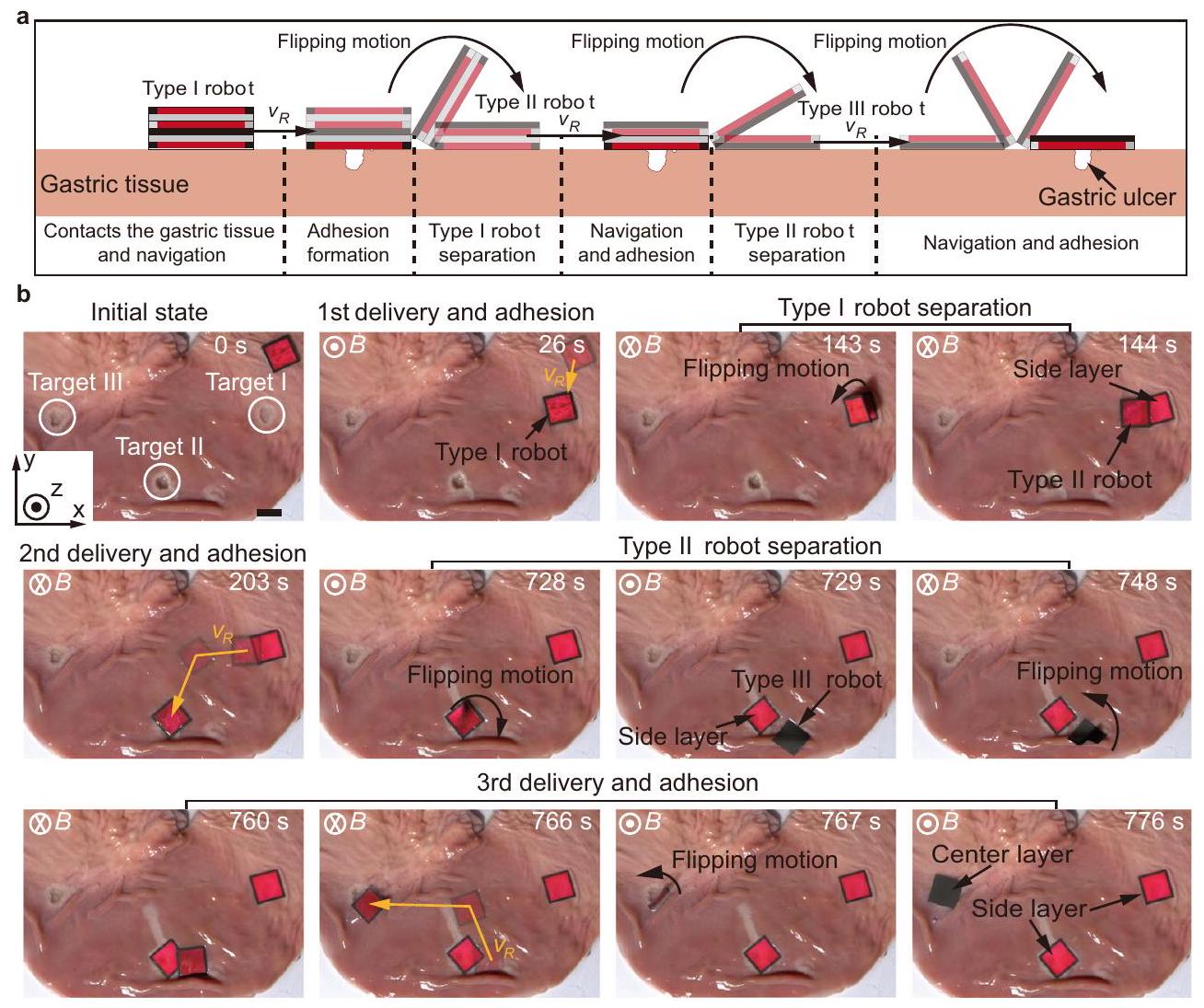
يصل الروبوت إلى الهدف لتسريع تشكيل الالتصاق، وهو أيضًا هدف. علاوة على ذلك، فإن التفاعل المغناطيسي الذي يتم تحفيزه بين الأجزاء المغناطيسية للطبقة الجانبية والطبقة المركزية، أي الإطار المغناطيسي والقاعدة المغناطيسية، أضعف من التفاعل اللاصق الذي يتشكل بين الطبقة الجانبية والأنسجة، مما يسهل الفصل بين طبقات الروبوت. بالإضافة إلى مبادئ التصميم المذكورة أعلاه، تم اقتراح استراتيجية للاصطدام والفصل، كما هو موضح في الشكل 1ب. يقترب الروبوت من القرحة المستهدفة على نسيج المعدة من خلال أداء حركة انتقالية، ثم يلتصق الفيلم اللاصق للطبقة الجانبية بنسيج المعدة عن طريق تطبيق قوة تدرج مغناطيسي.
الخصائص الميكانيكية لفيلم اللصق
أداء الالتصاق
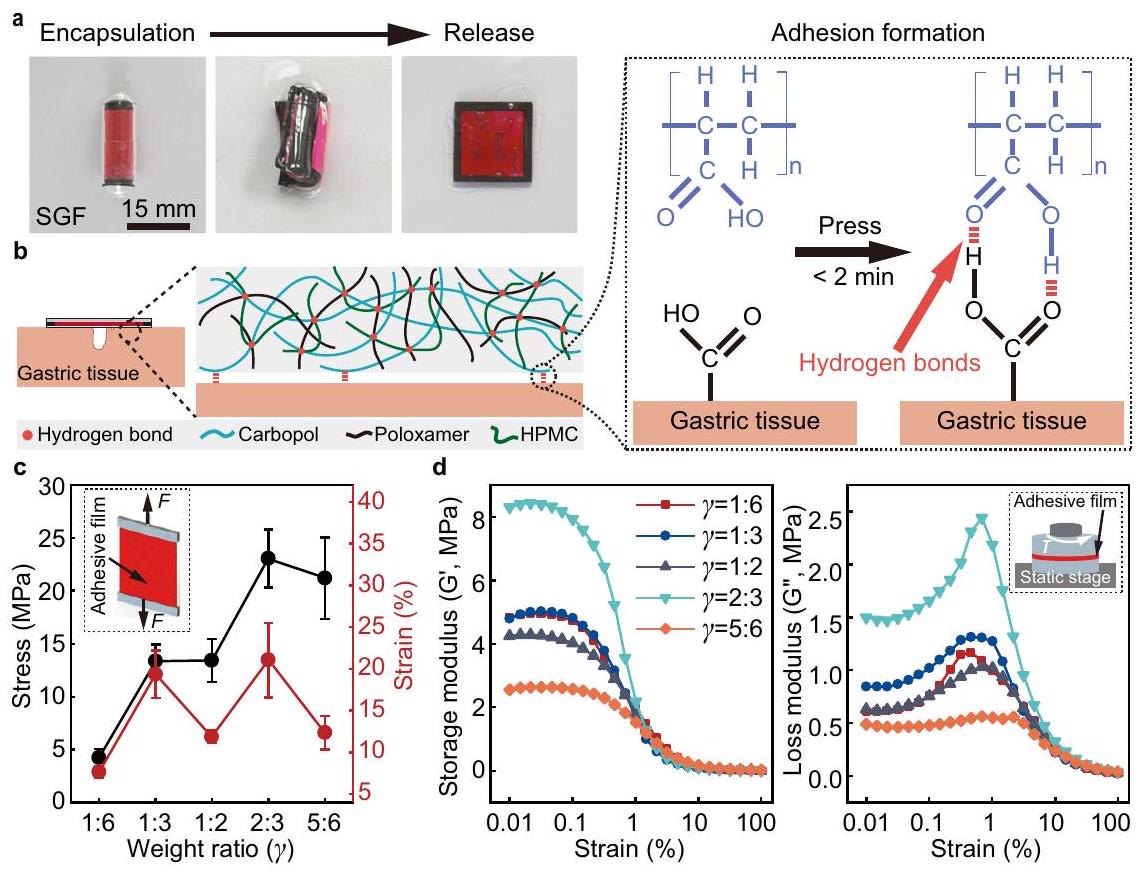
تم الحصول على القضبان من 3 تجارب في كل حالة. د تغيير معامل التخزين ومعامل الفقد للأفلام اللاصقة مع الإجهاد. تم إعداد الأفلام بخمسة نسب وزن مختلفة بين خليط الكاربوبول وHPMC-بولوكسايمر. في جميع الأفلام اللاصقة، يتم إعداد خليط HPMC-بولوكسايمر بنسبة وزن من
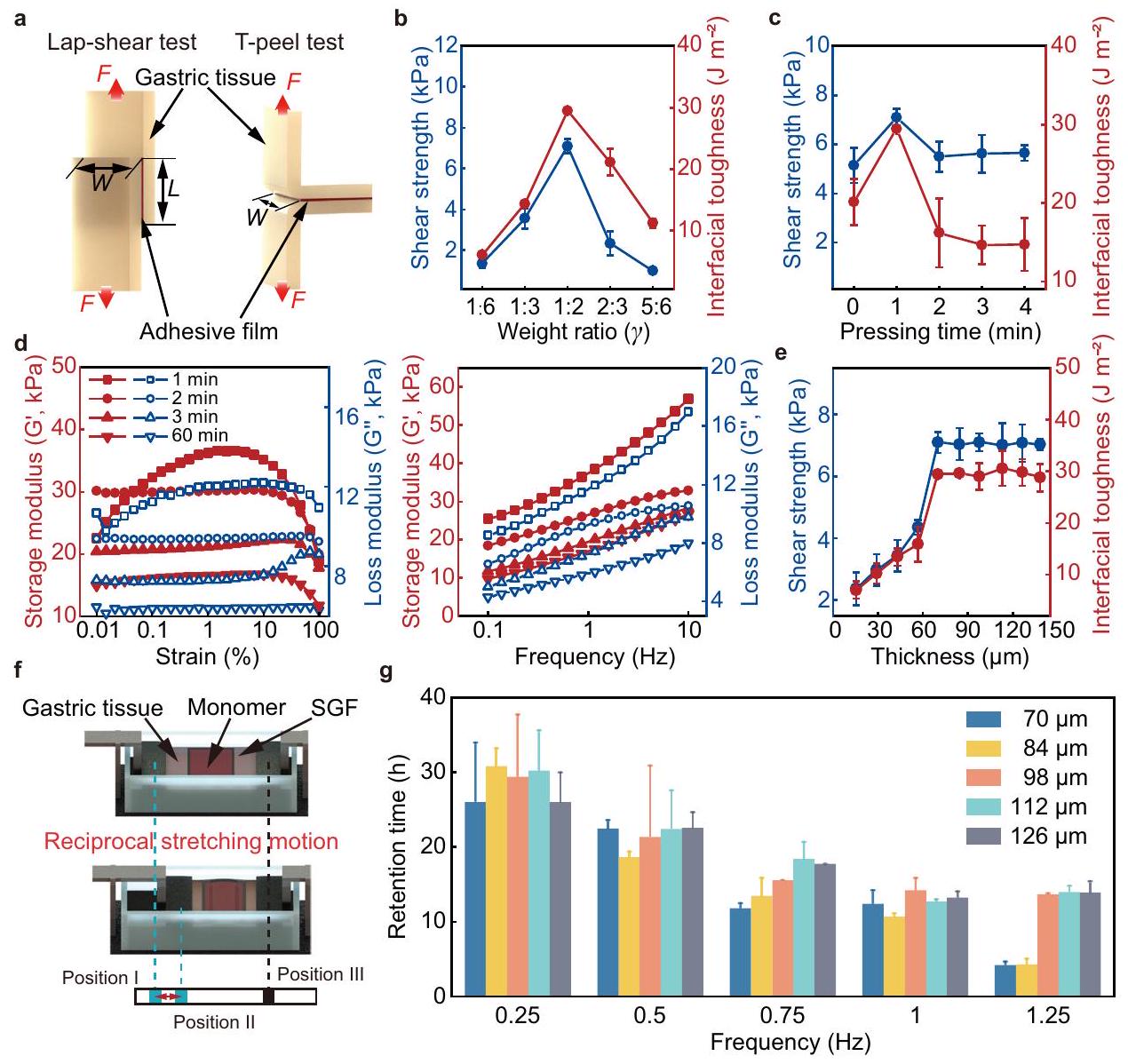
تم تقديم قوة القص المختبرة والصلابة الواجهة في الشكل 3ب، مما يشير إلى قوة الالتصاق للأفلام اللاصقة المعدة بنسب وزن مختلفة. في الاختبارات، يتم وضع فيلم لاصق بين نسيجين معديين مع تحميل قدره 1 كيلو باسكال.
المودول
، ويتم غمرها في SGF. يتم استخدام المشابك لتثبيت كلا طرفي نسيج المعدة، ويتم تحريك جانب واحد من النسيج لتمديده بشكل عكسي بين الموضع I والموضع II. يتم تثبيت المشبك الأيمن في الموضع III. تم إعداد خمس مجموعات من المونومرات، ويتم تقييم وقت الاحتفاظ تحت تردد الحركة من 0.25 هرتز إلى 1.25 هرتز. يتجاوز تردد الحركة العكسي 0.25 هرتز تردد الحركة الدودية للمعدة البشرية، أي، حوالي
التشغيل المغناطيسي للروبوت
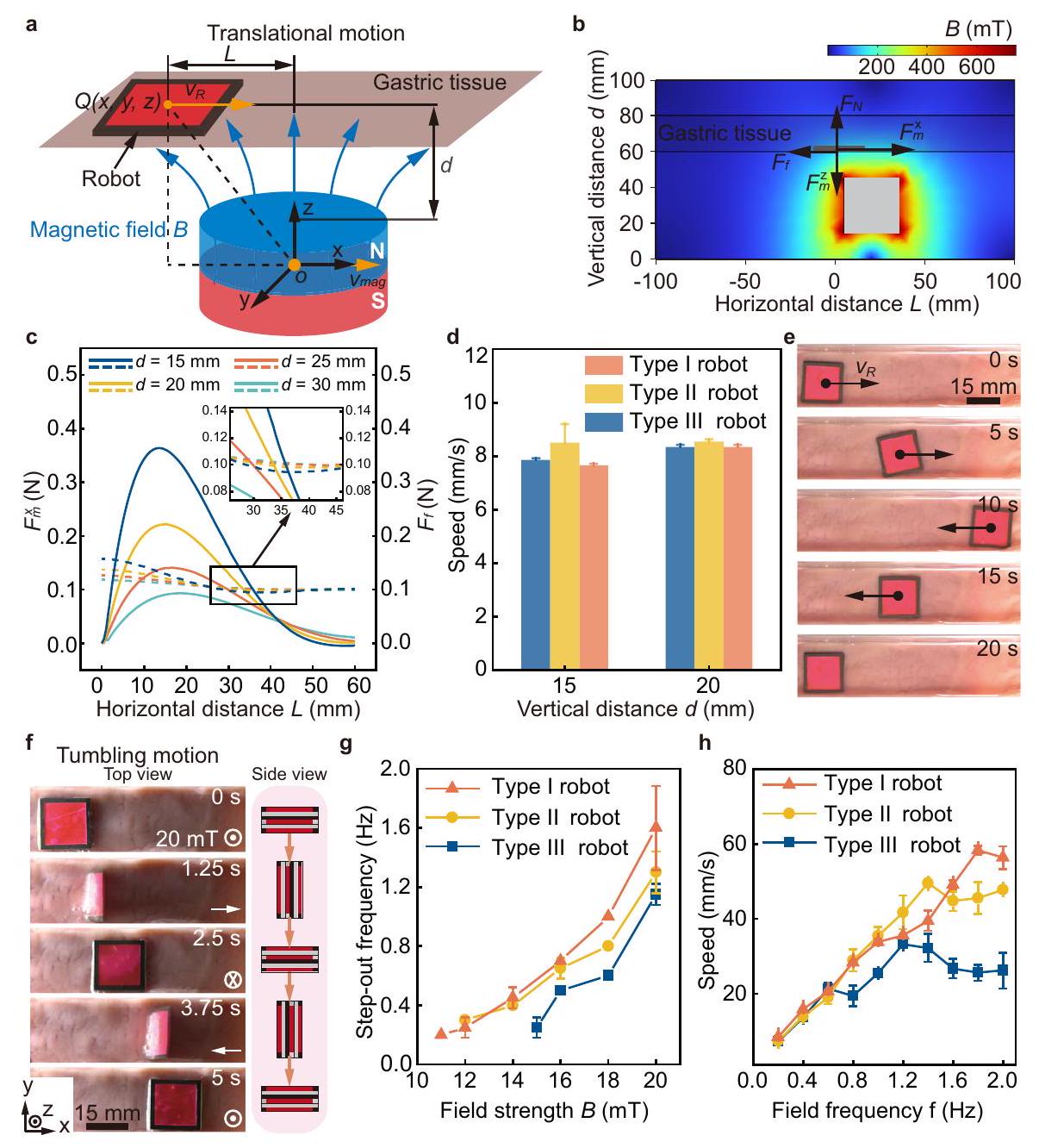
بالنسبة للروبوت، يتم نمذجة ومحاكاة القوة الخارجية المتراكمة المؤثرة على الروبوت (روبوت من النوع الأول) في الاتجاه الأفقي (الشكل 4c). عند
الفصل عند الطلب بواسطة حركة التدوير
الاتجاه موجود في الشكل 5c، مما يظهر أن الإجهاد يزداد مع قوة المجال واتجاه المجال. العلاقة بين قوى الطبقة-الطبقة، والعزم، واتجاه المجال المغناطيسي أثناء الفصل موجودة في الشكل التكميلية 7c، مما يظهر أن القوة الأفقية تزداد مع اتجاه المجال، بينما القوة الرأسية والعزم المغناطيسي يتناقصان تدريجياً.
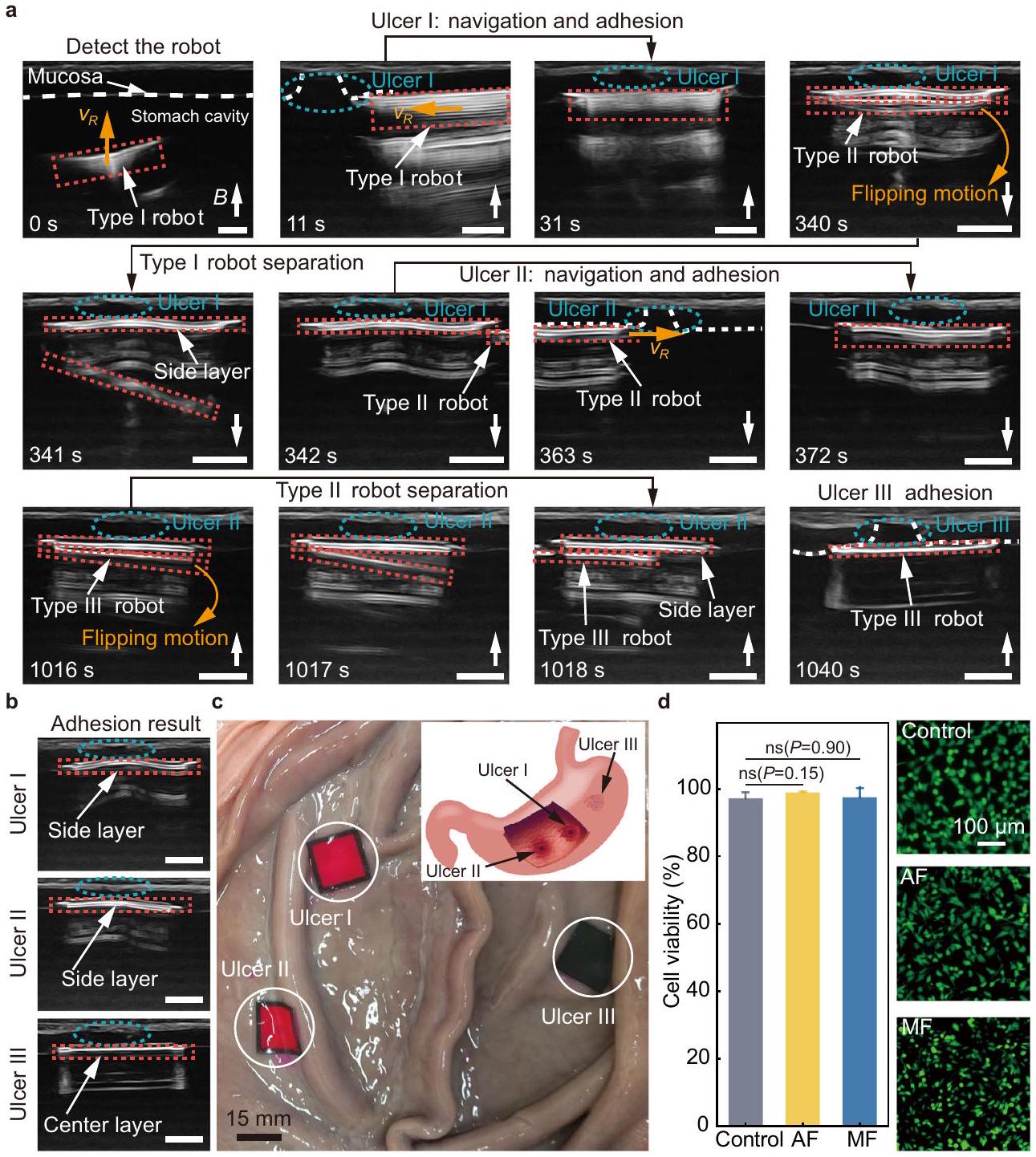
التصاق متعدد الأهداف لقرحات المعدة خارج الجسم
تظهر التجربة في الشكل التكميلي 12 (الطرق). في صور الموجات فوق الصوتية، يضر القرحة (الإهليلج الأزرق المتقطع، الشكل 7أ) و تكسر الغشاء المخاطي للمعدة (الخط الأبيض المتقطع في الشكل 7أ،
بين طيات اثنتين. تُظهر المخططات المرفقة في الشكل 7c المواقع الأولية للقرحات في معدة الخنزير.
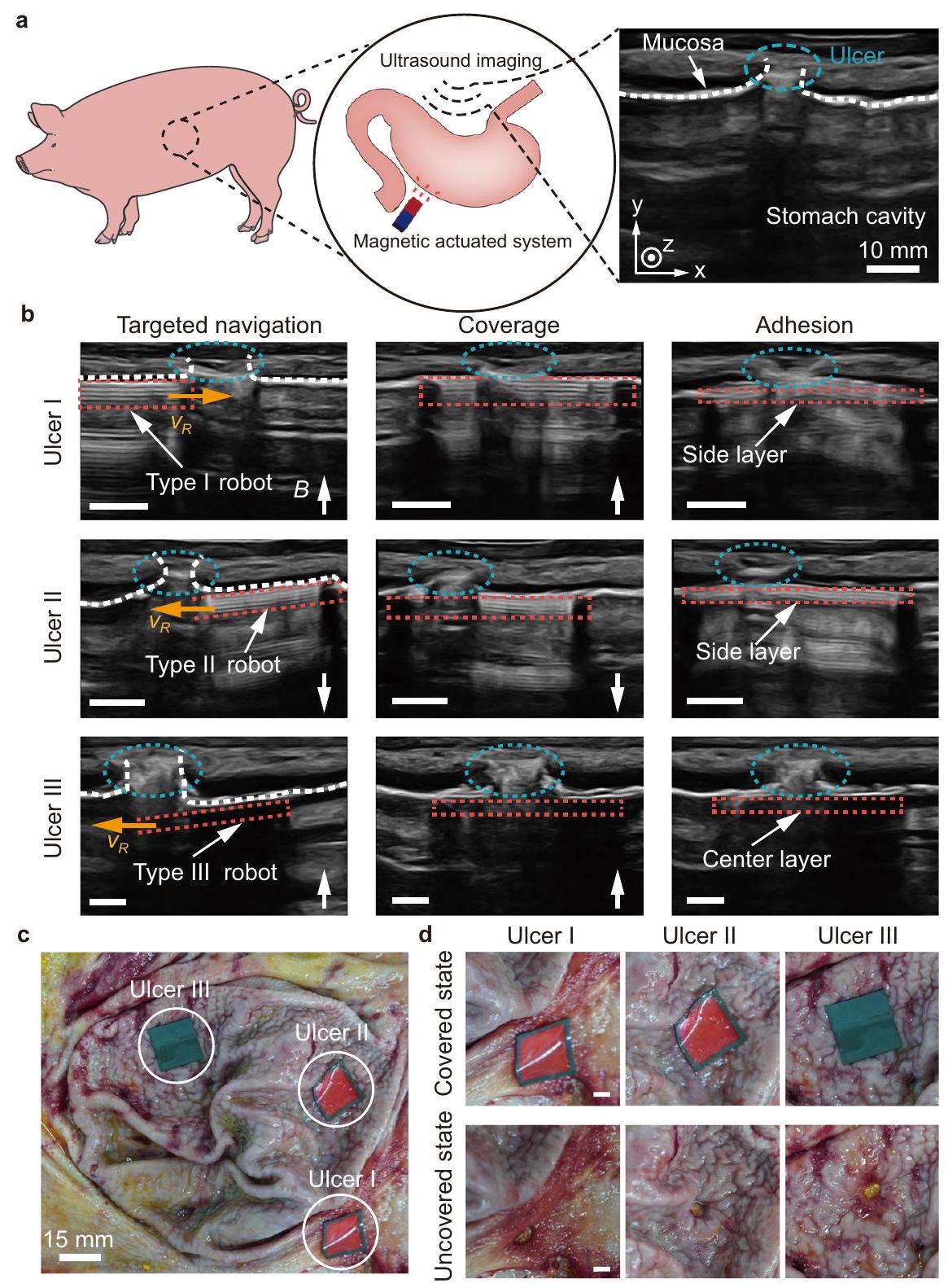
الالتصاق متعدد الأهداف في معدة خنزير حية
المناقشة
الاتجاه العمودي على مستواها، مما يوفر جاذبية مغناطيسية بين الطبقات. بمجرد أن تلتصق الطبقة الجانبية بالأنسجة الرطبة، يمكن استخدام العزم المغناطيسي لقلب الروبوت وفصله عن الطبقة الجانبية الملتصقة. من خلال الاستفادة من استراتيجية الالتصاق والفصل عند الطلب، نتحقق من تنفيذ الروبوت للالتصاق متعدد الأهداف في البيئات خارج الجسم وداخل الجسم، مما يظهر إمكانيته في علاج القرح المعدية. باختصار، من خلال دمج المواد الوظيفية في الروبوتات اللينة، يمكن توفير المزيد من الإمكانيات لتوسيع التطبيقات.
الطرق
المواد
من MACKLIN (شنغهاي، الصين). جميع المواد الكيميائية الأخرى من درجة كاشف نقية إضافية وتستخدم كما هي.
تصنيع الروبوت الناعم متعدد الطبقات المغناطيسي
بعد معالجة البلازما (الشكل التكميلي 1 أ، ب). يتم برمجة الطبقات بنفس اتجاه المغنطة العمودية على مستواها تحت مجال مغناطيسي نبضي (الشكل التكميلي 1 ج). أخيرًا، يتم تجميع الروبوت تحت جذب مغناطيسي بين الطبقات. يتم عرض معلومات مفصلة عن الروبوتات في الجدول التكميلي S2.
اختبارات ميكانيكية
(معامل التخزين،
اختبارات الالتصاق في المختبر
وتم اختبارها بواسطة اختبار القص اللاب القياسي (ASTM F2255) باستخدام آلة اختبار ميكانيكية (خلايا تحميل 0.1 كيلو نيوتن). يتم تحديد قوة القص عن طريق قسمة القوة القصوى على مساحة الالتصاق.
اختبار التوافق الحيوي في المختبر
تصوير بالموجات فوق الصوتية للاختبارات خارج الجسم وفي الجسم
إجراءات التجارب خارج الجسم وفي الجسم
تحضير معدة الخنزير للاختبارات خارج الجسم
اختبارات في الجسم في خنزير
المجال المغناطيسي للسماح للروبوت بتشكيل الالتصاق مع النسيج والانفصال عن الطبقة الجانبية. يتم فحص نتيجة الالتصاق النهائية باستخدام التصوير بالموجات فوق الصوتية. تحت التخدير العميق، يتم بعد ذلك قتل الحيوان عن طريق حقن كلوريد البوتاسيوم في الوريد، ويتم تشريح المعدة لملاحظة نتيجة الالتصاق النهائية. بالنسبة للاختبارات في الجسم، تكون أبعاد الروبوت (الروبوت من النوع الأول) هي
محاكاة
التحليل الإحصائي
ملخص التقرير
توفر البيانات
References
- Soon, R. H. et al. On-demand anchoring of wireless soft miniature robots on soft surfaces. Proc. Natl. Acad. Sci. 119, e2207767119 (2022).
- Ren, Z. et al. Soft-bodied adaptive multimodal locomotion strategies in fluid-filled confined spaces. Sci. Adv. 7, eabh2022 (2021).
- Gu, H. et al. Self-folding soft-robotic chains with reconfigurable shapes and functionalities. Nat. Commun. 14, 1263 (2023).
- Zheng, Z. et al. lonic shape-morphing microrobotic end-effectors for environmentally adaptive targeting, releasing, and sampling. Nat. Commun. 12, 411 (2021).
- Xu, T., Huang, C., Lai, Z. & Wu, X. Independent control strategy of multiple magnetic flexible millirobots for position control and path following. IEEE Trans. Robot. 38, 2875-2887 (2022).
- Ebrahimi, N. et al. Magnetic actuation methods in bio/soft robotics. Adv. Funct. Mater. 31, 2005137 (2021).
- Zhang, J. et al. Voxelated three-dimensional miniature magnetic soft machines via multimaterial heterogeneous assembly. Sci. Robot. 6, eabf0112 (2021).
- Deng, H. et al. Laser reprogramming magnetic anisotropy in soft composites for reconfigurable 3D shaping. Nat. Commun. 11, 6325 (2020).
- Gu, H., Boehler, Q., Ahmed, D. & Nelson, B. J. Magnetic quadrupole assemblies with arbitrary shapes and magnetizations. Sci. Robot. 4, eaax8977 (2019).
- Xu, T., Zhang, J., Salehizadeh, M., Onaizah, O. & Diller, E. Millimeterscale flexible robots with programmable three-dimensional magnetization and motions. Sci. Robot. 4, eaav4494 (2019).
- Richter, M. et al. Magnetic soft helical manipulators with local dipole interactions for flexibility and forces. Soft Robot. 10, 647-659 (2023).
- Hu, W., Lum, G. Z., Mastrangeli, M. & Sitti, M. Small-scale softbodied robot with multimodal locomotion. Nature 554, 81-85 (2018).
- Won, S., Kim, S., Park, J. E., Jeon, J. & Wie, J. J. On-demand orbital maneuver of multiple soft robots via hierarchical magnetomotility. Nat. Commun. 10, 4751 (2019).
- Li, W. et al. Self-vectoring electromagnetic soft robots with high operational dimensionality. Nat. Commun. 14, 182 (2023).
- Lu, H. et al. A bioinspired multilegged soft millirobot that functions in both dry and wet conditions. Nat. Commun. 9, 3944 (2018).
- Huang, H.-W. et al. Adaptive locomotion of artificial microswimmers. Sci. Adv. 5, eaau1532 (2019).
- Wang, Y. et al. Amphibious miniature soft jumping robot with ondemand in-flight maneuver. Adv. Sci. 10, 2207493 (2023).
- Wu, Y., Dong, X., Kim, J., Wang, C. & Sitti, M. Wireless soft millirobots for climbing three-dimensional surfaces in confined spaces. Sci. Adv. 8, eabn3431 (2022).
- Wang, C., Wu, Y., Dong, X., Armacki, M. & Sitti, M. In situ sensing physiological properties of biological tissues using wireless miniature soft robots. Sci. Adv. 9, eadg3988 (2023).
- Wang, C., Mzyk, A., Schirhagl, R., Misra, S. & Venkiteswaran, V. K. Biocompatible film-coating of magnetic soft robots for mucoadhesive locomotion. Adv. Mater. Technol. 8, 2201813 (2023).
- Zhou, C. et al. Ferromagnetic soft catheter robots for minimally invasive bioprinting. Nat. Commun. 12, 5072 (2021).
- Yang, Y. et al. Magnetic soft robotic bladder for assisted urination. Sci. Adv. 8, eabq1456 (2022).
- Kim, Y. et al. Telerobotic neurovascular interventions with magnetic manipulation. Sci. Robot. 7, eabg9907 (2022).
- Son, D., Gilbert, H. & Sitti, M. Magnetically actuated soft capsule endoscope for fine-needle biopsy. Soft Robot. 7, 10-21 (2020).
- Zong, Z., Zhang, S. & Wu, Z. Anisotropic contraction in a magnetically hard but mechanically ultra-soft foam for precise drug delivery. Adv. Mater. Technol. 8, 2201255 (2023).
- Zhang, H. et al. Dual-responsive biohybrid neutrobots for active target delivery. Sci. Robot. 6, eaaz9519 (2021).
- Dong, X. et al. Bioinspired cilia arrays with programmable nonreciprocal motion and metachronal coordination. Sci. Adv. 6, eabc9323 (2020).
- Lee, J., Kim, D., Bang, S. & Park, S. Drug-loaded mucoadhesive patch with active delivery and controlled releasing ability. Adv. Intell. Syst. 4, 2100203 (2022).
- Zheng, Z. et al. Programmable aniso-electrodeposited modular hydrogel microrobots. Sci. Adv. 8, eade6135 (2022).
- Ze, Q. et al. Spinning-enabled wireless amphibious origami millirobot. Nat. Commun. 13, 3118 (2022).
- Mair, L. O. et al. Soft capsule magnetic millirobots for regionspecific drug delivery in the central nervous system. Front. Robot. Al 8, 702566 (2021).
- Yang, X. et al. An agglutinate magnetic spray transforms inanimate objects into millirobots for biomedical applications. Sci. Robot. 5, eabc8191 (2020).
- Dong, Y. et al. Untethered small-scale magnetic soft robot with programmable magnetization and integrated multifunctional modules. Sci. Adv. 8, eabn8932 (2022).
- Wang, T. et al. Adaptive wireless millirobotic locomotion into distal vasculature. Nat. Commun. 13, 4465 (2022).
- Ze, Q. et al. Soft robotic origami crawler. Sci. Adv. 8, eabm7834 (2022).
- Cheng, Z. et al. Fabrication of ulcer-adhesive oral keratin hydrogel for gastric ulcer healing in a rat. Regen. Biomater. 8, rbab008 (2021).
- Brătucu, M. N. et al. Unusual complicated gastric ulcers. Medicina 57, 1345 (2021).
- Chu, J.N., Traverso, G. Foundations of gastrointestinal-based drug delivery and future developments. Nat. Rev. Gastroenterol. Hepatol. 19, 219-238 (2022).
- Anthis, A. H. C. et al. Modular stimuli-responsive hydrogel sealants for early gastrointestinal leak detection and containment. Nat. Commun. 13, 1-15 (2022).
- Wu, S. J., Yuk, H., Wu, J., Nabzdyk, C. S. & Zhao, X. A multifunctional origami patch for minimally invasive tissue sealing. Adv. Mater. 33, 2007667 (2021).
- Wu, J. et al. An off-the-shelf bioadhesive patch for sutureless repair of gastrointestinal defects. Sci. Transl. Med. 14, eabh2857 (2022).
- Xu, X. et al. Bioadhesive hydrogels demonstrating pH-independent and ultrafast gelation promote gastric ulcer healing in pigs. Sci. Transl. Med. 12, eaba8014 (2020).
- Chen, X. et al. Hydrogel bioadhesives with extreme acid-tolerance for gastric perforation repairing. Adv. Funct. Mater. 32, 2202285 (2022).
- Wang, H. et al. An integrally formed janus hydrogel for robust wettissue adhesive and anti-postoperative adhesion. Adv. Mater. 35, 2300394 (2023).
- Chun, M.-K., Bhusal, P. & Choi, H.-K. Application of Carbopol/PVP interpolymer complex to prepare mucoadhesive floating granule. Arch. Pharm. Res. 36, 745-751 (2013).
- Li, T., Bao, Q., Shen, J., Lalla, R. V. & Burgess, D. J. Mucoadhesive in situ forming gel for oral mucositis pain control. Int. J. Pharm. 580, 119238 (2020).
- Patel, M. M. et al. Mucin/Poly(acrylic acid) Interactions: a spectroscopic investigation of mucoadhesion. Biomacromolecules 4, 1184-1190 (2003).
- Deng, T. et al. A natural biological adhesive from snail mucus for wound repair. Nat. Commun. 14, 396 (2023).
- Yuk, H. et al. Dry double-sided tape for adhesion of wet tissues and devices. Nature 575, 169-174 (2019).
- Schulze, K. Imaging and modelling of digestion in the stomach and the duodenum. Neurogastroenterol. Motil. 18, 172-183 (2006).
- Marciani, L. et al. Assessment of antral grinding of a model solid meal with echo-planar imaging. Am. J. Physiol. -Gastrointest. Liver Physiol. 280, G844-G849 (2001).
- Debi, U. et al. Role of barium study in various gastric malignancies. Trop. Gastroenterol. 10, 246-255 (2019).
شكر وتقدير
مساهمات المؤلفين
المصالح المتنافسة
معلومات إضافية
http://www.nature.com/reprints
ملاحظة الناشر: تظل شركة سبرينجر ناتشر محايدة فيما يتعلق بالمطالبات القضائية في الخرائط المنشورة والانتماءات المؤسسية.
© المؤلف(ون) 2024
كلية هندسة الميكاترونيك والأتمتة، جامعة شنغهاي، شنغهاي 200444، الصين. كلية العلوم والهندسة، جامعة الصين في هونغ كونغ، شنتشن 518172، الصين. معهد شنتشن للذكاء الاصطناعي والروبوتات من أجل المجتمع، شنتشن 518172، الصين. قسم الهندسة الميكانيكية والصناعية، جامعة تورونتو، تورونتو، أونتاريو M5S 3G8، كندا. كلية هندسة الحاسوب والعلوم، جامعة شنغهاي، شنغهاي 200444، الصين. قسم الأشعة التداخلية، مستشفى جيش التحرير الشعبي الصيني العام، بكين 100853، الصين. كلية الطب، جامعة الصين في هونغ كونغ، شنتشن 518172، الصين. ساهم هؤلاء المؤلفون بالتساوي: زيهينغ تشين، ييبين وانغ. - البريد الإلكتروني: liuna_sia@shu.edu.cn; yujiangfan@cuhk.edu.cn
DOI: https://doi.org/10.1038/s41467-024-44995-9
PMID: https://pubmed.ncbi.nlm.nih.gov/38245517
Publication Date: 2024-01-20
A magnetic multi-layer soft robot for on-demand targeted adhesion
Accepted: 4 January 2024
Published online: 20 January 2024
(i) Check for updates
Abstract
Magnetic soft robots have shown great potential for biomedical applications due to their high shape reconfigurability, motion agility, and multifunctionality in physiological environments. Magnetic soft robots with multilayer structures can enhance the loading capacity and function complexity for targeted delivery. However, the interactions between soft entities have yet to be fully investigated, and thus the assembly of magnetic soft robots with ondemand motion modes from multiple film-like layers is still challenging. Herein, we model and tailor the magnetic interaction between soft film-like layers with distinct in-plane structures, and then realize multi-layer soft robots that are capable of performing agile motions and targeted adhesion. Each layer of the robot consists of a soft magnetic substrate and an adhesive film. The mechanical properties and adhesion performance of the adhesive films are systematically characterized. The robot is capable of performing two locomotion modes, i.e., translational motion and tumbling motion, and also the ondemand separation with one side layer adhered to tissues. Simulation results are presented, which have a good qualitative agreement with the experimental results. The feasibility of using the robot to perform multi-target adhesion in a stomach is validated in both ex-vivo and in-vivo experiments.
and surface coating of the robots, such as microspikes
hydrogen bonds. The adhesion performance of the adhesive film on ex-vivo porcine gastric tissues are characterized. Two locomotion modes of the robot on gastric tissues are explored and we demonstrate the on-demand separation between the robot and the adhered side layer through applying sufficient magnetic torque. The feasibility of using a magnetic multi-layer soft robot for on-demand targeted adhesion in an unstructured environment is validated in both ex-vivo gastric tissue and the stomach filled with fluid. The in-vivo trials of multi-target adhesion are also performed to validate the proposed strategy. This work presents an effective design of magnetic multilayer soft robots, paving the way for promising clinical opportunities, specially for the operations in GI tract.
Results
Design of a magnetic multi-layer soft robot

the robot reaches the target to accelerate the formation of adhesion is also a purpose. Furthermore, the magnetic interaction induced between the magnetic parts of the side layer and the center layer, i.e., the magnetic frame and the magnetic base, is weaker than the adhesive interaction formed between the side layer and the tissue, which facilitates the separation between layers of the robot. Besides the above design principles, an adhesion and separation strategy is proposed, as shown in Fig. 1b. The robot approaches the targeted ulcer on a gastric tissue through performing translational motion, and the adhesive film of the side layer then adheres to the gastric tissue by applying magnetic gradient force
Mechanical properties of the adhesive film
Adhesion performance

bars are obtained from 3 trials in each condition. d The change of storage modulus and loss modulus of the adhesive films with strain. The films are prepared with five different weight ratios between Carbopol and HPMC-Poloxamer mixture. In all adhesive films, the HPMC-Poloxamer mixture is prepared with a weight ratio of

tested shear strength and interfacial toughness are presented in Fig. 3b, indicating the adhesion strength of the adhesive films prepared with different weight ratios. In the tests, an adhesive film is placed between two gastric tissues with 1 kPa loaded
modulus
tissue, and they are submerged in SGF. Clamps are used to fix both ends of the gastric tissue, and one side of the tissue is actuated to reciprocally stretch between position I and position II. The right clamp is fixed at position III. Five groups of monomers are prepared, and the retention time is evaluated under the motion frequency from 0.25 Hz to 1.25 Hz . The reciprocal motion frequency of 0.25 Hz exceeds the gastric peristalsis frequency of the human stomach, i.e., approximately
Magnetic actuation of the robot

of the robot, the superposed external force exerted on the robot (Type I robot) along the horizontal direction is modeled and simulated (Fig. 4c). At
On-demand separation by flipping motion
direction is present in Fig. 5c, showing that stress increases with the field strength and the field direction. The relationship between the layer-layer forces, torque, and the magnetic field direction during separation is present in Supplementary Fig. 7c, showing that horizontal force increases with the field direction, while the vertical force and magnetic torque gradually decrease.
Multi-target adhesion for ex-vivo gastric ulcers

experiment is shown in Supplementary Fig. 12 (Methods). In the ultrasound images, the ulcer (the blue dashed ellipse, Fig. 7a) harms and breaks the gastric mucosa (the white dashed line in Fig. 7a,
between two folds. The schematics inset of in Fig. 7c shows the initial positions of the ulcers in the porcine stomach.
Multi-target adhesion in an in-vivo porcine stomach

Discussion
direction perpendicular to their plane, providing interlayer magnetic attractions. Once the side layer adheres to the wet tissue, the magnetic torque can be used to flip the robot and separate it from the adhered side layer. By leveraging the on-demand adhesion and separation strategy, we validate the implementation of the robot for multi-target adhesion in ex-vivo and in-vivo environments, demonstrating its potential in treating gastric ulcers. In summary, by integrating functional materials into soft robots, more possibilities could be provided to broaden the applications.
Methods
Materials

by MACKLIN (Shanghai, China). All other chemicals are of extra pure reagent grade and are used as received.
Fabrication of magnetic multi-layer soft robot
after plasma treatment (Supplementary Fig. 1a, b). The layers are programmed with the same magnetization direction perpendicular to their plane under a pulsed magnetic field (Supplementary Fig. 1c). Last, the robot is assembled under interlayer magnetic attraction. Detailed information of the robots is shown in Supplementary Table S2.
Mechanical tests

(Storage modulus,
In vitro adhesion tests
and tested by the standard lap-shear test (ASTM F2255) with a mechanical testing machine ( 0.1 kN load-cell). Shear strength is determined by dividing the maximum force by the adhesion area.
In vitro biocompatibility test
Ultrasound imaging for ex-vivo and in-vivo tests
Experimental procedure of ex-vivo and in-vivo tests
Preparation of porcine stomach for ex-vivo tests
In-vivo tests in a pig
magnetic field are adjusted to allow the robot to form adhesion with the tissue and separate from the side layer. The final adhesion result is examined using ultrasound imaging. Under deep anesthesia, the animal is then euthanized by intravenous injection of potassium chloride, and the stomach is dissected to observe the final adhesive result. For in-vivo tests, the dimensions of the robot (Type I robot) are
Simulation
Statistical analysis
Reporting summary
Data availability
References
- Soon, R. H. et al. On-demand anchoring of wireless soft miniature robots on soft surfaces. Proc. Natl. Acad. Sci. 119, e2207767119 (2022).
- Ren, Z. et al. Soft-bodied adaptive multimodal locomotion strategies in fluid-filled confined spaces. Sci. Adv. 7, eabh2022 (2021).
- Gu, H. et al. Self-folding soft-robotic chains with reconfigurable shapes and functionalities. Nat. Commun. 14, 1263 (2023).
- Zheng, Z. et al. lonic shape-morphing microrobotic end-effectors for environmentally adaptive targeting, releasing, and sampling. Nat. Commun. 12, 411 (2021).
- Xu, T., Huang, C., Lai, Z. & Wu, X. Independent control strategy of multiple magnetic flexible millirobots for position control and path following. IEEE Trans. Robot. 38, 2875-2887 (2022).
- Ebrahimi, N. et al. Magnetic actuation methods in bio/soft robotics. Adv. Funct. Mater. 31, 2005137 (2021).
- Zhang, J. et al. Voxelated three-dimensional miniature magnetic soft machines via multimaterial heterogeneous assembly. Sci. Robot. 6, eabf0112 (2021).
- Deng, H. et al. Laser reprogramming magnetic anisotropy in soft composites for reconfigurable 3D shaping. Nat. Commun. 11, 6325 (2020).
- Gu, H., Boehler, Q., Ahmed, D. & Nelson, B. J. Magnetic quadrupole assemblies with arbitrary shapes and magnetizations. Sci. Robot. 4, eaax8977 (2019).
- Xu, T., Zhang, J., Salehizadeh, M., Onaizah, O. & Diller, E. Millimeterscale flexible robots with programmable three-dimensional magnetization and motions. Sci. Robot. 4, eaav4494 (2019).
- Richter, M. et al. Magnetic soft helical manipulators with local dipole interactions for flexibility and forces. Soft Robot. 10, 647-659 (2023).
- Hu, W., Lum, G. Z., Mastrangeli, M. & Sitti, M. Small-scale softbodied robot with multimodal locomotion. Nature 554, 81-85 (2018).
- Won, S., Kim, S., Park, J. E., Jeon, J. & Wie, J. J. On-demand orbital maneuver of multiple soft robots via hierarchical magnetomotility. Nat. Commun. 10, 4751 (2019).
- Li, W. et al. Self-vectoring electromagnetic soft robots with high operational dimensionality. Nat. Commun. 14, 182 (2023).
- Lu, H. et al. A bioinspired multilegged soft millirobot that functions in both dry and wet conditions. Nat. Commun. 9, 3944 (2018).
- Huang, H.-W. et al. Adaptive locomotion of artificial microswimmers. Sci. Adv. 5, eaau1532 (2019).
- Wang, Y. et al. Amphibious miniature soft jumping robot with ondemand in-flight maneuver. Adv. Sci. 10, 2207493 (2023).
- Wu, Y., Dong, X., Kim, J., Wang, C. & Sitti, M. Wireless soft millirobots for climbing three-dimensional surfaces in confined spaces. Sci. Adv. 8, eabn3431 (2022).
- Wang, C., Wu, Y., Dong, X., Armacki, M. & Sitti, M. In situ sensing physiological properties of biological tissues using wireless miniature soft robots. Sci. Adv. 9, eadg3988 (2023).
- Wang, C., Mzyk, A., Schirhagl, R., Misra, S. & Venkiteswaran, V. K. Biocompatible film-coating of magnetic soft robots for mucoadhesive locomotion. Adv. Mater. Technol. 8, 2201813 (2023).
- Zhou, C. et al. Ferromagnetic soft catheter robots for minimally invasive bioprinting. Nat. Commun. 12, 5072 (2021).
- Yang, Y. et al. Magnetic soft robotic bladder for assisted urination. Sci. Adv. 8, eabq1456 (2022).
- Kim, Y. et al. Telerobotic neurovascular interventions with magnetic manipulation. Sci. Robot. 7, eabg9907 (2022).
- Son, D., Gilbert, H. & Sitti, M. Magnetically actuated soft capsule endoscope for fine-needle biopsy. Soft Robot. 7, 10-21 (2020).
- Zong, Z., Zhang, S. & Wu, Z. Anisotropic contraction in a magnetically hard but mechanically ultra-soft foam for precise drug delivery. Adv. Mater. Technol. 8, 2201255 (2023).
- Zhang, H. et al. Dual-responsive biohybrid neutrobots for active target delivery. Sci. Robot. 6, eaaz9519 (2021).
- Dong, X. et al. Bioinspired cilia arrays with programmable nonreciprocal motion and metachronal coordination. Sci. Adv. 6, eabc9323 (2020).
- Lee, J., Kim, D., Bang, S. & Park, S. Drug-loaded mucoadhesive patch with active delivery and controlled releasing ability. Adv. Intell. Syst. 4, 2100203 (2022).
- Zheng, Z. et al. Programmable aniso-electrodeposited modular hydrogel microrobots. Sci. Adv. 8, eade6135 (2022).
- Ze, Q. et al. Spinning-enabled wireless amphibious origami millirobot. Nat. Commun. 13, 3118 (2022).
- Mair, L. O. et al. Soft capsule magnetic millirobots for regionspecific drug delivery in the central nervous system. Front. Robot. Al 8, 702566 (2021).
- Yang, X. et al. An agglutinate magnetic spray transforms inanimate objects into millirobots for biomedical applications. Sci. Robot. 5, eabc8191 (2020).
- Dong, Y. et al. Untethered small-scale magnetic soft robot with programmable magnetization and integrated multifunctional modules. Sci. Adv. 8, eabn8932 (2022).
- Wang, T. et al. Adaptive wireless millirobotic locomotion into distal vasculature. Nat. Commun. 13, 4465 (2022).
- Ze, Q. et al. Soft robotic origami crawler. Sci. Adv. 8, eabm7834 (2022).
- Cheng, Z. et al. Fabrication of ulcer-adhesive oral keratin hydrogel for gastric ulcer healing in a rat. Regen. Biomater. 8, rbab008 (2021).
- Brătucu, M. N. et al. Unusual complicated gastric ulcers. Medicina 57, 1345 (2021).
- Chu, J.N., Traverso, G. Foundations of gastrointestinal-based drug delivery and future developments. Nat. Rev. Gastroenterol. Hepatol. 19, 219-238 (2022).
- Anthis, A. H. C. et al. Modular stimuli-responsive hydrogel sealants for early gastrointestinal leak detection and containment. Nat. Commun. 13, 1-15 (2022).
- Wu, S. J., Yuk, H., Wu, J., Nabzdyk, C. S. & Zhao, X. A multifunctional origami patch for minimally invasive tissue sealing. Adv. Mater. 33, 2007667 (2021).
- Wu, J. et al. An off-the-shelf bioadhesive patch for sutureless repair of gastrointestinal defects. Sci. Transl. Med. 14, eabh2857 (2022).
- Xu, X. et al. Bioadhesive hydrogels demonstrating pH-independent and ultrafast gelation promote gastric ulcer healing in pigs. Sci. Transl. Med. 12, eaba8014 (2020).
- Chen, X. et al. Hydrogel bioadhesives with extreme acid-tolerance for gastric perforation repairing. Adv. Funct. Mater. 32, 2202285 (2022).
- Wang, H. et al. An integrally formed janus hydrogel for robust wettissue adhesive and anti-postoperative adhesion. Adv. Mater. 35, 2300394 (2023).
- Chun, M.-K., Bhusal, P. & Choi, H.-K. Application of Carbopol/PVP interpolymer complex to prepare mucoadhesive floating granule. Arch. Pharm. Res. 36, 745-751 (2013).
- Li, T., Bao, Q., Shen, J., Lalla, R. V. & Burgess, D. J. Mucoadhesive in situ forming gel for oral mucositis pain control. Int. J. Pharm. 580, 119238 (2020).
- Patel, M. M. et al. Mucin/Poly(acrylic acid) Interactions: a spectroscopic investigation of mucoadhesion. Biomacromolecules 4, 1184-1190 (2003).
- Deng, T. et al. A natural biological adhesive from snail mucus for wound repair. Nat. Commun. 14, 396 (2023).
- Yuk, H. et al. Dry double-sided tape for adhesion of wet tissues and devices. Nature 575, 169-174 (2019).
- Schulze, K. Imaging and modelling of digestion in the stomach and the duodenum. Neurogastroenterol. Motil. 18, 172-183 (2006).
- Marciani, L. et al. Assessment of antral grinding of a model solid meal with echo-planar imaging. Am. J. Physiol. -Gastrointest. Liver Physiol. 280, G844-G849 (2001).
- Debi, U. et al. Role of barium study in various gastric malignancies. Trop. Gastroenterol. 10, 246-255 (2019).
Acknowledgements
Author contributions
Competing interests
Additional information
http://www.nature.com/reprints
Publisher’s note Springer Nature remains neutral with regard to jurisdictional claims in published maps and institutional affiliations.
© The Author(s) 2024
School of Mechatronics Engineering and Automation, Shanghai University, Shanghai 200444, China. School of Science and Engineering, The Chinese University of Hong Kong, Shenzhen 518172, China. Shenzhen Institute of Artificial Intelligence and Robotics for Society, Shenzhen 518172, China. Department of Mechanical and Industrial Engineering, University of Toronto, Toronto, ON M5S 3G8, Canada. School of Computer Engineering and Science, Shanghai University, Shanghai 200444, China. Department of Interventional Radiology, Chinese PLA General Hospital, Beijing 100853, China. School of Medicine, The Chinese University of Hong Kong, Shenzhen 518172, China. These authors contributed equally: Ziheng Chen, Yibin Wang.
