DOI: https://doi.org/10.1186/s12917-025-04579-1
PMID: https://pubmed.ncbi.nlm.nih.gov/40045302
تاريخ النشر: 2025-03-05
سلامة أقراص إيلونوسيتينيب (زينريليا™) بعد الإعطاء الفموي مرة واحدة يوميًا في الكلاب
الملخص
الخلفية: إيلونوستينيب هو كيان جزيئي جديد من فئة مثبطات كيناز جانوس (JAKi) لعلاج والسيطرة على أعراض حالات الأمراض الجلدية التحسسية، مثل الحكة وآفات الجلد في الكلاب. هذه الدراسة المخبرية مع أقراص إيلونوستينيب (زينريليا™، إيلانكو) بحثت في السلامة في الكلاب السليمة المعالجة مرة واحدة يوميًا لمدة 6 أشهر. كانت الدراسة تصميمًا عشوائيًا مزدوج التعمية لمجموعة متوازية تفحص جرعة واحدة (1X)، وجرعتين (2X)، وثلاث جرعات (3X) وخمس جرعات (5X) من الجرعة القصوى الموصى بها.
الكلمات الرئيسية إيلونوستينيب، زينريليا
الخلفية
تشمل المشهد الدوائي لإدارة الحالات التحسسية والحكة في الكلاب عدة عائلات من الأدوية مثل الجلوكوكورتيكويدات، مثبطات الكالسينيورين (مثل سيكلوسبورين أ)، مثبطات جانوس كيناز (JAKi)، والأجسام المضادة أحادية النسيلة المضادة لـ IL-31 (mAb). بينما تعتبر العديد من هذه العلاجات فعالة، إلا أنها قد تأتي مع آثار جانبية غير مرغوب فيها، مثل تلك التي لوحظت مع الجلوكوكورتيكويدات، أو قد تخفف الحكة دون معالجة الالتهاب الأساسي، كما هو الحال مع الأجسام المضادة أحادية النسيلة المضادة لـ IL-31. لقد اقتصر السوق البيطري على مثبط جانوس كيناز واحد، وهو أوكلاسيتي nib، لعلاج التهاب الجلد التأتبي الكلبي والحكة المرتبطة به، بينما تتوفر في الطب البشري مجموعة أوسع من مثبطات جانوس كيناز لمجموعة واسعة من الحالات المناعية.
إيلونوستينيب، وهو مثبط جديد لجين جيناز، تم تقديمه مؤخرًا في مجال الطب البيطري تحت اسم زينريليا.
تهدف هذه الدراسة إلى تقييم ملف الأمان لدواء إيلونوستينيب في الكلاب عند إعطائه مرة واحدة يوميًا، على مدى 6 أشهر في
طرق
الامتثال التنظيمي والأخلاقي
إدارة الحيوانات
تم إيواء الكلاب في أزواج (حيوانان/قفص من نفس الجنس) منذ وصولها حتى اليوم -3 من الدراسة، ثم تم إيواؤها بشكل فردي طوال مدة الدراسة في أقفاص متنقلة من الفولاذ المقاوم للصدأ مع أرضيات مغطاة بالبولي إيثيلين على شكل ماسة تحتوي على تحسينات للحيوانات. خلال مدة الدراسة بأكملها، كانت المياه الجارية متاحة بحرية، وتم تقديم نظام غذائي جاف مختبري يوميًا للحيوانات.
العشوائية، التعمية والعلاج
باستثناء الأفراد الذين يقومون بإدارة العلاجات أو الذين لديهم أدوار غير مرتبطة بجمع البيانات،
تم إخفاء جميع الأفراد الآخرين عن تعيينات مجموعة العلاج.
إدارة مقالة الاختبار
متغيرات السلامة
تم تسجيل أوزان الجسم لجميع الحيوانات خلال مرحلة التكيف (أيام الدراسة -12 و -1) ثم مرة واحدة أسبوعياً خلال الدراسة. تم قياس وتسجيل استهلاك الطعام (الطعام الجاف والرطب) يومياً. تم إجراء فحوصات جسدية كاملة بواسطة طبيب بيطري مرة واحدة خلال التكيف وكل أسبوعين خلال مرحلة الجرعات في أيام الدراسة.
تم جمع عينات الدم الكامل أيضًا من الوريد الوداجي لتقييم مجموعات الكريات البيضاء والأنماط الظاهرية في أيام الدراسة -16 و -8 ، وفي أيام الدراسة
عينات الدم للتحليل الدوائي
تمت معالجة البيانات البيواناليتكية كملفات تركيز فردية مقابل الزمن باستخدام تحليل غير مقسم (NCA). تم إجراء الحسابات باستخدام برنامج Phoenix WinNonlin (الإصدار 8.3؛ Certara، الولايات المتحدة الأمريكية). تم اشتقاق Tmax و Cmax من القيم المرصودة. تم حساب AUCs باستخدام طريقة Linear Up Log Down. بالإضافة إلى ذلك، تم حساب T1/2 باستخدام طريقة أفضل ملاءمة وتم تقييم تأثيرات الجرعة والزمن والجنس بناءً على نسب Cmax و AUClast.
التقييمات الإجمالية والميكروسكوبية
| أمراض الدم | تخثر | الكيمياء السريرية | كيمياء خاصة | تحليل البول |
| عدد كريات الدم الحمراء | وقت البروثرومبين | الفوسفاتاز القلوي | بروتين سي التفاعلي | حجم |
| تركيز الهيموجلوبين | وقت الثرومبوبلاستين الجزئي المنشط | البيليروبين الكلي | لون | |
| الهيماتوكريت | فيبرينوجين | أمينوترانسفيراز الأسبارتات | المظهر | |
| حجم الكريات الحمراء المتوسط | ألانين أمينوترانسفيراز | الكثافة النسبية | ||
| عرض توزيع كريات الدم الحمراء | غاما غلوتاميل ترانسفيراز | درجة الحموضة | ||
| تركيز الهيموغلوبين الجزيئي المتوسط | نيتروجين اليوريا | بروتين جلوكوز | ||
| الهيموغلوبين الوسيط الكروي | كيناز الكرياتين | بيليروبين | ||
| عدد الشبكيات (بالأعداد المطلقة والنسبة المئوية) | كرياتينين | الكيتونات | ||
| عدد الصفائح الدموية | إجمالي البروتين | دم | ||
| عرض توزيع كريات الدم الحمراء | أميلاز | يوروبيلينوجين | ||
| عدد كريات الدم البيضاء | لاكتات ديهيدروجيناز | |||
| عدد العدلات (المطلق والنسبة المئوية) | أحماض الصفراء | |||
| عدد اللمفاويات (بالأعداد المطلقة والنسب المئوية) | ألبومين | |||
| عدد الوحيدات (بالأعداد المطلقة والنسبة المئوية) | الجلوبيولين (المُحتسب) | |||
| عدد الإيوزينوفيلات (العدد المطلق والنسبة المئوية) | نسبة الألبومين إلى الجلوبولين (محسوبة) | |||
| عدد القاعديات (المطلق والنسبة المئوية) | جلوكوز | |||
| خلايا كبيرة غير ملونة (بالأعداد والنسبة المئوية) | إجمالي الكوليسترول | |||
| خلايا أخرى (حسب الاقتضاء) | الدهون الثلاثية | |||
| الإلكتروليتات (الصوديوم، البوتاسيوم، الكلوريد) | ||||
| كالسيوم | ||||
| الفوسفور | ||||
| مغنيسيوم |
طرق إحصائية
تم تحليل النقاط النهائية التي تم قياسها مرة واحدة بعد العلاج (أوزان الأعضاء) والتي لم تتضمن قياسًا قبل العلاج باستخدام تحليل التباين (ANOVA) مع ‘العلاج’ و ‘الجنس’ و ‘العلاج حسب الجنس’ كعوامل ثابتة.
تم تحليل النقاط النهائية التي تم قياسها عدة مرات بعد العلاج والتي شملت قياسًا قبل العلاج (كيمياء المصل، بروتين سي التفاعلي، التخثر، علم الدم، تحليل البول، وزن الجسم، تغييرات وزن الجسم واستهلاك الطعام) باستخدام تحليل التباين المتكرر (RMANCOVA) مع ‘العلاج’ و ‘الوقت’ و ‘الجنس’؛ والتفاعلات الثنائية ‘العلاج حسب الوقت’ و ‘العلاج حسب الجنس’ و ‘الجنس حسب الوقت’؛ والتفاعل الثلاثي ‘العلاج حسب الوقت حسب الجنس’ واعتبار متغير ثابت. تم استخدام آخر قيمة متاحة قبل العلاج كمتغير ثابت.
إذا كانت حدود التفاعل ذات دلالة
النتائج
إدارة الجرعة
الملاحظات السريرية
كشفت الملاحظات السريرية المتعلقة بالمقالة الاختبارية عن وجود يعتمد على الجرعة من التهاب الجريبات الشعرية بين الأصابع، أو الكيسات (الجدول 2)، مع أو بدون إفرازات على واحدة أو أكثر من الأقدام. كما تم ملاحظة آفات جلدية أقل مثل التورم العرضي أو القشور على الأقدام، بالإضافة إلى سماكة و/أو تغير لون جلد الأقدام.
| 0X | 1X | 2X | 3X | 5X | |
| تغير لون الجلد | 0 | 1 | 1 | ٢ | 0 |
| آفة جلدية | 2 | ٤ | ٥ | ٦ | ٨ |
| آفة جلدية مع إفراز | 1 | 1 | ٣ | ٣ | ٤ |
| أقدام متورمة | 1 | 1 | ٥ | ٦ | ٣ |
| تسمك الجلد (الأقدام) | 1 | 0 | 1 | 1 | 0 |
| جلد قشرة كف | 2 | 0 | 0 | 1 | 1 |
| ورم حليمي | 0 | 0 | 0 | 1 | ٢ |
| التهاب الجريبات الشعرية/الخراجات | 0 | 0 | 0 | 0 | ٣ |
أوزان الجسم واستهلاك الطعام
علم الأمراض السريرية
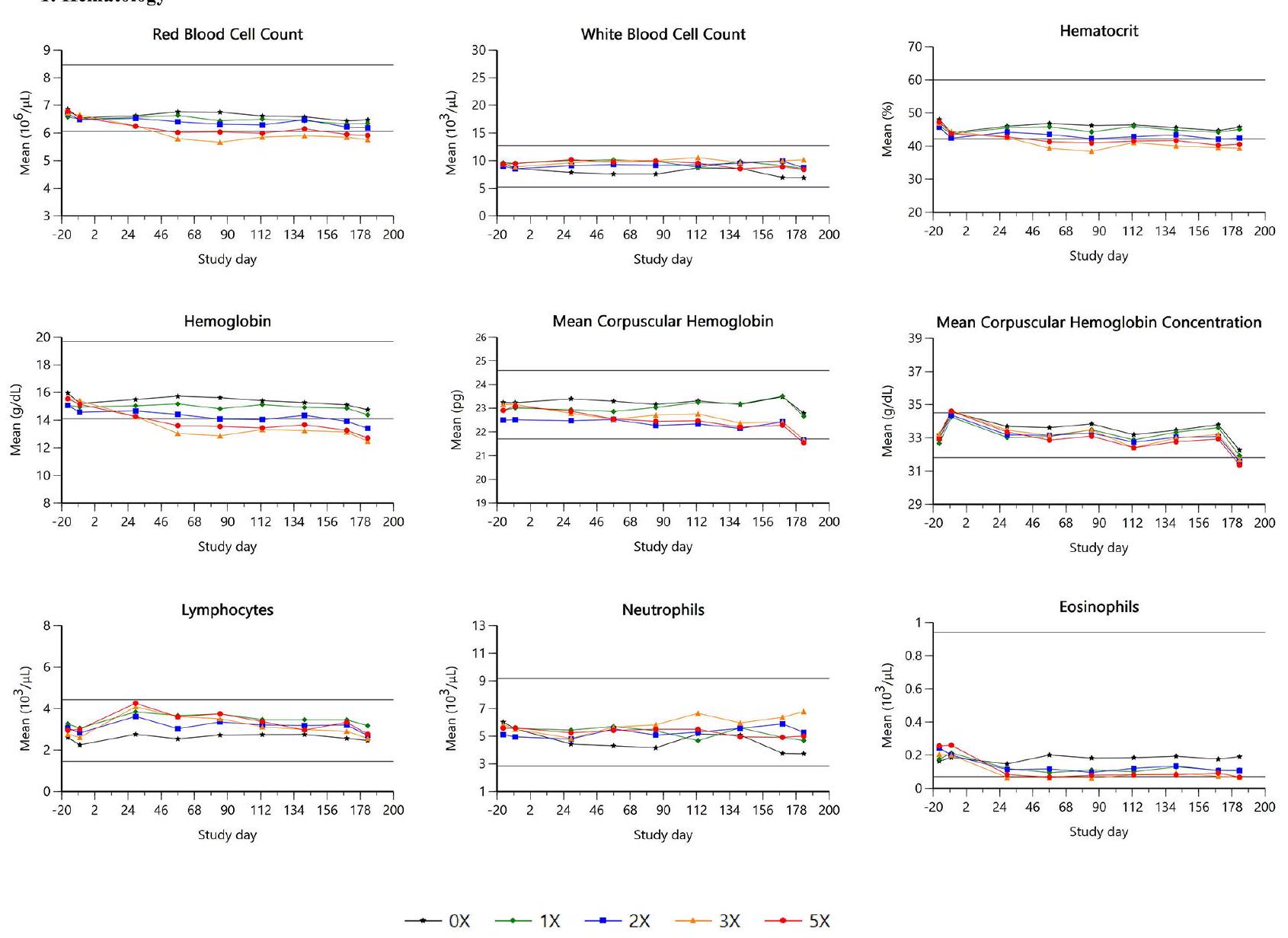
آثار العلاج ذات دلالة إحصائية للهيموغلوبين (
أظهرت الخلايا الحمضية تفاعلًا كبيرًا بين الجنس والعلاج (
كان هناك تأثير علاجي كبير للفبرينوجين (
كانت قيم البروتين الكلي كبيرة بشكل ملحوظ (
| تأثيرات المقال التجريبي مقارنةً بـ OX | |||||
| يوم الدراسة | المجموعات المتأثرة بشكل كبير | تعليقات | |||
| 1X | 3X | 5X | |||
| معاملات دموية | |||||
| HCT | كل | ↓ | ↓ | ||
| هيموغلوبين | كل | ↓ | ↓ | ↓ | |
| RBC | كل | ↓ | ↓ | ||
| MCH | كل | ↓ | ↓ | ||
| MCHC | كل | ↓ | ↓ | ↓ | |
| الحمضات | ٢٩-١٨٣ | ↓ | ↓ | إناث فقط | |
| معامل الكيمياء السريرية | |||||
| إجمالي البروتين | كل | ↑ | ↑ | ↑ | ذو دلالة إحصائية مجمعة حسب الجنس؛ الذكور (2X، 3X، 5X) الإناث (3X، 5X) |
| 113 | ↑ | ||||
| ٨٥,١١٣,١٤١ | ↑ | ||||
| ألبومين | ↓ | ↓ | ذو دلالة إحصائية في المجمّع حسب الجنس؛ الذكور (2X، 3X، 5X) الإناث (3X، 5X) | ||
| معامل التجلط | |||||
| فيبرينوجين | 57-183 | ↑ | ↑ | ارتباط مع كيسات بين الأصابع يتماشى مع استجابة المرحلة الحادة | |
كان هناك تأثير رئيسي كبير للعلاج على الألبومين
لم تكن هناك تأثيرات متعلقة بالمقالة الاختبارية على نقاط نهاية تحليل البول في أي من الجنسين عند أي مستوى جرعة.
أوزان الأعضاء، الفحوصات العامة والميكروسكوبية
تم تسجيل الملاحظات الماكروسكوبية التي تؤثر على 11 حيوانًا عبر جميع المجموعات في نهاية الدراسة. أظهر حيوانان (0 X و 2 X) سماكة أحادية في صيوان الأذن اليسرى، مما يتماشى مع إصابة موضعية واعتُبرت غير مرتبطة بالعلاج. كانت هناك أعداد قليلة من النتائج العرضية، بما في ذلك حالة واحدة من تضخم الغدة الدرقية/الغدد جارات الدرقية في أنثى واحدة.
2: الكيمياء السريرية
أظهرت الحيوانات الستة المتبقية تغييرات في الجلد فقط، بعضها مع تضخم في العقد اللمفاوية التصريفية، تم تفسيرها على أنها استجابات طبيعية للالتهاب الجلدي. كان لدى حيوان واحد (3X) أربعة عقيدات جلدية مرتفعة على كل قدم، تتماشى مع الورم الحليمي وترتبط بقطع من ديمودكس spp. وكيسات جريبية. كان هناك خمسة حيوانات في مجموعة الجرعة الأعلى
كانت النتائج المجهرية عبر جميع المجموعات ضئيلة ومتسقة إلى حد كبير مع علم الأمراض الخلفية، دون ملاحظات على آثار سلبية باستثناء التغيرات الجلدية. في مجموعة الجرعة الأعلى (5X)، لوحظت آفات جلدية في 5 من أصل 8 حيوانات. وشملت هذه آفات جلدية مختلفة في الأقدام مثل الأورام الحليمية في حيوانين وآفات التهابية مع قطع شعر تتماشى مع التهاب الجريبات الشعرية/التهاب الجريبات القيحي في 3 حيوانات (الجدول 2). كما أظهرت بعض الحيوانات غدد لمفاوية تفاعلية. تم تفسير الآفات الجلدية في مجموعة 5X على أنها مرتبطة بالعلاج.
نتائج الحركية الدوائية
تم حساب معلمات الحركية الدوائية لجميع الكلاب المعالجة في اليوم الأول من الدراسة واليوم 182، وتم تلخيصها في الجدول 4 بالنسبة لمستوى الجرعة ويوم العلاج. كانت تقلبات معلمات الحركية الدوائية Cmax و AUCs عمومًا منخفضة أو معتدلة. كانت فترة نصف العمر حوالي 3 ساعات عبر جميع المجموعات في اليومين 1 و 182.
زاد التعرض مع الجرعة وكان الزيادة قريبة من التناسب مع الجرعة (الجدول 4). كان التعرض أعلى قليلاً في اليوم 182 من الدراسة مع نسبة AUC تبلغ 1.2 و1.4 و1.6 و1.2 للمجموعات من 2 إلى 5 على التوالي (الجدول 4). كان التعرض مماثلاً للذكور والإناث في كل مجموعة علاجية وكل يوم، مما يدل على عدم وجود أي اختلافات كبيرة بين الذكور والإناث.
نقاش
3: تحديد المناعية الخلوية
أظهرت النتائج أن الإيلونوستينيب كان متسامحًا جيدًا من قبل الكلاب عند الجرعة العلاجية.
على الرغم من ملاحظة الأهمية الإحصائية في وزن الجسم وتغيرات وزن الجسم مقارنةً بالمجموعة الضابطة، لم يتم الكشف عن علاقة تعتمد على الجرعة. علاوة على ذلك، ظلت النتائج باستمرار أعلى قليلاً من قيم الضبط، ضمن النطاقات المرجعية المحددة، وافتقرت إلى الأهمية السريرية. قد يختلف التأثير على وزن الجسم بين مثبطات JAK اعتمادًا على
انتقائيتها لأنواع JAK. تم الإبلاغ عن زيادة الوزن في الكلاب مع استخدام أوكلاسيتيNib [18] وفي حالات قليلة جدًا تحت ظروف ميدانية مع إيلونوسيتيNib [19]. في البشر، تم الإبلاغ عن أن الآلية وراء زيادة الوزن الناتجة عن توفاسيتينيب مرتبطة بتقليل نشاط JAK3، الذي يُعتبر مرتبطًا بتطور السمنة [20]. باريسيتينيب، وهو نظير كيميائي قريب من إيلونوسيتيNib، يظهر فعالية أقل بكثير ضد JAK3، مما يؤدي إلى زيادة وزن محدودة، وبالتالي يدعم دوره المحتمل المفيد في السمنة وتطور الأمراض الأيضية [21].
كانت النتائج السريرية مرتبطة بشكل رئيسي بآفات جلدية على شكل كيسات بين الأصابع (IDC) أو التهاب الجريبات الشعرية بين الأصابع. بينما لوحظت الآفات الجلدية مع زيادة الجرعات، كانت خفيفة وغير متوقعة مع تعديل المناعة. إن وجود الأورام الحليمية الجلدية، أو IDC أو التهاب الجريبات الشعرية معروف في الأبحاث أو في الكلاب البيجل المخبرية، حيث توجد نسبة أعلى من المعتاد من IDC وعادة ما تتفاقم بسبب نوع الأرضيات المستخدمة في الاختبار.
| جي بي 2 (
|
Gp 3 (2X:
|
جي بي 4 (3X:
|
جي بي 5 (
|
|||||||||||||
| اليوم الأول | اليوم 182 | اليوم الأول | اليوم 182 | اليوم الأول | اليوم 182 | اليوم الأول | اليوم 182 | |||||||||
| تيمكس (ساعة)* | 2 | (1-2) | ٢ | (1-2) | 1.50 | (1-2) | 2 | (1-2) | 2 | (1-2) | 2 | (1-5) | 2 | (2-2) | 2 | (1-2) |
| Cmax (نانوغرام/مل) | ٢٧٤ | (24.2) | ٣١٠ | (20.6) | 433 | (21.0) | 540 | (13.4) | 659 | (15.1) | 972 | (33.2) | 919 | (15.6) | ١٠٨٠ | (29.4) |
| Cmax/D (نانوغرام/مل)** | ٣٢٧ | (٢٣.٠) | 378 | (20.6) | ٢٦٩ | (21.7) | ٣٣٢ | (13.6) | 272 | (15.5) | ٤٠٠ | (33.7) | 227 | (16.3) | ٢٧٠ | (29.1) |
| AUClast (ساعات*نانوغرام/مل) | ١١٥٠ | (25.3) | 1360 | (25.1) | 1710 | (24.3) | 2440 | (21.3) | ٣٣١٠ | (28.5) | ٥١٩٠ | (52.4) | ٤٣٨٠ | (14.7) | 5420 | (22.6) |
| AUClast/D (ساعات*نانوغرام/مل) | 1370 | (٢٦.٤) | 1660 | (25.8) | ١٠٦٠ | (24.9) | ١٥٠٠ | (20.5) | 1360 | (٢٩.٠) | ٢١٣٠ | (52.9) | ١٠٨٠ | (14.8) | 1350 | (22.3) |
| AUCinf (ساعة*نانوجرام/مل) | 1160 | (25.8) | 1370 | (25.5) | 1720 | (٢٤.٥) | 2450 | (21.0) | ٣٣٦٠ | (29.1) | 5140 | (٥٩.٠) | ٤٤١٠ | (14.8) | ٥٤٧٠ | (23.1) |
| AUCinf/D (ساعة*نانوغرام/مل) | 1380 | (٢٦.٩) | 1670 | (٢٦.٢) | ١٠٧٠ | (25.0) | 1510 | (20.2) | 1380 | (٢٩.٦) | 2110 | (٥٩.٦) | ١٠٩٠ | (14.8) | 1360 | (22.8) |
| أUCextra (%) | 0.595 | (77.4) | 0.557 | (70.9) | 0.398 | (٥٤.٣) | 0.472 | (118) | 0.918 | (173) | 0.891 | (215) | 0.498 | (٥٤.٦) | 0.557 | (١٣٣) |
| نصف العمر (س) | 3.36 | (14.6) | ٣.٢٩ | (11.9) | 3.08 | (8.95) | 2.68 | (28.5) | 3.68 | (24.8) | 3.62 | (٢٧.٤) | 3.08 | (10.6) | ٣.٢٠ | (20.7) |
وفقًا للنتائج السريرية، كشفت التحليلات المجهرية للجلد عن وجود ورم حليمي في مجموعة الجرعة العالية. الأورام الحليمية هي نموات حميدة ناتجة عن فيروس الورم الحليمي الكلبي، وعادة ما تسبب القليل من الانزعاج الظاهر أو المضاعفات وتكون ذاتية التحديد. كما تم ملاحظة الأورام الحليمية مع الأوكلاسيتي nib وتم امتصاصها بشكل عفوي. هذه الحالات شائعة في عموم السكان الكلاب، وخاصة في الكلاب المخبرية. الأورام الحليمية التي تم رؤيتها في هذه الدراسة تتماشى مع الأورام الحليمية الخارجية، التي تميل إلى أن تكون من أصل فيروسي، وتحدث بشكل شائع في الكلاب التي تقل أعمارها عن عامين، وتتناقص بشكل عفوي. في الدراسة الحالية، كانت إحدى حالات الورم الحليمي الموجودة على إحدى الأرجل في كلب واحد مرتبطة أيضًا بقطع من ديمودكس كانيس. تعتبر عث ديمودكس كانيس جزءًا من الفلورا الطبيعية لجلد الكلاب وعادة لا تسبب أي مرض سريري. تعتبر عدوى ديمودكس تأثيرًا محتملًا معروفًا لتثبيط JAK نتيجة لتثبيط المناعة. بشكل عام، اعتُبرت النتائج الجلدية ذات تأثير محدود، حيث كانت معظم الحالات تحت السريرية والحالات السريرية تستجيب عادةً بشكل جيد للرعاية الروتينية.
كان العلاج بالإيلونوستينيب مرتبطًا بتأثيرات خفيفة على معايير علم الدم المرتبطة بكتلة خلايا الدم الحمراء. تم الإبلاغ عن تغييرات مماثلة في المعايير الدموية عادةً للأدوية المثبطة لإنزيم JAK المستخدمة في المرضى البشر المصابين بالتهاب المفاصل الروماتويدي وكذلك في الكلاب المعالجة بالعلاج المثبط لإنزيم JAK. يبقى نمط تلك التغيرات عمومًا طفيفًا إلى معتدل وقد يُلاحظ فقط خلال فترة زمنية قصيرة. على الرغم من التشابه في النمط، تم ملاحظة اختلافات في التأثيرات بين مثبطات JAK المستخدمة في الطب البشري. أظهر العلاج بالباريسيتينيب انخفاضًا أوليًا في مستوى الهيموغلوبين ضمن النطاق الطبيعي تلاه زيادة طفيفة، بينما كان لبعض مثبطات JAK الأخرى مثل الأوباداسيتينيب تأثير محدود على الهيموغلوبين. أدى علاج الإيلونوستينيب إلى انخفاضات خفيفة في معايير خلايا الدم الحمراء (الهيموغلوبين، الهيماتوكريت، RBC، MCH وMCHC)، والحمضات. كانت التأثيرات تعتمد على الجرعة ومتسقة مع التأثيرات الديناميكية الدوائية المعروفة لتثبيط JAK، مما قد يؤثر على تكوين كريات الدم الحمراء وتمايز الحمضات وتنشيطها. كانت الانخفاضات
كانت التأثيرات في مجموعات الجرعة الزائدة من خفيفة إلى معتدلة. بالمقابل، ظلت معايير خلايا الدم الحمراء ضمن النطاق المرجعي في مجموعة 1 X (الشكل 3). من غير المحتمل أن تكون الأعداد المنخفضة قليلاً من الحمضات ذات دلالة بيولوجية. فيما يتعلق بنخاع العظام، تم الإبلاغ عن نسب المايلويد: الإريثرويد المنخفضة كمرتبطة بالعلاج في كلبين، وكانت متسقة مع استجابة نخاع العظام الطبيعية فسيولوجياً لكتلة خلايا الدم الحمراء المنخفضة على الرغم من عدم وجود تأثير واضح على الأعداد المطلقة من الخلايا الشبكية. لم يُلاحظ تأثير رئيسي للعلاج على سلالات الخلايا الأخرى، مما يشير إلى تأثير انتقائي نسبي على مسارات محددة تعتمد على JAK.
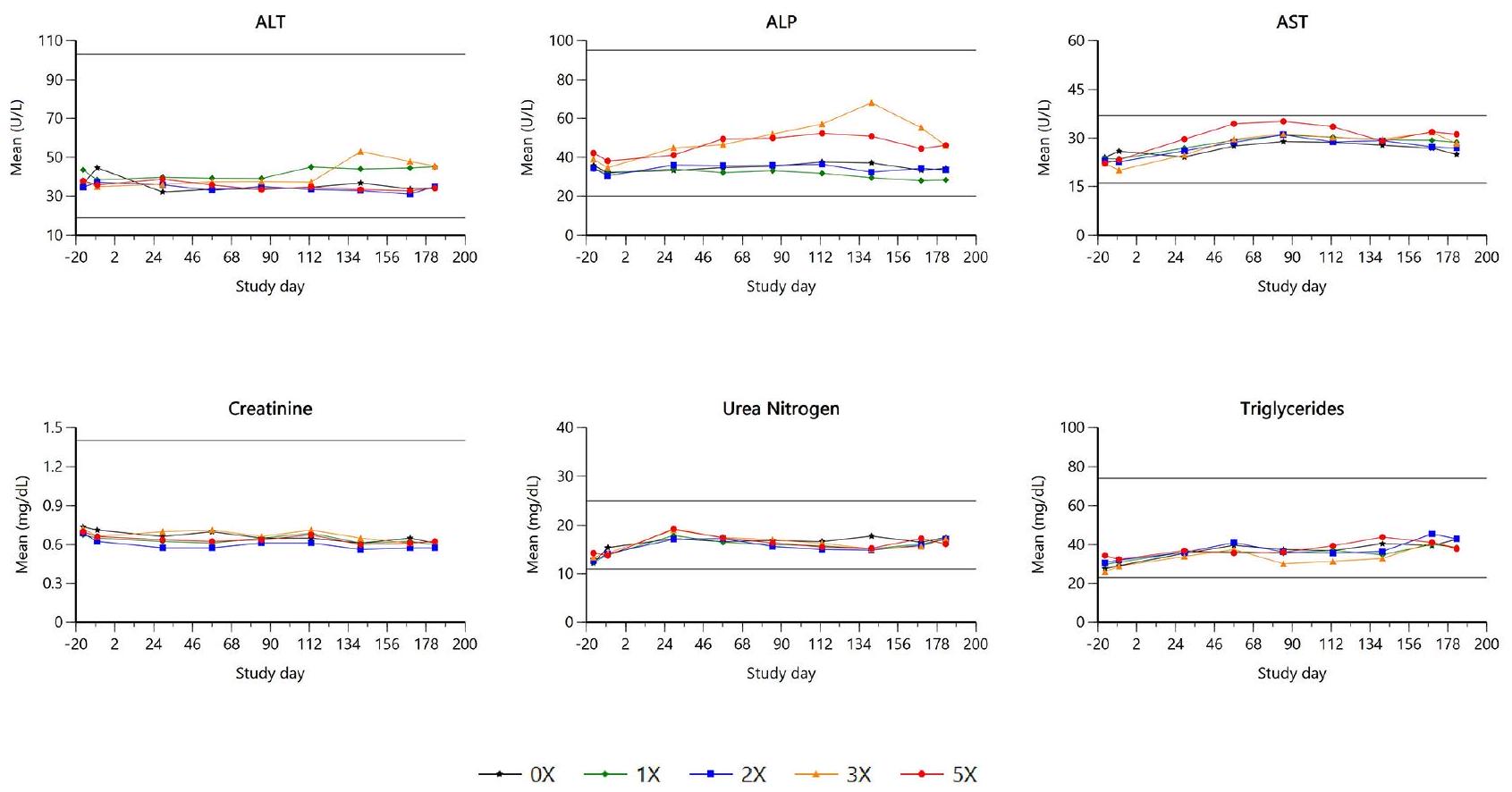
كانت هناك زيادات طفيفة في الفبرينوجين عند الجرعات المرتفعة، ومع ذلك، أشار ملف الكيمياء السريرية إلى ارتفاع فردي في مستويات البروتين الكلي والغلوبولين، مصحوبًا بانخفاض مستويات الألبومين ونسب الألبومين/الغلوبولين. كانت مستويات بروتين سي التفاعلي (CRP) أيضًا أعلى. ومن الجدير بالذكر أن جميع الكلاب التي أظهرت هذه الارتفاعات كانت تعاني أيضًا من مرض جلدي مرئي. كانت هذه النتائج نموذجية لاستجابة المرحلة الحادة وكانت مرتبطة زمنيًا بتغيرات التهابية مجهرية في الجلد، يُفترض أنها ناتجة عن التهاب الجريبات الشعرية بين الأصابع. لم تُلاحظ أي تغييرات ذات صلة أخرى في معايير علم الأمراض السريرية.
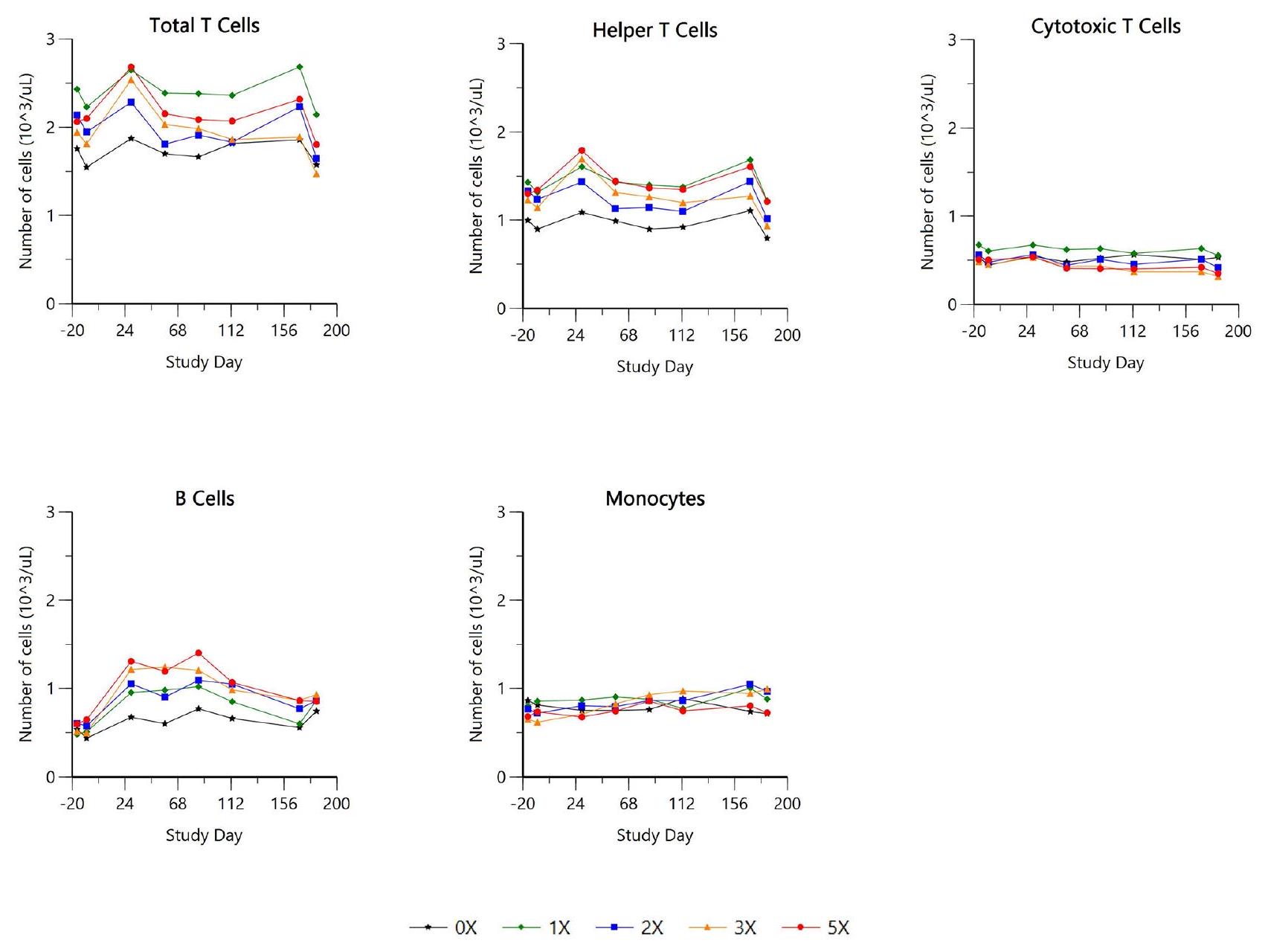
لم يكن هناك تأثير رئيسي لعلاج الإيلونوستينيب على إجمالي مجموعات خلايا الكريات البيضاء (CD5+ إجمالي الخلايا اللمفاوية التائية، CD4+ خلايا Th، CD8+ خلايا Tc، CD21+ خلايا B (CD45 + CD5- CD21+) والوحيدات). عدم وجود تأثيرات ملحوظة في هذه الدراسة ليس مفاجئًا ويعكس دراسة حديثة على البشر تتعلق بتحليل نمط خلايا الكريات البيضاء في الدم المحيطي من متطوعين أصحاء تم علاجهم بالتوفاسيتينيب. في هذه الورقة، كانت التغيرات طفيفة وقابلة للعكس. بالمثل، أظهر علاج الباريسيتينيب في مرضى التهاب المفاصل الروماتويدي المشاركين في التجارب السريرية من المرحلة الثالثة تغييرات طفيفة وقابلة للعكس في مجموعات الخلايا اللمفاوية. معظم مثبطات JAK تظهر تأثيرًا محدودًا على مجموعات الخلايا اللمفاوية بسبب آلية عملها التي تستهدف مسارات الإشارات داخل الخلايا بدلاً من التأثير مباشرة على مستقبلات سطح الخلية أو مسارات التمايز. تقدم نتائج هذه الدراسة دليلًا على أن الإيلونوستينيب لا يغير بشكل كبير مجموعات خلايا المناعة عند الجرعة العلاجية. وهذا يشير إلى ملف أمان ملائم فيما يتعلق بالاحتمالية الكامنة لقمع المناعة، وهي مسألة غالبًا ما ترتبط بالأدوية المناعية.
كانت تغييرات وزن الأعضاء طفيفة، غير معتمدة على الجرعة أو مرتبطة بالنتائج النسيجية المرضية، وبالتالي تم الاستنتاج بأنها ليست ذات أهمية بيولوجية عند الجرعة العلاجية. بينما أظهرت الدراسات الحديثة أن مسار JAK/STAT حاسم للأعضاء الأيضية مثل الأنسجة الدهنية والكبد والبنكرياس، لم تكشف الدراسة عن أي تأثير على الأعضاء المستهدفة الأيضية الرئيسية، مثل الكبد والكلى أو الأعضاء اللمفاوية الأولية. ظلت النسيجية المرضية لجميع الأعضاء غير ملحوظة مع
باستثناء التغيرات الجلدية الملحوظة. ظلت وظائف الكبد، كما تم تقييمها بواسطة الإنزيمات بما في ذلك الفوسفاتاز القلوي، والألانين أمينوترانسفيراز، والأسبارتات أمينوترانسفيراز، غير متأثرة. كانت المؤشرات الكيميائية الحيوية مثل مستويات الكرياتينين والبولة في البلازما، بالإضافة إلى تحليل البول، ضمن النطاقات الطبيعية لمجموعات العلاج. لم يتم ملاحظة المخاوف المحتملة من العلاج بمثبط المناعة الذي قد يؤدي إلى تعزيز أو تفاقم تلف الأعضاء المختلفة عند استخدام الإيلونوسيتينيب بالجرعة العلاجية الموصى بها والجرعات الزائدة.
تم تصميم جدول أخذ عينات الدم لتقييم الديناميكا الدوائية لمراقبة تعرض الجسم للدواء، مع تجنب التداخل مع تقييم نقاط الأمان الأساسية. لتعظيم التعرض الجهازي، تم إعطاء الأقراص أثناء إطعام الكلاب، حيث يوجد تقريباً
كان التباين بين الأفراد عمومًا منخفضًا إلى معتدل
أظهر التعرض زيادة قريبة من التناسب مع الجرعة، ولم يتم الكشف عن اختلافات كبيرة بين الجنسين، مما يشير إلى استجابة متسقة وقابلة للتنبؤ تجاه الدواء عبر جرعات وجنسيات مختلفة. بشكل عام، أكدت التحليلات الدوائية أن الكلاب كانت تتلقى جرعات متسقة ومعرضة للإيلونوستينيب، مما يدعم الاستنتاجات المتعلقة بسلامة المنتج.
بينما توفر الدراسة رؤى حول سلامة الإيلونوستينيب في الكلاب عند الجرعات الزائدة لتحديد هامش الأمان، تم إجراؤها في بيئة مختبرية محكومة باستخدام عدد صغير نسبيًا من كلاب البيجل الصحية. وبالتالي، قد لا تمثل النتائج بشكل كامل التباين الذي يُرى في مجموعة الكلاب الأوسع تحت ظروف الميدان. يمكن أن تؤثر عوامل مثل الحالات الصحية الموجودة مسبقًا، والسلالات المختلفة، والتأثيرات البيئية على ملف سلامة الدواء في البيئات الواقعية. تم إجراء ثلاث دراسات سريرية لدعم سلامة وفعالية الإيلونوستينيب في مجموعات الكلاب المتنوعة في أوروبا والولايات المتحدة.
الاستنتاجات
تشير إلى أن الإيلونوستينيب كان جيد التحمل في الكلاب عند الجرعة العلاجية وحتى عند جرعات تصل إلى خمسة أضعاف، دون ملاحظة أي آثار جانبية خطيرة أو وفيات.
كانت النتيجة السريرية الرئيسية هي زيادة تعتمد على الجرعة في الكيسات بين الأصابع (IDC)، وهو نتيجة تتماشى مع التأثير المعروف لفئة مثبطات JAKi المتمثل في زيادة القابلية للإصابات الموضعية. قد تكون IDC أيضًا ناتجة عن نوع الأرضيات المستخدمة في مرافق الاختبار ولم تُلاحظ عندما كانت الكلاب تعيش على الأسمنت وتستخدم فرشة من حبوب الذرة. ومع ذلك، كانت هذه الآفات عمومًا خفيفة وحُلت بواسطة العلاجات القياسية. بالإضافة إلى ذلك، تم ملاحظة الأورام الحليمية، وهي نموات حميدة تسببها فيروس الورم الحليمي الكلبي، لكنها شائعة في عموم السكان الكلاب وعادة ما تحل بشكل تلقائي.
تضمنت التغيرات المرتبطة بإيلونوسيتينيب انخفاضات طفيفة في معايير كريات الدم الحمراء والحمضات في مجموعات الجرعة العالية، بما يتماشى مع التأثيرات الديناميكية الدوائية المعروفة لتثبيط JAK، بينما ظلت مجموعة الجرعة العلاجية ضمن النطاق الطبيعي. لم تُلاحظ تغييرات ذات دلالة سريرية في تجمعات خلايا الكريات البيضاء، مما يشير إلى تأثيرات محدودة على تجمعات خلايا المناعة.
بشكل عام، تشير نتائج هذه الدراسة إلى وجود ملف أمان إيجابي للإيلونوسيتينيب، مما يدعم استخدامه المزمن في الكلاب.
| اختصارات | |
| تحليل التباين | تحليل التباين |
| وصول | تقرير أبحاث الحيوانات عن التجارب في المختبر |
| الجامعة الأمريكية في القاهرة | المساحة تحت المنحنى |
| أو سي إكسترا (%) | جزء من AUC الذي يتم استنتاجه خارج آخر تركيز قابل للقياس إلى اللانهاية |
| AUCinf | المساحة تحت المنحنى من الزمن صفر إلى اللانهاية |
| الـ AUC الأخير | المساحة تحت المنحنى من الزمن صفر إلى آخر تركيز قابل للقياس |
| Cmax | تركيز الدم الأقصى |
| آي دي سي | أكياس بين الأصابع |
| جاك | كيناز جانوس |
| جاك/ستات | كيناز جانوس/ناقل الإشارة ومفعل النسخ |
| جاكي | مثبط كيناز جانوس |
| MCH | الهيموغلوبين الوسيط الكروي |
| MCHC | تركيز الهيموغلوبين الجزيئي المتوسط |
| RBC | عدد كريات الدم الحمراء |
| RMANCOVA | تحليل التباين للقياسات المتكررة |
| نصف العمر | نصف العمر |
| تيمكس | الوقت للوصول إلى ذروة تركيز الدم |
| فيتش | المؤتمر الدولي البيطري حول التوافق |
شكر وتقدير
مساهمات المؤلفين
التمويل
توفر البيانات
الإعلانات
موافقة الأخلاقيات والموافقة على المشاركة
الموافقة على النشر
المصالح المتنافسة
تم النشر عبر الإنترنت: 05 مارس 2025
References
- Linek M, Favrot C. Impact of canine atopic dermatitis on the health-related quality of life of affected dogs and quality of life of their owners. Vet Dermatol. 2010. https://doi.org/10.1111/j.1365-3164.2010.00899.x
- Favrot C, Fischer N, Olivry T, ZwickI L, Audergon S, Rostaher A. Atopic dermatitis in West Highland white terriers – part I: natural history of atopic dermatitis in the first three years of life. Vet Dermatol. 2020. https://doi.org/10.1111/vde. 12801
- Gross T, Ihrke PJ, Walder EJ, Affolter V. Skin diseases of the dog and cat: clinical and histopathologic diagnosis. Oxford: Blackwell Science; 2005. https://doi.or g/10.1002/9780470752487
- Clark JD, Flanagan ME, Telliez JB. Discovery and development of Janus kinase (JAK) inhibitors for inflammatory diseases. J Med Chem. 2014. https://doi.org/ 10.1021/jm401490p
- Drechsler Y, Dong C, Clark DE, Kaur G. Canine atopic dermatitis: prevalence, impact, and management strategies. Vet Med (Auckl). 2024. https://doi.org/1 0.2147/VMRR.S412570
- Virtanen AT, Haikarainen T, Raivola J, Silvennoinen O. Selective JAKinibs: prospects in inflammatory and autoimmune diseases. BioDrugs. 2019. https:/ /doi.org/10.1007/s40259-019-00333-w
- Forster S, Trout C, Despa S, Boegel A, Berger D, King S. Efficacy and field safety of ilunocitinib for the control of atopic dermatitis in client-owned dogs: a multicenter, masked, randomized, placebo-controlled clinical trial. Manuscript in preparation.
- Forster S, Trout C, Despa S, Boegel A, Berger D, King S. Efficacy and field safety of ilunocitinib for the control of allergic dermatitis in client-owned dogs: a multicenter, double-masked, randomized, placebo-controlled clinical trial. Manuscript in preparation.
- Forster S, Despa S, Trout C, King S. Comparative efficacy and safety of ilunocitinib and oclacitinib for the control of pruritus and associated skin lesions in dogs with atopic dermatitis. Manuscript submitted for publication.
- Veterinary International Conference on Harmonization (VICH). Guideline 43: Target Animal Safety for Veterinary Pharmaceutical Products. 2009. https://w ww.vichsec.org/en/guidelines/pharmaceuticals/pharma-safety/pharma-targ et-animal-safety.html. Accessed 29 Jul 2024.
- United States Food and Drug Administration. Code of Federal Regulations Title 21, Part 58, Good Laboratory Practice for nonclinical laboratory studies. 2016. https://www.ecfr.gov/current/title-21/chapter-I/subchapter-A/part-58. Accessed 29 Jul 2024.
- Organisation for Economic Cooperation and Development (OECD). Series on Principles of Good Laboratory Practice (GLP) and Compliance Monitoring. 1997. https://www.oecd-ilibrary.org/environment/oecd-series-on-principle s-of-good-laboratory-practice-and-compliance-monitoring_2077785x. https: //doi.org/10.1787/2077785x. Accessed 29 Jul 2024.
- Animal and Plant Health Inspection Service, Department of Agriculture. Code of Federal Regulations. 9 CFR Chapter I Subchapter. https://www.ecfr.gov/cur rent/title-9/chapter-l/subchapter-A. Accessed on 29 Jul 2024.
- National Research Council. Guide for the Care and Use of Laboratory animals. Washington, DC: National Academies; 1996. https://doi.org/10.17226/5140. Accessed on 29 Jul 2024.
- Kilkenny C, Browne WJ, Cuthill IC, Emerson M, Altman DG. Improving bioscience research reporting: the ARRIVE guidelines for reporting animal research. J Pharmacol Pharmacother. 2010. https://doi.org/10.4103/0976-500X. 72351
- Food and Drug Administration. Guidance for industry. Bioanalytical method validation. 2018. https://www.fda.gov/files/drugs/published/Bioanalytical-Me thod-Validation-Guidance-for-Industry.pdf. Accessed on 29 Jul 2024.
- European Medicines Agency. Guideline on bioanalytical method validation. EMEA/CHMP/EWP/192217/2009, 2011 Rev. 1 Corr. 2** superseded by the ICH guideline M10 on bioanalytical method validation and study sample analysis. 2022. https://www.ema.europa.eu/en/documents/scientific-guideline/guidel ine-bioanalytical-method-validation_en.pdf. Accessed on 29 Jul 2024.
- Cosgrove SB, Wren JA, Cleaver DM, Walsh KF, Follis SI, King VI, Tena JK, Stegemann MR. A blinded, randomized, placebo-controlled trial of the efficacy and safety of the Janus kinase inhibitor oclacitinib (Apoquel
) in client-owned dogs with atopic dermatitis. Vet Dermatol. 2013. https://doi.org/10.1111/vde. 12088 - Food and Drug Administration. Freedom of Information Summary: Original New Animal Drug Application NADA 141-585 (Zenrelia™ (ilunocitinib tablets)). https://animaldrugsatfda.fda.gov/adafda/app/search/public/document /downloadFoi/15865
- Mishra J, Verma RK, Alpini G, Meng F, Kumar N. Role of Janus Kinase 3 in predisposition to obesity-associated metabolic syndrome. J Biol Chem. 2015. https://doi.org/10.1074/jbc.M115.670331
- Collotta D, Hull W, Mastrocola R, Chiazza F, Cento AS, Murphy C, Verta R, Ferreira Alves G, Gaudioso G, Fava F, Yaqoob M, Aragno M, Tuohy K, Thiemermann C, Collino M. Baricitinib counteracts metaflammation, thus protecting against diet-induced metabolic abnormalities in mice. Mol Metabolism. 2020. https://doi.org/10.1016/j.molmet.2020.101009
- Kovacs MS, McKiernan S, Potter DM, Chilappagari. An epidemiological study of interdigital cysts in a research Beagle colony. Contemp Top Lab Anim Sci. 2005;44:17-21.
- Diagnosis. Interdigital cyst. Lab Anim. 2007. https://doi.org/10.1038/laban050 7-18
- Cosgrove SB, Cleaver DM, King VL, Gilmer AR, Daniels AE, Wren JA, et al. Longterm compassionate use of oclacitinib in dogs with atopic and allergic skin disease: safety, efficacy and quality of life. Vet Dermatol. 2015. https://doi.org/ 10.1111/vde. 12194
- Food and Drug Administration. Freedom of Information Summary: Original New Animal Drug Application NADA 141-345 (Apoquel (Oclacitinib Tablet)). https://animaldrugsatfda.fda.gov/adafda/app/search/public/document/dow nloadFoi/902. Accessed 29 Jul 2024.
- Kay J, Harigai M, Rancourt J, Dickson C, Melby T, Issa M, et al. Changes in selected haematological parameters associated with JAK1/JAK2 inhibition observed in patients with rheumatoid arthritis treated with baricitinib. RMD Open. 2020. https://doi.org/10.1136/rmdopen-2020-001370
- Fleischmann RM, Genovese MC, Enejosa JV, Mysler E, Bessette L, Peterfy C, et al. Safety and effectiveness of upadacitinib or adalimumab plus methotrexate in patients with rheumatoid arthritis over 48 weeks with switch to alternate therapy in patients with insufficient response. Ann Rheum Dis. 2019. https:// doi.org/10.1136/annrheumdis-2019-215764
- Weinhold KJ, Bukowski JF, Brennan TV, Noveck RJ, Staats JS, Lin L, et al. Reversibility of peripheral blood leukocyte phenotypic and functional changes after exposure to and withdrawal from tofacitinib, a Janus kinase inhibitor, in healthy volunteers. Clin Immunol. 2018. https://doi.org/10.1016/j.clim.2018.0 3.002
- Tanaka Y, McInnes IB, Taylor PC, Byers NL, Chen L, de Bono S, et al. Characterization and changes of lymphocyte subsets in baricitinib-treated patients with rheumatoid arthritis: an integrated analysis. Arthritis Rheumatol. 2018. ht tps://doi.org/10.1002/art. 40680
- Collotta D, Franchina MP, Carlucci V, Collino M. Recent advances in JAK inhibitors for the treatment of metabolic syndrome. Front Pharmacol. 2023. https:// doi.org/10.3389/fphar.2023.1245535
ملاحظة الناشر
- *المراسلة:
إيمانويل أ. كونتس emmanuelle.kuntz@elancoah.com
إيلانكو لصحة الحيوان، ماتنستراس 24أ، بازل 4058، سويسرا - المتوسطات الهندسية و(نسبة CV الهندسية%) باستثناء (*) Tmax حيث يتم إعطاء الوسيط والمدى (الحد الأدنى-الحد الأقصى)
**Cmax و AUC يتم تطبيعها حسب الجرعة إلى
DOI: https://doi.org/10.1186/s12917-025-04579-1
PMID: https://pubmed.ncbi.nlm.nih.gov/40045302
Publication Date: 2025-03-05
Safety of ilunocitinib tablets (Zenrelia
Abstract
Background Ilunocitinib is a new molecular entity of the Janus kinase inhibitor (JAKi) class for the treatment and control of symptoms of allergic skin disease conditions, such as pruritus and skin lesions in dogs. This laboratory study with ilunocitinib tablets (Zenrelia™, Elanco) investigated the safety in healthy dogs treated once daily for 6 months. The study was a randomized, blinded, parallel-group design examining one (1X), two (2X), three (3X) and five (5X) times the maximum recommended dose (
Keywords Ilunocitinib, Zenrelia
Background
The pharmacological landscape for managing allergic and pruritic conditions in dogs includes several drug families such as glucocorticoids, calcineurin inhibitors (e.g., Cyclosporin A), Janus Kinase inhibitors (JAKi), and anti-IL-31 monoclonal antibodies ( mAb ). While many of these treatments are effective, they may come with undesirable side-effects, such as those observed with glucocorticoids, or may alleviate pruritus without addressing underlying inflammation, as with anti-IL-31 mAb . The veterinary market has been limited to a single JAKi, oclacitinib, for the treatment of canine atopic dermatitis and associated pruritus, while human medicine has access to a broader range of JAKi for a wide range of immune mediated conditions [5, 6].
Ilunocitinib, a novel JAKi, has recently been introduced to the veterinary field as Zenrelia
This study aimed to assess the safety profile of ilunocitinib in dogs when given once daily, over 6 months at
Methods
Regulatory and ethical compliance
Animal management
Dogs were pair-housed (2 animals/cage of same sex) from arrival until study day -3 and were then individually housed for the duration of the study in stainless steel mobile cages with poly-coated diamond shaped flooring containing animal enrichment. Through the whole study duration, tap water was available ad libitum and animals were offered daily dry laboratory diet (Lab Diet
Randomization, blinding and treatment
With the exception of individuals either administering the treatments or with roles unrelated to data collection,
all other personnel were blinded to the treatment group assignments.
Test article administration
Safety variables
Body weights for all animals were recorded during the acclimation phase (study days -12 and -1 ) and then once weekly during the study. Food consumption (dry and wet food) was measured and recorded daily. Complete physical examinations by a veterinarian were conducted once during acclimation and every two weeks during the dosing phase on study days
Whole blood samples were also collected from the jugular vein for the evaluation of the leukocyte subsets and phenotypes on study days -16 and -8 , and on study days
Blood samples for pharmacokinetic analysis
The bioanalytical data were processed as individual concentration vs. time profiles using a non-compartmental analysis (NCA). Calculations were performed with the software Phoenix WinNonlin (version 8.3; Certara, USA). Tmax and Cmax were derived from observed values. AUCs were calculated using the Linear Up Log Down method. In addition, T1/2 was calculated using the best fit method and dose, time and sex effects were evaluated based on Cmax and AUClast ratios.
Gross and microscopic evaluations
| Hematology | Coagulation | Clinical chemistry | Special chemistry | Urinalysis |
| Red blood cell count | Prothrombin time | Alkaline phosphatase | C-reactive protein | Volume |
| Hemoglobin concentration | Activated partial thromboplastin time | Total bilirubin | Color | |
| Hematocrit | Fibrinogen | Aspartate aminotransferase | Appearance | |
| Mean corpuscular volume | Alanine aminotransferase | Specific gravity | ||
| Red blood cell distribution width | Gamma glutamyl transferase | pH | ||
| Mean corpuscular hemoglobin concentration | Urea nitrogen | Protein glucose | ||
| Mean corpuscular hemoglobin | Creatine kinase | Bilirubin | ||
| Reticulocyte count (absolute and percent) | Creatinine | Ketones | ||
| Platelet count | Total protein | Blood | ||
| Red blood cell distribution width | Amylase | Urobilinogen | ||
| White blood cell count | Lactate dehydrogenase | |||
| Neutrophil count (absolute and percent) | Bile acids | |||
| Lymphocyte count (absolute and percent) | Albumin | |||
| Monocyte count (absolute and percent) | Globulin (calculated) | |||
| Eosinophil count (absolute and percent) | Albumin/globulin ratio (calculated) | |||
| Basophil count (absolute and percent) | Glucose | |||
| Large unstained cells (absolute and percent) | Total cholesterol | |||
| Other cells (as appropriate) | Triglycerides | |||
| Electrolytes (sodium, potassium, chloride) | ||||
| Calcium | ||||
| Phosphorus | ||||
| Magnesium |
Statistical methods
Endpoints measured once post-treatment (organ weights) that did not include a pre-treatment measurement were analyzed using analysis of variance (ANOVA) with ‘treatment,’ ‘sex’, and ‘treatment by sex’ as fixed effects.
Endpoints measured multiple times post-treatment that included a pre-treatment measurement (Serum chemistry, C-reactive protein, coagulation, hematology, urinalysis, body weight, body weight changes and food consumption) were analyzed using repeated measures analysis of covariance (RMANCOVA) with ‘treatment’, ‘time’, and ‘sex’; the two-way interactions ‘treatment by time,’ ‘treatment by sex’, and ‘sex by time’; the three-way interaction ‘treatment by time by sex’ and a covariate all as fixed effects. The last available pre-treatment value was used as the covariate.
If the interaction terms were significant (
Results
Dose administration
Clinical observations
Test article-related clinical observations revealed a dose-dependent presence of interdigital furunculosis, or cysts (Table 2), with or without discharge on one or more paws. Lesser cutaneous lesions such as occasional swelling or scabbing of paws, along with thickening and/or discoloration of paw skin were also noted.
| 0X | 1X | 2X | 3X | 5X | |
| Skin discoloration | 0 | 1 | 1 | 2 | 0 |
| Skin lesion | 2 | 4 | 5 | 6 | 8 |
| Skin lesion w/discharge | 1 | 1 | 3 | 3 | 4 |
| Swollen paws | 1 | 1 | 5 | 6 | 3 |
| Skin thickening (paws) | 1 | 0 | 1 | 1 | 0 |
| Skin scab paw | 2 | 0 | 0 | 1 | 1 |
| Papilloma | 0 | 0 | 0 | 1 | 2 |
| Folliculitis/furunculosis | 0 | 0 | 0 | 0 | 3 |
Body weights and food consumption
Clinical pathology
Statistically significant treatment effects for hemoglobin (
Eosinophils showed a significant sex by treatment interaction (
There was a significant treatment effect for fibrinogen (
Total protein values were significantly (
| Test Article Effects Compared to OX | |||||
| Study day | Groups significantly impacted | Comments | |||
| 1X | 3X | 5X | |||
| Hematological parameter | |||||
| HCT | all | ↓ | ↓ | ||
| Hb | all | ↓ | ↓ | ↓ | |
| RBC | all | ↓ | ↓ | ||
| MCH | all | ↓ | ↓ | ||
| MCHC | all | ↓ | ↓ | ↓ | |
| Eosinophils | 29-183 | ↓ | ↓ | females only | |
| Clinical chemistry parameter | |||||
| Total Protein | all | ↑ | ↑ | ↑ | significant in pooled by sex; males (2X, 3X, 5X) females (3X, 5X) |
| 113 | ↑ | ||||
| 85,113,141 | ↑ | ||||
| Albumin | ↓ | ↓ | significant in pooled by sex; males (2X, 3X, 5X) females (3X, 5X) | ||
| Coagulation parameter | |||||
| Fibrinogen | 57-183 | ↑ | ↑ | association with interdigital cysts consistent with acute phase response | |

There was a significant main effect of treatment for albumin (
There were no test article-related effects on urinalysis endpoints in either sex at any dose level.
Organ weights, gross and microscopic examinations
Macroscopic observations affecting 11 animals across all groups were recorded at the end of the study. Two animals ( 0 X and 2 X ) exhibited unilateral thickening of the left ear pinnae, consistent with focal trauma and were considered not treatment-related. There were low numbers of incidental findings, including a single case of enlarged thyroid/parathyroid glands in one female
2: Clinical Chemistry

The remaining six animals showed only skin changes, some with enlarged draining lymph nodes, interpreted as normal responses to cutaneous inflammation. One animal (3X) had four raised dermal nodules on each paw, consistent with papillomas and associated with Demodex spp. fragments and follicular cysts. Five animals in the highest dose group
Microscopic findings across all groups were minimal and largely consistent with background pathology, with no adverse effects noted except for cutaneous changes. In the highest dose group (5X), cutaneous lesions were observed in 5 out of 8 animals. These included various feet skin lesions such as papillomas in 2 animals and inflammatory lesions with hair fragments consistent with folliculitis/furunculosis in 3 animals (Table 2). Some animals also displayed reactive lymph nodes. The cutaneous lesions in the 5X group were interpreted as treatment-associated.
Pharmacokinetic results
Pharmacokinetic parameters were calculated for all treated dogs on study day 1 and study day 182 and are summarized in Table 4 with respect to dose level and treatment day. The variability of the pharmacokinetic parameters Cmax and AUCs was generally low or moderate. The half-life was approximately 3 h across all groups on days 1 and 182 .
Exposure increased with dose and the increase was close to dose proportional (Table 4). Exposure was slightly higher at study day 182 with AUC ratio of 1.2, 1.4, 1.6, and 1.2 for groups 2 to 5 respectively (Table 4). Exposure was similar in males and females for each treatment group and day, demonstrating absence of any significant differences between males and females.
Discussion
3: Immunophenotyping

The results demonstrated that ilunocitinib was welltolerated by dogs at the therapeutic dose (
Although statistical significance in body weight and body weight changes was observed compared to the controls, no dose-dependent relationship was detected. Moreover, the results consistently remained slightly above control values, within established reference ranges, and lacked clinical relevance. The impact on body weight may vary among JAK inhibitors depending on
their selectivity for JAK subtypes. Weight gain has been reported in dogs with the use of oclacitinib [18] and in very few cases under field conditions with ilunocitinib [19]. In humans, the mechanism behind tofacitinibinduced weight gain has been reported to be linked to a reduction in JAK3 activity, which is implicated in obesity pathogenesis [20]. Baricitinib, a close chemical analog of ilunocitinib, exhibits significantly lower potency against JAK3, resulting in limited weight gain, thereby supporting its potential beneficial role in obesity and metabolic disease development [21].
Clinical findings were mainly related to skin lesions in the form of interdigital cysts (IDC) or interdigital furunculosis. Whilst cutaneous lesions were noted with increasing doses, they were mild and not unexpected with immune modulation. The finding of cutaneous papillomas, IDC or furunculosis is known in research or laboratory Beagle dogs, in which a higher than normal background incidence of IDC is present and generally exacerbated by the type of flooring used in the testing
| Gp 2 (
|
Gp 3 (2X:
|
Gp 4 (3X:
|
Gp 5 (
|
|||||||||||||
| Day 1 | Day 182 | Day 1 | Day 182 | Day 1 | Day 182 | Day 1 | Day 182 | |||||||||
| Tmax (h)* | 2 | (1-2) | 2 | (1-2) | 1.50 | (1-2) | 2 | (1-2) | 2 | (1-2) | 2 | (1-5) | 2 | (2-2) | 2 | (1-2) |
| Cmax (ng/mL) | 274 | (24.2) | 310 | (20.6) | 433 | (21.0) | 540 | (13.4) | 659 | (15.1) | 972 | (33.2) | 919 | (15.6) | 1080 | (29.4) |
| Cmax/D (ng/mL)** | 327 | (23.0) | 378 | (20.6) | 269 | (21.7) | 332 | (13.6) | 272 | (15.5) | 400 | (33.7) | 227 | (16.3) | 270 | (29.1) |
| AUClast (h*ng/mL) | 1150 | (25.3) | 1360 | (25.1) | 1710 | (24.3) | 2440 | (21.3) | 3310 | (28.5) | 5190 | (52.4) | 4380 | (14.7) | 5420 | (22.6) |
| AUClast/D (h*ng/mL)** | 1370 | (26.4) | 1660 | (25.8) | 1060 | (24.9) | 1500 | (20.5) | 1360 | (29.0) | 2130 | (52.9) | 1080 | (14.8) | 1350 | (22.3) |
| AUCinf (h*ng/mL) | 1160 | (25.8) | 1370 | (25.5) | 1720 | (24.5) | 2450 | (21.0) | 3360 | (29.1) | 5140 | (59.0) | 4410 | (14.8) | 5470 | (23.1) |
| AUCinf/D (h*ng/mL)** | 1380 | (26.9) | 1670 | (26.2) | 1070 | (25.0) | 1510 | (20.2) | 1380 | (29.6) | 2110 | (59.6) | 1090 | (14.8) | 1360 | (22.8) |
| AUCextra (%) | 0.595 | (77.4) | 0.557 | (70.9) | 0.398 | (54.3) | 0.472 | (118) | 0.918 | (173) | 0.891 | (215) | 0.498 | (54.6) | 0.557 | (133) |
| T1/2 (h) | 3.36 | (14.6) | 3.29 | (11.9) | 3.08 | (8.95) | 2.68 | (28.5) | 3.68 | (24.8) | 3.62 | (27.4) | 3.08 | (10.6) | 3.20 | (20.7) |
Consistent with the clinical findings, microscopic analysis of the skin revealed the presence of papillomas in the high dose group. Papillomas are benign growths caused by the canine papillomavirus that generally result in little apparent discomfort or complications and are selflimiting. Papillomas were also observed with oclacitinib and resorbed spontaneously [25]. These conditions are common in the general canine population, particularly in laboratory dogs. The papillomas seen in this study are consistent with exophytic papillomas, which tend to be of viral origin, occur most commonly in dogs under 2 years of age, and regress spontaneously. In the current study, one of the cases of papilloma present on one paw in one single dog, was also associated with fragments of Demodex canis. D. canis mites are part of the normal flora of canine skin and usually cause no clinical disease. Demodex infection is a known potential effect of JAK inhibition secondary to immunosuppression [24-25]. Overall, the cutaneous findings were considered to have limited adversity, with most cases being sub-clinical and clinical cases typically responding well to routine care.
Treatment with ilunocitinib was associated with mild effects on hematology parameters associated with red cell mass. Similar variations in hematological parameters were typically reported for other JAKi used in human patients with rheumatoid arthritis [26] and in dogs treated with JAKi therapy [24]. The pattern of those alterations remains generally minor to moderate and is potentially only seen within a short period of time. Despite similarities in the pattern, differences in the effects were noted between JAKi used in human medicine. Treatment with baricitinib showed an initial decrease in hemoglobin within the normal range followed by a slight increase, while some other JAKi such as upadacitinib had limited impact on hemoglobin [27]. Ilunocitinib treatment induced mild decreases in red blood cell parameters (hemoglobin, hematocrit, RBC, MCH and MCHC), and eosinophils. The effects were dose-dependent and consistent with the known pharmacodynamic effects of JAK inhibition, potentially affecting erythropoiesis and eosinophil differentiation and activation. The decreases were
minimal to mild in the overdose groups. In contrast, red cell parameters within the 1 X group stayed within the reference range (Fig. 3). Slightly lower eosinophil counts are unlikely to have biological relevance. Regarding bone marrow, lower myeloid: erythroid ratios were reported to be treatment-related in two dogs and were consistent with a physiologically normal bone marrow response to the lower red blood cell mass despite no apparent effect on absolute reticulocyte counts. No main treatment effect on other cell lineages were observed, suggesting a relatively selective effect on specific JAK-mediated pathways.
There were minimal increases in fibrinogen at elevated doses, however, the clinical chemistry profile indicated individually elevated total protein and globulin levels, accompanied by reduced albumin levels and albumin/ globulin ratios. C-reactive protein (CRP) levels were also higher. Notably, all dogs exhibiting these elevations also presented with visible skin disease. These findings were typical of an acute phase response and were temporally associated with microscopic inflammatory changes in the skin, presumed to be secondary to interdigital furunculosis. No further relevant changes were observed in clinical pathology parameters.
There was no main treatment effect of ilunocitinib on overall leukocyte cell populations (CD5+total T lymphocytes, CD4+Th cells, CD8+Tc cells, CD21+B cells (CD45 + CD5- CD21+) and monocytes). The lack of significant effects observed in this study is not surprising and mirrors a recent human study involving peripheral blood leukocytes phenotype analysis from healthy volunteers treated with tofacitinib. In this paper, changes were minor and reversible [28]. Similarly, baricitinib treatment in rheumatoid arthritis patients involved in phase III clinical trials showed similar minimal and reversible changes in lymphocytes subsets populations [29]. Most JAKi’s exhibit limited impact on lymphocyte populations due to their mechanism of action targeting intracellular signaling pathways rather than directly affecting cell surface receptors or differentiation pathways. The findings of this study provide evidence that ilunocitinib does not significantly alter immune cell populations at the therapeutic dose. This suggests a favorable safety profile regarding potential immune suppression, a concern often associated with immunomodulatory drugs.
Organ weight changes were minimal, not dose dependent or correlative with histopathological findings, thus, they were concluded to be of no biological relevance at the therapeutic dose. While recent studies showed that the JAK/STAT pathway is critical for metabolic organs such as adipose tissue, liver and pancreas [30], the study did not reveal any effect on main metabolic target organs, such as liver, kidney or primary lymphoid organs. Histopathology of all organs remained unremarkable with the
exception of the cutaneous changes noted. Liver function, as assessed by enzymes including alkaline phosphatase, alanine aminotransferase, and aspartate aminotransferase, remained unaffected. Biochemical markers such as plasma creatinine and urea levels, along with urinalysis, were within normal ranges for the treatment groups. The potential concerns of a treatment with an immunosuppressant leading to promote or exacerbate different organ damage has not been observed when using ilunocitinib at the recommended therapeutic dose and overdoses.
The blood sampling schedule for pharmacokinetic assessment was designed to monitor drug exposure, while avoiding interference with the evaluation of primary safety endpoints. To maximize systemic exposure, the tablets were administered while the dogs were fed, since there is an approximate
The inter-individual variability was generally low to moderate (
Exposure exhibited a near dose-proportional increase, and no significant differences were detected between sexes, indicating a consistent and predictable response to the drug across different doses and sexes. Altogether, the pharmacokinetic analysis confirmed that the dogs were consistently dosed and exposed to ilunocitinib, supporting conclusions regarding the product’s safety.
While the study provides insights into the safety of ilunocitinib in dogs at overdosing to identify a margin of safety, it was conducted in a controlled laboratory environment using a relatively small number of healthy Beagle dogs. Consequently, the findings may not fully represent the variability seen in a broader canine population under field conditions. Factors such as pre-existing health conditions, different breeds, and environmental influences can impact the drug’s safety profile in real-world settings. Three clinical studies have been conducted, to further support the safety and efficacy of ilunocitinib in diverse canine populations in Europe and in the United States [6-8].
Conclusions
indicate that ilunocitinib was well-tolerated in dogs at the therapeutic dose and even at doses up to five times higher, with no serious adverse effects or mortality observed.
The main clinical finding was a dose-dependent increase in interdigital cysts (IDC), an outcome consistent with the known JAKi class effect of increased susceptibility to localized infections. IDC could also be due to the type of flooring used in the testing facilities and were not observed when dogs were housed on cement and used corncob bedding. However, these lesions were generally mild and resolved by standard treatments. Additionally, papillomas, benign growths caused by the canine papillomavirus, were observed but are common in the general canine population and usually resolve spontaneously.
Ilunocitinib-related changes included mild decreases in red blood cell parameters and eosinophils in the high dose groups, consistent with the known pharmacodynamic effects of JAK inhibition, while the therapeutic dose group stayed within the normal range. No clinically relevant changes were seen in leucocytes cell populations, indicating limited effects on immune cell populations.
Overall, the results of this study suggest a favorable safety profile for ilunocitinib, supporting its chronic use in dogs.
| Abbreviations | |
| ANOVA | Analysis of variance |
| ARRIVE | Animal research reporting in vitro experiments |
| AUC | Area under the curve |
| AUCextra (%) | Portion of AUC that is extrapolated beyond the last measurable concentration to infinity |
| AUCinf | AUC from time zero to infinity |
| AUClast | AUC from time zero to the last measurable concentration |
| Cmax | Peak blood concentration |
| IDC | Interdigital cysts |
| JAK | Janus kinase |
| JAK/STAT | Janus kinase/signal transducer and activator of transcription |
| JAKi | Janus kinase inhibitor |
| MCH | Mean corpuscular hemoglobin |
| MCHC | Mean corpuscular hemoglobin concentration |
| RBC | Red blood cell count |
| RMANCOVA | Repeated measures analysis of covariance |
| T1/2 | Half-life |
| Tmax | Time to reach peak blood concentration |
| VICH | Veterinary international conference on harmonization |
Acknowledgements
Author contributions
Funding
Data availability
Declarations
Ethics approval and consent to participate
Consent for publication
Competing interests
Published online: 05 March 2025
References
- Linek M, Favrot C. Impact of canine atopic dermatitis on the health-related quality of life of affected dogs and quality of life of their owners. Vet Dermatol. 2010. https://doi.org/10.1111/j.1365-3164.2010.00899.x
- Favrot C, Fischer N, Olivry T, ZwickI L, Audergon S, Rostaher A. Atopic dermatitis in West Highland white terriers – part I: natural history of atopic dermatitis in the first three years of life. Vet Dermatol. 2020. https://doi.org/10.1111/vde. 12801
- Gross T, Ihrke PJ, Walder EJ, Affolter V. Skin diseases of the dog and cat: clinical and histopathologic diagnosis. Oxford: Blackwell Science; 2005. https://doi.or g/10.1002/9780470752487
- Clark JD, Flanagan ME, Telliez JB. Discovery and development of Janus kinase (JAK) inhibitors for inflammatory diseases. J Med Chem. 2014. https://doi.org/ 10.1021/jm401490p
- Drechsler Y, Dong C, Clark DE, Kaur G. Canine atopic dermatitis: prevalence, impact, and management strategies. Vet Med (Auckl). 2024. https://doi.org/1 0.2147/VMRR.S412570
- Virtanen AT, Haikarainen T, Raivola J, Silvennoinen O. Selective JAKinibs: prospects in inflammatory and autoimmune diseases. BioDrugs. 2019. https:/ /doi.org/10.1007/s40259-019-00333-w
- Forster S, Trout C, Despa S, Boegel A, Berger D, King S. Efficacy and field safety of ilunocitinib for the control of atopic dermatitis in client-owned dogs: a multicenter, masked, randomized, placebo-controlled clinical trial. Manuscript in preparation.
- Forster S, Trout C, Despa S, Boegel A, Berger D, King S. Efficacy and field safety of ilunocitinib for the control of allergic dermatitis in client-owned dogs: a multicenter, double-masked, randomized, placebo-controlled clinical trial. Manuscript in preparation.
- Forster S, Despa S, Trout C, King S. Comparative efficacy and safety of ilunocitinib and oclacitinib for the control of pruritus and associated skin lesions in dogs with atopic dermatitis. Manuscript submitted for publication.
- Veterinary International Conference on Harmonization (VICH). Guideline 43: Target Animal Safety for Veterinary Pharmaceutical Products. 2009. https://w ww.vichsec.org/en/guidelines/pharmaceuticals/pharma-safety/pharma-targ et-animal-safety.html. Accessed 29 Jul 2024.
- United States Food and Drug Administration. Code of Federal Regulations Title 21, Part 58, Good Laboratory Practice for nonclinical laboratory studies. 2016. https://www.ecfr.gov/current/title-21/chapter-I/subchapter-A/part-58. Accessed 29 Jul 2024.
- Organisation for Economic Cooperation and Development (OECD). Series on Principles of Good Laboratory Practice (GLP) and Compliance Monitoring. 1997. https://www.oecd-ilibrary.org/environment/oecd-series-on-principle s-of-good-laboratory-practice-and-compliance-monitoring_2077785x. https: //doi.org/10.1787/2077785x. Accessed 29 Jul 2024.
- Animal and Plant Health Inspection Service, Department of Agriculture. Code of Federal Regulations. 9 CFR Chapter I Subchapter. https://www.ecfr.gov/cur rent/title-9/chapter-l/subchapter-A. Accessed on 29 Jul 2024.
- National Research Council. Guide for the Care and Use of Laboratory animals. Washington, DC: National Academies; 1996. https://doi.org/10.17226/5140. Accessed on 29 Jul 2024.
- Kilkenny C, Browne WJ, Cuthill IC, Emerson M, Altman DG. Improving bioscience research reporting: the ARRIVE guidelines for reporting animal research. J Pharmacol Pharmacother. 2010. https://doi.org/10.4103/0976-500X. 72351
- Food and Drug Administration. Guidance for industry. Bioanalytical method validation. 2018. https://www.fda.gov/files/drugs/published/Bioanalytical-Me thod-Validation-Guidance-for-Industry.pdf. Accessed on 29 Jul 2024.
- European Medicines Agency. Guideline on bioanalytical method validation. EMEA/CHMP/EWP/192217/2009, 2011 Rev. 1 Corr. 2** superseded by the ICH guideline M10 on bioanalytical method validation and study sample analysis. 2022. https://www.ema.europa.eu/en/documents/scientific-guideline/guidel ine-bioanalytical-method-validation_en.pdf. Accessed on 29 Jul 2024.
- Cosgrove SB, Wren JA, Cleaver DM, Walsh KF, Follis SI, King VI, Tena JK, Stegemann MR. A blinded, randomized, placebo-controlled trial of the efficacy and safety of the Janus kinase inhibitor oclacitinib (Apoquel
) in client-owned dogs with atopic dermatitis. Vet Dermatol. 2013. https://doi.org/10.1111/vde. 12088 - Food and Drug Administration. Freedom of Information Summary: Original New Animal Drug Application NADA 141-585 (Zenrelia™ (ilunocitinib tablets)). https://animaldrugsatfda.fda.gov/adafda/app/search/public/document /downloadFoi/15865
- Mishra J, Verma RK, Alpini G, Meng F, Kumar N. Role of Janus Kinase 3 in predisposition to obesity-associated metabolic syndrome. J Biol Chem. 2015. https://doi.org/10.1074/jbc.M115.670331
- Collotta D, Hull W, Mastrocola R, Chiazza F, Cento AS, Murphy C, Verta R, Ferreira Alves G, Gaudioso G, Fava F, Yaqoob M, Aragno M, Tuohy K, Thiemermann C, Collino M. Baricitinib counteracts metaflammation, thus protecting against diet-induced metabolic abnormalities in mice. Mol Metabolism. 2020. https://doi.org/10.1016/j.molmet.2020.101009
- Kovacs MS, McKiernan S, Potter DM, Chilappagari. An epidemiological study of interdigital cysts in a research Beagle colony. Contemp Top Lab Anim Sci. 2005;44:17-21.
- Diagnosis. Interdigital cyst. Lab Anim. 2007. https://doi.org/10.1038/laban050 7-18
- Cosgrove SB, Cleaver DM, King VL, Gilmer AR, Daniels AE, Wren JA, et al. Longterm compassionate use of oclacitinib in dogs with atopic and allergic skin disease: safety, efficacy and quality of life. Vet Dermatol. 2015. https://doi.org/ 10.1111/vde. 12194
- Food and Drug Administration. Freedom of Information Summary: Original New Animal Drug Application NADA 141-345 (Apoquel (Oclacitinib Tablet)). https://animaldrugsatfda.fda.gov/adafda/app/search/public/document/dow nloadFoi/902. Accessed 29 Jul 2024.
- Kay J, Harigai M, Rancourt J, Dickson C, Melby T, Issa M, et al. Changes in selected haematological parameters associated with JAK1/JAK2 inhibition observed in patients with rheumatoid arthritis treated with baricitinib. RMD Open. 2020. https://doi.org/10.1136/rmdopen-2020-001370
- Fleischmann RM, Genovese MC, Enejosa JV, Mysler E, Bessette L, Peterfy C, et al. Safety and effectiveness of upadacitinib or adalimumab plus methotrexate in patients with rheumatoid arthritis over 48 weeks with switch to alternate therapy in patients with insufficient response. Ann Rheum Dis. 2019. https:// doi.org/10.1136/annrheumdis-2019-215764
- Weinhold KJ, Bukowski JF, Brennan TV, Noveck RJ, Staats JS, Lin L, et al. Reversibility of peripheral blood leukocyte phenotypic and functional changes after exposure to and withdrawal from tofacitinib, a Janus kinase inhibitor, in healthy volunteers. Clin Immunol. 2018. https://doi.org/10.1016/j.clim.2018.0 3.002
- Tanaka Y, McInnes IB, Taylor PC, Byers NL, Chen L, de Bono S, et al. Characterization and changes of lymphocyte subsets in baricitinib-treated patients with rheumatoid arthritis: an integrated analysis. Arthritis Rheumatol. 2018. ht tps://doi.org/10.1002/art. 40680
- Collotta D, Franchina MP, Carlucci V, Collino M. Recent advances in JAK inhibitors for the treatment of metabolic syndrome. Front Pharmacol. 2023. https:// doi.org/10.3389/fphar.2023.1245535
Publisher’s note
- *Correspondence:
Emmanuelle A. Kuntz emmanuelle.kuntz@elancoah.com
Elanco Animal Health, Mattenstrasse 24a, Basel 4058, Switzerland - Geometric means and (geometric CV%) except for (*) Tmax where the median and range (minimum-maximum) are given
**Cmax and AUC are dose normalized to
