DOI: https://doi.org/10.1038/s41565-023-01587-w
PMID: https://pubmed.ncbi.nlm.nih.gov/38225357
تاريخ النشر: 2024-01-15
شبكات الميكروإلكترود ثلاثية الأبعاد المعتمدة على المعادن السائلة المدمجة مع الأطراف الاصطناعية الشبكية الفائقة الرقة القابلة للزراعة لاستعادة البصر
تم القبول: 28 نوفمبر 2023
نُشر على الإنترنت: 15 يناير 2024
(ط) تحقق من التحديثات
الملخص
الأطراف الاصطناعية الشبكية الإلكترونية لتحفيز خلايا الشبكية تعد واعدة لاستعادة البصر. ومع ذلك، فإن الأقطاب الكهربائية الصلبة في الزرعات الشبكية التقليدية يمكن أن تسبب ضررًا على الأنسجة الرقيقة للشبكية. كما أن لديها انتقائية محدودة بسبب قربها السيئ من الخلايا المستهدفة في الشبكية المتدهورة. هنا نقدم شبكة اصطناعية ناعمة (سمك،
يمكن للخلايا العصبية الشبكية أن تولد إدراكات بصرية (فوسفين)
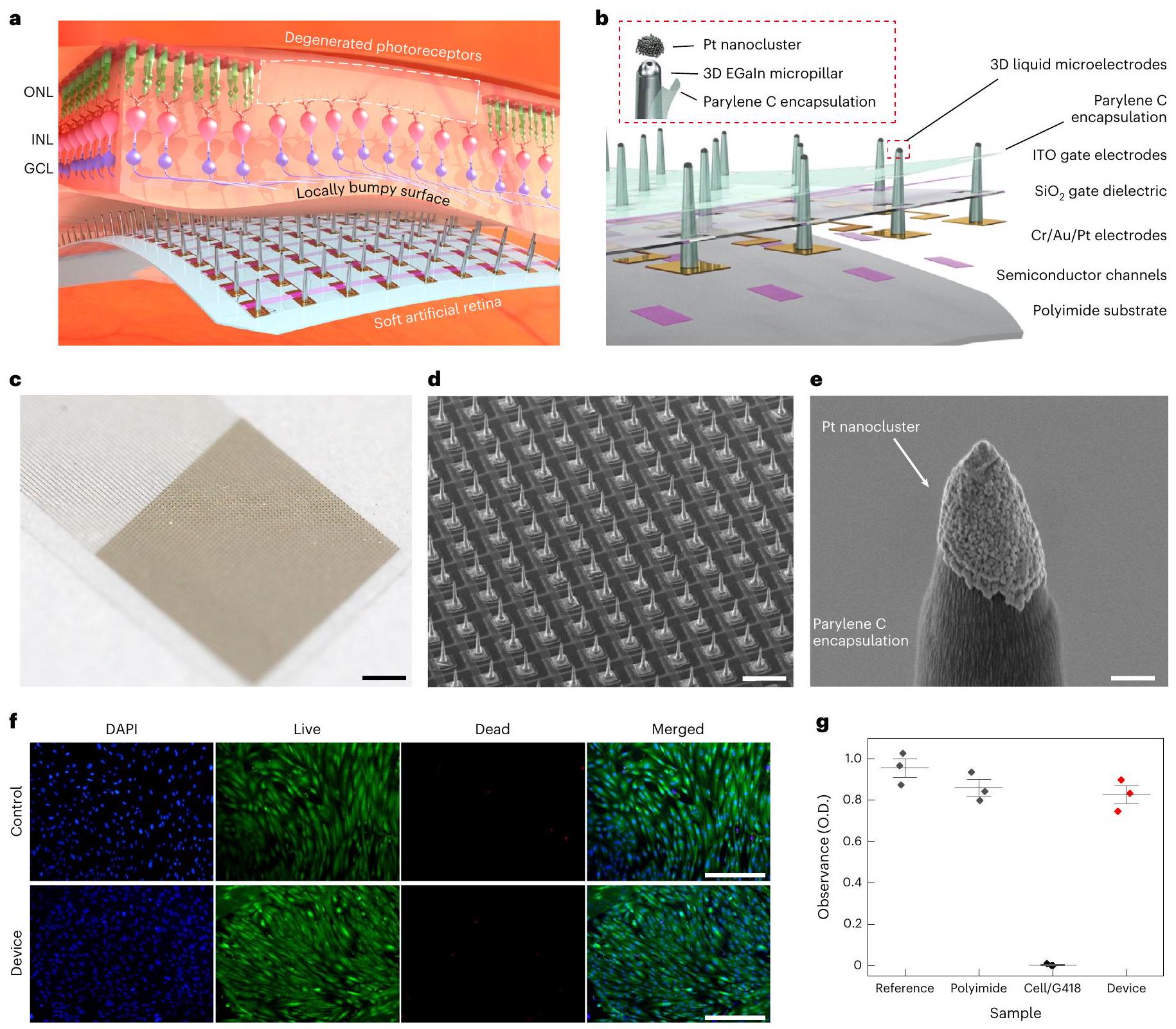
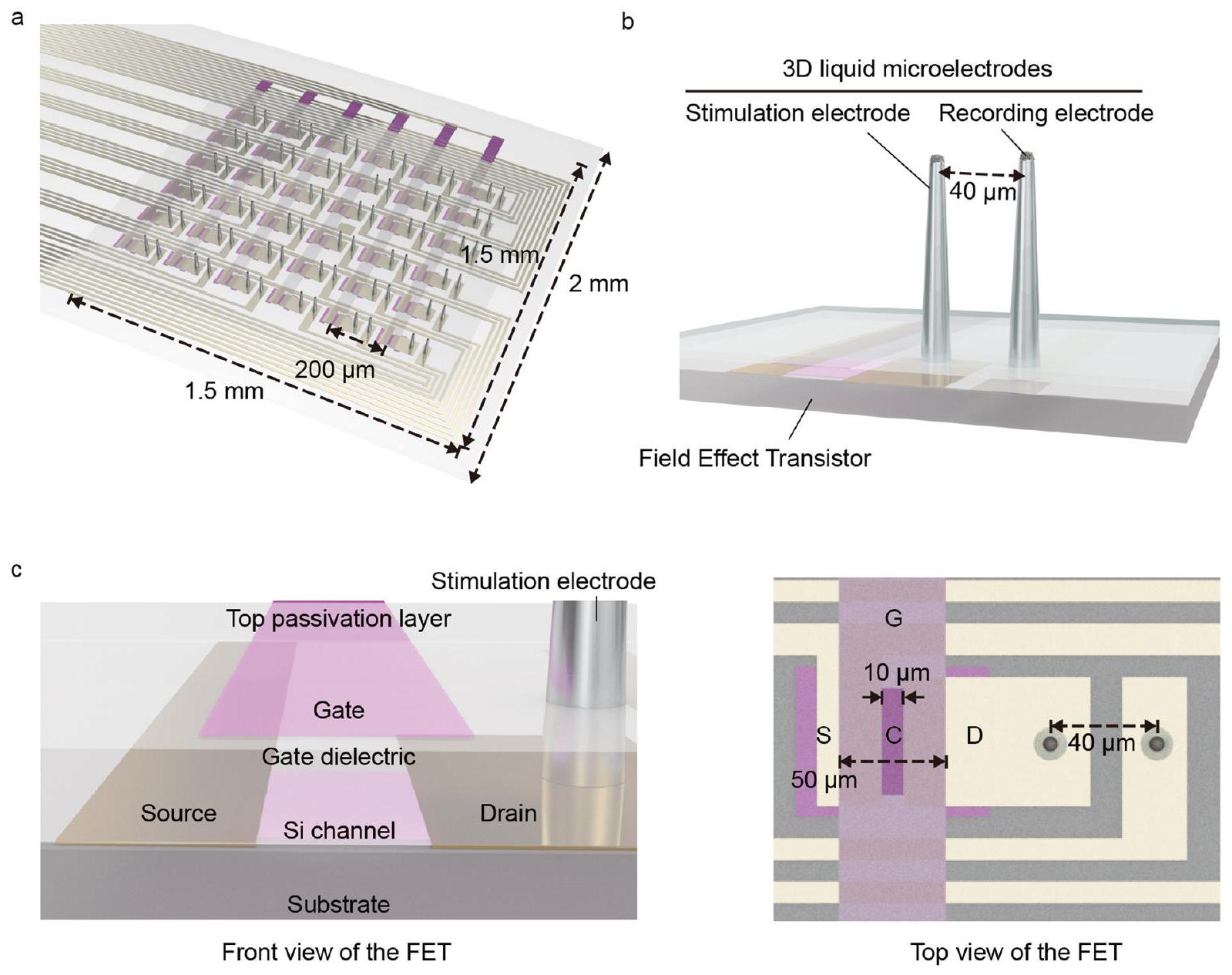
شبكية صناعية ناعمة مع مصفوفات ميكروإلكترود ثلاثية الأبعاد
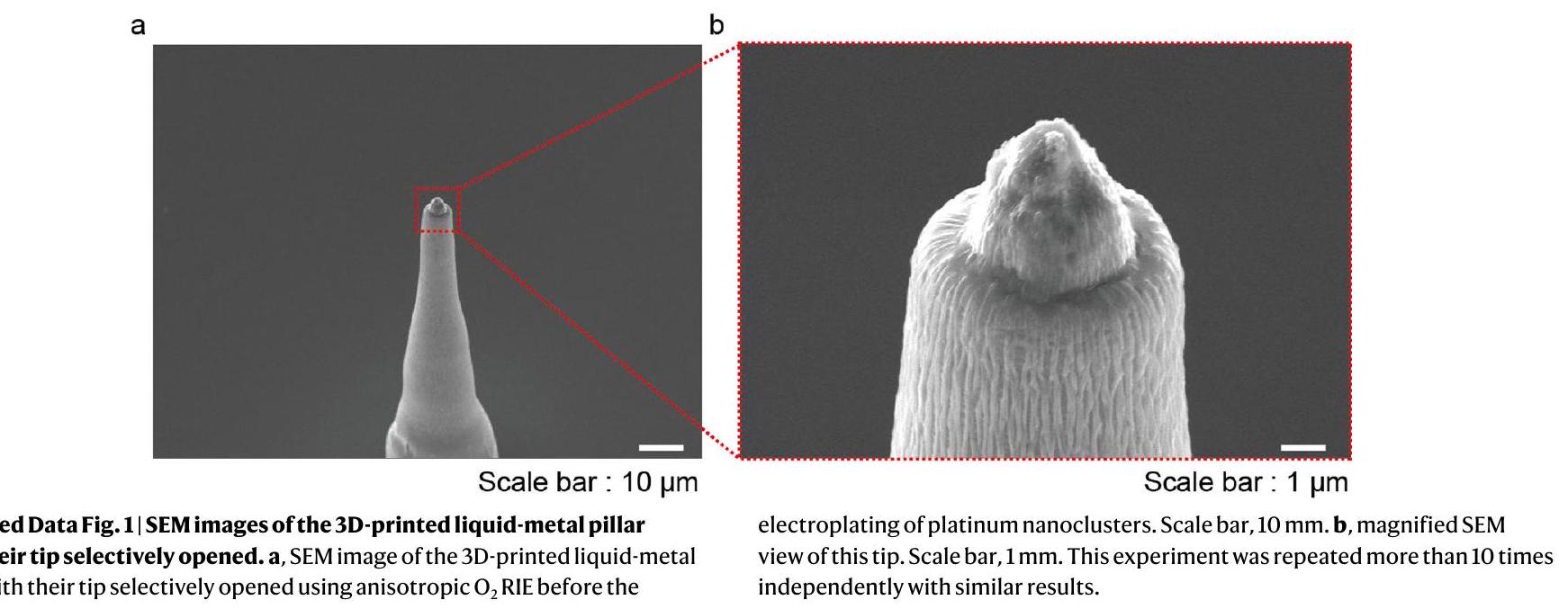
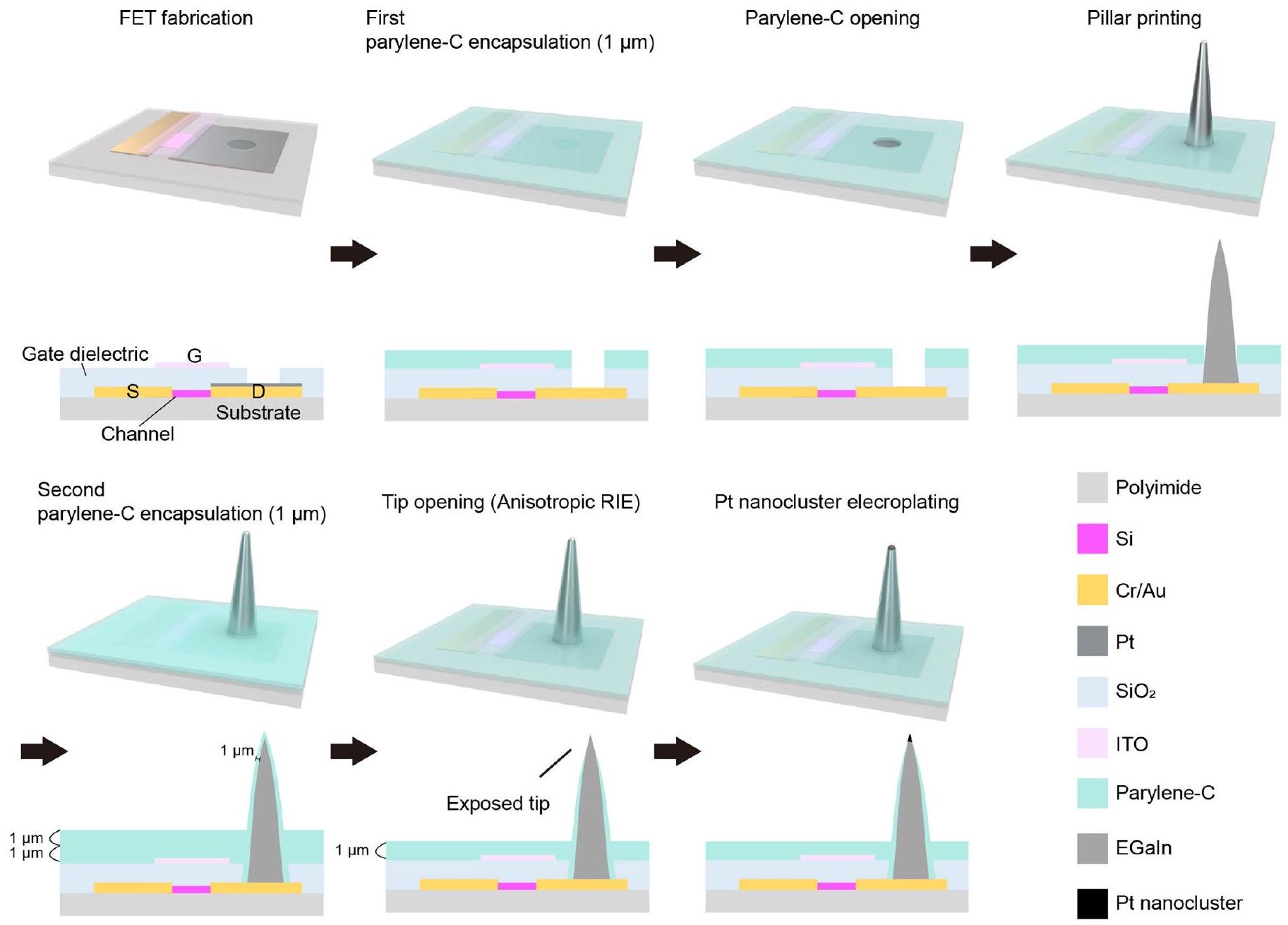
تخطيط الجهاز. تم طباعة مصفوفة الأعمدة الدقيقة ثلاثية الأبعاد EGaln مباشرة على أسطح أقطاب التصريف للترانزستورات الضوئية لتشكيل أقطاب التحفيز في درجة حرارة الغرفة. ثم تم تغليف جدران الأعمدة الجانبية بطبقة من باريلين C. تم فتح أطراف الأعمدة باستخدام تقنية غير متجانسة.
توصيفات الشبكية الاصطناعية اللينة
كانوا
(الشكل التوضيحي 15). المقاومة وسعة تخزين الشحن
تجارب كهربائية فيزيولوجية خارج الجسم
معالجة الإشارات باستخدام التعلم الآلي
استعادة الرؤية في الجسم الحي لفئران rd1 الحية
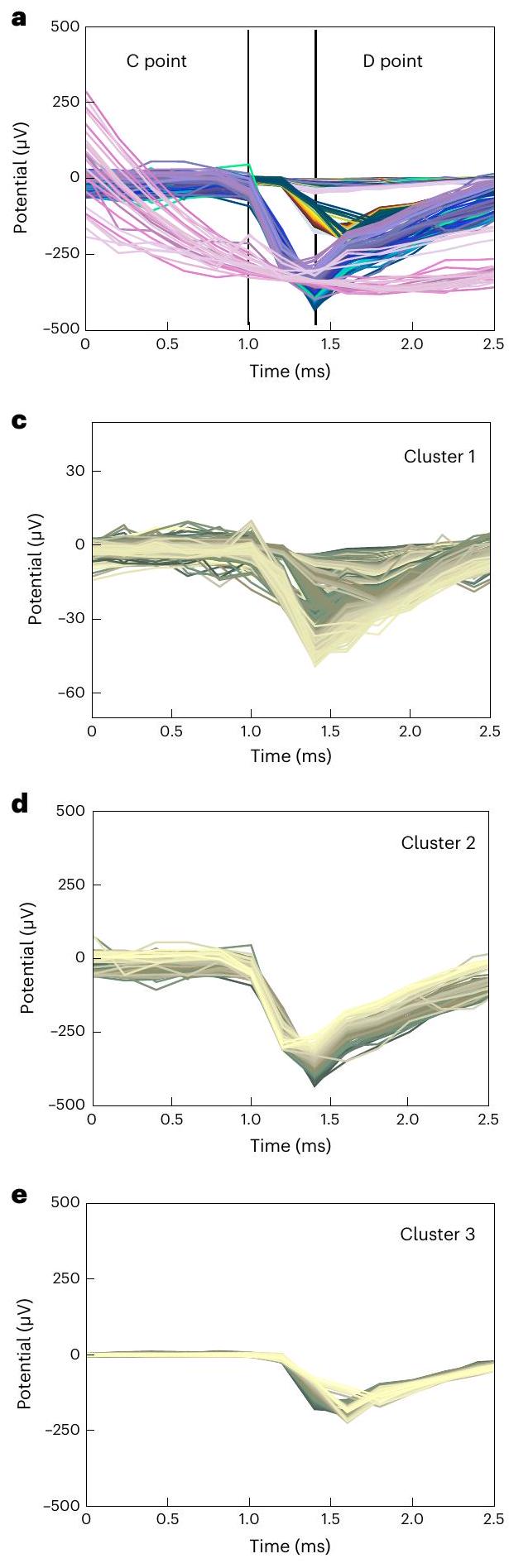

مصنفة كعنقود 2، مرتبة على أساس حجمها وشكلها (يسار)، ومتوسط نبضات خلايا العقدة الشبكية (RGC) للعنقود 2 (يمين). البيانات هي متوسط
أظهرت المنطقة المحلية المضيئة استجابات شبكية أكبر نسبيًا، مقارنةً بالمنطقة في الحالة المظلمة (الشكل 5g). عندما يتم تحفيز محاور خلايا العقدة الشبكية كهربائيًا، يمكن أن يحدث انتشار عكسي للتحفيزات الكهربائية، مما يؤدي إلى استجابة خاطئة لخلايا العقدة الشبكية في الظلام.
ومع ذلك، كانت التوزيعة المكانية لمعدلات إطلاق النار القصوى (أي، المجال الاستقبالي) مشابهة جدًا للشكل البيضاوي لهذا الإضاءة (الشكل 5h). أيضًا، تظهر نبضات خلايا الشبكية العقدية المرتبة (الشكل التوضيحي 24) شكل موجة نموذجي لاستجابة خلايا الشبكية العقدية الجسدية مشابهة.
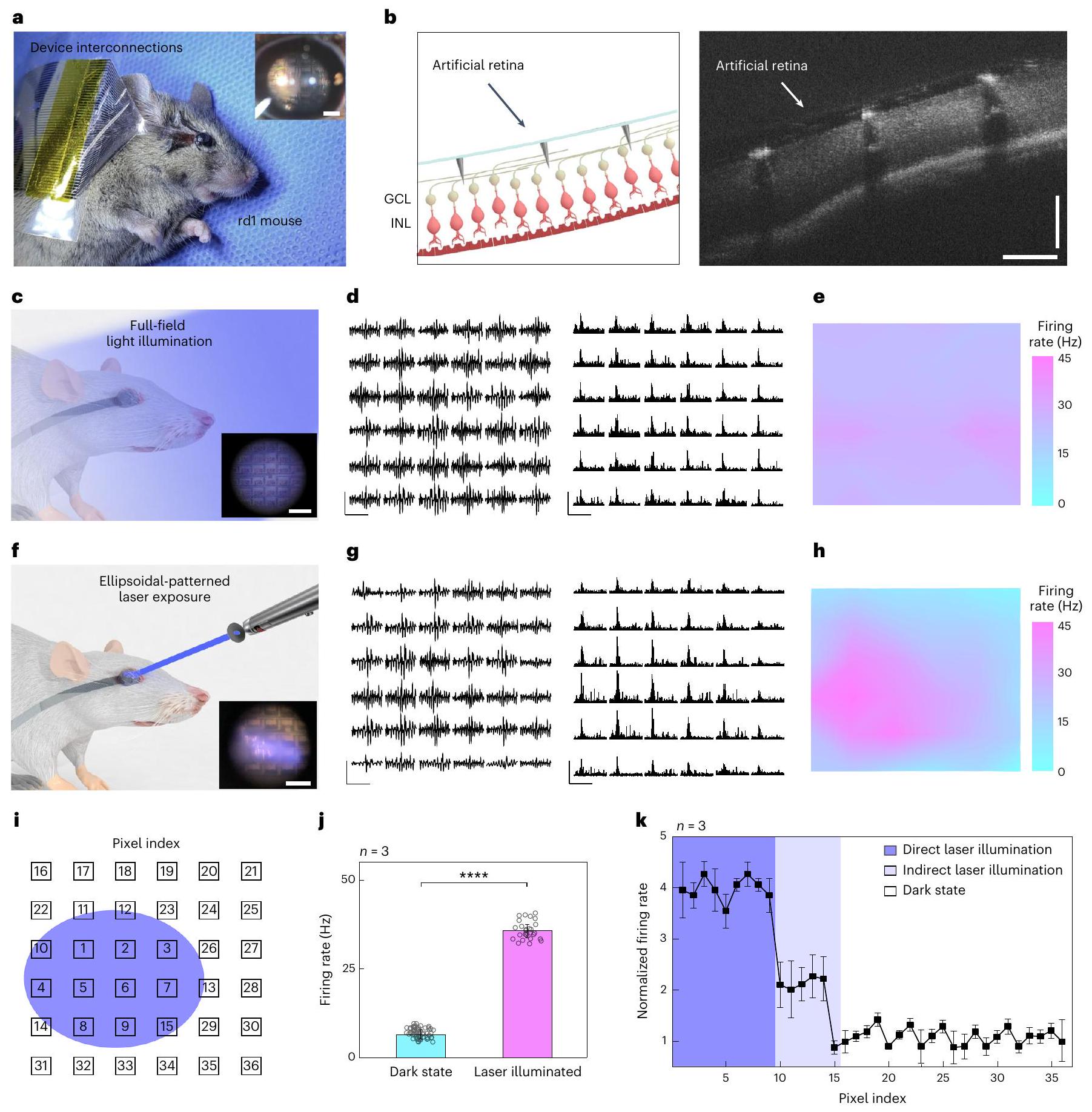
تعرض الليزر (طول الموجة، 415 نانومتر؛ الشدة،
لنتائج ex vivo (الشكل 4). لمقارنة الاستجابات الشبكية بشكل كمي في المنطقة المضيئة بالليزر والمنطقة غير المضيئة بالليزر (أي الحالة المظلمة)، تم وضع علامة على موقع كل إلكترود تسجيل (بكسل) كفهرس (الشكل 5i). ثم تم حساب متوسط معدلات الإطلاق القصوى المسجلة من البكسلات المضيئة بالكامل (الفهارس 1-9) والبكسلات في الحالة المظلمة (الفهارس 16-36). كانت نشاط خلايا العقدة الشبكية في المناطق المعرضة بالكامل أعلى بحوالي أربع مرات من نشاط خلايا العقدة الشبكية الخلفية.
الاستنتاجات
المحتوى عبر الإنترنت
References
- He, S., Dong, W., Deng, Q., Weng, S. & Sun, W. Seeing more clearly: recent advances in understanding retinal circuitry. Science 302, 408-411 (2003).
- Bloch, E., Luo, Y. & da Cruz, L. Advances in retinal prosthesis systems. Ther. Adv. Ophthalmol. 11, 2515841418817501 (2019).
- Lee, G. J., Choi, C., Kim, D.-H. & Song, Y. M. Bioinspired artificial eyes: optic components, digital cameras, and visual prostheses. Adv. Funct. Mater. 28, 1705202 (2018).
- Sahel, J.-A. et al. Partial recovery of visual function in a blind patient after optogenetic therapy. Nat. Med. 27, 1223-1229 (2021).
- Rao, Z. et al. Curvy, shape-adaptive imagers based on printed optoelectronic pixels with a kirigami design. Nat. Electron. 4, 513-521 (2021).
- Ko, H. C. et al. A hemispherical electronic eye camera based on compressible silicon optoelectronics. Nature 454, 748-753 (2008).
- Lorach, H. et al. Photovoltaic restoration of sight with high visual acuity. Nat. Med. 21, 476-482 (2015).
- Mathieson, K. et al. Photovoltaic retinal prosthesis with high pixel density. Nat. Photon. 6, 391-397 (2012).
- Tang, J. et al. Nanowire arrays restore vision in blind mice. Nat. Commun. 9, 786 (2018).
- Jang, J. et al. Implantation of electronic visual prosthesis for blindness restoration. Opt. Mater. Express 9, 3878-3894 (2019).
- Maya-Vetencourt, J. F. Subretinally injected semiconducting polymer nanoparticles rescue vision in a rat model of retinal dystrophy. Nat. Nanotechnol. 15, 30 (2020).
- Mandel, Y. et al. Cortical responses elicited by photovoltaic subretinal prostheses exhibit similarities to visually evoked potentials. Nat. Commun. 4, 1980 (2013).
- Sachs, H. G. & Gabel, V.-P. Retinal replacement-the development of microelectronic retinal prostheses-experience with subretinal implants and new aspects. Graefe’s Arch. Clin. Exp. Ophthalmol. 242, 717-723 (2004).
- Yue, L. et al. Ten-year follow-up of a blind patient chronically implanted with epiretinal prosthesis Argus I. Ophthalmology 122, 2545-2552.e1 (2015).
- Xie, H. et al. Monitoring cortical response and electrode-retina impedance under epiretinal stimulation in rats. IEEE Trans. Neural Syst. Rehabil. Eng. 29, 1178-1187 (2021).
- Lee, K.-W. et al. Pillar-shaped stimulus electrode array for high-efficiency stimulation of fully implantable epiretinal prosthesis. J. Micromech. Microeng. 22, 105015 (2012).
- Ahuja, A. K. et al. Factors affecting perceptual threshold in Argus II retinal prosthesis subjects. Trans. Vis. Sci. Technol. 2, 1 (2013).
- Ghani, N., Bansal, J., Naidu, A. & Chaudhary, K. M. Long term positional stability of the Argus II retinal prosthesis epiretinal implant. BMC Ophthalmol. 23, 70 (2023).
- Palanker, D., Vankov, A., Huie, P. & Baccus, S. Design of a high-resolution optoelectronic retinal prosthesis. J. Neural Eng. 2, S105-S120 (2005).
- Flores, T. et al. Optimization of pillar electrodes in subretinal prosthesis for enhanced proximity to target neurons. J. Neural Eng. 15, 036011 (2018).
- Esler, T. B. et al. Minimizing activation of overlying axons with epiretinal stimulation: the role of fiber orientation and electrode configuration. PLoS ONE 13, e0193598 (2018).
- Todorova, M. G., Scholl, H. P. N. & della Volpe Waizel, M. The impact of macular edema on microvascular and metabolic alterations in retinitis pigmentosa. Graefe’s Arch. Clin. Exp. Ophthalmol. 259, 643-652 (2021).
- Choi, C. et al. Human eye-inspired soft optoelectronic device using high-density
-graphene curved image sensor array. Nat. Commun. 8, 1664 (2017). - Seo, H. W. et al. A 3D flexible microelectrode array for subretinal stimulation. J. Neural Eng. 16, 056016 (2019).
- Cho, Y. H., Park, Y.-G., Kim, S. & Park, J.-U. 3D electrodes for bioelectronics. Adv. Mater. 33, 2005805 (2021).
- Ho, E. et al. Characteristics of prosthetic vision in rats with subretinal flat and pillar electrode arrays. J. Neural Eng. 16, 066027 (2019).
- Kim, E. et al. Fabrication of pillar shaped electrode arrays for artificial retinal implants. Sensors 8, 5845-5856 (2008).
- Park, Y.-G. et al. Liquid metal-based soft electronics for wearable healthcare. Adv. Healthc. Mater. 10, 2002280 (2021).
- Park, Y.-G. et al. Three-dimensional, high-resolution printing of carbon nanotube/liquid metal composites with mechanical and electrical reinforcement. Nano Lett. 19, 4866-4872 (2019).
- Yun, I. et al. Transferable transparent electrodes of liquid metals for bifacial perovskite solar cells and heaters. Nano Energy 93, 106857 (2022).
- Dickey, M. D. Stretchable and soft electronics using liquid metals. Adv. Mater. 29, 1606425 (2017).
- Park, Y.-G., An, H. S., Kim, J.-Y. & Park, J.-U. High-resolution, reconfigurable printing of liquid metals with three-dimensional structures. Sci. Adv. 5, eaaw2844 (2019).
- An, H. S. et al. High-resolution 3D printing of freeform, transparent displays in ambient air. Adv. Sci. 6, 1901603 (2019).
- Jang, J. et al. Human-interactive, active-matrix displays for visualization of tactile pressures. Adv. Mater. Technol. 4, 1900082 (2019).
- Kim, J. et al. Highly transparent and stretchable field-effect transistor sensors using graphene-nanowire hybrid nanostructures. Adv. Mater. 27, 3292-3297 (2015).
- Chen, S. et al. Toxicity and biocompatibility of liquid metals. Adv. Healthc. Mater. 12, 2201924 (2023).
- Yanovitch, L., Raz-Prag, D. & Hanein, Y. A new high-resolution three-dimensional retinal implant: system design and preliminary human results. Preprint at bioRxiv https://doi. org/10.1101/2022.09.14.507901 (2022).
- Jones, I. L., Warner, M. & Stevens, J. D. Mathematical modelling of the elastic properties of retina: a determination of Young’s modulus. Eye 6, 556-559 (1992).
- Shin, H. et al. Recent progress on wearable point-of-care devices for ocular systems. Lab Chip 21, 1269-1286 (2021).
- Mahadevappa, M. et al. Perceptual thresholds and electrode impedance in three retinal prosthesis subjects. IEEE Trans. Neural Syst. Rehabil. Eng. 13, 201-206 (2005).
- ISO 10993-5:2009. Biological Evaluation of Medical Devices. Part 5: Tests for In Vitro Cytotoxicity (International Organization for Standardization, 2009).
- Jacobs, G. H., Williams, G. A., Cahill, H. & Nathans, J. Emergence of novel color vision in mice engineered to express a human cone photopigment. Science 315, 1723-1725 (2007).
- Abballe, L. & Asari, H. Natural image statistics for mouse vision. PLoS ONE 17, e0262763 (2022).
- O’Hearn, T. M. et al. Electrical stimulation in normal and retinal degeneration (rd1) isolated mouse retina. Vis. Res. 46, 3198-3204 (2006).
- Saboo, K. V. et al. Unsupervised machine-learning classification of electrophysiologically active electrodes during human cognitive task performance. Sci. Rep. 9, 17390 (2019).
- Nielsen, F. Introduction to HPC with MPI for Data Science (Springer International Publishing, 2016).
- Hartigan, J. A. Clustering Algorithms (Wiley, 1975).
- Rousseeuw, P. & Rousseeuw, P. J. Silhouettes: a graphical aid to the interpretation and validation of cluster analysis. J. Comput. Appl. Math. 20, 53-65 (1987).
- Bholowalia, P. & Kumar, A. EBK-means: a clustering technique based on elbow method and K-means in WSN. Int. J. Comput. Appl. 105, 17-24 (2014).
- Li, P. H. et al. Anatomical identification of extracellularly recorded cells in large-scale multielectrode recordings. J. Neurosci. 35, 4663-4675 (2015).
© The Author(s) 2024
طرق
تصنيع مصفوفات الفوتوترانزستور للشبكية الاصطناعية
تصنيع أقطاب ميكرو كهربائية ثلاثية الأبعاد من LM
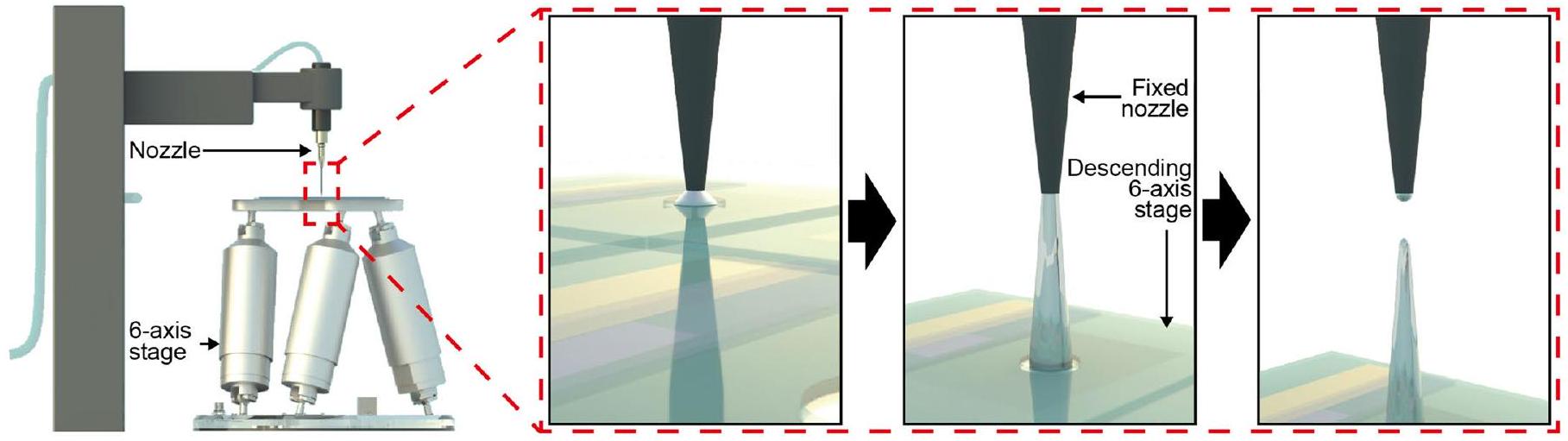
(1) الطباعة المباشرة لأقطاب EGaln ثلاثية الأبعاد النقية: يتكون نظام الطباعة المباشرة من فوهة شعرية متصلة بخزان حبر؛ جهاز تحكم في الضغط الهوائي ومرحلة ذات ستة محاور مع حركات تلقائية في
تم تطبيقه لتوصيل حبر EGaIn (75.5% غاليوم و24.5% إنديوم سبائك بالوزن؛ مواد تشانغشا سانتيك) من خزان إلى الركيزة من خلال الفوهة. بعد أن قمنا بالتحكم في
(2) الفتح الانتقائي لقمم الأقطاب الكهربائية ثلاثية الأبعاد: بعد طباعة أقطاب EGaln ثلاثية الأبعاد النقية، يتم إضافة طبقة من باريلين C (السماكة،
(3) ترسيب نانوكلاسترز البلاتين: لتحضير 50 مل من محلول الطلاء الكهربائي، قمنا بخلط 50 مل من الماء المقطر، و10 ملغ من خلات الرصاص ثلاثي الهيدرات (سيغما-ألدريتش) و0.5 غرام من رباعي كلوريد البلاتين (سيغما-ألدريتش) في درجة حرارة الغرفة. تم تحريك هذا المحلول الكهربائي لمدة 20 دقيقة بواسطة الاهتزاز فوق الصوتي. تم إجراء الطلاء الكهربائي من خلال نقل الأيونات بين الكاثود والأنود في محلول الطلاء الكهربائي للبلاتين. بعد تثبيت الجهاز على واجهة تسجيل متعددة القنوات (MZ-60، تكر-دايفس تكنولوجيز)، تم استخدام كاثود (القطب الكهربائي ثلاثي الأبعاد EGaIn النقي الذي سيتم طلاؤه كهربائيًا) وأنود (
(3) عملية شطف الشبكية الاصطناعية: قبل زراعة الجهاز، قمنا بشطف الشبكية الاصطناعية عن طريق غمر الجهاز برفق في
تجارب حيوانية خارج الجسم
نقطة انصهار EGaln،
زراعة داخل الجسم
تجارب حيوانية داخل الجسم
تم الحصول على إشارة الذروة ومعدل الإطلاق وتصديرها بواسطة برنامج التحليل (Synapse Suite الإصدار 94، تقنيات تاكر-دايف). ثم تم معالجة البيانات ورسمها باستخدام برنامج MATLAB R2021a (MathWorks) وبرنامج Origin 2022b. تم تطبيق إضاءة ضوئية كاملة المجال (470 نانومتر، TouchBright T1 مع فلتر تمرير نطاق BN470، جهاز Live Cell) أو ليزر (طول الموجة، 415 نانومتر) من خلال نمط إهليلجي لقناع الظل على قاع عين الفأر للتعرض للضوء (المدة، 5 ثوانٍ). لم يتم استبعاد أي نقاط بيانات من التحليلات. كما أن البيانات استوفت افتراضات الاختبارات الإحصائية المستخدمة.
التحليل الإحصائي
ملخص التقرير
توفر البيانات
توفر الشيفرة
شكر وتقدير
مساهمات المؤلفين
المصالح المتنافسة
معلومات إضافية
https://doi.org/10.1038/s41565-023-01587-w.


محفظة الطبيعة
آخر تحديث من المؤلف(ين): 22 نوفمبر 2023
ملخص التقرير
الإحصائيات
تم التأكيد
يجب أن تُوصف الاختبارات الشائعة فقط بالاسم؛ واصفًا التقنيات الأكثر تعقيدًا في قسم الطرق.
لتحليل بايزي، معلومات حول اختيار القيم الأولية وإعدادات سلسلة ماركوف مونت كارلو
للتصاميم الهرمية والمعقدة، تحديد المستوى المناسب للاختبارات والتقارير الكاملة عن النتائج
تقديرات أحجام التأثير (مثل حجم تأثير كوهين)
تحتوي مجموعتنا على الإنترنت حول الإحصائيات لعلماء الأحياء على مقالات تتناول العديد من النقاط المذكورة أعلاه.
البرمجيات والشيفرة
معلومات السياسة حول توفر كود الكمبيوتر
جمع البيانات
مايكروسوفت إكسل 2022
تحليل البيانات
أوريجن برو 2022ب (أوريجن لاب)
بالنسبة للمخطوطات التي تستخدم خوارزميات أو برامج مخصصة تكون مركزية في البحث ولكن لم يتم وصفها بعد في الأدبيات المنشورة، يجب أن تكون البرمجيات متاحة للمحررين والمراجعين. نحن نشجع بشدة على إيداع الشيفرة في مستودع مجتمعي (مثل GitHub). راجع إرشادات مجموعة Nature لتقديم الشيفرة والبرمجيات لمزيد من المعلومات.
معلومات السياسة حول توفر البيانات
- رموز الانضمام، معرفات فريدة، أو روابط ويب لمجموعات البيانات المتاحة للجمهور
- وصف لأي قيود على توفر البيانات
- بالنسبة لمجموعات البيانات السريرية أو بيانات الطرف الثالث، يرجى التأكد من أن البيان يتماشى مع سياستنا
رموز البرمجة المخصصة لـ MATLAB المستخدمة في هذه الدراسة والوصول إلى بياناتنا الخام متاحة من المؤلفين المقابلين عند الطلب المعقول.
مشاركون في الأبحاث البشرية
| التقارير عن الجنس والنوع الاجتماعي | استخدم مصطلحي الجنس (صفة بيولوجية) والنوع الاجتماعي (المتأثر بالظروف الاجتماعية والثقافية) بعناية لتجنب الخلط بين المصطلحين. أشر إلى ما إذا كانت النتائج تنطبق على جنس أو نوع اجتماعي واحد فقط؛ وصف ما إذا كان الجنس والنوع الاجتماعي قد تم أخذهما في الاعتبار في تصميم الدراسة، وما إذا كان الجنس و/أو النوع الاجتماعي قد تم تحديده بناءً على الإبلاغ الذاتي أو التعيين والأساليب المستخدمة. قدم في بيانات المصدر بيانات مفصلة عن الجنس والنوع الاجتماعي حيثما تم جمع هذه المعلومات، وتم الحصول على موافقة لمشاركة بيانات الأفراد؛ قدم الأرقام الإجمالية في ملخص التقرير هذا. يرجى الإشارة إذا لم يتم جمع هذه المعلومات. أبلغ عن التحليلات المستندة إلى الجنس والنوع الاجتماعي حيثما تم إجراؤها، وقدم مبررات لعدم وجود تحليل مستند إلى الجنس والنوع الاجتماعي. |
| خصائص السكان | وصف الخصائص السكانية ذات الصلة بالمتغيرات للباحثين المشاركين في الدراسة (مثل العمر، المعلومات الجينية، التشخيصات والعلاجات السابقة والحالية). إذا كنت قد قمت بملء أسئلة تصميم الدراسة في العلوم السلوكية والاجتماعية وليس لديك ما تضيفه هنا، اكتب “انظر أعلاه.” |
| التوظيف | وصف كيفية تجنيد المشاركين. تحديد أي انحياز محتمل للاختيار الذاتي أو أي انحيازات أخرى قد تكون موجودة وكيف من المحتمل أن تؤثر هذه على النتائج. |
| رقابة الأخلاقيات | حدد المنظمة (المنظمات) التي وافقت على بروتوكول الدراسة. |
التقارير المتخصصة في المجال
علوم الحياة العلوم السلوكية والاجتماعية العلوم البيئية والتطورية والبيئية
لنسخة مرجعية من الوثيقة بجميع الأقسام، انظرnature.com/documents/nr-reporting-summary-flat.pdf
تصميم دراسة العلوم الحياتية
| حجم العينة | تم اختيار عدد كافٍ من الحيوانات لإجراء التحليل الإحصائي. | ||
| استثناءات البيانات |
|
||
| التكرار |
|
||
| التوزيع العشوائي |
|
||
| عمى |
|
التقارير عن مواد وأنظمة وطرق محددة
| المواد والأنظمة التجريبية | طرق | ||
| غير متوفر | مشارك في الدراسة | غير متوفر | مشارك في الدراسة |
 |
أجسام مضادة X |  |
تسلسل شريحة الكروماتين |
 |
خطوط خلايا حقيقية النواة |  |
تدفق الخلايا |
 |
علم الحفريات وعلم الآثار |  |
 |
 |
|||
 |
 |
||
 |
البحث ذو الاستخدام المزدوج الذي يثير القلق | ||
الأجسام المضادة
| الأجسام المضادة المستخدمة |
|
||||||||
| التحقق |
|
خطوط خلايا حقيقية النواة
معلومات السياسة حول خطوط الخلايا والجنس والنوع في البحث
الخطوط التي يتم التعرف عليها بشكل خاطئ بشكل شائع (انظر سجل ICLAC)
الحيوانات وغيرها من الكائنات البحثية
| الحيوانات المخبرية | فئران النوع البري: ذكور، C57BL/6J، عمرها 8 أسابيع؛ فئران Rd1: ذكور، C3H، عمرها 8 أسابيع | ||
| الحيوانات البرية | غير متوفر | ||
| التقارير عن الجنس |
|
||
| عينات تم جمعها من الميدان |
|
||
| رقابة الأخلاقيات | تم إجراء جميع الإجراءات التجريبية على الحيوانات بناءً على الإرشادات وتمت الموافقة عليها من قبل لجنة رعاية واستخدام الحيوانات في جامعة يونسي. |
تدفق الخلايا
المؤامرات
توضح تسميات المحاور العلامة والفلوركروم المستخدم (مثل CD4-FITC).
المقاييس على المحاور واضحة تمامًا. قم بتضمين الأرقام على المحاور فقط للرسم البياني في أسفل اليسار من المجموعة (المجموعة هي تحليل للعلامات المتطابقة).
جميع الرسوم البيانية هي رسوم بيانية متساوية الارتفاع مع نقاط شاذة أو رسوم بيانية بالألوان الزائفة.
تم توفير قيمة عددية لعدد الخلايا أو النسبة المئوية (مع الإحصائيات).
المنهجية
تحضير العينة
تم إجراء تحليل تدفق الخلايا باستخدام جهاز BD FACS Verse II (بيكتون ديكنسون وشركاه)
تم الحصول على البيانات في برنامج BD FACSuite وتم تحليلها في برنامج FlowJo.
لتحليل، تم تسجيل 10,000 خلية من كل عينة.
تم تصنيف الخلايا أولاً لاستبعاد الحطام (باستخدام FSC-A مقابل SSC-A)، ثم تم تصنيفها للخلايا الفردية (باستخدام FSC-H مقابل FSC-W و SSC-H مقابل SSC-W، بالتتابع). تم إعداد التصنيف لاستخدام المرجع والسيطرة الإيجابية (الخلايا المعالجة بالبوروميسين) (سلبي PI مقابل إيجابي PI وسلبي FITC مقابل إيجابي FITC، على التوالي).
- تظهر قائمة كاملة بالانتماءات في نهاية الورقة.
البريد الإلكتروني: seunggeol.lee@pusan.ac.kr; shbyeon@yuhs.ac; jang-ung@yonsei.ac.kr - f، EEPs لشبكية عين الفأر rd1 تحت تعرض للضوء (470 نانومتر) مع كثافات مختلفة أثناء تشغيل الشبكية الاصطناعية باستخدام أقطاب تحفيز من نوع السطح المسطح. g، معدلات إطلاق EEPs كدالة لكثافات الضوء المضيء لشبكية عين الفأر WT و rd1. البيانات هي متوسط.
س.د. مع فئران مستقلة بيولوجياً. EEP للقرنية في الفأر WT تحت تعرض للضوء (470 نانومتر) خلال تشغيل الشبكية الاصطناعية مع ارتفاعات مختلفة من الميكروإلكترود 3D LM. i، EEP للقرنية في الفأر rd1 تحت تعرض للضوء (470 نانومتر) خلال تشغيل الشبكية الاصطناعية مع ارتفاعات مختلفة من الميكروإلكترود 3D LM. j، معدلات إطلاق النبضات المحفزة من خلايا RGC كدالة لارتفاعات ميكروإلكترودات 3D LM لفأر WT و rd1. البيانات هي متوسط س.د. مع فئران مستقلة بيولوجياً. قسم علوم المواد والهندسة، جامعة يونسي، سيول، جمهورية كوريا. مركز النانوميديسين، معهد العلوم الأساسية (IBS)، سيول، جمهورية كوريا. برنامج الدراسات العليا في هندسة النانو الطبية (NanoBME)، معهد العلوم المتقدمة، جامعة يونسي، سيول، جمهورية كوريا. معهد أبحاث الرؤية، قسم طب العيون، مستشفى سيفيرانس للعيون، كلية الطب بجامعة يونسي، سيول، جمهورية كوريا. مشروع دماغ كوريا 21 للعلوم الطبية، كلية الطب بجامعة يونسي، سيول، جمهورية كوريا. كلية الهندسة الكيميائية، جامعة بوسان الوطنية، بوسان، جمهورية كوريا. معهد أبحاث الرؤية، قسم طب العيون، مستشفى جانغنام سيفيرانس، كلية الطب بجامعة يونسي، سيول، جمهورية كوريا. قسم علوم وهندسة المواد العضوية، جامعة بوسان الوطنية، بوسان، جمهورية كوريا. قسم جراحة الأعصاب، كلية الطب بجامعة يونسي، سيول، جمهورية كوريا. ساهم هؤلاء المؤلفون بالتساوي: وون جي تشونغ، جيوك جانغ، جانغ كوي، سانغ هون لي. البريد الإلكتروني: seunggeol.lee@pusan.ac.kr; shbyeon@yuhs.ac; jang-ung@yonsei.ac.kr - يرجى ملاحظة أنه يجب أيضًا تقديم معلومات كاملة حول الموافقة على بروتوكول الدراسة في المخطوطة.
DOI: https://doi.org/10.1038/s41565-023-01587-w
PMID: https://pubmed.ncbi.nlm.nih.gov/38225357
Publication Date: 2024-01-15
Liquid-metal-based three-dimensional microelectrode arrays integrated with implantable ultrathin retinal prosthesis for vision restoration
Accepted: 28 November 2023
Published online: 15 January 2024
(i) Check for updates
Abstract
Electronic retinal prostheses for stimulating retinal neurons are promising for vision restoration. However, the rigid electrodes of conventional retinal implants can inflict damage on the soft retina tissue. They also have limited selectivity due to their poor proximity to target cells in the degenerative retina. Here we present a soft artificial retina (thickness,
retinal neurons can generate visual perceptions (phosphene)
Soft artificial retina with 3D LM microelectrode arrays
the device layout. The 3D EGaln micropillar array was directly printed on the drain electrode surfaces of the phototransistors to form the stimulation electrodes at room temperature. Then, the pillars’ sidewalls were encapsulated by the parylene C layer. The pillars’ tips were opened using anisotropic
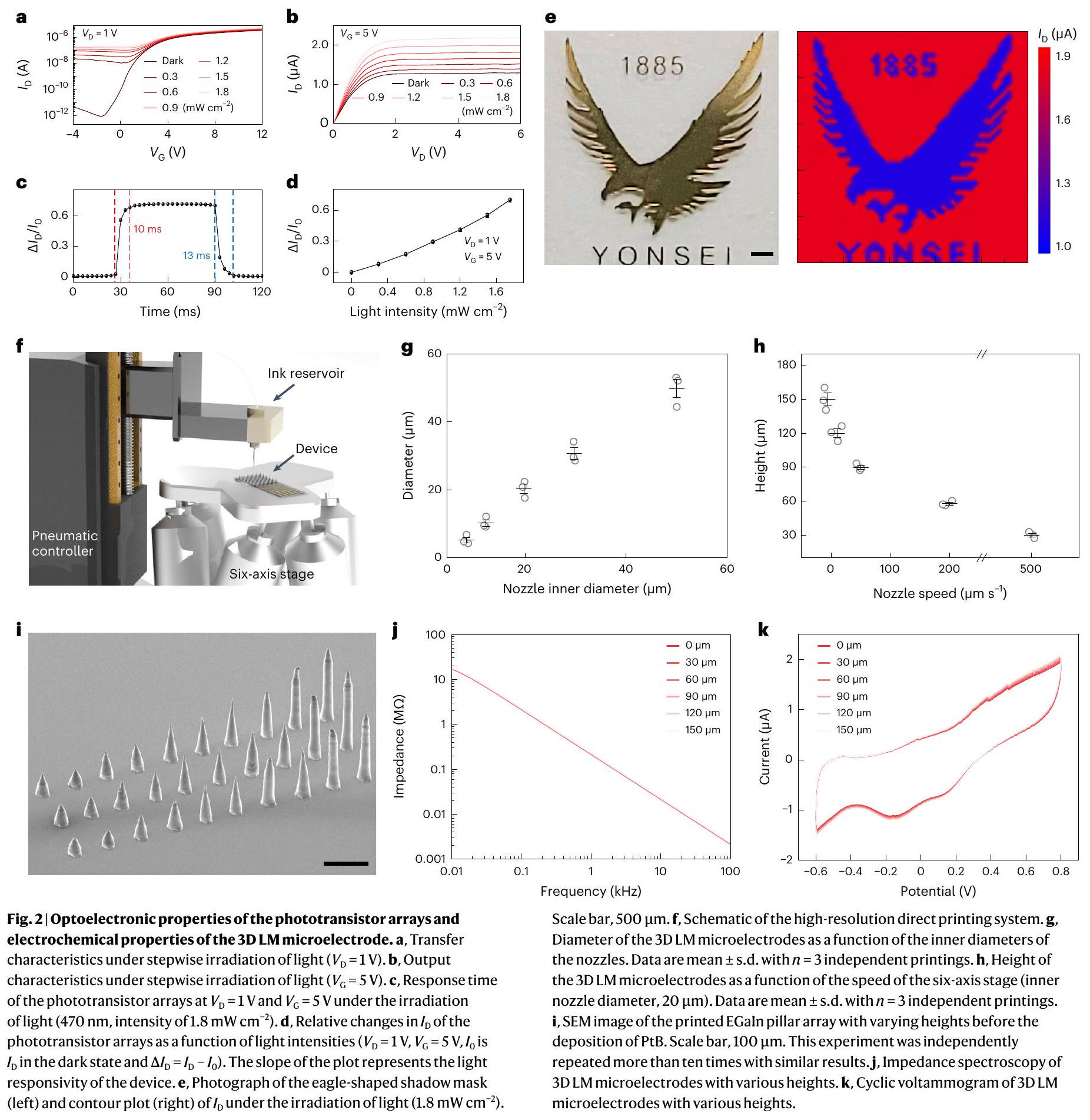
Characterizations of the soft artificial retina

were

(Supplementary Fig. 15). The impedance and charge storage capacity (
Ex vivo electrophysiological experiments
Signal processing using machine learning
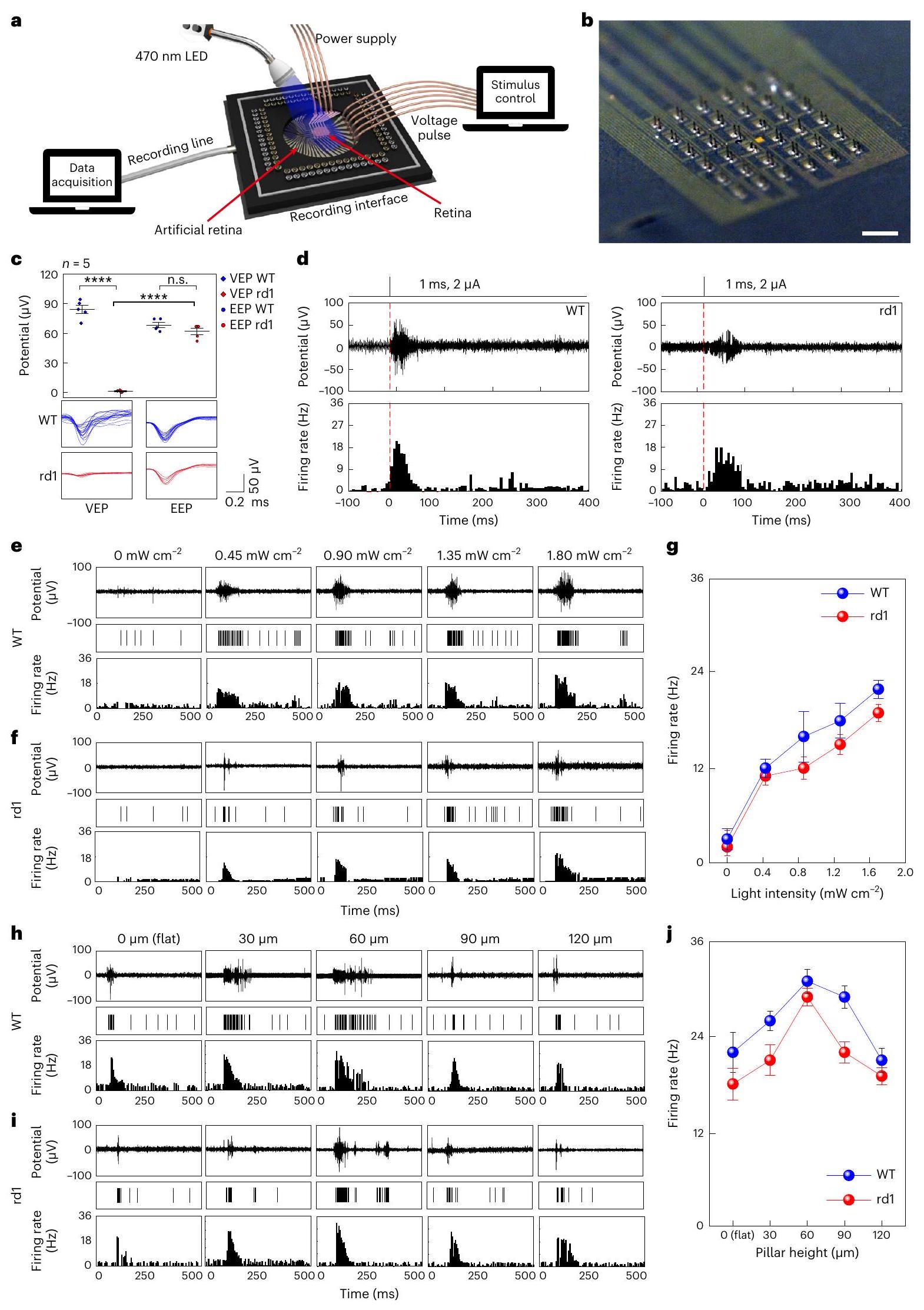
In vivo vision restoration of live rd1 mice



classified as cluster 2, sorted on the basis of their magnitude and shape (left), and their mean RGC spikes of cluster 2 (right). Data are mean
light-illuminated local area exhibited relatively larger retinal responses, compared with the area in the dark state (Fig.5g). When the RGC axons are electrically stimulated, the antidromic propagation of electrical stimuli can occur, leading to the misguided RGC response in the dark
state. However, the spatial distribution on the maximum firing rates (that is, the receptive field) was very similar to the ellipsoidal shape of this illumination (Fig. 5h). Also, the sorted RGC spikes (Supplementary Fig. 24) show a typical waveform of the somatic RGC response similar

laser exposure (wavelength, 415 nm ; intensity,
to the ex vivo results (Fig. 4). To quantitatively compare the retinal responses in the laser-illuminated and laser-unilluminated area (that is, the dark state), the position of each recording electrode (pixel) was marked as an index (Fig. 5i). Then, the maximum firing rates recorded from the fully illuminated pixels (indexes 1-9) and the dark-state pixels (indexes 16-36) were averaged. The RGC activity in the fully exposed areas was approximately fourfold higher than the background RGC activity.
Conclusions
Online content
References
- He, S., Dong, W., Deng, Q., Weng, S. & Sun, W. Seeing more clearly: recent advances in understanding retinal circuitry. Science 302, 408-411 (2003).
- Bloch, E., Luo, Y. & da Cruz, L. Advances in retinal prosthesis systems. Ther. Adv. Ophthalmol. 11, 2515841418817501 (2019).
- Lee, G. J., Choi, C., Kim, D.-H. & Song, Y. M. Bioinspired artificial eyes: optic components, digital cameras, and visual prostheses. Adv. Funct. Mater. 28, 1705202 (2018).
- Sahel, J.-A. et al. Partial recovery of visual function in a blind patient after optogenetic therapy. Nat. Med. 27, 1223-1229 (2021).
- Rao, Z. et al. Curvy, shape-adaptive imagers based on printed optoelectronic pixels with a kirigami design. Nat. Electron. 4, 513-521 (2021).
- Ko, H. C. et al. A hemispherical electronic eye camera based on compressible silicon optoelectronics. Nature 454, 748-753 (2008).
- Lorach, H. et al. Photovoltaic restoration of sight with high visual acuity. Nat. Med. 21, 476-482 (2015).
- Mathieson, K. et al. Photovoltaic retinal prosthesis with high pixel density. Nat. Photon. 6, 391-397 (2012).
- Tang, J. et al. Nanowire arrays restore vision in blind mice. Nat. Commun. 9, 786 (2018).
- Jang, J. et al. Implantation of electronic visual prosthesis for blindness restoration. Opt. Mater. Express 9, 3878-3894 (2019).
- Maya-Vetencourt, J. F. Subretinally injected semiconducting polymer nanoparticles rescue vision in a rat model of retinal dystrophy. Nat. Nanotechnol. 15, 30 (2020).
- Mandel, Y. et al. Cortical responses elicited by photovoltaic subretinal prostheses exhibit similarities to visually evoked potentials. Nat. Commun. 4, 1980 (2013).
- Sachs, H. G. & Gabel, V.-P. Retinal replacement-the development of microelectronic retinal prostheses-experience with subretinal implants and new aspects. Graefe’s Arch. Clin. Exp. Ophthalmol. 242, 717-723 (2004).
- Yue, L. et al. Ten-year follow-up of a blind patient chronically implanted with epiretinal prosthesis Argus I. Ophthalmology 122, 2545-2552.e1 (2015).
- Xie, H. et al. Monitoring cortical response and electrode-retina impedance under epiretinal stimulation in rats. IEEE Trans. Neural Syst. Rehabil. Eng. 29, 1178-1187 (2021).
- Lee, K.-W. et al. Pillar-shaped stimulus electrode array for high-efficiency stimulation of fully implantable epiretinal prosthesis. J. Micromech. Microeng. 22, 105015 (2012).
- Ahuja, A. K. et al. Factors affecting perceptual threshold in Argus II retinal prosthesis subjects. Trans. Vis. Sci. Technol. 2, 1 (2013).
- Ghani, N., Bansal, J., Naidu, A. & Chaudhary, K. M. Long term positional stability of the Argus II retinal prosthesis epiretinal implant. BMC Ophthalmol. 23, 70 (2023).
- Palanker, D., Vankov, A., Huie, P. & Baccus, S. Design of a high-resolution optoelectronic retinal prosthesis. J. Neural Eng. 2, S105-S120 (2005).
- Flores, T. et al. Optimization of pillar electrodes in subretinal prosthesis for enhanced proximity to target neurons. J. Neural Eng. 15, 036011 (2018).
- Esler, T. B. et al. Minimizing activation of overlying axons with epiretinal stimulation: the role of fiber orientation and electrode configuration. PLoS ONE 13, e0193598 (2018).
- Todorova, M. G., Scholl, H. P. N. & della Volpe Waizel, M. The impact of macular edema on microvascular and metabolic alterations in retinitis pigmentosa. Graefe’s Arch. Clin. Exp. Ophthalmol. 259, 643-652 (2021).
- Choi, C. et al. Human eye-inspired soft optoelectronic device using high-density
-graphene curved image sensor array. Nat. Commun. 8, 1664 (2017). - Seo, H. W. et al. A 3D flexible microelectrode array for subretinal stimulation. J. Neural Eng. 16, 056016 (2019).
- Cho, Y. H., Park, Y.-G., Kim, S. & Park, J.-U. 3D electrodes for bioelectronics. Adv. Mater. 33, 2005805 (2021).
- Ho, E. et al. Characteristics of prosthetic vision in rats with subretinal flat and pillar electrode arrays. J. Neural Eng. 16, 066027 (2019).
- Kim, E. et al. Fabrication of pillar shaped electrode arrays for artificial retinal implants. Sensors 8, 5845-5856 (2008).
- Park, Y.-G. et al. Liquid metal-based soft electronics for wearable healthcare. Adv. Healthc. Mater. 10, 2002280 (2021).
- Park, Y.-G. et al. Three-dimensional, high-resolution printing of carbon nanotube/liquid metal composites with mechanical and electrical reinforcement. Nano Lett. 19, 4866-4872 (2019).
- Yun, I. et al. Transferable transparent electrodes of liquid metals for bifacial perovskite solar cells and heaters. Nano Energy 93, 106857 (2022).
- Dickey, M. D. Stretchable and soft electronics using liquid metals. Adv. Mater. 29, 1606425 (2017).
- Park, Y.-G., An, H. S., Kim, J.-Y. & Park, J.-U. High-resolution, reconfigurable printing of liquid metals with three-dimensional structures. Sci. Adv. 5, eaaw2844 (2019).
- An, H. S. et al. High-resolution 3D printing of freeform, transparent displays in ambient air. Adv. Sci. 6, 1901603 (2019).
- Jang, J. et al. Human-interactive, active-matrix displays for visualization of tactile pressures. Adv. Mater. Technol. 4, 1900082 (2019).
- Kim, J. et al. Highly transparent and stretchable field-effect transistor sensors using graphene-nanowire hybrid nanostructures. Adv. Mater. 27, 3292-3297 (2015).
- Chen, S. et al. Toxicity and biocompatibility of liquid metals. Adv. Healthc. Mater. 12, 2201924 (2023).
- Yanovitch, L., Raz-Prag, D. & Hanein, Y. A new high-resolution three-dimensional retinal implant: system design and preliminary human results. Preprint at bioRxiv https://doi. org/10.1101/2022.09.14.507901 (2022).
- Jones, I. L., Warner, M. & Stevens, J. D. Mathematical modelling of the elastic properties of retina: a determination of Young’s modulus. Eye 6, 556-559 (1992).
- Shin, H. et al. Recent progress on wearable point-of-care devices for ocular systems. Lab Chip 21, 1269-1286 (2021).
- Mahadevappa, M. et al. Perceptual thresholds and electrode impedance in three retinal prosthesis subjects. IEEE Trans. Neural Syst. Rehabil. Eng. 13, 201-206 (2005).
- ISO 10993-5:2009. Biological Evaluation of Medical Devices. Part 5: Tests for In Vitro Cytotoxicity (International Organization for Standardization, 2009).
- Jacobs, G. H., Williams, G. A., Cahill, H. & Nathans, J. Emergence of novel color vision in mice engineered to express a human cone photopigment. Science 315, 1723-1725 (2007).
- Abballe, L. & Asari, H. Natural image statistics for mouse vision. PLoS ONE 17, e0262763 (2022).
- O’Hearn, T. M. et al. Electrical stimulation in normal and retinal degeneration (rd1) isolated mouse retina. Vis. Res. 46, 3198-3204 (2006).
- Saboo, K. V. et al. Unsupervised machine-learning classification of electrophysiologically active electrodes during human cognitive task performance. Sci. Rep. 9, 17390 (2019).
- Nielsen, F. Introduction to HPC with MPI for Data Science (Springer International Publishing, 2016).
- Hartigan, J. A. Clustering Algorithms (Wiley, 1975).
- Rousseeuw, P. & Rousseeuw, P. J. Silhouettes: a graphical aid to the interpretation and validation of cluster analysis. J. Comput. Appl. Math. 20, 53-65 (1987).
- Bholowalia, P. & Kumar, A. EBK-means: a clustering technique based on elbow method and K-means in WSN. Int. J. Comput. Appl. 105, 17-24 (2014).
- Li, P. H. et al. Anatomical identification of extracellularly recorded cells in large-scale multielectrode recordings. J. Neurosci. 35, 4663-4675 (2015).
© The Author(s) 2024
Methods
Fabrication of phototransistor arrays for the artificial retina
Fabrication of 3D LM microelectrodes
(1) Direct printing of 3D pristine EGaln electrodes: the direct printing system consists of a capillary nozzle connected to an ink reservoir; a pneumatic pressure controller and a six-axis stage with automatic movements in the
was applied to deliver the EGaIn ink (75.5% gallium and 24.5% indium alloy by weight; Changsha Santech Materials) from a reservoir onto the substrate through the nozzle. After we controlled the
(2) Selective opening of 3D electrode tips: after the printing of the 3D pristine EGaln electrodes, additional parylene C (thickness,
(3) Deposition of Pt nanoclusters: to prepare 50 ml of an electroplating solution, we mixed 50 ml of deionized water, 10 mg of lead acetate trihydrate (Sigma-Aldrich) and 0.5 g of platinum tetrachloride (Sigma-Aldrich) at room temperature. This electroplating solution was stirred for 20 min by ultrasonic vibration. The electroplating was performed by ion transfer between the cathode and anode in the Pt electroplating solution. After mounting the device to a multichannel recording interface (MZ-60, Tucker-Davis Technologies), a cathode (the 3D pristine EGaIn microelectrode that is to be electroplated) and an anode (
(3) Rinsing process of the artificial retina: before the implantation of the device, we rinsed the artificial retina by gently immersing the device in
Ex vivo animal experiments
melting point of EGaln,
In vivo implantation
In vivo animal experiments
the spike signal and firing rate were obtained and exported by analysis software (Synapse Suite version 94, Tucker-Davis Technologies). Then, the data were processed and mapped with MATLAB R2021a (MathWorks) and Origin 2022b software. Full-field light illumination ( 470 nm , TouchBright T1 with BN470 band-pass filter, Live Cell Instrument) or a laser (wavelength, 415 nm ) through an ellipsoidal pattern of a shadow mask was applied to the fundus of the mouse’s eye for light exposure (duration, 5 s ). No data points were excluded from the analyses. Also, data met the assumptions of the statistical tests used.
Statistical analysis
Reporting summary
Data availability
Code availability
Acknowledgements
Author contributions
Competing interests
Additional information
https://doi.org/10.1038/s41565-023-01587-w.





natureportfolio
Last updated by author(s): Nov 22, 2023
Reporting Summary
Statistics
Confirmed
Only common tests should be described solely by name; describe more complex techniques in the Methods section.
For Bayesian analysis, information on the choice of priors and Markov chain Monte Carlo settings
For hierarchical and complex designs, identification of the appropriate level for tests and full reporting of outcomes
Estimates of effect sizes (e.g. Cohen’s
Our web collection on statistics for biologists contains articles on many of the points above.
Software and code
Policy information about availability of computer code
Data collection
Microsoft Excel 2022
Data analysis
Origin Pro 2022b (Origin Lab)
For manuscripts utilizing custom algorithms or software that are central to the research but not yet described in published literature, software must be made available to editors and reviewers. We strongly encourage code deposition in a community repository (e.g. GitHub). See the Nature Portfolio guidelines for submitting code & software for further information.
Policy information about availability of data
- Accession codes, unique identifiers, or web links for publicly available datasets
- A description of any restrictions on data availability
- For clinical datasets or third party data, please ensure that the statement adheres to our policy
The custom codes for MATLAB used in this study and the access to our raw data are available from the corresponding authors upon reasonable request.
Human research participants
| Reporting on sex and gender | Use the terms sex (biological attribute) and gender (shaped by social and cultural circumstances) carefully in order to avoid confusing both terms. Indicate if findings apply to only one sex or gender; describe whether sex and gender were considered in study design whether sex and/or gender was determined based on self-reporting or assigned and methods used. Provide in the source data disaggregated sex and gender data where this information has been collected, and consent has been obtained for sharing of individual-level data; provide overall numbers in this Reporting Summary. Please state if this information has not been collected. Report sex- and gender-based analyses where performed, justify reasons for lack of sex- and gender-based analysis. |
| Population characteristics | Describe the covariate-relevant population characteristics of the human research participants (e.g. age, genotypic information, past and current diagnosis and treatment categories). If you filled out the behavioural & social sciences study design questions and have nothing to add here, write “See above.” |
| Recruitment | Describe how participants were recruited. Outline any potential self-selection bias or other biases that may be present and how these are likely to impact results. |
| Ethics oversight | Identify the organization(s) that approved the study protocol. |
Field-specific reporting
Life sciences Behavioural & social sciences Ecological, evolutionary & environmental sciences
For a reference copy of the document with all sections, see nature.com/documents/nr-reporting-summary-flat.pdf
Life sciences study design
| Sample size | The number of animals were chosen enough to perform statistical analysis. | ||
| Data exclusions |
|
||
| Replication |
|
||
| Randomization |
|
||
| Blinding |
|
Reporting for specific materials, systems and methods
| Materials & experimental systems | Methods | ||
| n/a | Involved in the study | n/a | Involved in the study |
 |
X Antibodies |  |
ChIP-seq |
 |
Eukaryotic cell lines |  |
Flow cytometry |
 |
Palaeontology and archaeology |  |
 |
 |
|||
 |
 |
||
 |
Dual use research of concern | ||
Antibodies
| Antibodies used |
|
||||||||
| Validation |
|
Eukaryotic cell lines
Policy information about cell lines and Sex and Gender in Research
Commonly misidentified lines (See ICLAC register)
Animals and other research organisms
| Laboratory animals | Wild-type mice : Male, C57BL/6J, 8-weeks old; Rd1 mice : Male, C3H, 8-weeks old | ||
| Wild animals | n/a | ||
| Reporting on sex |
|
||
| Field-collected samples |
|
||
| Ethics oversight | All of the experimental procedures performed on the animals were conducted based on the guidelines and were approved by the Institute of Animal Care and Use Committee of Yonsei University. |
Flow Cytometry
Plots
The axis labels state the marker and fluorochrome used (e.g. CD4-FITC).
The axis scales are clearly visible. Include numbers along axes only for bottom left plot of group (a ‘group’ is an analysis of identical markers).
All plots are contour plots with outliers or pseudocolor plots.
A numerical value for number of cells or percentage (with statistics) is provided.
Methodology
Sample preparation
Flow cytometry analysis was performed by using BD FACS Verse II (Becton Dickinson and company)
Data were acquired in BD FACSuite software and analysed in FlowJo software.
For analysis, 10,000 cells were recorded from each sample.
Cells were first gated to exclude debris (using FSC-A vs SSC-A), then gated for singlet (using FSC-H vs FSC-W and SSC-H vs SSCW, sequentially). Gating was set up to use reference and positive control (puromycin-treated cells) (PI negative vs PI positive and FITC negative vs FITC positive, respectively).
- A full list of affiliations appears at the end of the paper.
e-mail: seunggeol.lee@pusan.ac.kr; shbyeon@yuhs.ac; jang-ung@yonsei.ac.kr - f, EEPs of rd1 mouse retina under light ( 470 nm ) exposure with different intensities during the operation of the artificial retina with flat-surface-type stimulation electrodes.g, Firing rates of EEPs as a function of illuminated light intensities for WT and rd1 mouse retina. Data are mean
s.d. with biologically independent mice. , EEPs of WT mouse retina under light ( 470 nm ) exposure during the operation of artificial retina with different heights of the 3D LM microelectrode. i, EEPs of rd1 mouse retina under light ( 470 nm ) exposure during the operation of the artificial retina with different heights of the 3D LM microelectrode. j, Firing rates of evoked RGC spikes as a function of heights of 3D LM microelectrodes for WT and rd1 mouse retina. Data are mean s.d. with biologically independent mice. Department of Materials Science & Engineering, Yonsei University, Seoul, Republic of Korea. Center for Nanomedicine, Institute for Basic Science (IBS), Seoul, Republic of Korea. Graduate Program of Nano Biomedical Engineering (NanoBME), Advanced Science Institute, Yonsei University, Seoul, Republic of Korea. Institute of Vision Research, Department of Ophthalmology, Severance Eye Hospital, Yonsei University College of Medicine, Seoul, Republic of Korea. Brain Korea 21 Project for Medical Science, Yonsei University College of Medicine, Seoul, Republic of Korea. School of Chemical Engineering, Pusan National University, Busan, Republic of Korea. Institute of Vision Research, Department of Ophthalmology, Gangnam Severance Hospital, Yonsei University College of Medicine, Seoul, Republic of Korea. Department of Organic Material Science and Engineering, Pusan National University, Busan, Republic of Korea. Department of Neurosurgery, Yonsei University College of Medicine, Seoul, Republic of Korea. These authors contributed equally: Won Gi Chung, Jiuk Jang, Gang Cui, Sanghoon Lee. e-mail: seunggeol.lee@pusan.ac.kr; shbyeon@yuhs.ac; jang-ung@yonsei.ac.kr - Note that full information on the approval of the study protocol must also be provided in the manuscript.