DOI: https://doi.org/10.1186/s42826-024-00198-3
PMID: https://pubmed.ncbi.nlm.nih.gov/38549171
تاريخ النشر: 2024-03-29
مبادئ تحسين 3R: تعزيز رفاهية القوارض وجودة البحث
الملخص
تتناول هذه المقالة الاستعراضية تفاصيل مبادئ 3R-التنقيح كإطار حيوي لأبحاث الفئران المخبرية الأخلاقية. وتبرز الهدف الأساسي من بروتوكول التنقيح، وهو تعزيز رفاهية الحيوانات المخبرية مع تحسين الصلاحية العلمية لنتائج الأبحاث في الوقت نفسه. من خلال استكشاف المكونات الرئيسية لمبادئ التنقيح، توضح المقالة كيف ينبغي تنفيذ هذه الأخلاقيات في مراحل مختلفة من تجارب الحيوانات. وتؤكد على أهمية البيئات السكنية الغنية التي تقلل من التوتر وتشجع على السلوكيات الطبيعية، وطرق التعامل والتدريب غير المقيدة، وتقنيات الجرعات وأخذ العينات المنقحة التي تعطي الأولوية لراحة الحيوانات، والدور الحاسم لإدارة الألم المثلى وأهمية التقييم المنتظم لرفاهية الحيوانات في الحفاظ على رفاهية الفئران. بالإضافة إلى ذلك، يتم ذكر مزايا التعاون مع لجان رعاية الحيوانات والأخلاقيات. الجزء الآخر من المقالة يشرح الفوائد الواسعة لبروتوكول 3R-التنقيح مثل تعزيز رفاهية الحيوانات، وتحسين جودة الأبحاث، وتقليل التباين، والتعليقات الإيجابية من الباحثين وموظفي رعاية الحيوانات. علاوة على ذلك، يتناول سبل تعزيز اعتماد البروتوكول، مثل نشر أفضل الممارسات، وإجراء برامج تدريبية، والتفاعل مع الهيئات التنظيمية. بشكل عام، تبرز هذه المقالة أهمية بروتوكول 3R-التنقيح في مواءمة التقدم العلمي مع الاعتبارات الأخلاقية بالإضافة إلى تشكيل مستقبل أكثر إنسانية ومسؤولية لأبحاث الحيوانات.
الخلفية
الهدف المركزي من بروتوكول التكرير هو تحقيق توازن دقيق بين تعزيز الرفاهية
حول الحيوانات المختبرية وتحسين دقة التحقيقات العلمية. تعتبر الفئران والجرذان، نظرًا لتشابهها الجيني مع البشر، والتكاثر السريع، والفعالية من حيث التكلفة، وسهولة التعامل، أساسية في البحث العلمي ومناسبة لاعتبارات تحسين 3R. لذلك، يركز هذا المقال الاستعراضي بشكل أساسي على هذه الأنواع، مستكشفًا طرق التحسين المصممة خصيصًا لخصائصها الفريدة. من خلال فحص المكونات الرئيسية لمبادئ التحسين بعناية، يكشف هذا المقال عن مخطط شامل لتنفيذها عبر مراحل مختلفة من تجارب الحيوانات. يركز على إنشاء بيئات سكنية غنية تقلل من التوتر وتعزز السلوكيات الطبيعية، واعتماد طرق غير مقيدة للتعامل والتدريب لتعزيز الثقة والتعاون، واستخدام تقنيات جرعات وأخذ عينات محسنة تعطي الأولوية لراحة الحيوانات [4، 5]. بالإضافة إلى ذلك، تعتبر تقنيات إدارة الألم والقتل الرحيم حاسمة في الحفاظ على رفاهية الحيوانات والمعايير الأخلاقية [6، 7]. لضمان رفاهية الحيوانات المستمرة، فإن المراقبة والتقييم المنتظمين ضروريان لقياس رفاهية الحيوانات خلال التجربة. تعزز التعاون مع لجان أخلاقيات الحيوانات ثقافة البحث الأخلاقي، بينما يضمن الالتزام بالإرشادات واللوائح ممارسات بحث مسؤولة وشفافة. من خلال تبني مبادئ تحسين 3R، يمكن للباحثين أن يؤثروا بشكل كبير على رفاهية الحيوانات، ويحسنوا من صحة وموثوقية نتائجهم العلمية، ويقللوا من التباين وعدد الحيوانات المستخدمة [8]. في تعزيز التبني الواسع لممارسات التحسين، يستكشف هذا المقال قيمة التعاون مع مختبرات بحثية أخرى، والجهات الراعية والمساهمين، ونشر أفضل الممارسات والإرشادات، وتنفيذ برامج التدريب وورش العمل، ودور الهيئات التنظيمية ولجان المراجعة الأخلاقية [9].
النص الرئيسي
المكونات الرئيسية لمبادئ تحسين 3R
وصول الحيوانات والتكيف
بيئة السكن والإثراء
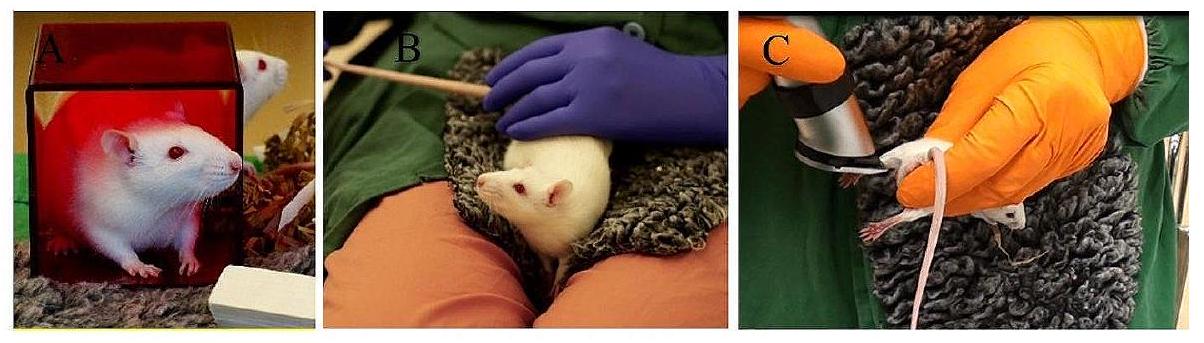
تسمح أقفاص الأرانب لتربية الفئران وأقفاص الفئران للفئران الصغيرة للجرذان بالمشاركة في سلوكيات طبيعية، بما في ذلك الاستكشاف، والتسلق، والتعشيش، والحفر، مما يقلل من التوتر، ويعزز بيئة معيشية أكثر طبيعية. علاوة على ذلك، لا يمكن التقليل من فوائد السكن الاجتماعي للجرذان. من المرجح أن تعيش الجرذان التي تعيش في مجموعات تجارب اجتماعية إيجابية، مما يمكن أن يؤدي إلى تقليل العدوانية وتحسين المهارات الاجتماعية. ومع ذلك، من الضروري مراعاة التفضيلات الفردية والديناميات السلوكية بعد تشكيل ومراقبة المجموعات الاجتماعية، حيث يمكن أن تؤثر توافق رفقاء القفص بشكل كبير على رفاهيتهم. إن دمج مجموعة متنوعة من مواد الإثراء، مثل الألعاب القابلة للمضغ، ومواد التعشيش، وأماكن الاختباء، وتحديات التسلق/التوازن (مثل أرجوحة الترامبولين، وعجلات الجري، والسلالم)، وإمكانيات الحفر، وخيارات البحث عن الطعام، والاتصالات الاجتماعية، وما إلى ذلك، يوفر للجرذان فرصًا للتحفيز الذهني والتمرين البدني. تساعد هذه الإثراءات في منع السلوكيات النمطية التي قد تنشأ من ظروف السكن الرتيبة، مما يحسن في النهاية من مرونة الحيوانات العاطفية وقدراتها المعرفية. بينما يتم توفير الإثراء، من الضروري تقييم هذه العناصر بانتظام وتدويرها للحفاظ على جاذبيتها وفعاليتها. تخلق صناديق المراقبة شبه مساحة مفتوحة للحيوانات داخل بيئة محكومة، مما يسمح لها بتجربة بيئة أكثر إثراءً، مما يعزز رفاهيتها العامة. كما أنها توفر مساحة قيمة لدراسة سلوك الحيوانات وتفاعلاتها. يمكن للباحثين تحليل استجابات الحيوانات للمؤثرات المختلفة عن كثب ومراقبة آثار التفاعلات السابقة. وبالتالي، فإن الاعتراف بأهمية توفير ظروف معيشية مثيرة وداعمة للجرذان.
يعزز توازنًا وديًا بين المسؤوليات الأخلاقية والتقدم العلمي في بيئات البحث.
في بعض الحالات، قد تتطلب التجارب أقفاصًا أصغر بسبب احتياجات البحث المحددة أو القيود المكانية، مما قد يحد من التطبيق المتسق للبيئات الغنية. هذه incompatibility المحتملة بين الجوانب المثالية والعملية لإسكان القوارض عبر جميع الظروف التجريبية تبرز أهمية نهج دقيق. يعترف هذا النهج بالمتطلبات المتنوعة للتجارب بينما يسعى لتحقيق رفاهية الحيوانات المثلى ضمن القيود القائمة. Advocated Benefiel وآخرون (2005) بوضوح عن تحسين رفاهية الحيوانات ولكنهم اقترحوا أيضًا أن الإثراء البيئي لديه القدرة على التسبب في زيادة التباين التجريبي ونتائج البحث. أشار Toth وآخرون (2011) إلى أن البيئات الغنية يجب أن تُصمم بعناية بحيث تترك النتائج التجريبية دون تغيير وأوصوا بتقييم الإثراء على أساس تجربة بتجربة. استراتيجيات الإثراء، مثل البيئات الكبيرة والمفتوحة، مفيدة بشكل خاص للتجارب التي تركز على علم السموم، وتقييم السمية، وعلم الأدوية الآمن، أو الدراسات السلوكية للوصول إلى آثار الأدوية الجديدة على الحيوانات التجريبية. بينما توفر للقوارض فرصًا للسلوكيات الطبيعية والتفاعلات الاجتماعية، تعزز هذه الإعدادات موثوقية وملاءمة النتائج في مرحلة الحياة في هذه المجالات. ومع ذلك، تظهر تحديات عملية، خاصة في مرافق الحيوانات الصغيرة ذات الموارد المحدودة، حيث قد تتعارض الضوابط البيئية الصارمة، مثل تلك المطلوبة لدراسات العدوى، مع تنفيذ مساحات الأقفاص الكبيرة. إن الاعتراف بهذه القيود أمر حاسم للباحثين لتطبيق استراتيجيات الإثراء بشكل مدروس يتماشى مع التجارب.

طرق التعامل والتدريب
يمكن أن يساعد الراحة على إنشاء مكان ناعم ومريح للقوارض خلال إجراءات التدريب والجرعات. توفر هذه الفراش المصنوع من الصوف، الذي يشير إلى فراش الحيوان الخاص، ليس فقط الألفة والراحة ولكن أيضًا تعزز السلوكيات الطبيعية. وبالمثل، فإن إدخال فراش صوفي قابل للتعقيم في صناديق الوزن يخلق بيئة هادئة وخالية من التوتر أثناء الوزن، مع ضمان النظافة من خلال التعقيم، مما يتماشى بسلاسة مع معايير البحث [29]. لذلك، فإن التعامل المتقن مع القوارض يعزز ثقتها، ويقلل من التوتر، ويضمن سلوكًا تعاونيًا، وهو أمر حاسم للملاحظات العلمية الدقيقة والمعاملة الأخلاقية (الشكل 2).
تدريب الحيوانات قبل التجارب يساهم في بناء الثقة والتعاون، مما يضمن أن تكون هادئة ومستعدة للمشاركة، مما يؤدي إلى إجراءات أكثر سلاسة، وتقليل مستويات التوتر، ونتائج بحث أكثر موثوقية. هناك طرق تدريب محددة للقوارض تتماشى مع مبادئ التحسين، تركز على التعامل اللطيف، والتعزيز الإيجابي، وتقليل التوتر أثناء الإجراءات (الجدول 1).
تدريب الحيوانات المخبرية (حوالي
جلسة التدريب الأولى: عندما تصل الحيوانات المخبرية لأول مرة إلى منشأة حيوانات، يلعب تدريبها الأولي وتعاملها دورًا حاسمًا في رفاهيتها اللاحقة. توفر الأبحاث العلمية رؤى قيمة حول أهمية بروتوكولات التدريب المنظمة خلال هذه الفترة الحرجة. يبرز مقال لسوان وآخرين (2023) أهمية التعامل اللطيف في تدريب الحيوانات المخبرية. يتناول المقال أهمية بروتوكولات التدريب العامة والتعامل اللطيف في المساهمة في الرفاهية العامة للحيوانات و
| طريقة التدريب | وصف | المراجع |
| التعزيز الإيجابي | استخدام التعزيز الإيجابي مثل مكافآت الطعام، ومواد الإثراء، أو التفاعلات الاجتماعية يخلق علاقة إيجابية مع البيئة التجريبية، مما يحفز القوارض على المشاركة برغبة. | [30] |
| التعويد والتقليل من الحساسية | التعرض التدريجي لإجراءات التعامل والمعدات لتعويد القوارض على المحفزات التي قد تسبب التوتر، مما يقلل من استجابات التوتر ويحسن الامتثال مع مرور الوقت. | [31] |
| التدريب القائم على الإثراء | يتم دمج أنشطة الإثراء في جلسات التدريب لتوفير التحفيز الذهني وتعزيز الروابط الإيجابية مع التعامل، مثل التنقل في المتاهات للحصول على مكافآت غذائية. | [32] |
| تدريب الواقع الافتراضي | يستخدم محاكيات الواقع الافتراضي لتعريف القوارض بإجراءات التعامل في بيئة مسيطر عليها، مما يقلل من استجابات التوتر ويزيد من التعاون خلال الجلسات اللاحقة. | [33] |
| بروتوكولات تدريب مخصصة | يخصص خطط التدريب لتناسب تفضيلات وسلوكيات كل حيوان على حدة، مما يحسن النتائج من خلال التكيف مع الاحتياجات الفريدة مثل التفضيلات اللمسية أو السمعية. | – |
الإجراءات القادمة. من الضروري مراجعة بروتوكول الدراسة لتحديد أجزاء الجسم المحددة التي تتطلب معالجة إضافية وتقديم الحيوانات للمعدات اللازمة. على سبيل المثال، إذا كان من المخطط إعطاء الجرعة عن طريق الفم، يجب تدريب الحيوانات على استخدام مقبض الجرعة. بحلول جلسة التدريب الأخيرة، يُوصى بتقديم الماء بلطف من خلال أنبوب تغذية فموي ناعم. يجب أن تشمل التدريب تقنيات أخذ عينات متنوعة أيضًا. على سبيل المثال، إذا كانت جمع الدم تتضمن الوريد الذيل، يجب تدليك الذيل بشكل متكرر ولطف. في حالة أخذ عينات من الوريد السافن، يجب أن تتعود الحيوانات على قبضة الفني وصوت آلة الحلاقة. إذا كان من الضروري استخدام أنابيب التقييد، مثل الدراسات المتعلقة بالاستنشاق، يجب أن تتعرف الحيوانات عليها قبل إجراء التقييد الأول. يمكن وضع جهاز التقييد في قفص الحيوانات لمدة عدة أيام، للسماح للحيوانات بالدخول واستكشاف الأنبوب بحرية، حتى تتعرف عليه. الهدف من جلسة التدريب النهائية هو أن تظهر الحيوانات الهدوء والاسترخاء والفضول.
تقنيات الجرعات وأخذ العينات
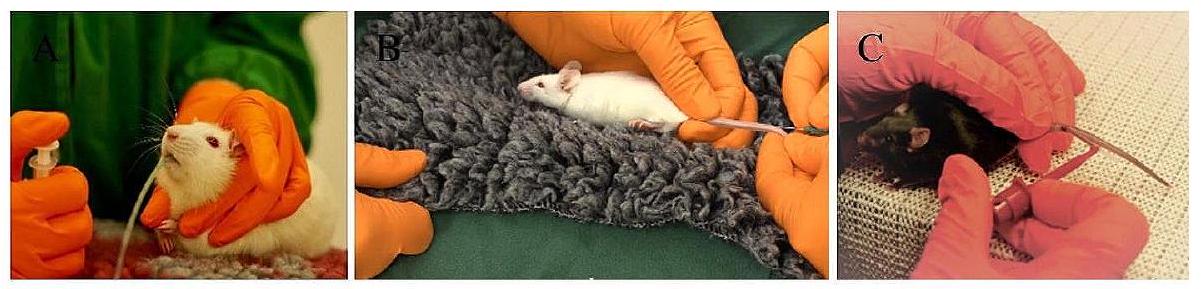
بدون قيود، مما يعزز تجربة أكثر راحة وأقل نفورًا للقوارض. تقنية أخذ عينات الميكرو الشعيرية هي تحسين ملحوظ آخر لجمع كميات صغيرة من الدم، كافية للت quantification البيواناليتيكي مقارنة بالطرق التقليدية ذات الحجم الكبير [41]. تقلل هذه الطريقة من معاناة الحيوانات وتكوين الكدمات، باستخدام جزء فقط من حجم الدم التقليدي. إن إعطاء الأولوية لطرق أقل تدخلاً، مثل أخذ عينات من الوريد الذيل أو الوريد الصافن، بدلاً من أخذ عينات من خلف العين، يبرز الاعتبارات الأخلاقية [42]. أظهرت دراسة من ماير وآخرون (2020) أن تقنيات أخذ عينات الدم من الوريد الوجهي والجيوب خلف العين أثرت بشكل كبير على نشاط الفئران الحركي وسلوك القلق، بينما كان لنزيف الأوعية الدموية في الذيل تأثير ضئيل على المعايير الفسيولوجية والسلوكية المقيمة [43]. لا تحافظ التقنيات الأقل تدخلاً على رفاهية القوارض فحسب، بل تقلل أيضًا من خطر العدوى أو المضاعفات المرتبطة بالطرق الأكثر تدخلاً، مما يقلل في النهاية من استجابات الضغط الفسيولوجي للحصول على بيانات أكثر دقة وموثوقية [44]. علاوة على ذلك، من المرجح أن تظهر الحيوانات التي تعاني من ضغط أقل أثناء الجرعات وأخذ العينات تعاونًا أكبر في الإجراءات اللاحقة، مما يعزز جو البحث المواتي (الشكل 3).
تقييم وإدارة الألم
التلاعبات التجريبية، التدخلات الجراحية، أو نماذج الأمراض، مما يدعو إلى نهج أكثر إنسانية ورحمة في أبحاث الحيوانات. إن سرعة بدء واستعادة التخدير الغازي، بالإضافة إلى مزايا إدارته غير الغازية، مفيدة بشكل خاص للإجراءات البسيطة؛ ومع ذلك، بالنسبة للجراحات الأكثر تعقيدًا وتوغلًا، يصبح تضمين المسكنات القابلة للحقن أمرًا حاسمًا. من المRemarkably، يكشف الجرعات الدقيقة من المسكنات الوريدية، مقارنة بالحقن الكبيرة داخل الصفاق، عن مزايا ملحوظة. أولاً، تسهل الجرعات الدقيقة الوريدية الإدارة الدقيقة والمستهدفة للمسكنات، مما يدعم نظام إدارة الألم بدقة وفعالية. تضمن هذه الاستراتيجية حصول الحيوانات على الجرعة المطلوبة من تخفيف الألم، مما يقلل من خطر الجرعات غير المثلى أو المفرطة. ثانيًا، تعتبر الحقن الوريدية أقل توغلاً من نظيراتها داخل الصفاق، مما يسبب إزعاجًا طفيفًا، باستثناء حجم السوائل الكبير المرتبط بالحقن داخل الصفاق، والذي يمكن أن يثقب في بعض الأحيان الأعضاء الداخلية.
يجب تشجيع الباحثين على استكشاف استراتيجيات بديلة لإدارة الألم، مثل التخدير الموضعي أو المسكنات متعددة الأنماط – وهي نهج يتضمن دمج مجموعة متنوعة من العوامل المسكنة لتحقيق تخفيف أكثر شمولاً للألم. يحمل هذا الاستراتيجية وعدًا في تقليل الجرعات الفردية من المسكنات، والحد من الآثار الجانبية، وتعزيز نتائج إدارة الألم بشكل عام. بالإضافة إلى ذلك، من الضروري استخدام تقنيات تقييم الألم غير الغازية لقياس فعالية المسكنات ومراقبة حالة الألم لدى الحيوانات. يساعد التقييم المنتظم للإشارات السلوكية والفسيولوجية للألم، بما في ذلك التغيرات في النشاط، والوضعية، والت vocalization، والعلامات الحيوية، في تمييز مستوى الألم الذي تعاني منه الحيوانات، مما يسهل إجراء التعديلات اللازمة على بروتوكولات المسكنات.
مراقبة رفاهية الحيوان
تحديد نقاط النهاية الإنسانية
إجراءات القتل الرحيم
التعاون مع لجان رعاية الحيوان والأخلاقيات
| المكون الرئيسي | الملخص | المراجع |
| وصول الحيوانات وتكيفها | تضمن بروتوكولات التفريغ المناسبة، بما في ذلك التعقيم ومراقبة الصحة، رفاهية الحيوان عند الوصول. يقلل التكيف التدريجي مع البيئات الجديدة وتقنيات التعامل اللطيفة من التوتر ويعزز العلاقات الإيجابية مع القائمين على الرعاية. | [1015] |
| بيئة الإسكان والإثراء | يعزز الإسكان الغني، بما في ذلك المساحات الكبيرة للقفص والتجمعات الاجتماعية، السلوكيات الطبيعية ويقلل من التوتر. يخلق دمج مواد إثراء متنوعة وصناديق المراقبة ظروف معيشية مثيرة بينما يسهل البحث في سلوك الحيوان. | [1624] |
| طرق التعامل والتدريب | تساعد تقنيات التعامل غير المقيدة، مثل التعامل عبر الأنفاق، في تعزيز رفاهية الحيوان والتعاون أثناء الإجراءات التجريبية. يعزز التعامل اللطيف واستخدام مواد الفراش اللينة الثقة والراحة، مما يعزز الملاحظات العلمية والمعاملة الأخلاقية. | [2536] |
| تقنيات الجرعة وأخذ العينات | تحسين طرق الجرعات وأخذ العينات، مثل أنابيب التغذية الفموية اللينة والحقن غير المقيدة، ي prioritizes راحة الحيوانات ويقلل من الضيق. تقنيات أخذ العينات الدقيقة الشعيرية تقلل من متطلبات حجم الدم وتحافظ على الاعتبارات الأخلاقية. | [3744] |
| تقييم وإدارة الألم | تساعد استراتيجيات تقييم الألم وإدارته الفعالة، بما في ذلك استخدام المسكنات وتقنيات المراقبة غير الغازية، في التخفيف من معاناة الحيوانات خلال الإجراءات التجريبية. إن وضع نقاط نهاية إنسانية وتطبيق إجراءات الإعدام السريع يعزز أيضًا المعايير الأخلاقية. | [4550] |
| مراقبة رفاهية الحيوانات | المراقبة المنتظمة لمؤشرات رفاهية الحيوانات، سواء السلوكية أو الفسيولوجية، تتيح الكشف المبكر عن الضيق والتدخل في الوقت المناسب. | [5153] |
| إنشاء نقاط نهاية إنسانية | مراقبة سلوك الحيوانات والمعايير الفسيولوجية. تحديد العتبات لتجنب الضيق الشديد أو المعاناة، واتخاذ الإجراءات المناسبة عند الوصول إلى النقاط النهائية. | [5456] |
| إجراءات القتل الرحيم | طرق سريعة وإنسانية للقتل الرحيم. استشارة الأطباء البيطريين المتخصصين لاختيار الطريقة بالإضافة إلى تصميم دراسات أولية لتحديد طرق القتل الرحيم المناسبة. أخذ الأمن الحيوي والأثر البيئي في الاعتبار عند التخلص من الجثث. | [٥٧، ٥٨، ٧] |
| التعاون مع لجان رعاية الحيوانات والأخلاقيات | مراجعة واعتماد بروتوكولات البحث لضمان اتباعها للمعايير الأخلاقية واللوائح. تسهيل مبادرات التدريب والتعليم. نشر أفضل الممارسات ومشاركة المعرفة. المساهمة في تقدم ممارسات البحث الأخلاقي على الحيوانات. | [٥٩، ٦٠] |
أثر وفوائد مبادئ 3R – تحسين
تحسين رفاهية الحيوانات ورفاهها
تحسين الصلاحية العلمية والموثوقية
تقليل التباين وعدد الحيوانات
في التصاميم التجريبية، يقلل الباحثون من مصادر التباين، مما يؤدي إلى نتائج أكثر اتساقًا وقابلية للتكرار. علاوة على ذلك، يشجع هذا الباحثين على احترام مبدأ 3R-التقليل، أي النظر بعناية في القوة الإحصائية لتجاربهم واستخدام الحد الأدنى من الحيوانات اللازمة لتحقيق نتائج ذات دلالة معنوية وإحصائية. لا يقلل هذا النهج من الاستخدام العام للحيوانات في البحث فحسب، بل يحسن أيضًا من كفاءة وفعالية التكاليف للدراسات العلمية. كما يعزز بروتوكول 3R-التنقيح تبادل أفضل الممارسات وتوحيد المنهجيات، مما يساهم بشكل أكبر في تقليل التباين التجريبي عبر مجموعات البحث المختلفة.
تعليقات إيجابية من الباحثين وموظفي رعاية الحيوانات
تعزيز اعتماد مبادئ 3R – التحسين
التعاون بين المعاهد البحثية وأصحاب المصلحة
الرفاهية، تعزيز الصلاحية العلمية، وتعزيز ممارسات البحث المسؤولة اجتماعيًا.
أفضل الممارسات والإرشادات للبث
برامج التدريب وورش العمل
مشاركة الهيئات التنظيمية ولجان المراجعة الأخلاقية
موارد تعليمية وبرامج تدريبية تقدم إرشادات حول التطبيق العملي لمبادئ 3R-تحسين. علاوة على ذلك، تسهل الملاحظات والتوصيات المقدمة من هذه الهيئات التحسين المستمر وتنقيح بروتوكولات البحث، مما يعزز الالتزام الجماعي برفاهية الحيوانات والسعي نحو التميز العلمي.
الاستنتاجات
الاختصارات
i.p. داخل الصفاق
الشكر والتقدير
مساهمات المؤلفين
التمويل
توفر البيانات
الإعلانات
المصالح المتنافسة
مارس 2024
نشر على الإنترنت: 29 مارس 2024
References
- Domínguez-Oliva A, Hernández-Ávalos I, Martínez-Burnes J, OlmosHernández A, Verduzco-Mendoza A, Mota-Rojas D. The Importance of Animal Models in Biomedical Research: current insights and applications. Animals. 2023;13:1223.
- Russell WMS, Burch RL. The principles of Humane experimental technique. London, UK: Methuen & Co Ltd.; 1959.
- Hubrecht RC, Carter E. The 3Rs and Humane experimental technique: implementing change. Anim (Basel). 2019;9:754.
- Lee G-H, Kim K, Jo W. Stress Evaluation of Mouse Husbandry Environments for Improving Laboratory Animal Welfare. Animals. 2023;13:249.
- Davies JR, Purawijaya DA, Bartlett JM, Robinson ESJ. Impact of refinements to Handling and Restraint methods in mice. Anim (Basel). 2022;12:2173.
- Flecknell PA. The relief of pain in laboratory animals. Lab Anim. 1984;18:147-60.
- Shomer NH, Allen-Worthington KH, Hickman DL, Jonnalagadda M, Newsome JT, Slate AR, et al. Review of Rodent Euthanasia methods. J Am Assoc Lab Anim Sci. 2020;59:242-53.
- Graham ML, Prescott MJ. The multifactorial role of the 3Rs in shifting the harm-benefit analysis in animal models of disease. Eur J Pharmacol. 2015;759:19-29.
- Lloyd MH, Foden BW, Wolfensohn SE. Refinement: promoting the three rs in practice. Lab Anim. 2008;42:284-93.
- Loew FM. Considerations in receiving and quarantining laboratory rodents. Lab Anim Sci. 1980;30:323-9.
- Conour LA, Murray KA, Brown MJ. Preparation of animals for research-issues to consider for rodents and rabbits. ILAR J. 2006;47:283-93.
- Tuli JS, Smith JA, Morton DB. Stress measurements in mice after transportation. Lab Anim. 1995;29:132-8.
- Gordon CJ. Effect of cage bedding on temperature regulation and metabolism of group-housed female mice. Comp Med. 2004;54:63-8.
- Obernier JA, Baldwin RL. Establishing an appropriate period of acclimatization following transportation of laboratory animals. ILAR J. 2006;47:364-9.
- Avishai-Eliner S, Brunson KL, Sandman CA, Baram TZ. Stressed-out, or in (utero)? Trends Neurosci. 2002;25:518-24.
- Würbel H. Ideal homes? Housing effects on rodent brain and behaviour. Trends Neurosci. 2001;24:207-11.
- Van Loo PL, Mol JA, Koolhaas JM, Van Zutphen BF, Baumans V. Modulation of aggression in male mice: influence of group size and cage size. Physiol Behav. 2001;72:675-83.
- Latham N, Mason G. From house mouse to mouse house: the behavioural biology of free-living Mus musculus and its implications in the laboratory. Appl Anim Behav Sci. 2004;86:261-89.
- Lidster K, Owen K, Browne WJ, Prescott MJ. Cage aggression in group-housed laboratory male mice: an international data crowdsourcing project. Sci Rep. 2019;9:15211.
- Key D. Environmental enrichment options for laboratory rats and mice. Lab Anim (NY). 2004;33:39-44.
- Harland BC, Dalrymple-Alford JC. Enriched Environment procedures for rodents: creating a standardized protocol for Diverse Enrichment to improve consistency across Research studies. Bio Protoc. 2020;10:e3637.
- van de Weerd HA, Baumans V, Koolhaas JM, van Zutphen LF. Strain specific behavioural response to environmental enrichment in the mouse. J Exp Anim Sci. 1994;36:117-27.
- Benefiel AC, Dong WK, Greenough WT. Mandatory enriched housing of laboratory animals: the need for evidence-based evaluation. ILAR J. 2005;46:95-105.
- Toth LA, Kregel K, Leon L, Musch TI. Environmental enrichment of laboratory rodents: the answer depends on the question. Comp Med. 2011;61:314-21.
- Gouveia K, Hurst JL. Reducing mouse anxiety during handling: Effect of experience with handling tunnels. PLoS ONE. 2013;8:e66401.
- Sensini F, Inta D, Palme R, Brandwein C, Pfeiffer N, Riva MA, et al. The impact of handling technique and handling frequency on laboratory mouse welfare is sex-specific. Sci Rep. 2020;10:17281.
- Henderson LJ, Dani B, Serrano EMN, Smulders TV, Roughan JV. Benefits of tunnel handling persist after repeated restraint, injection and anaesthesia. Sci Rep. 2020;10:14562.
- Hurst JL, West RS. Taming anxiety in laboratory mice. Nat Methods. 2010;7:825-6.
- Laule G. Positive Reinforcement Training for Laboratory Animals. In: Hubrecht R, Kirkwood J, editors. UFAW Handb Care Manag Lab Res Anim [Internet]. 1st ed. Wiley; 2010 [cited 2023 Oct 6]. p. 206-18. Available from: https://onlinelibrary.wiley.com/doi/https://doi.org/10.1002/9781444318777.ch16.
- Schindler CW, Weiss SJ. The influence of positive and negative reinforcement on selective attention in the rat. Learn Motiv. 1982;13:304-23.
- Clay AW, Bloomsmith MA, Marr MJ, Maple TL. Habituation and desensitization as methods for reducing fearful behavior in singly housed rhesus macaques. Am J Primatol. 2009;71:30-9.
- Bramati G, Stauffer P, Nigri M, Wolfer DP, Amrein I. Environmental enrichment improves hippocampus-dependent spatial learning in female C57BL/6 mice in novel IntelliCage sweet reward-based behavioral tests. Front Behav
33. Tang FMK, Lee RMF, Szeto RHL, Cheung JCT, Ngan OMY. Experiential learning with virtual reality: animal handling training. Innov Educ. 2020;2:2.
34. Swan J, Boyer S, Westlund K, Bengtsson C, Nordahl G, Törnqvist E. Decreased levels of discomfort in repeatedly handled mice during experimental procedures, assessed by facial expressions. Front Behav Neurosci. 2023;17:1109886.
35. Mieske P, Hobbiesiefken U, Fischer-Tenhagen C, Heinl C, Hohlbaum K, Kahnau P, et al. Bored at home?-A systematic review on the effect of environmental enrichment on the welfare of laboratory rats and mice. Front Vet Sci. 2022;9:899219.
36. Tryon SC, Sakamoto IM, Kellis DM, Kaigler KF, Wilson MA. Individual Differences in Conditioned Fear and extinction in female rats. Front Behav Neurosci. 2021;15:740313.
37. Õkva K, Tamoseviciute E, Ciziute A, Pokk P, Ruksenas O, Nevalainen T. Refinements for Intragastric Gavage in rats. Scand J Lab Anim Sci. 2014;33:243-52.
38. Wheatley JL. A gavage dosing apparatus with flexible catheter provides a less stressful gavage technique in the rat. Lab Anim (NY). 2002;31:53-6.
39. Turner PV, Vaughn E, Sunohara-Neilson J, Ovari J, Leri F. Oral gavage in rats: animal welfare evaluation. J Am Assoc Lab Anim Sci JAALAS. 2012;51:25-30.
40. Turner PV, Brabb T, Pekow C, Vasbinder MA. Administration of substances to laboratory animals: routes of administration and factors to consider. J Am Assoc Lab Anim Sci JAALAS. 2011;50:600-13.
41. Jonsson O, Palma Villar R, Nilsson LB, Norsten-Höög C, Brogren J, Eriksson M , et al. Capillary microsampling of
42. Diehl KH, Hull R, Morton D, Pfister R, Rabemampianina Y, Smith D, et al. A good practice guide to the administration of substances and removal of blood, including routes and volumes. J Appl Toxicol JAT. 2001;21:15-23.
43. Meyer N, Kröger M, Thümmler J, Tietze L, Palme R, Touma C. Impact of three commonly used blood sampling techniques on the welfare of laboratory mice: taking the animal’s perspective. PLoS ONE. 2020;15:e0238895.
44. Lee G, Goosens KA. Sampling blood from the lateral tail vein of the rat. J Vis Exp. 2015;(99):e52766.
45. Flecknell P. Rodent analgesia: Assessment and therapeutics. Vet J. 2018;232:70-7.
46. Ahmadi-Noorbakhsh S, Farajli Abbasi M, Ghasemi M, Bayat G, Davoodian N, Sharif-Paghaleh E, et al. Anesthesia and analgesia for common research models of adult mice. Lab Anim Res. 2022;38:40.
47. Gargiulo S, Greco A, Gramanzini M, Esposito S, Affuso A, Brunetti A, et al. Mice anesthesia, analgesia, and care, part I: anesthetic considerations in preclinical research. ILAR J. 2012;53:E55-69.
48. Navarro KL, Huss M, Smith JC, Sharp P, Marx JO, Pacharinsak C. Mouse anesthesia: the art and science. ILAR J. 2021;62:238-73.
49. Turner PV, Pang DS, Lofgren JL. A review of Pain Assessment methods in Laboratory rodents. Comp Med. 2019;69:451-67.
50. Mayer J. Use of behavior analysis to recognize pain in small mammals. Lab Anim (NY). 2007;36:43-8.
51. Bloomsmith MA, Perlman JE, Hutchinson E, Sharpless M. Behavioral Management Programs to Promote Laboratory Animal Welfare. In: Weichbrod RH, Thompson GA (Heidbrink), Norton JN, editors. Manag Anim Care Use Programs Res Educ Test [Internet]. 2nd ed. Boca Raton (FL): CRC Press/Taylor & Francis; 2018 [cited 2023 Oct 6]. Available from: http://www.ncbi.nlm.nih. gov/books/NBK500424/.
52. Do JP, Defensor EB, Ichim CV, Lim MA, Mechanic JA, Rabe MD, et al. Automated and Continuous Monitoring of Animal Welfare through Digital Alerting. Comp Med. 2020;70:313-27.
53. Kunczik J, Barbosa Pereira C, Zieglowski L, Tolba R, Wassermann L, Häger C, et al. Remote vitals monitoring in rodents using video recordings. Biomed Opt Express. 2019;10:4422-36.
54. Stokes WS. Humane endpoints for laboratory animals used in regulatory testing. ILAR J. 2002;43 Suppl:S31-38.
55. Morton DB. A systematic Approach for establishing Humane endpoints. ILAR J. 2000;41:80-6.
56. Demers G, Griffin G, De Vroey G, Haywood JR, Zurlo J, Bédard M. Animal research. Harmonization of animal care and use guidance. Science. 2006;312:700-1.
57. Leary S, Pharmaceuticals F, Underwood W, Anthony R, Cartner S, Johnson CL et al. AVMA Guidelines for the Euthanasia of Animals: 2020 Edition. American Veterinary Medical Association, 2020. https://www.avma.org/sites/default/ files/2020-02/Guidelines-on-Euthanasia-2020. Accessed 19 March 2024.
58. Clarkson JM, Martin JE, McKeegan DEF. A review of methods used to kill laboratory rodents: issues and opportunities. Lab Anim. 2022;56:419-36.
59. Hagelin J, Hau J, Carlsson H-E. The refining influence of ethics committees on animal experimentation in Sweden. Lab Anim. 2003;37:10-8.
60. Fenwick N, Griffin G, Gauthier C. The welfare of animals used in science: how the three rs ethic guides improvements. Can Vet J. 2009;50:523-30.
61. Neuhaus W, Reininger-Gutmann B, Rinner B, Plasenzotti R, Wilflingseder D, De Kock J, et al. The current status and work of three rs centres and platforms in Europe. Altern Lab Anim ATLA. 2022;50:381-413.
62. Garner JP. Stereotypies and other abnormal repetitive behaviors: potential impact on validity, reliability, and replicability of scientific outcomes. ILAR J. 2005;46:106-17.
63. Poole T. Happy animals make good science. Lab Anim. 1997;31:116-24.
64. Aske KC , Waugh CA . Expanding the 3 R principles: more rigour and transparency in research using animals. EMBO Rep. 2017;18:1490-2.
65. Törnqvist E, Annas A, Granath B, Jalkesten E, Cotgreave I, Öberg M. Strategic focus on
66. Thomas D. Laboratory animals and the art of empathy. J Med Ethics. 2005;31:197-202.
67. Bratcher NA, Reinhard GR. Creative implementation of 3 Rs principles within industry programs: beyond regulations and guidelines. J Am Assoc Lab Anim Sci JAALAS. 2015;54:133-8.
68. Nawroth C, Krause ET. The Academic, Societal and Animal Welfare Benefits of Open Science for Animal Science. Front Vet Sci [Internet]. 2022 [cited 2023 Oct 6];9. Available from: https://www.frontiersin.org/articles/https://doi. org/10.3389/fvets.2022.810989.
69. Hagelin J, Carlsson HE, Hau J. The importance of student training in experimental procedures on animals in biomedical education. Scand J Lab Anim Sci. 2000;27:35-41.
70. Ahmadi-Noorbakhsh S, Sadighi J, Hatami Z, Shamsi Gooshki E. A proposed framework for holding intensive 3Rs workshops in laboratory animal science. Lab Anim Res. 2022;38:10.
71. Ethics committees for. laboratory animals: a basis for their composition and function / Maggy Jennings. [Internet]. Wellcome Collect. [cited 2023 Oct 6]. Available from: https://wellcomecollection.org/works/uzfrfg4z.
72. Hau J, Carlsson HE, Hagelin J. Animal research. Ethics committees have influenced animal experiments in Sweden. BMJ. 2001;322:1604.
ملاحظة الناشر
- *المراسلة:
ماتيلدا باكبيرغ
matilda.backberg@ri.se
¹قسم السلامة الكيميائية والصيدلانية، قسم الاقتصاد الحيوي والصحة، معاهد الأبحاث RISE في السويد، Forskargatan 18، سودرتاليا 151 36، السويد
DOI: https://doi.org/10.1186/s42826-024-00198-3
PMID: https://pubmed.ncbi.nlm.nih.gov/38549171
Publication Date: 2024-03-29
3R-Refinement principles: elevating rodent well-being and research quality
Abstract
This review article delves into the details of the 3R-Refinement principles as a vital framework for ethically sound rodent research laboratory. It highlights the core objective of the refinement protocol, namely, to enhance the well-being of laboratory animals while simultaneously improving the scientific validity of research outcomes. Through an exploration of key components of the refinement principles, the article outlines how these ethics should be implemented at various stages of animal experiments. It emphasizes the significance of enriched housing environments that reduce stress and encourage natural behaviors, non-restraint methods in handling and training, refined dosing and sampling techniques that prioritize animal comfort, the critical role of optimal pain management and the importance of regular animal welfare assessment in maintaining the rodents well-being. Additionally, the advantages of collaboration with animal care and ethics committees are also mentioned. The other half of the article explains the extensive benefits of the 3R-Refinement protocol such as heightened animal welfare, enhanced research quality, reduced variability, and positive feedback from researchers and animal care staff. Furthermore, it addresses avenues for promoting the adoption of the protocol, such as disseminating best practices, conducting training programs, and engaging with regulatory bodies. Overall, this article highlights the significance of 3R-Refinement protocol in aligning scientific advancement with ethical considerations along with shaping a more compassionate and responsible future for animal research.
Background
The central objective of the refinement protocol is to strike a delicate balance between elevating the welfare
of laboratory animals and refining the rigor of scientific investigations. Rats and mice, due to their genetic similarities with humans, rapid reproduction, cost-effectiveness, and ease of handling, are fundamental in scientific research and favorable for 3R-Refinement considerations. This review article, therefore, primarily focuses on these species, exploring refinement methods tailored to their unique characteristics. By carefully examining the key components of the refinement principles, this article reveals a comprehensive outline for their implementation across various stages of animal experiments. It focuses on creating enriched housing environments that mitigate stress and promote natural behaviors, adopting non-restraint methods for handling and training to foster trust and cooperation, and employing refined dosing and sampling techniques that prioritize the comfort of the animals [4, 5]. Apart from these, pain management and euthanasia techniques are crucial in maintaining animal welfare and ethical standards [6, 7]. To ensure continual animal welfare, regular monitoring and assessment are essential to gauge the well-being of the animals during the experiment. Collaboration with animal ethics committees fosters ethical research culture, while adhering to guidelines and regulations ensures responsible, transparent research practices. By embracing the 3R-Refinement principles, researchers can significantly impact animal welfare, improve the scientific validity and reliability of their findings, and reduce variability and the number of animals used [8]. In promoting the widespread adoption of Refinement practices, this article explores the value of collaboration with other research laboratories, sponsors and stakeholders, the dissemination of best practices and guidelines, the implementation of training programs and workshops, and the role of regulatory bodies and ethical review committees [9].
Main text
Key components of 3R-refinement principles
Arrival and acclimatization of animals
Housing and enrichment environment
rabbit cages for housing rats and rat cages for mice) allow rodents to engage in natural behaviors, including exploration, climbing, nesting, and burrowing, thus reducing stress, and promoting a more naturalistic living environment [16, 17]. Furthermore, the benefits of social housing for rodents cannot be understated. Group-housed rodents are more likely to experience positive social interactions, which can lead to reduced aggression and improved social skills [18]. However, it is essential to consider individual preferences and behavioral dynamics after forming and observing the social groups, as the compatibility of cage mates can significantly impact their well-being [19]. Incorporating a variety of enrichment materials, such as chewable toys, nesting material, hiding places, climbing/balancing challenges (e.g., trapeze swing, running wheels, ladders), digging possibilities, search for food options, social contacts etc. provide rodents with opportunities for mental stimulation and physical exercise [20, 21] (Fig. 1). These enrichments help prevent stereotypic behaviors that may arise from monotonous housing conditions, ultimately improving the animals’ emotional resilience and cognitive abilities [22]. While providing enrichment, it is crucial to regularly assess and rotate these items to maintain their novelty and effectiveness. Observation boxes create a semblance of open space for animals within a controlled environment allowing them to experience a more enriched setting, enhancing their overall well-being. They also serve as a valuable space for studying animals’ behavior and interactions. Researchers can closely analyze animal’s responses to different stimuli and monitor the effects of previous interactions. Thus, acknowledging the significance of providing stimulating and supportive living conditions for rodents
fosters a friendly balance between ethical responsibilities and scientific advancement in research settings.
In certain situations, experiments may require smaller cages due to specific research needs or spatial constraints, which could limit the consistent application of enriched environments. This potential incompatibility between the ideal and the practical aspects of rodent housing across all experimental conditions underscores the importance of a subtle approach. This approach recognizes the varied demands of experiments while striving for optimal animal welfare within existing constraints. Benefiel et al. (2005) clearly advocated the improved animal welfare but also suggested that environmental enrichment has the potential for causing an increase in experimental variability and research outcomes [23]. Toth et al. (2011) highlighted that enriched environments should be carefully designed as to leave experimental results unaltered and recommended the evaluation of enrichment on an exper-iment-to-experiment basis [24]. Enrichment strategies, such as large and open cage environments, are particularly beneficial for experiments focused on toxicology, toxicity assessment, safety pharmacology, or behavioral studies to access the effects of novel drugs on experimental animals. While providing rodents with opportunities for natural behaviors, and social interactions, these settings enhance the reliability and relevance of in-life phase findings in these domains. However, practical challenges emerge, especially in smaller animal facilities with limited resources, where strict environmental controls, such as those needed for infection studies, may conflict with the implementation of large cage spaces. Acknowledging these constraints is crucial for researchers to thoughtfully apply enrichment strategies aligned with experimental

Handling and training methods
rest on can help to establishe a soft and comfortable place for rodents during training and dosing procedures. This fleece bedding, indicative of animal’s own bedding, not only provides familiarity and comfort but also nurtures natural behaviors. Similarly, introducing fleecy autoclavable bedding in weighing boxes creates a calm and stress-free environment during weighing, simultaneously ensuring hygiene through autoclaving, aligning seamlessly with research standards [29]. Therefore, refined handling of rodents enhances their trust, reduces stress, and ensures cooperative behavior, crucial for accurate scientific observations and ethical treatment (Fig. 2).
Training animals before experimentation establishes trust and cooperation, ensuring that they are calm and willing to participate, leading to smoother procedures, reduced stress levels, and more reliable research outcomes. There are specific training methods for rodents that align with the principles of refinement, focusing on gentle handling, positive reinforcement, and reduced stress during procedures (Table 1).
Training of the laboratory animals (approximately
First training session: When laboratory animals first arrive at an animal facility, their initial training and handling plays a crucial role in their subsequent welfare. Scientific research provides valuable insights into the importance of structured training protocols during this critical period. An article by Swan et al. (2023) emphasizes the significance of gentle handling in the training of laboratory animals [34]. The article features the importance of general training and gentling protocols in contributing to the animals’ overall well-being and

| Training Method | Description | References |
| Positive Reinforcement | Utilizing positive reinforcement such as food rewards, enrichment materials, or social interactions establishes a favorable connection with the experimental environment, motivating rodents to engage willingly | [30] |
| Habituation and Desensitization | Gradual exposure to handling procedures and equipment to acclimate rodents to potentially stressful stimuli, reducing stress responses and improving compliance over time. | [31] |
| Enrichment-Based Training | Integrates enrichment activities into training sessions to provide mental stimulation and promote positive associations with handling, such as maze navigation for food rewards. | [32] |
| Virtual Reality Training | Utilizes VR simulations to familiarize rodents with handling procedures in a controlled environment, reducing stress responses and increasing cooperation during subsequent sessions. | [33] |
| Tailored Training Protocols | Customizes training plans to individual animal preferences and behavioral tendencies, optimizing outcomes by adapting to unique needs such as tactile or auditory preferences. | – |
upcoming procedures. It’s essential to review the study protocol to identify specific body parts requiring extra handling and to introduce animals to necessary equipment. For instance, if oral dosing is planned, animals should be trained with the dose grip. By the last training session, a gentle introduction of water through a soft oral feeding tube is recommended. Training should encompass various sampling techniques as well. For example, if blood collection involves the tail vein, the tail should be stroked more often and gently pricked. In the case of saphenous vein sampling, animals should become accustomed to technician grips and the sound of the shaving machine. If restrainer tubes needed to be employed, such as for inhalation studies, animals should get familiarized with them before the first restraint procedure. The restrainer can be placed in the home cage of the animals for few days, to allow the animals to freely enter and explore the tube, so they get familiar with it. The goal of the final training session is for animals to exhibit calmness, relaxation, and curiosity.
Dosing and sampling techniques
without restraint, fostering a more comfortable and less aversive encounter for the rodents. The capillary micro-sampling technique is another noteworthy refinement for collecting small blood volumes, sufficient for the bioanalytic quantification in contrast to traditional large-volume methods [41]. This approach reduces animal suffering and hematoma formation, utilizing only a fraction of the conventional blood volume. Prioritizing less invasive methods, such as tail vein or saphenous vein sampling, over retro-orbital sampling, underscores ethical considerations [42]. Study from Meyer et al. (2020) showed that the blood sampling techniques from the vena facialis and retrobulbar sinus significantly affected mouse locomotor activity and anxiety-related behavior, while tail vessel bleeding had minimal impact on assessed physiological and behavioral parameters [43]. Minimally invasive techniques not only uphold rodent welfare but also mitigate infection or complications tied to more invasive methods, ultimately diminishing physiological stress responses for more accurate and reliable data [44]. Furthermore, animals experiencing reduced stress during dosing and sampling are likely to exhibit heightened cooperation in subsequent procedures, fostering a favorable research atmosphere (Fig. 3).
Assessment and management of pain
experimental manipulations, surgical interventions, or disease models, thereby advocating a more compassionate and humane approach to animal research [46, 47]. Gaseous anesthesia’s quick induction and recovery, along with its non-invasive administration advantages, are especially beneficial for minor procedures; however, for more complex and invasive surgeries, the inclusion of injectable analgesics becomes crucial [48]. Remarkably, micro-dosing of intravenous (i.v.) analgesics, as contrast to extensive intraperitoneal (i.p.) injections, unveils notable advantages. Primarily, i.v. micro-dosing facilitates precise, targeted analgesic administration, underpinning an accurate and effective pain management regimen. This strategy assures animals receive the requisite pain relief dose, mitigating the risk of suboptimal or excessive dosing. Secondly, i.v. injections, being less invasive than i.p. counterparts, cause minimal discomfort, excluding the substantial fluid volume associated with i.p. injections, which can at times puncture internal organs.
Researchers should be encouraged to explore alternative pain management strategies, such as localized anesthesia or multimodal analgesia-an approach entailing the combination of diverse analgesic agents for more comprehensive pain alleviation. This strategy holds promise in potentially diminishing individual analgesic dosages, curbing side effects, and enhancing overall pain management outcomes. Besides, it is necessary to employ non-invasive pain assessment techniques for gauging analgesia efficacy and monitoring animals’ pain status [49]. Regular evaluation of behavioral and physiological pain cues, encompassing alterations in activity, posture, vocalization, and vital signs, aids in discerning the level of pain experienced by animals, facilitating adjustments to analgesic protocols as necessary [50].

Animal welfare monitoring
Establishment of humane endpoints
Euthanasia procedures
Collaboration with animal care and ethics committees
| Key Component | Summary | References |
| Arrival and Acclimatization of Animals | Proper unpacking protocols, including disinfection and health monitoring, ensure animal welfare upon arrival. Gradual acclimatization to new environments and gentle handling techniques, reduce stress and foster positive relationships with caretakers. | [1015] |
| Housing and Enrichment Environment | Enriched housing, including large cage spaces and social groupings, promotes natural behaviors and reduces stress. Incorporating various enrichment materials and observation boxes creates stimulating living conditions while facilitating research on animal behavior. | [1624] |
| Handling and Training Methods | Non-restraint handling techniques, such as tunnel handling, promote animal welfare and cooperation during experimental procedures. Gentle handling and the use of soft bedding materials establish trust and comfort, enhancing scientific observations and ethical treatment. | [2536] |
| Dosing and Sampling Techniques | Refinement in dosing and sampling methods, such as soft oral feeding tubes and non-restraint injections, prioritizes animal comfort and minimizes distress. Capillary micro-sampling techniques reduce blood volume requirements and uphold ethical considerations. | [3744] |
| Assessment and Management of Pain | Effective pain assessment and management strategies, including the use of analgesics and non-invasive monitoring techniques, mitigate animal suffering during experimental procedures. Establishing humane endpoints and employing swift euthanasia procedures further uphold ethical standards. | [4550] |
| Animal Welfare Monitoring | Regular monitoring of animal welfare indicators, both behavioral and physiological, allows for early detection of distress and timely intervention. | [5153] |
| Establishment of humane endpoints | Monitoring animal behavior and physiological parameters. Setting thresholds to avoid extreme distress or suffering, and taking appropriate actions when endpoints are reached. | [5456] |
| Euthanasia Procedures | Swift and humane methods for euthanasia. Consultation with specialized veterinarians for method selection along with design of preliminary studies to determine appropriate euthanasia methods. Consideration of biosecurity and environmental impact in carcass disposal. | [57, 58, 7] |
| Collaboration with Animal Care and Ethics Committees | Review and approval of research protocols so that they follow ethical standards and regulations. Facilitation of training and education initiatives. Dissemination of best practices and knowledge sharing. Contribution to the advancement of ethical animal research practices. | [59, 60] |
Impact and benefits of 3 R -refinement principles
Enhanced animal welfare and well-being
Improved scientific validity and reliability
Reduction in variability and animal numbers
experimental designs, researchers minimize sources of variability, leading to more consistent and reproducible results [64]. Furthermore, this also encourage researchers to admire the 3 R-Reduction principle i.e., carefully consider the statistical power of their experiments and use the minimum number of animals necessary to achieve meaningful and statistically significant results. This approach not only reduce the overall use of animals in research but also improve the efficiency and costeffectiveness of scientific studies [65]. The 3R-Refinement protocol also promotes the sharing of best practices and standardization of methodologies, further contributing to a reduction in experimental variability across different research groups.
Positive feedback from researchers and animal care staff
Promoting the adoption of 3 R -refinement principles
Collaboration within research institutes and stakeholders
welfare, enhanced scientific validity, and the promotion of socially responsible research practices.
Broadcasting best practices and guidelines
Training programs and workshops
Engagement of regulatory bodies and ethical review committees
educational resources and training programs that provide guidance on the practical implementation of the 3R-Refinement principles. Furthermore, the feedback and recommendations provided by these bodies facilitate continuous improvement and refinement of research protocols, promoting a collective commitment to animal welfare and pursuit of scientific excellence.
Conclusions
Abbreviations
i.p. intraperitoneal
Acknowledgements
Authors contributions
Funding
Data availability
Declarations
Competing interests
March 2024
Published online: 29 March 2024
References
- Domínguez-Oliva A, Hernández-Ávalos I, Martínez-Burnes J, OlmosHernández A, Verduzco-Mendoza A, Mota-Rojas D. The Importance of Animal Models in Biomedical Research: current insights and applications. Animals. 2023;13:1223.
- Russell WMS, Burch RL. The principles of Humane experimental technique. London, UK: Methuen & Co Ltd.; 1959.
- Hubrecht RC, Carter E. The 3Rs and Humane experimental technique: implementing change. Anim (Basel). 2019;9:754.
- Lee G-H, Kim K, Jo W. Stress Evaluation of Mouse Husbandry Environments for Improving Laboratory Animal Welfare. Animals. 2023;13:249.
- Davies JR, Purawijaya DA, Bartlett JM, Robinson ESJ. Impact of refinements to Handling and Restraint methods in mice. Anim (Basel). 2022;12:2173.
- Flecknell PA. The relief of pain in laboratory animals. Lab Anim. 1984;18:147-60.
- Shomer NH, Allen-Worthington KH, Hickman DL, Jonnalagadda M, Newsome JT, Slate AR, et al. Review of Rodent Euthanasia methods. J Am Assoc Lab Anim Sci. 2020;59:242-53.
- Graham ML, Prescott MJ. The multifactorial role of the 3Rs in shifting the harm-benefit analysis in animal models of disease. Eur J Pharmacol. 2015;759:19-29.
- Lloyd MH, Foden BW, Wolfensohn SE. Refinement: promoting the three rs in practice. Lab Anim. 2008;42:284-93.
- Loew FM. Considerations in receiving and quarantining laboratory rodents. Lab Anim Sci. 1980;30:323-9.
- Conour LA, Murray KA, Brown MJ. Preparation of animals for research-issues to consider for rodents and rabbits. ILAR J. 2006;47:283-93.
- Tuli JS, Smith JA, Morton DB. Stress measurements in mice after transportation. Lab Anim. 1995;29:132-8.
- Gordon CJ. Effect of cage bedding on temperature regulation and metabolism of group-housed female mice. Comp Med. 2004;54:63-8.
- Obernier JA, Baldwin RL. Establishing an appropriate period of acclimatization following transportation of laboratory animals. ILAR J. 2006;47:364-9.
- Avishai-Eliner S, Brunson KL, Sandman CA, Baram TZ. Stressed-out, or in (utero)? Trends Neurosci. 2002;25:518-24.
- Würbel H. Ideal homes? Housing effects on rodent brain and behaviour. Trends Neurosci. 2001;24:207-11.
- Van Loo PL, Mol JA, Koolhaas JM, Van Zutphen BF, Baumans V. Modulation of aggression in male mice: influence of group size and cage size. Physiol Behav. 2001;72:675-83.
- Latham N, Mason G. From house mouse to mouse house: the behavioural biology of free-living Mus musculus and its implications in the laboratory. Appl Anim Behav Sci. 2004;86:261-89.
- Lidster K, Owen K, Browne WJ, Prescott MJ. Cage aggression in group-housed laboratory male mice: an international data crowdsourcing project. Sci Rep. 2019;9:15211.
- Key D. Environmental enrichment options for laboratory rats and mice. Lab Anim (NY). 2004;33:39-44.
- Harland BC, Dalrymple-Alford JC. Enriched Environment procedures for rodents: creating a standardized protocol for Diverse Enrichment to improve consistency across Research studies. Bio Protoc. 2020;10:e3637.
- van de Weerd HA, Baumans V, Koolhaas JM, van Zutphen LF. Strain specific behavioural response to environmental enrichment in the mouse. J Exp Anim Sci. 1994;36:117-27.
- Benefiel AC, Dong WK, Greenough WT. Mandatory enriched housing of laboratory animals: the need for evidence-based evaluation. ILAR J. 2005;46:95-105.
- Toth LA, Kregel K, Leon L, Musch TI. Environmental enrichment of laboratory rodents: the answer depends on the question. Comp Med. 2011;61:314-21.
- Gouveia K, Hurst JL. Reducing mouse anxiety during handling: Effect of experience with handling tunnels. PLoS ONE. 2013;8:e66401.
- Sensini F, Inta D, Palme R, Brandwein C, Pfeiffer N, Riva MA, et al. The impact of handling technique and handling frequency on laboratory mouse welfare is sex-specific. Sci Rep. 2020;10:17281.
- Henderson LJ, Dani B, Serrano EMN, Smulders TV, Roughan JV. Benefits of tunnel handling persist after repeated restraint, injection and anaesthesia. Sci Rep. 2020;10:14562.
- Hurst JL, West RS. Taming anxiety in laboratory mice. Nat Methods. 2010;7:825-6.
- Laule G. Positive Reinforcement Training for Laboratory Animals. In: Hubrecht R, Kirkwood J, editors. UFAW Handb Care Manag Lab Res Anim [Internet]. 1st ed. Wiley; 2010 [cited 2023 Oct 6]. p. 206-18. Available from: https://onlinelibrary.wiley.com/doi/https://doi.org/10.1002/9781444318777.ch16.
- Schindler CW, Weiss SJ. The influence of positive and negative reinforcement on selective attention in the rat. Learn Motiv. 1982;13:304-23.
- Clay AW, Bloomsmith MA, Marr MJ, Maple TL. Habituation and desensitization as methods for reducing fearful behavior in singly housed rhesus macaques. Am J Primatol. 2009;71:30-9.
- Bramati G, Stauffer P, Nigri M, Wolfer DP, Amrein I. Environmental enrichment improves hippocampus-dependent spatial learning in female C57BL/6 mice in novel IntelliCage sweet reward-based behavioral tests. Front Behav
33. Tang FMK, Lee RMF, Szeto RHL, Cheung JCT, Ngan OMY. Experiential learning with virtual reality: animal handling training. Innov Educ. 2020;2:2.
34. Swan J, Boyer S, Westlund K, Bengtsson C, Nordahl G, Törnqvist E. Decreased levels of discomfort in repeatedly handled mice during experimental procedures, assessed by facial expressions. Front Behav Neurosci. 2023;17:1109886.
35. Mieske P, Hobbiesiefken U, Fischer-Tenhagen C, Heinl C, Hohlbaum K, Kahnau P, et al. Bored at home?-A systematic review on the effect of environmental enrichment on the welfare of laboratory rats and mice. Front Vet Sci. 2022;9:899219.
36. Tryon SC, Sakamoto IM, Kellis DM, Kaigler KF, Wilson MA. Individual Differences in Conditioned Fear and extinction in female rats. Front Behav Neurosci. 2021;15:740313.
37. Õkva K, Tamoseviciute E, Ciziute A, Pokk P, Ruksenas O, Nevalainen T. Refinements for Intragastric Gavage in rats. Scand J Lab Anim Sci. 2014;33:243-52.
38. Wheatley JL. A gavage dosing apparatus with flexible catheter provides a less stressful gavage technique in the rat. Lab Anim (NY). 2002;31:53-6.
39. Turner PV, Vaughn E, Sunohara-Neilson J, Ovari J, Leri F. Oral gavage in rats: animal welfare evaluation. J Am Assoc Lab Anim Sci JAALAS. 2012;51:25-30.
40. Turner PV, Brabb T, Pekow C, Vasbinder MA. Administration of substances to laboratory animals: routes of administration and factors to consider. J Am Assoc Lab Anim Sci JAALAS. 2011;50:600-13.
41. Jonsson O, Palma Villar R, Nilsson LB, Norsten-Höög C, Brogren J, Eriksson M , et al. Capillary microsampling of
42. Diehl KH, Hull R, Morton D, Pfister R, Rabemampianina Y, Smith D, et al. A good practice guide to the administration of substances and removal of blood, including routes and volumes. J Appl Toxicol JAT. 2001;21:15-23.
43. Meyer N, Kröger M, Thümmler J, Tietze L, Palme R, Touma C. Impact of three commonly used blood sampling techniques on the welfare of laboratory mice: taking the animal’s perspective. PLoS ONE. 2020;15:e0238895.
44. Lee G, Goosens KA. Sampling blood from the lateral tail vein of the rat. J Vis Exp. 2015;(99):e52766.
45. Flecknell P. Rodent analgesia: Assessment and therapeutics. Vet J. 2018;232:70-7.
46. Ahmadi-Noorbakhsh S, Farajli Abbasi M, Ghasemi M, Bayat G, Davoodian N, Sharif-Paghaleh E, et al. Anesthesia and analgesia for common research models of adult mice. Lab Anim Res. 2022;38:40.
47. Gargiulo S, Greco A, Gramanzini M, Esposito S, Affuso A, Brunetti A, et al. Mice anesthesia, analgesia, and care, part I: anesthetic considerations in preclinical research. ILAR J. 2012;53:E55-69.
48. Navarro KL, Huss M, Smith JC, Sharp P, Marx JO, Pacharinsak C. Mouse anesthesia: the art and science. ILAR J. 2021;62:238-73.
49. Turner PV, Pang DS, Lofgren JL. A review of Pain Assessment methods in Laboratory rodents. Comp Med. 2019;69:451-67.
50. Mayer J. Use of behavior analysis to recognize pain in small mammals. Lab Anim (NY). 2007;36:43-8.
51. Bloomsmith MA, Perlman JE, Hutchinson E, Sharpless M. Behavioral Management Programs to Promote Laboratory Animal Welfare. In: Weichbrod RH, Thompson GA (Heidbrink), Norton JN, editors. Manag Anim Care Use Programs Res Educ Test [Internet]. 2nd ed. Boca Raton (FL): CRC Press/Taylor & Francis; 2018 [cited 2023 Oct 6]. Available from: http://www.ncbi.nlm.nih. gov/books/NBK500424/.
52. Do JP, Defensor EB, Ichim CV, Lim MA, Mechanic JA, Rabe MD, et al. Automated and Continuous Monitoring of Animal Welfare through Digital Alerting. Comp Med. 2020;70:313-27.
53. Kunczik J, Barbosa Pereira C, Zieglowski L, Tolba R, Wassermann L, Häger C, et al. Remote vitals monitoring in rodents using video recordings. Biomed Opt Express. 2019;10:4422-36.
54. Stokes WS. Humane endpoints for laboratory animals used in regulatory testing. ILAR J. 2002;43 Suppl:S31-38.
55. Morton DB. A systematic Approach for establishing Humane endpoints. ILAR J. 2000;41:80-6.
56. Demers G, Griffin G, De Vroey G, Haywood JR, Zurlo J, Bédard M. Animal research. Harmonization of animal care and use guidance. Science. 2006;312:700-1.
57. Leary S, Pharmaceuticals F, Underwood W, Anthony R, Cartner S, Johnson CL et al. AVMA Guidelines for the Euthanasia of Animals: 2020 Edition. American Veterinary Medical Association, 2020. https://www.avma.org/sites/default/ files/2020-02/Guidelines-on-Euthanasia-2020. Accessed 19 March 2024.
58. Clarkson JM, Martin JE, McKeegan DEF. A review of methods used to kill laboratory rodents: issues and opportunities. Lab Anim. 2022;56:419-36.
59. Hagelin J, Hau J, Carlsson H-E. The refining influence of ethics committees on animal experimentation in Sweden. Lab Anim. 2003;37:10-8.
60. Fenwick N, Griffin G, Gauthier C. The welfare of animals used in science: how the three rs ethic guides improvements. Can Vet J. 2009;50:523-30.
61. Neuhaus W, Reininger-Gutmann B, Rinner B, Plasenzotti R, Wilflingseder D, De Kock J, et al. The current status and work of three rs centres and platforms in Europe. Altern Lab Anim ATLA. 2022;50:381-413.
62. Garner JP. Stereotypies and other abnormal repetitive behaviors: potential impact on validity, reliability, and replicability of scientific outcomes. ILAR J. 2005;46:106-17.
63. Poole T. Happy animals make good science. Lab Anim. 1997;31:116-24.
64. Aske KC , Waugh CA . Expanding the 3 R principles: more rigour and transparency in research using animals. EMBO Rep. 2017;18:1490-2.
65. Törnqvist E, Annas A, Granath B, Jalkesten E, Cotgreave I, Öberg M. Strategic focus on
66. Thomas D. Laboratory animals and the art of empathy. J Med Ethics. 2005;31:197-202.
67. Bratcher NA, Reinhard GR. Creative implementation of 3 Rs principles within industry programs: beyond regulations and guidelines. J Am Assoc Lab Anim Sci JAALAS. 2015;54:133-8.
68. Nawroth C, Krause ET. The Academic, Societal and Animal Welfare Benefits of Open Science for Animal Science. Front Vet Sci [Internet]. 2022 [cited 2023 Oct 6];9. Available from: https://www.frontiersin.org/articles/https://doi. org/10.3389/fvets.2022.810989.
69. Hagelin J, Carlsson HE, Hau J. The importance of student training in experimental procedures on animals in biomedical education. Scand J Lab Anim Sci. 2000;27:35-41.
70. Ahmadi-Noorbakhsh S, Sadighi J, Hatami Z, Shamsi Gooshki E. A proposed framework for holding intensive 3Rs workshops in laboratory animal science. Lab Anim Res. 2022;38:10.
71. Ethics committees for. laboratory animals: a basis for their composition and function / Maggy Jennings. [Internet]. Wellcome Collect. [cited 2023 Oct 6]. Available from: https://wellcomecollection.org/works/uzfrfg4z.
72. Hau J, Carlsson HE, Hagelin J. Animal research. Ethics committees have influenced animal experiments in Sweden. BMJ. 2001;322:1604.
Publisher’s Note
- *Correspondence:
Matilda Bäckberg
matilda.backberg@ri.se
¹Department of Chemical and Pharmaceutical Safety, Division of Bioeconomy and Health, RISE Research Institutes of Sweden, Forskargatan 18, Södertälje 151 36, Sweden
